Зоологический журнал, 2020, T. 99, № 9, стр. 1036-1046
Сравнительный анализ питания северного оленя (Rangifer tarandus), белолобого гуся (Anser albifrons) и черной казарки (Branta bernicla) на островах Белый и Шокальского (ЯНАО)
С. Б. Розенфельд a, b, *, И. С. Шереметьев c, **
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
b Национальный парк “Гыданский”, ЯНАО
629350 Тазовский, Россия
c ФНЦ биоразнообразия наземной биоты Восточной Азии ДВО РАН
690022 Владивосток, Россия
* E-mail: rozenfeldbro@mail.ru
** E-mail: sheremetyev@biosoil.ru
Поступила в редакцию 19.12.2018
После доработки 17.03.2020
Принята к публикации 07.04.2020
Аннотация
Ямало-белоостровская и гыданская популяции дикого северного оленя (Rangifer tarandus) находятся под угрозой исчезновения, основные причины которой не определены. В решении этой проблемы большую ценность представляет анализ трофических спектров северного оленя на островах Белый и Шокальского, где эти популяции сосредоточены в летний период, особенно в сравнении с данными о размножающихся в это же время и использующих те же трофические ресурсы белолобым гусем (Anser albifrons) и черной казаркой (Branta bernicla). Установлено, что на островах Белый и Шокальского эти травоядные поедают более 40 видов растений. Питание разнообразнее у более подвижных видов, использующих больше типов местообитаний, но, как и трофическая избирательность, зависит от морфофизиологических характеристик видов. У гусей обе популяции намного многочисленнее, чем у казарок, и продолжают расти, а популяции казарок стабильны. Это объясняется преимуществами более широкого и менее избирательного трофического спектра гусей по сравнению с казарками. Однако обе островные популяции северного оленя, который имеет самый широкий и менее избирательный трофический спектр, резко сокращаются, таким образом, сокращение обусловлено не трофической конкуренцией. На этом основании можно рекомендовать только соблюдение режима ООПТ на этих островах, который может обеспечить всем травоядным по крайней мере равные исходные условия в использовании ограниченных ресурсов.
Вымирание сокращающихся и полностью или частично изолированных популяций дикого северного оленя (Rangifer tarandus) на северной окраине ареала наносит этому виду непоправимый ущерб и критически сказывается на функционировании арктических экосистем в целом, приобретая, таким образом, глобальное значение (Абатуров, 1979; Ims, Fuglei, 2005; Zimov et al., 2012; Metcalfe, Olofsson, 2015). Среди основных причин этого сокращения рассматривались нелегальная добыча, потеря местообитаний и ограничение миграций в ходе освоения Арктики, деградация пастбищ под влиянием одомашненных оленей и преследование оленеводами, болезни, хищники и климатические изменения, например многоснежье и гололеды (Филонов, 1983; Глушков, 1987; Перовский, 1988; Глушков, Граков, 1989; Володина, 2010; Ломанова, Баранов, 2014; Горчаковский, 2015). Негативное влияние могут оказывать и другие массовые потребители арктической растительности, такие как гусеобразные (Kerbes et al., 1990). Это влияние тем не менее остается неизученным из-за недостатка данных по трофическим спектрам и кормовой растительности. Однако жизнь травоядных Арктики проходит на грани обеспеченности пищей и в ее поисках (Данилкин, 1999; Ims, Fuglei, 2005; Казьмин, Абатуров, 2011; Розенфельд и др., 2012; Шереметьев и др., 2017а). Поэтому роль межвидовых трофических взаимодействий в комплексе причин вымирания северного оленя на окраине ареала должна быть оценена. Для этого нужно определить степень соответствия направлений популяционной динамики травоядных принципам распределения между ними общих трофических ресурсов.
Отступление границ ямало-белоостровской и гыданской популяций тундрового северного оленя в Ямало-Ненецком автономном округе (ЯНАО) в 20 в. к северу поставило их под угрозу исчезновения (Корытин и др., 2010). К началу 2000-х первая популяция насчитывала около 2.5 тыс. особей, почти полностью сосредоточенных летом на о-ве Белый и на севере п-ова Ямал (заказник “Ямальский”), вторая популяция – около 0.5 тыс. на о-ве Шокальского (заповедник “Гыданский”) (Ширшов, 2003; Кривенко и др., 2005; Петров, 2006; Корытин и др., 2010; Розенфельд, 2018). В 2019 г., по данным летних авиаучетов, в ямало-белоостровской популяции мы насчитали 2157 особей, в гыданской популяции – 182 и, таким образом, должны констатировать продолжение их сокращения. На о-ве Шокальского гнездится около 12 тыс. пар белолобых гусей (Anser albifrons), к выводкам которых на линьке присоединяется еще несколько тысяч, а также гнездится около 100 пар черных казарок (Branta bernicla) и линяет еще до 17 тыс. (Rozenfeld et al., 2017; ГПЗ “Гыданский”, 2018). На о-ве Белый по данным наших авиаучетов в 2019 г. гнездится более 9.6 тыс. пар гусей, плотность гнездования которых продолжает расти и уже выше, чем в материковых районах Ямала и Гыдана (Тюлин, 1938; Дмитриев и др., 2007), и до 300 пар казарок, численность которых остается стабильной (Емельченко, Дмитриев, 2005; Дмитриев и др., 2007). Какие растения эти три вида поедают, в каком соотношении, с какой избирательностью и как в итоге распределяется между ними сообща используемая первичная продукция, образуемая в летний период, в условиях островных ограничений – неизвестно. Не только прилет гусей и казарок и существенный рост кормовых потребностей у оленей в связи с увеличением уровня метаболизма, но и всеобщее размножение и выращивание потомства делают лето критическим сезоном в годовом цикле всех этих видов (Данилкин, 1999; Сафронов, 2005; Drent, 2006; Сыроечковский, 2013; Розенфельд и др., 2017).
Цель работы – выяснить состав, соотношение и избирательность растений в трофическом спектре дикого северного оленя островов Белый и Шокальского в летний период в сравнении со спектрами белолобого гуся и черной казарки.
МАТЕРИАЛ И МЕТОДЫ
Острова Белый и Шокальского расположены севернее 73° с.ш. в 100 км друг от друга у п-ова Ямал и у побережья Гыданского п-ова соответственно. Оба острова низменные, находятся в северной полосе подзоны арктических тундр, не отличающихся флористическим разнообразием. Пастбища по видовому составу и обилию основных кормовых растений очень похожи (Ребристая, 2002).
Материал по питанию собран в июле–августе 2018–2019 гг. Изучены 61 кормовая проба травоядных (белолобый гусь 18, черная казарка 13, северный олень 30) и 15 ботанических укосов в местах их совместного питания. Сеть проб и укосов включает 28 ресурсных наименований, представленных объединенными в основном на родовом уровне кормовыми растениями (табл. 1). Оценка численности оленей и гусеобразных основывается на авиаучетных данных по п-ову Ямал (от пролива Малыгина до пос. Сеяха), включая о-в Белый 24–25 и 27 июля 2019 г., и по о-ву Шокальского 23 июля 2019 г. Использован гидросамолет СТЕРХ-1С (RA 0801-G). Обследована площадь 4800 км2, проанализированная в масштабе 1 : 100 000 с использованием комплекса ArcGIS (Esri) в системе координат Pulkovo 1942 (Rozenfeld et al., 2017).
Таблица 1.
Состав трофических ресурсов оленей, гусей и казарок островов Белый и Шокальского и их вклад в дифференциацию проб и укосов в пространстве первых двух канонических переменных (F1 и F2)
| Ресурсы | Стандартизированные коэффициенты | |
|---|---|---|
| F1 | F2 | |
| Bryophyta | –1.29292 | –1.30716 |
| Phippsia algida, Puccinellia phryganodes + Carex subspathacea | –2.17128 | 0.46163 |
| Arctophila fulva + Dupontia fisheri | –1.26098 | 0.32436 |
| Poa alpigena, P. arctica + Hierochloё pauciflora | –1.24787 | –0.80148 |
| Stellaria sp. | –0.36341 | –0.73457 |
| Carex aquatilis | –0.54010 | –0.57808 |
| Eriophorum polystachion, russeolum, sheuchzeri | –0.62486 | 0.52539 |
| Lichenophyta | –0.71560 | –0.12031 |
| Equisetum arvense | –0.86563 | 0.12408 |
| Draba glacialis | 0.41031 | 0.12686 |
| Ranunculus pallasii | –0.47196 | 0.22798 |
| Saxifraga sp. | 0.46148 | 0.05849 |
| Arctagrostis latifolia | –0.48607 | 0.13608 |
| Cerastium sp. | –0.31062 | 0.24765 |
| Pedicularis hirsuta | 0.46978 | –0.06929 |
| Calamagrostis deschampsioides, С. holmii | –0.31128 | –0.11454 |
| Festuca rubra | 0.22942 | –0.06246 |
Идентификация растений кормовых проб выполнена на основе метода Оуэна (Owen, 1975) с использованием препаратов экскрементов и атласа микроструктур эпидермиса растений (Розенфельд, 2009, 2011). Укосы собраны на участках 0.3 × 0.3 м, 0.5 × 0.5 м и 1 × 1 м. Масса растений определена в сухом состоянии с точностью до 0.01 г.
Оценка вклада распределения проб по островам в их соотношение по количеству ресурсных наименований выполнена с использованием UPGMA-классификации, анализ вклада ресурсных наименований в распределение укосов по группам травоядных – с помощью дискриминантного анализа. Перекрывание трофических спектров оценено с использованием индекса Шимкевича-Симпсона (табл. 2) по данным присутствия/отсутствия, открывающим широкие сравнительные возможности (Песенко, 1982; Hammer et al., 2001; Geange et al., 2011). В анализе трофической избирательности использованы стандартизированные данные по количественному соотношению ресурсных наименований в пробах и укосах, а в качестве метрики – индекс D Джэйкобса (Jacobs, 1974):
Таблица 2.
Перекрывание трофических ниш (индекс Шимкевича-Симпсона, %; сверху справа) и корреляция Спирмена между категориями избирательности ресурсных наименований (снизу слева) травоядных ЯНАО
| Травоядные | Белолобый гусь | Черная казарка | Северный олень |
|---|---|---|---|
| Белолобый гусь | – | 62.1 | 85.1 |
| Черная казарка | 0.125 | – | 50.0 |
| Северный олень | 0.506* | –0.168 | – |
Три категории избирательности ресурсов в соответствии с принадлежностью их значений D к одному из трех равных интервалов спектра [–1;1] выделено: D ∈ [–1; –0.33] – дискриминируемые, D ∈ (–0.33; 0.33) – нейтральные, D ∈ [0.33; 1] – элективные (Шереметьев и др., 2017). Совокупность элективных ресурсов рассматривается как доля наиболее качественных кормов в питании и основной элемент сравнения видов, дискриминируемые – как наименее качественные, нейтральные – ресурсы промежуточного качества (Jacobs, 1974). Олени, гуси и казарки сопоставлены: 1 – по доле элективных ресурсов в составе трофического спектра; 2 – по количественной доле элективных ресурсов в кормовых пробах, соответствующей их массовой доле в содержимом кишечника; 3 – по отношению второго параметра к первому, которое позволяет сравнить виды по величине затрат на поиск и добывание лучших по качеству кормов (избирательное усилие). В оценке вклада избирательности в трофическую дифференциацию видов травоядных использован коэффициент корреляции Спирмена между категориями D ресурсных наименований (табл. 2). Все расчеты выполнены с помощью программ Past 1.57 (Hammer et al., 2001) и Statistica 13 (TIBCO Software Inc., 2017).
РЕЗУЛЬТАТЫ
Классификация кормовых проб и распределение укосов. Одна из двух наиболее крупных групп проб в их UPGMA-классификации по количественному соотношению ресурсных наименований объединяет большинство проб белолобого гуся и все пробы черной казарки. Во второй группе 31 из 33 проб принадлежат северному оленю, две – белолобому гусю (рис. 1). Таким образом, в анализе трофической избирательности нет оснований выделять островные подвыборки проб, что соответствует низкому уровню разнообразия пастбищ (Ребристая, 2002). Количественная оценка вклада ресурсных наименований в дифференциацию проб и укосов (табл. 1) не позволяет уверенно различить виды травоядных по степени соответствия трофического спектра растительным ассоциациям пастбищ (рис. 2).
Рис. 1.
UPGMA-классификация кормовых проб травоядных ЯНАО (A – белолобый гусь, B – черная казарка, R – северный олень; bel – о-в Белый, sh – о-в Шокальского, 2016–2018 – дата, 1–22 – идентификационные номера).

Рис. 2.
Кормовые пробы белолобого гуся (A), черной казарки (B) и северного оленя (R) и ботанические укосы (1–15) в основных типах их местообитаний в пространстве первых двух канонических переменных (F1 и F2; табл. 1).

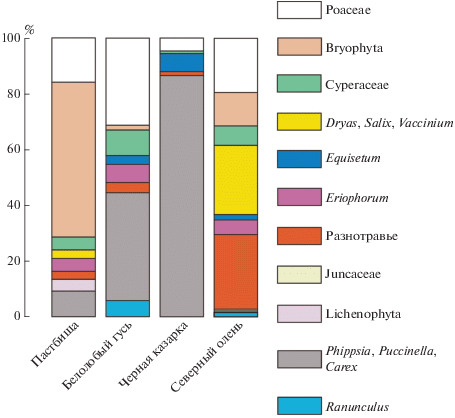
Состав и количественное соотношение трофических ресурсов. Выявлено более 40 поедаемых видов сосудистых растений и других кормов, условное объединение которых в группы позволяет проиллюстрировать количественные различия в питании травоядных на фоне количественной характеристики растительности пастбищ (рис. 3). Это активно используемые белолобым гусем и черной казаркой галофиты приморских маршей, пушицы (Eriophorum), кислые злаки (Juncaceae), лютик Палласа (Ranunculus pallasii), осоковые (Cyperaceae) и злаки (Poaceae) тундровых биотопов, хвощи (Equisetaceae), а также разнотравье, кустарнички, мхи и лишайники, в большом количестве поедаемые северным оленем, но в незначительном количестве – гусем и казаркой. Основу питания казарок, предпочитающих кормиться на приморских маршах, составляет галофитная растительность, а тундровые злаки и хвощи потребляются в меньшей степени. Трофический спектр гусей гораздо разнообразнее, чем у казарок, что соответствует более широкому спектру типов кормовых местообитаний гусей, который включает, кроме приморских маршей, тундру. Основу питания гусей составляют маршевая растительность, а также злаки, осоковые и корневища лютика Палласа, обильные в аласах. Питание северного оленя, использующего еще более широкий спектр типов местообитаний, является самым разнообразным. При этом рацион оленей по сравнению с рационом гусей включает меньше злаков, осоковых и хвощей и очень мало – растений приморских маршей и лютика Палласа (рис. 3). Из 28 общих ресурсных наименований северный олень использует 27, белолобый гусь – 20, черная казарка – 9. Уровень межвидового перекрывания трофических спектров – не менее 50% (табл. 2).
Рис. 3.
Количественное соотношение растений на пастбищах и в трофических спектрах трех видов травоядных на островах Белый и Шокальского.
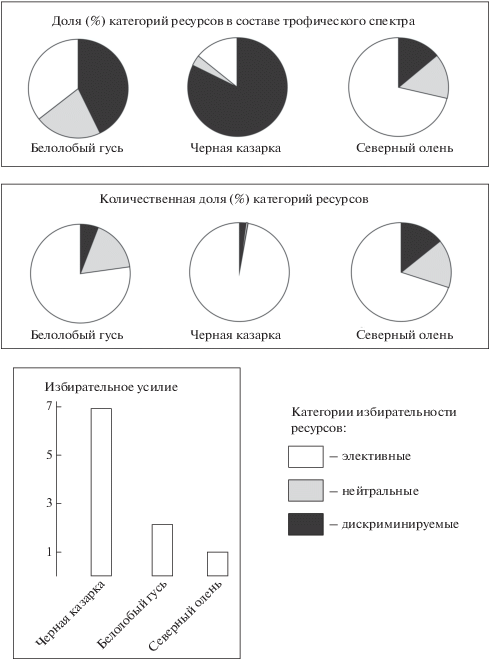
Трофическая избирательность. По доле элективных ресурсов в составе диет с большим отрывом доминирует северный олень, на последнем месте черная казарка, большая часть ресурсов которой является дискриминируемыми (рис. 4). Наибольшая количественная доля элективных ресурсов, напротив, у казарки, тогда как у северного оленя она меньше всего (рис. 4). Добавление нейтральных ресурсов к элективным ничего в этом распределении не меняет. Акцентировать эти различия позволяет расчет величины избирательного усилия (рис. 4) как показателя затрат потребителя на улучшение качества питания и на перераспределение элективных ресурсов в свою пользу. Корреляция распределений значения индекса Якобса в трофических спектрах видов травоядных показывает, что северный олень и белолобый гусь достоверно сходны не только по составу кормов, но и по избирательности, и отличаются от черной казарки (табл. 2).
ОБСУЖДЕНИЕ
Суммарное количество видов растений, поедаемых северным оленем, белолобым гусем и черной казаркой на островах Белый и Шокальского, составляет значительную часть местной флоры. Это свидетельствует о высокой степени освоенности ресурсной базы этих пространственно ограниченных пастбищ, а с другой стороны, о хорошей изученности трофических спектров этих травоядных. Перекрывание спектров по составу показывает отсутствие существенной трофической дифференциации, которая всегда рассматривается как основа стабильного сосуществования экологически сходных видов. Количественные различия в питании существенны (рис. 3), но определить по ним исходные преимущества одного из сравниваемых видов над другими без учета количественного соотношения ресурсов на пастбищах нельзя (рис. 2).
В межвидовых различиях по количественному соотношению основных групп кормовых растений (рис. 3), как и по составу, можно увидеть влияние подвижности травоядных, благодаря которой увеличивается разнообразие используемых ими местообитаний. В самом разнообразном трофическом спектре почти не ограниченных в перемещениях оленей нет выраженного доминирования какой-то одной или двух основных групп кормов, как у гусей и казарок. У гусей, питающихся разнообразнее казарок и, кроме маршей, активно использующих тундровые местообитания, в питании выражено доминирование маршевой растительности и злаков, 70% в сумме (рис. 3), а у казарок – доля маршевой растительности более 87%.
Однако это только внешнее проявление глубоких, в первую очередь морфофизиологических различий, определяющих трофическую избирательность видов (Шереметьев, Розенфельд, 2018). У травоядных способность отыскивать определенный корм и потребность в качественном питании с наибольшей очевидностью повышаются с увеличением размера тела (Geist, 1974; Laca et al., 2010; Muller et al., 2013). Также негативный эффект от избытка в корме снижающих его качество конструктивных углеводов, кремния и других компонентов компенсируется эффективностью пищеварения (Саблина, 1970; Clauss et al., 2008; Gordon, Prins, 2008). Поэтому крупного северного оленя с большой длиной кишечника, переднекишечной ферментацией и целлюлозорасщепляющей микрофлорой следует считать более приспособленным к питанию низкокачественной растительной пищей и ожидать, таким образом, от него наименьшей трофической избирательности. Переход гусеобразных к облигатной фитофагии считается недавним (Olsen, 2015). Их кишечник слабо дифференцирован и не имеет целлюлозорасщепляющей микрофлоры (Sedinger, Raveling, 1984; Sedinger et al., 1992). Все это позволяет предполагать, что у гусеобразных более высокая избирательность питания, чем у оленей, особенно у мелких казарок (Розенфельд, Шереметьев, 2016). Таким образом, по шкале ресурсных стратегий грэйзинг/браузинг (Gordon, 2003), определяющих избирательность, с учетом морфофизиологических особенностей олени могут быть исходно классифицированы как грэйзеры (неизбирательно стригущие), а гуси и еще в большей степени казарки – как браузеры (избирательно выщипывающие).
Наблюдаемое распределение изученных видов по избирательности полностью соответствует ожиданию на основании приведенных морфофизиологических характеристик. В частности, в трофическом спектре казарок многократно меньше элективных ресурсных наименований, чем у гусей и оленей, тогда как в массе содержимого кишечника казарок эти ресурсы составляют 97% (рис. 4). У оленей, напротив, массовая доля элективных ресурсов в содержимом кишечника даже несколько меньше доли их числа в трофическом спектре. В конечном счете очевидно, что наибольшие усилия в поиске и добывании лучших по качеству кормов затрачивают казарки, гуси – более чем в три раза меньше казарок, а олени – меньше почти в семь раз (рис. 4).
В попытке оценить роль этих достаточно существенных различий в динамике рассматриваемых популяций дикого северного оленя следует сначала вернуться к списку внешних факторов, влияние которых признается потенциально негативным, затем к формализации различий в популяционных трендах оленей, гусей и казарок. Сокращение обеих популяций оленей в последние несколько лет продолжалось без новых климатических изменений и промышленного освоения островов Белый и Шокальского. Запрет на выпас домашних оленей так же исключает и все негативные эффекты оленеводства. Из внешних факторов остается вероятным только негативное влияние хищничества, в т.ч. нелегальной охоты, интенсивность которой мало зависит от плотности популяций жертв. Упрощенная таким образом система регуляции сообщества травоядных уже без поправок соответствует концепции контроля “сверху и/или снизу” (top-down/bottom-up control) (Sinclair et al., 2003; Hopcraft et al., 2010), и соотношение оленей, гусей и казарок по популяционным трендам будет определять, влияют ли на это соотношение больше хищники или больше трофические ресурсы и ресурсные взаимодействия этих видов. Приведенные данные по динамике численности позволяют формализовать различия в популяционных трендах сравниваемых видов и охарактеризовать соотношение этих трендов следующим образом: белолобый гусь – популяционный рост; черная казарка – стабильность; северный олень – сокращение.
Приведенные данные по динамике численности позволяют формализовать различия в популяционных трендах сравниваемых видов следующим образом: белолобый гусь – популяционный рост; черная казарка – стабильность; северный олень – сокращение. Соотношение популяционных трендов гусей и казарок определено соотношением их трофических спектров: более крупными и продолжающими расти являются популяции гусей, трофический спектр которых шире и менее избирателен, чем у казарок. Это соответствует предположению о конкурентном преимуществе ширины ниш как меры экологической специализации (Colwell, Futuyma, 1971; Greenberg, 1990; Ashton et al., 2010). В противном случае пришлось бы допустить менее интенсивную добычу хищниками более многочисленных гусей, что будет противоречить концепции избирательного хищничества (Ивлев, 1955). Более выраженный, по сравнению с казарками, грэйзинг гусей представляет собой реализацию стратегии снижения связанных с питанием затрат, в данном случае уменьшение избирательного усилия, которое при прочих относительно равных условиях важнее, чем увеличение энергетической ценности питания казарок-браузеров (Bergman et al., 2001). В соответствии с этой логикой обе островные популяции оленей, характеризующихся самой большой шириной и наименьшей избирательностью трофического спектра, должны иметь максимальную скорость роста или по крайней мере оставаться стабильными. Косвенным подтверждением этого был быстрый рост популяции северного оленя на о-ве Врангеля в середине 20 в., который пришлось искусственно ограничивать, на фоне длительной популяционной депрессии гусей и казарок (Розенфельд и др., 2017; Шереметьев и др., 2017а).
Однако морфофизиологический потенциал северного оленя, способный обеспечить итоговое распределение трофических ресурсов в его пользу, остается нереализованным, показывая, что популяции оленей на островах Белый и Шокальского являются ограниченными преимущественно “сверху”, т.е. хищниками, в т.ч. человеком”.
Более 40 лет заповедного режима на о-ве Белый и более 20 лет на о-ве Шокальского при неограниченном размножении должно быть вполне достаточно для исчерпания емкости среды. Дефицит общих для оленей, гусей и казарок трофических, в первую очередь элективных, ресурсов при этом обусловливает и рост затрат на кормодобывание у всех видов. В таких условиях должен доминировать северный олень как вид с наименьшими затратами. Однако оба островных сообщества травоядных как бы задержаны на ранних стадиях сукцессии, для которых не свойственно доминирование морфофизиологически приспособленных к менее избирательному питанию K-стратегов (MacArthur, Wilson, 1967; Разумовский, 1981; Шварц, 2004). В выборе непосредственной причины этой задержки между влиянием хищников и нелегальной добычи мы вынуждены остановиться на последнем варианте, поскольку никакой хищник не в состоянии исказить естественный цикл сообществ, в то время как нелегальная добыча оленей на островах Белый и Шокальского, которая здесь практикуется, – может нанести такой ущерб.
ЗАКЛЮЧЕНИЕ
Дикий северный олень на островах Белый и Шокальского используют в питании более 40 видов растений сообща с белолобым гусем и черной казаркой. Наименьшим разнообразием и абсолютным преобладанием количественной доли галофитов характеризуется трофический спектр черной казарки. В спектре белолобого гуся значительно больше количественная доля осок, злаков, лютика Палласа и других групп, а наибольшим разнообразием, а также количественной выравненностью групп кормов с преобладанием кустарничков, мхов и разнотравья отличается питание северного оленя. Можно заключить, что богатство и выравненность трофических спектров этих видов травоядных по доле ресурсов увеличивается с увеличением их мобильности и разнообразия типов местообитаний.
Сопоставление ресурсных наименований по количественной доле в кормовых пробах и на пастбищах показывает, что наименее избирательным является питание северного оленя, в котором количественная доля лучших по качеству кормов даже меньше их доли в трофическом спектре. Питание белолобого гуся намного более избирательно, а у черной казарки является самым избирательным. Различия между всеми видами по уровню трофической избирательности очень значительны. При большом сходстве трофических спектров всех видов по составу ресурсов только северный олень и белолобый гусь в значительной степени сходны по избирательности.
Только у белолобого гуся и черной казарки соотношение направлений популяционных трендов соответствует соотношению этих видов по ширине и избирательности трофических спектров. Популяции гусей, использующих в два раза больше ресурсных наименований и в три раза менее избирательных, чем казарки, растут; популяции казарок стабильны. Однако продолжающееся сокращение популяций северного оленя на обоих островах не соответствует его наиболее широкому и наименее избирательному трофическому спектру. Это вынуждает исключить конкуренцию за трофические ресурсы из факторов, угрожающих сегодня существованию ямало-белоостровской и гыданской популяциям дикого северного оленя. Единственным фактором, который угрожает этим охраняемым популяциям, остается нелегальная добыча, на которую Департаменту природно-ресурсного регулирования, лесных отношений и развития нефтегазового комплекса Ямало-Ненецкого автономного округа можно рекомендовать обратить более пристальное внимание? Ухудшающееся состояние этих включенных в Красную книгу ЯНАО популяций (Корытин и др., 2010) таково, что необходимы фундаментальные исследования условий их обитания, в т.ч. с применением спутниковой телеметрии и других современных методов, не только на островах Белый и Шокальского, но и во всех прилегающих районах ЯНАО, так же как исследования механизмов функционирования сообществ этих травоядных в целом.
Список литературы
Абатуров Б.Д., 1979. Биопродукционный процесс в наземных экосистемах. М.: Наука. 130 с.
Володина С.О., 2010. Дикий северный олень (Rangifer tarandus L., 1758). // Состояние охотничьих ресурсов в Российской Федерации в 2008–2010 гг. ФБУ “Центрохотконтроль” http://www.ohotcontrol.ru/ resource/Resources_2008-2013/%D0%9B%D0%BE% D1%81%D1%8C.pdf
Глушков В.М., 1987. Воспроизводство и продуктивность лося и их прогнозирование // Экология. № 6. С. 31–39.
Глушков В.М., Граков Н.Н., 1989. Теория динамики численности, концепция цикличности и реальность идеи управления популяциями лося // Управление популяциями диких копытных животных. Киров. С. 14–35.
Горчаковский А. А., 2015. Дикий северный олень на острове Шокальского и полуострове Явай (Ямало-Ненецкий автономный округ) // Фауна Урала и Сибири. № 1. С. 123–126.
ГПЗ “Гыданский”, 2018. [Электронный ресурс. URL: https://gdanskiyzp.ru/?page_id=2983. Дата доступа 01.11.2018]
Данилкин А.А., 1999. Оленьи. М.: ГЕОС. 552 с.
Дмитриев А.Е., Емельченко Н.Н., Слодкевич В.Я., 2007. Орнитофауна острова Белого // Материалы к распространению птиц на Урале, в Приуралье и в Западной Сибири. Екатеринбург: Изд-во Уральского ун-та. С. 56–67.
Емельченко Н.Н, Дмитриев А.Е., 2005. Материалы по гнездованию черной казарки (Branta bernicla) на о. Белом // Гусеобразные птицы Северной Евразии: Тез. докл. 3 международного симпозиума. Санкт-Петербург: Картфабрика ВСЕГЕИ. С. 78–80.
Ивлев В.С., 1955. Экспериментальная экология питания рыб. М.: Пищепромиздат. 252 с.
Казьмин В.Д., Абатуров Б.Д., 2011. Количественная характеристика питания вольноживущих северного оленя (Rangifer tarandus) и овцебыка (Ovibos moschatus) на острове Врангеля // Зоологический журнал. Т. 90. № 5. С. 616–623.
Корытин Н.С., Головатин М.Г., Кривенко В.Г., 2010. Северный олень Rangifer tarandus (Linnaeus, 1758) // Красная книга Ямало-Ненецкого автономного округа: животные, растения, грибы. Екатеринбург: “Баско”. С. 24–25.
Кривенко В.Г., Мирутенко М.В., Равкин Е.С., 2005. Состояние редких животных, занесенных в Красную книгу Ямало-Ненецкого автономного округа. [Электронный ресурс. URL: http://www.biodat.ru/doc/lib/kriv1.htm. Дата доступа 04.12.2018]
Ломанова Н.В., Баранов В.Н., 2014. Лось (Alces alces L., 1758) // Состояние охотничьих ресурсов в Российской Федерации в 2008–2013 гг. [Электронный ресурс. URL: http://www.ohotcontrol.ru/resource/ Resources_2008–2013/%D0%9B%D0%BE%D1%81% D1%8C.pdf. Дата доступа 04.12.2018]
Перовский М.Д., 1988. Роль различных факторов в потерях популяций диких копытных животных в РСФСР // Хронологические изменения численности охотничьих животных в РСФСР. М. С. 106–126.
Песенко Ю.А., 1982. Принципы и методы количественного анализа в фаунистических исследованиях. М.: Наука. 288 с.
Петров А.Н., 2006. Дикий северный олень Rangifer tarandus Linnaeus, 1758 // Красная книга Ненецкого автономного округа. Нарьян-Мар: ГУП НАО “Ненецкий информационно-аналитический центр”. С. 364–366.
Разумовский С.М., 1981. Закономерности динамики биоценозов. М.: Наука. 231 c.
Ребристая О.В., 2002. Сосудистые растения острова Шокальского (Карское море) // Ботанический журнал. Т. 87. № 6. С. 29–40.
Розенфельд С.Б., 2009. Питание казарок и гусей в российской Арктике. М.: Товарищество научных изданий КМК. 236 с.
Розенфельд С.Б., 2011. Атлас микрофотографий кутикулярной структуры эпидермиса кормовых растений позвоночных фитофагов тундровой и степной зон Евразии. М.: Товарищество научных изданий КМК. 32 с.
Розенфельд С.Б., 2018. Итоговый отчет о результатах работ по мониторингу состояния ямало-белоостровской популяции дикого северного оленя (по гос. контракту № 7/18 от 11.04.2018 г.). 31 с.
Розенфельд С.Б., Груздев А.Р., Сипко Т.П. и др., 2012. Трофические связи овцебыка (Ovibos moschatus) и северного оленя (Rangifer tarandus) на острове Врангеля // Зоологический журнал. Т. 91. № 4. С. 503–512.
Розенфельд C.Б., Шереметьев И.С., 2016. Арктические гуси (Anser) и казарки (Branta) Евразии: анализ факторов динамики численности и ареалов // Журнал общей биологии. Т. 77. № 1. С. 16–37.
Розенфельд С.Б., Шереметьев И.С., Баранюк В.В., 2017. Малый белый гусь на острове Врангеля: трофические связи со жвачными и выбор репродуктивных местообитаний // Зоологический журнал. Т. 96. № 5. С. 511–521.
Саблина Т.Б., 1970. Эволюция пищеварительной системы оленей. М.: Наука. 248 с.
Сафронов В.М., 2005. Экология и использование дикого северного оленя в Якутии. Якутск: ЯФ ГУ “Изд-во СО РАН”. 188 с.
Сыроечковский Е.В., 2013. Пути адаптации гусеобразных трибы Anserini к обитанию в Арктике. М.: Товарищество научных изданий КМК. 297 с.
Тюлин А.Н., 1938. Промысловая фауна острова Белого // Труды Института полярного земледелия, животноводства и промыслового хозяйства. Сер. Промысловое, хозяйство. Л. 1. Вып. 1. С. 5–39.
Филонов К.П., 1983. Лось. М.: Лесная промышленность. 246 с.
Шварц Е.А., 2004. Сохранение биоразнообразия сообщества и экосистемы. М.: Товарищество научных изданий КМК. 112 с.
Шереметьев И.С., Петруненко Е.А., Кислов Д.В. и др., 2017. Трофическая избирательность крупных травоядных Восточной Монголии // Сибирский экологический журнал. № 1. С. 21–32.
Шереметьев И.С., Розенфельд С.Б., Груздев А.Р., 2017а. Перекрывание трофических спектров жвачных, гусей и леммингов на о-ве Врангеля в летний период // Экология. № 6. С. 440–446.
Шереметьев И.С., Розенфельд С.Б., 2018. Ландшафтные изменения на переходе плейстоцен-голоцен и динамика ареалов крупных травоядных млекопитающих Северной Азии // Аридные экосистемы. Т. 24. № 4. С. 21–30.
Ширшов С.М., 2003. Современное состояние ресурсов дикого северного оленя в Ямало-Ненецком автономном округе // Северный олень в России, 1982–2002 годы. М.: “Триадафарм”. С. 170–177.
Ashton I.W., Miller A.E., Bowman W.D., Suding K.N., 2010. Niche complementarity due to plasticity in resource use: plant partitioning of chemical N forms // Ecology. V. 91. № 11. P. 3252–3260.
Bergman C.M., Fryxell J.M., Gates C.C., Fortin D., 2001. Ungulate foraging strategies: energy maximizing or time minimizing? // Journal of Animal Ecology. V. 70. P. 289–300.
Clauss M., Kaiser T., Hummel J., 2008. Morphophysiological adaptation of browsing and grazing mammals // The ecology of browsing and grazing. Heidelberg: Springer-Verlag. P. 47–88.
Colwell R.K., Futuyma D.J., 1971. On the measurement of niche breadth and overlap // R.K. Ecology. V. 52. P. 567–576.
Drent R.H., 2006. The timing of birds’ breeding seasons: the Perrins hypothesis revisited especially for migrants // Ardea. V. 94. P. 305–322.
Geange S.W., Pledger S., Burns K.C. et al., 2011. A unified analysis of niche overlap incorporating data of different types // Methods in Ecology and Evolution. № 2. P. 175–184.
Gordon I., 2003. Browsing and grazing ruminants: Are they different beasts? // Forest Ecology and Management. V. 181. P. 13–21.
Geist V., 1974. On the relationship of social evolution and ecology in ungulates // American Zoologist. V. 14. P. 205–220.
Gordon I.J., Prins H.H.T., 2008. Introduction: grazers and browsers in a changing world // The Ecology of Browsing and Grazing. Ecological Studies. V. 195. Berlin: Springer. P. 1–20.
Greenberg R., 1990. Ecological plasticity, neophobia, and resource use in birds // Studies in Avian Biology. V. 13. P. 431–437.
Hammer O., Harper D.A.T., Ryan P.D., 2001. PAST: Palaeontological Statistics software package for education and data analysis // Palaeontologia Electronica. V. 4. № 1. P. 9.
Hopcraft J.G.C., Olff H., Sinclair A.R.E., 2010. Herbivores, resources and risks: Alternating regulation along primary environmental gradients in savannas // Trends in Ecology & Evolution. V. 25. P. 119–128.
Ims R.A., Fuglei E., 2005.Trophic interaction cycles in tundra ecosystems and the impact of climate change // BioScience. V. 55. P. 311–322.
Jacobs J., 1974. Quantitative measurement of food selection: A modification of the forage ratio and Ivlev’s electivity index // Oecologia. V. 14. № 4. P. 413–417.
Kerbes R.H., Kotanen P.M., Jefferies R.L., 1990. Destruction of wetland habitats by lesser snow geese: A keystone species on the West Coast of Hudson Bay // Journal of Applied Ecology. V. 27. № 1. P. 242–258.
Laca E.A., Sokolow S., Galli J.R. et al., 2010. Allometry and spatial scales of foraging in mammalian herbivores // Ecology Letters. V. 13. P. 311–320.
MacArthur R.H., Wilson E.O., 1967. The theory of island biogeography. Princeton. Princeton Univ. Press. 203 p.
Metcalfe D.B., Olofsson J., 2015. Distinct impacts of different mammalian herbivore assemblages on arctic tundra CO2 exchange during the peak of the growing season // Oikos. V. 124. № 12. P. 1632–1638.
Muller D. W., Codron D., Meloro C. et al., 2013. Assessing the Jarman–Bell Principle: Scaling of intake, digestibility, retention time and gut fill with body mass in mammalian herbivores // Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology. V. 164. P. 129–140.
Olsen A.M., 2015. Exceptional avian herbivores: multiple transitions toward herbivory in the bird order Anseriformes and its correlation with body mass // Ecology and Evolution. V. 5. № 21. P. 5016–5032.
Owen M., 1975. An assessment of fecal analyses technique in waterfowl feeding studies // Journal of Wildlife Management. V. 39. № 2. P. 271–279.
Rozenfeld S.B., Soloviev M.Yu., Kirtaev G.V. et al., 2017. Estimation of the spatial and habitat distribution of Anseriformes in the Yamal-Nenets and Khanty-Mansi autonomous regions (Experience from the use of ultralight aircrafts) // Biology Bulletin. V. 44. № 8. P. 960–979.
Sedinger J.S. et al., 1992. Ecology of prefledging waterfowl // Ecology and management of breeding waterfowl. Minneapolis and London: University of Minnesota press. P. 109–127.
Sedinger J.S., Raveling D.G., 1984. Dietary selectivity in relation to availability and quality of food for gosling of Cackling Geese // Auk. V. 101. P. 295–306.
Sinclair A.R.E., 2003. Patterns of predation in a diverse predator-prey system. A.R.E. Sinclair, S. Mduma, J.S. Brashares // Nature. V. 425. P. 288–290.
TIBCO Software Inc. Statistica, вepcия 13, 2017. http://statistica.io
Zimov S.A., Zimov N.S., Tikhonov A.N., Chapin F.S., 2012. Mammoth steppe: A high-productivity phenomenon // Quaternary Science Reviews. V. 57. P. 26–45.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал