Зоологический журнал, 2020, T. 99, № 9, стр. 963-987
Роль симпатрического и аллопатрического видообразования в формировании биологического разнообразия насекомых-фитофагов – исследование на примере палеарктических видов рода Macropsis Lewis 1836 (Homoptera, Auchenorrhyncha, Cicadellidae, Eurymelinae, Macropsini)
Д. Ю. Тишечкин *
Биологический факультет Московского государственного университета
имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: macropsis@yandex.ru
Поступила в редакцию 19.02.2020
После доработки 09.03.2020
Принята к публикации 23.04.2020
Аннотация
На примере 60 палеарктических видов рода Macropsis (Homoptera, Cicadellidae, Eurymelinae, Macropsini) исследован вклад симпатрического и аллопатрического видообразования в формирование биоразнообразия этих насекомых-фитофагов. Согласно реконструированным ранее сценариям эволюции, в умеренной зоне Палеарктики род расселялся с востока на запад, сформировав 10 естественных групп, выделяющихся в одних и тех же границах как по морфологическим признакам, так и по трофической специализации. При формулировке гипотезы о возможных путях видообразования в каждой группе мы исходили, главным образом, из географического критерия. Если близкие виды викарируют друг друга в разных зоогеографических регионах, вероятно, они возникли в условиях аллопатрии. Если виды имеют перекрывающиеся ареалы и живут на одном кормовом растении, предполагается, что они возникли в условиях аллопатрии и стали вторично симпатрическими за счет последующего расселения. Наконец, если близкие виды имеют сильно перекрывающиеся ареалы, населяют сходные биотопы, но четко различаются по кормовой специализации, это может указывать на их происхождение в условиях симпатрии за счет перехода на новые кормовые растения. Для 31 вида (51.7%) наиболее вероятной или даже единственной возможной является гипотеза об аллопатрическом видообразовании, тогда как для 20 видов (33.3%) вполне допустима, хотя и не всегда может быть убедительно обоснована гипотеза о симпатрическом видообразовании. Механизм происхождения 9 видов (15%) остался неясным. Из этого следует, что симпатрическое видообразование у Macropsis – явление нередкое, но говорить о его преобладании над аллопатрическим не приходится. Таким образом, даже в пределах одного рода насекомых-фитофагов видообразование может происходить разными путями: в условиях аллопатрии, когда смена кормового растения не обязательна, хотя и возможна, и в условиях симпатрии, при которой именно переход на новое растение является триггером дивергенции. Отдельно обсуждаются случаи внутривидовой дифференциации, которые можно рассматривать как начальную стадию видообразования: аллопатрические цветовые формы, связанные с одним и тем же кормовым растением, аллопатрические цветовые формы, связанные с разными растениями, и формы, живущие на разных видах растений (как симпатрических, так и аллопатрических), но при этом не различающиеся по окраске. Показано, что даже у специализированных фитофагов дивергенция не всегда бывает вызвана переходом на новое кормовое растение.
Изучение видообразования у насекомых представляет особый интерес, поскольку эта группа достигла максимального видового разнообразия, практически несравнимого с другими таксонами. Объем литературы по данному вопросу в последние десятилетия лавинообразно возрастает; это касается даже обзорных работ, не говоря уже о частных исследованиях. В связи с этим в данной статье мы ограничимся, главным образом, ссылками на некоторые обзоры и на работы по насекомым-фитофагам, преимущественно, по цикадовым (Homoptera, Auchenorrhyncha).
Механизм аллопатрического видообразования понятен и не требует построения сложных гипотез. Существование многочисленных аллопатрических видов, викарирующих друг друга в разных биогеографических регионах, на разных островах или на разных горных хребтах, свидетельствует о том, что этот вариант видообразования достаточно обычен. Кроме того, практически во всех группах животных известны внутривидовые географические формы, представляющие собой примеры незавершившегося аллопатрического видообразования. Некоторые из них описаны как подвиды, другие с уверенностью разграничить не удается.
В последние годы мы подробно исследовали географическую изменчивость двух видов цикаделлид (Homoptera, Auchenorrhyncha, Cicadellidae) и одного вида пенниц (Homoptera, Auchenorrhyncha, Aphrophoridae) (Tishechkin, 2018, 2019, 2019b). Во всех трех случаях разные формы одного вида не различаются по биотопическим предпочтениям и кормовой специализации. Разделить их по морфологическим или акустическим признакам также не удается: два вида образуют подвиды, соединенные переходной зоной, а у третьего наблюдается мозаичное распределение морфологических и акустических вариаций. Все это свидетельствует о том, что они представляют собой именно внутривидовые формы, а не разные виды. При этом все три вида имеют практически непрерывное распространение. Это доказывает, что у цикадовых образование внутривидовых форм, во-первых, возможно не только при географической изоляции, но и в непрерывном ряду популяций и, во-вторых, не всегда связано с переходом на другое кормовое растение. Разумеется, не всем таким формам суждено со временем стать “хорошими” видами, однако в случае возникновения кратковременной изоляции, например, при флуктуациях климата вероятность их окончательного разделения достаточно велика.
Вопрос о вкладе симпатрического видообразования в формирование биоразнообразия до сих пор далек от решения. Еще во второй половине прошлого столетия некоторые исследователи, в частности, Майр, вообще отрицали его возможность или считали такое явление редким исключением (например, Майр, 1974; Futuyma, Mayer, 1980). Однако после детального описания нескольких примеров симпатрического видообразования многие специалисты заняли противоположную, но столь же радикальную позицию: по их мнению, этот вариант является основным у видов с узкой трофической специализацией, в первую очередь, в некоторых группах насекомых. При этом у насекомых до сих пор известно сравнительно небольшое число хорошо изученных примеров симпатрического видообразования, поэтому такая точка зрения остается во многом дискуссионной.
Впервые гипотеза, объясняющая механизм симпатрического видообразования у специализированных фитофагов, была сформулирована во второй половине XIX века (Walsh, 1864). Основанием для этого стало изучение одного из видов мух семейства Tephritidae (Diptera) – Rhagoletis pomonella (Walsh 1867), перешедшего с местного вида боярышника на культурную яблоню и наносящего ущерб садоводству. Впоследствии он, а также несколько других видов этого семейства, стали популярными модельными объектами исследований по данной теме (например, Berlocher, 1999; Feder, Filchak, 1999).
Начиная с 90-х годов прошлого столетия изучение экологического видообразования, при котором репродуктивная изоляция возникает как результат разделения экологических ниш, стало одним из наиболее популярных направлений эволюционной биологии (Jousselin, Elias, 2019). У видов с узкой пищевой специализацией, в первую очередь у насекомых-фитофагов и паразитоидов, экологическое видообразование обычно считают синонимом симпатрического, т.к. в естественных условиях новый хозяин или кормовое растение, как правило, обитают в той же местности, что и исходный хозяин или исходное кормовое растение. Переход на нового хозяина, аллопатричного с исходным хозяином, возможен лишь при расширении ареала и наблюдается преимущественно при интродукции.
Одним из наиболее детальных и широко известных исследований, убедительно доказывающих существование симпатрического видообразования у насекомых-фитофагов, является цикл работ Т. Вуда с соавторами по американским горбаткам комплекса Enchenopa binotata (Say 1824) (Homoptera, Auchenorrhyncha, Membracidae) (Wood, 1980; Wood, Guttman, 1982; Wood, Keese, 1990; Wood et al., 1999 и др.). Комплекс включает около десяти криптических видов, большинство из которых до сих пор формально не описано и, таким образом, не имеет научных названий. Дивергенция в этой группе, по всей вероятности, началась с перехода предковой формы на разные симпатрические виды деревьев и кустарников. Как и большинство других цикадовых, E. binotata откладывает яйца в сделанные яйцекладом надрезы на коре кормового растения. Весной стимулом для развития яиц является начало сокодвижения в стебле. Поскольку у разных видов растений оно начинается в разные сроки, это приводит к расхождению сроков развития популяций горбатки, связанных с этими видами растений. За счет этого поток генов между формами с разных кормовых растений ослаб, и началась их постепенная дивергенция; в эксперименте даже при пятидневной разнице в возрасте между разными лабораторными линиями наблюдалось четко выраженное ассортативное скрещивание. Спаривание у видов комплекса E. binotata происходит преимущественно на “своем” кормовом растении, на него же самки предпочитают откладывать яйца; на других видах хозяев выживаемость яиц и личинок намного ниже.
Связанные с акустической коммуникации аспекты этой проблемы в деталях исследованы Р. Кокрофтом с соавторами; чтобы не увеличивать без необходимости число ссылок, сошлемся на одну из его обзорных работ (Cocroft et al., 2008). Сигналы всех видов горбаток этой группы различаются преимущественно по количественным параметрам, особенно, по несущей частоте и продолжительности. В опытах с ретрансляцией сигналов самки отвечали только на сигнал конспецифического самца; наиболее ярко эти предпочтения были выражены по отношению к частоте. На чужом растении самцы пели менее охотно и издавали более короткие сигналы, что, несомненно, также вносит вклад в репродуктивную изоляцию, поскольку снижает привлекательность самца для самки.
Более того, в этой группе наблюдается и прямое влияние экологической дивергенции на структуру сигналов. Изучение частотных характеристик двух видов растений показало, что живущие на них горбатки издают сигналы на частотах, распространяющихся с минимальным затуханием именно по “своему” кормовому растению. Поэтому межвидовые различия сигналов по несущей частоте, вероятно, изначально возникли именно как “частотная настройка” на характеристики определенного субстрата (ветвей разных видов растений) и лишь впоследствии стали одним из факторов репродуктивной изоляции.
Данные о том, что различия в фенологии между разными видами кормовых растений могут стать причиной репродуктивной изоляции, получены и для других фитофагов, в частности, для перепончатокрылых семейства Cynipidae (Hymenoptera) (Hood et al., 2019).
Огромное видовое разнообразие цикадок трибы Erythroneurini (Cicadellidae, Typhlocybinae) в Новом Свете также, по-видимому, сформировалось, главным образом, за счет симпатрического видообразования, т.к. эта группа включает множество симпатрических видов с узкой пищевой специализацией (Bush, Butlin, 2004). В этой же статье можно найти и многочисленные ссылки на работы по симпатрическому видообразованию в других таксонах насекомых.
Как правило, видообразование в условиях симпатрии связывают именно со сменой хозяина (для фитофагов – кормового растения); некоторые авторы считают этот вариант наиболее вероятным и легко доказуемым (Bolnick, Fitzpatrick, 2007). Тем не менее, симпатрическое видообразование у фитофагов возможно и при переходе на разные органы одного вида растений (листья, стебли, корни, цветки и плоды) или при смене типов питания (минирование листьев, галлобразование и т.п.) (Bruzzese et al., 2019). Однако для видов рода Macropsis Lewis 1836 (Homoptera, Auchenorrhyncha, Cicadellidae, Eurymelinae, Macropsini), являющихся объектами нашего исследования, этот вариант исключен, так как все они питаются, высасывая соки из тонких ветвей, черешков или крупных жилок листьев.
Появление новых кормовых рас, в перспективе способных дивергировать до уровня видов, может быть вызвано и человеческой деятельностью – введением растений в культуру или их интродукцией. В частности, становление одного из основных вредителей риса в Тихоокеанском регионе – Nilaparvata lugens (Stål 1854) (Homoptera, Auchenorrhyncha, Delphacidae) – объясняют переходом этого вида с одного из дикорастущих злаков на рис, выращиваемый в тех же условиях. В настоящее время первичное кормовое растение растет по краям рисовых полей в качестве сорняка, но две кормовые расы N. lugens (“рисовая” и “дикая”) по структуре призывных сигналов уже обособились до уровня самостоятельных видов (Claridge et al., 1985). Аналогично, генетическая дифференциация цикадки Dalbulus maidis (DeLong 1923) (Homoptera, Auchenorrhyncha, Cicadellidae, Deltocephalinae), вероятно, связана с введением в культуру кукурузы и ее распространением в разных частях Нового Света (Bernal et al., 2019).
В итоге, в настоящее время принципиальную возможность симпатрического видообразования уже никто не отрицает. На первый план вышли два других вопроса: во-первых, как определить, сформировалась данная группа видов в процессе аллопатрического или симпатрического видообразования и, во-вторых, насколько распространен второй вариант видообразования в природе?
Неопровержимым доказательством того, что видообразование происходило в условиях симпатрии, может быть лишь прямое наблюдение всего процесса дивергенции. На практике это пока невозможно, что заставляет обращаться к косвенным доказательствам, т.е. к поиску признаков или особенностей, которые с большей вероятностью соответствуют симпатрической, нежели аллопатрической модели видообразования. Разные авторы предлагают разные косвенные критерии для выявления случаев симпатрического видообразования (например, восемь критериев у Берлохера и Федера (Berlocher, Feder, 2002), четыре – у Болника и Фицпатрика (Bolnick, Fitzpatrick, 2007). При использовании большинства из этих критериев необходимо проведение генетических исследований или лабораторных экспериментов, что заставляет ограничиваться небольшой группой модельных таксонов. Поскольку наша задача, напротив, заключается в изучении как можно большего числа видов, в данном случае применим, главным образом, лишь один критерий, а именно, географический. Если сестринские виды симпатричны, но живут на разных растениях, вероятно, они возникли в условиях симпатрии, если же они аллопатричны, скорее всего, их дивергенция происходила за счет аллопатрии. Кроме того, по мнению авторов двух цитированных выше работ, для таксона, в котором с большей вероятностью возможно симпатрическое видообразование, должны быть характерны следующие черты.
1. Виды такого таксона должны обладать узкой пищевой специализацией (Berlocher, Feder, 2002).
У являющихся объектами нашего исследования представителей рода Macropsis дело обстоит именно так, вплоть до того, что иногда для определения вида достаточно знать его кормовое растение.
2. Группа кормовых растений, используемых разными видами, должна обладать достаточно большим видовым разнообразием (Berlocher, Feder, 2002).
Рода Populus, Salix и Rosa, с которыми связаны виды Macropsis, предположительно возникшие в результате симпатрического видообразования, включают значительное число видов, в том числе встречающихся в одном растительном сообществе.
3. Спаривание должно происходить на кормовом растении. Это способствует репродуктивной изоляции как за счет пространственной сегрегации (популяции живут на разных растениях), так и из-за фенологических различий (популяции, живущие на разных растениях, расходятся по сезонам размножения) (Berlocher, Feder, 2002).
Повышение вероятности симпатрического видообразования обусловлено не только именно спариванием на растении-хозяине, но и в целом привязанностью к этому растению в сочетании с низкой расселительной способностью. Виды Macropsis проходят на своих кормовых растениях весь цикл развития и неохотно покидают их. Кроме того, как и все мелкие цикадовые, они используют для поиска полового партнера вибрационную коммуникацию. Вибрационные сигналы могут передаваться с растения на растение только при физическом контакте корней, стеблей или листьев, а дальность их распространения по прямой ветви ограничена 1–2 метрами. Поэтому даже у симпатрических форм, связанных с разными видами деревьев и кустарников, различия в пищевых предпочтениях способствуют акустической изоляции.
4. Видообразование должно быть завершенным. Состояние частичной дивергенции может оказаться стабильным и не приведет к формированию репродуктивно изолированных форм, поэтому интерпретировать такие случаи как примеры симпатрического видообразования нельзя (Bolnick, Fitzpatrick, 2007). В нашем случае видовая самостоятельность всех криптических видов подтверждается анализом морфологических и акустических признаков.
Таким образом, род Macropsis полностью соответствует всем перечисленным критериям.
Нужно добавить, что географический критерий становится менее надежным с течением времени, прошедшего после акта видообразования. Виды, имеющие аллопатрическое происхождение, могут стать вторично симпатрическими за счет последующего расселения, а изначально симпатрические виды могут, наоборот, исчезнуть в зоне симпатрии и сформировать аллопатрические ареалы. Подобные изменения, в частности, вызванные плейстоценовыми флуктуациями климата, возможны даже в сравнительно молодых группах. Несмотря на это, географический критерий, по мнению ряда авторов, не теряет своего значения и даже продолжает играть основную роль в исследованиях видообразования (Bolnick, Fitzpatrick, 2007).
В умеренной зоне Палеарктики род Macropsis представлен молодыми, недавно разошедшимися видами, порой практически неразличимыми по морфологическим признакам; видовой статус многих из них удалось доказать только при помощи анализа призывных сигналов самцов (например, Tishechkin, 1999, 2002, 2015a). Поэтому вероятность значительных изменений ареалов в этой группе существенно меньше, чем в большинстве других таксонов палеарктических цикадовых, где виды достаточно легко различимы по морфологии и, по-видимому, сформировались сравнительно давно. Тем не менее у Macropsis нам известны случаи вторичной симпатрии; они будет рассмотрены ниже.
Относительно распространенности симпатрического видообразования в литературе существует весь спектр возможных мнений. Ряд специалистов, в частности Г. Буш (обзор: Bush, Butlin, 2004 и другие работы первого автора), полагает, что разнообразие паразитоидов и специализированных фитофагов, в сумме составляющих порядка 25–40% от общего числа видов животных (Berlocher, Feder, 2002), формируется преимущественно за счет симпатрического видообразования. Напротив, в неспециализированных в плане питания группах, по-видимому, преобладает аллопатрическое видообразование. Такая позиция обосновывается, в частности, тем, что за счет одного лишь перехода на новое кормовое растение поток генов между популяциями иногда сокращается настолько, что различия в сигналах, служащих для распознавания конспецифического партнера, могут возникнуть просто в результате дрейфа генов, т.е. без влияния разнонаправленного отбора (Butlin, 1996).
Другие авторы придерживаются более умеренной точки зрения. Безусловно соглашаясь с тем, что симпатрическое видообразование существует, они полагают, что имеющиеся данные все же свидетельствуют в пользу преобладания аллопатрического видообразования даже у специализированных фитофагов (Claridge, de Vrijer, 1994; Bolnick, Fitzpatrick, 2007). Например, в двух связанных со злаками родах неарктических Deltocephalinae (Homoptera, Auchenorrhyncha, Cicadellidae) – Flexamia DeLong 1926 (более 40 видов) и Athysanella Baker 1898 (более 150 видов) – дивергенция на ранних этапах эволюции, вероятно, происходила за счет перехода на новые кормовые растения, т.е. в условиях симпатрии, а на более поздних – за счет разделения ареалов предковых форм, т.е. в условиях аллопатрии (Dietrich, 1999). Аналогичные результаты были недавно получены и для одного из родов тропических Tephritidae (Diptera) (Winkler et al., 2018).
Таким образом, недооценивать роль разных вариантов видообразования не следует, поскольку маловероятно, что все огромное разнообразие организмов сформировалось неким единым образом (Claridge, 1993; Drosopoulos, 1993). Даже само разграничение двух типов видообразования представляется условным, т.к. между строго аллопатрическим и строго симпатрическим видообразованием существует континуум вариантов. Признание промежуточного типа – парапатрического видообразования – хотя и позволяет несколько точнее описать реальное положение вещей, но представляет собой лишь условность (Butlin et al., 2008; Fitzpatrick et al., 2008; Claridge, 2010).
Оценить распространенность симпатрического видообразования отчасти позволяют количественные исследования роли смены хозяина в этом процессе. Изучение 21 описанного в литературе примера перехода насекомых-фитофагов на новые кормовые растения показало, что у трех видов популяции с разных растений безусловно можно считать кормовыми расами, представляющими собой первую стадию симпатрического видообразования, а еще у восьми видов можно отнести к категории кормовых рас с большой долей вероятности (Drès, Mallet, 2002). Форбс с соавторами, рассмотрев данные по 85 видам насекомых, подсчитал, что у 43 из них переход на нового хозяина привел к формированию новых репродуктивных барьеров, причем в 26 случаях это способствовало видообразованию (Forbes et al., 2017). Примечательно, что доля таксонов, в которых переход на новое кормовое растение вероятно стал триггером дивергенции, в обоих исследованиях примерно одинакова и составляет чуть более 50%.
Подсчеты других авторов (Bolnick, Fitzpatrick, 2007) дают совершенно иные результаты: из 309 рассмотренных ими актов видообразования лишь в 9.4% случаев возникшие сестринские виды имели ареалы, перекрывающиеся более чем на 90%, и потенциально могли сформироваться в условиях симпатрии. Однако в этом исследовании не были учтены озерные рыбы и насекомые-фитофаги, т.е. именно те две группы, в которых описано наибольшее число случаев потенциально симпатрического видообразования. Такое расхождение результатов (более 50% и менее 10%) явно свидетельствует о том, что в разных таксонах “склонность” к симпатрическому видообразованию выражена в разной степени. Поэтому лишь суммирование многочисленных частных исследований, выполненных на разных группах, позволит оценить вклад разных типов видообразования в формирование биоразнообразия.
Данная работа представляет собой как раз такое частное исследование, однако мы используем иной подход, нежели большинство авторов, работающих на единичных модельных объектах. Взяв одну большую группу специализированных фитофагов, а именно, палеарктические виды цикадовых рода Macropsis, мы делаем попытку оценить в ней число видов, сформировавшихся в условиях симпатрии и аллопатрии.
МАТЕРИАЛ И МЕТОДИКА
Исследованный материал был собран автором в период с 1985 по 2019 г. на территории европейской России от Подмосковья до Крыма и полупустынь Заволжья, на Северном Кавказе, Южном Урале, в Южной Сибири от Алтая до Забайкалья, на Дальнем Востоке (Амурская обл., Хабаровский и Приморский края, о-в Сахалин), а также в Южном и Юго-восточном Казахстане и Кыргызстане. Использованные в работе данные по морфологии, распространению, кормовым растениям и акустическим сигналам изложены в наших обзорных работах по роду Macropsis (Tishechkin, 1999, 2002, 2015a), а также в многочисленных частных статьях, ссылки на которые здесь не приводятся. Из этих же статей взята часть приведенных ниже морфологических рисунков.
Определение кормовых растений из семейства ивовых (Salicaceae) производили по монографии Скворцова (1968), а также по ключам в региональных “Флорах” (Большаков, 1992; Недолужко, 1995; Скворцов, 1972); валидные названия секций и видов ив приведены по Валягиной-Малютиной (2018). Растения из других семейств определяли по многочисленным региональным определителям, список которых мы не приводим.
Для регистрации вибрационных сигналов цикадовых использовали пьезокристаллический адаптер (головку звукоснимателя) ГЗП-311 от проигрывателя для виниловых дисков, сигнал с которого подавали на микрофонный вход записывающего устройства через согласующий усилитель. Запись производили на кассетный магнитофон “Электроника-302-1” (до 2005 г.), минидисковый рекордер Sony Walkman MZ-NH900 (2005–2016 г.г.) или WAV/MP3 рекордер Roland R-05 (начиная с 2017 г.). Во всех случаях во избежание амплитудных искажений использовали режим ручной регулировки уровня записи. Обработку полученных записей производили в программе Cool Edit Pro 2.1.
При формулировке гипотезы о возможных путях видообразования в каждой группе видов мы основывались на ряде соображений и априорных допущений, о которых нужно сказать подробнее.
1. По мнению Гамильтона (Hamilton, 1983), Macropsini возникли в Ориентальной области, т.к. именно в этом регионе наблюдается наибольшее разнообразие родов, а виды четко различаются по морфологическим признакам. Оттуда они проникли на юг, в Австралию, где сформировали богатую, весьма оригинальную и до сих пор малоизученную фауну, и на север, в Голарктику. Некоторые рода (например, Pediopsoides Matsumura 1912) достигают максимального разнообразия в юго-восточных районах Палеарктики, преимущественно в Китае. Они почти не заходят в умеренную зону и представлены хорошо различающимися по морфологическим признакам видами. Oncopsis Burmeister 1838, Macropsis и Macropsidius Ribaut 1952, напротив, широко расселились именно в районах с умеренным климатом, где включают большое число трудноразличимых видов.
Закономерности эволюции подсемейства в целом и рода Macropsis во многом схожи (Tishechkin, 2016). На юго-востоке Палеарктики виды этого рода наиболее разнообразны в морфологическим плане, вплоть до того, что один из них был выделен в отдельный подрод (Li et al., 2013). По мере продвижения на север и на запад их морфологическое разнообразие резко уменьшается, и в лесной зоне, за исключением южной части Дальнего Востока, остается несколько близкородственных и крайне однородных групп, включающих большое число криптических видов. В горах Средней Азии представители рода перешли на неосвоенные ранее виды растений и сформировали на них отдельные небольшие группы видов, некоторые представители которых впоследствии вышли за пределы этого региона. Кроме того, одна “южная” ветвь Macropsis, связанная с мимозовыми (Mimosaceae), проникла, вероятно, через Индию, Пакистан, южный Иран и Аравийский п-ов в Африку, где образовала большое число видов на огромном роде Acacia (Tishechkin, 2019c).
Таким образом, в наших последующих рассуждениях мы исходим из того, что в умеренной зоне Палеарктики род расселялся с востока на запад, образовав ряд своеобразных таксонов в Средней Азии.
2. Изученные виды рода образуют 10 естественных групп, выделяющихся в одних и тех же границах как по морфологическим признакам, так и по трофической специализации. Это позволяет утверждать, что виды в пределах каждой группы представляют собой сестринские формы, возникшие при освоении новой адаптивной зоны, т.е. группы кормовых растений (Tishechkin, 2016).
3. При определении наиболее вероятного сценария видообразования мы исходим преимущественно из географического критерия.
Если близкие виды викарируют друг друга в разных географических регионах, можно полагать, что они возникли в результате аллопатрии.
Если близкие виды имеют в той или иной мере перекрывающиеся ареалы и живут на одном кормовом растении, мы предполагаем, что они возникли в условиях аллопатрии и стали вторично симпатрическими за счет последующего расселения (Tishechkin, 2015). Хотя расселение за пределы изначального ареала требует определенного времени и, казалось бы, маловероятно для недавно возникших и почти не дивергировавших по морфологическим признакам видов, тем не менее, в нашем материале есть немало таких примеров.
Наконец, если близкие виды имеют сильно перекрывающиеся ареалы, населяют сходные биотопы, но четко различаются по кормовой специализации, это может указывать на их возникновение в результате симпатрического видообразования за счет расхождения по разным кормовым растениям.
РЕЗУЛЬТАТЫ
Случаи симпатрического и аллопатрического видообразования у палеарктических видов рода Macropsis
В этом разделе мы рассмотрим 10 упомянутых выше групп видов и сделаем попытку реконструировать сценарий видообразования в каждой из них.
1. Виды, развивающиеся на дубах (Quercus spp., Fagaceae). Наиболее сильно отличаются от остальных палеарктических групп. Достигают максимального разнообразия на юго-востоке Палеарктики и в прилежащих частях Ориентальной области, где находится один из центров видового разнообразия дубов (Меницкий, 1984). Передние крылья обычно с беспорядочно расположенными темными крапинками, верхняя часть лица, переднеспинка, и, как правило, щиток с четким продольным серединным килем (рис. 1, 1), восьмой стернит брюшка самцов по бокам с пучками хет (рис. 1, 2), отростки пигофора разнообразной формы в отличие от простых шиловидных у видов из других групп (рис. 1, 3), ствол пениса в профиль узкий, параллельносторонний, нередко с широко закругленной вершиной (рис. 1, 4) (Li et al., 2014).
Рис. 1.
Цикадки рода Macropsis. 1–4 – группа 1, вид с дуба (M. matsumurana), 5–13 – группа 2, виды с ивовых, принадлежащие к разным комплексам (5 – M. vicina, 6 – M. validiuscula, 7, 10, 13 – M. viridobrunnea, 8, 11 – M. ocellata, 9 – M. iliensis, 12 – M. hinganensis); 14–15 – группа 2, виды с тополей (14 – M. suspecta, 15 – M. fuscinervis); 16–17 – группа 2, ивовые виды из первого комплекса (16 – M. arvicolaria, 17 – M. leporina); 18–31 – группа 2, ивовые виды из второго комплекса (18–20, 27 – M. flavida, 21–23, 28 – M. multa, 24–26, 29 – M. impura, 30–31 – M. remota); 32–35 – ивовые виды из третьего комплекса (32–33 – M. viridinervis, 34–35 – M. verbae). 1 – внешний вид, 2 – VIII стернит брюшка самца, 3, 13 – отросток доли пигофора, 4, 10–12, 19–20, 22–23, 25–26, 30–32, 34 – пенис сбоку, 5–9, 16–17 – аподемы II брюшного тергита самца, 14–15, 27–29, 33, 35 – внутренние створки яйцеклада, 18, 21, 24 – тергальные и стернальные аподемы II брюшного сегмента самца.
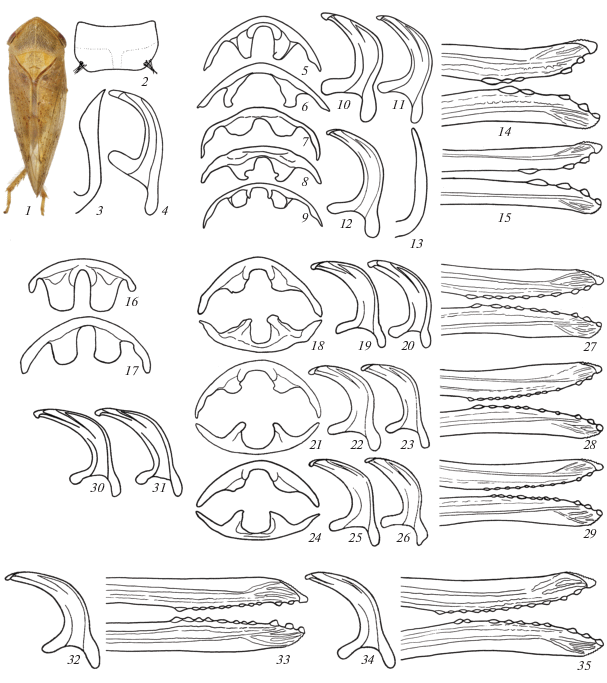
В России два вида на Дальнем Востоке. M. matsumurana (China 1925) распространен от юга Амурской обл. до Южного Приморья, о-ва Кунашир и Японии, M. jozankeana (Matsumura 1912) известен только из Южного Приморья, с о-ва Кунашир и из Японии. Таким образом, ареалы этих видов полностью перекрываются. Первый вид был собран в Приморье на Quercus dentata Thunb.; в Амурской обл., за неимением последнего, живет на Q. mongolica Fisch. ex Ledeb. Второй вид достоверно известен только с Q. dentata, хотя тоже, несомненно, способен питаться и на других видах дубов, поскольку на Кунашире Q. dentata не растет. На юге Приморья мы неоднократно собирали оба вида с одного дерева Q. dentata.
Учитывая способность M. matsumurana и M. jozankeana развиваться на разных видах дубов, т.е. отсутствие у них узкой кормовой специализации, мы предполагаем, что они возникли в условиях аллопатрии и стали вторично симпатрическими в ходе последующего расширения ареалов. Такой сценарий представляется более вероятным еще и потому, что, помимо материка, оба вида распространены также на островах (Южные Курилы и Япония), т.е. в условиях, способствующих аллопатрическому видообразованию.
2. Виды, связанные с двумя родами семейства ивовых (Salicaceae) – ивами (Salix) и тополями (Populus). Характеризуются следующей комбинацией признаков: тергальные аподемы II брюшного сегмента самцов обычно короткие, разделены широкой округлой выемкой, если по длине превышают собственную ширину в основании, то вершины лопастей не расширены (рис. 1, 5–9, 16–17, 18, 21, 24); ствол пениса в профиль сравнительно широкий, расширенный в середине или параллельносторонний, всегда постепенно сужающийся к вершине (рис. 1, 10–12, 19–20, 22–23, 25–26, 30–32, 34), отростки пигофора простые, шиловидные (рис. 1, 13).
Самая большая группа, включающая ряд до сих пор не описанных видов. Некоторые из них образуют комплексы близкородственных, часто практически неразличимых по морфологическим признакам форм, другие, напротив, не вписываются ни в один из таких комплексов, и их родственные связи неясны. Здесь рассмотрены 39 видов; несколько форм, видовой статус которых не доказан, исключены из анализа.
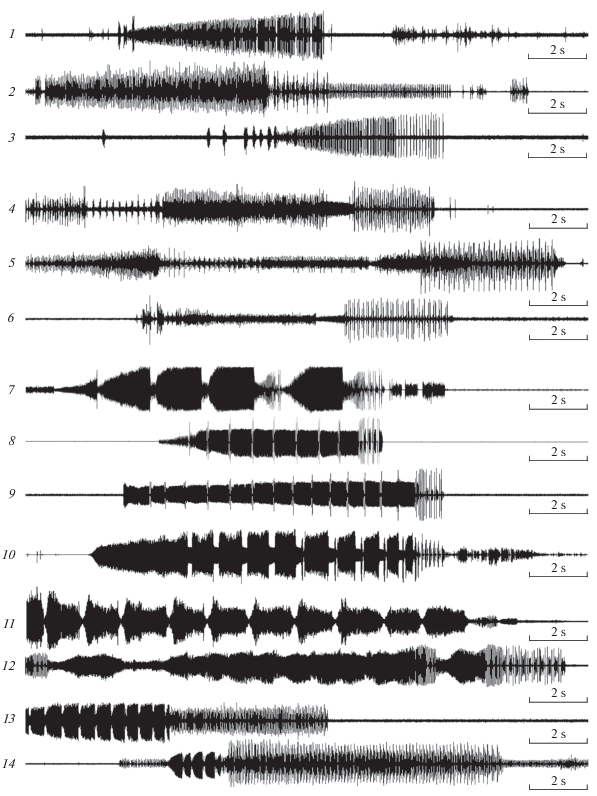
Отдельный комплекс образуют пять видов, связанных с родом Populus. Это довольно крупные виды, имеющие на внутренних створках яйцеклада, помимо трех предвершинных, 1–3 дополнительных зубца (рис. 1, 14–15). Поскольку у Macropsis число дополнительных зубцов подвержено внутривидовой изменчивости, на рисунках для каждого вида мы приводим лишь один более или менее типичный вариант. Отличаются от всех остальных изученных представителей рода своеобразной структурой призывных сигналов и сигналов ухаживания, а также отсутствием четкой границы между сигналами этих двух типов. В норме одиночный самец издает простые сигналы, основным компонентом которых является трель пульсов, иногда разделенная на несколько частей, – призывные сигналы в узком смысле слова (рис. 2, 1–3). Реже он спонтанно исполняет сложные многокомпонентные фразы, состоящие из одной или нескольких трелей пульсов и оканчивающиеся высокоамплитудной последовательностью серий (рис. 2, 4–6). Такой же сигнал самец издает и при ухаживании за самкой непосредственно перед попыткой копуляции. Необходимо пояснить, что сигналы мелких цикадовых отличаются очень широкой внутривидовой изменчивостью (Tishechkin, 2010; см. также рис. 2, 11–12 и 13–14). Поэтому при сравнении осциллограмм следует учитывать, что длительность фразы в целом и ее отдельных частей, а также соотношение амплитуд разных компонентов может меняться в широких пределах даже в песне одного самца.
Рис. 2.
Осциллограммы сигналов самцов рода Macropsis. 1–3 – виды с тополей, призывные сигналы; 4–6 – то же, сигналы ухаживания; 7–14 – ивовые виды из второго комплекса, призывные сигналы. 1, 4 – M. suspecta; 2, 5 – M. graminea; 3, 6 – M. fuscinervis; 7 – M. impura; 8 – M. flavida; 9 – M. remota; 10 – M. daurica; 11–12 – M. microcera; 13–14 – M. multa.
Три внешне очень сходных вида имеют аллопатрическое распространение; все они питаются на так называемых “черных тополях” (виды секций Aigeiros и Tacamahaca). Это европейско-кавказский M. graminea (Fabricius 1798), среднеазиатский M. validiuscula Dubovsky 1966 и встречающийся от Восточного Казахстана до Дальнего Востока M. suspecta Tishechkin 1994. Первые два живут на тополях секции Aigeiros, однако могут переходить на культивируемые бальзамические тополя (секция Tacamahaca) и гибридные формы, третий пока известен только с тополей секции Tacamahaca; таким образом, полного расхождения по разным кормовым растениям у них не наблюдается. На наш взгляд, эти три вида представляют собой типичный пример аллопатрического видообразования.
M. fuscinervis (Boheman 1845) живет на осине (Populus tremula L.) и распространен по всей Палеарктике в пределах ее ареала. M. vicina (Horváth 1897) связан с серебристым тополем (P. alba L.) и населяет всю Европу, Западную Сибирь, Казахстан и Среднюю Азию. Тем не менее, его естественный ареал, вероятно, не столь широк, т.к. по мнению Скворцова (1972), в Азии серебристый тополь в диком виде встречается лишь на востоке Казахстана и, возможно, кое-где на Сырдарьинском Каратау, а в остальных районах представляет собой культурный или одичавший вид. В итоге ареалы M. fuscinervis и M. vicina перекрываются почти полностью, за исключением “сомнительной” среднеазиатской части, где серебристый тополь, скорее всего, интродуцирован, а осина не растет.
Для этой пары видов вполне возможен симпатрический сценарий видообразования за счет перехода предковой формы с осины на серебристый тополь при расселении с востока на запад. В его пользу свидетельствует еще и то, что оба кормовых растения филогенетически очень близки, нередко образуют гибриды (Скворцов, 1972), и их обычно относят к одной секции Populus.
Остальные виды этой группы развиваются на ивах. Среди них наблюдается максимальное число потенциальных случаев симпатрического видообразования. Этому, вероятно, во многом способствуют особенности биологии кормовых растений. Во-первых, многие виды ив образуют по долинам рек смешанные заросли, тянущиеся практически непрерывной полосой по всем разветвлениям речной сети. В такой ситуации трудно представить возникновение эффективной географической изоляции между популяциями в разных участках речного бассейна, особенно на равнине. Во-вторых, разные виды ив в пределах одного растительного сообщества расходятся по фенологии, в частности, по срокам распускания листьев (Валягина-Малютина, 2018), что неминуемо приводит к различиям в сроках развития связанных с ними фитофагов. Здесь усматривается явная аналогия с горбатками группы Enchenopa binotata (см. введение), которые тоже сформировались в условиях симпатрии за счет перехода на различающиеся по фенологии кормовые растения.
Первый комплекс “ивовых” видов включает три криптических вида, обладающих очень длинными и широкими аподемами II брюшного тергита самцов (рис. 1, 16–17); все они живут на ивах подрода Vetrix. M. ochotonaria Tishechkin 1994 и M. arvicolaria Tishechkin 1994 связаны с ивами секции Helix, но первый распространен от Тывы до Амурской обл. (долина р. Зея), а второй известен только из Южного Приморья. M. leporina Tishechkin 1997, в отличие от двух предыдущих видов, живет на ивах секции Viminella и распространен от Забайкалья до Дальнего Востока, т.е. симпатричен с ними. В зоне симпатрии он нередко встречается в одном биотопе с M. ochotonaria или M. arvicolaria, поскольку по берегам рек их кормовые растения могут образовывать смешанные заросли. По морфологическим признакам эти виды неразличимы. Сигналы M. leporina и M. ochotonaria содержат сходные элементы, в то время как сигнал M. arvicolaria принципиально отличается от них по амплитудно-временнóму рисунку.
Можно предположить, что M. leporina и M. ochotonaria сформировались в результате симпатрического видообразования за счет расхождения по разным видам кормовых растений, а M. arvicolaria возник в условиях аллопатрии, отделившись от второго из них или от их общего предка.
Второй комплекс образуют шесть видов, различающихся по окраске, размерам и трофической специализации. Об их родстве свидетельствуют сходное строение аподем II брюшного сегмента и гениталий самцов (некоторые виды по этим признакам вообще неразличимы, рис. 1, 18–26), внутренних створок яйцеклада (у всех видов несут от 7 до 13 мелких дополнительных зубцов, рис. 1, 27–29) и наличие сходных элементов в призывных сигналах (рис. 2, 7–14). В этом комплексе тоже есть как аллопатрические, так и симпатрические формы.
Три вида викарируют друг друга в разных регионах. M. impura (Boheman 1847) распространен в западной части Палеарктики до Казахстана и Средней Азии включительно; питается на Salix repens L. и S. rosmarinifolia L. (подрод Vetrix, секция Incubaceae). Сходный с ним по строению, но отличающийся по окраске и сигналам M. flavida Vilbaste 1980, напротив, населяет восточную часть Палеарктики от Западной Сибири до материковой части Дальнего Востока; характеризуется широкой кормовой специализацией и был отмечен на многих видах ив подрода Vetrix из секций Viminella (S. schwerinii Wolf, S. udensis Trautv. et Mey), Cinerella (S. bebbiana Sarg., S. abscondita Laksch.), Arbuscella (S. rhamnifolia Pall.), Daphnella (S. rorida Laksch.), Helix (S. ledebouriana Trautv. и S. miyabeana Seem.) и Glaucae (S. glauca L.). При этом M. flavida сохраняет определенную избирательность даже в смешанных зарослях нескольких видов ив. Наконец, M. remota Tishechkin 1998 обитает только на Сахалине и отличается от своего материкового соседа M. flavida морфологией внутренних структур, в частности, более узким и вытянутым пенисом (рис. 1, 19–20 и 30–31), и размерами, но издает такие же сигналы (рис. 2, 8 и 9); питается только на S. schwerinii и S. udensis (подрод Vetrix, секция Viminella) (Tishechkin, 2019a).
Кроме того, существуют еще три вида, частично или полностью симпатрические с M. flavida, сходные с ним по строению гениталий, но отличающиеся от него размерами, структурой сигналов и, отчасти, окраской и кормовой специализацией. M. microcera Vilbaste 1980 встречается в европейской России и в Западной и Центральной Сибири (Тыва), однако восточнее не проникает; питается на S. viminalis L. и S. gmelinii Pall. (подрод Vetrix, секция Viminella). M. multa Tishechkin 1997 населяет всю Сибирь и Дальний Восток. В Забайкалье и на Дальнем Востоке питается на S. brachypoda (Trautv. et Mey) Kom. (подрод Vetrix, секция Incubaceae), за пределами ее ареала в Тыве и в Иркутской обл. был найден на ивах секции Arbuscella (также подрод Vetrix). M. daurica Tishechkin 1997 известен только из восточного Забайкалья и Амурской обл., хотя, по всей вероятности, доходит до Южного Приморья; живет на S. triandra nipponica (Franch. et Sav.) A. Skvorts. (подрод Salix, секция Amygdalinae).
История формирования этой группы представляется нам следующим образом. Предковым видом в данном комплексе, по-видимому, следует считать M. flavida или некую очень близкую к нему форму; широкая кормовая специализация, вероятно, способствовала ее разделению на ряд более специализированных видов-олигофагов или монофагов. Сахалинский эндемик M. remota, безусловно, возник в результате аллопатрического видообразования в условиях островной изоляции. M. impura, замещающий M. flavida в западной половине Палеарктики, вероятно, также сформировался в условиях аллопатрии; его обособлению от родительского вида могла способствовать и специализация в питании на двух близких видах четко очерченной секции Incubaceae.
Ситуация с M. microcera допускает разные сценарии: он мог обособиться в сибирской части ареала в условиях симпатрии с M. flavida за счет перехода на S. viminalis и S. gmelinii из секции Viminella, а мог и сформироваться на них в европейской части ареала в условиях аллопатрии. Нам представляется более вероятным первое предположение. Во-первых, потенциальный “родительский” вид M. flavida хотя и может жить на ивах секции Viminella, но именно на S. viminalis и S. gmelinii не обнаружен. Во-вторых, в Западной Сибири M. microcera достаточно обычен, в то время как в европейской части России встречается редко и спорадически, что явно указывает на его “сибирское” происхождение.
Наконец, два последних вида, по-видимому, также возникли в результате симпатрического видообразования за счет перехода на другие кормовые растения, поскольку их ареалы полностью перекрываются с ареалом M. flavida. M. multa, вероятно, изначально специализировался на питании S. brachypoda (секция Incubaceae) и лишь при расселении за пределы ее ареала к западу от Байкала начал переходить на ивы из других секций, растущие в сходных биотопах; напомним, что его западнопалеарктический родственник M. impura тоже “ушел” на ивы секции Incubaceae. M. daurica стал монофагом S. triandra nipponica; ни на каких других видах ив мы его не находили.
Третий комплекс включает два крупных одноцветно-зеленых европейских вида со сравнительно узким, почти не расширенным в середине стволом пениса и большим (7–12) числом мелких дополнительных зубцов на внутренних створках яйцеклада (рис. 1, 32–35). M. viridinervis Wagner 1950 распространен от Западной Европы до Зауралья (Оренбургская обл.) и Северного Кавказа; питается на S. triandra L. (подрод Salix, секция Amygdalinae). Ареал M. verbae Anufriev et Zhiltsova 1982 полностью совпадает с ареалом кормового растения – S. acutifolia Willd. (подрод Vetrix, секция Daphnella) – и включает восточную Европу и северо-запад Казахстана. Он почти целиком лежит в пределах ареала M. viridinervis; последний пока не найден лишь на северо-западе Казахстана, но известен из приграничных районов Оренбургской обл. На аллювиальных наносах по берегам рек S. triandra и S. acutifolia вместе с рядом других видов ив нередко образуют смешанные заросли, поэтому M. viridinervis и M. verbae часто встречаются в одном биотопе. В таких условиях более вероятен сценарий симпатрического видообразования, поэтому мы полагаем, что эти два вида сформировались в условиях симпатрии за счет расхождения по разным кормовым растениям.
К четвертому комплексу относятся пять видов: M. costalis (Matsumura 1911), M. notata (Prohaska 1923), M. regalis Tishechkin 1996, M. murina Tishechkin 1998 и M. perpetua Tishechkin 1996 (рис. 3). Они характеризуются хорошо развитым черным рисунком на голове, переднеспинке и щитке (рис. 3, 1–6, 13–15, 22, 26, 30), наличием выступа на внутренней части аподем II брюшного тергита (рис. 3, 7, 16, 23, 27, 31), коротким широким пенисом (рис. 3, 10–11, 19–20, 24, 28, 32) и 2–4 дополнительными зубцами на внутренних створках яйцеклада (рис. 3, 12, 21, 25, 29, 33).
Рис. 3.
Ивовые виды рода Macropsis из четвертого комплекса. 1–12 – M. notata (1–3 – особи с Дальнего Востока, 4–6 – особи из европейской России); 13–21 – M. costalis; 22–25 – M. regalis; 26–29 – M. perpetua; 30–33 – M. murina. 1–6, 13–15, 22, 26, 30 – внешний вид, 7, 16 – аподемы II брюшного тергита самца, 8–9, 17–18 – аподемы II брюшного стернита самца, 10–11, 19–20, 24, 28, 32 – пенис сбоку, 12, 21, 25, 29, 33 – внутренние створки яйцеклада, 23, 27, 31 – тергальные и стернальные аподемы II брюшного сегмента самца.

M. costalis и M. notata представляют собой сестринские виды. Они отличаются от остальных представителей этого комплекса очень широкими, более или менее треугольными, аподемами II брюшного стернита (рис. 3, 8–9 и 17–18) и издают сигналы со сходным амплитудно-временным рисунком (рис. 4, 1–3 и 4–6). M. costalis населяет Дальний Восток России, включая Сахалин и Южные Курилы, а также Японию; питается на S. schwerinii и, реже, на S. udensis (подрод Vetrix, секция Viminella). M. notata известен из материковой части Дальнего Востока и из Японии, где живет на S. pierotii Miq. (подрод Salix, секция Subalbae), отсутствует в Сибири, но далее при продвижении на запад вновь появляется в Восточном Казахстане откуда доходит до Западной Европы. В этой части своего ареала он, за неимением S. pierotii, питается на S. triandra (подрод Salix, секция Amygdalinae), лишь изредка переходя на S. euxina I.V. Belyaeva (подрод Salix, секция Salix). Исходя из того, что расселение Macropsis в Палеарктике происходило с востока на запад, мы полагаем, что эти два вида возникли на Дальнем Востоке в условиях симпатрии за счет расхождения по разным кормовым растениям, и лишь позднее второй из них расширил свой ареал, проникнув в западную половину Палеарктики.
Рис. 4.
Осциллограммы призывных сигналов самцов рода Macropsis. 1–3 – M. notata; 4–6 – M. costalis; 7–8 – M. asiatica; 9–10 – M. ibragimovi; 11–12 – M. abdullaevi. Фрагменты сигналов, помеченные цифрами “2–3”, “5–6”, “8”, “10” и “12”, представлены на осциллограммах под такими же номерами.
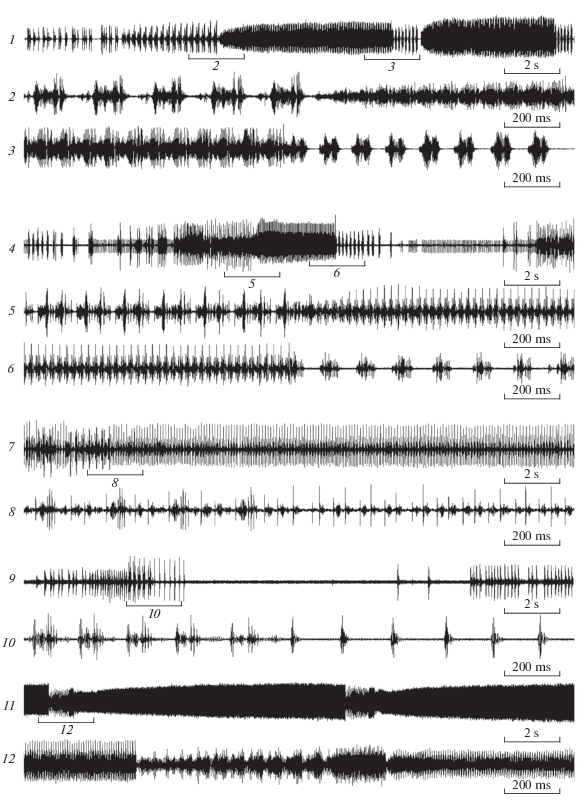
Ареалы M. regalis и M. murina охватывают материковую часть Дальнего Востока России, незначительно заходя в Восточное Забайкалье и в прилежащие районы Монголии. Оба вида питаются на S. schwerinii и нередко встречаются вместе или совместно с M. costalis. M. perpetua обычен в материковой части Дальнего Востока, где живет на S. pierotii совместно с M. notata. Кроме того, он крайне редко и спорадически встречается по всей южной Сибири, так же, как и M. notata, переходя в западной части ареала на S. triandra.
Поскольку эти три вида живут на тех же кормовых растениях, что M. costalis и M. notata, и полностью симпатричны с ними, более вероятным для них представляется сценарий аллопатрического видообразования с последующим расширением ареалов и возникновением вторичной симпатрии.
В пятый комплекс входят M. ocellata Provancher 1872, M. vocalis Tishechkin, 1994 и M. gravesteini Wagner 1953, в норме живущие на S. alba L. (подрод Salix, секция Salix); лишь последний изредка переходит на S. euxina из той же секции. Это одноцветно-зеленые виды, нередко с черным пятном на вершине темени; у M. ocellata в некоторых популяциях также присутствуют светло-желтые особи с темными рисунком на верхней стороне тела (как на рис. 3, 6). Внутренние створки яйцеклада у всех видов с 3–5 дополнительными зубцами (рис. 5, 1, 4, 7), пенис умеренно расширен (рис. 5, 2–3, 5–6, 8–9).
Рис. 5.
Цикадки рода Macropsis. 1–9 – группа 2, ивовые виды из пятого комплекса (1–3 – M. ocellata, 4–6 – M. gravesteini, 7–9 – M. vocalis); 10–18 – группа 2, ивовые виды из шестого комплекса (10–12 – M. iliensis, 13–15 – M. tarbagataica, 16–18 – M. asiatica); 19–26 – группа 3, виды с Ulmus (19–22 – M. illota, 23–26 – M. glandacea), 27–36 – группа 4, виды сo Spiraea (27–31 – M. sibirica, 32–36 – M. brunnescens); 37–39 – группа 5, вид с Rubus (M. fuscula); 40–42 – группа 6, вид с шиповника (M. megerlei); 43–45 – группа 7, вид с облепихи (M. mulsanti); 46–48 – группа 9, вид с Elaeagnus (M. elaeagni). 1, 4, 7, 10, 13, 16 – внутренние створки яйцеклада, 2–3, 5–6, 8–9, 11–12, 14–15, 17–18, 21–22, 25–26, 30–31, 35–36, 39, 42, 45, 48 – пенис сбоку, 19–20, 23–24, 27–28, 32–33 – аподемы II брюшного тергита самца, 29, 34 – стилус, 37, 40, 43, 46 – тергальные и стернальные аподемы II брюшного сегмента самца, 38, 41, 44, 47 – вершина стилуса.
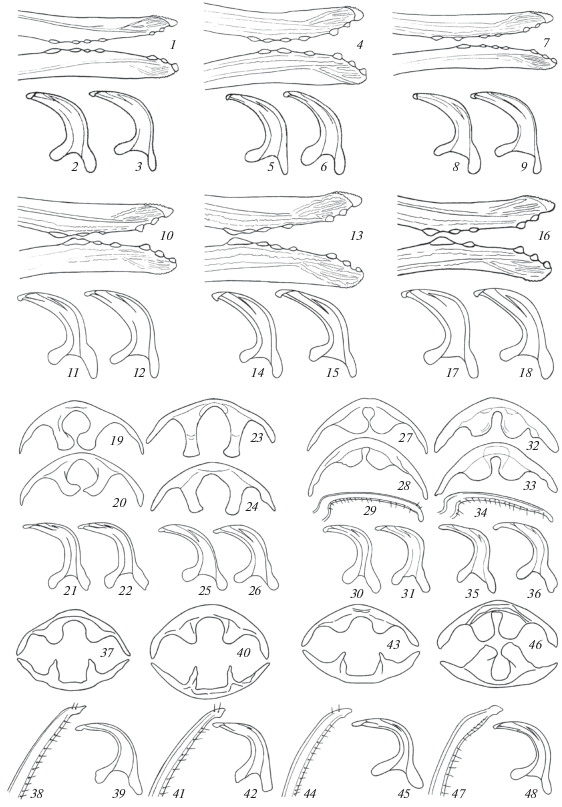
M. ocellata и M. gravesteini распространены по всей Европе и в северной половине Казахстана до широты Балхаша за исключением безводных районов, где ивы не растут; на востоке они заходят даже южнее: по долине р. Лепсы – до северо-восточных предгорий Джунгарского Алатау. При этом в европейской России северная граница распространения M. ocellata проходит севернее Московской обл., в то время как M. gravesteini доходит лишь до севера Саратовской обл. Третий вид – M. vocalis – известен только из предгорий Северного Кавказа от Черноморского побережья до Чечни; в районе Анапы был собран совместно с M. ocellata.
Представить симпатрическое возникновение трех видов, связанных с одним кормовым растением, невозможно; единственным вариантом остается аллопатрическое видообразование с последующим расселением и вторичным перекрыванием ареалов. В числе прочего, расширению ареалов могло способствовать и то, что S. alba представляет собой один из самых обычных видов ив и повсеместно широко культивируется. В настоящее время распространение этих видов, вероятно, ограничивается климатическими факторами, так как они заселяют не весь ареал кормового растения. В частности, M. ocellata проникает на север существенно дальше по сравнению с M. gravesteini, а M. vocalis, будучи теплолюбивым видом, сформировавшимся в Предкавказье, вероятно, не смог выйти за пределы этого региона; данных о его находках в Закавказье тоже пока нет.
Шестой комплекс образуют восемь видов, распространенных в Средней Азии и Казахстане: M. iliensis Mitjaev 1971, M. tarbagataica Mitjaev 1971, M. anufrievi Tishechkin 2015, M. tienschanica Tishechkin 2014, M. milkoi Tishechkin 2015, M. abdullaevi Dubovsky 1966, M. ibragimovi Dubovsky 1966 и M. asiatica Dubovsky 1966. Это в большинстве своем сравнительно мелкие одноцветно-зеленые формы, иногда с более или менее затемненными передними крыльями, особенно у самцов. Внутренние створки яйцеклада с 2–4 дополнительными зубцами (рис. 5, 10, 13, 16), пенис, как правило, широкий с явственным расширением в средней части (рис. 5, 11–12, 14–15, 17–18); большинство видов морфологически различается лишь по форме аподем II брюшного сегмента самцов.
Ареалы M. ibragimovi и M. asiatica перекрываются почти полностью и ограничиваются Западным Тянь-Шанем; второй вид также проникает в южную часть Сырдарьинского Каратау. Чрезвычайно близкий к ним M. abdullaevi встречается не только на Западном Тянь-Шане, но и спорадически – на Внутреннем и Северном Тянь-Шане. Морфологически все три вида крайне схожи; трудноуловимые различия имеются только в форме аподем II брюшного сегмента самцов. M. abdullaevi и M. ibragimovi живут на S. niedzwieckii Goerz и часто встречаются вместе, M. asiatica развивается на S. pycnostachya Anderss. (оба вида относятся к секции Helix подрода Vetrix). Сигналы M. ibragimovi и M. asiatica сильно различаются по продолжительности, но при этом содержат сходные элементы (рис. 4, 7–8 и 9–10), сигнал M. abdullaevi, напротив, не имеет с ними ничего общего (рис. 4, 11–12). Можно предположить, что первые два вида сформировались в условиях симпатрии за счет расхождения по разным кормовым растениям; поскольку при этом они практически перестали вступать в акустический контакт, некоторое сходство сигналов не мешает успешной внутривидовой коммуникации. M. abdullaevi, вероятно, возник на том же кормовом растении, что и M. ibragimovi, в условиях аллопатрии. В ходе последующего расселения эти виды стали симпатрическими; этому способствовали и четкие различия в структуре сигналов, позволившие им существовать совместно.
M. tienschanica, M. milkoi и M. tarbagataica распространены гораздо шире. M. tienschanica известен из Таджикистана, Кыргызстана и Южного Казахстана; собран на S. alba (подрод Salix, секция Salix). M. milkoi имеет сходный, но более широкий ареал, на северо-востоке доходящий до юго-западной оконечности Тарбагатая; питается на S. alba (подрод Salix, секция Salix) и на видах секции Helix (подрод Vetrix). Наконец, M. tarbagataica встречается по всему Казахстану, заходя на северо-западе на Южный Урал (Губерлинские горы), на северо-востоке – в западную Монголию, а на юге – в горы Кыргызстана; он также питается на S. alba и на видах секции Helix. Учитывая почти полное перекрывание ареалов этих видов, можно было бы предположить, что они возникли в условиях симпатрии. Однако сходная кормовая специализация заставляет отказаться от этой гипотезы. По всей видимости, они сформировались в результате аллопатрического видообразования и стали вторично симпатрическими в ходе последующего расширения ареалов. Как и в случае с видами предыдущего комплекса, расселению в немалой степени могло способствовать широкое распространение их кормовых растений: в Казахстане и Средней Азии виды секции Helix являются самыми обычными растениями во всех приречных местообитаниях, а S. alba, как уже говорилось, встречается там повсеместно, в том числе в культуре.
Практически такой же ареал, как M. tarbagataica, имеет питающийся на S. turanica Nasarov (подрод Vetrix, секция Viminella) M. iliensis. В Кыргызстане и Казахстане мы неоднократно собирали его в одной точке с другими видами этого комплекса. Формирование M. iliensis вполне могло происходить в условиях симпатрии за счет перехода на новое кормовое растение, тем более что другие азиатские виды рода Macropsis на ивах секции Viminella не живут; лишь однажды в Губерлинских горах на Южном Урале мы собрали на S. viminalis небольшую серию M. tarbagataica.
Малоизученный M. anufrievi описан нами из Таджикистана (Гиссаро-Дарваз) по коллекционному материалу; его кормовые растения и призывные сигналы неизвестны. Также остаются неясными родственные связи семи видов, не включенных ни в один из вышеперечисленных комплексов, – это европейские M. marginata (Herrich-Schäffer 1836) и M. haupti Wagner 1941, распространенные от Западной Европы до Байкала M. prasina (Boheman 1852) и M. infuscata (J. Sahlberg 1871), дальневосточный M. hinganensis Tishechkin 2004, встречающийся по всей Средней Азии и югу Казахстана, весьма своеобразный M. viridobrunnea Dlabola, 1961 и транспалеарктический M. cerea (Germar 1837). Сформулировать сколько-нибудь убедительную гипотезу о происхождении этих восьми видов мы не можем.
Таким образом, для 18 видов второй группы наиболее вероятным вариантом представляется возникновение в условиях аллопатрии, для 13 видов – в условиях симпатрии; происхождение 8 видов остается неясным.
3. Два вида, живущих на вязах (Ulmus spp., Ulmaceae). Она характеризуется следующей комбинацией признаков: аподемы II брюшного тергита самца удлиненные, обычно с расширенными вершинами (рис. 5, 19–20, 23–24), пенис несколько более узкий, чем у представителей предыдущей группы (рис. 5, 21–22, 25–26).
M. glandacea (Fieber 1868) населяет южную половину Европы, а также завезен в Северную Америку (Hamilton, 1983). M. illota (Horvath 1899) в естественных условиях обитает в Японии, Китае, на Дальнем Востоке России, а также в степях Забайкалья и Монголии, куда проникает вслед за своим кормовым растением Ulmus pumila L. Эти виды представляют собой типичный пример аллопатрического видообразования в результате так называемой неморальной дизъюнкции – разделения некогда единого пояса широколиственных лесов во время плейстоценовых оледенений; случаи такого рода известны во многих группах насекомых, связанных с широколиственными породами.
Эти виды интересны в том отношении, что они стали вторично симпатрическими в результате интродукции второго из них в Западную Палеарктику. В Казахстане, Средней Азии и на юге европейской России U. pumila представляет собой один из наиболее широко культивируемых видов деревьев: его повсеместно выращивают в населенных пунктах, по краям полей и вдоль транспортных магистралей. Вместе с ним в эти районы проник и M. illota; в настоящее время он уже стал обычным в Кыргызстане и Южном Казахстане, а также в Нижнем Поволжье, однако в дикой природе пока не найден. Тем не менее, рано или поздно он начнет проникать за пределы антропогенных ландшафтов. В результате данная пара видов будет производить впечатление возникшей в условиях симпатрии, поскольку M. glandacea, хотя и питается на нескольких видах вязов, на U. pumila не отмечен, в отличие от M. illota. Таким образом, антропогенный фактор, наряду с естественными изменениями ареала, способен вносить искажения в оценку числа видов, сформировавшихся тем или иным образом.
4. Два вида, питающихся на Spiraea spp. (Rosaceae). Отличаются от представителей других групп широкими округлыми, разделенными узкой выемкой аподемами II брюшного тергита самца (рис. 5, 27–28, 32–33) и закругленными лопастевидными вершинами стилусов (рис. 5, 29, 34); по форме пениса они отчасти сходны с представителями предыдущей группы (рис. 5, 30–31, 35–36).
Эти виды также, по всей видимости, возникли в условиях аллопатрии. Ареал M. sibirica Kusnezov 1929 охватывает степную зону от европейской России до Забайкалья, а также равнинные и горные степи Казахстана и Средней Азии. M. brunnescens Vilbaste 1968 распространен по всему югу Дальнего Востока России и в юго-восточном Забайкалье. Таким образом, эти виды практически полностью викарируют друг друга. Незначительное перекрывание их ареалов в Забайкалье представляет собой вполне ординарное явление, поскольку как среди животных, так и среди растений известно немало примеров проникновения маньчжурских видов к западу от Большого Хингана, главным образом, по долинам крупных рек бассейна Амура.
Оставшиеся шесть групп объединяют виды с узким пенисом, постепенно сужающимся к вершине, и с заостренной вершиной стилуса; отросток пигофора простой, шиловидный. Нередко даже виды из разных групп практически неразличимы по строению брюшных аподем и гениталий (рис. 5, 37–48), хотя хорошо различаются по окраске (рис. 6).
Рис. 6.
Цикадки рода Macropsis. 1–3 – группа 5, виды с Urtica и Rubus (1 – M. scutellata, 2 – M. fuscula, самец из Казахстана, 3 – то же, самец с Дальнего Востока); 4–9 – группа 6, виды с шиповника (4 – M. megerlei, 5 – M. idae, самец, 6 – то же, самка, 7 – M. formosa, 8 – M. ornata, 9 – M. bimaculata); 10–12 – группа 7, виды с облепихи (10 – M. mulsanti, 11 – M. pictipes, 12 – M. emeljanovi); 14–22 – группа 8, виды с Berberis integerrima (13–14 – M. berberidis berberidis, 15–16 – M. berberidis arkytica, 17–18 – M. berberidis pallidicephala, 19–20 – M. berberidicola berberidicola, 21–22 – M. berberidicola narynensis); 23 – группа 9, вид с Elaeagnus (M. elaeagni). 1–12, 14, 16, 18, 20, 22–23 – внешний вид, 13, 15, 17, 19, 21 – лицо.

5. Виды с бледно-желтой фоновой окраской и сильно развитым черным или темно-коричневым рисунком, связанные преимущественно с кустарниками рода Rubus (Rosaceae); лишь один вид живет на крапиве (Urtica spp., Urticaceae). На территории России и сопредельных стран – два вида (рис. 6, 1 и 2–3), еще один вид и несколько форм неясного статуса известны из Западной Европы.
M. scutellata (Boheman 1845) распространен по всей Европе, на Кавказе и в Закавказье, а на восток проникает по югу Западной Сибири и Северному Казахстану до Алтая; питается на крапиве. M. fuscula (Zetterstedt 1828) имеет практически такой же ареал, но в Казахстане доходит на юг до предгорий Тянь-Шаня, а также изредка встречается в отрыве от основного ареала на Дальнем Востоке, включая Сахалин и Южные Курилы; питается на кустарниках рода Rubus. Таким образом, ареалы этих видов перекрываются практически полностью, что свидетельствует в пользу гипотезы об их симпатрическом видообразовании. Кроме того, крапива и виды Rubus (малина и ежевики) часто растут вместе по опушкам, полянам, в оврагах, зарослях кустарников и т.п., что облегчает переход с одного кормового растения на другое. Нужно отметить, что случаи перехода на неродственные кормовые растения известны у многих фитофагов; ярким примером могут служить первичное и вторичное кормовые растения у двудомных видов тлей.
6. Виды, связанные с шиповниками (Rosa spp., Rosaceae). Группа включает пять видов, разделяющихся на две подгруппы.
Первую образуют M. megerlei (Fieber 1868), M. idae Emeljanov 1964 и M. formosa Dubovsky 1966. Это виды со светлыми головой, переднеспинкой и щитком и коричневыми надкрыльями (полупрозрачные у самок M. idae); рисунок на голове слабо выражен или отсутствует (рис. 6, 4, 5–6 и 7). Ареал M. megerlei охватывает всю Европу, Закавказье, лесостепные и степные районы Сибири до Байкала, Восточный Казахстан и северную Монголию. M. idae населяет горные системы Казахстана, Кыргызстана и Таджикистана в пределах низкогорий и среднегорий, а также спорадически встречается на равнинах Казахстана, на северо-западе проникая за его пределы на Южный Урал и в Заволжье. M. formosa встречается лишь в кустарниково-степном поясе гор, окружающих Ферганскую долину, только на одном низкорослом виде шиповника, определить который нам не удалось.
Поскольку M. megerlei, в отличие от остальных видов, предпочитает равнинные районы, лишь изредка заходя в низкогорья, можно предположить, что он возник в условиях аллопатрии. Напротив, ареалы M. formosa и M. idae полностью перекрываются; при этом они живут на разных видах шиповника, что согласуется с гипотезой их симпатрического происхождения.
M. ornata Lindberg 1926 и M. bimaculata Korolevskaya 1963 образуют вторую подгруппу; от трех предыдущих видов они отличаются сильно развитым черным рисунком на голове, переднеспинке и щитке (рис. 6, 8–9). Ареал первого вида охватывает низкогорья и среднегорья Тянь-Шаня, Памиро-Алая и Гиссаро-Дарваза. Второй вид мы в природе не изучали, он известен нам только по сборам из нескольких точек на хребтах Гиссаро-Дарваза. Тем не менее, имеющиеся данные о распространении этих видов вполне допускают симпатрический сценарий их формирования.
7. Три вида, связанных с облепихой Hippophae rhamnoides L. (Elaeagnaceae). По особенностям темного рисунка схожи с некоторыми видами из групп 5 и 6 (рис. 6, 10–12) и неотличимы от них по строению аподем и гениталий (рис. 5, 43–45 и 37–42).
M. mulsanti (Fieber 1868) распространен в горных районах Европы в пределах ареала облепихи, на Северном Кавказе и в горах Средней Азии и Казахстана. Ареал M. pictipes (Horvath 1904) включает восточную часть Северного Кавказа, горы Средней Азии и Казахстана, Западную Монголию и юг Центральной Сибири (Тыва). Ареал M. emeljanovi Dubovsky 1966 охватывает горы Средней Азии и Казахстана, Западную Монголию и юг Центральной Сибири (Тыва). Таким образом, ареалы эти видов перекрываются в значительной мере, но не полностью. В Средней Азии и в Казахстане мы находили их в условиях строгой симпатрии, т.е. на одном растении; при этом у всех трех видов самцы были акустически активны. Такую же ситуацию наблюдали в южной Тыве у M. pictipes и M. emeljanovi.
Поскольку эти виды связаны с одним и тем же кормовым растением, мы полагаем, что они сформировались в условиях аллопатрии. Это тем более вероятно еще и потому, что облепиха – растение горное и за счет этого имеет дизъюнктивный ареал. Частичное перекрывание ареалов, по-видимому, произошло позднее в результате расселения этих видов из мест их возникновения. Можно добавить, что в настоящее время M. mulsanti расселяется по европейской России с культивируемой облепихой и уже стал обычным на всех приусадебных участках в Подмосковье; два других вида за пределами естественного ареала пока не найдены.
8. Два среднеазиатских вида, связанных с барбарисом Berberis integerrima Bunge (Berberidaceae): M. berberidis Dubovsky 1966 и M. berberidicola Dubovsky 1966 (рис. 6, 13–22). От видов с узким пенисом и заостренными вершинами стилусов из групп 5–7 отличаются широкими, разделенными узкой выемкой аподемами II брюшного тергита самцов (как у видов из группы 4) и очень длинным яйцекладом, далеко выходящим за конец брюшка (рис. 6, 16, 22). Распространены в аридных низкогорьях и среднегорьях Западного Тянь-Шаня, Памиро-Алая и Гиссаро-Дарваза; M. berberidicola также незначительно заходит во Внутренний Тянь-Шань по бассейну Нарына. Ареалы обоих видов имеют достаточно сложную конфигурацию, однако за несколько лет исследований во многих районах Средней Азии нам ни разу не удалось обнаружить их в одной точке. Ранее мы ошибочно полагали, что они могут отчасти различаться по кормовой специализации: первый предпочитает Berberis oblonga (Regel) Schneid., второй – B. integerrima Bunge (Тишечкин, 2012). Однако в современной ботанической литературе эти названия считаются синонимами (Черепанов, 1995: 218), следовательно оба вида являются монофагами на одном и том же кормовом растении.
В такой ситуации можно допустить лишь один сценарий – возникновение этих видов в условиях аллопатрии, что достаточно типично для горных районов.
9. Два вида, связанных с лохом (Elaeagnaceae, Elaeagnus spp.). По форме пениса и стилусов отчасти сходны с видами из групп 5–8 (рис. 5, 46–48 и 37–45), но отличаются от них стройными пропорциями тела и одноцветной бледно-зеленой окраской без всяких следов темного рисунка (рис. 6, 23).
Естественный ареал M. elaeagni Emeljanov 1964, по-видимому, охватывает Казахстан и Среднюю Азию. В настоящее время его точные границы установить трудно, т.к. вслед за одним из своих кормовых растений – Elaeagnus angustifolia L., широко культивируемым в декоративных целях, этот вид быстро расселяется и на севере уже дошел до Москвы, а на западе – до Германии. M. elaeagnicola Dubovsky 1966 способен питаться на тех же видах Elaeagnus (мы неоднократно собирали оба вида на одном дереве), однако до сих пор найден только в Средней Азии. Таким образом, ареалы этих видов полностью перекрываются.
Так же как и для представителей двух предыдущих групп в этой ситуации возможен только один сценарий – возникновение в условиях аллопатрии с последующим расселением и формированием вторичной симпатрии.
10. Один своеобразный азиатский вид M. scabrosa Korolevskaja 1963, питающийся на пустынных тополях подрода Turanga. По морфологическим признакам он не имеет ничего общего с видами из группы 2 и, по всей видимости, перешел на тополя независимо от них, тем более что последние на подроде Turanga не обнаружены. Хотя по форме пениса M. scabrosa тяготеет к группам 5–9, его происхождение и родственные связи нам неясны.
Примеры внутривидовой дифференциации у видов Macropsis
Выше были рассмотрены примеры завершившегося как симпатрического, так и аллопатрического видообразования. В этом разделе мы рассмотрим случаи незавершившегося видообразования, иными словами, речь пойдет о внутривидовых формах, которые различаются лишь по окраске и/или кормовой специализации, но неразличимы ни по морфологическим признакам, ни по структуре призывных сигналов. Напомним, что эти формы в перспективе вовсе не обязательно должны стать хорошими видами, поскольку такое состояние может оказаться стабильным и процесс дивергенции на этой стадии может остановиться.
Среди них можно выделить три категории: аллопатрические цветовые формы, связанные с одним и тем же кормовым растением, аллопатрические цветовые формы, связанные с разными растениями и, наконец, формы, живущие на разных видах кормовых растений (как симпатрических, так и аллопатрических), но при этом не различающиеся по окраске.
1. Аллопатрические цветовые формы, питающиеся на одном и том же растении в пределах всего ареала. Среди изученных видов Macropsis нам известно два таких примера.
Первый представляют собой два среднеазиатских вида – M. berberidis и M. berberidicola, живущих на барбарисе Berberis integerrima. Один из них распадается на три (рис. 6, 13–18), а другой – на две (рис. 6, 19–22) дискретные аллопатрические цветовые формы, описанные в ранге подвидов (Тишечкин, 2012); за все годы исследований в Средней Азии нам не удалось обнаружить промежуточных вариантов между ними. Вместе с тем оба вида на протяжении своих ареалов сохраняют однородность по строению гениталий и паттерну сигналов.
Второй пример – M. impura, распространенный от Западной Европы до Казахстана и Средней Азии. На территории России и сопредельных стран, за исключением крайнего северо-запада, он развивается на S. rosmarinifolia (подрод Vetrix, секция Incubaceae). Этот вид ивы способен расти в разных экологических условиях: по болотам, сырым лугам и опушкам в центральных районах европейской России, в песчаных степях в Нижнем Поволжье, вдоль ручьев и речек в межгорных котловинах в Средней Азии. Несмотря на это, M. impura всюду следует за своим кормовым растением. В Западной Европе, в центральных районах европейской России, в Казахстане и Средней Азии встречается только коричневая цветовая форма с хорошо развитым черным рисунком (рис. 7, 1–2). В популяциях из песчаных степей Поволжья у большинства самцов в окраске отчетливо заметен зеленоватый оттенок (рис. 7, 3–5), а у самок преобладает зеленая форма (рис. 7, 6–7); коричневые особи окрашены светлее, чем в популяциях из центральной России и составляют лишь небольшой процент. Кроме того, у самок из Нижнего Поволжья черный рисунок, как правило, в той или иной мере редуцирован, а нередко и вовсе отсутствует. По-видимому, подобная степная или близкая к ней форма была описана Длаболой (Dlabola, 1967) из реликтового песчаного биотопа на берегах Дуная в южной Словакии под названием M. impura cencovica Dlabola 1967.
Рис. 7.
Внутривидовые цветовые формы у цикадок рода Macropsis. 1–2 – M. impura из лесных районов европейской России; 3–7 – то же, из степей Нижнего Поволжья; 8–10 – M. hinganensis из Хабаровского края; 11–16 – то же, с Сахалина.

На равнинах европейской части России выявить какие-либо географические барьеры между лесной (коричневой) и степной (зеленой) формами M. impura невозможно. Ареалы питающихся на барбарисе видов и подвидов образуют довольно сложную картину, но никаких географических барьеров, с очевидностью маркирующих их границы, не выявляется. B. integerrima, на котором они развиваются, достаточно обычен по всему Приферганью, а высота хребтов и глубина ущелий в пределах ареала практически любого из подвидов не отличается от таковых на границах между подвидами или даже видами.
2. Аллопатрические цветовые формы, питающиеся на разных видах растений. Нам известно три примера подобного рода.
У обитающего на Дальнем Востоке M. hinganensis набор цветовых форм в изученной материковой популяции существенно меньше, чем на южном Сахалине (рис. 7, 8–10 и 11–16). На материке этот вид был собран на Salix bebbiana Sarg., а на Сахалине – на S. caprea и S. taraikensis Kimura (все три вида ив – из секции Cinerella подрода Vetrix). Чем вызваны такие различия – географической изоляцией или сменой кормовых растений, судить трудно.
Следующие два вида имеют дизъюнктивные ареалы: они распространены в Западной Палеарктике на восток до Алтая, отсутствуют в большей части Сибири и вновь возникают на Дальнем Востоке.
Особи M. notata из дальневосточных популяций отличаются от западнопалеарктических несколько более развитым рисунком из темных пятен на голове, переднеспинке и щитке (рис. 3, 1–2 и 4–5). Кроме того, на Дальнем Востоке встречается цветовая форма с косой черной полосой на передних крыльях (рис. 3, 3), а в большинстве европейских популяций – бледно-желтая цветовая форма с двумя продольными темными полосами на верхней стороне тела (рис. 3, 6). Как уже говорилось выше, на Дальнем Востоке этот вид питается на S. pierotii, а в западной Палеарктике – на S. triandra, лишь изредка переходя на S. euxina. Являются ли различия в окраске этого вида следствием дизъюнкции ареала или разной кормовой специализации в данном случае также неясно, но нужно отметить, что европейские формы с S. triandra и S. euxina по окраске не различаются.
Аналогичная картина наблюдается у M. fuscula. Особи из западной части ареала (рис. 6, 2) отличаются от дальневосточных (рис. 6, 3) более развитым темным рисунком. В Западной Палеарктике этот вид живет на Rubus idaeus L., R. caesius L. и R. nessensis W. Hall., а на Дальнем Востоке – на R. sachalinensis Lévl., который очень близок к R. idaeus и иногда считается его синонимом (Якубов и др., 1996). При этом, как и предыдущий вид, в западнопалеарктических популяциях M. fuscula не образует цветовых форм на разных кормовых растениях.
3. Олигофаги, способные жить на нескольких видах кормовых растений, но не образующие на них разных цветовых вариаций. В роде Macropsis имеется множество таких примеров: из 60 изученных видов по крайней мере 27 были отмечены на двух и более кормовых растениях.
У одних видов расширение кормовой специализации, по-видимому, связано с тем, что при расселении за пределы ареала первичного хозяина они вынуждены были перейти на другие виды растений. В этой ситуации популяции с разных кормовых растений оказываются аллопатрическими или лишь отчасти симпатрическими. Например, M. suspecta, живущий на Дальнем Востоке преимущественно на Populus maximowiczii, переходит в Восточной Сибири на P. suaveolens, в Западной Сибири и на Тарбагатае – на P. laurifolia, а на крайнем западе своего ареала на Джунгарском Алатау – на P. talassica Kom.
Альтернативные растения-хозяева из разный частей ареала, как правило, относятся к одной секции; переход на виды из других секций также возможен, но случаи перехода на растения другого рода у Macropsis нам неизвестны.
Конспецифичность большинства исследованных аллопатрических популяций с разных кормовых растений была проверена при помощи анализа сигналов. Мы не нашли никаких устойчивых различий между сибирскими и дальневосточными популяциями M. suspecta с разных видов тополей, между популяциями M. ochotonaria с S. ledebouriana в Тыве и с S. miyabeana в Забайкалье и в Амурской обл., между популяциями M. perpetua с S. pierotii на Дальнем Востоке и с S. triandra из Иркутской обл., между популяциями M. multa с S. brachypoda на Дальнем Востоке и с ив секции Arbuscella в Восточной Сибири, между популяциями M. marginata и M. haupti с S. purpurea в Нижнем Поволжье и с S. elbursensis в Краснодарском крае и между популяциями M. sibirica со Spiraea hypericifolia L. из степей европейской России и Казахстана и со S. aquilegifolia Pallas из Забайкалья.
Другие виды-олигофаги могут питаться на нескольких симпатрических видах растений, хотя, как правило, отдают предпочтение только одному из них, а на остальных встречаются лишь изредка. В этих случаях разные кормовые растения также чаще принадлежат к одной секции. Например, M. leporina, M. costalis и M. remota, питающиеся на S. schwerinii (секция Viminella подрода Vetrix), иногда переходят на S. udensis из той же секции, а M. gravesteini, обычно встречающийся на S. alba, может жить и на S. euxina (обе – из секции Salix номинативного подрода).
Известны и виды, способные развиваться на растениях из разных секций или подродов. M. validiuscula питается на тополях из секций Aigeiros, но изредка переходит на культивируемые тополя секции Tacamahaca и на гибридные формы. M. prasina, как правило, живет на S. cinerea (секция Cinerella подрода Vetrix), но изредка переходит на виды секции Viminella из того же подрода. В Иркутской обл. мы находили этот вид только на S. viminalis (секция Viminella подрода Vetrix), но никаких отличий от европейской формы с S. cinerea ни по морфологическим признакам, ни по сигналам нам выявить не удалось. M. tarbagataica и M. milkoi питаются на ивах секции Helix (подрод Vetrix) и на S. alba из номинативного подрода; конспецифичность форм с разных растений подтверждена анализом призывных сигналов.
Наиболее широкой кормовой специализацией среди изученных видов обладают M. flavida, M. cerea и M. viridobrunnea. Все они отличаются широким цветовым полиморфизмом, встречаются на ивах из разных секций и даже подродов и явно не принадлежат к числу недавно сформировавшихся, т.к. имеют весьма обширные ареалы. При этом у каждого из этих видов популяции с разных кормовых растений не различаются ни по сигналам, ни по набору цветовых вариаций.
В заключение добавим, что симпатрические внутривидовые формы, связанные с разными кормовыми растениями, т.е. различающиеся по окраске или морфологии кормовые расы, которые можно было бы рассматривать как пример незавершенного симпатрического видообразования, в нашем материале не выявлены.
ОБСУЖДЕНИЕ
Итак, всего нами было рассмотрено 60 видов рода Macropsis из десяти групп. Для 31 из них (51.7%) наиболее вероятной или даже единственно возможной представляется гипотеза об аллопатрическом видообразовании. Для 20 видов (33.3%) гипотеза о симпатрическом видообразовании если и не может быть убедительно обоснована, то, по крайней мере, вполне допустима. Механизм происхождения 9 видов (15%) остался невыясненным. Напомним, что, по мнению ряда авторов, формирование биоразнообразия у специализированных фитофагов и паразитоидов происходит преимущественно за счет симпатрического видообразования (Bush, Butlin, 2004). Однако, несмотря на явную “предрасположенность” изученной нами группы к симпатрическому видообразованию, полученная цифра (33.3%) не столь уж и велика. Тем не менее она значительно превышает оценки, сделанные без учета данных по насекомым-фитофагам и озерным рыбам (9.4%; Bolnick, Fitzpatrick, 2007). Из этого можно заключить, что симпатрическое видообразование в роде Macropsis – явление нередкое, но говорить о его преобладании над аллопатрическим не приходится.
При использовании географического критерия для определения типа видообразования нельзя недооценивать возможность возникновения вторичной симпатрии за счет расселения видов из центра их происхождения.
Мы считаем виды сформировавшимися в результате аллопатрического видообразования, а их симпатрию вторичной, только в случаях, если они живут на одном кормовом растении. Очевидно, что допустить их симпатрическое возникновение за счет смены хозяина в такой ситуации невозможно. В нашем материале насчитывается 18 таких видов (30%). Для симпатрических видов, живущих на разных растениях, мы во всех случаях принимаем гипотезу о симпатрическом видообразовании. Однако вполне вероятно, что среди них тоже есть случаи аллопатрического видообразования с возникновением вторичной симпатрии, но выявить их невозможно. Поэтому в действительности доля видов, возникших в результате симпатрического видообразования, может оказаться еще меньше, чем в наших расчетах.
Говоря о последующем расселении и вторичной симпатрии, нужно учитывать и антропогенный фактор, т.к. в роде Macropsis, как и среди других фитофагов, немало видов, связанных с декоративными деревьями и кустарниками. Поскольку эти растения обычно высаживают не семенами, а саженцами, вероятность интродукции покоящихся стадий (у цикадовых – яиц, отложенных под кору тонких ветвей) с посадочным материалом очень велика. Действительно, некоторые виды, в частности питающиеся на мелколистном вязе, лохе и облепихе, в настоящее время уже завезены далеко за пределы их естественного ареала.
В отличие от вторичной симпатрии, возникновение вторичной аллопатрии требует, помимо расселения на новых территориях, еще и вымирания в пределах изначального ареала. В нашей ситуации такой сценарий представляется слишком сложным и маловероятным, поскольку трудно представить себе причину, вызвавшую вымирание одного из близких видов, но практически не повлиявшую на другой. Поэтому случаи существования близких аллопатрических видов на разных кормовых растениях мы интерпретируем как аллопатрическое видообразование со сменой хозяина. В группе 2 это три очень близких аллопатрических вида с тополей секций Aigeiros и Tacamahaca, а также M. impura и M. flavida из второго комплекса ивовых видов. Такая же картина наблюдается у двух видов, живущих на вязах (группа 3).
Рассмотренные примеры как завершившегося, так и незавершенного видообразования показывают, что даже у специализированных фитофагов дивергенция отнюдь не всегда бывает вызвана переходом на новое кормовое растение. В роде Macropsis немало видов, связанных с одним и тем же растением (виды с лоха, облепихи, близкие виды, живущие на S. alba); их возникновение никак не связано со сменой растений-хозяев. Это относится и к внутривидовым формам, развивающимся на одном растении (лесная и степная формы M. impura и подвиды у среднеазиатских видов с барбариса). Наконец, у двух видов, имеющих дизъюнктивные ареалы и различающихся по набору цветовых форм в западных и восточных популяциях (M. notata и M. fuscula), дифференциация также, скорее всего, связана с географической изоляцией, а не со сменой хозяина, т.к. в западных популяциях каждый из них может питаться на нескольких видах растений, но разных цветовых форм на них не образует. И наоборот, переход на новое кормовое растение вовсе не обязательно приводит к формированию разных кормовых рас и к видообразованию. Как уже говорилось выше, существуют виды, способные развиваться на разных кормовых растениях, но при этом не демонстрирующие внутривидовой дифференциации. Это касается как видов, переходящих с одного растения на другое на протяжении своего ареала, так и видов, питающихся на нескольких видах растений в одной местности.
Географическая изоляция также не всегда приводит к дивергенции. Например, у трех из шести изученных видов Macropsis с Сахалина никаких различий между островными и материковыми популяциями выявлено не было (Tishechkin, 2019a).
Таким образом, даже в пределах одного рода насекомых-фитофагов видообразование может происходить разными путями: в условиях аллопатрии, когда смена кормового растения не обязательна, хотя и возможна, и в условиях симпатрии, при которой именно переход на новое растение является триггером дивергенции. Наконец, в некоторых случаях, несмотря на благоприятствующие условия – переход на новое кормовое растение или географическую изоляцию, внутривидовая дифференциация вообще не выявляется.
Список литературы
Большаков Н.М., 1992. Семейство 43. Salicaceae – ивовые // Флора Сибири. Т. 5. Новосибирск: Наука. С. 8–59.
Валягина-Малютина Е.Т., 2018. Ивы России. Иллюстрированный определитель // Определители по флоре и фауне России. Вып. 12. М.: KMK Scientific Press. 371 с.
Майр Э., 1974. Популяции, виды и эволюция. М.: Мир. 463 с.
Меницкий Ю.Л., 1984. Дубы Азии. Л.: Наука. 315 с.
Недолужко В.А., 1995. Семейство 66. Ивовые – Salicaceae Mirb. // Сосудистые растения Советского Дальнего Востока. Т. 7. С.-Пб.: Наука. С. 145–212.
Скворцов А.К., 1968. Ивы СССР. Систематический и географический обзор. М.: Наука. 262 с.
Скворцов А.К., 1972. Сем. 29. Salicaceae – Ивовые // Определитель растений Средней Азии. Критический конспект флоры. Т. 3. Ташкент: Фан. С. 6–25.
Тишечкин Д.Ю., 2012. Систематика и биология цикадок рода Macropsis (Homoptera, Cicadellidae, Macropsinae), трофически связанных с барбарисом (Berberis spp., Berberidaceae) // Зоологический журнал. Т. 91. № 2. С. 163–174.
Черепанов С.К., 1995. Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). С.-Пб.: Мир и семья – 95. 991 с.
Якубов В.В., Недолужко В.А., Шанцер И.А., Тихомиров В.Н., Румянцев С.Д., 1996. Сем. 82. Розовые – Rosaceae Juss. // Сосудистые растения Советского Дальнего Востока. Т. 8. С.-Пб.: Наука. С. 125–246.
Berlocher S.H., 1999. Host race or species? Allozyme characterization of the ‘flowering dogwood fly’, a member of the Rhagoletis pomonella complex // Heredity. V. 83. P. 652–662.
Berlocher S.H., Feder J.L., 2002. Sympatric speciation in phytophagous insects: moving beyond controversy? // Annual Review of Entomology. V. 47. P. 773–815.
Bernal J.S., Dávila-Flores A.M., Medina R.F., Chen Y.H., Harrison K.E., Berrier K.A., 2019. Did maize domestication and early spread mediate the population genetics of corn leafhopper? // Insect Science. V. 26. № 3. P. 569–586.
Bolnick D.I., Fitzpatrick B.M., 2007. Sympatric speciation: models and empirical evidence // Annual Review of Ecology, Evolution and Systematics. V. 38. P. 459–487.
Bruzzese D.J., Wagner D.L., Harrison T., Jogesh T., Overson R.P., Wickett N.J., Raguso R.A., Skogen K.A., 2019. Phylogeny, host use, and diversification in the moth family Momphidae (Lepidoptera: Gelechioidea) // PLoS ONE. V. 14. № 6: e0207833. P. 1–21.
Bush G.L., Butlin R.K., 2004. Sympatric speciation in insects // Adaptive Speciation. Eds U. Dieckmann, M. Doebeli, J.A.J. Metz, D. Tautz. Cambridge University Press. P. 229–248.
Butlin R.K., 1996. Co-ordination of the sexual signaling system and the genetic basis of differentiation between populations in the brown planthopper, Nilaparvata lugens // Heredity. V. 77. P. 369–377.
Butlin R.K., Galindo J., Grahame J.W., 2008. Sympatric, parapatric or allopatric: the most important way to classify speciation? // Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. V. 363 (1506). P. 2997–3007.
Claridge M.F., 1993. Speciation in insect herbivores – the role of acoustic signals in leafhoppers and planthoppers // Evolutionary Patterns and Processes. Eds D.R. Lees, D. Edwards. Linnean Society Symposium Series. № 14. London: Academic Press. P. 285–297.
Claridge M.F., 2010. Species are real biological entities // Contemporary debates in philosophy of biology. Eds F.J. Ayala, R. Arp. Wiley-Blackwell, West Sussex, UK. P. 91–109.
Claridge M.F., Den Hollander J., Morgan J.C., 1985. The status of weed-associated populations of the brown planthopper Nilaparvata lugens (Stål) – host race or biological species? // Zoological Journal of the Linnean Society. V. 84. P. 77–90.
Claridge M.F., de Vrijer P.W.F., 1994. Reproductive behavior: the role of acoustic signals in species recognition and speciation // Planthoppers. Their ecology and management. Eds R.F. Denno, T.J. Perfect. Boston: Springer. P. 216–233.
Cocroft R.B., Rodrígues R. L., Hunt R.E., 2008. Host shifts, the evolution of communication, and speciation in the Enchenopa binotata species complex of treehoppers // Tilmon K.J. (Ed.) Specialization, Speciation, and Radiation – The Evolutionary Biology of Herbivorous Insects. University of California Press, Berkeley. Ch. 7. P. 88–100.
Dietrich C.H., 1999. The role of grasslands in the diversification of leafhoppers (Homoptera: Cicadellidae): a phylogenetic perspective // Warwick C. (Ed.). Proceedings of the Fifteenth North American Prairie Conference. Natural Areas Association, Bend, OR. P. 44–48.
Dlabola J., 1967. Beschreibungen von neuen südpaläarktischen Zikadenarten (Homoptera, Auchenorrhyncha) // Acta Entomologica Musei Nationalis Pragae. V. 37. P. 31–50.
Drès M., Mallet J., 2002. Host races in plant-feeding insects and their importance in sympatric speciation // Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. V. 357 (1420). P. 471–492.
Drosopoulos S., 1993. Modes of speciation in leafhoppers, planthoppers and froghoppers: a review based on biosystematic data // Proceedings of the 8th Auchenorrhyncha Congress. Eds S. Drosopoulos, P.V. Petrakis, M.F. Claridge, P.W.F. de Vrijer. Delphi, Greece, 9–13 Aug., 1993. P. 106–107.
Feder J.L., Filchak K.E., 1999. It’s about time: the evidence for host plant-mediated selection in the apple maggot fly, Rhagoletis pomonella, and its implications for fitness trade-offs in phytophagous insects // Entomologia Experimentalis et Applicata. V. 91. P. 211–225.
Fitzpatrick B.M., Fordyce J.A., Gavrilets S., 2008. What, if anything, is sympatric speciation? // Journal of Evolutionary Biology. V. 21. № 6. P. 1452–1459.
Forbes A.A., Devine S.N., Hippee A.C., Tvedte E.S., Ward A.K., Widmayer H.A., Wilson C.J., 2017. Revisiting the particular role of host shifts in initiating insect speciation // Evolution. V. 71. № 5. P. 1126–1137.
Futuyma D.J., Mayer G.C., 1980. Non-Allopatric speciation in animals // Systematic Zoology. V. 29. № 3. P. 254–271.
Hamilton K.G.A., 1983. Revision of the Macropsini and Neopsini of the New-World (Rhynchota: Homoptera: Cicadellidae), with notes on intersex morphology // Memoirs of the Entomological Society of Canada. V. 123. P. 1–223.
Hood G.R., Zhang L., Hu E.G., Ott J.R., Egan S.P., 2019. Cascading reproductive isolation: plant phenology drives temporal isolation among populations of a host-specific herbivore // Evolution. V. 73. № 3. P. 554–568.
Jousselin E., Elias M., 2019. Testing host-plant driven speciation in phytophagous insects: a phylogenetic perspective // ArXiv: 1910.09510, Peer-reviewed and recommended by PCI Evolutionary Biology. P. 1–35.
Li H., Dai R.-H., Li Z.-Z., Tishechkin D.Yu., 2013. Taxonomic study of Chinese species of the genus Macropsis Lewis, 1836 (Hemiptera: Cicadellidae: Macropsinae) II: a new subgenus for Macropsis flavovirens Kuoh // Zootaxa. V. 3641. № 1. P. 57–62.
Li H., Tishechkin D.Yu., Dai R.-H., Li Z.-Z., 2014. Taxonomic study of Chinese species of the genus Macropsis Lewis, 1836 (Hemiptera: Cicadellidae: Macropsinae) III: a review of oak-dwelling species // Zootaxa. V. 3760. № 3. P. 351–368.
Tishechkin D.Yu., 1999. Review of the species of the genus Macropsis Lewis, 1834 (Homoptera: Cicadellidae: Macropsinae) from the Russian Far East and adjacent territories of Transbaikalia // Russian Entomological Journal. V. 8. № 2. P. 73–113.
Tishechkin D.Yu., 2002. Review of the species of the genus Macropsis Lewis, 1834 (Homoptera, Cicadellidae, Macropsinae) from European Russia and adjacent territories // Russian Entomological Journal. V. 11. № 2. P. 123–184.
Tishechkin D.Yu., 2010. On the variability of the temporal pattern of vibrational calling signals in leafhoppers (Homoptera: Cicadellidae) // Russian Entomological Journal. V. 19. № 1. P. 31–40.
Tishechkin D.Yu., 2015. Speciation in Macropsinae leafhoppers (Homoptera: Auchenorrhyncha: Cicadellidae) – the role of acoustic signal divergence and host plant shifts // Russian Entomological Journal. V. 24. № 1. P. 7–16.
Tishechkin D.Yu., 2015a. Taxonomic study of Central Asian species of the genus Macropsis Lewis, 1836 (Homoptera: Auchenorrhyncha: Cicadellidae: Macropsinae). III: Descriptions of two new willow-dwelling species, new synonym, annotated check-list, and key to species // Zootaxa. V. 3985. № 1. P. 31–52.
Tishechkin D.Yu., 2016. Host plant shifts and transitions into new adaptive zones in leafhoppers: the example of Macropsinae (Homoptera: Auchenorrhyncha: Cicadellidae) of Russia and adjacent countries // Zootaxa. V. 4121. № 2. P. 117–132.
Tishechkin D.Yu., 2018. On the taxonomic structure and variability of Macropsidius involutus Dlabola, 1963 (Homoptera: Cicadellidae: Macropsinae) – morphology and calling signal pattern // Zootaxa. V. 4455. № 3. P. 486–498.
Tishechkin D.Yu., 2019. Geographical variability of Lepyronia coleoptrata (Linnaeus, 1758) (Hemiptera: Cercopoidea) across Russia // Zootaxa. V. 4543. № 3. P. 401–413.
Tishechkin D.Yu., 2019a. Leafhoppers of the genus Macropsis Lewis, 1836 (Homoptera: Auchenorrhyncha: Cicadellidae: Macropsinae) on Sakhalin – different evolutionary trends in different species // Russian Entomological Journal. V. 28. № 2. P. 107–119.
Tishechkin D.Yu. 2019b. Taxonomic structure and variability of Selenocephalus obsoletus (Germar, 1817) (Auchenorrhyncha: Cicadellidae: Deltocephalinae: Selenocephalini) // Zootaxa. V. 4638. № 1. P. 114–124.
Tishechkin D.Yu., 2019c. Macropsini (Homoptera: Auchenorrhyncha: Cicadellidae: Eurymelinae) from the vicinity of Ambo, Ethiopia // Zootaxa. V. 4664. № 3. P. 365–376.
Walsh B.D., 1864. On phytophagic varieties and phytophagic species // Proceedings of the Entomological Society of Philadelphia. V. 3. P. 403–430.
Winkler I., Scheffer S.J., Lewis M.L., Ottens K.J., Rasmussen A.P., Gomes-Costa G.A., Santillan L.M.H., Condon M.A., Forbes A.A., 2018. Anatomy of a Neotropical insect radiation // BMC Evolutionary Biology. V. 18. № 1. P. 1–13.
Wood T.K., 1980. Divergence in the Enchenopa binotata complex (Homoptera: Membracidae) effected by host plant adaptation // Evolution. V. 34. № 1. P. 147–160.
Wood T.K., Guttman S., 1982. Ecological and behavioral basis for reproductive isolation in the sympatric Enchenopa binotata complex (Homoptera: Membracidae) // Evolution. V. 36. № 2. P. 233–242.
Wood T.K., Keese M., 1990. Host-plant-induced assortative mating in Enchenopa treehoppers // Evolution. V. 44. № 3. P. 619–628.
Wood T.K., Tilmon K.J., Shantz A.B., Harris C.K., Pesek J., 1999. The role of host–plant fidelity in initiating insect race formation // Evolutionary Ecology Research. V. 1. P. 317–332.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


