Зоологический журнал, 2021, T. 100, № 1, стр. 40-56
Морфология органа обоняния анабаса (Anabas testudineus, Anabantidae, Perciformes)
А. О. Касумян a, b, Н. И. Пащенко a, *, Л. Т. К. Оань c
a Биологический факультет Московского государственного университета
имени М.В. Ломоносова
119234 Москва, Россия
b Институт проблем экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Россия
c Российско-Вьетнамский тропический научно-исследовательский
и технологический центр, Приморское отделение
Нячанг, Вьетнам
* E-mail: visitgrusha@gmail.com
Поступила в редакцию 25.12.2019
После доработки 12.01.2020
Принята к публикации 19.02.2020
Аннотация
Методом световой микроскопии исследована макроморфология органа обоняния анабаса (Anabas testudineus). Входное отверстие (передняя ноздря) представляет собой короткую и неширокую направленную вперед трубку. Выходное отверстие (задняя ноздря) у крупных особей (TL > 8–10 см) почти полностью перекрывает кожная складка-клапан, возникающая при длине тела рыб 6.0 см и постепенно увеличивающаяся в размерах. Переднюю часть обонятельной полости занимает обонятельная розетка параллельного типа. Число складок в розетке увеличивается по мере роста рыб, но не превышает 11 (TL 22 см). Обонятельные складки в центре розетки наиболее крупные, их размеры закономерно уменьшаются к ее медиальному и латеральному краям. У рыб, достигших длины TL 6.5 см, на боковой поверхности складок появляются вторичные складки. Отверстия, ведущие в два вентиляционных (акцессорных) мешка – крупный лакримальный и меньший по объему этмоидальный, – расположены в каудальной части обонятельной полости. Предложена схема вентиляции обонятельной полости. Обсуждается возможность использования анабасом обоняния для ориентации и навигации при перемещениях по суше.
Изучение морфологии органа обоняния у рыб, разных по систематике и экологии, представляет значительный интерес для выяснения разнообразия, видовых особенностей и общих закономерностей структурного и функционального развития у них обонятельной системы (Yamamoto, 1982; Zeiske et al., 1992). Анабас, или рыба-ползун (Anabas testudineus) привлекает особое внимание для такого рода исследований благодаря своеобразной биологии – способности временно покидать водоемы и выживать вне воды в течение нескольких часов и даже суток (Das, 1927; Johansen, 1970; Liem, 1987). Анабас – облигатно воздуходышащая рыба. Он извлекает примерно равное количество кислорода за счет жаберного дыхания и газового обмена через поверхность наджаберной полости и хорошо развитого лабиринтового органа (Munshi et al., 1986). При отсутствии в воде кислорода только за счет воздушного дыхания он выживает более длительное время, чем при жаберном дыхании в насыщенной кислородом воде, но без доступа к атмосферному воздуху (Hughes, Singh, 1970). Это происходит за счет того, что у анабаса толщина жаберного эпителия намного больше, а проницаемость газов в несколько раз слабее, чем аналогичные показатели эпителия наджаберной полости и лабиринтового органа (Hughes et al., 1973; Aguilar et al., 2018).
В пределах своего обширного ареала (Индия, Бангладеш, Китай и вся Юго-Восточная Азия) анабас встречается в пресноводных водоемах различного типа, но наиболее обычен в небольших и мелководных заросших водной растительностью реках, ручьях, канавах, каналах, водохранилищах, прудах, рисовых чеках (Das, 1927; Smith, 1945; Rainboth, 1996). Ухудшение кислородных условий, повышение температуры воды и снижение уровня воды, часто наблюдаемые в этих водоемах, особенно в засушливое время года, не побуждают анабаса выходить на сушу в поисках более подходящих для обитания водоемов. Как следует из результатов экспериментов, покидать воду стимулирует недостаток корма и усиливающаяся пищевая конкуренция (Liem, 1987; Павлов и др., 2018). Согласно наблюдениям в природе, выход на сушу происходит в ночные часы и в сезон дождей (Das, 1927; Liem, 1987), хотя упоминается о перемещениях по суше и в сухое время (Smith, 1945). Расстояние, преодолеваемое за один выход, достигает почти 200 м (Pinter, 1986, цит. по: Graham 1997); по другим наблюдениям анабас проходит свыше 90 м сложного маршрута примерно за 30 мин (Smith, 1945). В лабораторном эксперименте максимальная скорость перемещения приближается к 1.8 длины тела в секунду, что для подопытных рыб длиной 14.3 см составляет 25.6 см/с (Davenport, Abdul Matin, 1990). На своем пути рыбы способны двигаться вверх по наклонной поверхности (до 25°–30°) и преодолевать невысокие вертикальные препятствия (Davenport, Abdul Matin, 1990).
Сведения о направленности перемещений анабаса по суше в доступной литературе отыскать не удалось, однако многими авторами упоминается, что воздушное дыхание позволяет этим рыбам выходить из воды и расселяться, переходя из водоема в водоем (Das, 1927; Smith, 1945; Liem, 1987; Davenport, Abdul Matin, 1990; Linke, 1992; Sayer, Davenport, 1991; Rainboth, 1996; Graham, 1997; Sokheng et al., 1999). Ориентируется ли анабас на суше и каким образом это ему удается, неизвестно, хотя по предположениям некоторых авторов анабас способен к хомингу (Smith, 1945) и может находить путь к новым водоемам (Linke, 1992). Поскольку выход на сушу происходит в ночные или предутренние часы, а перемещаться анабас предпочитает по участкам, поросшим травой (Das, 1927; Liem, 1987), то ориентация и навигация по зрительным ориентирам, запоминаемых рыбой, как это происходит, например, у амфибионтного батигобиуса Bathygobius soporator (Aronson, 1971), вряд ли возможна. Другие рыбы, тоже способные долгое время находиться вне воды, ориентируются по солнцу, чтобы двигаться по направлению к водоему, к которому должны вернуться, чтобы не погибнуть (пятноголовый фундулюс (Fundulus notti)), либо определяют верное направление по отраженному от водной поверхности поляризованному свету (обыкновенный фундулюс (Fundulus heteroclitus)) (Goodyear, 1970; Bressman et al., 2016). Однако зрительная ориентация не может рассматриваться в качестве возможной для анабаса, предпочитающего выходить из воды в темное время суток. Ориентация по уклону местности, способность к которой проявляется у некоторых рыб (мраморный ривулус (Kryptolebias marmoratus), гамбузия (Gambusia affinis)) (Boumis et al., 2014; Bressman et al., 2019), тоже представляется мало приемлемой для анабаса, населяющего равнинные водоемы.
Среди дистантных сенсорных систем важную роль в ориентации и навигации у многих водных и наземных животных играет обоняние (Hasler, 1966; Hasler, Scholz, 1983; Grassman, 1993; Cardé, Willis, 2008; Lohmann et al., 2008; Nevitt, 2008; Wyatt, 2014). Амфибионтные животные, такие как лягушки и жабы (Anura), также руководствуются запаховыми сигналами при миграции к родным водоемам (хоминг) для нереста или зимовки и при возвращении к летним участкам обитания (Grubb, 1973, 1973а; Sinsch, 1992; Ogurtsov, 2004). Поэтому использование анабасом обонятельных ориентиров во время сухопутных перемещений к новым водоемам или для возвращения в исходный нельзя исключать.
Существующие данные об обонятельной системе анабаса крайне ограничены. Сообщается, что в органе обоняния у половозрелых рыб имеется до 10 обонятельных складок, располагающихся параллельно друг другу (Datta et al., 1976). На боковой поверхности складок от основания и до гребня обнаружены невысокие вторичные складки, отсутствующие у молодых особей (Rahmani, Khan, 1980, 1981а). В обонятельном эпителии присутствуют основные типы клеток – сенсорные нейроны, мерцательные, опорные и базальные клетки. Слизистые клетки найдены лишь в эпителии вентиляционных (акцессорных) мешков (Rahmani, Khan, 1980, 1981а). Отмечается слабое развитие у анабаса обонятельных долей в переднем мозге (Bersa, 1997, цит. по: Binoy et al., 2015). Сведения о способности анабаса реагировать на обонятельные стимулы отсутствуют. Предполагается, что анабас принадлежит к рыбам-макросматикам, у которых обонятельная система развита слабо и ее роль в жизни невелика (Datta et al., 1976; Rahmani, Khan, 1981). Выявленное у анабаса стремление объединяться в группы, состоящие из знакомых особей своего вида, контролируется зрительной рецепцией, запаховые сигналы (феромоны) на такой выбор рыб влияния не оказывают (Binoy, Thomas, 2006; Binoy et al., 2015).
Целью настоящего исследования было изучение макроморфологии и вентиляции органа обоняния у анабаса Anabas testudineus. В задачи работы входило также проследить за морфологическими изменениями органа обоняния, связанными с ростом рыб.
МАТЕРИАЛ И МЕТОДИКА
Рыбы отловлены в водоемах, расположенных в окрестностях г. Нячанг (провинция Кханьхоа, Вьетнам), часть рыб приобретена живыми на местном рынке. После доставки в лабораторию Приморского отделения Совместного Российско-Вьетнамского тропического научно-исследовательского и технологического центра рыб измеряли и фиксировали в 4% водном растворе формальдегида. Препарирование и исследование морфологии органа обоняния выполнены под бинокулярным микроскопом МБС-1. Измерения морфологических структур сделаны с помощью окулярного микрометра. Вентиляцию органа обоняния изучали на фиксированных препаратах при механической имитации движения челюстей и жаберных крышек, для визуализации токов воды использовали взвесь черной китайской туши. Всего морфологическому исследованию подвергнуты 103 особи с абсолютной длиной тела (TL) 3.8–22.0 см.
РЕЗУЛЬТАТЫ
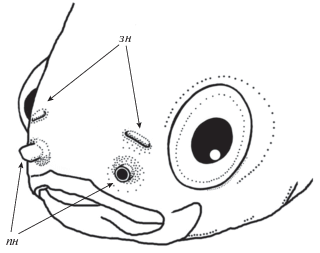
Морфология органа обоняния. Орган обоняния расположен ростральнее и медиальнее глаз (рис. 1). Обонятельная полость открывается наружу передней (входной) и задней (выходной) ноздрями, отстоящими друг от друга. Передняя ноздря находится вблизи верхней челюсти, имеет форму направленной вперед короткой трубки, идущей от центра неглубокой округлой впадины на эпидермальном своде ростральной части обонятельной полости, сформированной у рыб всех исследованных размеров (рис. 2). У самых крупных из исследованных особей, ростральная часть этой впадины заходит под выступающий край верхней челюсти. Трубка в длину достигает 2.1 мм, внешний диаметр составляет 62–86% от ее длины (табл. 1).
Рис. 2.
Передняя ноздря (A–C – вид с латеральной, дорсальной и ростральной сторон) и задняя ноздря (D) у анабаса (Anabas testudineus); вч – верхняя челюсть, к – кожная складка-клапан. Шкала 0.5 мм.
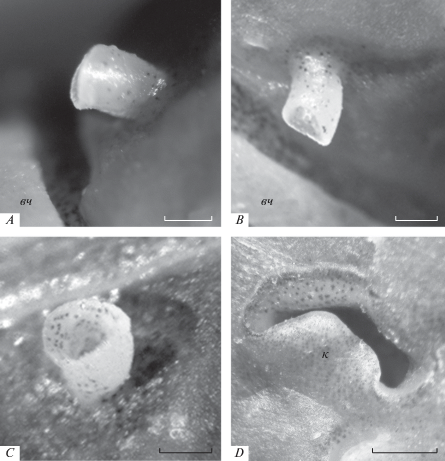
Таблица 1.
Некоторые морфологические параметры (средние значения) у анабаса (Anabas testudineus) разного размера
| TL, мм | No f, шт. | с, мм | o, мм | Lon, мм | Don, мм | Won, мм | Lor, мм | Wor, мм | Loo, мм | Woo, мм | Lvs, мм | Evs, мм | % TL | % o | % Lor | Число рыб |
|||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| o | Won | Lor | Won | Lor | Won | ||||||||||||||
| 38–40 | 6–7 | 13.4 | 4.25 | 0.40 | 0.30 | 0.35 | 0.65 | 1.20 | 1.45 | 1.40 | – | 0.35 | 11.04 | 0.91 | 1.69 | 8.24 | 15.29 | 53.85 | 2 |
| 41–50 | 5–7 | 16.2 | 4.59 | 0.66 | 0.35 | 0.41 | 0.74 | 1.38 | 1.76 | 1.53 | – | 0.41 | 9.77 | 0.87 | 1.58 | 8.93 | 16.12 | 55.41 | 10 |
| 51–60 | 6–8 | 17.7 | 4.75 | 0.68 | 0.42 | 0.49 | 0.75 | 1.53 | 1.89 | 1.66 | 0.43 | 0.45 | 8.48 | 0.88 | 1.34 | 10.32 | 15.79 | 65.33 | 21 |
| 61–70 | 6–9 | 20.4 | 5.04 | 0.81 | 0.49 | 0.57 | 0.83 | 1.69 | 2.16 | 1.81 | 0.56 | 0.50 | 7.78 | 0.88 | 1.28 | 11.32 | 16.47 | 68.68 | 17 |
| 71–80 | 7–8 | 16.1 | 5.20 | 0.80 | 0.50 | 0.75 | 1.20 | 1.55 | 2.25 | 1.65 | – | – | 6.50 | 0.94 | 1.50 | 14.42 | 23.08 | 62.50 | 2 |
| 81–90 | 7–8 | 24.7 | 5.23 | 0.90 | 0.65 | 0.86 | 1.03 | 1.70 | 2.63 | 1.93 | 0.50 | 0.55 | 6.08 | 1.00 | 1.20 | 16.44 | 19.69 | 83.50 | 4 |
| 91–100 | 8–9 | 26.9 | 5.93 | 1.08 | 0.73 | 1.03 | 1.35 | 2.18 | 3.18 | 2.33 | – | 0.70 | 6.18 | 1.07 | 1.41 | 17.37 | 22.77 | 76.30 | 4 |
| 101–110 | 8–9 | 29.5 | 6.38 | 1.02 | 0.80 | 0.97 | 1.34 | 2.70 | 3.06 | 2.80 | 0.67 | 0.82 | 5.97 | 0.91 | 1.26 | 15.20 | 21.00 | 72.39 | 6 |
| 111–120 | 8–10 | 32.2 | 6.69 | 1.14 | 0.92 | 1.03 | 1.33 | 2.65 | 3.43 | 2.76 | 0.80 | 0.86 | 5.69 | 0.88 | 1.13 | 15.40 | 19.88 | 77.44 | 11 |
| 121–130 | 8–10 | 33.1 | 6.84 | 1.19 | 0.91 | 1.13 | 1.43 | 2.81 | 3.58 | 2.88 | 0.78 | 0.86 | 5.38 | 0.89 | 1.12 | 16.52 | 20.91 | 79.02 | 10 |
| 131–140 | 8–10 | 35.5 | 6.77 | 1.19 | 0.95 | 1.07 | 1.35 | 2.83 | 3.53 | 2.94 | 0.65 | 0.97 | 4.99 | 0.79 | 1.00 | 15.80 | 19.94 | 79.26 | 10 |
| 141–150 | 9–10 | 40.3 | 7.50 | 1.33 | 1.00 | 1.23 | 1.60 | 3.30 | 4.17 | 3.40 | 0.40 | 0.90 | 5.04 | 0.83 | 1.08 | 16.40 | 21.33 | 76.88 | 3 |
| 151–160 | 9 | 38.0 | 7.50 | 1.20 | 1.00 | 1.20 | 1.50 | 3.40 | 3.40 | 3.50 | 0.90 | 1.10 | 4.84 | 0.77 | 0.97 | 16.00 | 20.00 | 80.00 | 1 |
| 161–170 | 9 | 43.0 | 7.50 | 1.20 | 1.00 | 1.30 | 2.00 | 3.70 | 4.40 | 3.80 | 0.40 | 0.80 | 4.52 | 0.78 | 1.20 | 17.3 | 26.67 | 65.00 | 1 |
| 191–200 | 11 | 52.0 | 8.50 | 1.60 | 1.50 | 2.50 | 2.00 | 4.60 | 5.50 | 4.80 | – | – | 4.40 | 1.30 | 1.30 | 29.41 | 23.54 | 125.00 | 1 |
| 201–210 | 11 | 59.0 | 10.0 | 2.30 | 1.80 | 2.30 | 2.10 | 5.30 | 6.20 | 5.50 | – | – | 4.55 | 1.05 | 0.95 | 23.00 | 21.00 | 109.52 | 1 |
Примечания. Nof – число обонятельных складок, с – длина головы, o – диаметр глаза, Lon – длина трубки входной ноздри, Don – диаметр просвета входной ноздри, Won – ширина выходной ноздри, Lor – длина обонятельной розетки, Wor – ширина обонятельной розетки, Loo – длина органа обоняния, Woo – ширина органа обоняния, Lvs и Evs – длина входного отверстия лакримального и этмоидального вентиляционных мешков. Прочерк – нет данных.
Задняя ноздря в виде округлого канала проходит сквозь костно-хрящевую перемычку. Снаружи отверстие ноздри окружено невысоким ободком и почти полностью перекрыто эластичной кожной складкой-клапаном. Свободный просвет, ограниченный краями складки и самой ноздри, у крупных особей (TL > 9.5 см) узкий и серповидный (рис. 2).
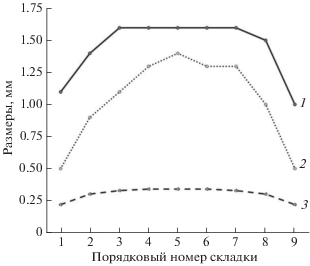
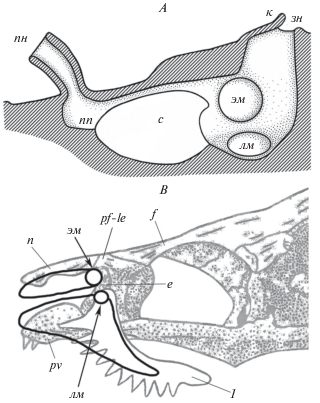
Обонятельная полость эллипсоидная и уплощенная, окружена костной капсулой, сверху в ростральной части перекрыта тонкой эпидермальной крышей, в каудальной части – широкой утолщенной костно-хрящевой перемычкой, состоящей из хрящевого сочленения выростов носовой (nasale) и слезной (lacrimale) костей. На дне в передней части обонятельной полости находится почти симметричная обонятельная розетка параллельного типа, образованная у исследованных особей 5–11 обонятельными складками (рис. 3). Ширина розетки примерно вдвое больше ее длины, она практически полностью заполняет ростральную часть обонятельной полости (табл. 1). Складки располагаются параллельно друг другу и отходят в каудальном направлении от узкой слабоизогнутой поперечной площадки (рис. 3). В центре розетки обонятельные складки наиболее крупные, близкие по длине, их толщина достигает 350–400 мкм, расстояние между складками около 15–20 мкм. К медиальному и латеральному краям розетки размеры складок закономерно уменьшаются (рис. 4). У рыб с TL > 65 мм на крупных складках отчетливо видна продольная вторичная складчатость. Число вторичных складок на боковой поверхности первичной складки достигает 9–11 у наиболее крупных рыб. Гребень складок уплощен, у рыб с TL > 100 мм в его дистальной части имеется небольшой закругленный направленный назад языкообразный вырост, лишенный вторичной складчатости и поэтому меньшей толщины по сравнению с самой складкой.
Рис. 3.
Обонятельная розетка с 7 обонятельными складками (A) и отверстия, ведущие в вентиляционные мешки (B), у анабаса (Anabas testudineus), TL 54 мм; эм и лм – этмоидальный и лакримальный вентиляционные мешки, о – глаз, пп – поперечная площадка, Р/К – ростро-каудальное направление. Шкала 0.5 мм.
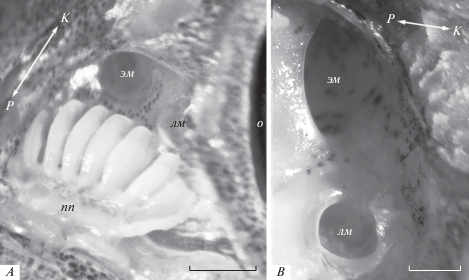
Рис. 4.
Зависимость размеров первичных обонятельных складок от их положения в розетке у анабаса (Anabas testudineus): 1 – длина, 2 – высота, 3 – толщина складки. Порядковые номера складок даны в направлении от латеральной к медиальной стороне розетки. Анализ проведен по 10 особям (TL 12.0–16.6 см), каждая из которых имеет 9 складок в розетке.
На дне обонятельной полости за обонятельной розеткой находятся два близко расположенных отверстия, одно из которых занимает медиальное, другое – латеральное положение и ведут соответственно в полость вентиляционных мешков – лакримального и этмоидального (рис. 3 и 5). Оба отверстия округлые, у крупных особей диаметр отверстия этмоидального мешка больше, чем лакримального отверстия (табл. 1). Диаметр каждого из этих отверстий больше диаметра каждой из ноздрей. Большой лакримальный мешок находится под дном обонятельной полости, сужаясь, он тянется под лакримальной костью в вентральном направлении вдоль глазной впадины (рис. 5). Этмоидальный мешок меньше по объему, он вытянут в ростральном направлении вдоль медиальной стенки обонятельной полости. Этмоидальные мешки правого и левого органов обоняния разделяют этмоидальная кость и хрящевая перегородка. Полости вентиляционных мешков изнутри выстланы прочной и эластичной оболочкой. По нашим ориентировочным оценкам, суммарный объем лакримального и этмоидального мешков значительно превышает объем обонятельной полости.
Рис. 5.
Схема органа обоняния (A) и расположение и размеры вентиляционных мешков относительно костей черепа (B) у анабаса (Anabas testudineus): с – обонятельная складка, e – ethmoidale, n – nasale, f – frontale, l – lacrimale, pf-le – prefrontale-lateral ethmoidale, pv – prevomer. Остальные обозначения – см. рис. 1–3. Рисунок черепа анабаса – по: Liem, 1963.
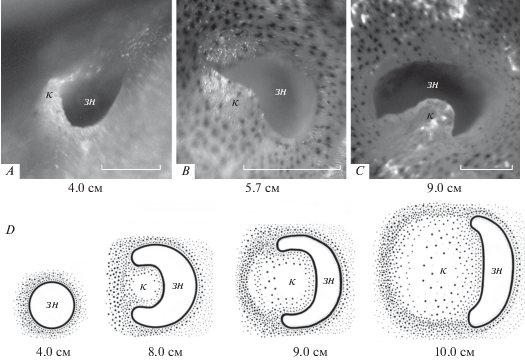
Онтогенетические изменения органа обоняния. Возрастные изменения в морфологии органа обоняния прослежены начиная от особей размером 3.8–4.0 см. У анабаса этого размера все основные структурные элементы орган обоняния уже присутствуют – обонятельная розетка со складками, передняя и задняя ноздри, оба вентиляционных мешка. У молоди, как и у особей всех других размеров, область вокруг входной ноздри имеет вид неглубокой округлой впадины, у наиболее крупных особей (TL > 15 см) ростральный край впадины накрывает рельефно выступающая верхняя челюсть. Задняя ноздря у самых мелких из исследованных особей (TL ≤ 4.0 см) круглая, толщина костно-хрящевой крыши обонятельной полости небольшая. По мере роста рыб толщина крыши увеличивается, а на ростральном крае задней ноздри начинает образовываться складка-клапан. Клапан становится заметным у рыб длиной около 6 см TL, у рыб длиной 8 см клапан выражен хорошо – он тонкий, округлый и частично закрывает отверстие выходной ноздри. С ростом рыб диаметр задней ноздри и размер клапана увеличиваются таким образом, что клапан начинает перекрывать значительную часть ноздри, оставляя свободной узкую полукруглую щель (рис. 6). Расстояние между входной и выходной ноздрями увеличивается.
Рис. 6.
Изменение формы (A–C) и схема формирования кожной складки-клапана (D) в задней ноздре у анабаса (Anabas testudineus) с увеличением длины тела рыбы (TL); обозначения см. на рис. 1 и 2. Шкала 0.5 мм.
Самые мелкие исследованные особи имеют сформированную розетку из 5–7 обонятельных складок с заостренным гребнем (табл. 1). В дальнейшем количество складок медленно увеличивается. Новые складки образуются на латеральном и медиальном краях розетки, они небольшие, имеют почти прямоугольную форму (вид сбоку), на поперечном срезе овальные, без вторичной складчатости. По мере роста рыб складки становятся длиннее и шире, дистальная часть их гребня заостряется, каудальный край постепенно поднимается и приобретает вид небольшого языкообразного выроста (рис. 7). Толщина выроста меньше, чем толщина складки. Складки в центре розетки самые крупные (рис. 4), их гребень уплощен, заостренность каудального выроста выражена слабо. Толщина складок увеличивается с ростом рыб – от 75 мкм у особей < 6 см TL до 600–650 мкм у наиболее крупной из исследованных особей, длиной 22 см TL (табл. 1). Измерения, проведенные у 10 особей, каждая из которых имела длину тела TL 12.0–16.6 см и 9 складок в розетке, показали, что длина, высота и ширина складок в большинстве случаев значимо коррелирует с длиной тела (табл. 2). После достижения анабасом длины 6.5 см (TL) на боковой поверхности центральных складок становятся заметными первые параллельные вторичные складки, ориентированные вдоль ростро-каудальной оси первичной складки.
Рис. 7.
Формирование первичной обонятельной складки и вторичной складчатости у анабаса (Anabas testudineus): A–B – закладка обонятельной складки, вид сбоку и поперечный срез; C–D – обонятельная складка у рыб длиной тела 5 см (TL), вид сбоку и поперечный срез; E–F – обонятельная складка у рыб длиной тела > 13 см (TL), вид сбоку и поперечный срез; вс – вторичная складчатость.
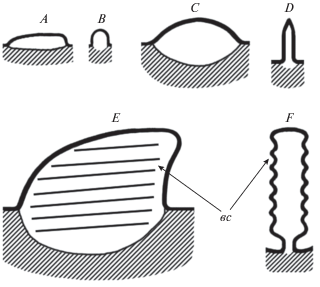
Таблица 2.
Значения коэффициента корреляции Спирмена (rs) между длиной тела рыб и размерами обонятельных складок, имеющих разное расположение в обонятельной розетке, состоящей из 9 складок, у анабаса (Anabas testudineus)
| Параметр складки | Порядковый номер складки | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| Длина | 0.23 | 0.47 | 0.76* | 0.84** | 0.78** | 0.78** | 0.78** | 0.32 | 0.66* |
| Высота | 0.56 | 0.59 | 0.65* | 0.74* | 0.67* | 0.69* | 0.44 | 0.38 | 0.76* |
| Толщина | 0.69* | 0.65* | 0.79** | 0.89*** | 0.91*** | 0.89*** | 0.80** | 0.58 | 0.55 |
У исследованных рыб всех размеров хорошо видны входные отверстия обоих вентиляционных мешков. У мелких особей их диаметр примерно одинаковый, хотя размер этмоидального мешка у молоди значительно меньше, чем лакримального. По мере роста рыбы входное отверстие этмоидального мешка становится крупнее, чем входное отверстие лакримального мешка (табл. 1), при этом этмоидальный мешок остается значительно меньшим по размерам, чем лакримальный у особей всех размеров.
Вентиляция органа обоняния. Имитация дыхательных движений на фиксированных препаратах рыб показала, что раскрытие ротового отверстия вызывает поступление воды в орган обоняния через переднюю ноздрю. Заднюю ноздрю в это время, из-за создающегося отрицательного давления в обонятельной полости, перекрывает клапан. Ток воды внутрь обонятельной полости возникает, по-видимому, из-за изменения объема вентиляционных мешков в результате смещения прилегающих к ним костей черепа и верхней челюсти. Вода попадает в центр лежащей непосредственно под передней ноздрей поперечной площадки, от которой отходят обонятельные складки. Вода проходит между складками и всасывается внутрь расширяющихся вентиляционных мешков. Сдавливание вентиляционных мешков при смыкании ротового отверстия выталкивает воду в обонятельную полость и далее через заднюю ноздрю наружу. Клапан ноздри в этот момент отходит вверх и облегчает выход воды.
ОБСУЖДЕНИЕ
Ноздри. Орган обоняния у анабаса, как и у многих других рыб, относится к дитремному типу, т.е. имеет две ноздри – переднюю входную и заднюю выходную (Døving, 1986). Передняя ноздря представляет собой направленную вперед короткую трубку, что встречается у рыб разных по систематике, но часто сходных по образу жизни. Большинство их предпочитает стоячие и медленно текущие водоемы, прибрежные биотопы с большим числом укрытий, многие из них малоподвижные донные или придонные рыбы. Переднюю ноздрю в виде трубки имеют эволюционно древние Polypteriformes (Cladistia) и Amiiformes и различные Teleostei из семейств Gobiidae, Muraenidae, Mastacembelidae, Cobitidae, Lophiidae, Anguillidae и другие (Liermann, 1933; Шмальгаузен, 1962; Pfeiffer, 1968; Kleerekoper, 1969; Zeiske et al., 1992; Sarkar et al., 2014). Длина трубки передней ноздри у рыб разных таксонов различается, но диаметр этой трубки небольшой, что представляет морфологическую адаптацию, снижающую вероятность попадания в обонятельную полость взвешенных в воде частиц донного грунта. Длинная трубка передней ноздри, например у Polypteriformes и многих Muraenidae, облегчает, по-видимому, локальный обонятельный поиск или позволяет направленно оценивать окружающее запаховое пространство. Возможно, такой способностью обладает и анабас, у которого трубка передней ноздри хорошо выражена (рис. 2).
Наличие в задней ноздре крупного клапана, направленного назад от переднего края обонятельного отверстия, отличает анабаса от других рыб. Складка-клапан в задней ноздре имеется далеко не у всех рыб, она отсутствует, например, у Acipenseriformes, Salmoniformes, Cypriniformes, Esociformes и других. У анабаса клапан может полностью перекрывать ноздрю, что, как и узкая трубка передней ноздри, предохраняет от нежелательного попадания в полость органа обоняния мелких частиц, особенно при зарывании в илистый донный грунт для пережидания засушливого периода года (Das, 1927; Smith, 1945; Mookerjee, Mazumdar, 1946 – цит. по: Datta et al., 1976). Перекрытая клапаном ноздря будет также препятствовать обсыханию обонятельного эпителия при выходе анабаса на сушу. Однако основное назначение клапана, на наш взгляд, связано с вентиляцией обонятельной полости (см. ниже). Аналогичная складка-клапан найдена также у Cyprinodontiformes, но у них, в отличие от анабаса, она отходит от заднего края обонятельного отверстия и направлена вперед (Zeiske, 1974). Складка-клапан обнаружена в щелевидной задней ноздре у радужных рыб Melanotaeniidae (Atheriniformes) (Breucker et al., 1979; Zeiske et al., 1979), у Scombridae (Perciformes) (Gooding, 1963). У относящихся к Sparidae (Perciformes) сарпы Sarpa salpa и сарга Diplodus vulgaris в задней ноздре имеется две складки, обращенные навстречу друг другу (Døving et al., 1977).
Обонятельная полость, розетка и складки. Обонятельная полость у анабаса также имеет свои отличия. Передняя часть полости почти полностью заполнена обонятельной розеткой, тогда как задняя часть свободная, в ней на дне расположены отверстия двух вентиляционных мешков, а вверху – отверстие в короткий канал задней ноздри. Обонятельная розетка параллельного типа с расположением первичных обонятельных складок вдоль длинной оси тела (тип “D” по: Yamamoto, Ueda, 1979). Розеткой такого же типа обладают различные представители Channoidei – сестринского по отношению к Anabantoidei подотряда (Shibuya, 1960; Schulte, Riehl, 1977; Rana et al., 1978; Yamamoto, Ueda, 1978; Mandal et al., 2005; Rüber et al., 2006; Khaparde et al., 2012), но также и систематически далекие южноамериканская аравана (Osteoglossum bicirrhosum (Osteoglossiformes)) (Шмальгаузен, 1962), радужная меланотениа (Melanotaenia (=Nematocentris) maccullochi) и другие виды радужных рыб (Atheriniformes) (Zeiske et al., 1979), угрехвостый сом (Plotosus lineatus (Siluriformes)) (Theisen et al., 1991), морские удильщики (Lophiiformes) (Yamamoto, Ueda, 1978), различные виды камбал (Pleuronectiformes) – рогатая (Pleuronichthys cornutus), морская (Pleuronectes platessa), европейская речная (Platichthys flesus) (Liermann, 1933; Шмальгаузен, 1962; Holl, 1965; Yamomoto, Ueda, 1979). У близкородственных анабасу китайского макропода (Macropodus chinensis) и целующегося гурами (Helostoma temmincki), входящих вместе с анабасом в Anabantoidei, строение розетки похожее, но из-за того, что немногочисленные складки слегка веерообразно расходятся, розетку этих рыб относят к типу “Е” (по: Yamomoto, Ueda, 1979), также как и розетку у длиннорылого панцирника (Lepisosteus osseus (Lepisosteiformes)) (Шмальгаузен, 1962; Rahmani, Khan, 1981). В розетках параллельного и веерообразного типов отсутствует септа – центральная складка, отличающаяся от остальных складок по размеру, форме и клеточному составу эпителия. Однако можно полагать, что рудиментом септы у анабаса является длинная и узкая площадка, от которой отходят первичные обонятельные складки. Справедливость этого предположения может быть проверена, если проследить за формированием обонятельной розетки у ранней молоди анабаса в период, когда возникают первые обонятельные складки.
Еще одна особенность морфологии органа обоняния анабаса – вторичная складчатость на боковой поверхности первичных обонятельных складок. Параллельные вторичные складки у анабаса небольшие по высоте и тянутся вдоль ростро-каудальной оси первичной складки (Rahmani, Khan, 1981а). Разные по размерам и форме вторичные складки обнаружены на первичных обонятельных складках у рыб, принадлежащих к Chondrichthyes, Salmoniformes, Perciformes, Gadiformes и другим группам (Teichmann, 1954; Theisen et al., 1986; Pfeiffer, 1963; Holl, 1965; Bertmar, 1972; Девицина, 1972; Yamamoto, Ueda, 1977, 1979; Cox, 2008; Ghosh, Chakrabarti, 2010, 2014). Интересно, что у китайского макропода и целующегося гурами, относящихся, как и анабас, к Anabantoidea, такие складки отсутствуют (Rahmani, Khan, 1981).
Считается, что вторичная складчатость увеличивает поверхность обонятельного эпителия, в том числе площадь его сенсорной части, и повышает таким образом рецепторную оснащенность органа и потенциальные возможности обонятельной системы в целом (Zeiske et al., 1992; Døving, Kasumyan, 2008). Однако у анабаса в эпителии вторичных складок обонятельные сенсорные нейроны отсутствуют, они сосредоточены в эпителии между вторичными складками (Rahmani, Khan, 1981а). Ростро-каудальная ориентация вторичных складок соответствует направлению основного потока воды, проходящего через обонятельную полость. Поэтому более вероятным выглядит предположение, что невысокие вторичные складки канализируют и облегчают прохождение микропотоков воды в узком пространстве между первичными складками. Вода, текущая по своеобразным каналам, образуемым параллельными вторичными складками, будет постоянно омывать жгутики и микровилли сенсорных нейронов и доставлять к ним запаховые вещества. Прохождению воды по каналам способствуют также мерцательные клетки, которые, как было выяснено, располагаются преимущественно на боковых стенках вторичных складок (Rahmani, Khan, 1980).
Формирование органа обоняния. Развитие органа обоняния прослежено нами у анабасов длиной более 4 см, т.е. примерно с возраста 3–4 мес (Morioka et al., 2009). У молоди этого размера большинство структур в органе уже сформированы – имеются передняя и задняя ноздри, оба вентиляционных мешка, а обонятельных складок уже 5–7, т.е. больше половины от их максимально возможного числа в розетке у анабаса (11) (табл. 1). Это указывает на раннее онтогенетическое развитие органа обоняния у анабаса. По мере роста рыб морфология органа претерпевает дальнейшее развитие, но происходит это развитие относительно медленно и выражается в основном в появлении и росте кожного эластичного клапана в задней ноздре, в увеличении линейных размеров самого органа и всех его структур – длины и диаметра трубки передней ноздри, размеров обонятельной розетки и составляющих ее первичных обонятельных складок, отверстий, ведущих в акцессорные мешки (табл. 1). На боковой поверхности первичных складок у анабаса, достигшего 6.5 см (TL), развивается и становится заметной вторичная складчатость. Появление вторичной складчатости связывают с достижением анабасом половой зрелости, наступающей при длине примерно 8–13 см (Rahmani, Khan, 1981а) или чуть позже (10–15 см) (Smith, 1945). Вторичные складки возникают на центральных первичных складках вначале у основания, а затем по всей их поверхности (Rahmani, Khan, 1981а), хотя в нашей работе мы не нашли подтверждения такой динамике, скорее развитие вторичной складчатости имеет обратное направление – от вершины первичной складки к ее основанию.
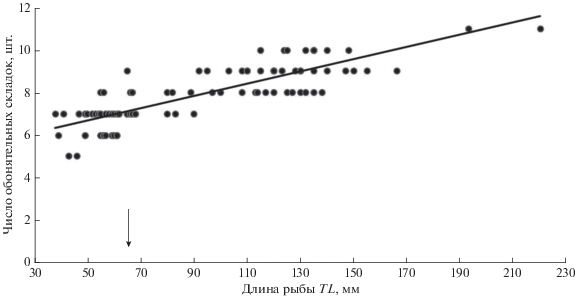
Известно, что в онтогенезе у рыб вторичная складчатость возникает после того, как число первичных складок в розетке становится максимальным и далее с ростом рыб не увеличивается. У ранее исследованных видов это происходит задолго до достижения рыбами половой зрелости (Watling, Hilleman, 1964; Døving, Kasumyan, 2008; Kudo et al., 2009). У видов, не имеющих вторичной складчатости, число первичных складок в розетке нарастает в течение всего соматического роста рыб (Atta, 2013; Пащенко, Касумян, 2017). У анабаса, несмотря на наличие вторичной складчатости, число первичных складок увеличивается постоянно, но эти изменения происходят медленно (рис. 8). Такой вариант онтогенетического развития обонятельной розетки у рыб выявлен впервые. Очевидно, что непрерывное появление у анабаса новых первичных обонятельных складок в розетке и увеличение их размеров (длины и высоты) приводят, как и у других рыб, к увеличению площади обонятельного эпителия и общего числа сенсорных нейронов в нем (Døving, Kasumyan, 2008; Пащенко, Касумян, 2017). Возникновение вторичной складчатости заметным образом не изменяет плавный линейный рост числа первичных складок в розетке по мере увеличения длины рыб (рис. 8). Это подтверждает предположение, что вторичная складчатость у анабаса скорее всего требуется для упорядочения и направления микропотоков воды вдоль зоны, где расположены обонятельные сенсорные нейроны.
Рис. 8.
Зависимость числа первичных складок в обонятельной розетке от длины тела (TL) у анабаса (Anabas testudineus). Стрелкой отмечен размер рыб, при котором на первичных обонятельных складках начинает формироваться вторичная складчатость.
Акцессорные мешки и вентиляция органа обоняния. У анабаса к обонятельной полости примыкают два акцессорных носовых мешка. Такие мешки в соответствии с их основной функцией обычно называют вентиляционными (Zeiske et al., 1992). Они обнаружены у многих видов, чаще всего у медленно плавающих или малоподвижных рыб, хотя в этом правиле имеется много исключений. Несмотря на значительные видовые различия по размерам и числу вентиляционных мешков (Døving, 1986; Zeiske et al., 1992; Webb, 1993; Kasumyan, 2004; Zielinski, Hara, 2007), у многих видов, в том числе и у анабаса, мешки открываются в обонятельную полость в ее каудальной части, т.е. позади обонятельной розетки (Zeiske, 1974; Døving et al., 1977; Rahmani, Khan, 1980; Theisen et al., 1991; Munshi, Hughes, 1992; Webb, 1993; Belanger et al., 2003). Лакримальный мешок по размерам чаще всего превосходит этмоидальный (Nevitt, 1991). У анабаса в выстилающем оба мешка эпителии присутствуют многочисленные слизистые клетки, а в субэпителиальном слое – мышечные (Rahmani, Khan, 1980).
Акцессорные носовые мешки окружены костными элементами черепа и верхней челюсти. Смещения этих костных структур, вызываемые дыхательными движениями, приводят к изменениям механического воздействия на стенки вентиляционных мешков и, как следствие, к сокращению или увеличению их объема (Kapoor, Ojha, 1972; Holl, 1974; Nevitt, 1991). При встрече с запаховым стимулом рыбы могут интенсифицировать поступление воды в обонятельную полость преднамеренно, широко раскрывая и закрывая рот (“зевание”) или совершая резкие движения челюстями и жаберными крышками (“кашель”), что максимально усиливает механическое воздействие на вентиляционные мешки (Nevitt, 1991).
Наши эксперименты показали, что при имитации дыхательных движений у анабаса при раскрытии ротового отверстия происходит поступление воды через переднюю ноздрю в обонятельную полость и при смыкании челюстей – выброс воды через заднюю ноздрю. Разрежение, создаваемое в обонятельной полости при расширении вентиляционных мешков, приводит к опусканию клапана и перекрыванию задней ноздри, что улучшает поступление воды через переднюю ноздрю. При сжатии мешков клапан поднимается и не препятствует выходу воды наружу через заднюю ноздрю. Выход ее через переднюю ноздрю блокируется узкой и достаточно длинной трубкой этой ноздри, а также тем, что передняя часть обонятельной полости заполнена обонятельными складками, тогда как задняя часть полости полностью свободна и не препятствует движению воды. По нашим наблюдениям, у анабаса при обычных (плавных) движениях челюстей вода из органа обоняния через переднюю ноздрю наружу не выходит. Поступление воды внутрь обонятельной полости через переднюю ноздрю и выход ее наружу через заднюю происходит у всех рыб, имеющих орган обоняния дитремного типа, хотя механизмы, обеспечивающие такую направленность движения воды, могут быть разными (Kapoor, Ojha, 1972; Holl, 1974; Døving et al., 1977; Nevitt, 1991).
Таким образом, цикл вентиляции органа обоняния у анабаса выглядит следующим образом. Вода, поступающая в обонятельную полость через переднюю ноздрю, попадает в центр площадки, от которой отходят обонятельные складки, затем проходит между складками по микроканалам, образуемым вторичными складками, и входит в вентиляционные мешки, расширяющиеся при открывании рыбой рта (рис. 9). Закрывание рта и сдавливание мешков вызывают выход из них воды вначале в каудальную половину обонятельной полости, свободную от каких-либо структур, а затем наружу через открывшуюся под напором воды заднюю ноздрю. Строгая направленность потоков воды в обонятельной полости достигается благодаря размерам и расположению ноздрей, наличию клапана, ростральному положению розетки и особой микроструктуре поверхности обонятельных складок, а также благодаря тому, что выходные отверстия крупных акцессорных мешков расположены в каудальной части обонятельной полости. Широкие отверстия акцессорных мешков, несомненно, снижают турбулентность потоков внутри обонятельной полости. Узкая трубка входной ноздри не позволяет проникать в орган обоняния значительных объемов воды при плавании или нахождении анабаса в потоке. Возможно, в интервалах между дыхательными движениями некоторую роль в вентиляции органа могут играть мерцательные клетки обонятельного эпителия. Способ активной (принудительной) вентиляции органа обоняния за счет акцессорных мешков называют циклосматией (Døving et al., 1977).
Рис. 9.
Схема вентиляции обонятельной полости анабаса (Anabas testudineus): A – поступление воды в обонятельную полость, B – выход воды из обонятельной полости наружу; (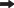 ) – направление основных потоков воды – в обонятельную полость и в вентиляционные
мешки и наружу; (→) – направление микропотоков воды в обонятельной полости; (
) – направление основных потоков воды – в обонятельную полость и в вентиляционные
мешки и наружу; (→) – направление микропотоков воды в обонятельной полости; ( ) и (- -) – расширение и сжатие вентиляционных носовых мешков; остальные обозначения
см. на рис. 1, 3 и 5.
) и (- -) – расширение и сжатие вентиляционных носовых мешков; остальные обозначения
см. на рис. 1, 3 и 5.
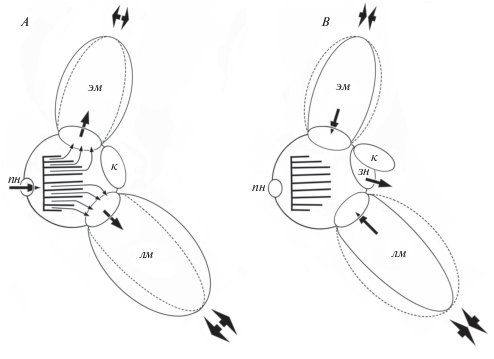
Циклосматия в онтогенезе у анабаса формируется, по-видимому, рано, поскольку оба вентиляционных мешка имеются уже у наиболее мелких из исследованных нами особей (около 4 см TL). Однако у них отсутствует клапан в задней ноздре, а размеры мешков, особенно этмоидального, относительно невелики, что указывает на постепенное онтогенетическое формирование вентиляционного механизма. Завершается этот процесс в возрасте, близком к достижению половозрелости, наступающей у анабаса при длине 10–15 см (Smith, 1945).
Несомненно, что вентиляция обонятельной полости у анабаса происходит не только при движениях челюстей при жаберном (водном) типе дыхания, но и при атмосферном, когда рыба, поднявшись к поверхности воды, захватывает очередную порцию свежего воздуха. Очередная порция воздуха захватывается примерно 1 раз в 1–4 мин и зависит от температуры воды, при стрессе рыб частота жаберных движений становится значительно выше (Das, 1927). Попадает ли в орган обоняния вода или воздух в момент захвата воздуха – остается не выясненным.
Обоняние и ориентация. Анабас относится к облигатно воздуходышащим рыбам, которые погибают от недостатка кислорода при лишении их доступа к атмосферному воздуху (Hughes, Singh, 1970; Graham, 1997). Смена воздуха в наджаберной полости, где располагается лабиринтовый орган, у анабаса, в отличие многих воздуходышащих рыб, даже близкородственных ему других Anabantoidei, например у мраморного гурами (Trichopodus trichopterus), обыкновенного макропода (Macropodus opercularis) и бойцовой рыбки (Betta splendens), имеет не четырех-, а трехфазный цикл. Благодаря такому способу вентиляции, не предусматривающему использование воды для освобождения наджаберной полости от отработанного воздуха и заполнения свежим, анабас и подобные ему рыбы – сомы Clarias, большинство Synbranchiformes и другие, могут пребывать вне воды длительное время и могут не погибать от удушья. Именно это дает им возможность выходить на сушу и преодолевать по ней достаточно большие расстояния (Liem, 1987).
Сведения о поведении анабаса вне воды крайне скудные. Сообщается об агрессии между самцами анабаса, вышедшими на берег, и преследовании ими самок (Das, 1927), что кажется сомнительным. Упоминается также, что анабасы на суше могут питаться (Das, 1927), что более реально, поскольку ведущей причиной выхода анабаса на сушу считают недостаток доступной для них пищи в водоеме и усиление пищевой конкуренции (Liem, 1987). В пищеварительном тракте у анабаса находят различных наземных животных (Bhattacharjee, Chandra, 2016), которые, однако, могли случайно попасть в водоем, а не были схвачены рыбами во время выхода на сушу. Отсутствие у анабаса значимых сезонных колебаний состава потребляемых организмов (Bhattacharjee, Chandra, 2016) и слабая протрузия челюстей (Liem, 1963) также указывают, что питание вне воды, если и происходит, то скорее всего носит случайный характер. Основной побуждающей мотивацией выхода анабаса на сушу следует считать стремление к расселению – поиску и освоению новых водоемов в результате так называемых латеральных миграций.
Трудно представить, что перемещения и другие действия анабаса на суше, совершаемые в темное время суток, являются хаотичными и ненаправленными. Ориентация и навигация необходима хотя бы для того, чтобы вернуться в исходный водоем, если попасть в новый так и не удалось. Зрение в темное время суток, особенно в сезон дождей, для этого не может быть полезным, как и сенсорная система боковой линии для рыб, пребывающих вне воды. Электрорецепция у анабаса не выявлена (Moller, 1995), но даже при ее гипотетическом наличии она, как и боковая линия, оказалась бы бесполезной для рыб, находящихся не в воде, а на воздухе. По этой же причине трудно ожидать, что ориентация анабаса на суше происходит на основе слуховой системы, которая у рыб устроена иначе, чем у наземных позвоночных (Kasumyan, 2005). Использование для навигации магниторецепции, обнаруженной у разных рыб (Hellinger, Hoffmann, 2009), возможно, но скорее не для поиска новых водоемов при расселении, а для направленного возвращения к исходному месту. Некоторые случайные наблюдения дают пока слабые основания для предположения о возможности хоминга у анабаса (Smith, 1945).
Более вероятной при перемещениях анабаса по суше может быть обонятельная ориентация. Известно, что многие амфибионтные животные, такие как жабы, лягушки и тритоны пользуются запаховыми ориентирами при наземных перемещениях и миграциях, а протяженность проходимого ими пути вполне соизмерима с расстояниями, которые анабас способен преодолевать по суше и даже превышает эти расстояния (Grant et al., 1968; Бастаков, 1986; Ogutsov, 2004; Огурцов, 2012). Находясь вне воды, анабас совершает апериодические захваты воздуха для дыхания (личные наблюдения). Эти действия неизбежно сопряжены со смещениями костей черепа, челюстного и жаберного аппаратов, а значит и с изменениями объема вентиляционных мешков и, как следствие, с вентиляцией обонятельной полости – поступлением в нее новых порций воздуха. Из-за высокой влажности и испарений, характерных для сезона дождей в тропиках, воздух, поступающий к обонятельным рецепторам, будет насыщен различными запахами, в том числе и несущими информацию об исходном водоеме и тех водоемах, которые незнакомы для рыб. Известно, что многие вещества, продуцируемые гидробионтами в воду, обладают летучестью и, попадая в воздух, влияют на поведение животных (Suyama et al., 1985; Nevitt et al., 1995; Fink, 2007; Silberbush, Blaustein, 2008; Silberbush et al., 2010).
Движение амфибионтных рыб по суше энергетически более затратное, чем плавание (Sayer, Davenport, 1991). Поэтому частота вентиляции наджаберного органа у перемещающихся по земле анабасов будет выше, чем при нахождении в воде, а значит будет выше частота вентиляции обонятельной полости и поступления в нее запаховых сигналов. Узкая трубка передней ноздри и перекрытая клапаном задняя ноздря изолируют обонятельную полость и препятствуют быстрой потере воды слизью, покрывающей обонятельный эпителий. Слизистые клетки обнаружены у анабаса только в эпителии акцессорных мешков, поэтому они могут выполнять не только вентилирующую функцию, но и обеспечивать присутствие на поверхности обонятельного эпителия слоя слизи, в который погружены жгутики и микровилли сенсорных нейронов. У амфибий обонятельную слизь продуцируют боуменовы железы, которые в филогенезе позвоночных впервые появляются именно у земноводных (Бронштейн, 1977).
Вполне возможно, что в рецепции химических сигналов-ориентиров одновременно с обонянием у анабаса участвует и общее химическое чувство, функция которого у рыб, как у первично водных животных, не ограничивается только защитными реакциями на неспецифические химические раздражители, но и включает восприятие информационных химических сигналов (Silver, Finger, 1984; Peters et al., 1991; Kotrschal et al., 1996). Такое предположение основано на том, что у анабаса в эпителии наджаберного органа имеются структуры, напоминающие одиночные хемосенсорные клетки (Hughes, Munshi, 1973).
ЗАКЛЮЧЕНИЕ
Выполненное нами исследование позволило существенно дополнить представления о структуре органа обоняния и особенностях его развития в онтогенезе у анабаса и высказать предположения о значении обоняния в его жизни. Другие сенсорные системы – зрение, слух, боковая линия, вкусовая рецепция – изучены у анабаса намного слабее (Begum et al., 2013; Binoy et al., 2015). Еще менее исследована роль сенсорных систем в поведении анабаса и его способности получать информацию для коммуникации и миграций, для ориентации и навигации, особенно во время пребывания этих амфибионтных рыб на суше. Существующие сведения о поведении и образе жизни анабаса вне воды ограничены в основном публикациями почти вековой давности (Das, 1927; Smith, 1945), строгие экспериментальные работы в этом и других направлениях остаются эпизодическими (Liem, 1987; Davenport, Abdul Matin, 1990; Binoy, Thomas, 2008; Зворыкин, 2012, 2018; Павлов и др., 2018). Неизвестно, насколько направленны перемещения анабаса по суше, как долго по времени и на какое расстояние он может удаляться от исходного водоема, способен ли действительно проявлять хоминг и насколько этот хоминг точен. При отсутствии данных, полученных с помощью мечения, возможность расселения анабаса за счет проявляемых им вне воды латеральных миграций также остается недоказанной. Получение таких оценок позволит точнее понять биологию этого широко распространенного и многочисленного вида в пресноводных водоемах Юго-Восточной Азии (Зворыкин и др., 2014) и адаптивные возможности тропических рыб в целом. Анабас во многих странах относится к объектам культивирования, хотя общие объемы его выращивания относительно не велики (Lefevre et al., 2014). В некоторых странах анабас включен в список инвазийных видов (Hitchcock, 2008), что придает дополнительное значение и важность новым сведениям о его биологии, поведении, уровне развития сенсорных систем.
Список литературы
Бастаков В.А., 1986. Предпочтение сеголетками прудовой лягушки (комплекс Rana esculenta) запаха грунта своего водоема // Зоологический журнал. Т. 65. С. 1864–1868.
Бронштейн А.А., 1977. Обонятельные рецепторы позвоночных. Л.: Наука. 160 с.
Девицина Г.В., 1972. Морфология органа обоняния тресковых рыб (Gadidae). Вопросы ихтиологии. Т. 12. Вып. 6. С. 1094–1100.
Зворыкин Д.Д., 2012. Размножение и репродуктивное поведение рыбы-ползуна Anabas testudineus (Perciformes, Anabantidae) в аквариуме // Вопросы ихтиологии. Т. 52. С. 469–479.
Зворыкин Д.Д., 2018. Освоение нового корма анабасом Anabas testudineus при одиночном и групповом содержании // Вопросы ихтиологии. Т. 52. С. 469–479.
Зворыкин Д.Д., Динь Тхи Хай Йен, Во Тхи Ха, 2014. Состав и основные особенности ихтиофауны пресных и солоноватых вод региона // Экология внутренних вод Вьетнама. Павлов Д.С. и Зворыкин Д.Д. (ред.). Москва: Товарищество научных изданий КМК. С. 225–240.
Огурцов С.В., 2012. Проблема многофакторности при изучении хемоориентации сеголеток сухопутных видов амфибий // Зоологический журнал. Т. 91. С. 1330–1339.
Павлов Е.Д., Павлов Д.С., Ганжа Е.В., Шарова М.М., Чан Дык Зьен, 2018. Влияние тиомочевины на поведение анабаса Anabas testudineus в потоке воды // Вопросы ихтиологии. Т. 58. С. 584–588.
Пащенко Н.И., Касумян А.О., 2017. Развитие органа обоняния в онтогенезе карповых рыб (Cyprinidae, Teleostei) // Вопросы ихтиологии. Т. 57. Вып. 1. С. 96–111.
Шмальгаузен О.И., 1962. Морфологическое исследование обонятельных органов рыб // Труды Института морфологии животных. Вып. 40. С. 157–187.
Aguilar L., Leite R.N., Ferreira C.A., da Cruz A.L., 2018. The integument of the nonamphibious goby Gobionellus oceanicus: its functional morphology and respiratory capacity // Journal of Morphology. V. 279. P. 1548–1558.
Aronson L.R., 1971. Further studies on orientation and jumping behavior in the gobiid fish, Bathygobius soporator. Annals of the New York Academy of Sciences. V. 188. P. 378–392.
Atta K.I., 2013. Morphological, anatomical and histological studies on the olfactory organs and eyes of teleost fish: Anguilla anguilla in relation to its feeding habits // The Journal of Basic and Applied Zoology. V. 66. P. 101–108.
Begum A., Goswami U.C., Dey S., 2013. Ultramicroscopic structure of the lens of Anabas testudineus and its significance // Clarion. V. 2. P. 52–55.
Belanger R.M., Smith C.M., Corkum L.D., Zielinski B.S., 2003. Morphology and histochemistry of the peripheral olfactory organ in the round goby, Neogobius melanostomus (Teleostei: Gobiidae) // Journal of Morphology. V. 257. P. 62–71.
Bertmar G., 1972. Secondary foldings of the olfactory organ in young and adult sea trout. Acta Zoologica. V. 53. 113–120.
Bhattacharjee I., Chandra G., 2016. Food and feeding habits of three air-breathing fish in its natural habitat // International Journal of Fisheries and Aquatic Studies. V. 4. P. 586–589.
Binoy V.V., Kasturirangan R., Sinha A., 2015. Sensory cues employed for the acquisition of familiarity-dependent recognition of a shoal of conspecifics by climbing perch (Anabas testudineus Bloch) // Journal of Biosciences. V. 40. P. 225–232.
Binoy V.V., Thomas K.J., 2006. The climbing perch (Anabas testudineus Bloch) recognize members of a familiar shoal // Current Science. V. 90. P. 288–289.
Binoy V.V., Thomas K.J., 2008. The influence of hunger on food-stocking behaviour of climbing perch Anabas testudineus // Journal of Fish Biology. V. 73. P. 1053–1057.
Boumis R.J., Ferry L.A., Pace C.M., Gibb A.C., 2014. Heads or tails: do stranded fish (mosquitofish, Gambusia affinis) know where they are on a slope and how to return to the water? // PLoS ONE. 9(8), e104569.
Bressman N.R., Farina S.C., Gibb A.C., 2016. Look before you leap: visual navigation and terrestrial locomotion of the Intertidal killifish Fundulus heteroclitus // Journal of Experimental Zoology. V. 325A. P. 57–64.
Bressman N.R., Simms M., Perlman B.M., Ashley-Ross M., 2019. Where do fish go when stranded on land? Terrestrial orientation of the mangrove rivulus Kryptolebias marmoratus // Journal of Fish Biology. V. 95. P. 335–344.
Breucker H., Zeiske E., Melinkat R., 1979. Development of the olfactory organ in the rainbow fish Nematocentris maccullochi (Atheriniformes, Melanotaeniidae) // Cell and Tissue Research. V. 200. № 1. P. 53–68.
Cardé R.T., Willis M.A., 2008. Navigational strategies used by insects to find distant, wind-borne sources of odor // Journal of Chemical Ecology. V. 34. P. 854–866.
Cox J.P.L., 2008. Hydrodynamic aspects of fish olfaction // Journal of the Royal Society Interface. V. 5. P. 575–593.
Das B.K., 1927. The bionomics of certain air-breathing fishes of India, together with an account of the development of their air-breathing organs // Philosophical Transactions of the Royal Society B. V. 216. P. 183–219.
Datta N.C., Saha A.K., Das A., 1976. Investigation on the morphology of the olfactory apparatus of Anabas testudineus (Bloch) // Journal of the Inland Fisheries Society of India. V. 8. P. 13–18.
Davenport J., Abdul Matin A.K.M., 1990. Terrestrial locomotion in the climbing perch, Anabas testudineus (Bloch) (Anabantidea, Pisces) // Journal of Fish Biology. V. 37. P. 175–184.
Døving K.B., 1986. Functional properties of the fish olfactory system // Progress in sensory physiology. V. 6. (ed. D. Ottoson). Berlin: Springer-Verlag. P. 39–104.
Døving K.B., Dubois-Dauphin M., Holley A., Jourdan F., 1977. Functional anatomy of the olfactory organ of fish and the ciliary mechanism of water transport // Acta Zoologica. V. 58. P. 245–255.
Døving K.B., Kasumyan A.O., 2008. Chemoreception // Fish larval physiology. Eds Finn R.N., Kapoor B.G. Enfield. Sci. Publ. P. 331–394.
Fink P., 2007. Ecological functions of volatile organic compounds in aquatic systems // Marine and Freshwater Behaviour and Physiology. V. 40. P. 155–168.
Ghosh S.K., Chakrabarti P., 2010. Cellular organisation and functions of the olfactory epithelium of pearl spot Etroplus suratensis (Bloch): a light and scanning electron microscopic study // Folia Morphologica. V. 69. № 3. P. 154–159.
Ghosh S.K., Chakrabarti P., 2014. Histophysiological studies on the olfactory epithelium of banded pearl spot Etroplus suratensis (Bloch, 1790) // Journal of Entomology and Zoology Studies. V. 2. № 1. P. 78–82.
Gooding R.M., 1963. The olfactory organ of the skipjack, Katsuwonus pelamis // FAO Fisheries Reports. № 3. P. 1621–1631.
Goodyear C.P., 1970. Terrestrial and aquatic orientation in the starhead topminnow, Fundulus notti // Science. V. 168. P. 603–605.
Graham J.B., 1997. Air-breathing fishes: evolution, diversity, and adaptation. San Diego, CA: Academic Press. 299 p.
Grant D., Anderson O., Twitty V., 1968. Homing orientation by olfactory in newts (Taricha rivularis) // Science. V. 160. № 3834. P. 1354–1355.
Grassman M., 1993. Chemosensory orientation behaviour in juvenile sea turtles // Brain, Behavior and Evolution. V. 41. P. 224–228.
Grubb J.C., 1973. Olfactory orientation in the breeding Mexican toad, Bufo valliceps // Copeia. № 3. P. 490–497.
Grubb J.C., 1973a. Olfactory orientation in Bufo woodhousei fowleri, Pseudacris clarki and Pseudacris streckeri // Animal Behaviour. V. 21. P. 726–732.
Hasler A.D., 1966. Underwater guideposts. Madison: University of Wisconsin Press. 155 p.
Hasler A.D., Scholz A.T., 1983. Olfactory imprinting and homing in salmon. New York: Springer Verlag. 138 p.
Hellinger J., Hoffmann K.-P., 2009. Magnetic field perception in the rainbow trout, Oncorhynchus mykiss // Journal of Comparative Physiology A. V. 195. P. 873–879.
Hitchcock G., 2008. Climbing perch (Anabas testudineus) (Perciformes: Anabantidae) on Saibai Island, northwest Torres Strait: first Australian record of this exotic pest fish // Memoirs of the Queensland Museum. V. 52. P. 207–211.
Holl A., 1965. Vergleichende morphologische and histologische Untersuchungen am Geruchsorgan der Knochenfische // Zeitschrift für Morphologie und Ökologie der Tiere. V. 54. P. 707–782.
Holl A., 1974. Active, rhytmische Ventilation des Geruchsorgan bei Starchelaalen (Mastacembelidae) // Zeitschrift für Naturfoschung. V. 29. C. 787–789.
Hughes G.M., Dube S.C., Munshi J.S.D., 1973. Surface area of the respiratory organs of the climbing perch, Anabas testudineus (Pisces, Anabantidae) // Journal of Zoology (London). V. 170. P. 227–243.
Hughes G.M., Munshi J.S.D., 1973. Fine structure of the respiratory organs of the climbing perch, Anabas testudineus (Pisces: Anabantidae) // Journal of Zoology (London). V. 170. P. 201–225.
Hughes G.M., Singh B.N., 1970. Respiration in an air-breathing fish, the climbing perch Anabas testudineus Blach. I. Oxygen uptake and carbon dioxide release into air and water // Journal of Experimental Biology. V. 53. P. 265–280.
Johansen K., 1970. Air breathing in fishes // In Hoar W.S. and Randell D.J., eds Fish Physiology, IV. New York, London: Academic Press. P. 361–411.
Kapoor A.S., Ojha P.P., 1972. Studies on ventilation of the olfactory chambers of fishes with a critical reevaluation of the role of the accessory nasal sacs // Archives de Biologie. V. 83. P. 167–178.
Kasumyan A.O., 2004. The olfactory system in fish: structure, function, and role in behavior // Journal of Ichthyology. V. 44. № 2. P. 180–223.
Kasumyan A.O., 2005. Structure and function of auditory system in fish // Journal of Ichthyology. V. 45. Suppl. 2. P. S223–S270.
Khaparde K.P., Baile V.V., Masram S.C., Sonarghare P.C., Sonparote U.R., 2012. Functional significance of olfactory cells of a snakehead Ophiocephalus striatus (Bloch) // Bionano Frontier. V. 5. № (2 – I). P. 145–148.
Kleerekoper H., 1969. Olfaction in fishes. Bloomington: Indiana University Press. 222 p.
Kotrschal K., Peters R.C., Døving K.B., 1996. Chemosensory and tactile nerve responses from the anterior dorsal fin of a rockling, Gaidropsarus vulgaris (Gadidae, Teleostei) // Primary Sensory Neuron. V. 1. № 4. P. 297–309.
Kudo H., Shinto M., Sakurai Y., Kaeriyama M., 2009. Morphometry of olfactory lamellae and olfactory receptor neurons during the life history of chum salmon (Oncorhynchus keta) // Chemical Senses. V. 34. P. 617–624.
Lefevre S., Wang T., Jensen A., Cong N.V., Huong D.T.T. et al., 2014. Air-breathing fishes in aquaculture. What can we learn from physiology? // Journal of Fish Biology. V. 84. P. 705–731.
Liem K.F., 1963. The comparative osteology and phylogeny of the Anabantoidei (Teleostei, Pisces) // Illinois Biology Monographs. № 30. P. 1–149.
Liem K.F., 1987. Functional design of the air ventilation apparatus and overland excursions by teleosts // Fieldiana, Zoology, new series. V. 37. P. 1–29.
Liermann K., 1933. Über den Bau des Geruchsorgans der Teleostier // Zietschrift für Anatpmie und Entwicklungsgeschichte. Bd. 100. P. 1–39.
Linke H., 1992. Labyrinth fish: the bubble nest builders, their identification, care and breeding. Melle: Tetra Press. 174 p.
Lohmann K.J., Lohmann C.M.F., Endres C.S., 2008. The sensory ecology of ocean navigation // Journal of Experimental Biology. V. 211. P. 1719–1728.
Mandal D.K., Roy D., Ghosh L., 2005. Structural organization of the olfactory epithelium of a spotted snakehead fish, Channa punctatus // Acta Ichthyologica et Piscatoria. V. 35. № 1. P. 45–50.
Moller P. (ed.), 1995. Electric fishes: history and behavior. London: Chapman & Hall. 584 p.
Morioka S., Ito S., Kitamura S., Vongvichith B., 2009. Growth and morphological development of laboratory-reared larval and juvenile climbing perch Anabas testudineus // Ichthyological Research. V. 56. P. 162–171.
Munshi J.S.D., Hughes G.M., 1992. Air breathing Fishes of India. Their structure, unction and Life History. Oxford & IBH. New Delhi. 338 p.
Munshi J.S.D., Olson K.R., Ojha J., Ghosh T.K., 1986. Morphology and vascular anatomy of the accessory respiratory organs of the air-breathing climbing perch, Anabas testudineus (Bloch) // American Journal of Anatomy. V. 176. P. 321–331.
Nevitt G.A., 1991. Do fish sniff? A new mechanism of olfactory sampling in pleuronectid flounders // Journal of Experimental Biology. V. 157. P. 1–18.
Nevitt G.A., 2008. Sensory ecology on the high seas: the odor world of the procellariiform seabirds // Journal of Experimental Biology. V. 211. P. 1706–1713.
Nevitt G.A., Veit R.R., Kareiva P., 1995. Dimethyl sulphide as a foraging cue for Antarctic procellariiform seabirds // Nature. V. 376. P. 681–682.
Ogurtsov S.V., 2004. Olfactory orientation in anuran amphibians // Russian Journal of Herpetology. V. 11. № 1. P. 35–40.
Peters R.C, Kotrschal K., Krautgartner W.D., 1991. Solitary chemoreceptor cells of Ciliata muslela (Gadidae, Teleostei) are tuned to mucoid stimuli // Chemical Senses. V. 16. P. 31–42.
Pfeiffer W., 1963. The morphology of the olfactory organ of the Pacific salmon // Canadian Journal of Zoology. V. 41. P. 1233–1236.
Pfeiffer W., 1968. Das Geruchsorgan der Polypteridae (Pisces, Brachiopterygii) // Zeitschrift für Morphologie der Tiere. V. 63. P. 75–110.
Rahmani A.R., Khan S.M., 1980. Histology of the olfactory epithelium and the accessory nasal sacs of an anabantoid fish, Anabas testudineus (Bloch) // Archives de Biologie. V. 91. P. 397–411.
Rahmani A.R., Khan S.M., 1981. The olfactory organ in a few Indian teleosts // Current Science. V. 50. № 7. P. 329–331.
Rahmani A.R., Khan S.M., 1981a. Development of the secondary lamellae in the olfactory epithelium of Anahas testudineus // Japanese Journal of Ichthyology. V. 28. № 2. P. 177–180.
Rainboth W.J., 1996. Fishes of the Cambodian Mekong. FAO species identification field guide for fishery purposes. FAO, Rome. 265 p.
Rana A.K., Ojha J., Munshi J.S.D., 1978. Morphometrics of the olfactory rosette in relation to body weight in a fresh water murrel Channa punctatus (Bloch) // Archives de Biologie. V. 89. P. 403–417.
Rüber L., Britz R., Zardoya R., 2006. Molecular phylogenetics and evolutionary diversification of Labyrinth fishes (Perciformes: Anabantoidei) // Systematic Biology. V. 55. № 3. P. 374–397.
Sarkar S.K., Acharya A., Jana S., De S.K., 2014. Macro-anatomical variation of the olfactory apparatus in some Indian teleosts with special reference to their ecological habitat // Folia Morphologica. V. 73. № 2. P. 122–128.
Sayer M.D.J., Davenport J., 1991. Amphibious fish: why do they leave water? // Reviews in Fish Biology and Fisheries. V. 1. № 2. P. 159–181.
Schulte E., Riehl R., 1977. Electron microscopical studies of olfactory organ of Ophiocephalus (Channa) obscurus Guenther, 1861 (Teleostei, Ophiocephalidae) // Journal of Biosciences. V. 32. № 3–4. P. 307–308.
Shibuya T., 1960. The electrical responses of the olfactory epithelium of some fishes // Japanese Journal of Physiology. V. 10. № 3. P. 317–326.
Silberbush A., Blaustein L., 2008. Oviposition habitat selection by a mosquito in response to a predator: are predator-released kairomones air-borne cues? // Journal of Vector Ecology. V. 33. P. 208–211.
Silberbush A., Markman S., Lewinsohn E., Bar E., Cohen J.E., Blaustein L., 2010. Predator-released hydrocarbons repel oviposition by a mosquito // Ecology Letters. V. 13. P. 1129–1138.
Silver W.L., Finger T.E., 1984. Electrophysiological examination of a non-olfactory, non-gustatory chemosense in the searobin, Prionotus carolinus // Journal of Comparative Physiology A. V. 154. P. 167–174.
Sinsch U., 1992. Amphibians // Animal Homing, F. Papi (ed.). London: Chapman & Hall. P. 213–233.
Smith H.M., 1945. The fresh-water fishes of Siam, or Thailand // Bulletin of the United States National Museum. V. 188. P. 1–622.
Sokheng C., Chhea C.K., Viravong S., Bouakhamvongsa K., Suntornratana U. et al., 1999. Fish migrations and spawning habits in the Mekong mainstream: a survey using local knowledge (basin-wide) // Assessment of Mekong fisheries: fish migrations and spawning and the impact of water management project (AMFC). AMFP Report. V. 2. № 99. Vientiane. Lao P.D.R. P. 1–149.
Suyama M., Hirano S., Yamazaki S., 1985. Odor of ayu and its volatile components // Bulletin of the Japanese Society for the Science of Fish. V. 51. P. 287–294.
Teichmann H., 1954. Vergleichende Untersuchungen an der Fische // Zeitschrift für Morphologie und Ökologie der Tiere. V. 43. P. 171–212.
Theisen B., Zeiske E., Breucker H., 1986 Functional morphology of the olfactory organs in the spiny dogfish (Squalus acanthias L.) and the small-spotted catshark (Scyliorhinus canicula L.) // Acta Zoologica. V. 67. P. 73–86.
Theisen B., Zeiske E., Silver W.I., Marui T., Caprio J., 1991. Morphological and physiological studies on the olfactory organ of the striped eel catfish, Plotosus lineatus // Marine Biology. V. 110. P. 127–135.
Watling H., Hilleman H.H., 1964. The development of the olfactory apparatus of the grayling (Thymallus arcticus) // J. Fish. Res. Board Can. V. 21. P. 373–396.
Webb J.F., 1993. The accessory nasal sacs of flatfishes: systematic significance and functional implications // Bulletin of Marine Science. V. 52. P. 541–553.
Wyatt T.D., 2014. Pheromones and animal behavior: chemical signals and signatures. 2 ed. Cambridge: Cambridge University Press. 420 p.
Yamamoto M., 1982. Comparative morphology of fish olfactory organ in teleosts // Chemoreception in fishes. T.J. Hara (ed.). Amsterdam: Elsevier. P. 39–59.
Yamamoto M., Ueda K., 1977. Comparative morphology of fish olfactory epithelium. I. Salmoniformes // Bulletin of the Japanese Society for the Science of Fish. V. 43. P. 1163–1174.
Yamamoto M., Ueda K., 1978. Comparative morphology of fish olfactory epithelium. V. Gasterosteiformes, Channiformes and Synbranchiformes // Bulletin of the Japanese Society for the Science of Fish. V. 44. № 12. P. 1309–1314.
Yamamoto M., Ueda K., 1979. Comparative morphology of fish olfactory epithelium. X. Perciformes, Beryciformes, Scorpaeniformes, and Pleuronectiformes // Journal of the Faculty of Science. (University of Tokyo). V. 14. P. 273–297.
Zeiske E., 1974. Morphologische und morphometrische Untersuchungen am Geruchsorgan oviparer Zahnkarpfen (Pisces) // Zeitschrift für Morphologie der Tiere. Bd. 77. S. 19–50.
Zeiske E., Breucker H., Melinkat R., 1979. Gross morphology and fine structure of the olfactory organ of rainbow fish (Atheriniformes, Melanotaeniidae) // Acta Zoologica. V. 60. P. 173–186.
Zeiske E., Theisen B., Breucker H., 1992. Structure, development, and evolutionary aspects of the peripheral olfactory system // In Hara TJ. (ed.). Fish Chemoreception. London: Chapman & Hall. P. 13–39.
Zielinski B.S., Hara T.J., 2007. Olfaction // In Hara T.J., Zielinski B.S., Farrell A.F. and Brauner C.J. (eds). Sensory systems neuroscience. N.Y.: Academic Press. P. 1–43.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал