Зоологический журнал, 2021, T. 100, № 1, стр. 17-27
К вопросу о зараженности раков-отшельников Diogenes pugilator Rоuх 1828 (Decapoda, Anomura, Diogenidae) корнеголовыми ракообразными Septosaccus cuenoti Duboscq 1912 (Rhizocephala, Peltogastridae) в Черном море у берегов Крыма
А. В. Кулиш a, *, Л. В. Юшко a, **
a Керченский государственный морской технологический университет
298309 Керчь, Россия
* E-mail: kulish1972@mail.ua
** E-mail: lybovweb@gmail.com
Поступила в редакцию 22.08.2019
После доработки 24.04.2020
Принята к публикации 29.04.2020
Аннотация
Исследована зараженность раков-отшельников семейства Diogenidae, обитающих у южных берегов Крымского полуострова (Черное море), корнеголовыми ракообразными надотряда Rhizocephala. Установлена инвазия особей рака-отшельника Diogenes pugilator специфичным для него паразитом Septosaccus cuenoti с экстенсивностью инвазии 10.6%, при интенсивности инвазии 0–2 особи. Выполнены морфологические исследования внешней части самки паразита – экстерны, а также развивающихся в ней яиц. Выделены четыре стадии эмбрионального развития яиц. На каждой из стадий развития рассчитаны максимальный и минимальный диаметр яиц, их индекс формы, а также площадь и объем. Расчетным способом определены количество яиц с развивающимися эмбрионами в экстернах, потенциальное количество продуцируемых самкой Septosaccus cuenoti науплиусов в одной генерации, а также ориентировочная доля их выхода от первоначального количества оплодотворенных ооцитов.
Одна из наиболее интересных групп и в то же время наименее изученная таксономическая группа среди гидробионтов Черного моря – корнеголовые ракообразные (Rhizocephala, Kentrogonida, Peltagastridae), паразитирующие на десятиногих ракообразных (Decapoda; Malacostraca). Корнеголовые моноксенны, имеют хозяев только одного определенного вида. По литературным данным (Øksnebjerg, 2000), до настоящего времени в Черном море отмечено шесть видов Rhizocephala, относящихся к двум семействам – Peltogastridae и Sacculinidae. При этом один вид пелтагастрид (Parthenopea subterranean Kossmann 1874) инвазирует рака-крота (Callianassa subterranean (Montagu 1808)), два других вида данного семейства (Peltogaster paguri Rathke 1842, Septosaccus cuenoti Duboscq 1912) паразитируют на раках-отшельниках, а три вида саккулинид (Sacclina carcini Thompson 1836, Sacculina benedeni Kossmann 1872, Sacculina eriphiae Smith 1906) ‒ на крабах (соответственно Carcinus aestuarii Nardo 1847, Pachygrapsus marmoratus (Fabricius 1787) и Eriphia verrucosa (Forskål 1775)).
Имеющаяся информация о корнеголовых раках, паразитирующих на раках-отшельниках в Азово-Черноморском бассейне, крайне ограничена. Существуют лишь немногочисленные указания на их находки (Совинский, 1904; Зернов, 1913; Antipa, 1941), а также описания их морфологии и отдельных аспектов биологии (Чекановская, 1928; Попов, 1929; Bulgurkov, 1938; Codreanu R., 1941; Codreanu R., Codreanu M., 1959). Все упомянутые исследования выполнены до начала 70-х годов прошлого века преимущественно в западной части Черного моря (у берегов Болгарии и Румынии). Последняя и наиболее значимая статья, посвященная корнеголовым ракообразным у берегов Крымского п-ова опубликована Поповым в 1929 г. (1929). Недостаточная изученность Rhizocephala акватории Черного моря и, соответственно, необходимость ликвидации этого пробела в наших знаниях отмечены в наиболее полной на сегодняшний день сводке по Средиземному и Черному морям (Øksnebjerg, 2000).
Паразиты являются раздельнополыми организмами, их развитие происходит со сложным метаморфозом с тремя личиночными стадиями (Høeg, 1995; Høeg, Lützen, 1995, 1996). Для половозрелых женских и мужских особей характерны значительные различия в морфологии. Тело женской особи состоит из двух основных частей, названия которых отражают положение по отношению к организму хозяина: экстерна (внешняя часть) и интерна (внутренняя часть) (Попов, 1929; Høeg, Lützen, 1995).
Корнеголовые раки имеют сложный жизненный цикл, связанный с многочисленными морфофизиологическими преобразованиями. На поздних стадиях эмбрионального развития, еще в оболочке яиц, происходит дифференциация будущих личинок по полу. После выклева и выхода в окружающую среду личинки корнеголовых семейства Peltogastridae на первой стадии (науплиус) ведут свободноживущий, планктонный образ жизни, преобразуясь после ряда линек в стадию циприс. Первым двум личиночным стадиям свойствен лецитотрофный тип питания. В дальнейшем развитие самок и самцов идет по-разному.
Самки оседают на поверхности хозяина и, проходя метаморфозы, теряют сегментацию тела, преобразуясь в специализированную личинку – кентрогон. На этой стадии самка способна проникать сквозь покровы десятиногого ракообразного, инвазируя его. Развиваясь внутри хозяина, клеточная масса кентрогона “прорастает” в ткани практически всех органов, образуя разветвленную систему корневых отростков – интерну. Достигая определенной физиологической зрелости, интерна “пробивает” покровы тела хозяина в области его абдомена, образуя наружное репродуктивное тело – экстерну. По завершению роста и развития экстерны самка корнеголового ракообразного становится половозрелой и способна к оплодотворению.
Подвижные самцы на стадии циприса прикрепляются к зрелым экстернам самок. На их поверхности личинки линяют, трансформируясь в трихогона. После этого самец через приемный канал проникает в экстерну, мигрирует в ее специальную сосудистую часть, где созревает и начинает продуцировать мужские половые клетки.
После инвазирования Rhizocephala, как правило, коренным образом изменяют своих хозяев, вплоть до их полного физиологического подчинения (Ritchie, Høeg, 1981; O’Brien, van Wyk, 1985; Øksnebjerg, 2000). Результатом этого становится подавление части собственных инстинктов хозяина (прежде всего, репродуктивных), что выражается в паразитарной кастрации, феминизации поведения самцов и торможении линьки с целью обеспечения роста и воспроизводства паразита.
Исходя из этого, целью нашей работы стало исследование зараженности черноморских раков-отшельников (Decapoda, Anomura, Diogenidae) корнеголовыми ракообразными рода Septosaccus Duboscq 1912 (Peltogastridae, Rhizocephala).
МАТЕРИАЛ И МЕТОДЫ
Материалом для настоящих исследований послужили сборы двух черноморских видов раков-отшельников Diogenes pugilator Rоuх 1828 и Clibanarius erythropus (Latreillе 1818), отловленные в период с 25.06.2017 г. по 27.06.2017 г. на трех контрольных участках в бухте Провато в пределах набережной и пляжа поселка Орджоникидзе (Феодосия, Крым) (44°57′37.56″ с.ш., 35°21ʹ16.80ʺ в.д.; 44°57ʹ46.81ʺ с.ш., 35°21ʹ08.65ʺ в.д.; 44°57ʹ53.37ʺ с.ш., 35°20ʹ51.00ʺ в.д.) (рис. 1).
Раков-отшельников отлавливали вручную на участках дна с песчаным грунтом с включением гальки, а также в валунно-глыбовых развалах камней с неплотными зарослями цистозиры, на глубинах от уреза воды до 5 м. Объем материала 100 особей раков-отшельников, из них 65 – Diogenes pugilator и 35 – Clibanarius erythropus. На месте лова их фиксировали 4%-м раствором формальдегида. В лаборатории определяли вид рака-отшельника (по: Кобякова, Долгопольская, 1969) и вид Gastropoda, раковину которого этот рак использовал (по: Голиков, Старобогатов, 1972). После извлечения отшельника из раковины измеряли длину его карапакса с помощью штангенциркуля (с точностью до 0.01 см) и массу тела на торсионных весах ВТ-500 (с точностью до 0.001 г), а у самок – наличие эмбрионов на плеоподах. Раковину взвешивали на технических весах AXIS A 250/0.01 (с точностью до 0.01 г). Абдомен раков-отшельников обследовали на наличие экстерн корнеголовых паразитов. Для учета паразитов, находящихся в хозяине, но еще не образовавших экстерну, всех раков-отшельников подвергали анатомическому вскрытию. По результатам их обнаружения рассчитывали экстенсивность (ЭИ – число зараженных раков-отшельников к общему количеству исследованных их особей, %) и интенсивность (ИИ – минимальное и максимальное количество паразитов, обнаруженных на одном раке-отшельнике) инвазии, а также индекс обилия паразитов (ИО – среднее количество паразитов, приходящееся на одного зараженного рака-отшельника). Видовую принадлежность паразита определяли по особенностям строения его внешней части (экстерны) (по: Øksnebjerg, 2000). Экстерну измеряли штангенциркулем (длину, ширину по середине ее длины и высоту с точностью до 0.1 мм). После вскрытия каждой экстерны измеряли большой и малый диаметры у 20 яиц с развивающимися эмбрионами при помощи микроскопа МБС-9, имеющего окуляр с микрометрической линейкой. При перерасчете промеров в микрометры (мкм) использовали объект-микрометр. В дальнейшем для яиц расчетным путем определяли индекс формы (отношение большего диаметра к меньшему), среднюю площадь поверхности (эллипса) и объем (эллипсоида) (мкм, мкм2 и мкм3 соответственно). Исходными данными для расчетов служили деления микрометрической линейки, пересчитанные в микрометры после ее калибровки на объект-микрометре ОМПУ 4.2 (0.01 мм). Количество яиц (эмбрионов) паразита в экстерне рассчитывали как результат отношения объема выводковой полости экстерны (исключались 40% ее объема ‒ объем кутикулы и других мягких элементов выводковой полости включая специальные камеры для самцов) к среднему объему яйца. При этом объем выводковой полости определяли расчетным путем как разницу общего объема экстерны и ее объема после извлечения всех яиц. Кроме этого, под микроскопом определяли степень развития эмбрионов по особенностям их строения.
Для обработки результатов использованы стандартные пакеты компьютерных программ Microsoft Excel 2016 и SPSS 16.0.2.
РЕЗУЛЬТАТЫ
Заражение корнеголовыми ракообразными у раков-отшельников диагностируется наличием на их абдомене (мягкой брюшной части) экстерны паразитов (Øksnebjerg, 2000). Они были обнаружены на 7 особях D. pugilator из 66 обследованных (10.6%). На раках-отшельниках C. erythropus корнеголовые паразиты обнаружены не были (0%) Паразиты на стадии интерны в исследуемых раках-отшельниках не обнаружены (табл. 1).
Таблица 1.
Зараженность раков-отшельников корнеголовыми паразитами рода Septosaccus
| Вид рака-отшельника | Общее количество исследованных особей | Показатели зараженности | |||
|---|---|---|---|---|---|
| Количество зараженных особей | Экстенсивность инвазии (ЭИ), % | Интенсивность инвазии (ИИ), экз. | Индекс обилия (ИО) | ||
| C. erythropus | 35 | 0 | 0 | 0 | 0 |
| D. pugilator | 66 | 7 | 10.6 | 0–2 | 1.14 |
У одной особи D. pugilator было обнаружено две экстерны, но одна из них не была прикреплена к абдомену отшельника, свободно находясь рядом со второй прикрепленной экстерной у абдомена рака-отшельника в раковине. В ней находились развивающиеся яйца паразита, по внешнему виду и строению не отличающиеся от таковых во второй прикрепленной экстерне. Неприкрепленная экстерна была несколько светлее прикрепленной.
D. pugilator в бухте Провато использует раковины двух видов гастропод ‒ Tritia reticulata и Rapana venosa (Кулиш, Юшко, 2018). Однако в наших сборах все зараженные корнеголовыми паразитами раки-отшельники использовали в качестве переносного укрытия раковины лишь одного вида брюхоногих моллюсков ‒ Tritia reticulata (табл. 2).
Таблица 2.
Промеры инвазированных раков отшельников Diogenes pugilator и используемых ими раковин Tritia reticulate
| Показатель | Рак-отшельник | Масса раковины моллюска, г | |
|---|---|---|---|
| Масса, мг | Длина карапакса, см | ||
| M ± m | 214 ± 40.76 | 0.63 ± 0.035 | 1.04 ± 0.32 |
| min–max (lim) | 140–270 (130) | 0.57–0.68 (0.11) | 0.68–1.57 (0.89) |
Зараженные одной особью корнеголового паразита раки-отшельники, при одинаковой длине карапакса и массе тела, использовали меньшие по размерам и весу раковины, чем рак-отшельник, инвазированный двумя паразитами. Так, два рака-отшельника, имеющие наиболее близкую индивидуальную массу, равную 220 (с одной экстерной паразита) и 230 мг (с двумя экстернами), использовали раковины массой ‒ соответственно 1.22 г и 1.26 г. При этом раковина, используемая D. pugilator с двумя экстернами Septosaccus cuenoti, также имела бо́льшие размеры (общая высота на 7.8%, максимальная ширина завитка на 17.3%, ширина устья на 12.5%, высота первого завитка на 24.4%). Для сравнения: более крупные особи рака-отшельника, имевшие одну экстерну паразита, также использовали меньшие по размеру и массе раковины.
Экстерны S. cuenoti представляли собой плотные удлиненные образования в виде мешков (рис. 2 и 3), уплощенных в “дорсо-вентральном” направлении. Под “вентральной” стороной экстерны мы имеем в виду ее часть, обращенную к абдомену рака-отшельника, под “дорсальной” стороной ‒ сторону экстерны, обращенную к стенке раковины (рис. 2).
Рис. 2.
Морфологическое строение экстерн Septosaccus cuenoti (рисунок авторов): A – длина, B – ширина, H – высота.
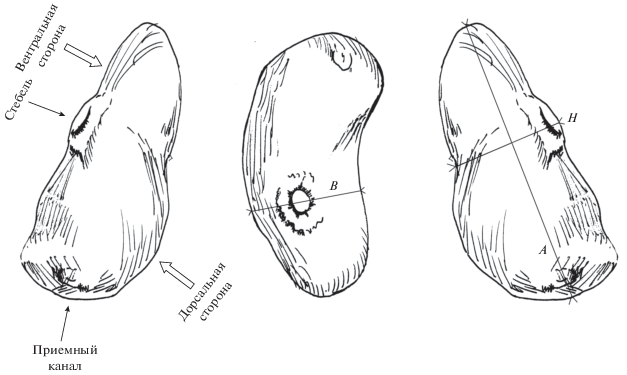
Рис. 3.
Внешний вид экстерны Septosaccus cuenoti (фото авторов): а – вид экстерны с вентральной стороны, в – стебель экстерны, с – приемный канал экстерны, 1 – стебель, 2 – приемный канал.
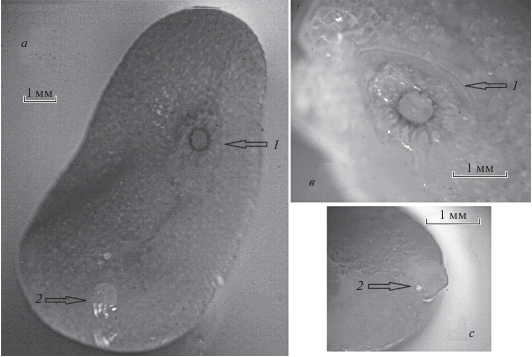
Экстерна имеет два отчетливо выделяющихся характерных элемента – стебель (рис. 3в) и приемный канал (рис. 3с). Форма экстерны несимметрично-бобовидная, имеющая с одной стороны утолщение, ориентированное в сторону приемного канала (рис. 2 и 3).
Экстерна покрыта мягкой эластичной кутикулой. Кутикула прозрачная, сквозь нее отчетливо видны яйца паразита с развивающимися в них эмбрионами (рис. 3).
На вентральной стороне экстерны на расстоянии двух третей длины от утолщенной части располагается стебель – структура (рис. 4в), соединяющая внешнюю (экстерну) и внутреннюю (интерну) части тела паразита. В центральной части основания стебля на экстерне отчетливо виден диск проводящей ткани. По его окружности располагаются характерные концентрические кольца, образующиеся после линьки наружной кутикулы выводковой полости экстерны (Lützen, 1987). Каждый раз после выхода во внешнюю среду генерации науплиусов наружная кутикула экстерны разрывается, происходит ее лизис и на внешнем периметре диска появляется очередная кольцевая структура (Lützen, 1987). С вентральной стороны на краю расширенной части экстерны расположен приемный канал (рис. 3с), представляющий собой эластичную трубчатую структуру.
Рис. 4.
Экстерна самки Septosaccus cuenoti (фото авторов): а – экстерна S. cuenoti, в – абдомен D. pugilator; 1 – стебель – структура, соединяющая внешнюю (экстерну) и внутреннюю (интерну) части паразита; 2 – приемный канал экстерны.
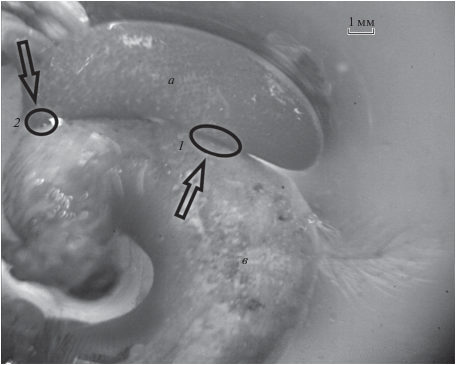
Экстерна S. cuenoti у всех зараженных раков-отшельников была прикреплена к задней трети абдомена D. pugilator, располагаясь поверх и вдоль его, пространственно ориентируясь своим приемным каналом в сторону тельсона рака-отшельника (рис. 4).
У корнеголовых паразитов S. cuenoti из бухты Провато экстерны различались между собой лишь размерами и массой (табл. 3). Было исследовано семь экстерн.
Таблица 3.
Размерно-весовые характеристики экстерн Septosaccus cuenoti
| Показатель | Длина (A), мм | Ширина (B), мм | Высота (H), мм | Масса, мг |
|---|---|---|---|---|
| M ± m | 12.6 ± 0.92 | 5.1 ± 0.98 | 4.5 ± 0.93 | 22 ± 2.41 |
| min–max (lim) | 11.6–14.0 (2.4) | 3.8–6.5 (2.7) | 3.7–6.4 (2.7) | 18–25 (7) |
Длина экстерн S. cuenoti варьировала от 11.6 до 14.0 мм при массе от 18 до 25 мг. По отношению к длине карапакса инвазированных раков-отшельников (хозяев) длина экстерн изменяется в пределах от 177.9 до 215.4% (в среднем составляла 198.1%). Масса экстерн к массе раков-отшельников от 7.4 до 12.9% (в среднем 10.3%).
Яйца в выводковой камере “упакованы” весьма плотно, при минимуме полостной жидкости. Эмбрионы в экстернах разных особей паразитов были на разных стадиях развития. При этом в каждой экстерне эмбрионы по морфологическому строению (стадии развития) не различались между собой.
Яйца корнеголового паразита имели форму эллипсоида вращения с разным соотношением большого и малого диаметров. Средние величины большого (Dmax) и малого (Dmin) диаметров яиц в целом составили соответственно 51.86 ± ± 6.74 мкм и 39.18 ± 5.38 мкм (здесь и далее по тексту ±m – стандартное отклонение). Величины значительно варьировали. Dmax изменялся от 40 до 70 мкм, Dmin составляет 30–55 мкм.
Рассчитанный для развивающихся яиц индекс формы (Dmax/Dmin) составлял в среднем 1.34 ± ± 0.19 при варьировании (min–max) данного показателя в пределах 1.00–2.00. Соответственно, расчетные величины площади поверхности (S) яиц составляли 1607.86 ± 361.25 мкм2 (942–2592), при среднем объеме (V) яиц 43 105.16 ± 15 374.30 мкм3 (18 850–95 033).
Руководствуясь общими представлениями об изменениях морфологии зародышей, принятыми в эмбриологии ракообразных (Иванова-Казас, 1979), кладки в экстернах по степени развития эмбрионов S. cuenoti мы разделили на четыре условные группы (далее по тексту “стадии развития”).
1-я стадия – яйца полупрозрачные, желток слабозернистый, без следов дробления или со следами дробления;
2-я стадия – яйца полупрозрачные, на анимальном полюсе присутствует серповидная зародышевая полоска, желток слабозернистый;
3-я стадия – эмбрион занимает от одной трети объема яйца, желток имеет крупные зерна;
4-я стадия – внутри яйца полностью сформированная личинка (науплиус), остаток желтка заключен под ее карапаксом.
В результате этого экстерны (n = 7 экз.) распределились следующим образом: на 1-й, 3-й и 4-й стадиях по 2 экз., на 2-й стадии – 1 экз. В экстернах с яйцами на 4-й стадии имелись отдельные вылупившиеся науплиусы.
Значения морфологических параметров яиц с эмбрионами, находящихся на разных стадиях развития, заметно различались между собой (табл. 4).
Таблица 4.
Морфологические показатели развивающихся яиц Septosaccus cuenoti
| Стадия развития | Число яиц, экз., N | Dmax, мкм | Dmin, мкм | Индекс формы Dmax/Dmin |
S, мкм2 | V, мкм3 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| M ± m | min–max (lim) | M ± m | min–max (lim) | M ± m | min–max (lim) | M ± m | min–max (lim) | M ± m | min–max (lim) | ||
| 1 | 40 | 44.50 ± ± 0.56 | 40–55 (15) |
35.25 ± ± 0.59 | 30–45 (15) |
1.28 ± ± 0.03 | 1.00–1.83 (0.83) |
1230.65 ± ± 24.01 | 942–1590 (648) |
29 208.45 ± ± 1012.22 | 18 850–47 713 (28 863) |
| 2 | 20 | 50.00 ± ± 0.81 | 45–60 (15) |
36.25 ± ± 0.50 | 35–40 (5) |
1.38 ± ± 0.03 | 1.13–1.57 (0.44) | 1424.35 ± ± 33.36 | 1237–1885 (648) | 34 573.55 ± ± 1233.30 | 28 863–50 265 (21 402) |
| 3 | 40 | 56.00 ± ± 0.78 | 40–65 (25) |
42.13 ± ± 0.71 | 35–55 (20) |
1.34 ± ± 0.03 | 1.00–1.71 (0.71) |
1856.58 ± ± 44.28 | 1100–2592 (1492) |
52 821.25 ± ± 2075.58 | 25 656–95 033 (69 377) |
| 4 | 40 | 56.00 ± ± 0.81 | 45–70 (25) |
41.63 ± ± 0.88 | 30–55 (25) |
1.37 ± ± 0.04 | 1.00–2.00 (1.00) |
1828.10 ± ± 43.70 | 1374–2376 (1002) |
51 551.60 ± ± 2285.41 | 28 274–87 114 (58 840) |
В процессе эмбрионального развития от 1-й стадии до 4-й стадии площадь поверхности и объем яиц увеличивается (рис. 5). Характер изменения их значений описывается линейными функциями с высокими величинами достоверности аппроксимации (R 2 > 0.7).
Рис. 5.
Изменение морфологических параметров яиц в процессе эмбрионального развития: V – объем, S – площадь, Dmax/Dmin – индекс формы.
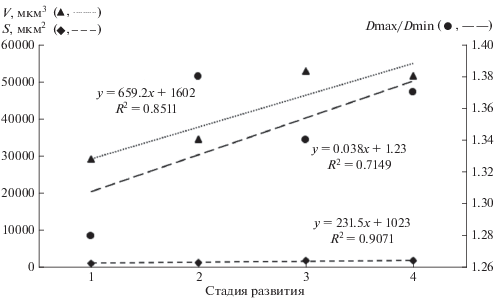
Величина индекса формы яиц заметно варьировала, как в пределах промеров одной экстерны, так и при сравнении средних значений для яиц, находящихся на одной стадии развития.
Количество яиц в экстерне можно считать “реализованной плодовитостью” (Буруковский, Андреева, 2010). Две самки S. cuenoti с яйцами на 1-й стадии развития имели 364.8 и 395.0 тыс. шт. яиц, особь с яйцами на 2-й стадии имела 264.0 тыс. шт., у двух особей с яйцами на 3-й стадии развития было 253.2 и 188.1 тыс. шт. и, наконец, две самки с яйцами на 4-й стадии имели 378.5 и 127.9 тыс. шт. Высокая вариабельность реализованной плодовитости может объясняться или размерами всей экстерны, или размерами ее выводковой камеры. Например, экстерны, содержащие яйца на 4-й стадии развития, различались размерами. У одной из них были длина 12.6 мм, ширина 3.8 мм, высота 3.7 мм (127.9 тыс. шт. яиц), у второй 13.1, 5.6 и 6.4 мм соответственно (378.5 тыс. шт. яиц). Ожидаемый факт уменьшения средней реализованной плодовитости в зависимости от степени развития яиц подтвержден данными нашего анализа (рис. 6).
Рис. 6.
Изменение численности яиц в экстерне в процессе развития. Средние данные по экстернам: для стадий 1, 3, 4 по n = 2; для стадии 2 n = 1.
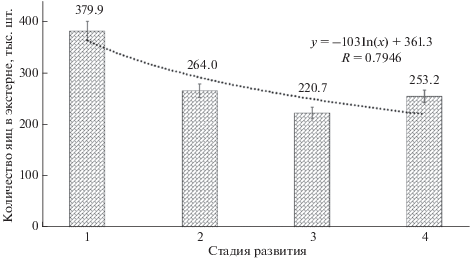
Можно предположить, что из выводковой камеры экстерны в среднем выходит 66.8% науплиусов от изначального количества оплодотворенных яиц. У одной самки S. cuenoti за один этап воспроизводства экстерну могут покинуть 120–260 тыс. науплиусов. Изменение числа развивающихся в экстерне самки яиц в процессе раннего эмбриогенеза может быть описано логарифмическим уравнением (R 2 = 0.79).
ОБСУЖДЕНИЕ
В бассейне Средиземного моря у раков-отшельников семейства Diogenidae описаны два вида моноксенных корнеголовых паразитов Rhizocephala, относящихся к роду Septosaccus Duboscq 1912 (Øksnebjerg, 2000) ‒ Septosaccus cuenoti Duboscq 1912 и S. rodriguezii (Fraisse 1877), соответственно специфичные ракам-отшельникам D. pugilator и C. erythropus. Причем в Черном море до настоящего времени отмечен только один из указанных видов – S. cuenoti, паразитирующий на D. pugilator (Øksnebjerg, 2000). Этот факт подтверждают и наши исследования. Заражения паразитами S. rodriguezii раков-отшельников C. erythropus не установлены. Последнее, на первый взгляд, может быть обусловлено небольшим объемом выборки C. erythropus. Но отсутствие находок S. rodriguezii у берегов Румынии и Болгарии, где материалом послужили сотни особей раков-отшельников (Codreanu, 1941; Codreanu, Codreanu, 1959), позволяет предположить наличие в Черном море факторов, препятствующих распространению данного паразита из Средиземного моря на север. Возможно, это связано с пониженной соленостью Черного моря, а также особенностями его температурного режима.
Корнеголовые раки S. cuenoti в Черном море отмечены в его западной части у берегов Болгарии и Румынии (Bulgurkov, 1938; Codreanu, 1941; Antipa, 1941; Codreanu, Codreanu, 1959), а также у берегов юго-западной части Крымского п-ова (бухты г. Севастополь) (Попов, 1929). Наши данные позволяют сделать заключение о более широком распространении S. cuenoti в Черном море, включая его северо-восточную часть у берегов Крыма.
Полученные нами значения экстенсивности инвазии (10.6%) в целом не превышают значения, указанные в литературных источниках для западных районов Черного моря: до 17.51% у берегов Румынии (Codreanu, Codreanu, 1959); до 31.4% у берегов Болгарии (Bulgurkov, 1938). И значительно ниже значений (до 60%), полученных Поповым (1929) у берегов Крыма в бухтах г. Севастополь.
Для большинства видов семейства Peltogastridae свойственно заражение одной особи десятиногих ракообразных (хозяина) не более чем одной особью паразита (Codreanu, Codreanu, 1959; Høeg, Lützen, 1995). Особи S. cuenoti, как правило, также образуют на D. pugilator лишь одну экстерну (Øksnebjerg, 2000), а наличие двух паразитов (экстерн) отмечается значительно реже (Codreanu, 1941), что подтверждают и наши данные. Из семи зараженных особей из бухты Провато лишь один рак-отшельник (14.3%) имел на абдомене две экстерны S. cuenoti. При этом вторая экстерна была не прикреплена к абдомену рака-отшельника. Возможно, несмотря на аккуратное выполнение работ, она была оторвана при извлечении отшельника из раковины или отделилась в процессе фиксации формальдегидом. При этом, по данным Бодуэна (Bauduin, 1931), при инвазировании рака-отшельника двумя паразитами всегда отмечается существенная разница в возрасте и размере их экстерн (Bauduin, 1931). В наших исследованиях экстерны имели сходные размеры. Кроме того, видимых различий в развитии яиц в прикрепленной и неприкрепленной экстерне не установлено.
Общепринято, что корнеголовые ракообразные оказывают значительное воздействие не только на физиологическое состояние своих хозяев, но и на их поведенческие реакции (Høeg, 1995). Так, особи с более высокой интенсивностью инвазии воспринимают экстерны паразитов как часть своего тела (кладку своих яиц) и поэтому в процессе роста подыскивают для себя более “просторные” раковины, даже несмотря на их больший вес. Сравнив морфологические параметры и массу зараженных раков-отшельников и раковин, используемых ими в качестве укрытия, мы проследили зависимость между количеством экстерн паразита на хозяине и размером используемой хазяином раковины. Достоверность данного утверждения подтверждается тем, что на дне в бухте было достаточно пустых раковин, и вряд ли между отшельниками существовала конкуренция из-за них.
Длина экстерн S. cuenoti у берегов Крыма на 45‒75% больше длины, указанной ранее Кодряну (Codreanu, 1941) для Черного моря (8 мм), и на 16‒40% для Атлантического океана (10 мм) (Codreanu, 1941). Если Кодряну измерял экстерны живых паразитов (указания в работе отсутствуют), а размеры исследованных нами экстерн, фиксированных в 4%-м растворе формальдегида, могли уменьшиться, то преобладание размеров экстерн паразитов из бухты Провато остается несомненным.
По мнению Кодряну, существует положительная корреляционная взаимосвязь между размером экстерны паразита и размером его хозяина (Codreanu, 1941). Однако размер карапакса рака-отшельника D. pugilator, обитающего в Черном море у берегов Крыма, меньше аналогичного параметра для акватории у берегов Франции (Noël, 2016), а длина экстерн S. cuenoti в сравнении, напротив, больше, что требует дополнительного объяснения.
При лабораторном исследовании развития личинок S. cuenoti в Румынии, Кодряну (Codreanu, 1959) отметил, что яйца паразита на последней стадии развития имеют форму эллипсоида и размеры 170 × 125, не указывая при этом единиц измерения. Позже Барнс (Barnes, 1989) в своем своде информации о плодовитости представителей инфракласса Cirripedia, куда входят и Rhizocephala, со ссылкой на работу Кодряну (Codreanu, 1959), приводит указанные выше данные о размере яиц S. cuenoti, но с указанием единицы измерения в мкм. Сведения о состоянии яиц (живые или фиксированные) на момент их измерения ни один из авторов не представляет. При сравнении полученных нами средних величин большого (Dmax) и малого (Dmin) диаметров яиц, фиксированных в 4%-м растворе формальдегида, и находящихся на 4-й стадии развития в экстернах S. cuenoti из бухты Провато (56.0 × 41.6 мкм), и аналогичных величин у особей данного вида из западной части Черного моря у берегов Румынии (Codreanu, 1959) заметны различия. У берегов Крыма яйца Rhizocephala оказались значительно мельче (на 67%), чем яйца у западночерноморских представителей этого вида (170 × 125 мкм). При этом индекс формы яйца (Dmax/Dmin) из экстерн S. cuenoti в бухте Провато и у берегов Румынии имеет близкие значения – соответственно 1.37 и 1.36.
Установленная индивидуальная вариабельность морфометрических показателей яиц (Dmax, Dmin, Dmax/Dmin) в развивающихся кладках по экстернам, находящимся на одной стадии эмбрионального развития, может объясняться разными причинами. Возможно, это связано с небольшим объемом исходного материала. Но, на наш взгляд, это может свидетельствовать об индивидуальных особенностях в развития яиц, зависящих от возраста паразита, количества генераций науплиусов за сезон и размера экстерны. Следует учесть и определенную разницу размеров развивающихся яиц, связанных с незначительной задержкой начала развития части зародышей после их оплодотворения. Это может быть обусловлено различной численностью и активностью самцов в репродуктивный период, как в среде окружающей ивазированных раков-отшельников, так и находящихся в экстерне самки корнеголового рака.
Установленное увеличение размаха вариации (lim) морфологических показателей яиц (Dmax, Dmin, S и V) к 4-й стадии развития (начало выклева науплиусов) может объясняться следующим: ранее исследователями отмечено, что выходящие из яиц науплиусы корнеголовых ракообразных дифференцированы по полу, отчетливо различаются между собой по отдельным морфологическим признакам и размерам (личинки самцов крупнее личинок самок (Høeg, 1995; Høeg, Lützen 1995, 1996)). Возможно, что особенности изменения размеров яиц связаны с начинающейся ранней дифференцировкой эмбрионов по полу. При этом, учитывая индивидуальные особенности количественного соотношения самок и самцов в отдельных экстернах, средние значения размеров яиц и показатели их вариации могут значительно изменяться.
Сходное морфологическое строение развивающихся эмбрионов в исследованных экстернах S. cuenoti позволяет предположить наличие одной генерации будущих науплиусов, выметываемых непрерывно по мере завершения их созревания. Это позволяет предположить, что корнеголовым ракообразным S. cuenoti свойствен фронтальный тип развития эмбрионов в экстерне, характеризующийся единообразием и единовременностью.
ВЫВОДЫ
1) Среди раков-отшельников D. pugilator и C. erythropus, обитающих в акватории бухты Провато (Феодосия, Черное море), заражение паразитическими корнеголовыми раками рода Septosaccus обнаружено только у D. pugilator. Экстенсивность инвазии 10.6%, при интенсивности 0‒2 особи и индексе обилия 1.14. Показатели инвазии не превышают данных для Черного и Средиземного морей.
2) Длина экстерн S. cuenoti у берегов Крыма больше, как в сравнении с литературными данными из западной части Черного моря (на 45‒75%), так и для Атлантического океана (на 16–40%).
3) Яйца S. cuenoti в экстернах имеют форму эллипсоида и следующие параметры: большой диаметр (Dmax) 51.86 ± 6.74 мкм (40–70 мкм); малый диаметр (Dmin) 39.18 ± 5.38 мкм (30–55 мкм); индекс формы (Dmax/Dmin) 1.34 ± 0.19 (1.00–2.00); площадь поверхности яиц – 1607.86 ± 361.25 мкм2 (942–2592); объем яиц 43 105.16 ± 15 374.30 мкм3 (18 850–95 033). Средние значения диаметров яиц в бухте Провато меньше (на 67%) аналогичных промеров яиц из Средиземного моря.
4) В каждой отдельной экстерне яйца находились на одинаковом уровне развития, т.е. процесс эмбриогенеза имел фронтальный характер. Эмбрионы в яйцах в зависимости от степени развития разделены на четыре стадии. Все изменения морфологических параметров яиц (площадь поверхности, объем, индекс формы) в процессе эмбриогенеза описываются линейными уравнениями при R 2 > 0.7.
5) Реализованная плодовитость уменьшается от 379.9 тыс. шт. (на 1-й стадии) до 253.2 тыс. шт. (на 4-й стадии). Самка S. cuenoti за один этап воспроизводства может дать не менее 120 тыс. науплиусов, при их выходе, равном 66.8% от первоначального количества оплодотворенных яиц. Изменение числа развивающихся в экстерне самки эмбрионов описывается логарифмическим уравнением при R 2 = 0.79.
Список литературы
Буруковский Р.Н., Андреева В.М., 2010. О географическом распространении, батиметрическом распределении и биологии креветки Acanthephyra pelagica (Risso 1816) (Decapoda, Oplophoridae) // Журнал Сибирского федерального университета. Серия: Биология. Т. 3. № 3. С. 303–321.
Голиков А.Н., Старобогатов Я.И., 1972. Класс брюхоногие моллюски – Gastropoda // Определитель фауны Черного и Азовского морей. Киев: Наукова Думка. Т. 3. С. 65–166.
Зернов С.А., 1913. К вопросу об изучении жизни Черного моря // Записки Императорской Академии наук. Сер. 8. Т. 32. № 1. С. 1–299.
Иванова-Казас О.М., 1979. Сравнительная эмбриология беспозвоночных животных. Членистоногие. М.: Наука. 224 с.
Кобякова З.И., Долгопольская М.А., 1969. Отряд десятиногих – Decapoda. Определитель фауны Черного и Азовского морей. Киев: Наукова думка. Т. 2. С. 270– 306.
Кулиш А.В., Юшко Л.В., 2018. К вопросу о выборе раковины раками-отшельниками (Diogenidae: Anomura: Decapoda) обитающими в Чёрном море у берегов Крыма (предварительные данные) // Водные биоресурсы и аквакультура Юга России. Материалы Всерос. науч.-практ. конф. Краснодар: Кубанский гос. ун-т. С. 148–151.
Попов В.К., 1929. Rhizocephala и Bopyridae Севастопольской бухты // Труды Севастопольской биологической станции. Т. 1. С. 1–27.
Совинский В.К., 1904. Введение в изучение фауны Понто-Каспийско-Аральского морского бассейна, рассматриваемой с точки зрения самостоятельной зоогеографической провинции // Записки Киевского общества естествоиспытателей. Т. 18. С. I–XIII, 487 с.
Чекановская О.В., 1928. Изменение абдоминальных конечностей у Diogenes varians Heller (D. pugilator Roux) при паразитической кастрации // Доклады Академии наук СССР. С. 381–382.
Antipa G., 1941. Marea Neagra // Publicationile Fondului Vasile Adamachi. № 10. P. 1–313.
Barnes M., 1989. Egg production in cirripedes // Oceanography and Marine Biology: An Annual Review. № 27. P. 91–166.
Bauduin H., 1931. Notes anatomiques sur le Septosaccus cuenoti // Memoire de la Faculte des Sciences de l’Université de Paris No. d’ordre: 425 (Also in): Travaux de la Station biologique de Roscoff. № 9. P. 11–26.
Bulgurkov K., 1938. Study of Rhizocephala and Bopyridae from the Bulgarian Black Sea coast // Trud. na Chernorskata Biol. Sta. v’Varna. № 7. P. 69–81.
Codreanu R., 1941. Sur les Pagures du littoral Roumain de la Mer Noire et leurs crustacés parasités // Analele Academiei Romane Memoriile Sectiunii Stiintifice. Ser. 3. 16. P 1095–1130.
Codreanu R., 1959. Sur le développement larvaire du Rhizocéphale Septosaccus cuenoti Duboscq, parasite du Pagure Diogenes pugilator (Roux) de la mer Noire // Comptes rendus de l’Académie des Sciences. Paris. V. 248. Part 2. P. 3739–3741.
Codreanu R., Codreanu M., 1959. Données biologique et statistiques sur un pagure, Diogenes pugilator (Roux) de la Mer Noire et ses crustacés parasités. Essai d’analyse de ses caractères sexuels // Lucrarile Sesiunii Stiintifice Agigea. № 21. P. 315–348.
Høeg J.T., 1995. The biology and life cycle of the Cirripedia Rhizocephala // Journal of the Marine Biological Association of the United Kingdom. № 75. P. 517–550.
Høeg J.T., Lützen J., 1995. Life cycle and reproduction in the Cirripedia Rhizocephala // Oceanogr. Mar. Biol. № 33. P. 427–485.
Høeg J.T., Lützen J., 1996. Rhizocephala // Forest J., ed. Traité de Zoologie. Crustacea. VII. Fasc. II. Paris: Masson et Cie. P. 541–568.
Lützen J., 1987. Life history parameters calculated from growth rings in parasitic barnacles of the family Peltogastridae (Crustacea: Cirripedia: Rhizocephala) // Journal of Crustacean Biology. № 7. P. 493–506.
Noël P., 2016. Le diogène des sables Diogenes pugilator (Roux, 1829). In Muséum national d’Histoire naturelle [Ed.]. Inventaire national du Patrimoine naturel. P. 1–18. [Электронный ресурс]. Режим доступа: http:// inpn.mnhn.fr. Дата обращения: 08.08.2019.
O’Brien J., van Wyk P., 1985. Effects of crustacean parasitic castrators (Epicaridean Isopods and Rhizocephalan barnacles) on growth of crustacean hosts // Wenner A., ed. Crustacean growth: Factors in adult growth. Crustacean. Issues 3. A.A. Balkema, Rotterdam. P. 191–218.
Øksnebjerg, 2000. The Rhizocephala (Crustacea: Cirripedia) of the Mediterranean and Black seas: taxonomy, biogeography, and ecology // Israel Journal of Zoology. № 46. P. 1–102.
Ritchie L.E., Høeg J.T., 1981. The life history of Lernaeodiscus porcellanae (Cirripedia Rhizocephala) and co-evolution with its porcellanid host // Journal of Crustacean Biology. № 1. P. 334–347.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал