Зоологический журнал, 2021, T. 100, № 1, стр. 57-67
Влияние погодных условий на сроки прилета и репродуктивные показатели розовой чайки (Rhodostethia rosea) в дельте реки Лены (Якутия)
С. В. Волков a, *, В. И. Поздняков b
a Институт проблем экологии и эволюции РАН
119071 Москва, Россия
b Государственный природный заповедник “Усть-Ленский”
678400 Республика Саха (Якутия), Тикси, Россия
* E-mail: owl_bird@mail.ru
Поступила в редакцию 29.09.2019
После доработки 19.02.2020
Принята к публикации 24.04.2020
Аннотация
Обобщены данные по фенологии весенней миграции и гнездованию розовой чайки, собранные в 1982–2013 гг. в дельте реки Лена, северная Якутия. За указанный период произошли заметные изменения погоды, выросла: среднегодовая температура (F1,27 = 7.74, p < 0.04), температура июня (F1,27 = 11.75, p < 0.002) и всего летнего сезона (F1,27 = 9.13, p < 0.005), в более ранние сроки стал происходить переход среднесуточных температур через 0°С (F1,26= 14.73, p < 0.001). Однако продолжительность периода с положительными температурами увеличилась незначительно (F1,26= 3.53, p < 0.07). Установлена зависимость сроков появления розовых чаек от даты схода снега (r = 0.62, p < 0.05), июньских среднесуточных (r = –0.48, p < 0.01) и минимальных суточных (r = –0.70, p < 0.001) температур. Для розовой чайки, как высокоарктического вида, характерна максимальная амплитуда колебаний величины кладки среди чайковых птиц. В дельте Лены эта амплитуда выше, чем в более южных районах, где в основном изучали гнездовую экологию вида. Величина кладки отрицательно связана с датой начала гнездования. Чем раньше самки приступают к гнездованию, тем больше яиц в их кладках. Репродуктивные возможности вида зависят от температурного режима в предгнездовой период. В холодные сезоны начало гнездования сдвигается на более поздние сроки (r = –0.75, p < 0.001), снижается величина кладки (F1,172 = 27.307, p < 0.00001). Наблюдается тенденция уменьшения объема яиц, наиболее заметно от даты схода снега (F1,226 = 33.4, p < 0.00001) и средней температуры предгнездового периода (F1,226 = 23.4, p < 0.00001). Несмотря на то, что начиная с 1982 г. температуры гнездового сезона в дельте Лены показывают тенденцию явного роста и это приводит к более раннему прилету розовых чаек (F1,27 = 14.87, p < 0.001), смещения сроков начала гнездования у вида не обнаружено. Вероятно, амплитуда межгодовых изменений имеет более широкий размах, чем многолетний тренд. Закономерности вариаций сроков старта гнездования, величины кладки и размеров яиц обусловлены динамикой условий среды, в первую очередь температурой воздуха в предгнездовой период.
Изменения климата происходят во многих районах мира, но наиболее они заметны в Арктике (Parmesan, Yohe, 2003; Meltofte et al., 2007; Cohen et al., 2014; van Gils et al., 2016; Головнюк и др., 2017). Многочисленные исследования в последних два десятилетия продемонстрировали влияние климатических изменений на фенологию сезонных миграций большого числа видов птиц (Jonsén et al., 2006; Zalakevicius et al., 2006; Соколов, 2010; Gunnarsson, Tómasson, 2011; Соловьев и др., 2012; Волков и др., 2013 и др.). Тем не менее прогнозировать изменения экологии животных в ответ на колебания климата сложно, поскольку нередко они опосредованы и другими факторами (Stenseth et al., 2002; Berteaux et al., 2006; Соловьев и др., 2012; Артемьев, 2013; Weiser et al., 2017, 2018; Шариков и др., 2019). Для территории России наблюдений за многолетней динамикой сообществ животных относительно немного, а для ее арктических районов эти наблюдения единичны (Головнюк и др., 2017; Fufachev et al., 2019). Хотя именно здесь из-за короткого гнездового сезона, подобные изменения должны быть выражены ярче, чем в регионах умеренного пояса или тропиков.
По сравнению с расположенными южнее регионами, для Арктики характерен относительно сжатый гнездовой сезон, большинство видов птиц приступают к откладке яиц сразу после снеготаяния. Вылупление птенцов приурочено, как правило, к периоду массового появления корма, показатели обилия которого также зависят от весенней фенологии (Meltofte et al., 2007; Lameris et al., 2018). Другая важная особенность арктических регионов – широкие пределы межгодовой изменчивости условий гнездования, обусловленных погодой. Крайние даты старта откладки яиц даже в последующих сезонах могут различаться на месяц. На фоне подобных межгодовых колебаний влияние постепенного потепления на экологию видов может оказаться незаметным. В последнее время появляются работы, показывающие, что те или иные изменения в экологии некоторых видов не всегда успевают за тенденциями потепления климата (Gaston et al., 2009; Both, 2010; Kwon et al., 2019). В ряде случаев выводковый период, изначально подстроенный к периоду максимального обилия качественного корма, смещается на сроки, когда качество кормов уже проходит пиковые, оптимальные показатели. Последствия таких изменений остаются практически не изученными, предполагается, что они могут негативно влиять на скорость роста, а в итоге на выживаемость и приспособленность нового поколения (van Gils et al., 2016; Lameris et al., 2017, 2018; Weiser et al., 2017; Kwon et al., 2018, 2019). Вместе с тем, для арктических видов запаздывание вылупления на 1–2 недели не должно быть экстраординарной ситуацией, поскольку колебания метеоусловий между сезонами имеют бόльшую амплитуду, чем их изменения под влиянием постепенного потепления климата.
Многими исследованиями показано, что птицы на разных широтах стараются гнездиться как можно раньше, продуктивность размножения у таких пар заметно выше (Newton, 1998; Meltofte et al., 2007; Weiser et al., 2018). Вынужденное гнездование в поздние сроки приводит к снижению выживаемости, как во время инкубации, так и в выводковый период. В годы с холодной погодой и затяжным снеготаянием длительная отсрочка начала гнездования для видов с длинным циклом размножения может перерасти в пропуск репродуктивного сезона (Meltofte et al., 2007).
Формирующие современную арктическую фауну виды птиц, несомненно, обладают высокой пластичностью к динамичным условиям, характерным для районов их гнездования. Но, с другой стороны, долговременные направленные изменения климата могут вести к заметным сдвигам в экологии птиц, в частности к смещению сроков прилета, начала и окончания гнездования, успешности инкубационного и выводкового периодов, а также к изменениям численности и/или смещению ареала. Широкая амплитуда колебаний показателей продуктивности гнездования птиц в Арктике в зависимости от погоды – известный факт, хорошо документированный во многих исследованиях. Однако степень этого влияния на разные стороны экологии птиц остается слабоизученной и представляет большой интерес.
Розовая чайка (Rhodostethia rosea) – некрупный исключительно арктический вид семейства чайковых (Laridae). Ее гнездовой ареал практически полностью расположен в границах России – от восточного Таймыра до Чукотки (Зубакин и др., 1988; Юдин, Фирсова, 2002; Поздняков, 2006). Известны нерегулярные случаи гнездования на Шпицбергене, в Гренландии и Канадской Арктике (Burger et al., 2018). Негнездовой период розовые чайки проводят также в Арктике, кочуя в Северном Ледовитом океане вдоль кромки льда (Зубакин и др., 1988; Gilg et al., 2016). Из-за труднодоступности районов гнездования многие аспекты гнездовой биологии вида изучены слабо. В настоящей работе проанализировано влияние ряда метеорологических параметров и современных изменений климата на фенологию и гнездовую экологию розовых чаек, сроки их прилета на места гнездования, сроки начала откладки яиц, величинау кладки и размеры яиц.
МАТЕРИАЛ И МЕТОДИКА
Дельта р. Лены (71°42′–74° с.ш., 120–129°30′ в.д.) – крупнейшая евразиатская дельта, ее площадь 28 500 км2. Здесь широко представлены северные субарктические тундры, в континентальной части значительные площади занимают сухие щебнистые тундры, ближе к побережью располагается подзона приморских арктических тундр (Перфильева, 1985). Наблюдения проводили на стационарах в восточной (72°55′ с.ш., 129°22′ в.д.) и северной (73°25′ с.ш., 126°38′ в.д.) частях дельты. В дельте Лены розовая чайка – обычный вид, населяющий всю территорию района исследований. Распределение по дельте неравномерное. Относительно регулярно, с высокой плотностью, розовые чайки гнездятся в прибрежной полосе низменных, сильно обводненных приморских тундр восточной и северной оконечностей дельты. Во внутренних частях дельты птицы встречаются спорадично и приурочены к участкам низменных заболоченных тундр. Реже гнездятся на небольших песчаных островах проток (Поздняков, 2006).
Были проанализированы материалы по биологии розовой чайки, собранные нами в 1994–2013 гг., а также сведения из “Летописей природы” Усть-Ленского заповедника начиная с 1982 г. В анализе использованы данные по 174 кладкам. Измерения яиц проводили общепринятыми методами, с помощью штангенциркуля с точностью до 0.1 мм. Все яйца (n = 228) взвешивали, но эти данные не включили в анализ, поскольку гнезда осматривали на разных стадиях инкубации, а масса яиц существенно изменяется в ходе развития эмбриона. Размеры использовали для вычисления объема по формуле: V = kDd 2, где V – объем яйца (см3), D – максимальная длинна (мм), d – максимальный диаметр (мм), k = 0.47 – коэффициент для яиц грушевидной формы (Governali et al., 2012).
Метеоданные за 1982–2013 гг. получены с полярной станций им. Хабарова (72°41′ с.ш., 126°50′ в.д.), расположенной в южной части дельты Лены. Они доступны на сайте National Oceanic and Atmospheric Administration (NOAA) Climate Prediction Center (http://www.cpc.ncep.noaa.gov).
Для выявления долговременных тенденций в динамике погодных условий и репродуктивных показателей использованы методы линейной регрессии. Распределение среднего объема яйца было нормальным, поэтому при анализе зависимости этого параметра от внешних факторов применяли множественную регрессию.
РЕЗУЛЬТАТЫ
Погодные и климатические изменения. Среднегодовая температура воздуха в дельте Лены за период 1982–2013 гг. выросла более чем на 2°С (F1,27 = 7.74, p < 0.04), в летний период (июнь–август) эта тенденция проявляется более выражено (F1,27 = 9.13, p < 0.005, рис. 1). Значения среднемесячных температур мая и июня достоверно изменились, оба месяца стали теплее (май: F1,27 = 7.97, p < 0.001; июнь: F1,27 = 11.75, p < 0.002, рис. 1). Кроме этого, в более ранние даты стал происходить переход среднесуточных температур через 0°С (F1,26 = 14.73, p < 0.001).
Рис. 1.
Тенденции изменения температур воздуха (°С) в дельте реки Лены в 1982–2013 гг. а: 1 – среднегодовой, 2 – среднелетней (июнь–август); б: 1 – среднесуточной майской, 2 – среднесуточной июньской, данные стандартизованы.
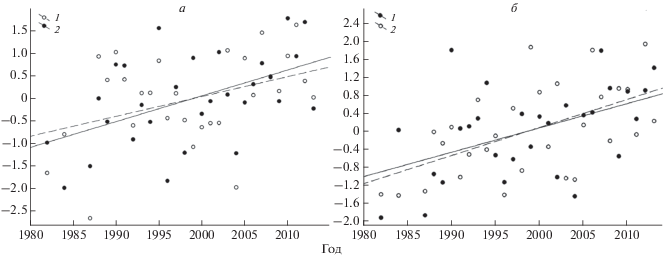
Однако при явной тенденции роста годовых и летних температур продолжительность периода с положительными температурами, во время которого и гнездятся чайки, изменилась незначительно (F1,26 = 3.53, p < 0.07). В среднем длительность этого периода составляет 109.2 ± 10.1 (90–130) дней, медиана – 109 дней.
Сроки прилета. Амплитуда межгодовых колебаний дат прилета розовых чаек в дельту Лены составляет 27 дней (29.05–24.06). В среднем чайки появляются в I декаду июня: 7.06 ± 6.2 дня, медиана – 6.06 (n = 28). Смещение дат прилета на более ранние сроки в период наших наблюдений хорошо выражено (F1,27 = 14.87, p < 0.001). В 1980-х гг. первых розовых чаек регистрировали в среднем 9.06 (n = 5), в 1990-х гг. – 7.06 (n = 10), а в 2000-х гг. – 3.06 (n = 13).
Появление розовой чайки в районах гнездования коррелирует с июньскими среднесуточными и минимальными температурами (r = –0.48, p < 0.01 и r = –0.70, p < 0.001 соответственно, рис. 2), датой перехода среднесуточных температур через 0°С (r = 0.58, p < 0.001, рис. 3) и датой схода снега (r = 0.62, p < 0.05). В 1980–1990-х гг. появление розовых чаек происходило с среднем через 1–2 дня после перехода среднесуточных температур через 0°С, в 2000-х гг. стала проявляется тенденция отставания прилета от наступления периода с положительными температурами (рис. 3), хотя статистически она не подтверждается.
Рис. 2.
Зависимость дат прилета розовой чайки в дельту реки Лены от динамики июньских минимальных (1, правая ось) и среднесуточных (2, левая ось) температур (°С), данные стандартизованы.
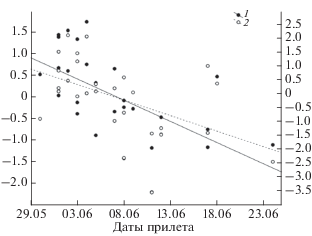
Рис. 3.
Тенденции изменения дат прилета розовых чаек (1) и даты перехода среднесуточных температур через 0°С (2) в дельте реки Лены в 1982–2013 гг.

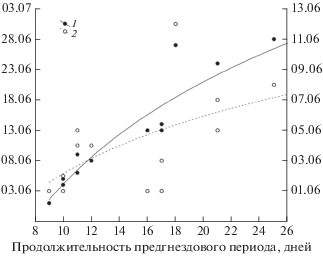
Длительность предгнездового периода. Промежуток времени между прилетом и откладкой первого яйца у розовой чайки в разные годы составляла от 3 до 25 дней, в среднем 15 ± 5.3 дня (n = 14). На фоне межгодовых флуктуаций, направленных изменений в длительности предгнездового периода не происходило (р < 0.5). На продолжительность предгнездового периода в каждый конкретный год влияет дата перехода среднесуточных температур через 0°С (r = 0.92, p < 0.0001, рис. 4). Корреляция с минимальными и среднесуточными температурами июня также достоверна (r = –0.80, p < 0.001 и r = –0.68, p < 0.01 соответственно). Прослеживается значимая корреляция между продолжительностью предгнездового периода и средней температурой этого периода, а также суммой среднесуточных температур, накопленных за этот временной промежуток (r = ‒0.73, p < 0.004 и r = –0.71, p < 0.007 соответственно). Чем ниже температура, тем продолжительнее предгнездовой период. Хотя дата прилета оказывает определенное влияние на длительность предгнездового периода, эта зависимость имеет нелинейный характер. В ряде случаев в годы позднего прилета чайки вынуждены приступать к гнездованию в относительно более сжатые сроки, даже при неблагоприятных погодных условиях. В нормальной ситуации короткий промежуток между прилетом и откладкой первого яйца отмечается в годы с ранним прилетом и температурами выше среднего.
Рис. 4.
Продолжительность предгнездового периода у розовых чаек в дельте реки Лены в зависимости от перехода среднесуточных температур через 0°С (1, левая ось) и даты прилета (2, правая ось).
Начало гнездования. Откладка первого яйца происходит обычно во второй половине июня, в разные годы 10–25.06, в среднем – 18.06 ± 7.5 дня (n = 14). За период наблюдений смещение дат начала откладки яиц не выражено (р < 0.5). Сроки начала гнездования розовой чайки отрицательно зависят от динамики среднесуточной температуры июня (r = –0.75, p < 0.001) и минимальной температуры июня (r = –0.86, p < 0.0001). Чем ниже в июне среднесуточная температура и минимальная температура, тем позже птицы приступают к гнездованию. Влияние минимальной температуры на откладку первых яиц более выражено, чем влияние среднесуточной температуры (рис. 5). Даты устойчивого перехода среднесуточных температур через 0°С (r = 0.91, p < 0.0002) и даты схода снега (r = 0.69, p < 0.03) также оказались значимыми параметрами (рис. 6). Сроки начала гнездования положительно коррелируют с датами прилета (r = 0.83, p < 0.001) и, вероятно, полностью определяются локальными погодными условиями.
Рис. 5.
Изменение дат начала гнездования розовых чаек в дельте реки Лены в зависимости от динамики июньских минимальных (1) и среднесуточных (2) температур (°С), данные стандартизованы.
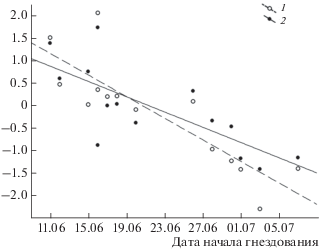
Рис. 6.
Изменение дат начала гнездования розовых чаек в дельте реки Лены в зависимости от дат схода снега (1) и перехода среднесуточных температур через 0°С (2), данные стандартизованы.
Величина кладки и размеры яиц. Розовая чайка, как и большинство представителей семейства чайковых, в норме имеет детерминированный размер кладки из трех яиц. Тем не менее в дельте Лены средняя величина этого параметра значительно флуктуирует по годам – от 1.6 до 2.6 яиц, в среднем за все годы наблюдений – 2.0 ± 0.1 яйца (n = 174). Анализ величины кладки показал высокую зависимость этого параметра от температурного режима в предгнездовой период (F1,172 = 27.31, p < 0.00001). Чем выше средняя температура после прилета чаек, тем больше величина их кладок.
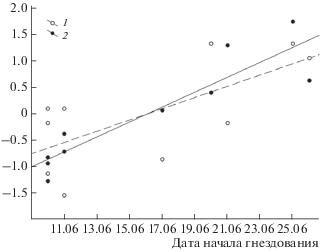
Низкие температуры в предгнездовой период и поздний переход среднесуточных температур через 0°С приводят к задержке начала гнездования и удлиняют продолжительность предгнездового периода, обуславливая снижение средней величины кладки (F1,172 = 15.32, p < 0.0001 и F1,172 = 8.86, p < 0.003 соответственно). Чем раньше розовые чайки приступают к гнездованию, тем больше величина их кладки (r = –0.85, p < 0.002, рис. 7).
Рис. 7.
Изменение величины кладки розовых чаек в дельте реки Лены в зависимости от дат схода снега (1) и перехода среднесуточных температур через 0°С (2).
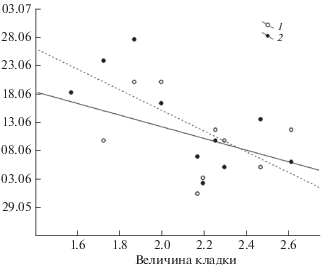
За период наших наблюдений выраженного тренда в динамике объема или линейных размеров яиц не выявлено. Тем не менее эти параметры изменяются в зависимости от температурного режима. В поздние сезоны отмечена тенденция уменьшения объема яиц. Наиболее заметно этот показатель зависит от даты схода снега (F1,226 = 33.4, p < 0.00001), средней температуры предгнездового сезона (F1,226 = 23.4 p < 0.00001), минимальной температуры июня (F1,226 = 5.9, p < 0.01) и даты перехода среднесуточных температур через 0°С (F1,226 = 6.05, p < 0.01).
ОБСУЖДЕНИЕ
Прилет и его связь с погодными условиями. Начиная с 1982 г., среднегодовые и летние температуры в дельте Лены возрастали, а даты схода снегового покрова смещались на более ранние. Вслед за повышением майских и июньских среднесуточных температур сдвинулся на более ранние сроки и прилет розовых чаек в дельту Лены. Положительный фенологический ответ на потепление, в частности более ранний прилет, – широко распространенная реакция, отмечаемая у многих видов птиц в последние 2–3 десятилетия в Северном полушарии (Parmesan, Yohe, 2003; Jonsén et al., 2006; Gunnarsson, Tómasson, 2011; Weiser et al., 2017 и др.).
Некоторые авторы полагают, что сроки появления розовых чаек в местах размножения характеризуются относительным постоянством (Андреев, Кондратьев, 1981; Андреев, 1985; Дегтярев и др., 1987). На Колыму розовые чайки прилетают раньше и действительно в 1978–1982 гг., несмотря на разные погодные условия, разброс дат их появления, был относительно небольшой – 10 дней (22–31.05, в среднем 26.05 ± 3.3 дня, медиана 26.05, n = 5) (Андреев, 1985). В дельте Лены вид появляется на 10–12 дней позже, а разброс между крайними датами существенно больше – 27 дней. Вероятно, такая разница обусловлена тем, что дельта Лены располагается более чем на 1200 км дальше долины Колымы на пути весеннего пролета вида, идущего в северной Якутии в западном направлении. Согласно полученным нами данным, весенняя фенология прилёта розовой чайки в дельте Лены определяется температурным режимом и межсезонно варьирует в широких пределах. Колебания температурного режима влияют на ускорение или затормаживание соответствующих фенологических явлений. В годы с более низкими температурами в мае–начале июня чайки прилетают на места гнездования заметно позже, а продолжительность предгнездового периода увеличивается.
Зависимость величины кладки и размеров яиц от фенологии сезона. Степень приспособленности птиц к изменениям среды можно оценить через динамику основных параметров размножения – величину кладки, размеры яиц, успешность инкубации и выводкового периода. Учитывая тенденцию продолжающегося роста температур воздуха в весенний и летний периоды, можно было бы ожидать наличие сходной тенденции и в репродуктивных показателях. Однако на наших данных это выявить не удалось.
В дельте Лены для розовой чайки характерна максимальная амплитуда межгодовых колебаний средней величины кладки – от 1.6 до 2.6 яиц. В колымских тундрах этот параметр варьировал в меньших пределах – от 2.2 до 2.7 яиц (Андреев, 1985; Кречмар и др., 1991), в Хромо-Индигирском междуречье в 1978 и 1979 гг. – 2.0 ± 0.1 и 2.1 ± ± 0.1 яиц (Зубакин, Авданин, 1983, расчет наш). Район наших работ расположен на 2°–5° севернее указанных регионов, соответственно погодные условия в весенний период здесь могут быть менее благоприятны для вида, а их влияние может проявляться более резко. Задержка начала размножения при неблагоприятных условиях приводит к увеличению количества полных кладок с 1–2 яйцами и, соответственно, снижению среднего значения этого показателя в целом для местной популяции.
Средние показатели продуктивности размножения группировки розовых чаек в дельте Лены за период наблюдений практически не изменились. Они были связаны с характером весенней погоды: динамикой локальных температур воздуха предгнездового периода или июня в целом. Действительно, при более теплом предгнездовом периоде кладки розовых чаек в среднем крупнее, но устойчивого межсезонного тренда в районе наших исследований не прослеживается. На Колыме также отмечали значительное влияние температуры и даты схода снега на репродуктивный потенциал розовых чаек, в частности на динамику среднего размера кладки (Андреев, 1985). По наблюдениям А.В. Андреева (1985), в годы с ранней и дружной весной и более высокими температурами в третьей декаде мая средний размер кладки возрастал. В дельте Лены майские температуры не оказывают столь сильного влияния, что очевидно объясняется более поздним прилетом и более поздним началом размножения птиц в районе наших работ. Хотя на репродуктивный потенциал вида в дельте Лены и на Колыме оказывают влияние температурные условия разных периодов, понятно что важна конкретная ситуация непосредственно в короткий период, предшествующий началу гнездования.
Величина кладок розовых чаек в дельте Лены отрицательно зависит от сроков начала гнездования. При низких температурах предгнездового сезона и июня в целом пары позже приступали к откладке яиц, а их кладки в среднем были меньше. Вероятно, такая зависимость обусловлена дефицитом корма, обилие и доступность которого в холодные сезоны гораздо ниже, чем в норме, из-за задержки схода снега, ограничивающего активность беспозвоночных (Андреев, 1985; Meltofte et al., 2007). Поскольку формирование яиц у розовых чаек происходит непосредственно на местах гнездования, на основе местных кормовых ресурсов, при низких температурах в предгнездовой сезон бóльшая часть полученной энергии идет на поддержания физиологических потребностей организма. Среди чайковых сходные закономерности были обнаружены у моевок (Rissa tridactyla) в арктических районах (Murphy et al., 1991; Gaston et al., 2005; Moe et al., 2009), хотя в умеренной зоне, например в Шотландии, эта тенденция уже не проявлялась (Frederiksen et al., 2004).
В ряде исследований в отношении воробьиных птиц было показано, что более высокие весенние температуры приводят к более раннему началу гнездования, но не влияют на размер кладки (Winkler et al., 2002; Weatherhead, 2005). В то же время у гусеобразных и некоторых морских птиц локальные температуры оказались, напротив, положительно связаны с величиной кладки (Dickey et al., 2008; Moe et al., 2009; van Oudenhove et al., 2014; Layton-Matthews et al., 2019). У ряда видов куликов, для большинства которых в норме характерны 4 яйца в кладке, в годы с низкими температурами и, соответственно, более поздним началом гнездования, увеличивается доля кладок с тремя и двумя яйцами (Weiser et al., 2018). Отмечаемые исследователями различные реакции на неблагоприятные погодные условия в период формирования кладки для разных групп птиц обусловлены, вероятно, комплексом факторов. В том числе весом снесенных яиц относительной веса самки и, соответственно количеством энергии, инвестируемой ею в формирование яиц. В годы с неблагоприятными погодными условиями наблюдается дефицит доступных кормов, и часть энергии, получаемой при кормлении, тратится самками не на формирование яиц, а на поддержание собственной терморегуляции. Ограничения в доступности кормов может привести либо к сокращению количества яиц, либо в уменьшении их размеров. Чем кладка “дороже” для самки, тем ярче проявляется зависимость между факторами среды и величиной кладки.
Размеры яиц. Данных относительно влияния погодных условий, в частности даты схода снега, в свою очередь сильно скоррелированной с температурой воздуха, на размеры яиц в литературе мало, и они противоречивы (Sandercock et al., 1999; Meltofte et al., 2007; Martin et al., 2018; Weiser et al., 2018). Для гусеобразных и хищных птиц в неблагоприятные годы, в первую очередь, отмечают сокращение величины кладки. Для ржанкообразных, имеющих детерминированную кладку из трех (чайки) или четырех (бекасовые, ржанковые) яиц, предполагают сокращение размеров яиц (Meltofte et al., 2007; Martin et al., 2018), вероятно, компенсирующее энергетические затраты родителей в неблагоприятных для размножения условиях. Но только у небольшой части исследованных видов этой группы подобную тенденцию удалось подтвердить (Liebezeit et al., 2014; Weiser et al., 2017, 2018). У розовых чаек в холодные затяжные сезоны проявляются обе тенденции – снижается и величина кладок, и размеры яиц. Уменьшение размеров яиц, скорее всего, связано с физиологической реакцией организма на неблагоприятные погодные условия и ограниченную доступность кормовых ресурсов. Сокращение величины кладки может происходить и в результате частичного разорения гнезд, поскольку насиживающая птица вынуждена тратить больше времени на поиск корма, так как в условиях его дефицита ей приходится улетать на более дальние дистанции от гнездового участка. В некоторых работах продемонстрировано, что в годы с низким обилием добычи родители менее активно и агрессивно защищают гнезда и выводки от хищников (Newton, 1998; Smith, Wilson, 2010), что в конечном счете влияет на результативность размножения.
Изменение климата и реакция птиц, пластичность фенологии, адаптация к нестабильным условиям. Хотя температура гнездового сезона в дельте Лены с 1980 г. возрастает, и это приводит к более раннему прилету розовых чаек, но смещения сроков начала гнездования на более ранние у вида не обнаружено. По нашему мнению это связано с тем, что амплитуда межгодовых изменений имеет более широкий размах, чем многолетний тренд. Изучение фенологии гнездования двух видов морских птиц на Шпицбергене – моевки и люрика (Alle alle) – показало противоположные реакции на увеличение температуры воздуха и более раннее начало весны. Если у люриков смещение сроков начала гнездования на более ранние даты происходило параллельно климатическим и погодным изменениям, то моевки в тот же период стали гнездиться достоверно позже (Moe et al., 2009). Разная реакция на потепление может наблюдаться не только у разных видов в одном регионе, но и у одного и того же вида на разных широтах. Например, в Канаде у толстоклювой кайры (Uria lomvia) в низких широтах гнездовой сезон сдвигается в соответствии с изменением климата, а в высокоартических районах этого не происходит (Gaston et al., 2005, 2009). Ряд исследований показывают, что потепление климата ведет как к более раннему началу гнездования у некоторых видов (Catharacta maccormicki, Fratercula cirrhata, Sterna paradisaea, Uria lomvia), так и к его отсрочке на более поздние даты у других (Daption capense, Fulmarus glacialis, Pygoscelis adeliae, Rissa tridactyla, Uria aalge), или отсутствию выраженных изменений (Aptenodytes forsteri, Fratercula arctica, Fulmarus glacialis, Pagodroma nivea, Ptychoramphus aleuticus) (Gjerdrum et al., 2003; Abraham, Sydeman, 2004; Frederiksen et al., 2004; Durant et al., 2004; Gaston et al., 2005, 2009; Barbraud, Weimerskirch, 2006; Møller et al., 2006; Moe et al., 2009; Reed et al., 2009; Wanless et al., 2009). Разная реакция на современные климатические изменения у видов со сходной экологией может свидетельствовать о наличии во многих случаях более существенных факторов, помимо климатических.
Согласно данным наблюдений за большой синицей (Parus major) в Великобритании, за полвека средняя дата начала откладки яиц сдвинулась на более ранние сроки примерно на 14 дней (Charmantier et al., 2008). Этот сдвиг практически соответствует сдвигу в фенологии выплода гусениц – основного корма для птенцов этого вида. Основываясь на оценках наследуемости дат откладки яиц и силе отбора, влияющего на этот параметр, авторы показали, что, если бы наблюдаемый сдвиг был обусловлен только эволюционной адаптацией, ему бы потребовалось в 4 раз больше времени. Следовательно, фенологическая пластичность может быть лучшим способом справиться с изменениями окружающей среды, поскольку она позволяет быстрее реагировать на новые условия.
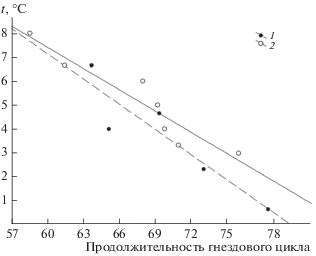
Особенно важна высокая фенологическая пластичность в нестабильных условиях арктических регионов, где, несмотря на заметный рост температур в период гнездования, условия сезонов могут изменяться в широком диапазоне и непредсказуемо. Продолжительность периода с положительными температурами в дельте Лены составляет в среднем 109 дней, при успешном гнездовании розовым чайкам требуется на гнездовой цикл, от момента прилета до откочевки молодняка, 60–70 дней. В целом у вида даже в затяжные холодные сезоны, когда погодные условия не позволяют начать рано гнездиться, существует потенциальный запас времени для завершения успешного цикла размножения. При этом в холодные сезоны с низкими температурами в предгнездовой и инкубационный периоды существенно удлиняется гнездовой цикл, как по нашим данным (r = –0.95, p < 0.001, n = 7), так и по более ранним публикациям (Андреев, 1985, r = –0.92, p < 0.02, n = 5, расчет наш) (рис. 8). Ограничения на возможность реализации этого потенциала накладывает, скорее всего, дефицит корма – мелких беспозвоночных, малоактивных при низких температурах. Уменьшение величины кладки и объема яиц вероятно является компенсирующим механизмом, позволяет сократить продолжительность инкубации и, соответственно, затраты на теплопродукцию.
Рис. 8.
Зависимость продолжительности гнездового цикла у розовых чаек от температур предгнездового и инкубационного периодов* в колымских тундрах (1) и дельте реки Лены (2). * для Колымы период с 20.05 по 10.07, для дельты реки Лены с 01.06 по 20.07.
В заключение можно отметить, что, несмотря на выраженный рост температур и более ранний прилет розовых чаек, пока не наблюдается устойчивых тенденций в изменении репродуктивных показателей вида. Закономерности флуктуации сроков начала гнездования, динамики величины кладки и размеров яиц обусловлены динамикой локальных условий среды, в первую очередь температурами воздуха в конкретный сезон. В более теплые сезоны прослеживается рост величины кладки и объема яиц, сдвигается на более ранние даты начало гнездования, однако межгодовые вариации этих параметров колеблются в очень широких пределах и устойчивого межсезонного тренда пока не прослеживается. За счет фенотипической пластичности розовые чайки пока вполне успешно приспосабливаются к изменениям климата и широкой амплитуде колебаний погодных условий в арктических районах северной Якутии. При сохранении в дальнейшем тенденции потепления климата в Арктике возможны более заметные изменения в экологии размножения и распространении вида.
Список литературы
Андреев А.В., 1985. Успех размножения розовой чайки Rhodostethia rosea (McGill.) в Нижнеколымской тундре и определяющие его факторы // Редкие и исчезающие птицы Дальнего Востока. Владивосток. С. 110–131.
Андреев А.В., Кондратьев А.Я., 1981. Новые данные по биологии розовой чайки (Rhodostethia rosea) // Зоологический журнал. Т. 60. № 3. С. 418–425.
Артемьев А.В., 2013. Влияние изменений климата на экологию мухоловки-пеструшки Ficedula hypoleuca в Карелии // Экология. Т. 44. № 3. С. 221–229.
Волков С.В., Гринченко О.С., Свиридова Т.В., 2013. Сроки прилета серого журавля (Grus grus) в северном Подмосковье и их связь с погодными и климатическими факторами // Зоологический журнал. Т. 92. № 7. С. 834–840. https://doi.org/10.7868/s0044513413070155
Головнюк В.В., Соловьев М.Ю., Поповкина А.Б., 2017. Многолетний мониторинг птиц наземных экосистем на Таймыре // Динамика численности птиц в наземных ландшафтах. М. С. 87–91.
Дегтярев А.Г., Лабутин Ю.В., Блохин Ю.Ю., 1987. Розовая чайка: данные о миграциях и особенностях репродуктивного цикла у границ ареала // Зоологический журнал. Т. 66. С. 1873–1886.
Зубакин В.А., Авданин В.О., 1983. Особенности колониального гнездования розовой чайки (Rhodostethia rosea) // Зоологический журнал. Т. 62. № 11. С. 1754–1756.
Зубакин В.А., Кищинский А.А., Флинт В.Е., Авданин В.О., 1988. Розовая чайка // Птицы СССР. Чайковые. М.: Наука. С. 244–257.
Кречмар А.В., Андреев А.В., Кондратьев А.Я., 1991. Птицы северных равнин. Л.: Наука. 288 с.
Перфильева В.И., 1985. Растительность // Растительный и животный мир дельты реки Лены. Якутск. С. 49–78.
Поздняков В.И., 2006. Розовая чайка (Rhodostethia rosea) в дельте р. Лена // Бутурлинский сборник: Материалы II Международных Бутурлинских чтений. Ульяновск. С. 100–117.
Соколов Л.В., 2010. Климат в жизни растений и животных. СПб.: Изд-во “Тесса”. 344 с.
Соловьев М.Ю., Поповкина А.Б., Головнюк В.В., 2012. Некоторые результаты многолетнего мониторинга популяций куликов на таймыре // Бутурлинский сборник: Материалы IV Международных Бутурлинских чтений. Ульяновск. С. 268–276.
Шариков А.В., Волков С.В., Свиридова Т.В., Буслаков В.В., 2019. Влияние трофического и погодно-климатического факторов на динамику численности птиц-миофагов в местах их размножения // Зоологический журнал. Т. 98. С. 203–213. http://dx.doi.org/10.1134/s0044513419020144
Юдин К.А., Фирсова Л.В., 2002. Rhodostethia rosea – Розовая чайка // Фауна России и сопредельных стран. Птицы. Т. II. Вып. 2. Ч. 1. Поморники семейства Stercorariidae и чайки подсемейства Larinae. С. 511–528.
Abraham C.L., Sydeman W.J., 2004. Ocean climate, euphausiids and auklet nesting: inter-annual trends and variation in phenology, diet and growth of a planktivorous seabird, Ptychoramphus aleuticus // Marine Ecology Progress Series. V. 274. P. 235–250.
Barbraud C, Weimerskirch H., 2006. Antarctic birds breed later in response to climate change // Proceedings of the National Academy of Sciences USA. V. 103. P. 6248–6251.
Berteaux D., Humphries M.M., Krebs C.J., Lima M., McAdam A.G., Pettorelli N. et al., 2006. Constraints to projecting the effects of climate change on mammals // Climate Research. V. 32. P. 151–158.
Both Ch., 2010. Food availability, mistiming, and climatic change // Effects of climate change on birds. Oxword. P. 129–147.
Burger J., Gochfeld M., Garcia, E.F.J., 2018. Ross’s Gull (Rhodostethia rosea). In: del Hoyo J., Elliott A., Sargatal J., Christie D.A., de Juana E. (eds). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (retrieved from https://www.hbw.com/node/54007 on 10 February 2018)
Charmantier A., McCleery R.H., Cole L.R., Perrins C.M., Kruuk L.E.B., Sheldon B.C., 2008. Adaptive phenotypic plasticity in response to climate change in a wild bird population // Science. V. 320. P. 800–803.
Cohen J., Screen J. A., Furtado J.C., Barlow M., Whittleston D., Coumou D. et al., 2014. Recent Arctic amplification and extreme mid-latitude weather // Nature Geoscience. V. 7. P. 627–637.
Dickey M.H., Gauthier G., Cadieux M.C., 2008. Climatic effects on the breeding phenology and reproductive success of an arctic-nesting goose species // Global Change Biology. V. 14. P. 1973–1985.
Durant J.M., Anker-Nilssen T., Hjermann D.Ø., Stenseth N.C., 2004. Regime shifts in the breeding of an Atlantic puffin population // Ecology Letters. V. 7. P. 388–394.
Frederiksen M., Harris M.P., Daunt F., Rothery P., Wanless S., 2004. Scale-dependent climate signals drive breeding phenology of three seabird species // Global Change Biology. V. 10. P. 1214–1221.
Fufachev I.A., Ehrich D., Sokolova N.A., Sokolov V.A., Sokolov A.A., 2019. Flexibility in a changing arctic food web: Can rough-legged buzzards cope with changing small rodent communities? // Global Change Biology. P. 1–11. https://doi.org/10.1111/gcb.14790
Gaston A.J., Gilchrist H.G., Hipfner J.M., 2005. Climate change, ice conditions and reproduction in an Arctic nesting marine bird: Brünnich’s guillemot (Uria lomvia L.) // Journal Animal Ecology. V. 74. P. 832–841.
Gaston A.J., Gilchrist H.G., Mallory M.L., Smith P.A., 2009. Changes in seasonal events, peak food availability, and consequent breeding adjustment in a marine bird: a case of progressive mismatching // Condor. V. 111. P. 111–119.
Gilg O., Andreev A., Aebischer A., Kondratyev A., Sokolov A., Dixon A., 2016. Satellite tracking of Ross’s Gull Rhodostethia rosea in the Arctic Ocean // Journal Ornithology. V. 157. P. 249–253.
Gjerdrum C., Vallee A.M.J., St Clair C.C., Betram D.F., Ryder J.L., Blackburn G.S., 2003. Tufted puffin reproduction reveals ocean climate variability // Proceedings of the National Academy of Sciences USA. V. 100. P. 9377–9382.
Governali F.C., Gates H.R., Lanctot R.B., Holmes R.T., 2012. Egg volume can be accurately and efficiently estimated from linear dimensions for Arctic-breeding shorebirds // Wader Study Group Bulletin. V. 119. P. 46–51.
Gunnarsson T.G., Tómasson G., 2011. Flexibility in spring arrival of migratory birds at northern latitudes under rapid temperature changes // Bird Study. V. 58. P. 1–12.
Newton I., 1998. Population Limitation in Birds. London: Academic Press. 597 p.
Jonsén N., Lindén A., Ergon T., Knudsen E., Vik J.O., Rubolini D., et al., 2006. Rapid advance of spring arrival dates in long-distance migratory birds // Science. V. 312. P. 1959–1961.
Kwon E., English W.B., Weiser E.L., Franks S.E., Hodkinson D.J., Lank D.B., Sandercock B.K., 2018. Delayed egg-laying and shortened incubation duration of Arctic-breeding shorebirds coincide with climate cooling // Ecology and Evolution. V. 8. P. 1339–1351.
Kwon E., Weiser E.L., Lanctot R.B., Brown S.C., Gates H.R., Gilchrist G., Kendall S.J. et al., 2019. Geographic variation in the intensity of warming and phenological mismatch between Arctic shorebirds and invertebrates // Ecological Monographs. e01383. https://doi.org/10.1002/ecm.1383
Lameris T.K., Scholten I., Bauer S., Cobben M.M.P., Ens B.J., Nolet B.A., 2017. Potential for an Arctic-breeding migratory bird to adjust spring migration phenology to Arctic amplification // Global Change Biology. P. 1–11. https://doi.org/10.1111/gcb.13684
Lameris T.K., van der Jeugd H.P., Eichhorn G., Dokter A.M., Bouten W., Boom M.P., Litvin K.E., Ens B.J., Nolet B.A., 2018. Arctic geese tune migration to a warming climate but still suffer from a phenological mismatch // Current Biology. V. 28. P. 1–7.
Layton-Matthews K., Hansen B.B., Grøtan V., Fuglei E., Loonen M.J.J.E., 2019. Contrasting consequences of climate change for migratory geese: predation, density dependence and carryover effects offset benefits of high-arctic warming // Global Change Biology. https://doi.org/10.1111/gcb.14773
Liebezeit J.R., Gurney K.E.B., Budde M., Zack S., Ward D., 2014. Phenological advancement in arctic bird species: relative importance of snow melt and ecological factors // Polar Biology. V. 37. P. 1309–1320.
Martin J.L., Smith P.A., Béchet A., Daufresne T., 2018. Late snowmelt can result in smaller eggs in Arctic shorebirds // Polar Biology. V. 41. P. 2289–2295.
Meltofte H., Piersma T., Boyd H., MacCaffery B., Ganter B., Golovnyuk V.V. et al., 2007. A circumpolar review of the effects of climate variation on the breeding ecology of arctic shorebirds // Meddelelser om Grpnland Bioscience. V. 59. P. 1–48.
Moe B., Stempniewicz L., Jakubas D., Angelier F., Chastel O., Dinessen F., et al., 2009. Climate change and phenological responses of two seabird species breeding in the high-Arctic // Marine Ecology Progress Series. V. 393. P. 235–246.
Møller A.P., Flensted-Jensen E., Mardal W., 2006. Rapidly advancing laying date in a seabird and the changing advantage of early reproduction // Journal Animal Ecology. V. 75. P. 657–665.
Murphy E.C., Springer A.M., Roseneau D.G., 1991. High annual variability in reproductive success of kittiwakes (Rissa tridactyla L.) at a colony in western Alaska // Journal Animal Ecology. V. 60. P. 515–534.
Newton I., 1998. Population Limitation in Birds. London: Academic Press. 597 p.
NOAA Climate Prediction Center. [Электронный ресурс]. Режим доступа: http://www.cpc.ncep.noaa.gov. Дата обновления: 05.09.2019.
Parmesan C., Yohe G., 2003. A globally coherent fingerprint of climate change impacts across natural systems // Nature. V. 421. P. 37–42.
Reed T.E., Warzybok P., Wilson A.J., Bradley R.W., Wanless S., Sydeman W.J., 2009. Timing is everything: flexible phenology and shifting selection in a colonial seabird // Journal Animal Ecology. V. 78. P. 376–387.
Sandercock B.K., Lank D.B., Cooke F., 1999. Seasonal declines in the fecundity of arctic-breeding sandpipers: different tactics in two species with an invariant clutch size // Journal Avian Biology. V. 30. P. 460–468.
Smith P.A., Wilson S., 2010. Intraseasonal patterns in shorebird nest survival are related to nest age and defence behaviour // Oecologia. V. 163. P. 613–624.
Stenseth N.C., Mysterud A., Ottersen G., Hurrell J.W., Chan K.S., Lima M. 2002. Ecological effects of climate fluctuations // Science. V. 297. P. 1292–1296.
van Gils J.A., Lisovski S., Lok T., Meissner W., Ożarowska A., de Fouw J. et al., 2016. Body shrinkage due to Arctic warming reduces red knot fitness in tropical wintering range // Science. V. 352. P. 819–821. https://doi.org/10.1126/science.aad6351
van Oudenhove L., Gauthier G., Lebreton J.D., 2014. Year-round effects of climate on demographic parameters of an arctic-nesting goose species // Journal Animal Ecology. V. 83. P. 1322–1333.
Wanless S., Frederiksen M., Walton J., Harris M.P., 2009. Long-term changes in breeding phenology at two seabird colonies in the western North Sea // Ibis. V. 151. P. 274–285.
Weatherhead P.J., 2005. Effects of climate variation on timing of nesting, reproductive success, and offspring sex ratios of red-winged blackbirds // Oecologia. V. 144. P. 168–175.
Weiser E.L., Brown S.C., Lanctot R.B., Gates H.R., Abraham K., Bentzen R.L. et al., 2017. Life-history tradeoffs revealed by seasonal declines in reproductive traits of 21 species of Arctic-breeding shorebirds // Journal Avian Biology. V. 49. https://doi.org/10.1111/jav.01531
Weiser E.L., Brown S.C., Lanctot R.B., Gates H.R., Abraham K., Bentzen R.L. et al., 2018. Effects of environmental conditions on reproductive effort and nest success of Arctic-breeding shorebirds // Ibis. V. 160. P. 608–623.
Winkler D.W., Dunn P.O., McCulloch C.E., 2002. Predicting the effects of climate change on avian life-history traits // Proceedings of the National Academy of Sciences USA. V. 99. P. 13 595–13 599.
Zalakevicius M., Bartkeviciene G., Raudonikis L., Janulaitis J., 2006. Spring arrival response to climate change in birds: a case study from eastern Europe // Journal Ornithology. V. 147. P. 326–343.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


