Зоологический журнал, 2021, T. 100, № 10, стр. 1110-1123
Морфологическая изменчивость бархатниц Aphantopus hyperantus и Erebia ligea (Lepidoptera, Satyridae) в аллопатрических и аллохронных микропопуляциях
Е. Ю. Захарова a, *, А. О. Шкурихин a
a Институт экологии растений и животных Уральского отделения РАН
620144 Екатеринбург, Россия
* E-mail: zakharova@ipae.uran.ru
Поступила в редакцию 20.09.2020
После доработки 19.01.2021
Принята к публикации 20.01.2021
Аннотация
Проанализирована изменчивость морфологических признаков (форма и размер переднего крыла, расположение, диаметр и число глазчатых пятен в субмаргинальной полосе крылового рисунка) двух видов дневных чешуекрылых семейства Satyridae: Aphantopus hyperantus (Linnaeus 1758) и Erebia ligea (Linnaeus 1758), обитающих совместно на одних и тех же участках в Свердловской области. Предполагалось, что при обитании на незначительно удаленных (около 10 км) друг от друга, но объединенных общей сетью коридоров (дороги, просеки) участках в пределах одного лесного массива микропопуляции моновольтинного вида-генералиста (A. hyperantus) изолированы слабо и фенотипически однородны, в то время как микропопуляции бициклического вида-специалиста (E. ligea) изолированы в большей степени и, соответственно, сильнее фенотипически дифференцированы. При анализе изменчивости морфологических признаков использовали методы фенетики, традиционной и геометрической морфометрии. У обоих видов между изученными микропопуляциями были обнаружены значимые различия по форме и размерам крыла, а также по расположению и стабильности проявления глазчатых пятен в крыловом рисунке. Как и ожидалось, изоляция микропопуляций временем и расстоянием привела к формообразованию у E. ligea. Исходная гипотеза об однородности популяции A. hyperantus на обследованной территории не подтвердилась. Оказалось, что изоляция расстоянием также оказывается достаточной, если вид проявляет значительную степень оседлости.
К настоящему времени совершенно очевидно, что угрозой существованию всего биоразнообразия, в том числе разнообразия насекомых, является утрата естественной среды обитания вследствие хозяйственной деятельности человека. Процессы, связанные с вырубкой лесов, увеличением посевных площадей и урбанизацией приводят к деградации и фрагментации ландшафтов (Habel et al., 2019; Cardoso et al., 2020 и др.). На условия, когда пригодные для обитания участки оказываются в значительной степени изолированы, разные группы насекомых реагируют по-разному: одни существуют в виде локальных популяций (Poniatowski et al., 2018), другие, например, хорошо перемещающиеся и склонные к расселению чешуекрылые, образуют метапопуляции (Sutcliffe et al., 1997; Hanski, 1999; Powney et al., 2012; Viljur, Teder, 2018 и др.). При обитании в условиях фрагментированной среды для насекомых, в том числе чешуекрылых, резко возрастает роль “коридоров” для расселения, т.е. ландшафтных структур, способствующих перемещению организмов между подходящими участками, окруженными непригодными для обитания биотопами (Gutzwiller, 2002).
Различные аспекты экологии и пространственного распределения дневных чешуекрылых (Rhopalocera) как на популяционном уровне, так и на уровне сообществ достаточно подробно изучены, особенно на территории Европы. Так, при расселении видов по “коридорам” значительное влияние оказывают как характер окружающих биотопов, например типы почв и растительных сообществ, условия влажности и т.д. (Viljur, Teder, 2018), так и характеристики самих коридоров (Grill et al., 2020; Habel et al., 2020). Виды-генералисты и виды-специалисты по-разному используют коридоры для расселения: первые более охотно проникают в них и активно по ним перемещаются, вторые – менее активны и более чувствительны к различным параметрам, таким как наличие цветущих растений или флористический состав луговых сообществ (Habel et al., 2020).
В данной статье мы анализируем изменчивость морфологических признаков двух видов дневных чешуекрылых семейства Satyridae: Aphantopus hyperantus (Linnaeus 1758) и Erebia ligea (Linnaeus 1758), обитающих совместно на одних и тех же участках в пределах предлесостепных сосново-березовых лесов на юге Свердловской обл. Цель наших исследований заключается в тестировании гипотезы о том, что при обитании на открытых участках, незначительно удаленных друг от друга в пределах одного лесного массива и объединенных общей сетью коридоров (дороги, просеки), микропопуляции моновольтинного вида-генералиста (A. hyperantus) изолированы слабо и фенотипически однородны. Микропопуляции бициклического вида-специалиста (E. ligea), вероятно, изолированы в большей степени и соответственно сильнее фенотипически дифференцированы.
Мы анализируем изменчивость формы и размера переднего крыла, а также расположения, диаметра и числа глазчатых пятен в субмаргинальной полосе крылового рисунка. Выбранные признаки различны по выполняемым функциям и степени фенотипической изменчивости.
Форма крыла обусловливает характер полета и связанные с ним поведенческие акты, такие как поиск половых партнеров, избегание хищников, расселение в поисках кормовых растений и т.д. Наиболее удобными и адекватными методами изучения изменчивости формы крыла чешуекрылых являются методы геометрической морфометрии, которые позволяют решать различные задачи в эволюционном и экологическом контексте (Breuker et al., 2010; Sanzana et al., 2013; Шкурихин, Ослина, 2016; Jugovic et al., 2018; Paučulova et al., 2018 и др.).
Крыловой рисунок чешуекрылых является одной из наиболее подробно изученных морфологических систем с точки зрения генетики, биологии развития и эволюционных представлений (Beldade, Peralta, 2017; Sekimura, Nijhout, 2017; Marcus, 2019 и др.). Известно, что глазчатые пятна выполняют коммуникативные функции, а также служат для отпугивания хищников и отвлечения их внимания на край крыла, повреждение которого наименее опасно для жизни особи (Kodandaramaiah, 2011). Как было показано в ряде работ, анализ изменчивости размеров глазчатых пятен в комплексе с другими характеристиками, например, особенностями их расположения на крыле, позволяет достаточно полно описать изменчивость популяции (Cassel-Lundhagen et al., 2009, 2020).
МАТЕРИАЛ И МЕТОДЫ
Характеристика территории
Территория, на которой мы проводили исследования, расположена в окрестностях биостанции Уральского федерального университета (УрФУ) вблизи междуречья Исети и Сысерти (Сысертский р-н Свердловской обл.) (рис. 1). К началу 21 века лесные массивы междуречья Исети и Сысерти были подвержены значительным антропогенным нагрузкам: рекреация, сбор ягод и грибов, выпас скота, выборочные рубки. На основе расчета индекса синантропизации показано, что большая часть лесов была либо умеренно, либо сильно нарушена (Мухин и др., 2003). За прошедшие с начала века два десятилетия антропогенная трансформация сообществ усилилась в значительной степени. Во-первых, происходит активная застройка населенных пунктов. Во-вторых, увеличивается рекреационная нагрузка на лесные массивы из-за вытаптывания, сбора ягод и грибов, отдыха горожан в окрестностях водохранилища на р. Сысерть. В то же время, такие виды деятельности как выпас скота и сенокошение практически прекращены.
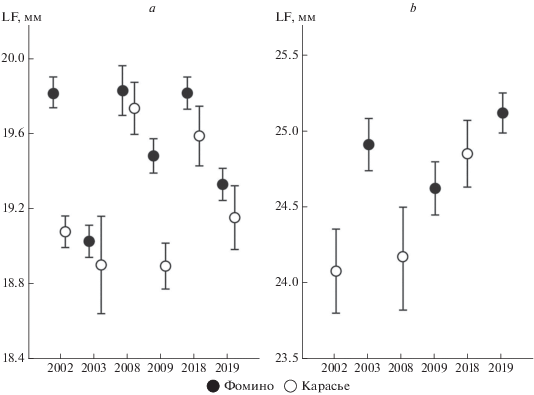
Рис. 1.
Карта района исследований на территории Сысертского р-на Свердловской обл. Участки отлова Aphantopus hyperantus и Erebia ligea: 1 – Фомино, 2 – Карасье. Примеры “коридоров” и их расположение на карте: а – просека, b – асфальтовая дорога, c – грунтовая дорога.
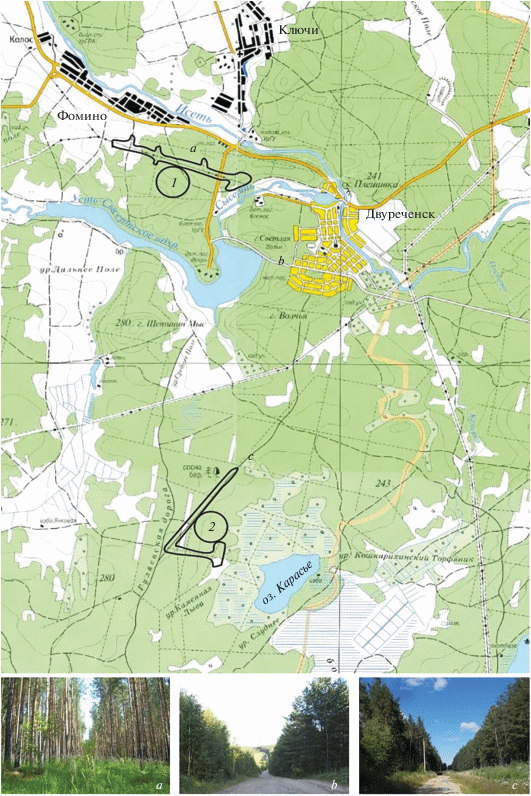
Мы проводили отлов чешуекрылых на двух участках, удаленных друг от друга на расстояние около 10 км (рис. 1). Первый участок – “Фомино” – представляет собой вытянутую полосу (около 1.5–2 км) открытого пространства вдоль линии электропередач, опушки сосняка и просеки, расходящиеся в глубь леса на 200–300 м. Юго-восточный конец участка упирается в берег р. Сысерть и представляет собой пойменный луг. Несмотря на наличие реки, данный участок является более сухим по сравнению со вторым, расположенным южнее, в окрестностях оз. Карасье. Второй участок – “Карасье” также имеет протяженность около 1.5 км, расположен вдоль грунтовой лесной дороги, и заканчивается влажным разнотравно-злаковым лугом на сильно заболоченном берегу озера. Между данными участками нет значительных барьеров, существует разветвленная сеть коридоров в виде просек (рис. 1a) и дорог различного типа (рис. 1b, 1c).
Характеристика видов чешуекрылых
Aphantopus hyperantus (Linnaeus 1758) – широко распространенный лугово-лесной транспалеарктический вид (van Swaay et al., 2006; Settele et al., 2008; Gorbunov, Kosterin, 2007). Типичный вид-генералист. Спектр предпочитаемых биотопов весьма широк – открытые пространства (суходольные, разнотравные, злаковые, влажные и другие типы лугов), поляны и опушки лиственных и смешанных лесов, кромки болот и т.д. В значительной степени толерантен к антропогенной нагрузке, заселяет различные агроландшафты, лесополосы, искусственные насаждения, парки, обочины полей и дорог (Saarinen et al., 2005; Valtonen, Saarinen, 2005; van Swaay et al., 2006; Адаховский, 2014; Roth et al., 2014 и др.), но несмотря на высокое обилие на пастбищах и сенокосах, предпочитает естественные луга (Saarinen, Jantunen, 2005).
Согласно данным литературы, A. hyperantus принято считать оседлым видом, для которого характерны мелкие, легко разграничивающиеся популяции (Pollard, Yates, 1993; Sutcliffe et al., 1997; Billeter et al., 2003). Так, при изучении фрагментированных, небольших по площади территорий показано, что большинство особей A. hyperantus (63–79%) не склонны к расселению и остаются на одном и том же участке, а радиус индивидуальной активности составляет в среднем около 178.7 ± ± 136.5 м у самцов и 175.3 ± 116.2 м у самок (Sutcliffe et al., 1997; Valtonen, Saarinen, 2005). Другими авторами (Billeter et al., 2003) при изучении метапопуляций A. hyperantus в условиях сильно фрагментированного ландшафта Швейцарии, где элементы условно естественных сообществ (берега дренажных каналов, живые изгороди и т.д.) окружены агроценозами, были получены аналогичные результаты. Доля оседлых резидентов на разных участках варьировала от 65 до 85%, доля мигрантов – от 7 до 20%; максимальное расстояние, преодоленное самцами, составляло 760 м, самками – 970 м (средний радиус индивидуальной активности 179 м). По-видимому, особенности расчлененности ландшафта и небольшой размер пригодных для обитания участков являются необходимыми условиями для формирования оседлых микропопуляций. В противном случае, в слабо фрагментированной среде, где особи вида могут легко найти необходимые ресурсы, они свободно перемещаются, не задерживаясь долго на одном участке (Горбач, 2012, 2014).
На всем пространстве ареала A. hyperantus – строго моновольтинный вид, гусеницы которого развиваются на различных Poaceae и зимуют в III или IV возрасте (Gorbunov, Kosterin, 2007; Рыжкова, Лопатина, 2016).
Изменчивость глазчатых пятен в крыловом рисунке A. hyperantus изучена ранее (Новоженов, 1989, 1997; Захарова, 1998; Zakharova, 2000; Горбач, 2012). Показано, что на переднем крыле их число может варьировать от 0 до 3. Как правило, в рисунке переднего крыла присутствуют 3 пятна (P2, P4, P5), иногда – 2 (P2, P4) или 1 (P2) (рис. 2a–2c). Особи с полным отсутствием пятен в популяциях редки, и частота их встречаемости не превышает 1% (Новоженов, 1997; Zakharova, 2000).
Рис. 2.
Передние крылья самцов A. hyperantus (a–c) и E. ligea (d–f): a – схема меток и промеров (1–15 – номера меток, LF – длина крыла); b – 2 пятна (P2, P4) в крыловом рисунке; c – 1 пятно (P2) в крыловом рисунке; d – схема промеров диаметров глазчатых пятен (P2, P3, P4, P5); e – 3 пятна (P2, P3, P5) в крыловом рисунке; f – 2 пятна (P2, P3) в крыловом рисунке.

Erebia ligea (Linnaeus 1758) – широко распространенный транспалеарктический вид-специалист, приуроченный к лесным местообитаниям, таким как опушки темнохвойных и смешанных лесов, просеки, поляны и обочины лесных дорог, а также к злаково-разнотравным и некоторым другим типам лугов (Schneider, Fry, 2001; van Swaay et al., 2006; Gorbunov, Kosterin, 2007). Показано, что спектр заселяемых биотопов и ширина экологической ниши E. ligea в 3 раза у́же, чем у A. hyperantus (Komonen et al., 2004), а чувствительность к антропогенной нагрузке выше (Saarinen, Jantunen, 2005; Адаховский, 2014). Недавние исследования поведения и склонности к перемещениям нескольких видов рода Erebia Dalman 1816, в том числе E. ligea, на территории одного из национальных парков Австрии показали, что дороги являются серьезным препятствием к их расселению. Несмотря на то, что имаго способны перелететь через любую широкую заасфальтированную дорогу, делают они это редко и неохотно (Grill et al., 2020).
Хорошо известно, что виды рода Erebia являются бициклическими или моновольтинными, но никогда не бывают поливольтинными (Warren, 1936). Согласно данным литературы, в жизненном цикле присутствуют две диапаузы (первая на стадии сформировавшейся гусеницы в яйце или только что отродившейся I возраста, вторая – на стадии гусеницы IV возраста).
Мы изучали закономерности вылета имаго и фенотипическую изменчивость крыльев E. ligea на выбранной нами территории – в окрестностях д. Фомино и оз. Карасье с 2001 г. Оказалось, что на первом участке (Фомино) чернушки летали только в нечетные годы (за исключением единичных имаго в 2016 г.), на втором участке (Карасье) – в четные (Захарова, Шкурихин, 2017). Таким образом, микропопуляции, обитающие на этих двух участках, оказались изолированы не только расстоянием, но и временем, благодаря асинхронному двухгодичному жизненному циклу. Такая изоляция, по-видимому, способствовала формированию двух морфологических форм, различающихся по местоположению фокусов глазчатых пятен в субмаргинальной полосе переднего крыла (Захарова, Шкурихин, 2017).
Закономерности изменчивости размеров имаго и глазчатых пятен крылового рисунка E. ligea описаны нами для Урала и сопредельных территорий (Захарова, 2008, 2010; Захарова, Татаринов, 2016). В рисунке переднего крыла число глазчатых пятен может варьировать от 2 до 4 (крайне редко – 5), наиболее часто встречающимся вариантом является наличие трех пятен (P2, P3, P5), последовательно расположенных в ячейках M1–M2, M2–M3, Cu1–Cu2 (рис. 2d–2 f).
Камеральная обработка материала
В данной работе мы использовали выборки самцов A. hyperantus и E. ligea. Моновольтинный вид A. hyperantus отлавливали синхронно на двух участках, бициклический E. ligea – в четные годы на Карасьем, в нечетные – на Фомино. Объемы и годы взятия выборок приведены в табл. 1. Все выборки хранятся в Музее Института экологии растений и животных УрО РАН (Екатеринбург).
Таблица 1.
Объем выборок самцов E. ligea и A. hyperantus с двух участков на территории Сысертского района Свердловской области
| Год | E. ligea, экз. | A. hyperantus, экз. | ||
|---|---|---|---|---|
| Карасье | Фомино | Карасье | Фомино | |
| 2002 | 12 | – | 57 | 60 |
| 2003 | – | 30 | 6 | 55 |
| 2008 | 8 | – | 21 | 23 |
| 2009 | – | 30 | 27 | 48 |
| 2018 | 19 | – | 16 | 55 |
| 2019 | – | 53 | 14 | 55 |
Изменчивость формы крыльев изучали методами геометрической морфометрии, позволяющими независимо анализировать изменчивость формы и размеров (Adams et al., 2004; Zelditch et al., 2004; Mitteroecker, Gunz, 2009). Отпрепарированные левые передние крылья фотографировали с вентральной стороны с помощью фотоаппарата Canon Eos 600D, высота и угол наклона которого были фиксированы с помощью штатива. В программе tpsDig 2.29 (Rolhf, 2017) на изображениях крыльев провели расстановку 15 меток (landmarks) согласно схеме на рис. 2a. Метки 1–6 расставляли по контуру медиальной ячейки, метки 7–14 – по контуру крыла. Поскольку для методов геометрической морфометрии должно выполняться требование об одинаковом наборе меток для каждого объекта, на пятна, имеющиеся на крыльях не у всех особей (P3, P4 и P5), метки не ставили. Меткой 15 маркировали положение фокуса (или центра при отсутствии фокуса) глазчатого пятна P2 в ячейке M1–M2. Только это пятно постоянно присутствует в крыловом рисунке всех особей обоих изучаемых видов.
Длину крыла (LF) измеряли между ландмарками 1–7 (рис. 2a) в программе tmorphgen6 пакета программ IMP (Sheets, 2003). Диаметры глазчатых пятен (P2, P3, P4, P5 – у E. ligea и P2, P4, P5 у A. hyperantus) измеряли в программе ImageJ 1.48v (Rasband, 2014), как показано на рис. 2d.
Статистические методы
При изучении изменчивости длины крыла использовали многофакторный дисперсионный анализ. Всего в модель включили три фактора: “вид”, “участок отлова”, “год отлова”. Выдвинутую гипотезу о большей изолированности популяций бициклического вида E. ligea по сравнению с моновольтинным видом A. hyperantus проверяли по статистической значимости взаимодействия факторов “вид” × “участок отлова”. Если взаимодействие факторов “вид” × “участок отлова” было статистически значимо, это означало, что у одного вида размах различий больше, чем у другого. Фактор “год отлова” введен в модель для оценки межгодовой изменчивости. Поскольку у E. ligea вылет имаго происходит в четные годы на одном участке, а в нечетные на другом, проанализировать взаимодействие фактора “год отлова” с двумя другими факторами в модели не представляется возможным. Вместо этого фактора “год отлова” анализировали как вложенный или гнездовой (Schielzeth, Nakagawa, 2013). Анализ изменчивости длины крыла (LF) проводили по-отдельности для каждого вида в программе Statistica 8.0 (Statsoft inc.).
Форму крыла изучали независимо по двум наборам ландмарок: первый набор (ландмарки 1–14) характеризует форму контура крыла и структуру его жилкования, второй набор (ландмарки 2, 5, 7, 10, 14, 15) характеризует положение пятна P2 на крыле. Согласно схеме нимфалоидного крылового рисунка (Schwanwitsch, 1924; Nijhout, 1990), глазчатые пятна расположены в виде полосы проксимальнее ряда парафокусных элементов, и местоположение одного из пятен (например, P2) отражает в общих чертах расположение всех пятен в рисунке.
Для каждого набора ландмарок провели процедуру прокрустовой суперимпозиции, в результате чего между всеми объектами были устранены различия, не связанные с формой (Zelditch et al., 2004; Васильев и др., 2018). Далее на основе полученных прокрустовых координат рассчитали значения частных деформаций, которые использовали в дальнейшем для статистических сравнений. Прокрустову суперимпозицию и расчет частных деформаций проводили в программе Past 4.02 (Hammer et al., 2001). Гипотезу о большей изолированности популяций E. ligea по сравнению с A. hyperantus проверяли при помощи многофакторного дисперсионного анализа. Дизайн модели полностью совпадает с описанным выше для размерных характеристик крыла. Различия заключаются в том, что анализ проводили по всей совокупности значений частных деформаций, т.е. форма представляет собой многомерный признак, поэтому использовали многофакторный MANOVA, а не ANOVA. В модели также исследуется влияние факторов “вид”, “участок отлова” и “год отлова”, а также взаимодействие факторов “вид” × “участок отлова”. Поскольку форма крыла является многомерным признаком, для подтверждения выдвинутой гипотезы статистической значимости взаимодействия факторов “вид” × “участок отлова” недостаточно. В геометрической морфометрии мерой различий двух форм является прокрустова дистанция (более детально: Zelditch et al., 2004; Васильев и др., 2018). Две формы могут по-разному отличаться друг от друга (например, наибольший вклад в различия могут вносить те или иные ландмарки), но при этом сумма различий, выраженная прокрустовой дистанцией, может быть одинаковой. Поэтому дополнительно в случае статистической значимости взаимодействия факторов “вид” × × “участок отлова” сравнивали масштаб различий между участками у обоих видов. Для этого в программе MorphoJ 1.06d (Klingenberg, 2011) были вычислены прокрустовы дистанции между выборками, собранными на разных участках, для каждого из видов, а затем сравнили набор прокрустовых дистанций E. ligea и A. hyperantus при помощи критерия Манна-Уитни. Для визуализации различий формы крыла между локалитетами по каждому из видов провели дискриминантный анализ в программе MorphoJ 1.06d.
Изменчивость глазчатых пятен крылового рисунка анализировали следующим образом. Во-первых, рассматривали глазчатые пятна в крыловом рисунке как дискретные неметрические признаки (фены), частоты их встречаемости сравнивали между выборками с помощью критерия χ2 Пирсона в программе Past 4.02. Во-вторых, анализировали изменчивость метрического признака “суммарный диаметр” пятен крылового рисунка, для чего использовали многофакторный дисперсионный анализ так же, как при анализе изменчивости длины крыла. Для A. hyperantus суммировали измерения диаметров пятен P2 + P4 + P5, для E. ligea – P2+P3+P4+P5. В-третьих, рассчитали значения индексов пятен (P2/LF, P4/LF, P5/LF – для A. hyperantus и P2/LF, P3/LF, P4/LF, P5/LF – для E. ligea), характеризующие размеры пятен относительно длины крыла. Статистическую значимость различий между выборками по комплексу индексов оценили независимо для каждого вида с помощью канонического дискриминантного анализа в программе Statistica 8.0 (Statsoft inc.). В качестве меры величины различий использовали квадрат дистанции Махаланобиса D2.
РЕЗУЛЬТАТЫ
Изменчивость длины крыла
Очевидно, что в отличие от массы тела, длина крыла не изменяется в течение жизни имаго (за исключением случаев механических повреждений) и при этом зависит от условий развития преимагинальных стадий. Мы предполагаем, что фактор доступности корма для видов-олигофагов, чьи гусеницы развиваются на злаках, не является лимитирующим и не меняется от года к году. Вероятнее всего, причиной межгодовых различий размеров являются погодные условия, в которых происходит развитие гусениц старших возрастов и их рост до окукливания. В эксперименте (Рыжкова, Лопатина, 2016) было показано, что увеличение температуры воздуха приводит к уменьшению размера особей A. hyperantus, что согласуется с “temperature-size rule” (Atkinson, 1994). В природных условиях сложно выявить степень влияния отдельных экологических факторов на конечные размеры имаго, поскольку все они действуют одновременно и во взаимодействии друг с другом. При проведении регрессионного анализа не обнаружено значимых зависимостей длины крыла от таких климатических показателей, как средняя температура мая, июня и количество осадков (мм) в эти месяцы за годы исследования (по данным для метеостанции 28 440 в г. Екатеринбурге из архива данных сайта “Погода и климат”). Возможно, при увеличении числа наблюдений связь между размерами имаго и параметрами погоды будет обнаружена.
На рис. 3 проиллюстрирована изменчивость длины крыла самцов обоих изучаемых видов. По результатам дисперсионного анализа значимым оказалось влияние всех трех факторов – “вид” (F = 3822.5, df = 1, p < 0.01), “участок отлова” (F = 25.7, df = 1, p < 0.01) и “год отлова” (F = 6.7, df = 14, p < 0.01), а взаимодействие “вид” × “участок отлова” – незначимым (F = 1.3, df = 1, p = 0.25). Как было показано ранее, межгодовые различия по размерам могут превышать географические (Захарова, Татаринов, 2016), однако для обоих видов обнаружено, что имаго из окрестностей Фомино в среднем крупнее, чем из окрестностей Карасьего. Средняя длина переднего крыла самцов A. hyperantus составляет 19.5 ± 0.1 (Фомино) и 19.2 ± 0.1 мм (Карасье), у E. ligea – 24.9 ± 0.1 (Фомино) и 24.5 ± 0.1 мм (Карасье). Поскольку взаимодействие факторов “вид” × × “участок отлова” оказалось незначимым, можно заключить, что по размерам крыла популяции бархатниц из двух близкорасположенных локалитетов различаются в равной степени.
Изменчивость формы крыла и расположения ряда глазчатых пятен
По результатам дисперсионного анализа значений частных деформаций, характеризующих изменчивость формы контура крыла и медиальной ячейки, влияние всех факторов оказалось статистически значимым (табл. 2). Поскольку взаимодействие факторов “вид” × “участок отлова” также оказалось значимым, можно заключить, что различия по форме крыла между двумя участками отлова у A. hyperantus и E. ligea не совпадают. Средняя величина прокрустовой дистанции, характеризующая величину различий по форме крыла, между выборками из окрестностей Фомино и оз. Карасье у A. hyperantus составила 0.014, а у E. ligea – 0.018. Результаты теста Манна-Уитни (U = 77, p < 0.05) подтверждают, что по данному признаку имаго с разных участков отлова значимо сильнее различаются у E. ligea, чем у A. hyperantus.
Таблица 2.
Результаты трехфакторного дисперсионного анализа (MANOVA) изменчивости формы крыла A. hyperantus и E. ligea
| Эффект | λ Уилкса | d.f. 1 | d.f. 2 | p |
|---|---|---|---|---|
| “Вид” | 0.29 | 24 | 549 | <0.01 |
| “Участок отлова” | 0.92 | 24 | 549 | <0.01 |
| “Вид” × “Участок отлова” | 0.91 | 24 | 549 | <0.01 |
| “Год отлова” | 0.29 | 336 | 6706 | <0.01 |
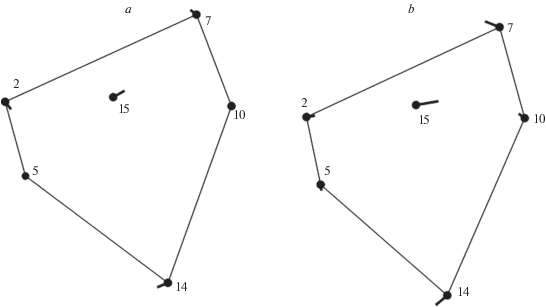
По результатам дисперсионного анализа значений частных деформаций, характеризующих изменчивость положения пятна P2 в субмаргинальной области крыла, влияние всех факторов оказалось статистически значимым (табл. 3). Взаимодействие факторов “вид” × “участок отлова” также оказалось значимым, следовательно, различия по положению пятна P2 на крыле у имаго, отловленных на двух разных участках, не совпадают у A. hyperantus и E. ligea. Как можно видеть из рис. 4, векторы смещения ландмарок совпадают по направлению у обоих изученных видов. У имаго обоих видов, отловленных в окрестностях оз. Карасье, пятно P2 и, следовательно, весь ряд пятен расположены ближе к внешнему краю крыла, чем у имаго, отловленных в окрестностях Фомино. Средняя величина различий между участками по положению пятна P2 на крыле, выраженная в прокрустовой дистанции, составила для A. hyperantus 0.021, а для E. ligea – 0.032. По результатам теста Манна–Уитни (U = 63.5, p < 0.05) выявлено, что по исследованному признаку выборки E. ligea с разных участков различаются сильнее, чем выборки A. hyperantus.
Таблица 3.
Результаты трехфакторного дисперсионного анализа (MANOVA) изменчивости положения пятна P2 в пределах маргинальной области крыла у A. hyperantus и E. ligea
| Эффект | λ Уилкса | d.f. 1 | d.f. 2 | p |
|---|---|---|---|---|
| “Вид” | 0.40 | 8 | 565 | <0.01 |
| “Участок отлова” | 0.88 | 8 | 565 | <0.01 |
| “Вид” × “Участок отлова” | 0.97 | 8 | 565 | 0.02 |
| “Год отлова” | 0.63 | 112 | 3974 | <0.01 |
Рис. 4.
Результаты дискриминантного анализа различий по положению пятна P2 в пределах маргинальной области крыла у A. hyperantus (a) и E. ligea (b). Точками показана усредненная конфигурация для каждого из видов, векторы смещения ландмарок иллюстрируют различия между усредненной конфигураций и конфигурацией, характеризующей крыло имаго из окрестностей оз. Карасье.
Изменчивость глазчатых пятен крылового рисунка
В изученных выборках у всех самцов A. hyperantus в крыловом рисунке присутствовало глазчатое пятно P2, а у самцов E. ligea – пятна P2 и P3. Остальные пятна (P4 и P5) обнаруживались с разной частотой (табл. 4). Оказалось, что в выборках A. hyperantus из Фомино пятна P4 и P5 встречались значимо чаще (для P4 χ2 = 20.1, df = 5, p = = 0.001, для P5 χ2 = 92.7, df = 5, p < 0.0001), чем в выборках из окрестностей Карасьего. В случае E. ligea различия между выборками с двух участков обнаружены только по частотам встречаемости пятна P4 (χ2 = 26.1, df = 2, p < 0.0001).
Таблица 4.
Средние значения (± ошибка среднего) диаметра (мм) и частота встречаемости дискретных пятен крылового рисунка у самцов E. ligea и A. hyperantus
| Вид | Участок | Год | P2 | P3 | P4 | P5 | Суммарный диаметр пятен | ||
|---|---|---|---|---|---|---|---|---|---|
| мм | мм | мм | % | мм | % | ||||
| E. ligea | Карасье | 2002 | 1.7 ± 0.1 | 1.8 ± 0.1 | – | 0.0 | 1.0 ± 0.1 | 91.7 | 4.4 ± 0.3 |
| 2008 | 1.8 ± 0.1 | 1.9 ± 0.1 | – | 0.0 | 1.1 ± 0.2 | 87.5 | 4.6 ± 0.4 | ||
| 2018 | 1.7 ± 0.1 | 1.8 ± 0.1 | 0.6 ± 0.4 | 5.3 | 1.1 ± 0.1 | 89.5 | 4.5 ± 0.3 | ||
| Фомино | 2003 | 1.9 ± 0.1 | 1.9 ± 0.1 | 1.4 ± 0.2 | 9.7 | 1.4 ± 0.1 | 93.5 | 5.2 ± 0.2 | |
| 2009 | 1.8 ± 0.1 | 1.8 ± 0.1 | 0.5 ± 0.2 | 10.0 | 1.1 ± 0.1 | 80.0 | 4.5 ± 0.2 | ||
| 2019 | 2.0 ± 0.1 | 1.9 ± 0.0 | 0.7 ± 0.1 | 17.0 | 1.3 ± 0.1 | 98.1 | 5.2 ± 0.2 | ||
| A. hyperantus | Карасье | 2002 | 1.8 ± 0.1 | – | 1.6 ± 0.1 | 78.9 | 1.1 ± 0.1 | 29.8 | 3.2 ± 0.2 |
| 2003 | 1.6 ± 0.1 | – | 1.7 ± 0.3 | 66.7 | 1.2 ± 0.3 | 33.3 | 3.0 ± 0.5 | ||
| 2008 | 1.9 ± 0.1 | – | 1.6 ± 0.1 | 90.5 | 0.8 ± 0.2 | 38.1 | 3.5 ± 0.3 | ||
| 2009 | 1.7 ± 0.1 | – | 1.6 ± 0.1 | 88.9 | 1.1 ± 0.1 | 55.6 | 3.6 ± 0.2 | ||
| 2018 | 1.7 ± 0.1 | – | 1.7 ± 0.2 | 81.3 | 0.9 ± 0.2 | 31.3 | 3.2 ± 0.3 | ||
| 2019 | 1.8 ± 0.1 | – | 1.5 ± 0.2 | 92.9 | 1.2 ± 0.2 | 35.7 | 3.6 ± 0.3 | ||
| Фомино | 2002 | 1.9 ± 0.1 | – | 1.5 ± 0.1 | 88.3 | 0.9 ± 0.1 | 45.0 | 3.6 ± 0.2 | |
| 2003 | 1.9 ± 0.1 | – | 1.6 ± 0.1 | 98.2 | 1.1 ± 0.1 | 63.6 | 4.0 ± 0.2 | ||
| 2008 | 1.8 ± 0.1 | – | 1.7 ± 0.1 | 91.3 | 1.0 ± 0.1 | 52.2 | 3.8 ± 0.2 | ||
| 2009 | 1.9 ± 0.1 | – | 1.8 ± 0.1 | 95.8 | 1.1 ± 0.1 | 70.8 | 4.3 ± 0.2 | ||
| 2018 | 2.0 ± 0.1 | – | 1.7 ± 0.1 | 98.2 | 1.0 ± 0.1 | 56.4 | 4.1 ± 0.2 | ||
| 2019 | 1.9 ± 0.1 | – | 1.8 ± 0.1 | 94.5 | 1.1 ± 0.1 | 67.3 | 4.2 ± 0.2 | ||
Результаты измерения диаметров всех глазчатых пятен рисунка переднего крыла обоих изучаемых видов приведены в табл. 4. Направление изменчивости размеров пятен совпадает с изменчивостью длины крыла: имаго обоих видов из Фомино имеют более крупные пятна в крыловом рисунке, чем имаго из окрестностей Карасьего. Различия между выборками самцов A. hyperantus по признаку “суммарный диаметр пятен рисунка” оценили с помощью результатов двухфакторного ANOVA: “участок отлова” (F = 19.3, df = 1, p < 0.0001), “год” (F = 2.5, df = 5, p = 0.03), их взаимодействие незначимо. При анализе выборок E. ligea по признаку “суммарный диаметр пятен рисунка” было обнаружено значимое влияние фактора “год” (F = 2.9, df = 5, p = 0.02).
Изменчивость относительных размеров глазчатых пятен в рисунке переднего крыла самцов двух видов оценили с помощью канонического дискриминантного анализа на основе рассчитанных индексов (отношение диаметра пятна к длине крыла). Полученные результаты проиллюстрированы на рис. 5. В наибольшей степени отличны от других выборки, которым соответствуют максимально удаленные друг от друга центроиды в пространстве канонических осей. Так, для A. hyperantus значимо различаются, например, выборки 2018 г. из Фомино и Карасьего (D 2 = 0.66, F = 2.72, p < 0.05). Тем не менее иногда хронографические различия между выборками из одного местообитания могут превышать географические (D 2(Фомино 2002 и Фомино 2009) = 0.92, F = 8.1, p < 0.0001; D 2(Фомино 2008 и Карасье 2008) = 0.38, F = 1.38, p = 0.2). Обнаруженная изменчивость во времени может объясняться целым рядом причин, в том числе различиями погодных условий разных лет, небольшими объемами выборок и их неоднородностью (отловом имаго в разные периоды лёта генерации). Известно, что фаза вылета имаго в ходе лёта генерации может вносить вклад в общую картину изменчивости метрических признаков крылового рисунка (Захарова, Татаринов, 2016). При сравнении обобщенных по годам выборок A. hyperantus из двух местообитаний мы получили следующий результат: λ Уилкса = 0.95, F = 7.00; df 1 = 3; df 2 = = 433; p < 0.0001.
Рис. 5.
Результаты канонического дискриминантного анализа изменчивости относительного размера глазчатых пятен в крыловом рисунке A. hyperantus (a) и E. ligea (b) из окрестностей Фомино и Карасьего. Приведены центроиды выборок с учетом величин стандартных ошибок.
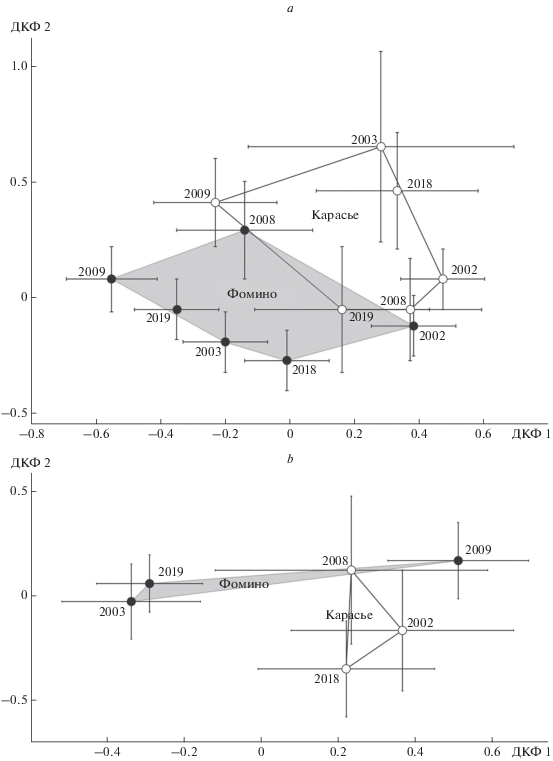
Результаты дискриминантного анализ комплекса индексов глазчатых пятен крылового рисунка E. ligea приведены на рис. 5b. Несмотря на то, что вдоль второй канонической оси, на которую приходится 16.1% дисперсии, есть тенденция к проявлению географических различий, они оказались статистически незначимы. Только для двух пар выборок D 2(Фомино 2003 и Фомино 2009) = 0.76, F = 2.8, p = 0.02; D 2(Фомино 2009 и Фомино 2019) = 0.66, F = 3.11, p = 0.02 обнаружены значимые различия.
ОБСУЖДЕНИЕ
Начиная изучение изменчивости морфологических признаков, мы предполагали, что при обитании на одной и той же территории в условиях фрагментированного ландшафта популяция A. hyperantus будет фенотипически однородна в отличие от популяции E. ligea. Такое предположение строилось на изложенных выше сведениях об особенностях экологии и жизненных циклов этих видов.
Исходное предположение о фенотипической однородности популяции A. hyperantus не подтвердилось. Анализ фенотипической изменчивости переднего крыла двух видов бархатниц методами традиционной и геометрической морфометрии позволил обнаружить значимые различия между микропопуляциями у обоих видов по всем изученным признакам (размеры, форма крыла, глазчатые пятна рисунка). По целому ряду проанализированных признаков различия между микропопуляциями оказались сонаправленными у обоих видов. Тем не менее степень фенотипической дифференциации у вида-специалиста E. ligea оказалась выше, чем у вида-генералиста A. hyperantus.
Имаго обоих видов из Фомино оказались крупнее по сравнению с имаго из окрестностей оз. Карасьего. На примере бархатницы Coenonympha oedippus (Fabricius 1787) было показано, что имаго из засушливых участков мельче, чем из более увлажненных (Jugovic et al., 2018). Согласно нашим результатам, наоборот, самцы A. hyperantus и E. ligea крупнее в более засушливом локалитете (Фомино), по сравнению с самцами этих видов из окрестностей оз. Карасьего. На наш взгляд, наиболее вероятно, что разная степень увлажненности сравниваемых участков оказывает опосредованное влияние на размеры чешуекрылых через кормовую базу гусениц, т.е. видовой состав злаков, их относительное обилие, объем фитомассы и т.д. Однако для проверки этого предположения необходимо проведение комплексного экологического исследования, максимально полно описывающего микроландшафтные, климатические и геоботанические особенности каждого из модельных участков отлова.
У имаго обоих видов из Фомино крупные глазчатые пятна смещены в сторону медиальной ячейки, тогда как у имаго из окрестностей оз. Карасьего мелкие глазчатые пятна расположены ближе к краю крыла. Кроме того, у особей с первого участка в целом больше пятен на переднем крыле из-за большей частоты встречаемости дискретных пятен (фенов P4 и P5) по сравнению с имаго со второго участка. Известно, что глазчатые пятна могут выполнять различные функции и в зависимости от этого могут подвергаться действию отбора в направлении уменьшения или увеличения размеров (Kodandaramaiah, 2011; Dapporto et al., 2018), а проявление дискретных пятен в крыловом рисунке обусловлено эпигенетическими причинами и носит пороговый характер (Brakefield, van Noordwijk, 1985; Захарова, 2010).
На данном этапе исследования однозначно объяснить причины и закономерности наблюдаемых морфологических различий затруднительно. Мы предполагаем, что обнаруженные нами различия между микропопуляциями, сохраняющиеся на протяжении относительно длительного периода времени (около 20 лет), свидетельствуют о синхронной реакции двух видов на действующие факторы среды и отбора. Поскольку морфологические различия наблюдаются в локальном пространственном масштабе (около 10 км между изучаемыми локалитетами), можно утверждать, что фрагментация среды обитания создает относительно эффективный изоляционный барьер для данных видов и существующей сети коридоров недостаточно для полного перемешивания особей из соседних микропопуляций. Тем не менее остается открытым вопрос, являются ли обнаруженные различия между микропопуляциями стабильными и каким-либо образом (генетически или эпигенетически) закрепленными, т.е. действительно ли произошла дифференциация микропопуляций, или же эти различия воспроизводятся из года в год как сходная фенотипическая реакция особей на развитие в сходных условиях среды в единой популяции, в пределах которой свободное перемещение особей затруднено.
Полученные нами результаты подтверждают предположение о большей изолированности популяций вида-специалиста E. ligea по сравнению с видом-генералистом A. hyperantus. Однако нами были исследованы всего два вида, и обнаруженные различия хотя и не противоречат выдвинутому предположению, могут объясняться случайностью. Для более строго подтверждения данного вывода необходимо исследовать большее количество пар видов генералист–специалист в различных группах дневных чешуекрылых.
ЗАКЛЮЧЕНИЕ
Таким образом, как по форме и размерам крыла, так и по расположению и стабильности проявления глазчатых пятен в крыловом рисунке можно выделить достаточно обособленные микропопуляции у обоих видов. Изоляция микропопуляций временем и расстоянием создает предпосылки к формообразованию, что наглядно показано на примере бициклического вида-специалиста E. ligea. Исходная гипотеза об однородности популяции моновольтинного вида-генералиста A. hyperantus на обследованной территории не подтвердилась. Оказалось, что изоляция расстоянием также оказывается достаточна, если вид проявляет значительную степень оседлости.
Список литературы
Адаховский Д.А., 2014. Экологическая характеристика дневных чешуекрылых (Lepidoptera, Rhopalocera) Удмуртии. Топический аспект // Вестник Удмуртского университета. Вып. 4. С. 44–55.
Васильев А.Г., Васильева И.А., Шкурихин А.О., 2018. Геометрическая морфометрия: от теории к практике. М.: Товарищество научных изданий КМК. 471 с.
Горбач В.В., 2012. Внутрипопуляционная изменчивость элементов рисунка на крыльях глазка цветочного Aphantopus hyperantus (Lepidoptera, Satyridae) // Ученые записки Петрозаводского государственного университета. № 6. С. 27–31.
Горбач В.В., 2014. Фауна и экология булавоусых чешуекрылых (Lepidoptera: Hesperioidea et Papilionoidea) Восточной Фенноскандии. Автореф. дис. … докт. биол. наук. Петрозаводск: Петрозаводский государственный университет. 47 с.
Захарова Е.Ю., 1998. Опыт использования спектров изменчивости для анализа гетерогенности природных популяций на примере Aphantopus hyperantus L. (Lepidoptera, Satyridae) // Беспозвоночные животные Южного Зауралья и сопредельных территорий. Материалы Всерос. конф., 14–16 апреля 1998 г. Курган: Изд-во Курганского ун-та. С. 146–148.
Захарова Е.Ю., 2008. Сезонная изменчивость крылового рисунка Erebia ligea L. (Lepidoptera: Satyridae) на Среднем Урале // Современные проблемы эволюции (сборник докладов): XXII Любищевские чтения. Т.2.: Секция экологии и биологии. Ульяновск: Ульяновский гос. пед. ун-т. С. 30–38.
Захарова Е.Ю., 2010. Сезонная изменчивость длины крыла и глазчатых пятен в популяциях Erebia ligea (L.) (Lepidoptera, Satyridae) на Среднем Урале // Энтомологическое обозрение. Т. 89. № 2. С. 320–332.
Захарова Е.Ю., Татаринов А.Г., 2016. Хроногеографический подход к анализу изменчивости бициклического вида Erebia ligea (L.) (Lepidoptera: Satyridae) на Урале // Сибирский экологический журнал. № 3. С. 322–332.
Захарова Е.Ю., Шкурихин А.О., 2017. Морфологическая изменчивость крыла Erebia ligea (Linnaeus, 1758) (Lepidoptera: Satyridae) в бициклических и моновольтинных популяциях на Урале // Евразиатский энтомологический журнал. Т. 16. Вып. 4. С. 344–352.
Мухин В.А., Третьякова А.С., Тептина А.Ю., Кутлунина Н.А., Зимницкая С.А., Гончарова Ю.В., Юдин М.М., Березина А.Я., 2003. Флора и растительность биологической станции Уральского государственного университета: учеб. пособие по летней полевой практике для студентов биол. фак. Екатеринбург: Изд-во Урал. ун-та. 132 с.
Новоженов Ю.И., 1989. Хронографическая изменчивость популяции // Журнал общей биологии. Т. 50. № 2. С. 171–183.
Новоженов Ю.И., 1997. Половой диморфизм полиморфизма окраски у некоторых видов насекомых // Журнал общей биологии. Т. 58. № 1. С. 26–43.
Погода и климат [электронный ресурс]. Режим доступа: http://www.pogodaiklimat.ru/weather.php?id= 28440. Дата обновления: 01.06.2020
Рыжкова М.В., Лопатина Е.Б., 2016. Сезонный цикл развития бабочки Aphantopus hyperantus (L.) (Lepidoptera, Nymphalidae: Satyrinae) в Ленинградской области // Энтомологическое обозрение. Т. 95. № 3. С. 449–472.
Шкурихин А.О., Ослина Т.С., 2016. Сезонная изменчивость переднего крыла поливольтинных белянок Pieris rapae L. и P. napi L. (Lepidoptera: Pieridae) в лесостепной зоне Южного Урала // Экология. № 3. С. 229–235.
Adams D.C., Rohlf F.J., Slice D.E., 2004. Geometric morphometrics: ten years of progress following the “revolution” // Italian Journal of Zoology. V. 71. P. 5–16.
Atkinson D., 1994. Temperature and organism size – a biological law for ectotherms? // Advances in Ecological Research. V. 25. P. 1–58.
Beldade P., Peralta C.M., 2017. Developmental and evolutionary mechanisms shaping butterfly eyespots// Current Opinion in Insect Science. V. 19. P. 22–29.
Billeter R., Sedivy I., Diekötter T., 2003. Distribution and dispersal patterns of the ringlet butterfly (Aphantopus hyperantus) in an agricultural landscape // Bulletin of the Geobotanical Institute ETH. V. 69, P. 45–55.
Brakefield P.M., van Noordwijk A.J., 1985. The genetics of spot pattern characters in the meadow brown butterfly Maniola jurtina (Lepidoptera: Satyrinae) // Heredity. V. 54. P. 275–284.
Breuker C.J., Gibbs M., van Dongen S., Merckx T., van Dyck H., 2010. The use of geometric morphometrics in studying butterfly wings in an evolutionary ecological context // Morphomrtrics for Nonmorphometricians. Berlin-Heidelberg: Springer-Verlag. P. 271–287.
Cassel-Lundhagen A., Tammaru T., Windig J.J., Ryrholm N., Nylin S., 2009. Are peripheral populations special? Congruent patterns in two butterfly species // Ecography. V. 32. P. 591–600.
Cassel-Lundhagen A., Schmitt T., Wahlberg N., Sarvašová L., Konvička M., Ryrholm N., Kaňuch P., 2020. Wing morphology of the butterfly Coenonympha arcania in Europe: Traces of both historical isolation in glacial refugia and current adaptation // Journal of Zoological Systematics and Evolutionary Research. V. 58. P. 929–943. https://doi.org/10.1111/jzs.12360
Cardoso P., Barton P.S., Birkhofer K., Chichorro F., Deacon C. et al., 2020. Scientists’ warning to humanity on insect extinctions // Biological Conservation. V. 242. 108426. https://doi.org/10.1016/j.biocon.2020.108426
Dapporto L., Hardy P.B., Dennis R.L.H., 2018. Evidence for adaptive constraints on size of marginal wing spots in the grayling butterfly, Hipparchia semele // Biological Journal of the Linnean Society. V. XX. P. 1–15
Gorbunov P., Kosterin O., 2007. The butterflies (Hesperioidea and Papilionoidea) of North Asia (Asian part of Russia) in nature. M.: Rodina & Fodio. V. 2. 408 p.
Grill A., Polic D., Guariento E., Fiedler K., 2020. Permeability of habitat edges for Ringlet butterflies (Lepidoptera, Nymphalidae, Erebia Dalman 1816) in an alpine landscape // Nota Lepidopterologica. V. 43. P. 29–41.
Gutzwiller K.J. (ed)., 2002. Applying landscape ecology in biological conservation. N.Y.: Springer Science+Business Media. 518 p.
Habel J.C., Trusch R., Schmitt T., Ochse M., Ulrich W., 2019. Long-term large-scale decline in relative abundances of butterfly and burnet moth species across south-western Germany // Sci. Rep. V. 9. 14921. https://doi.org/10.1038/s41598-019-51424-1
Habel J.C., Ulrich W., Schmitt T., 2020. Butterflies in corridors: quality matters for specialists // Insect Conservation and Diversity. V. 13. P. 91–98.
Hammer Ø., Harper D.A.T., Ryan P.D., 2001. PAST: Paleontological statistics software package for education and data analysis // Palaeontologia Electronica. V. 4. 9 p.
Hanski I., 1999. Metapopulation Ecology. N.Y.: Oxford University Press. 313 p.
Jugovic J., Zupan S., Bužan E., Čelik T., 2018. Variation in the morphology of the wings of the endangered grass-feeding butterfly Coenonympha oedippus (Lepidoptera: Nymphalidae) in response to contrasting habitats // European Journal of Entomology. V. 115. P. 339–353.
Klingenberg C.P., 2011. MorphoJ: an integrated software package for geometric morphometrics // Molecular Ecology Resources. V. 11. P. 353–357.
Kodandaramaiah U., 2011. The evolutionary significance of butterfly eyespots // Behavioural Ecology. V. 22. P. 1264– 1271.
Komonen A., Grapputo A., Kaitala V., Kotiaho J., Paivinen J., 2004. The role of niche breadth, resource availability and range position on the life history of butterflies // Oikos. V. 105. P. 41–54.
Marcus J.M., 2019. Evo-Devo of butterfly wing patterns // Evolutionary developmental biology. Nuno de la Rosa L., Müller G. (eds). Cham: Springer International Publishing. P. 1–14.
Mitteroecker P., Gunz P., 2009. Advances in geometric morphometrics // Evolutionary Biology. V. 36. P. 235–247.
Nijhout H.F., 1990. A comprehensive model for colour pattern formation in butterflies // Proceedings of The Royal Society of London. B. V. 239. P. 81–113.
Paučulova L., Dzurinka M., Semeláková M., Csanády A., Panigaj L., 2018. Phylogeography, genetic structure and wing pattern variation of Erebia pronoe (Esper, 1780) (Lepidoptera: Nymphalidae) in Europe // Zootaxa. V. 4441. № 2. P. 279–297.
Pollard E., Yates T.J., 1993. Monitoring butterflies for ecology and conservation. London: Chapman and Hall. 274 p.
Poniatowski D., Stuhldreher G., Löffler F., Fartmann T., 2018. Patch occupancy of grassland specialists: habitat quality matters more than habitat connectivity // Biological Conservation. V. 225. P. 237–244.
Powney G.D., Broaders L.K., Oliver T.H., 2012. Towards a measure of functional connectivity: local synchrony matches small scale movements in a woodland edge butterfly // Landscape Ecol. V. 27. P. 1109–1120.
Rasband W.S., 2014. ImageJ [electronic resource]. Режим доступа: http://imagej.nih.gov/ij/. Дата обновления: 02.08.2020
Rohlf F.J., 2017. TpsDig version 2.29 [electronic resource]. Режим доступа: https://life.bio.sunysb.edu/morph/. Дата обновления: 02.08.2020
Roth T., Strebel N., Amrhein V., 2014. Estimating unbiased phenological trends by adapting site-occupancy models // Ecology. V. 95. № 8. P. 2144–2154.
Saarinen K., Jantunen J., 2005. Grassland butterfly fauna under traditional animal husbandry: contrasts in diversity in mown meadows and grazed pastures // Biodiversity and Conservation. V. 14. P. 3201–3213.
Saarinen K., Valtonen A., Jantunen J., Saarnio S., 2005. Butterflies and diurnal moths along road verges: does road type affect diversity and abundance? // Biological Conservation. V. 123. P. 403–412.
Sanzana M.-J., Parra L.E., Sepúlveda-Zúňiga E., Benítez H.A., 2013. Latitudinal gradient effect on the wing geometry of Auca coctei (Guérin) (Lepidoptera, Nymphalidae) // Revista Brasileira de Entomologia. V. 57. № 4. P. 411–416.
Schielzeth H., Nakagawa S., 2013. Nested by design: model fitting and interpretation in a mixed model era // Methods in Ecology and Evolution. V. 4. P. 14–24.
Schneider C., Fry G., 2001. The influence of landscape grain size on butterfly diversity in grasslands // Journal of Insect Conservation. V. 5. P. 163–171.
Schwanwitsch B.N., 1924. On the groundplan of the wing pattern in nymphalids and certain other families of rhopalocerous Lepidoptera // Proc. Zool. Soc. London B. V. 34. P. 509–528.
Sekimura T., Nijhout H.F. (eds)., 2017. Diversity and evolution of butterfly wing patterns. An integrative approach. Singapore: Springer. 320 p.
Settele J., Kudrna O., Harpke A., Kühn I., van Swaay C. et al., 2008. Climatic risk atlas of European butterflies. Sofia-Moscow: Pensoft. 712 p.
Sheets H., 2003. IMP – Integrated Morphometrics Package [electronic resource]. Режим доступа: https:// www.animal-behaviour.de/imp/. Дата обновления: 17.06.2021
Sutcliffe O.L., Thomas C.D., Peggie D., 1997. Area-dependant migration by ringlet butterflies generates a mixture of patchy population and metapopulation attributes // Oecologia. V.109. P. 229–234.
Valtonen A., Saarinen K., 2005. A highway intersection as an alternative habitat for a meadow butterfly: effect of mowing, habitat geometry and roads on the ringlet (Aphantopus hyperantus) // Ann. Zool. Fennici. V. 42. P. 545–556.
Van Swaay C.A.M., Warren M.S., Lois G., 2006. Biotope use and trends of European butterflies // J. Insect Conserv. V. 10. P. 189–209.
Viljur M-L., Teder T., 2018. Disperse or die: Colonisation of transient open habitats in production forests is only weakly dispersal-limited in butterflies // Biological Conservation. V. 218. P. 32–40.
Warren B.C.S., 1936. Monograph of the genus Erebia. London: British museum of natural history. 407 p.
Zakharova E.Yu., 2000. Phenotypic variability of eyespots as homologous wing pattern elements in satyrs (Lepidoptera: Nymphalidae: Satyrinae) // Biodiversity and Dynamics of Ecosystems in North Eurasia. Section “Diversity of the fauna of North Eurasia” (August 21–26, 2000). V. 3, Part 1. Novosibirsk: IC&G. P. 113–115.
Zelditch M.L., Swiderski D.L., Sheets H.D., Fink W.L., 2004. Geometric morphometrics for biologist: a primer. N.Y.: Elsevier Acad. Press. 443 p.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал