Зоологический журнал, 2021, T. 100, № 2, стр. 123-133
Возрастная динамика гельминтофауны серебристых чаек (Larus argentatus) Кольского залива Баренцева моря
В. В. Куклин a, *, М. М. Куклина a
a Мурманский морской биологический институт РАН
183010 Мурманск, Россия
* E-mail: VV_Kuklin@mail.ru
Поступила в редакцию 25.11.2019
После доработки 19.12.2019
Принята к публикации 05.01.2020
Аннотация
Представлены результаты исследования возрастных изменений гельминтофауны серебристых чаек (Larus argentatus) в Кольском заливе Баренцева моря. Изучена фауна паразитических червей у нелетающих птенцов (15 видов) и взрослых птиц (20 видов) в июне, а также у слетков (22 вида) и взрослых птиц (13 видов) в сентябре. 9 видов гельминтов отмечены у всех групп птиц. У птенцов отсутствуют паразиты, циркулирующие в пресноводных экосистемах, а также виды, жизненные циклы которых реализуются в морских прибрежных экосистемах при участии в качестве промежуточных хозяев беспозвоночных с твердыми покровами. При этом для птенцов характерна инвазия некоторыми неспецифичными гельминтами, которые обычно паразитируют у других птиц, но не встречаются у взрослых чаек. У слетков, перешедших к самостоятельному питанию, отмечено наибольшее разнообразие гельминтофауны – в ее состав входят практически все виды, найденные у взрослых птиц, а также некоторые “детские” паразиты. В качестве наиболее вероятных причин обнаруженных различий выделены раздельный сбор кормов чайками-родителями для себя и для птенцов, низкая резистентность молодых птиц к инвазии неспецифичными гельминтами, различная эффективность добычи кормов слетками и взрослыми птицами и различная сезонная доступность некоторых пищевых объектов. Установлено, что на состав и динамику гельминтофауны чаек разного возраста определенное влияние может оказывать использование птицами пищевых отбросов.
Возрастная динамика гельминтофауны – один из важнейших аспектов экологической паразитологии, изучению которого уделяется пристальное внимание. Результаты исследований, охватывающих разные группы животных, неоднократно подтверждали, что их гельминтофауна с увеличением возраста претерпевает ряд закономерных изменений, обусловленных влиянием многих факторов – экологии питания молодых и взрослых особей, особенностей морфологии, физиологии и поведения животных разного возраста, физико-географических условий в районах размножения.
Ряд работ был посвящен анализу возрастных изменений паразитофауны северных морских птиц – толстоклювой кайры на Новой Земле (Марков, 1937), нескольких видов чаек и гаг на Восточном Мурмане (Белопольская, 1952; Куклин, 2013), обыкновенной гаги в Кандалакшском заливе Белого моря (Кулачкова, 1958), сизой чайки в Северной Норвегии (Bakke, 1972, 1985), серебристой чайки в Северной Атлантике (Threlfall, 1967, 1968). Выводы авторов в целом согласуются с классическими закономерностями – разнообразие гельминтофауны и значения количественных показателей заражения с возрастом хозяев увеличиваются, динамика состава паразитов напрямую зависит от различий в экологии птенцов и взрослых особей, а переход молодых птиц к самостоятельному питанию приводит к быстрому выравниванию практически всех параметров инвазии (Быховская-Павловская, 1962, 1967).
Большинство исследований проводилось в природных популяциях, а птицы для питания и выкармливания птенцов использовали традиционную кормовую базу. В последние же десятилетия в рационе многих морских птиц (прежде всего крупных чаек) заметно возросла доля пищевых отходов, причем не только у представителей из “городских популяций”, но и у тех, которые гнездятся на определенном отдалении от антропогенных ландшафтов – в частности, на островах Кольского залива (Горяев и др., 2011). Наряду с этим чайки продолжают добывать и потреблять корма в морских и в пресноводных биоценозах. Соответственно, птицы используют пищевые объекты как природного, так и антропогенного происхождения и для выкармливания потомства.
По этим причинам в районах гнездования серебристых чаек на островах Кольского залива в настоящее время сложилась уникальная комбинация экологических условий – относительно низкий уровень беспокойства, обширная и богато населенная литораль и близость урбанизированной территории. Указанные обстоятельства не могли не повлиять на экологию чаек в сезон размножения и, соответственно, не отразиться на возрастной динамике паразитофауны птиц.
Цель исследования – изучение возрастных изменений гельминтофауны серебристых чаек Кольского залива и анализ особенностей заражения птиц с учетом влияния экологических и сезонных факторов.
МАТЕРИАЛ И МЕТОДЫ
Материал был собран в северной части Кольского залива в гнездовых колониях серебристых чаек на островах Зеленый и Медвежий в июне и сентябре 2015 г. За указанный период обследовано 26 нелетающих птенцов 2–3-недельного возраста, 31 взрослая птица (22 – в июне, 9 – в сентябре) и 20 слетков. Камеральный анализ материала после его предварительной заморозки проводилась в лаборатории Мурманского морского биологического института.
Для вскрытия птиц и первичной обработки органов и тканей использовались общепринятые паразитологические методики (Дубинина, 1971; Галактионов и др., 1997). При обследовании содержимого пищеварительного тракта и желчного пузыря применялся метод последовательных “взмучиваний-сливов”, остальных органов – компрессорный способ (сдавливание тканей между двумя стеклами). Поиск и извлечение гельминтов проводились под бинокуляром “Leica EZ4D”.
Найденные трематоды, цестоды и скребни фиксировались 70% этанолом, впоследствии из них были изготовлены тотальные препараты, окрашенные муцикармином (Куклин, 2013а). Нематод фиксировали раствором Барбагалло, а перед определением просветляли в 10% растворе глицерина. Анализ морфологии гельминтов, необходимый для их идентификации, проведен с использованием светового микроскопа “МикМед-2”.
Для каждого из обнаруженных видов гельминтов определены количественные параметры заражения – экстенсивность инвазии (ЭИ) (отношение количества особей птиц, зараженных паразитом данного вида, к числу птиц в выборке) и индекс обилия (ИО) (отношение общего количества экземпляров гельминтов к общему количеству обследованных птиц). При статистической обработке результатов исследований использовались методы сравнения рассчитанных доверительных интервалов ЭИ и ИО на 5% уровне значимости, достоверность обнаруженных различий по ЭИ в разных группах птиц оценивалась по точному критерию Фишера (F). Для расчетов использована компьютерная программа Quantitative Parasitology 3.0 (Rozsa et al., 2000).
Проведен анализ содержимого желудков чаек и определена относительная встречаемость различных групп кормов. При расчете относительной встречаемости рассчитывалось отношение количества встреч данной группы кормов к сумме встреч всех групп кормов:
где n – количество встреч данной группы кормов, N – общее количество встреч всех групп кормов.РЕЗУЛЬТАТЫ
У серебристых чаек в районе проведения исследований обнаружено 27 видов гельминтов (11 – трематод, 10 – цестод, 5 – нематод, 1 – скребней). У нелетающих птенцов найдено 15 видов паразитических червей, у слетков – 22 вида, у взрослых птиц в июне – 20 видов, а в сентябре – 13 видов. Данные по видовому составу гельминтофауны и значения количественных параметров инвазии чаек представлены в табл. 1.
Таблица 1.
Состав гельминтофауны и показатели заражения серебристых чаек Кольского залива (2015 г.)
| Виды гельминтов | Нелетающие птенцы, июнь (n = 26) |
Взрослые птицы, июнь (n = 22) |
Слетки, сентябрь (n = 20) |
Взрослые птицы, сентябрь (n = 9) |
||||
|---|---|---|---|---|---|---|---|---|
| ЭИ, % | ИО, экз. | ЭИ, % | ИО, экз. | ЭИ, % | ИО, экз. | ЭИ, % | ИО, экз. | |
| Trematoda | ||||||||
| Cryptocotyle lingua (Lühe 1899) |
61.54 (40.57–79.78) |
6.19 (3.08–14.38) |
59.09 (36.35–79.30) |
65.41 (10.00–203.32) |
75.00 (50.89–91.35) |
21.50 (9.30–63.20) |
77.78 (39.99–97.19) |
16.67 (3.22–38.67) |
| Cryptocotyle concavum (Creplin 1825) |
– | – | – | – | 5.00 (0.12–24.88) |
31.65 (0.00–94.95) |
– | – |
| Himasthla larina (Ishkulov et Kuklin 1998) |
23.08 (8.97–43.65) |
98.47 (49.6–221.0) |
31.82 (13.86–54.88) |
21.09 (4.73–75.36) |
85.00 (62.10–96.80) |
193.45 (60.15–471.45) |
77.78 (39.99–97.19) |
476.78 (108.56–1074.22) |
| Gymnophallus deliciosus (Olsson 1893) |
3.85 (0.09–19.64) |
0.08 (0.00–0.23) |
36.36 (17.19–59.35) |
6.82 (3.05–12.95) |
45.00 (23.05–68.48) |
17.05 (7.75–39.90) |
88.89 (51.75–99.72) |
20.22 (10.33–32.33) |
| Microphallus piriformes (Odhner 1905) Galaktionov 1983 |
7.69 (0.94–25.14) |
20.35 (0.00–58.54) |
31.82 (13.86–54.88) |
170.09 (43.55–452.68) |
65.00 (40.78–84.61) |
2335.60 (871.10–4632.45) |
66.67 (29.92–92.52) |
1136.89 (400.67–2682.67) |
| Microphallus pygmaeus (Levinsen 1881) Odhner 1905 |
3.85 (0.09–19.64) |
0.58 (0.00–1.73) |
– | – | – | – | – | – |
| Microphallus similis (Jaеgerskioеld 1900) |
– | – | 13.64 (2.90–34.92) |
0.77 (0.05–2.18) |
15.00 (3.20–37.90) |
30.70 (0.50–138.25) |
11.11 (0.28–48.25) |
39.00 (0.00–117.00) |
| Maritrema arenaria (Hadley et Castle 1940) |
– | – | 9.09 (1.12–29.17) |
0.45 (0.00–1.36) |
20.00 (5.73–43.67) |
0.55 (0.10–1.25) |
11.11 (0.28–48.25) |
0.78 (0.00–2.33) |
| Plagiorchis laricola (Skrjabin 1924) |
– | – | 13.64 (2.90–34.92) |
3.27 (0.05–10.41) |
5.00 (0.12–24.88) |
0.10 (0.00–0.30) |
– | – |
| Diplostomum indistinctum (Guberlet 1923) |
– | – | 13.64 (2.90–34.92) |
0.73 (0.05–3.18) |
15.00 (3.20–37.90) |
0.25 (0.00–0.55) |
– | – |
| Notocotylus sp. | – | – | – | 10.00 (1.23–31.70) |
0.25 (0.00–0.65) |
– | – | |
| Cestoda | ||||||||
| Alcataenia dominicana (Railiet, Henry 1912) |
– | – | 63.64 (40.65–82.81) |
32.45 (16.77–61.27) |
20.00 (5.73–43.67) |
11.95 (0.30–38.30) |
55.56 (21.20–86.31) |
11.67 (1.89–38.67) |
| Alcataenia larina (Krabbe 1869) |
50.00 (29.92–70.08) |
12.38 (6.15–24.81) |
13.64 (2.90–34.92) |
2.32 (0.05–7.77) |
15.00 (3.20–37.90) |
1.95 (0.45–4.80) |
– | – |
| Arctotaenia tetrabothrioides (Loennberg 1890) |
19.23 (6.55–39.36) |
15.35 (3.15–42.35) |
– | – | 5.00 (0.12–24.88) |
0.05 (0.00–0.15) |
– | – |
| Anomotaenia micracantha micracantha (Krabbe 1869) |
– | – | 4.55 (0.11–22.85) |
0.05 (0.00–0.14) |
– | – | – | – |
| Paricterotaenia porosa (Rudolphi 1810) |
– | – | 9.09 (1.12–29.17) |
0.32 (0.00–0.91) |
– | – | – | – |
| Microsomacanthus ductilis (Linton 1927) |
26.92 (11.57–47.79) |
149.23 (13.23–563.23) |
59.09 (36.35–79.30) |
53.50 (12.73–137.41) |
15.00 (3.20–37.90) |
1.35 (0.15–5.15) |
11.11 (0.28–48.25) |
0.44 (0.00–1.33) |
| Wardium cirrosa (Krabbe 1869) |
30.77 (14.32–51.79) |
7.69 (2.54–17.69) |
50.00 (28.22–71.78) |
99.55 (40.55–252.77) |
15.00 (3.20–37.90) |
25.65 (0.60–111.75) |
11.11 (0.28–48.25) |
0.11 (0.00–0.33) |
| Wardium fryei (Mayhew 1925) |
11.54 (2.44–30.16) |
0.58 (0.04–2.50) |
45.45 (24.38–67.79) |
10.32 (3.18–35.55) |
25.00 (8.65–49.11) |
63.95 (1.20–313.10) |
22.22 (2.81–60.01) |
138.89 (0.00–553.56) |
| Tetrabothrius erostris (Loennberg 1889) |
38.46 (20.22–59.43) |
3.15 (1.27–6.81) |
63.64 (40.65–82.81) |
4.73 (2.36–11.77) |
40.00 (19.11–63.95) |
3.45 (0.90–8.40) |
66.67 (29.92–92.52) |
11.11 (1.67–38.33) |
| Tetrabothrius cylindraceus (Rudolphi 1819) |
– | – | 9.09 (1.12–29.17) |
0.23 (0.00–0.82) |
15.00 (3.20–37.90) |
7.50 (0.15–29.80) |
22.22 (2.81–60.01) |
24.67 (0.00–60.44) |
| Nematoda | ||||||||
| Anisakis sp. l | – | – | 4.55 (0.11–22.85) |
0.05 (0.00–0.14) |
– | – | – | – |
| Paracuaria adunca (Creplin 1846) Anderson et Wong 1981 |
30.77 (14.32–51.79) |
1.92 (0.65–4.35) |
50.00 (28.22–71.78) |
3.23 (1.55–6.55) |
70.00 (45.72–88.11) |
8.20 (4.25–13.85) |
66.67 (29.92–92.52) |
5.44 (2.67–9.67) |
| Cosmocephalus obvelatus (Creplin 1825) |
– | – | – | – | 5.00 (0.12–24.88) |
0.05 (0.00–0.15) |
– | – |
| Stegophorus stellaepolaris (Parona 1901) |
19.23 (6.55–39.36) |
1.38 (0.42–3.19) |
4.55 (0.11–22.85) |
0.09 (0.00–0.27) |
15.00 (3.20–37.90) |
0.50 (0.00–1.20) |
– | – |
| Streptocara crassicauda (Creplin 1829) |
3.85 (0.09–19.64) |
0.08 (0.00–0.23) |
– | – | – | – | – | – |
| Acanthocephala | ||||||||
| Polymorphus phippsi (Kostylew 1922) |
15.38 (4.35–34.87) |
0.42 (0.08–1.38) |
– | – | 5.00 (0.12–24.88) |
0.05 (0.00–0.15) |
– | – |
9 видов гельминтов отмечены у всех групп птиц, и при этом значения ЭИ и ИО трематодами Cryptocotyle lingua и цестодами Tetrabothrius erostris не имеют статистически достоверных отличий. Исключительно у нелетающих птенцов зарегистрированы единичные случаи заражения трематодами Microphallus pygmaeus и нематодами Streptocara crassicauda. Кроме того, в гельминтофауне птиц этой группы, а также у слетков представлены ленточные черви Arctotaenia tetrabothrioides и скребни Polymorphus phippsi, которые отсутствуют у взрослых птиц. В то же время у птенцов в июне не обнаружено ряда паразитов, характерных для всех остальных групп птиц – трематод Microphallus similis и Maritrema arenaria, цестод Alcataenia dominicana и Tetrabothrius cylindraceus. Также для нелетающих птенцов характерны более низкие значения ЭИ трематодами Himasthla larina, Gymnophallus deliciosus и Microphallus piriformes по сравнению со слетками. Величины ЭИ двумя последними видами у птенцов оказались значительно ниже и по сравнению со взрослыми птицами из сентябрьской выборки.
При анализе ЭИ некоторыми видами гельминтов установлено, что в случаях незначительного перекрывания границ доверительных интервалов значение критерия Фишера показывает наличие достоверных различий. В частности, более высокой по сравнению с нелетающими птенцами оказалась ЭИ июньских взрослых птиц трематодами G. deliciosus (F = 0.00712), цестодами Microsomacanthus ductilis (F = 0.03948) и Wardium fryei (F = = 0.01115), слетков – нематодами Paracuaria adunca (F = 0.01632), взрослых птиц сентябрьской выборки – трематодами H. larina (F = 0.00603). В свою очередь, согласно значениям критерия Фишера, ЭИ цестодами Alcataenia larina у птенцов оказалась выше по сравнению со взрослыми птицами в июне (F = 0.01308) и по сравнению со слетками (F = 0.02723).
Инвазия цестодами Anomotaenia micracantha micracantha и Paricterotaenia porosa, а также нематодами Anisakis sp. отмечена только у взрослых птиц в июне, причем значения ЭИ и ИО указанными паразитами были невысокими. В свою очередь, заражение трематодами Cryptocotyle concavum, Notocotylus sp. и нематодами Cosmocephalus obvelatus (также при незначительных величинах ЭИ и ИО) зарегистрировано лишь у слетков. Статистически достоверные различия между взрослыми птицами июньской выборки и слетками отмечены для ЭИ трематодами H. larina – более высокой она оказалась у молодых птиц. Оценка по критерию Фишера показала, что у взрослых птиц в июне ЭИ отдельными видами цестод была выше, чем у слетков (при наличии перекрывания границ доверительных интервалов). Это относится к A. dominicana (F = 0.00584), M. ductilis (F = = 0.00456) и Wardium cirrosa (F = 0.02321).
При сравнении показателей заражения у слетков и взрослых птиц в сентябре не выявлено случаев полного расхождения границ доверительных интервалов ЭИ гельминтами, зарегистрированными в обеих группах чаек. Использование критерия Фишера позволило установить, что ЭИ трематодами G. deliciosus достоверно выше у взрослых птиц (F = 0.04317).
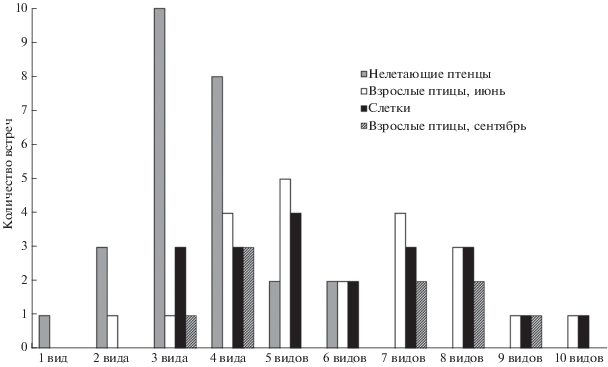
В ходе исследования не обнаружено птиц, свободных от заражения гельминтами. Моноивазия цестодами T. erostris отмечена у одного нелетающего птенца. Количество видов гельминтов у остальных особей чаек варьировало от 2 до 10, причем встречаемость того или иного числа видов паразитов в одной птице имела свои особенности в разных возрастных группах (рис. 1). Почти у каждой особи зарегистрированы присущие только ей видовые комплексы гельминтов, не найденные в таких сочетаниях у других экземпляров. Исключение составили лишь 4-видовой комплекс C. lingua + G. deliciosus + T. erostris + P. adunca, отмеченный у двух взрослых птиц в сентябре, а также 8-видовой комплекс C. lingua + H. larina + + G. deliciosus + M. piriformes + A. dominicana + + T. cylindraceus + W. fryei + P. adunca, зарегистрированный у одного слетка и у одной взрослой чайки из сентябрьской выборки.
Рис. 1.
Встречаемость различного числа видов гельминтов в тканях одной особи серебристой чайки (Кольский залив, 2015 г.).
По результатам анализа содержимого желудков птиц установлено, что в рационе чаек в июне доминировали полихеты, пищевые отходы, двустворчатые моллюски и рыба (табл. 2), а относительная доля этих групп кормов у птенцов и у взрослых птиц была примерно одинаковой. Встречаемость других объектов не превышала 10%. У слетков и взрослых птиц в сентябре в питании преобладали мидии, пищевые отходы и ягоды, но при этом у молодых чаек вдвое ниже была доля рыбных кормов, а у взрослых птиц не отмечены полихеты. В целом наибольшее разнообразие пищевого спектра было характерно для нелетающих птенцов, наименьшее – для взрослых птиц в сентябре. Но необходимо сделать оговорку, что объемы выборок птиц разных групп были неравными, и это обстоятельство могло повлиять на результаты обследования.
Таблица 2.
Состав и относительная встречаемость кормов (%) в желудках серебристых чаек Кольского залива (2015 г.)
| Группа кормов | Группы птиц | |||
|---|---|---|---|---|
| Нелетающие птенцы, июнь | Взрослые особи, июнь | Слетки, сентябрь |
Взрослые особи, сентябрь | |
| Рыба | 11.43 | 14.53 | 10.35 | 23.53 |
| Полихеты | 37.14 | 34.15 | 13.79 | – |
| Двустворчатые моллюски | 14.29 | 14.63 | 31.03 | 29.40 |
| Гастроподы | 5.71 | – | – | 11.77 |
| Ракообразные | 2.86 | 2.44 | – | – |
| Иглокожие | – | – | 3.45 | – |
| Птенцы других птиц | 5.71 | – | – | – |
| Мышевидные грызуны | – | 2.44 | – | – |
| Наземные членистоногие | 2.86 | 9.76 | 3.45 | – |
| Ягоды | – | – | 10.34 | 11.77 |
| Пищевые отходы | 20.00 | 21.95 | 27.59 | 23.53 |
ОБСУЖДЕНИЕ
Согласно полученным данным, состав гельминтофауны птенцов оказался менее разнообразным, чем у слетков и у взрослых птиц июньской выборки, а значения большинства количественных показателей их заражения были ниже по сравнению с аналогичными параметрами у птиц из указанных групп. В общем плане эти результаты соответствуют постулатам экологической паразитологии, описывающих закономерности возрастной динамики паразитофауны животных (Догель, 1962; Быховская-Павловская, 1967). Однако отдельные качественные и количественные особенности инвазии чаек разного возраста требуют более детального рассмотрения.
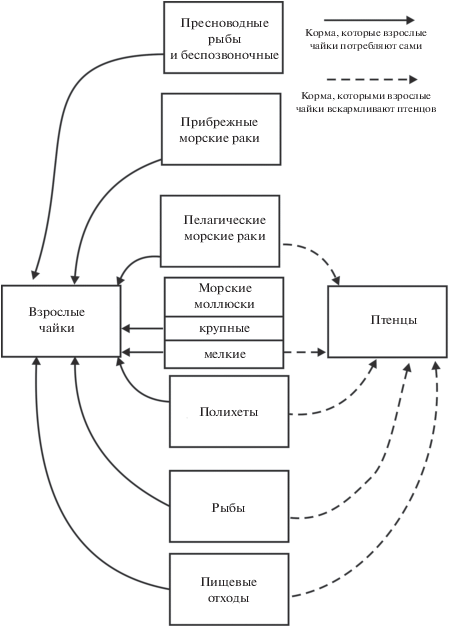
У птенцов, в отличие от взрослых птиц из июньской выборки, не обнаружено гельминтов, циркулирующих в пресноводных биоценозах (трематод Plagiorchis laricola и Diplostomum indistinctum, цестод P. porosa), а также морских форм, использующих в качестве промежуточных хозяев литоральных беспозвоночных – трематод M. similis (второй промежуточный хозяин – краб Hyas araneus) и M. arenaria (вторые промежуточные хозяева – усоногие раки Semibalanus balanoides, паратенические – гастроподы р. Nucella) (Успенская, 1963; McCarthy et al., 1999). Отсутствие этих паразитов и более низкие значения ЭИ и ИО трематодами, метацеркарии которых формируются в моллюсках (за исключением H. larina), по всей видимости, объясняются особенностями кормовой стратегии взрослых птиц, добывающих в этот период пищу и для себя, и для потомства (рис. 2). Серебристые чайки в течение первых 3–4 недель после вылупления птенцов вскармливают их в основном мягкой, калорийной и легко усваиваемой пищей, состав которой может варьировать в разных регионах в зависимости от доступности (Hillström et al., 1994; Nogales et al., 1995; Steenweg et al., 2011). Более того, появление птенцов служит своеобразным триггером для начала сбора именно такого корма, даже если в предшествующий период чайки предпочитали использовать другие объекты (Spaans, 1971; Pierotti, Annett, 1987). При этом взрослые птицы зачастую отдельно добывают пищу для себя и для птенцов в разных кормовых стациях (Nogales et al., 1995). Скорее всего, именно поэтому для птенцов характерно отсутствие пресноводных паразитов и более низкая зараженность гельминтами, у которых роль промежуточных хозяев играют морские животные с твердыми наружными покровами (крупные моллюски и ракообразные) – они используются лишь в качестве “прикорма”, за исключение мелких мидий. В то же время показатели ЭИ и ИО птенцов и взрослых птиц из июньской выборки паразитами, циркуляция которых проходит при участии морских и проходных рыб (трематодами C. lingua, цестодами T. erostris, нематодами P. adunca и, возможно, Stegophorus stellaepolaris) не имеют значимых различий. Из гельминтов этой группы в птенцах не обнаружены лишь цестоды T. cylindraceus и личинки нематод рода Anisakis, но их находки были единичными и у взрослых птиц.
Рис. 2.
Группы кормов, используемых взрослыми серебристыми чайками для самостоятельного потребления и для выкармливания птенцов (Кольский залив, 2015 г.).
Сложнее поддается трактовке характер заражения молодых и взрослых чаек в июне цестодами рода Wardium, пути циркуляции которых на Мурмане достоверно не установлены. Жизненные циклы видов, обнаруженных в ходе нашего исследования, в других регионах реализуются при участии аннелид (Бондаренко, 1997; Greben et al., 2019). В Кольском заливе в течение июня морские полихеты (главным образом Alitta virens) играют важную и примерно одинаковую роль в питании птиц всех возрастов (табл. 2), но данных об их зараженности личинками цестод в указанном районе нет.
Самыми труднообъяснимыми выглядят различия в зараженности птенцов и половозрелых птиц в июне ленточными червями рода Alcataenia. Промежуточные хозяева этих гельминтов в Баренцевом море неизвестны. В северной части Тихого океана цистицеркоиды A. larina были обнаружены у планктонных эвфаузиид Thysanoessa inermis (Shimazu, 1975), а в качестве промежуточных хозяев A. dominicana зарегистрированы литоральные амфиподы Traskorchestia ochotensis, Locustogammarus locustoides и Spinulogammarus ochotensis (Атрашкевич и др., 2005). Если в Баренцевоморском регионе циркуляция указанных цестод происходит по аналогичным схемам, то можно предположить, что при откорме птенцов их родители интенсивнее используют пелагических ракообразных, а прибрежных чаще потребляют сами. Косвенным подтверждением этого может служить более высокое значение ЭИ взрослых птиц гименолепидидами M. ductilis, у которых роль промежуточных хозяев играют литоральные гаммариды (Burt, Jarecka, 1984). При этом точная идентификация остатков ракообразных в желудках птиц часто крайне затруднена из-за их сильного измельчения и высокой скорости переваривания.
У нелетающих птенцов найдено 4 вида гельминтов, отсутствующих у взрослых птиц (см. “Результаты”). Наличие “детских” видов паразитов – одна из характерных черт птиц-полифагов, которая может быть обусловлена особенностями анатомии птенцов (в частности, наличием фабрициевой сумки) (Зехнов, 1947; Быховская-Павловская, 1953; Кириллов, Кириллова, 2013), резкими различиями в рационе молодых и взрослых птиц (Барышева, 1939; Соколова, 1959) или же неспособностью организма птенцов эффективно сопротивляться инвазии неспецифичными гельминтами ввиду недостаточного развития защитных реакций (Белопольская, 1952; Humphrey et al., 1978). Поскольку у птенцов чаек в ювенильных органах гельминтов обнаружено не было, а состав кормов не имел заметных отличий от такового у взрослых птиц, то наиболее вероятным представляется третий вариант трактовки полученных данных. Трематоды M. pygmaeus и скребни P. phippsi – обычные и широко распространенные паразиты обыкновенной гаги (Somateria mollissima), редко достигающие половозрелого состояния в других видах птиц (Белопольская, 1952; Галактионов и др., 1997; Куклин, Куклина, 2005). Специфичными хозяевами цестод A. tetrabothrioides служат различные виды куликов (Юрпалова, Коновалов, 1969; Спасская, Спасский, 1978; Пельгунов, 2019; Baer, 1956, 1962). При этом половозрелые экземпляры этих червей были обнаружены у бургомистров (Larus hyperboreus) на Шпицбергене (Куклин, Куклина, 2005), что может служить подтверждением способности паразитов развиваться в неспецифичных хозяевах, резистентность которых ослаблена. Для нематод S. crassicauda характерен широкий круг окончательных хозяев, и их отсутствие у других групп чаек, по-видимому, не связано с возрастными особенностями инвазии птиц.
Гельминтофауна слетков чаек оказалась наиболее богатой (табл. 1). Общее разнообразие паразитов самостоятельно питающихся молодых птиц в сентябре во многом идентично таковому у взрослых особей из июньской выборки, а значимые различия количественных параметров инвазии зарегистрированы лишь для 4 видов. Повышение зараженности слетков трематодами H. larina, очевидно, связано с увеличением в их рационе относительной доли мидий (табл. 2) – вторых промежуточных хозяев указанных гельминтов (Ишкулов, Куклин, 1998). Более низкие значения ЭИ молодых птиц в сентябре цестодами A. dominicana, M. ductilis и W. cirrosa, по всей видимости, объясняется недостаточным развитием у слетков техники добычи подвижных беспозвоночных, которые играют роль промежуточных хозяев этих паразитов (Verbeek, 1977). Кроме того, некоторые объекты становятся менее доступными – в частности, полихеты, у которых к этому времени заканчивается сезон размножения, сопровождающийся их массовым всплытием в верхние слои воды (Chatelain et al., 2008). В то же время у слетков зарегистрированы и единичные случаи заражения “детскими” гельминтами – A. tetrabothrioides и P. phippsi. Возможно, к сентябрю птицы еще не успевают полностью освободиться от долгоживущих взрослых стадий этих паразитов.
Небольшой объем выборки по взрослым серебристым чайкам в сентябре (птицы в это время уже практически не посещают гнездовые территории) затрудняет корректную трактовку данных в плане анализа гельминтофауны молодых и половозрелых особей перед отлетом на зимовку. Однако необходимо отметить высокую ЭИ взрослых чаек в сентябре трематодами G. deliciosus по сравнению и со слетками, и с обеими возрастными группами птиц в июне. Видимо, это объясняется тем, что в осенний период чайки не совершают протяженных перелетов, концентрируясь и добывая корм в основном в узкой прибрежной полосе. Соответственно, возрастает интенсивность потребления птицами литоральных кормов, в том числе и двустворчатых моллюсков – промежуточных хозяев гимнофаллид (Lauckner, 1983).
О том, каким образом на гельминтофауне птиц сказывается потребление ими пищевых отбросов, пока можно сделать лишь предварительные выводы. Пищевые отбросы, как правило, не содержат инвазионных стадий паразитов, которые могут развиваться в чайках (за исключением некоторых отходов первичной обработки свежей рыбы). Поэтому их использование напрямую не влияет на разнообразие гельминтофауны птиц, хотя может отражаться на значениях количественных показателей инвазии отдельными видами паразитов. В то же время при дефиците природных морских кормов в Кольском заливе доступность пищевых отходов на окрестных свалках освобождает взрослых чаек от необходимости добывать пищу для птенцов, например, в пресноводных биоценозах. Этот нюанс может иметь важное значение для объяснения отсутствия у них паразитов с пресноводными жизненными циклами.
Возможно также, что использование пищевых отбросов влияет на химическую среду и активность микрофлоры в желудочно-кишечном тракте птиц. Согласно результатам ряда наблюдений, птенцы, в рационе которых высока доля пищевых отходов, растут медленнее и умирают чаще, чем те, которых родители выкармливают природными кормами – возможно, из-за углеводно-белкового дисбаланса (Pierotti, Annett, 1987, 1990, 1991; Noordhuis, Spaans, 1992). Ослабление организма птенцов при такой диете может способствовать успешному развитию в них неспецифичных паразитов. Но для точного ответа на это вопрос нужны детальные биохимические исследования.
ЗАКЛЮЧЕНИЕ
Птенцы серебристых чаек в гнездовых колониях островов Кольского залива в течение не менее 50 дней с момента вылупления в плане питания полностью зависимы от родителей. Следствием этого можно считать тот факт, что птенцы и взрослые чайки имеют 11 общих видов паразитов. Однако в составе гельминтофауны взрослых птиц и нелетающих птенцов имеются и заметные качественные различия. Для птенцов характерны практически полное отсутствие паразитов с пресноводными жизненными циклами, а также низкая зараженность гельминтами, циркулирующими в прибрежных морских экосистемах и использующих в качестве промежуточных хозяев относительно крупных беспозвоночных с твердыми наружными покровами. В то же время у птенцов отмечена инвазия некоторыми паразитами, которые не встречаются у взрослых чаек, но являются обычными компонентами гельминтофауны других птиц (гаг и куликов). Основные причины обнаруженных различий – раздельный сбор кормов взрослыми чайками для себя и для птенцов и слабое развитие иммунной системы молодых птиц. Возможно, что опосредованное влияние на инвазию чаек разных возрастных групп оказывает и использование птицами пищевых отходов. Такая кормовая стратегия, с одной стороны, исключает возможность заражения птенцов многими гельминтами, с другой – вызывает нарушения в физиологии молодых птиц и ослабляет их устойчивость к неспецифичным паразитам.
Переход слетков к самостоятельному питанию приводит к тому, что видовой состав их гельминтофауны становится практически идентичным таковому у взрослых чаек – 17 общих видов со взрослыми птицами из июньской выборки и 13 со взрослыми птицами из сентябрьской выборки. При этом они не успевают полностью освободиться от инвазии некоторыми “детскими” гельминтами. Как следствие, для слетков характерно наибольшее разнообразие паразитов. У молодых птиц по сравнению со взрослыми отмечены высокие значения количественных параметров инвазии гельминтами, использующими в качестве промежуточных хозяев малоподвижных беспозвоночных (мидий), и низкие показатели заражения паразитами, у которых эту роль играют мобильные организмы (ракообразные). Очевидно, эффективность сбора слетками разных групп кормов имеет заметные различия. К тому же к моменту подъема молодых птиц на крыло сезонная доступность ряда пищевых объектов (в частности, морских полихет) уменьшается. Высокие значения ЭИ взрослых птиц в сентябре трематодами G. deliciosus по сравнению со слетками, скорее всего, объясняются более активной и успешной добычей промежуточных хозяев гельминтов (двустворчатых моллюсков) в зоне сублиторали.
Список литературы
Атрашкевич Г.И., Орловская О.М., Регель К.В., Михайлова Е.И., Поспехов В.В., 2005. Паразитические черви животных Тауйской губы // Биологическое разнообразие Тауйской губы Охотского моря. Владивосток: Изд-во Дальнаука. С. 175–251.
Барышева А.Ф., 1939. Паразитофауна серой куропатки (Perdix perdix) // Ученые записки ЛГУ. Т. 43, серия биологическая. Вып. 11. С. 67–76.
Белопольская М.М., 1952. Паразитофауна морских водоплавающих птиц // Ученые записки ЛГУ. № 141, серия биологическая. Вып. 28. С. 127–180.
Бондаренко С.К., 1997. Жизненный цикл Wardium fryei (Cestoda: Hymenolepididae) // Паразитология. Т. 31. № 2. С. 142–156.
Быховская-Павловская И.Е., 1953. Фауна сосальщиков птиц Западной Сибири и ее динамика // Паразитологический сборник Зоологического института АН СССР. Вып. 15. С. 1–116.
Быховская-Павловская И.Е., 1962. Трематоды птиц фауны СССР: эколого-географический обзор. М., Л.: Изд-во АН СССР. 407 с.
Быховская-Павловская И.Е., 1967. Развитие экологической паразитологии в СССР // Паразитология. Т. 1. № 5. С. 391–404.
Галактионов К.В., Куклин В.В., Ишкулов Д.Г., Галкин А.К., Марасаев С.Ф. и др., 1997. К гельминтофауне птиц побережья и островов Восточного Мурмана (Баренцево море) // Экология птиц и тюленей в морях северо-запада России. Апатиты: Изд-во КНЦ РАН. С. 67–153.
Горяев Ю.И., Горяева А.А., Татаринкова И.П., 2011. Крупные чайки в антропогенных ландшафтах Западного Мурмана (Кольский полуостров) // Беркут. Т. 20. Вып. 1–2. С. 90–110.
Догель В.А., 1962. Общая паразитология. Л.: Изд-во Ленингр. ун-та. 464 с.
Дубинина М.Н., 1971. Паразитологическое исследование птиц. Л.: Наука. 139 с.
Зехнов М.И., 1947. Возрастные изменения в зараженности грача (Corvus frugilegus L.) эндопаразитами // Зоологический журнал. Т. 26. № 2. С. 133–142.
Ишкулов Д.Г., Куклин В.В., 1998. К фауне химастлин Восточного Мурмана // Паразитология. Т. 32. № 1. С. 84–94.
Кириллов А.А., Кириллова Н.Ю., 2013. Трематоды птиц (Aves) Среднего Поволжья. 2. Отряды Plagiorchiida, Renicolida, Strigeida и Shistosomatida // Паразитология. Т. 47. № 2. С. 136–177.
Куклин В.В., 2013. Гельминтофауна моевки (Rissa trydactyla) Баренцева моря // Зоологический журнал. Т. 92. № 7. С. 781–789.
Куклин В.В., 2013а. Модифицированная методика изготовления тотальных препаратов паразитических плоских червей // Российский паразитологический журнал. № 4. С. 66–67.
Куклин В.В., Куклина М.М., 2005. Гельминты птиц Баренцева моря: фауна, экология, влияние на хозяев. Апатиты: Изд-во КНЦ РАН. 290 с.
Кулачкова В.Г., 1958. Эколого-фаунистический обзор паразитофауны обыкновенной гаги Кандалакшского залива // Труды Кандалакшского гос. заповедника. Вып. 1. С. 103–159.
Марков Г.С., 1937. Возрастные изменения паразитофауны Новоземельской кайры // Труды Ленинградского общества естествоиспытателей. Т. 66. Вып. 3. С. 456–465.
Пельгунов А.Н., 2019. Формирование цестодофауны двух видов куликов рода Calidris в местах гнездовий // Зоологический журнал. Т. 98. № 7. С. 725–731.
Соколова Г.А., 1959. Динамика паразитофауны зяблика (Fringilla coelebs) // Вестник ЛГУ. Т. 43, серия биологическая. Вып. 1. С. 83–90.
Спасская Л.П., Спасский А.А., 1978. Цестоды птиц СССР. Т. 9. Дилепидиды лимнофильных птиц. М.: Наука. 186 с.
Успенская А.В., 1963. Паразитофауна бентических ракообразных Баренцева моря. М., Л.: Изд-во АН СССР. 128 с.
Юрпалова Н.М., Коновалов Ю.Н., 1969. Четыре вида дилепидид от куликов Чукотки // Паразиты позвоночных животных. Кишинев: Изд-во Картя Молдовеняскэ. С. 136–145.
Baer J.G., 1956. Parasitic helminths collected in West Greenland // Meddelelser om Grønland. Bd. 124. № 10. P. 5–55.
Baer J.G., 1962. Cestoda // The Zoology of Iceland. V. 2. Pt. 12. P. 1–63.
Bakke T.A., 1972. Studies of the Helminth Fauna of Norway XXII: The common gull, Larus canus L., as final host for Digenea (Platyhelminthes). I. The ecology of the common gull and their infection in relation to season and the gull, s habitat, with the distribution of the parasites in the intestine // Norwegian Journal of Zoology. V. 20. P. 165–188.
Bakke T.A., 1985. Studies of the Helminth Fauna of Norway XL: The common gull, Larus canus L., as final host for Cestoda (Platyhelminthes) // Fauna Norvegica. Serie A. V. 6. P. 42–54.
Burt M.D.B., Jarecka L., 1984. Studies on the life cycle of Hymenolepis ductilis Linton, 1927, and on the ultrastructure of its cystycercoid tegument // Acta Parasitologica Polonica. V. 29. P. 35–42.
Chatelain E. H., Breton S., Lemieux H., Blier P., 2008. Epitoky in Nereis (Neanthes) virens (Polychaeta: Nereididae): A story about sex and death // Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. V. 149. I. 1. P. 202–208.
Greben O., Kudlai O., Kornyushin V.V., 2019. The intermediate host of Wardium cirrosa (Krabbe, 1869) Spassky, 1961 (Cestoda, Cyclophyllidea, Aploparaksidae) in Ukraine // Parasitology Research. V. 118. I. 11. P. 3129–3137.
Hillström L., Kilpi M., Lindström K., 1994. Diet of Herring Gulls Larus argentatus during chick rearing in the Gulf of Finland // Ornis Fennica. V. 71. I. 3. P. 95–101.
Humphrey S.R., Courtney C.H., Forrester D.J., 1978. Community ecology of the helminth parasites of the brown pelican // Wilson Bulletin. V. 90. I. 4. P. 587–598.
Lauckner G., 1983. Diseases of Mollusca: Bivalvia // Diseases of Marine Animals (Kinne O. Eds). Hamburg: Biologische Anstalt Helgoland. V. 2. Ch 13. P. 477–961.
McCarthy H.O., Irwin S.W.B., Fitzpatrick S.M., 1999. Nucella lapillus as a paratenic host for Maritrema arenaria // Journal of Helminhology. № 73. P. 281–282.
Nogales M., Zonfrillo B., Monaghan P., 1995. Diet of adult and chick Herring Gulls Larus argentatus argenteus on Alisa Craig, south-west Scotland // Seabirds. V. 17. P. 56–63.
Noordhuis R., Spaans A.L., 1992. Interspecific competition for food between Herring Larus argentatus and Lesser Blackbacked Gulls Larus fuscus in the Dutch Wadden Sea area // Ardea. V. 80. I. 1. P. 115–132.
Pierotti R., Annett C., 1987. Reproductive consequences of dietary specialization and switching in an ecological generalist // Foraging behavior. Kamil A.C., Krebs J., Pulliam R. (eds). New York: Plenum Press. P. 417–442.
Pierotti R., Annett C., 1990. Diet and reproductive performance in seabirds // Bioscience. V. 40. I. 8. P. 568–574.
Pierotti R., Annett C., 1991. Diet choice in the Herring Gull: constraints imposed by reproductive and ecological factors // Ecology. V. 72. I. 1. P. 319–328.
Rozsa L., Reiczigel J., Majoros G., 2000. Quantifying parasites in samples of hosts // Journal of Parasitology. V. 86. I. 2. P. 228–232.
Shimazu T., 1975. Some cestodes and acanthocephalan larvae from euphasiid crustaceans collected in northern North Pacific Ocean // Bulletin of the Japanese Society of Science and Fisheries. V. 41. P. 813–821.
Spaans A.L., 1971. On the feeding ecology of the Herring Gulls Larus argentatus Pont. on the northern part of the Netherland // Ardea. V. 55. I. 1–2. P. 73–188.
Steenweg R.J., Ronconi R.A., Leonard M.L., 2011. Seasonal and age-dependent dietary partitioning between Great Black-Backed and Herring Gulls // Condor. V. 113. I. 4. P. 795–805.
Threlfall W., 1967. Studies on helminths parasites of the herring gull, Larus argentatus Pontopp., in northern Carnarvonshire and Anglesey // Parasitology. V. 57. I. 3. P. 431–453.
Threlfall W., 1968. Studies on helminths parasites of the American herring gull (Larus argentatus Pont.) in Newfoundland // Canadian Journal of Zoology. V. 46. I. 6. P. 1119–1126.
Verbeek N.A.M., 1977. Comparative feeding behavior of immature and adult herring gulls // Wilson Bulletin. V. 89. I. 3. P. 415–421.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


