Зоологический журнал, 2021, T. 100, № 3, стр. 264-274
Фауна пресноводных Harpacticoida (Copepoda) дельты реки Лена
А. А. Новиков a, *, Е. Н. Абрамова b, Р. М. Сабиров a
a Казанский федеральный университет
420008 Казань, Россия
b Усть-Ленский государственный природный заповедник
678400 Тикси, Россия
* E-mail: aan201097@yandex.ru
Поступила в редакцию 30.10.2019
После доработки 20.12.2019
Принята к публикации 04.02.2020
Аннотация
Впервые приведена фаунистическая сводка по пресноводным копеподам отряда Harpacticoida дельты реки Лена. Изучены разнообразные биотопы и районы дельты. В результате обнаружено 18 видов из двух семейств: Canthocamptidae и Harpacticidae. 8 из обнаруженных видов являются новыми для района исследования, 5 видов из родов Bryocamptus, Canthocamptus, Moraria и Maraenobiotus, вероятно, являются новыми для науки. Дана краткая экологическая характеристика и указаны имеющиеся отличия усть-ленских популяций от типовых. Фауна пресноводных гарпактикоид дельты включает три основныe компоненты: палеарктические виды, голарктические виды и виды с “берингийским ареалом”. Приведено морфологическое описание найденного нами Bryocamptus umiatensis Wilson 1958. Этот вид имеет высокое сходство с недавно описанным из Кореи Bryocamptus jejuensis Lee et Chang 2016. Основной отличительный признак данных видов – вооружение анальной пластинки – в исследованном регионе подвергается значительной внутрипопуляционной изменчивости. Приведен ключ для определения пресноводных Canthocamptidae дельты Лены.
Веслоногие рачки из отряда Harpacticoida являются широко распространенной группой в морских и континентальных водах. В пресных водах насчитывается более тысячи видов, преимущественно из семейства Canthocamptidae (Boxshall, Defaye, 2007), которое является крупнейшим семейством в отряде и, по всей видимости, входит в одну из первых волн колонизации копеподами пресных вод (Selden et al., 2010). Гарпактикоиды встречаются в самых разнообразных биотопах, таких как озера, реки, временные лужи, микроводоемы в пазухах листьев растений, грунтовые воды (Боруцкий, 1952). Бо́льшая часть представителей является бентосными формами и редко попадается в планктонную сеть, в связи с чем гарпактикоиды – самая малоизученная группа пресноводных Copepoda.
В целом, фауна пресноводных Harpacticoida российской Арктики изучена очень слабо, а наиболее изученным в этом плане районом является Большеземельская тундра (Фефилова 2010).
Река Лена впадает в море Лаптевых, ее дельта расположена на севере восточной части Якутии и занимает огромную площадь в 29 630 км2 (Schneider et al., 2009). Вся дельта находится за полярным кругом в районе многолетней мерзлоты. Большая часть территории относится к зоне тундр, за исключением южного о-ва Тит-Ары, на котором располагается самый северный массив леса Якутии (рис. 1). Как и во многих других арктических районах (Wrona et al., 2006), в дельте расположено огромное количество (около 50 тысяч) больших и малых озер (Мастахов, 1972). Копеподы, в том числе и представители Harpacticoida, играют заметную роль в пресноводных экосистемах, являясь важным звеном пищевых цепей в них.
Впервые пресноводные гарпактикоиды дельты упоминаются в статье Абрамовой (1996). Тогда было обнаружено 4 вида из семейства Canthocamptidae: Moraria duthiei (Scott 1896), Moraria mrazeki Scott 1903, Canthocamptus glacialis Lilljeborg 1902, Attheyella nordenskioldi (Lilljeborg 1902). Позднее список дополнился Maraenobiotus brucei (Richard 1898) и Pesceus schmeili (Mrazek 1893) (Nigamatzyanova et al., 2016; Abramova et al., 2017). Основной целью нашей работы является пополнение имеющихся сведений о видовом составе веслоногих ракообразных из отряда Harpacticoida в российской Арктике.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор материала проходил в 2018 и 2019 годах с апреля по сентябрь в составе российско-немецких экспедиций “Лена-2018” и “Лена-2019”.
Для исследования были выбраны водоемы разных типов: протоки, временные заливные пойменные участки, переувлажненные моховые подушки, полигональные, старичные и термокарстовые озера, небольшие ручьи и лужи, мелкие депрессии на ледовом комплексе, а также почвенная вода на границе активного слоя и мерзлоты. Почвенную воду собирали методом Карамана-Шаппюи (Malard et al., 2002). Бо́льшая часть проб собрана на о-ве Самойловский, остальные районы сбора проб отмечены на карте (рис. 1).
Качественные пробы были собраны с помощью сети Апштейна и дночерпателя Ван-Вина. При сборе материала из переувлажненного мха были предусмотрены частичное разрушение растительного покрова и выдавливание воды из моховых подушек. Для сбора проб в литорали рамку сети проводили несколько раз по донному осадку. На большой глубине (более 2 м) был использован дночерпатель. После сбора образцов в сито сливали придонную воду и несколько верхних сантиметров осадка. В весенние месяцы с помощью мотобура были собраны ледяные керны с последующим вытаиванием из них организмов. В качестве фиксатора использовали формалин.
Рисунки выполнены в программе CorelDraw на основе оригинальных фото. Определение рачков проводили с помощью микроскопов Olympus BX61 и Zeiss Primo Star. Для этого использовали описания, приведенные в монографиях Боруцкого (1952), Веллса (Wells, 2007), Фефиловой (2015), Чана (Chang, 2010). Количественные данные приведены относительно численности гарпактикоид.
В тексте применены сокращения: P1–P5 – с первой по пятую пары торакальных конечностей соответственно.
ХАРАКТЕРИСТИКА ВОДОЕМОВ
Все исследованные водоемы по гидрологическим, гидрохимическим и фаунистическим характеристикам мы условно разбили на 4 группы (табл. 1):
Таблица 1.
Гидрологические и гидрохимические показатели основных групп водоемов
| Тип водоема | Площадь водной поверхности, га | Максимальная глубина, м | Максимальная температура поверхности, °C | pH | Электро- проводность, мкС/см | Содержание кислорода, мг/л |
|---|---|---|---|---|---|---|
| Небольшие термокарстовые озера | До 0.3 | 2.2 | 20.1 | 6.37–7.57 | 28–104 | 3.92–9.44 |
| Крупные озера | 0.8–56 | 12 | 14.1 | 6.98–7.44 | 66–127 | 6.73–8.29 |
| Переувлажненные мхи | – | – | 6.2 | – | – | – |
| Пойменные лужи | До 0.1 | 1.9 | 18.2 | 6.62–7.67 | 88–489 | 6.25–9.14 |
1) Небольшие термокарстовые озера, в том числе полигональные
2) Крупные озера
3) Переувлажненные мхи
4) Пойменные лужи
Полигональные озера – наиболее распространенный тип водоемов дельты. Образование происходит за счет криогенных процессов в активном слое почвы и возникновения морозобойных трещин (Попов, 1958; Щукин, 1960). В зависимости от возраста и глубины полигоны могут иметь разное количество растительности. Условно, полигональные озера можно разделить на 2 группы: глубокие (около 1–1.5 м глубиной) и мелкие (менее 50–70 см глубиной) (Вишнякова, Абрамова, 2009). И те, и другие имеют всегда прозрачную воду, низкую минерализацию (в среднем от 30 до 90 мкС/см) и нейтральную pH, хотя в мелких водоемах часто происходит незначительное повышение кислотности. Грунт представлен толстым слоем мелкодисперсного растительного детрита. Глубокие полигоны имеют небольшое количество высшей растительности, в основном представленной арктофилой (Arctophila sp.), и очень многочисленные колонии Nostoc, иногда заполняющие всю поверхность дна. Мелкие полигональные озера, как правило, сильно зарастают водной растительностью.
Крупные озера – водоемы площадью больше 30–50 м2. Как правило, имеют смешанное старично-термокарстовое происхождение. По гидрохимическим характеристикам озера могут сильно различаться. Крупные озера имеют литоральную зону, которая может быть либо песчаной, либо заросшей околоводной растительностью, и более глубоководную зону – профундаль, также различающуюся по типам грунтов. На глубине свыше 1.5 м обычно преобладает ил мелкой фракции с примесью песка.
Переувлажненные мхи. Фактически являются наземными биотопами. Любые понижения в условиях мерзлых грунтов при отсутствии дренажа заполняются водой. Часто переувлажненные мхи можно найти на местах весенних ручьев и луж, по берегам небольших озер и полигонов, а также в депрессиях или на местах мелких полигонов. Из особенностей таких водоемов можно отметить низкие температуры из-за постоянного контакта воды с мерзлыми грунтами и полное отсутствие открытой воды. Таким образом, для мелких животных данный биотоп напоминает сеть полостей и тоннелей, заполненных водой. Вследствие этого фауна таких водоемов имеет смешанное происхождение. Наиболее обильными группами в этих водоемах являются олигохеты, нематоды, тихоходки, коллемболы, различные клещи и гарпактикоидные рачки, изредка встречаются представители отряда Cyclopoida и личинки двукрылых.
Пойменные лужи – небольшие водоемы, по площади и глубине часто напоминают полигоны. Как правило, являются частью пойменной сети и периодически во время обильных осадков превращаются в водотоки. От полигонов сильно отличаются по минерализации, которая в таких водоемах всегда выше 150–200 мкС/см, а иногда достигает и 500 мкС/см. По берегам луж часто в большом количестве произрастает околоводная растительность. Неглубокие лужи почти всегда зарастают арктофилой, и в таком случае открытый грунт отсутствует. На дне и на растениях накапливается толстый слой детрита, создающий условия дефицита кислорода. Из животных в таких условиях встречаются только личинки хирономид.
РЕЗУЛЬТАТЫ
В результате исследования было обнаружено 18 видов (табл. 2) из двух семейств Harpacticoida: Canthocamptidae и Harpacticidae. Из них 8 – являются новыми для района исследования, 5 – (по одному виду из родов Canthocamptus, Maraenobiotus, Moraria и два – из рода Bryocamptus) требуют подтверждения таксономического статуса и, вероятно, являются новыми для науки. Доминирующий комплекс Harpacticoida дельты включает виды: Canthocamptus glacialis, Moraria duthiei, Moraria. sp. 1, которые встречаются почти во всех исследованных пробах и часто доминируют по численности.
Таблица 2.
Виды пресноводных Harpacticoida дельты Лены
| № | Вид | Первая находка в дельте реки Лена | Тип водоема | |||
|---|---|---|---|---|---|---|
| небольшие термокарстовые озера | крупные озера | переувлажненные мхи | пойменные лужи | |||
| 1 | Attheyella (Neomrazekiella) dentata (Poggenpool 1874) | Эта работа | – | – | + | + |
| 2 | Attheyella (Neomrazekiella) nordenskioldi (Lilljeborg 1902) | Абрамова, 1996 | – | + | ++ | – |
| 3 | Bryocamptus (Arcticocamptus) krochini (Borutzky 1951) | Эта работа | – | ++ | – | – |
| 4 | Bryocamptus (Bryocamptus) sp. 2 | Эта работа | – | + | – | – |
| 5 | Bryocamptus (Bryocamptus) umiatensis Wilson 1958 | Эта работа | + | – | ++ | – |
| 6 | Bryocamptus (Bryocamptus) vejdovskyi (Mrazek 1893) | Эта работа | + | ++ | – | + |
| 7 | Bryocamptus (Bryocamptus) sp. 1 | Эта работа | + | – | ++ | – |
| 8 | Bryocamptus (Echinocamptus) nivalis (Willey 1925) | Эта работа | – | – | – | + |
| 9 | Canthocamptus glacialis Lilljeborg 1902 | Абрамова, 1996 | ++ | + | + | ++ |
| 10 | Canthocamptus sp. 1 | Эта работа | – | + | – | + |
| 11 | Epactophanes richardi Mrazek 1893 | Эта работа | – | + | ++ | – |
| 12 | Harpacticus uniremis Krøyer 1842 | Эта работа | – | – | – | + |
| 13 | Maraenobiotus sp. 1 | Nigamatzyanova et al., 2016 | + | – | + | – |
| 14 | Moraria duthei (Scott 1896) | Абрамова, 1996 | ++ | ++ | + | ++ |
| 15 | Moraria insularis Fefilova 2008 | Эта работа | – | + | – | – |
| 16 | Moraria mrazeki Scott 1903 | Абрамова, 1996 | ++ | ++ | + | + |
| 17 | Moraria sp. 1 | Эта работа | ++ | ++ | ++ | ++ |
| 18 | Pesceus schmeili (Mrazek 1893) | Abramova et al., 2017 | – | ++ | + | + |
Canthocamptidae
Canthocamptus glacialis Lilljeborg 1902
Распространен в арктической области от полярного Урала и Новой земли на западе до о-ва Врангеля на востоке (Боруцкий, 1952; Фефилова, 2015; Novichkova, Chertoprud, 2015). Указывается как один из наиболее распространенных видов в мелких тундровых водоемах, ранее неоднократно отмечался на различных островах дельты (Абрамова, 1996; Вишнякова, Абрамова, 2009). Нами обнаружен преимущественно в полигональных озерах, переувлажненном мхе и небольших термокарстовых озерках. Также изредка встречается в профундали больших озер. По всей видимости предпочитает водоемы с низкой минерализацией (не более 100–110 мкС/см). В полигональных озерах по численности доминирует среди гарпактикоид (до 100%).
Canthocamptus sp. 1
Найден в двух озерах возле горы Америка-Хая (рис. 1). Похож на C. glacialis, но отличается по вооружению дистальных члеников эндоподитов плавательных ног и наличию зубчиков на анальной пластинке.
Moraria duthiei (Scott T. et Scott A. 1896)
Имеет циркумполярное распространение. Редко встречается за пределами тундровой зоны, в частности имеются отдельные популяции в Польше, Германии, на Британских о-вах и в Скандинавии, однако, они, как правило, приурочены к крупным озерам с невысокой температурой воды (Боруцкий, 1952; Dimante-Deimantovica et al., 2016). Встречается на Аляске (Reed, 1962; Tash, 1971) и на Камчатке (Ishida, 1998). Ранее M. duthiei была обнаружена на о-вах Дунай в мелких водоемах (Абрамова, 1996). Вид является одним из наиболее часто встречающихся гарпактикоид в дельте. Нами найден почти на всех исследованных островах в самых разнотипных водоемах, но никогда не достигает значительной численности. В переувлажненном мхе и мейобентосе крупных озер средняя численность около 3–5%, только в полигональных озерах численность доходит до 1/3, где из гарпактикоид уступает только C. glacialis.
Рис. 2.
Bryocamptus (Bryocamptus) umiatensis Wilson 1958, var. jejuensis, самец: а – P2, b – P3, c – P4. var. jejuensis – особи с голой анальной пластинкой, var. umiatensis – особи с шипиками на анальной пластинке. Масштаб 50 мкм.
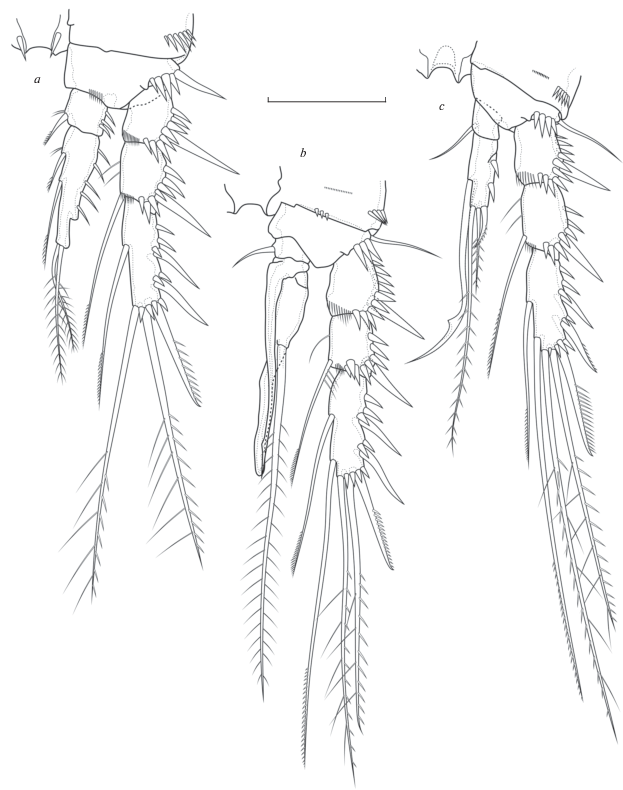
Рис. 3.
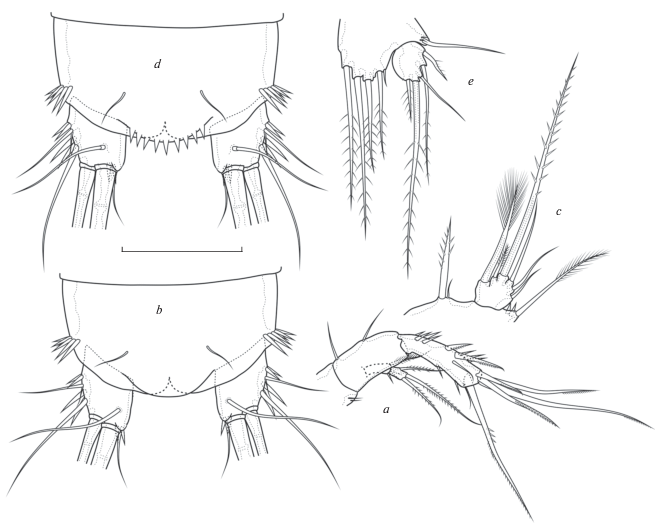
Bryocamptus (Bryocamptus) umiatensis Wilson 1958, var. jejuensis, самец: a – антенна, b – анальный сегмент с фуркальными ветвями, c – P5; var. umiatensis самец: d – анальный сегмент с фуркальными ветвями; var. jejuensis самка: e – P5. Масштаб 50 мкм.
Для M. duthiei характерна треугольная анальная пластинка с углом разной степени выраженности, однако во многих изученных водоемах дельты вместе с типичными особями встречаются самцы и самки с круглой анальной пластинкой, при этом их численность относительно типичных особей непостоянна.
Moraria mrazeki Scott T. 1903
Имеет широчайший ареал. Встречается в большей части Палеарктики, обнаружен в Гренландии и на Аляске. Указан для Северной Америки (Боруцкий, 1952; Reed, 1962; Tash, 1971; Reid, Lesko, 2003). Ранее в дельте был обнаружен в мелких водоемах на правом берегу Быковской протоки (Абрамова, 1996).
В районе исследований M. mrazeki не является массовым, встречается в небольшом количестве водоемов, но достигает в них большой относительной численности. Идентификация этого вида не является точной, так как в отличие от европейских популяций, где самки несут группу шипов на внутреннем крае фурки (Фефилова, 2015), в дельте Лены у обоих полов данная группа шипов отсутствует. Неизвестно, как этот признак проявляется у американских популяций.
Moraria insularis Fefilova 2008
Довольно редкий вид. Ранее было известно только одно местонахождение в типовом местообитании на о-ве Долгий в Баренцевом море (Фефилова, 2015). Обнаружен на песчаной литорали нескольких неглубоких термокарстовых озер. По всем признакам совпадает с первоописанием (Фефилова, 2008). Так же как и в типовой популяции, в наших пробах были встречены особи как с одним, так и с двумя рядами шипиков на фуркальных ветвях.
Moraria sp. 1
Один из доминирующих видов Harpacticoida дельты, найден более чем в 50% исследованных проб, довольно часто преобладает по численности в самых разнообразных водоемах. Морфологически очень близок к M. mrazeki, схож с ним по вооружению плавательных ног, отличается вооружением абдоменальных сегментов, формой и вооружением фуркальных ветвей, а также соотношением длин щетинок на P5.
Pesceus schmeili (Mrázek 1893)
Ареал включает почти всю Палеарктику (Боруцкий, 1952). Ранее был найден в термокарстовых озерах на о-ве Самойловский (Abramova et al., 2017). Нами особи данного вида обнаружены преимущественно в крупных озерах. Pesceus schmeili предпочитает илистые грунты, однако, в озере Круглом на о-ве Тит-Ары является одним из доминирующих на песчано-илистом дне. Также это один из немногих видов копепод, обнаруженных в профундали озер на глубине более 4 м.
Attheyella (Neomrazekiella) nordenskioldii (Lilljeborg 1902)
Типичный арктический вид. Вероятно, имеет циркумполярный ареал, имеются находки для Америки и Камчатки (Боруцкий, 1952; Reed, 1962; Shiozawa, 1991; Ishida, 1998). В дельте на о-вах Дунай ранее был найден Абрамовой (1996). Нами обнаружено, что A. nordenskioldii обычно доминирует, а часто даже является единственным представителем Harpacticoida в мелких лужах с открытой водой или по сильно заросшим берегам озер. При этом в пробах из обводненного мха и сплошь заросших водоемов почти никогда не встречаются взрослые особи.
Attheyella (Neomrazekiella) dentata (Poggenpool 1874)
=Attheyella northumbrica Brady 1880
Довольно редок в дельте Лены; ареал, вероятно, голарктический, есть находки с Аляски (Боруцкий, 1952; Фефилова, 2015; Reed, 1962). Найдены единичные особи в нескольких небольших слабопроточных лужах и в небольших лужах, с глубиной около 10–15 см.
Maraenobiotus sp. 1
Ранее был определен Г.Р. Нигаматзяновой с соавторами как Maraenobiotus brucei (Richard 1898). Найден в крупном термокарстовом оз. Рыба на о-ве Самойловский как один из доминирующих представителей копепод в пелагических литоральных пробах (Nigamatzyanova et al., 2016). Однако никакой подтверждающей информации приведено не было, поэтому есть основание полагать, что вид был определен неверно. По нашим данным, является в дельте очень редким видом. Встречается в воде с низкими концентрациями ионов: в полигональных озерах, переувлажненных мхах. Численность особей Maraenobiotus относительно всех гарпактикоид в полигональных озерах максимально достигала 6%. Довольно многочисленным был в одной пробе из влажного торфа в период максимальной толщины активного слоя почвы в начале сентября (около 40 см). В крупных озерах, в том числе в оз. Рыба, вид не был обнаружен за весь период сбора проб.
Отличается от других видов и форм рода полной редукцией щупика мандибулы вплоть до небольшого бугорка с одной щетинкой, по вооружению плавательных ног совпадает с M. brucei.
Epactophanes richardi Mrazek 1893
Относится к космополитам (Фефилова, 2015). Ранее для него были описаны многочисленные формы и вариететы, самостоятельность которых как таксономических единиц еще в середине прошлого века поставлена под сомнение (Боруцкий, 1952). По всей видимости эврибионтный вид, встречается как в больших озерах, так и в моховых подушках, однако наибольшей численности достигает именно во мхе.
Bryocamptus (Bryocamptus) vejdovskyi (Mrazek 1893)
Широко распространенный в Голарктике вид. Найден на территории почти всей северной Евразии (Боруцкий, 1952; Фефилова, 2015), обнаружен в Японии, Корее и Китае (Ishida, Kikuchi, 2000; Chang, 2010), на Аляске (Reed, 1962). В районе исследования найден преимущественно в южной части дельты, на о-ве Тит-Ары обнаружен в пробах из различных водоемов от моховых подушек до крупных озер.
Bryocamptus (Arcticocamptus) krochini (Borutzky 1951)
Описан с Камчатки, позднее был обнаружен в Большеземельской тундре (Боруцкий, 1952, 1966). Нахождение этого вида в дельте Лены хорошо вписывается в известный ареал, который, по всей видимости, простирается по всей северо-восточной Евразии (Боруцкий, 1966). Найден нами в двух крупных озерах с песчаным дном, где доминировал по численности среди Harpacticoida, а также в одном термокарстовом озере с илистым грунтом.
Bryocamptus (Echinocamptus) nivalis (Willey 1925)
Обитает в восточной Евразии и Северной Америке (Wilson, 1956; Robertson, Gannon, 1981; Chang, 2010). Ишидой определялся как Bryocamptus calvus (Brehm 1927), найден им на Камчатке, в Японии (Ishida, 1998; Ishida, Kikuchi, 2000), также обнаружен в Корее (Lee, Chang, 2006). Нами найден только близ горы Америка-Хая в мелкой илистой луже вместе с Canthocamptus sp. 1, A. nordenskioldi и M. duthiei.
Bryocamptus (Bryocamptus) umiatensis Wilson 1958
Одна из наиболее интересных находок. Вид описан из северной Аляски, позже был обнаружен на Сахалине (Ishida, Kobayashi, 1993). Относительно недавно был найден в горной болотистой местности на о-ве Джеджу в Южной Корее (Lee, Chang, 2006). В крайне скудном исключительно текстовом первоописании, сделанном Вилсоном, у данного вида на анальной пластинке имеется 3–5 шипов у самок и 8 шипов у самцов (Wilson, 1958). В корейской и сахалинской популяциях анальные пластинки обоих полов полностью гладкие и шипов не несут, это послужило поводом для недавнего описания Bryocamptus jejuensis Lee et Chang 2016 с типовым местообитанием на о-ве Джеджу. Авторы данной статьи отметили следующие различия: гладкая анальная пластинка, модифицированная щетинка на эндоподите Р3 самца, имеющая вид толстого и длинного отростка, мечевидный зазубренный отросток на конце одной из апикальных щетинок на эндоподите Р4, а также небольшие различия в вооружении фуркальных ветвей самок (Lee, Chang, 2016).
В популяции из дельты Лены в одной и той же пробе почти всегда встречаются особи и с гладкой, и с шипастой анальной пластинкой. При этом никаких других морфологических различий между особями с этими вариантами строения анальной пластинки (в том числе, по комплексу интегументальных пор, микровооружения коксоподитов и базиподитов) нами не было обнаружено. Количество шипиков у самцов, если они имеются, в среднем от 8 до 10, у самок – от 5 до 8.
Также незначительные различия между популяциями из Кореи и дельты Лены имеются в строении концевой части одной из апикальных щетинок эндоподита Р4, которая у корейских особей имеет мощный пильчатый край, а у усть-ленских особей имеет вид своеобразного наконечника копья. За исключением этих деталей все остальные признаки обоих полов идентичны рисункам, сделанным в первоописании B. jejuensis.
На наш взгляд, для уточнения статуса B. jejuensis и особей из дельты Лены необходим более тщательный анализ с использованием рачков из разных частей ареала, в особенности из типовых местообитаний: о-ва Джеджу и Аляска.
В дельте Лены является одним из массовых видов в моховых подушках, кроме того, обнаружен в 60 км к югу от дельты также во мхах в лесотундре.
Bryocamptus sp. 1
Массовый вид копепод в моховых подушках, имеет сходство с Bryocamptus zschokkei (Schmeil, 1893). Отличается формой и вооружением эндоподитов плавательных ног самок и самцов, а также вооружением дистальных члеников экзоподитов.
Bryocamptus sp. 2
Встречается как правило в крупных термокарстовых озерах. Морфологически очень близок к Bryocamptus minutus (Claus 1863). Отличается от него наличием пяти, а не шести щетинок на внутренней лопасти P5 и вооружением экзоподитов P3 и P4.
Harpacticus uniremis Krøyer 1842
Является видом с широким ареалом, включающим северную Атлантику, северную Пацифику и Северный ледовитый океан, а также Черное и Средиземное моря. Встречается преимущественно в морских и солоноватых водах, однако, нами обнаружена 1 самка с яйцевым мешком в пойменном заросшем ручье с электропроводностью не более 250–300 мкС/см.
ОБСУЖДЕНИЕ
Несмотря на имеющееся мнение о бедности арктической фауны (Hebert, Hann, 1986), на данный момент фауна пресноводных копепод дельты Лены насчитывает 76 видов (18 – Harpacticoida, 37 – Cyclopoida, 21 – Calanoida). 15 из 18 обнаруженных видов гарпактикоид были встречены на одном о-ве Самойловский площадью не более 5 км2 в южной части дельты, причем в данной работе совсем не учитывались материалы из приустьевых участков, а также приморских озер и лагун с солоноватой водой.
Для европейского северо-востока России известно 33 вида Harpacticoida с учетом солоноватоводных представителей (Фефилова, 2015). Большая часть обнаруженных нами видов также встречается на европейском северо-востоке России, отличия фауны дельты Лены заключаются в наличии B. umiatensis, B. nivalis.
При сравнении с фауной Harpacticoida Аляски выявлено большое количество общих видов. Однако в дельте Лены, в отличие от Аляски, имеются B. krochini, M. insularis, C. glacialis, обнаруженные только в российской Арктике, и палеарктический широко распространенный вид P. schmeili, который на Аляске заменяется близким видом Pesceus reductus (Wilson M.S. 1956) (Wilson, 1956a; Reed, 1962; Tash, 1971).
На формирование современной фауны пресноводных Harpacticoida дельты Лены оказали влияния различные исторические геологические и климатические процессы. Одним из наиболее значимых является смена этапов оледенений и межледниковий во время плейстоцена (Roy et al., 2004). В ледниковые эпохи участок суши, включающий восточную Сибирь и Аляску, был частично свободен ото льда. В совокупности с понижением уровня Мирового океана во время максимумов оледенений данный участок был цельным без морских проливов и образовывал так называемую Берингию (Roy et al., 2004; Ehlers, Gibbard, 2007).
В это время происходил обмен континентальных фаун Евразии и Америки, чем объясняется их большое сходство. В частности, это показано для многих млекопитающих (Rodriguez et al., 2006), для копепод из родов Eurytemora и Limnocalanus (Abramova et al., 2017) и для других видов пресноводного зоопланктона (Samchyshyna et al., 2008). В период межледниковий сформировавшийся Берингов пролив изолировал популяции, что могло привести к дифференциации некоторых видов на близкие, находящиеся по разные стороны от пролива.
Таким образом, фауна пресноводных Harpacticoida дельты Лены состоит из нескольких зоогеографических компонент:
1) Виды с голарктическим или циркумполярным ареалом: A. dentata, A. nordenskioldii, B. vejdovskyi, M. duthiei.
2) Виды с “берингийским ареалом”: B. nivalis, B. umiatensis.
3) Палеарктические виды, среди которых M. insularis, Br. krochini, C. glacialis найдены только в российской Арктике. При этом часть видов формирует пары с близкородственными видами с Аляски: Br. krochini – Br. subarcticus, C. glacialis – C. assimilis, P. schmeili – P. reductus (Tash, Armitage, 1967).
4) Космополитный Epactophanes richardi, который скорее всего является группой видов (Bruno, Cottarelli, 1999).
Ключ для определения пресноводных Canthocamptidae дельты Лены:
1 (2) Экзоподиты Р1 2-членистые ..... Maraenobiotus sp. 1
2 (1) Экзоподиты Р1 3-членистые
3 (16) Экзоподит антенны 1-членистый
4 (7) Эндоподит Р1 3-членистый, эндоподит Р3 самца 3-членистый …........................ род Attheyella
5 (6) Экзоподит антенны несет 3 щетинки, задние края сегментов уросомы зазубрены …. Attheyella (Neomrazekiella) dentata (Poggenpool 1874)
6 (5) Экзоподит антенны несет 4 щетинки, задние края сегментов уросомы гладкие …. Attheyella (Neomrazekiella) nordenskioldii (Lilljeborg 1902)
7 (4) Эндоподит Р1 2-членистый, эндоподит Р3 самца 2-членистый
8 (9) Экзоподит антенны несет 2 щетинки ..… ............................Epactophanes richardi Mrazek 1893
9 (8) Экзоподит антенны несет 4 щетинки ..… .............................................................. род Moraria
10 (11) Дистальный членик экзоподита Р3 несет 5 шипов и щетинок, антеннула 8-членистая .… ...........................Moraria duthiei (Scott T. et A. 1896)
11 (10) Дистальный членик экзоподита Р3 несет 4 шипа и щетинки, антеннула 7-членистая
12 (13) Задние края сегментов тела отчетливо зазубрены …............. Moraria insularis Fefilova 2008
13 (12) Задние края сегментов тела не зазубрены
14 (15) У самок крайняя внешняя щетинка эндоподита Р5 короче средней щетинки экзоподита, самцы не несут группы шипов на внутреннем крае фурки …............. Moraria mrazeki Scott T. 1903
15 (14) У самок крайняя внешняя щетинка эндоподита Р5 длиннее средней щетинки экзоподита, самцы несут группу шипов на внутреннем крае фурки …....................................... Moraria sp. 1
16 (3) Экзоподит антенны 2-членистый
17 (18) Экзоподит антенны несет 3 щетинки, края сегментов тела грубо зазубрены...…... ...................................Pesceus schmeili (Mrázek 1893)
18 (17) Экзоподит антенны несет 4 щетинки
19 (22) Первый членик эндоподита Р1 доходит до конца экзоподита, длина фурок в 2 раза больше ширины …............................ род Canthocamptus
20 (21) Анальная пластинка и сегменты тела гладкие …..... Canthocamptus glacialis Lilljeborg 1902
21 (20) Анальная пластинка несет 4–5 зубчиков, сегменты тела слабо зазубрены …....... Canthocamptus sp. 1
22 (19) Первый членик эндоподита Р1 не доходит до конца экзоподита, фурки почти квадратные …............................................. род Bryocamptus
23 (24) Второй членик экзоподита Р1 с внутренней стороны не несет щетинку ….. Bryocamptus (Echinocamptus) nivalis (Willey 1925)
24 (23) Второй членик экзоподита Р1 с внутренней стороны несет щетинку
25 (28) Эндоподит Р1 2-членистый
26 (27) Анальная пластинка несет более 5 крепких зубчиков ….... Bryocamptus (Arcticocamptus) krochini (Borutzky 1951)
27 (26) Анальная пластинка несет 3–4 оттянутых мощных шипа …................... Bryocamptus sp. 1
28 (25) Эндоподит Р1 отчетливо 3-членистый
29 (30) Зубчики анальной пластинки раздвоенные …..................... Bryocamptus (Bryocamptus) sp. 2
30 (29) Зубчики анальной пластинки, если имеются, то нераздвоенные
31 (32) Одна из апикальных щетинок 3-го членика эндоподита Р3 самца преобразована в толстый и мощный придаток, 4-я щетинка фурки самки развита нормально …..... Bryocamptus (Bryocamptus) umiatensis Wilson 1958
32 (31) Апикальные щетинки 3-го членика эндоподита Р3 самца обычные, 4-я щетинка фурки самки отсутствует …...... Bryocamptus (Bryocamptus) vejdovskyi (Mrazek 1893)
Список литературы
Абрамова Е.Н., 1996. Copepoda (Crustacea, Copepoda) Усть-Ленского заповедника // Гидробиологические исследования в природных заповедниках. М. Вып. 5. С. 5–16.
Боруцкий Е.В., 1952. Harpacticoida пресных вод // Фауна СССР. Ракообразные. Т. 3. Вып. 4. М.‑Л.: Изд-во АН СССР. 425 с.
Боруцкий, Е.В., 1966. Harpacticoida (Crustacea, Copepoda) Вашуткиных озер (бассейна р. Усы) // Гидробиологическое изучение и рыбохозяйственное освоение озер Крайнего Севера СССР. М. 51 с.
Вишнякова И.И., Абрамова Е.Н., 2009. Организация зоопланктонных сообществ полигональных озер южной части дельты р. Лены // Система моря Лаптевых и прилегающих морей Арктики: Современное состояние и история развития. М.: Московский университет. С. 265–277.
Мастахов С.Е., 1972. Река Лена. Якутск: Якутское кн. изд-во. 112 с.
Попов А.И., 1958. Полярный покровный комплекс // Вопросы физической географии полярных стран. Т. 1. С. 5–27.
Фефилова Е.Б., 2008. Новые виды рода Moraria (Copepoda, Harpacticoida) и подвид рода Eurytemora (Calanoida) с островов Баренцева моря // Зоологический журнал. Т. 87. № 4. С. 393–402.
Фефилова Е.Б., 2015. Веслоногие раки (Copepoda) // Фауна европейского Северо-Востока России. М.: Товарищество научных изданий КМК. Т. 12. 319 с.
Щукин И.С., 1960. Общая геоморфология. Т. 1. М. Издательство Московского университета. 615 с.
Abramova E., Vishnyakova I., Boike J., Abramova A., Solovyev G., Martynov F., 2017. Structure of freshwater zooplankton communities from tundra waterbodies in the Lena River Delta, Russian Arctic, with a discussion on new records of glacial relict copepods // Polar Biology. V. 40. № 8. P. 1629–1643.
Boxshall G.A., Defaye D., 2007. Global diversity of copepods (Crustacea: Copepoda) in freshwater // In Freshwater Animal Diversity Assessment. Dordrecht: Springer. P. 195–207.
Bruno M.C., Cottarelli V., 1999. Harpacticoids from groundwaters in the Philippines: Parastenocaris mangyans, new species, Epactophanes philippinus, new species, and redescription of Phyllognathopus bassoti (Copepoda) // Journal of crustacean Biology. V. 19. № 3. P. 510–529.
Chang C.Y., 2010. Continental Harpacticoida // Invertebrate fauna of Korea, Flora and fauna of Korea. V. 21. № 4. 244 p.
Dimante-Deimantovica I., Jensen T.C., Walseng B., 2016. Freshwater harpacticoids (Crustacea: Copepoda: Harpacticoida) in Norway–a comprehensive contribution from G.O. Sars, and a provisional checklist // Journal of Natural History. V. 50. № 27–28. P. 1773–1795.
Ehlers J., Gibbard P.L., 2007. The extent and chronology of Cenozoic global glaciation // Quaternary International. V. 164. P. 6–20.
Hebert P.D., Hann, B.J., 1986. Patterns in the composition of arctic tundra pond microcrustacean communities // Canadian Journal of Fisheries and Aquatic Sciences. V. 43. № 7. P. 1416–1425.
Ishida T., 1998. Freshwater copepods from the east coast of the Kamchatka Peninsula, Russia // Journal of marine systems. V. 15. № 1-4. P. 391–396.
Ishida T., Kikuchi Y., 2000. Illustrated fauna of the freshwater harpacticoid copepods of Japan // Bulletin of the Biogeographical Society of Japan. V. 55. P. 7–94.
Ishida T., Kobayashi T., 1993. Copepods from waters around Ozerki Hatchery, Kamchatka, Russia // Scientific Reports of the Hokkaido Salmon Hatchery. V. 47. P. 109–112
Lee J., Chang C.Y., 2006. Taxonomy on Freshwater Canthocamptid Harpacticoids from South Korea V. Genus Bryocamptus // Animal Systematics, Evolution and Diversity. V. 22. № 2. P. 195–208.
Lee J., Chang C.Y., 2016. A new species of the genus Bryocamptus (Copepoda, Harpacticoida, Canthocamptidae) from alpine wetlands at Jeju Island, Korea // Animal Systematics, Evolution and Diversity. V. 32. № 3. P. 219–229.
Malard F., Dole-Olivier M.J., Mathieu J., Stoch F., 2002. Sampling manual for the assessment of regional groundwater biodiversity // Protocols for the Assessment and Conservation of Aquatic Life in the Subsurface (PASCALIS). 74 p.
Nigamatzyanova G., Frolova L., Abramova E., 2016. Zooplankton spatial distribution in thermokarst lake of the Lena river delta (Republic of Sakha (Yakutia)) // Research Journal of Pharmaceutical, Biological and Chemical Sciences. V. 7. № 5. P. 1288–1297.
Novichkova A.A., Chertoprud E. S., 2015. Fauna of microcrustaceans (Cladocera: Copepoda) of shallow freshwater ecosystems of Wrangel Island (Russian Far East) // Journal of natural history. V. 49. № 45–48. P. 2955–2968.
Reed E.B., 1962. Freshwater plankton crustacea of the Colville River Area, Northern Alaska // Arctica. V. 15. P. 27–50.
Reid J.W., Lesko L.T., 2003. A new species of Moraria (Crustacea: Copepoda: Harpacticoida) from the Laurentian Great Lakes // Zootaxa. V. 205. № 1. P. 1–19.
Robertson A., Gannon J.E., 1981. Annotated Checklist of the Free-Living Copepods of the Great Lakes // Journal of Great Lakes Research. V. 7. № 4. P. 382–393.
Rodriguez J., Hortal J., Nieto M., 2006. An evaluation of the influence of environment and biogeography on community structure: the case of Holarctic mammals // Journal of Biogeography. V. 33. № 2. P. 291–303.
Roy M., Clark P.U., Barendregt R.W., Glasmann J.R., Enkin R.J., 2004. Glacial stratigraphy and paleomagnetism of late Cenozoic deposits of the north-central United States // Geological Society of America Bulletin. V. 116. № 1–2. P. 30–41.
Samchyshyna L., Hansson L.A., Christoffersen K., 2008. Patterns in the distribution of Arctic freshwater zooplankton related to glaciation history // Polar Biology. V. 31. № 12. P. 1427–1435.
Schneider J., Grosse G., Wagner D., 2009. Land cover classification of tundra environments in the Arctic Lena Delta based on Landsat 7 ETM+ data and its application for upscaling of methane emissions // Remote Sensing of Environment. V. 113. № 2. P. 380–391.
Selden P.A., Huys R., Stephenson M.H., Heward A.P., Taylor P.N., 2010. Crustaceans from bitumen clast in Carboniferous glacial diamictite extend fossil record of copepods // Nature Communications. V. 1. № 50. P. 1–6.
Shiozawa D.K., 1991. Microcrustacea from the benthos of nine Minnesota streams // Journal of the North American Benthological Society. V. 10. № 3. P. 286–299.
Tash J.C., 1971. Some crustacean zooplankton of the Noatak River area, northern Alaska // Arctic. V. 24. P. 108–112.
Tash J.C., Armitage K.B., 1967. Ecology of Zooplankton of the Cape Thompson Area Alaska // Ecology. V. 48. № 1. P. 129–139.
Wells J.B.J., 2007. An annotated checklist and keys to the species of Copepoda Harpacticoida (Crustacea). Zootaxa. V. 1568. 872 p.
Wilson M.S., 1956. North American harpacticoid copepods: 1. Comments on the known fresh-water species of the Canthocamptidae. 2. Canthocamptus oregonensis, n. sp. from Oregon and California // Transactions of the American Microscopical Society. V. 75. № 3. P. 290–307.
Wilson M.S., 1956a. North American harpacticoid copepods: 3, Paracamptus reductus, n. sp., from Alaska // Journal of the Washington Academy of Sciences. V. 46. № 11. P. 348–351.
Wilson M.S., 1958. North American harpacticoid copepods 4. Diagnosis of new species of freshwater Canthocamptidae and Cletodidae (genus Huntemannia) // Proceedings of the Biological Society of Washington. V. 71. № 1. P. 43–48.
Wrona F.J., Prowse T.D., Reist J.D., Hobbie J.E., Lévesque L.M., Vincent W.F., 2006. Climate change effects on aquatic biota, ecosystem structure and function // AMBIO: A Journal of the Human Environment. V. 35. № 7. P. 359–370.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал