Зоологический журнал, 2021, T. 100, № 4, стр. 385-408
Биология размножения большой конюги (Aethia cristatella, Alcidae, Charadriiformes) в северной части Охотского моря
Е. Ю. Голубова *
Институт биологических проблем Севера ДВО РАН
685000 Магадан, Россия
* E-mail: elena_golubova@mail.ru
Поступила в редакцию 11.02.2020
После доработки 05.05.2020
Принята к публикации 08.05.2020
Аннотация
Представлены результаты изучения в 1989–2019 гг. биологии размножения большой конюги (Aethia cristatella) на о-ве Талан, расположенном в Тауйской губе Охотского моря, где в начале 1990-х гг. гнездилось около 950 тыс. особей. В последующие годы ее численность сокращалась и в 2016–2017 гг. составила 35–70 тыс. особей. В зависимости от ледовой обстановки сроки начала откладки яиц варьировали с 18 мая по 2 июня, средняя дата за весь период исследования приходится на 22 мая. Вылупление птенцов в разные годы начиналось в период с 19 июня по 7 июля (средняя дата 26 июня). Новорожденные птенцы весили 20–40 г (в среднем 31.4). Максимальный вес птенцов во время пребывания в гнезде варьировал в среднем от 156 до 296 г. Ко времени схода в море их вес снижался в среднем до 134–289 г, при этом ежедневный его прирост составлял в разные годы в среднем от 3.5 до 7.4 г. Молодые птицы, средний возраст которых составлял 30–36 сут, покидали остров в конце июля и в течение августа. Некоторые птенцы достигали моря, успешно слетая со склона, другие же спускались по земле и значительно теряли в весе. Средний вес слетков, пойманных на пути следования к морю, варьировал в разные годы от 109 до 177 г, а вес отдельных особей – от 80 до 270 г. Среди молодых отмечали вполне летных, но, вероятно, не долетевших до водной поверхности птиц с длиной крыла от 120 мм и весом от 180 г. Их доля в благоприятные годы составляла более 60%. В числе других были депрессивные нежизнеспособные особи, зачастую покрытые пухом, с небольшим весом и коротким крылом. В неблагоприятные годы они составляли подавляющее большинство, при этом общее количество встреченных на острове молодых птиц увеличивалось в разы. Успех размножения варьировал от 0 до 90.6% (в среднем 35.6), успех инкубации – от 0 до 95% (в среднем 66.1), успех птенцового периода – от 0 до 96.7% (в среднем 44.5). Показатели успеха гнездования заметно снизились с 2007 г., а с 2014 г. стали регулярно “нулевыми”. Основным фактором, определяющим успех размножения больших конюг, является доступность и обилие их кормовой базы в Тауйской губе. В последние годы ее состояние заметно ухудшилось, вследствие климатических и гидрологических изменений в северной части Охотского моря. Из наземных и пернатых хищников, причастных к гибели взрослых конюг, птенцов, кладок и слетков, на острове обитают сапсан, белоплечий орлан, вóрон, тихоокеанская чайка, горностай, лисица и три вида полевок. Наиболее ощутимый ущерб популяции причиняет сапсан, в составе питания которого конюга составляет 30–60% от всех добываемых в течение сезона птиц.
Большая конюга (Aethia cristatella (Pallas 1769)) – один из наиболее многочисленных обитателей Северной Пацифики. Общая ее численность оценивается разными авторами от 6 до 8.200 млн особей (Del Hoyo et al., 1996; Gaston, Jones, 1998; Jones, 1993; Шунтов, 1998). Из них около 3 млн особей обитает на 39 вулканических островах Берингова моря и в заливе Аляска. Самые крупные колонии расположены на островах Св. Лаврентия (более 1 млн особей), Киска (360 тыс. особей), Булдырь (280 тыс. особей), Малый Диомид (219 тыс. особей) и Горелый (186 тыс. особей) (NPSCD, 2013).
В азиатской части ареала эти птицы гнездятся на восточном и южном побережьях Чукотского п-ова. На севере, согласно данным Портенко (1973), этот вид не проникал далее мыса Инчоун, где и предположительно гнездился. Есть данные (Головкин, Флинт, 1975; Велижанин, 1978) о существовании небольших колоний у мыса Сердце-Камень. Однако более поздние сведения этого не подтверждают (Кондратьев, 1986; Konyukhov et al., 1998; Н.Б. Конюхов, С.П. Харитонов, А.А. Кочнев, личное сообщение). Птиц видели на воде, но среди них могли быть как неразмножающиеся кочующие особи, так и прилетающие с ближайших крупных колоний, расположенных в Беринговом море – о-в Ратманова (Большой Диомид) и о-в Крузенштерна (Малый Диомид). Большие конюги вместе с конюгами-крошками в большом количестве появляются в середине октября у о-ва Колючин, западнее мыса Сердце-Камень (А.А. Кочнев, личное сообщение). Одиночных птиц встречали также у мыса Шмидта, в акваториях островов Врангеля и Геральда, где они также никогда не гнездились (Портенко, 1973; Н.Б. Конюхов, личное сообщение). Далее по восточному побережью большая конюга возможно гнездилась или гнездится в окрестностях мыса Дежнева (Портенко, 1973). Одиночную птицу отмечали также в Мечигменском заливе, на мысе Халюсткина в 1984 г. (Н.Б. Конюхов, С.П. Харитонов, личное сообщение). Достаточно плотно и крупными колониями вид гнездится на южном побережье полуострова, в окрестностях бухты Провидения, в частности на мысах Ягночымло, Улахпэн, Имтук, Лысая Голова и Кекилин (Konyukhov et al., 1998).
Южнее, вдоль побережья Берингова моря и Тихого океана, колонии этого вида расположены на островах Верхотурова, Командорских (Арий Камень, Медный), а также на островах в средней части Большой Курильской гряды – Экарма, Чиринкотан, Райкоке, Матуа, Топорковый, Расшуа, Ушишир, Симушир, Черные Братья (Вяткин, 1986; 2000; 2016; Карташев, 1961; 1979; Артюхин, 1990; 1999; Артюхин и др., 2001; Кленова, Шиенок, 2012; Зеленская, 2001).
В Охотском море ее колонии расположены на островах Ямского архипелага, а также на островах Талан, Ионы, Сахалин и Тюлений (Харитонов, 1975; 1980; Нечаев, 1986; Трухин, Кузин, 1996; Трухин, 2006; 2016; Велижанин, 1975; 1978; Кондратьев и др., 1993; Зеленская, 2009). Сообщалось (Дулькейт, Шулькин, 1937; Велижанин, 1978) о предположительном гнездовании конюги на островах Шантарского архипелага и, в частности, на о-ве Меньшикова (“несколько тысяч конюг”), однако последующие исследования (Дементьев, 1951; Иванов и др., 1953; Козлова, 1957; Росляков, 1986; Росляков, Росляков, 1996) этого не подтвердили. Совсем недавно было доказано (Ю.А. Артюхин, личное сообщение) существование колоний этих птиц в Пенжинской губе, на что указывал ранее Яхонтов (1974; 1979).
Сведения о численности большой конюги в разных колониях базируются, главным образом, на данных конца 1980-х и начала 1990-х гг., и в ряде публикаций этого периода отмечалось ее увеличение. В эти годы возросла популяция конюг на южном побережье Чукотки, в частности на мысах Ягночымло (с 500–600 тыс. особей в 1987 г. до 1 млн. особей в 1990 г.) и Улахпэн (90–100 тыс. особей в 1985–1987 гг.), Имтук (20 тыс. особей в 1985–1987 гг.), Лысая Головка (30–40 тыс. особей). На о-ве Ратманова ее численность в 1991 г. составляла около 1 млн особей (Конюхов, 1991; Зубакин и др., 1992; Konyukhov et al., 1998; Конюхов, 1990; 1991; 2016; 2016а). На о-ве Верхотурова популяция большой конюги в 1975 г. оценивалась в 6 тыс. пар, в 1994 г. – 12 тыс. пар. Увеличение численности птиц напрямую связывается с отсутствием на острове наземных хищников (песца и горностая) в течение последних 10–15 лет (Вяткин, 1986; 2000; 2016). Практически на порядок возросло количество конюг на о-ве Арий Камень – с 10 пар в 1960 г. до 100 пар в 1989 г. и 150 особей в 2000 г. (Карташев, 1979; Артюхин, 1990; 1999; Зеленская, 2001). На о-ве Медный этот вид в небольшом числе был отмечен в 1960 и 1994 гг. (20 пар), но достоверный факт ее гнездования был установлен только в 2012 г., при этом численность птиц остается по-прежнему невысокой – как минимум 40 особей у северной оконечности мыса Черный (Карташев, 1961; Артюхин, 1999; 1999а; Кленова, Шиенок, 2012). На островах Курильской гряды общая численность большой конюги в 2000 г. была оценена, как минимум, в 450 тыс. особей (Артюхин и др., 2001). При этом авторы не исключали недоучеты и допускали их реальную численность в несколько миллионов. В результате последующих учетов в 2003 и 2009 гг. (Артюхин, 2003; 2016) было установлено, что на островах гнездится более 950 тыс. особей большой конюги, из которых как минимум 900 тыс. обитают на островах Чиринкотан, Матуа и Янкича. Эти данные превышают результаты учетов в 1963 г. (Велижанин, 1971) и 2000 г., но как считает автор (Артюхин, 2016), “это лишь следствие несовершенства использованных методов учета”. На о-ве Сахалин гнездование большой конюги установлено на мысе Терпения, где в 1981 г. было учтено 0.8–1.0 тыс. пар птиц (Нечаев, 1986). На о-ве Тюлений гнездование большой конюги известно с 1988 г., а согласно учетам 1989 г. здесь гнездилось не менее 600 пар птиц. В дальнейшем ее численность возросла и в 1990–1994 гг. составила 1.0–1.5 тыс. пар. При этом птицы использовали для гнездования подвалы домов, что совсем несвойственно этому виду. К началу 2000-х гг. в результате их обрушения и сноса численность вида снизилась в 2 раза и составила 700–800 особей (Трухин, Кузин, 1996; Трухин, 2006; 2016). На о-ве Ионы численность большой конюги оценивалась в 1974 и 2009 гг. Результаты этих исследований оказались достаточно сопоставимыми – 7 и 9 тыс. особей, соответственно (Харитонов, 1975; 1980; Андреев и др., 2012). На о-ве Матыкиль учеты птиц были неоднократными: в 1974 г. ее численность составляла более 220 тыс. особей, в 1984 г. – около 350 тыс. особей, в 1988 г. – от 600 тыс. до 1 млн особей, в 2006 г. – 1760.8 тыс. особей (Велижанин, 1975; 1978; Кондратьев и др., 1993; Зеленская, 2009). На островах Атыкан и Баран в 1974 г. ее численность оценивалась в 30 тыс. и 2 тыс. особей соответственно (Велижанин, 1975; 1978). Много позднее, в 2016 г., конюг отмечали как гнездящимися здесь, но учеты не проводили (Зеленская, 2018). На о-ве Хатемалью этот вид ранее не отмечался вовсе, но по результатам исследований Зеленской (2018) здесь, вероятно, гнездится порядка 100 особей. Из-за различий в методах учета судить о динамике численности птиц на Ямских о-вах не представляется возможным.
В настоящем сообщении мы рассматриваем некоторые аспекты гнездовой биологии большой конюги, обитающей на о-ве Талан (59°18′ с.ш., 149°04′ в.д.). Этот вид является важным компонентом биологического разнообразия и индикатором морских экосистем северной части Охотского моря, численность которого в последние годы стремительно сокращается (Кондратьев и др., 1992; Андреев и др., 2010; Андреев, Голубова, 2019). Остров Талан является единственной точкой в российских дальневосточных морях, где ведется долговременный мониторинг численности, фенологии размножения и продуктивности этого вида. Ежегодные исследования различных аспектов биологии размножения большой конюги проводятся также на островах Св. Лаврентия и Алеутских (Булдырь, Киска, Касаточий) и благодаря этому мы имеем возможность сопоставлять и обобщать результаты, полученные в разных участках гнездового ареала данного вида.
МАТЕРИАЛ И МЕТОДЫ
Биологию размножения большой конюги изучали в 1989–1993 гг. в период с 7 мая по 14 сентября и в 1999–2012, 2014–2019 гг. с 1 июня по 2 сентября на о-ве Талан, расположенном в Тауйской губе Охотского моря (рис. 1). Данные за 1987–1988, 1994, 1996 и 2013 гг. были получены из опубликованных источников (Kitaysky, 1996; Перемитин, 1999; 1999а; Кленова, Бахтурина, 2014) и архивных материалов лаборатории орнитологии ИБПС ДВО РАН.
Наблюдения за птицами проводились на склонах западной и северной экспозиции, где ежегодно и целенаправленно осматривались места, подходящие для гнездования этого вида. Поиск новых и осмотр известных с предыдущего года гнездовых камер осуществляли по возможности каждые 2 дня и после того, как активность взрослых птиц на склонах острова заканчивалась. Гнезда, в которых были обнаружены кладки, снова проверяли только накануне вылупления птенцов и в дальнейшем с регулярностью одного раза в 1–2 недели. В период схода молодых птиц в море гнезда проверяли как можно чаще. В результате этого были определены сроки откладки яиц, вылупления и схода птенцов, а также различные параметры продуктивности вида. Поскольку сроки заезда исследователей на остров в большинстве случаев совпадали с периодом насиживания яиц у больших конюг, дату появления в гнездах кладки рассчитывали косвенным путем, исходя из сроков вылупления птенцов и длительности инкубации, в норме равной 35 сут (Кондратьев и др., 1992). За весь период исследований под наблюдением находилось 1487 гнезда. До 2007 г. величина изученной выборки составляла 60–100 гнезд за сезон. В последующие годы она снизилась до 15–25 гнезд. После 2015 г. поиск доступных для наблюдений “поверхностных” гнезд стал затруднительным в связи с сокращением численности птиц, а многие из ранее известных гнезд не заселяются уже многие годы.
В 1999–2004, 2006–2009, 2014 и 2018 гг. для периодов откладки яиц и вылупления птенцов вычисляли медиану – это установленная дата, когда количество яиц или птенцов на участке было больше или равно 50% от общего числа отложенных. Успех размножения большой конюги оценивали по отношению числа покинувших гнезда птенцов к числу отложенных яиц; выживаемость птенцов – по отношению числа молодых птиц, доживших до схода на море, к числу вылупившихся птенцов; успех инкубации – по отношению числа вылупившихся птенцов к числу отложенных яиц. Большая конюга гнездится чаще всего плотными скоплениями и в глубоких недоступных для хищников каменных осыпях. В таких участках показатели успеха размножения птиц, как правило, достаточно высоки (Bedard, 1969; Sealy, 1968; Piatt et al., 1990). На о-ве Талан мы осматривали, в основном, наиболее доступные, “поверхностно” расположенные гнезда, кладки и птенцы в которых в первую очередь подвергаются воздействию хищников. В связи с этим, приведенные нами показатели гибели кладок и птенцов, возможно, не отражали общую ситуацию на острове, а общий успех размножения мог быть несколько занижен.
Динамику роста птенцов изучали в 1999–2006 гг. В качестве показателя использовали вес птенцов, который измеряли каждые 2 дня с момента их вылупления и до схода в море. Для получения сравнимых данных птенцов взвешивали в одинаковое время суток (Burger, 1988) и при отсутствии у них корма. Если птицы оказывались накормленными, их взвешивали позднее в этот же день или на следующий. Во время дождей гнезда не посещали, поэтому интервалы между взвешиванием в такие периоды увеличивались. Прирост веса рассчитывали по отношению массы тела птенца к его возрасту. В качестве показателя массы брали разницу между весом птенца накануне выхода из гнезда и в момент вылупления. Если вес новорожденного птенца известен не был, использовали средний показатель, полученный для птенцов из других гнезд. Всего под наблюдением находилось 70 птенцов. Частоту кормления изучали в 1999 (19.07–7.08) и 2000 гг. (10.07–8.08) путем взвешивания птенцов каждые два часа с 6:00 до 24:00. Под наблюдением находилось 10 и 8 гнезд, соответственно.
В ходе исследований измеряли и взвешивали доступные для наблюдателя яйца конюг, случайно найденных живых и погибших от хищников взрослых птиц или их останки (головы, крылья), а в конце сезона размножения – живых и мертвых сходящих в море молодых птиц, обнаруженных на территории острова. Причины гибели яиц и стадии развития в них эмбрионов устанавливали по окончании сезона размножения, разбивая яйца. Причины гибели взрослых птиц определяли по характеру повреждений, выясняли по возможности пол, а также их гнездовой статус по наличию на теле наседных пятен.
В 2017–2019 гг. для оценки влияния хищников на популяцию большой конюги регулярно осматривали полосу пляжа у западного склона острова длиной около 500 м. Во время каждого маршрута учитывали погибших птиц или их останки (тушки, части тела, перья, крылья), после чего все это удаляли с пляжа во избежание повторного учета в последующие дни. В 2017 г. эти работы проводили в период с 12.07 по 4.08, в 2018 – с 8.06 по 22.08, в 2019 г. – с 9.06 по 22.08.
Линейные промеры и взвешивания яиц и птиц были выполнены с помощью электронного штангенциркуля с точностью до 0.1 мм и весов “Pesola” – до 1 г. В тексте и таблицах средние величины приведены как среднее ± SE (стандартная ошибка). В табл. № 1 эти данные представлены таким же образом, как и в приведенных здесь же литературных источниках – среднее ± SD (стандартное отклонение). Все расчеты выполнены в программе “Excel” c использованием описательной статистики.
РЕЗУЛЬТАТЫ
Характеристика местообитаний и динамика численности
Остров Талан представляет собой горный останец, высота которого в разных участках варьирует от 180 до 220 м. Склоны южной и восточной экспозиций преимущественно скалистые, и круто обрываются в море. С западной стороны он менее крут и отделен от моря узким каменистым пляжем. Северный склон острова наиболее пологий и постепенно переходит в морскую террасу высотой 3–6 м над ур. м., шириной 150–200 м, окаймленную береговым каменистым валом и пляжем с нагромождениями плавника.
Большая конюга гнездится по всему периметру и высотному профилю острова, используя при этом естественные укрытия в различных биотопах. Наиболее высока плотность гнездования птиц в крупноглыбовых россыпях на северных и западных участках острова. В таких местах гнездовые камеры птиц чаще всего располагаются глубоко в камнях и практически не просматриваются. Здесь большая конюга образует совместные колонии с многочисленной ипаткой (Fratercula corniculata) и относительно редким топорком (Lunda cirrhata). В меньшем количестве птицы заселяют мелкоглыбистые осыпи, а также задернованные участки по периферии осыпей и склоновые кочкарники, покрытые зарослями вейника Лангсдорфа (Calamagrostis langsdorfii), где находятся основные гнездовья стáрика (Synthliboramphus antiquus), белобрюшки (Aethia psittacula) и топорка. Гнезда конюг в этих участках острова располагаются неглубоко, а иногда у самой поверхности. В начале 1990-х гг., например, плотность гнездования вида в таких участках составляла 0.5, 0.125 и 0.035 гнезд/м2, соответственно (Китайский, 1991). На склонах южной и восточной экспозиции некоторые птицы устраивают гнезда в расщелинах скал, но преимущественно селятся на крупноглыбовых осыпях в предвершинных участках острова и в завалах камней у подножия скал и бухт.
В соответствии с зонами высокой концентрации гнездовий большой конюги в начале 1990-х гг. на острове условно выделяли три больших “центра” воздушной активности птиц во время утреннего и вечернего роений – это западный, южный и восточный. “Западный” объединял порядка 30% островной популяции конюг, “южный” – не более 25% от численности птиц западного склона, а “восточный” – не менее чем в два раза превосходил сообщества западного склона. Хотя плотность гнездования птиц на восточном склоне была заметно ниже, площадь охватываемых роением склонов более чем в три раза превосходила таковые на западной оконечности острова. В эти годы численность большой конюги оценивалась в 950–1200 тыс. особей (Кондратьев и др., 1992а). С начала 2000-х годов численность птиц сокращалась и к моменту проведенных в 2008 г. учетов она составила 260–300 тыс. особей (Андреев и др., 2010). На фоне общего снижения численности большой конюги очаги относительно высокой концентрации птиц на южном и западном участках острова по-прежнему сохранялись, однако их количество заметно убыло в “восточном центре роения”. В последующие годы численность большой конюги на о-ве Талан продолжала падать и в 2016–2017 гг. она составляла 35–70 тыс. особей (Андреев, Голубова, 2019). При этом “южный центр роения” практически полностью распался, а с восточной стороны острова осталось всего несколько тысяч птиц. В настоящее время основная масса птиц гнездится на западном и северном склонах острова.
Морфологическое описание взрослых птиц
Половой диморфизм большой конюги хорошо виден на многих морфометрических параметрах. Самцы, как правило, тяжелее и имеют большую длину крыла, длину и высоту клюва (Jones, 1993; Конюхов, 1990; 1993; Gaston, Jones, 1998). Эти различия достаточно очевидны в представленной сводной таблице данных, собранных нами и другими исследователями на о-ве Талан (табл. 1). Статистическая достоверность этих различий была показана ранее на птицах с о-ва Талан и других регионов тихоокеанского побережья (Кленова и др., 2012; Пшеничникова и др., 2014; Pshenichnikova et al., 2015). При этом наиболее значимыми оказались такие параметры, как высота клюва, вес и длина крыла. Согласно данным Кленовой с соавторами (Кленова и др., 2012) одной лишь высоты клюва оказалось достаточно, чтобы классифицировать особей по полу с 94.3% надежностью. В начале сезона размножения птицы имеют яркую украшающую орнаментацию. На клюве развиваются четыре роговые пластины оранжевого цвета, на лбу – загибающийся вперед хохол, а по бокам головы – аурикулярные косицы из удлиненных белых перышек, которые тянутся от глаза назад. Выраженность орнамента практически идентична у самцов и самок, но с возрастом длина хохла, аурикулярных косиц и риктального щитка клюва заметно увеличиваются (Jones et al., 2000; Кленова и др., 2012; Пшеничникова и др., 2014; Pshenichnikova et al., 2015). Существенных различий в длине цевки и хвоста также не обнаружено, в то же время длина хохла и косиц являются отличительными признаками полового диморфизма конюг на о-ве Св. Лаврентия (Конюхов, 1993; Jones, 1993a).
Таблица 1.
Морфометрические параметры большой конюги с острова Талан
| Показатель | Среднее | SD | n | min–max | Годы | Источник |
|---|---|---|---|---|---|---|
| Самцы | ||||||
| Вес, г | 275.7 | 26.4 | 27 | 210–320 | 1997–2019 | Данные автора |
| 285 | 22 | 109 | – | 2008–2010 | Кленова и др., 2012 | |
| 293 | – | 70 | 236–355 | 1987–1992 | Кондратьев и др., 1992 | |
| Длина крыла, мм | 144.9 | 4.7 | 35 | 134–155 | 1997–2019 | Данные автора |
| 145.1 | 3.6 | 109 | – | 2008–2010 | Кленова и др., 2012 | |
| Длина хвоста, мм | 42 | 3.9 | 34 | 35–52 | 1997–2019 | Данные автора |
| Длина цевки, мм | 27.8 | 1.5 | 33 | 24.1–31.2 | 1997–2019 | Данные автора |
| 29.9 | 5.9 | 109 | – | 2008–2010 | Кленова и др., 2012 | |
| Длина клюва, мм | 12.3 | 0.9 | 31 | 10.4–14.3 | 1997–2019 | Данные автора |
| 12.4 | 0.6 | 109 | – | 2008–2010 | Кленова и др., 2012 | |
| Высота клюва, мм | 12.3 | 0.8 | 12 | 11.1–13.8 | 1997–2019 | Данные автора |
| 12.6 | 0.6 | 109 | – | 2008–2010 | Кленова и др., 2012 | |
| Длина косицы, мм | 39.7 | 5.7 | 109 | – | 2008–2010 | Кленова и др., 2012 |
| Самки | ||||||
| Вес, г | 268.4 | 31.4 | 26 | 205–340 | 1997–2019 | Данные автора |
| 268 | 21 | 101 | – | 2008–2010 | Кленова и др., 2012 | |
| 276 | – | 84 | 222–350 | 1987–1992 | Кондратьев и др., 1992 | |
| Длина крыла, мм | 144 | 5.1 | 30 | 132–154 | 1997–2019 | Данные автора |
| 141.9 | 3.5 | 101 | – | 2008–2010 | Кленова и др., 2012 | |
| Длина хвоста, мм | 40.8 | 3.7 | 28 | 36–53 | 1997–2019 | Данные автора |
| Длина цевки, мм | 27.2 | 1.2 | 29 | 24.2–29.3 | 1997–2019 | Данные автора |
| 28.6 | 1.1 | 101 | – | 2008–2010 | Кленова и др., 2012 | |
| Длина клюва, мм | 11.6 | 0.7 | 28 | 10.1–13.1 | 1997–2019 | Данные автора |
| 11.9 | 0.6 | 101 | – | 2008–2010 | Кленова и др., 2012 | |
| Высота клюва, мм | 10.9 | 0.4 | 18 | 10.1–11.8 | 1997–2019 | Данные автора |
| 10.7 | 0.6 | 101 | – | 2008–2010 | Кленова и др., 2012 | |
| Длина косицы, мм | 37.7 | 5.5 | 101 | – | 2008–2010 | Кленова и др., 2012 |
| Самцы + самки | ||||||
| Вес, г | 270.9 | 29.3 | 55 | 205–340 | 1997–2019 | Данные автора |
| 276 | 23 | 221 | – | 2008–2011 | Pshenichnikova et al., 2015 | |
| 301.3 | 22.2 | 110 | 238–364 | 1993 | Архив лаборатории | |
| 279.9 | 20.2 | 119 | 236–326 | 1988 | Архив лаборатории | |
| 283.4 | 26.8 | 77 | 214–356 | 1989 | Архив лаборатории | |
| Длина крыла, мм | 144.6 | 4.7 | 71 | 132–155 | 1997–2019 | Данные автора |
| 143.7 | 3.8 | 221 | – | 2008–2011 | Pshenichnikova et al., 2015 | |
| 140.6 | 4.2 | 94 | 132–153 | 1993 | Архив лаборатории | |
| Длина хвоста, мм | 41.5 | 3.8 | 66 | 35–53 | 1997–2019 | Данные автора |
| Длина цевки, мм | 27.5 | 1.4 | 66 | 24.1–31.2 | 1997–2019 | Данные автора |
| 28.9 | 1.5 | 94 | 25.5–33.6 | 1993 | Архив лаборатории | |
| Длина клюва, мм | 11.9 | 0.9 | 69 | 10.1–14.3 | 1997–2019 | Данные автора |
| 12.2 | 0.7 | 221 | – | 2008–2011 | Pshenichnikova et al., 2015 | |
| 12.6 | 0.9 | 94 | 10.5–15 | 1993 | Архив лаборатории | |
| Высота клюва, мм | 11.4 | 1.1 | 39 | 9.8–14.4 | 1997–2019 | Данные автора |
| 11.7 | 1.1 | 221 | – | 2008–2011 | Pshenichnikova et al., 2015 | |
| 12.9 | 1.2 | 94 | 10.5–15.4 | 1993 | Архив лаборатории | |
| Длина хохла, мм | 38.8 | 5.6 | 221 | – | 2008–2011 | Pshenichnikova et al., 2015 |
| Длина косицы, мм | 27.5 | 4.1 | 221 | – | 2008–2011 | Pshenichnikova et al., 2015 |
Вес большой конюги варьирует между колониями, год от года, в течение сезона и суток и в зависимости от гнездового статуса птиц (Конюхов, 1990; Jones, 1993; Gaston, Jones, 1998). На о-ве Талан вес птиц в период размножения был несколько выше в конце 1980-х и в начале 1990-х гг., чем в последующие годы (табл. 1). По сравнению с колониями Берингова моря и тихоокеанского побережья, птицы здесь оказались крупнее и имели большую длину крыла и высоту клюва (Пшеничникова и др., 2014). Учитывая (Walsh et al., 2005; Pshenichnikova et al., 2015) генетическую гомогенность птиц в пределах ареала, различия морфометрических параметров могут быть связаны с возрастным составом популяции и экологическими особенностями вблизи гнездовых колоний.
Биология размножения
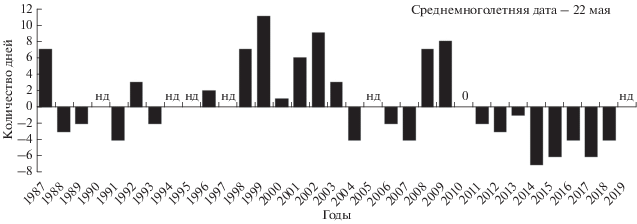
Фенология. Массовый прилет большой конюги на о-в Талан происходит в конце апреля – в первых числах мая. В 1987 г. птицы появились 29.04, в 1998 г. – 26.04, а в 2003 г. их отмечали уже 21.04 (Кондратьев и др., 1992; Утехина, 1999; наши данные). В 1988–2013 гг. сроки появления первых кладок варьировали между 18.05 в 1991 г. и 2.06. в 1999 г., а самые поздние в сезоне были отмечены в середине или в конце июня (14–28.06). В последующие годы откладка яиц заканчивалась уже в конце первой декаде июня, при этом сроки начала гнездования птиц в этот период были стабильно ранними (15–18.05) (рис. 2). В соответствии с известными датами прилета конюг в 1987, 1998 и 2003 гг. предгнездовой период (отрезок времени с момента появлением первых птиц на острове до начала откладки яиц) большой конюги составлял в эти годы 30–35 дней. Средняя дата начала яйцекладки в 1987–2019 гг. приходилась на 22 мая. В ранние по срокам размножения годы медиана периода откладки яиц варьировала между 27 и 30 мая, а в поздние сезоны она приходилась на 4–11 июня.
Рис. 2.
Ежегодные отклонения от среднемноголетнего значения сроков начала откладки яиц у большой конюги на острове Талан (нд – нет данных).
В кладке содержится одно яйцо. Его длина по нашим данным варьировала от 49.15 до 60.0 мм (в среднем 55.45 ± 0.29, n = 58), ширина – от 32.2 до 39.2 мм (в среднем 37.20 ± 0.15, n = 58). Согласно данным Перемитина (1999) размеры яйца 52.1–59.2 × 36.2–38.1 мм (в среднем 56.1 ± 1.01 × 36.8 ± 0.29, n = 6), а масса свежеотложенного – 32.1–40.3 (в среднем 36.9 ± 1.05, n = 6). Исследования (Кондратьев и др., 1992; Кондратьев, 1993) на о-ве Талан показали, что режимы обогрева яиц у разных пар конюг сильно различаются. В некоторых случаях птицы оставляли гнезда на несколько суток, после чего насиживание возобновлялось. Поэтому продолжительность периода инкубации варьирует в широких пределах – от 35 сут в нормальных условиях до 42, в случае его прерывания.
В зависимости от сроков начала откладки яиц вылупление птенцов начиналось 19.06 в 2014 г. и 7.07 в 1999 г. В некоторые годы поздних новорожденных птенцов отмечали еще в конце июля и в начале августа. Среднемноголетняя дата начала вылупления – 26 июня. В годы с ранним гнездованием медиана периода вылупления птенцов приходилась на 29.06–4.07, в другие сезоны – в период с 9 по 16.07.
На протяжении ряда лет сход молодых птиц в море начинался обычно в конце июля или в начале августа и продолжался до конца августа. В поздние сезоны первых слетков наблюдали только в конце первой декады августа. В 1990 г. на острове сошли единичные птицы из гнезд с поздними кладками, которых стали отмечать только с 17–19 августа. В 2007, 2010–2011, 2014–2015, и в 2017, 2019 гг. сходящих молодых птиц не наблюдали вовсе, поскольку все они погибали в гнездах на разных стадиях роста, а в 2016 г. в гнездах конюг птенцов не было вовсе, поскольку все кладки были брошены до начала их вылупления.
По мере схода в море молодых птиц происходит постепенный отлет взрослых особей с острова, что в нормальные по репродуктивным показателям годы продолжалось до конца августа. При отсутствии птенцов взрослые конюги начинали покидать остров в начале июля и, как правило, к концу второй декады июля или к началу августа их уже не отмечали.
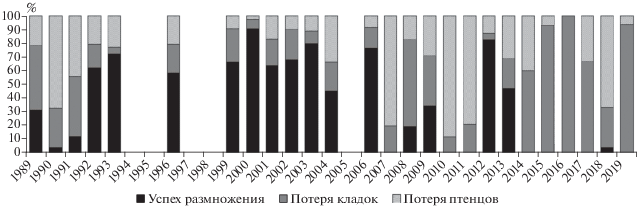
Продуктивность. Успех размножения большой конюги варьировал от 0 до 90.6% и в среднем за весь период наблюдений составил 35.64 ± 5.96 (n = 29), успех инкубации – от 0 до 95% (в среднем 66.13 ± 5.44, n = 26), успех птенцового периода – от 0 до 96.7% (в среднем 44.47 ± 7.46, n = 26) (табл. 2). В конце 80-х и в течение 90-х гг. успех размножения птиц колебался в достаточно широких пределах от 4.2 до 72.2% и в среднем составил 39.56%. В 1999–2006 гг. он был стабильным и относительно высоким – в среднем 70.01% – и варьировал от 45.59 до 90.62%. В последующие годы этот показатель заметно снизился и в среднем составил 14.43%. За исключением 2012 г., когда успех размножения составил 82.5%, он варьировал от 0 до 47.4%. С 2014 г. сезоны с “нулевыми” показателями успеха размножения стали регулярными.
Таблица 2.
Показатели продуктивности большой конюги на контрольных площадках острова Талан в 1987–2019 годах
| Показатель | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 96 | 99 | 00 | 01 | 02 | 03 | 04 | 06 | 07 | 08 | 09 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Всего гнезд | 55 | 50 | 60 | 71 | 100 | 82 | 79 | 190 | 19 | 77 | 64 | 53 | 59 | 64 | 68 | 71 | 70 | 57 | 38 | 34 | 53 | 40 | 19 | 25 | 15 | 15 | 24 | 24 | 16 |
| Всего погибших яиц | – | – | 28 | 20 | 44 | 14 | 4 | – | 4 | 19 | 4 | 10 | 13 | 6 | 14 | 10 | 14 | 36 | 14 | 4 | 11 | 2 | 4 | 10 | 14 | 15 | 16 | 7 | 15 |
| Причины гибели: | |||||||||||||||||||||||||||||
| Брошены, ненасиженные | 3 | 2 | 9 | 7 | 0 | 2 | 1 | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| Брошены, насиженные | – | – | 25 | 18 | 35 | 7 | 4 | – | 2 | 18 | 4 | 6 | 11 | 5 | 14 | 10 | 14 | 34 | 14 | 4 | 11 | 2 | 4 | 10 | 14 | 15 | 16 | 7 | 15 |
| из них: | |||||||||||||||||||||||||||||
| “болтун” | – | – | 3 | 1 | 0 | 0 | 0 | – | 2 | 1 | 1 | 0 | 1 | 2 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Обвал гнезда | – | – | 0 | 0 | 0 | 0 | 1 | – | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Беспокойство | – | – | 0 | 0 | 0 | 0 | 0 | – | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Исчезли | 16 | 4 | 0 | 0 | 1 | – | 0 | 6 | 2 | 4 | 2 | 1 | 2 | 0 | 8 | 6 | 7 | 3 | 0 | 1 | 0 | 5 | 5 | 5 | 8 | 6 | 0 | ||
| Съедено полевками | – | – | 2 | 6 | 10 | 9 | 1 | – | – | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 2 | 4 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 |
| Всего вылупилось птенцов | – | – | 32 | 51 | 56 | 68 | 75 | – | 15 | 58 | 60 | 43 | 46 | 58 | 54 | 60 | 56 | 21 | 24 | 30 | 42 | 38 | 15 | 15 | 1 | 0 | 8 | 17 | 1 |
| Всего погибших птенцов | – | – | 13 | 48 | 44 | 17 | 18 | – | 4 | 7 | 2 | 9 | 6 | 7 | 23 | 6 | 56 | 10 | 11 | 30 | 42 | 5 | 6 | 15 | 1 | 0 | 8 | 16 | 1 |
| Причины гибели: | |||||||||||||||||||||||||||||
| Голодание (погибли в гнезде) | – | – | 4 | 39 | 44 | 10 | 7 | – | 2 | 4 | 0 | 7 | 1 | 6 | 10 | 6 | 33 | 7 | 8 | 25 | 34 | 5 | 6 | 15 | 1 | 0 | 7 | 10 | 1 |
| Исчезли (ранний сход) | – | – | 9 | 9 | 0 | 7 | 11 | – | 1 | 0 | 2 | 2 | 2 | 1 | 13 | 0 | 23 | 3 | 3 | 5 | 8 | 0 | 0 | 0 | 0 | 0 | 1 | 6 | 0 |
| Убиты | – | – | 0 | 0 | 0 | 0 | 0 | – | 1 | 3 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Беспокойство | – | – | 0 | 0 | 0 | 0 | 0 | – | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Всего сошло птенцов | – | – | 19 | 3 | 12 | 51 | 57 | – | 11 | 51 | 58 | 34 | 40 | 51 | 31 | 54 | 0 | 11 | 13 | 0 | 0 | 33 | 9 | 0 | 0 | 0 | 0 | 1 | 0 |
| Успех инкубации, % | – | – | 53.3 | 71.8 | 56 | 82.9 | 94.9 | – | 78.9 | 75.3 | 93.7 | 81.1 | 77.9 | 90.6 | 79.4 | 84.5 | 80 | 36.8 | 63.6 | 88.2 | 79.2 | 95 | 78.9 | 60 | 6.7 | 0 | 33.3 | 70.8 | 6.2 |
| Успех птенцового периода, % | – | – | 59.4 | 5.9 | 21.4 | 75 | 76 | – | 73.3 | 87.9 | 96.7 | 79.1 | 86.9 | 87.9 | 57.6 | 90 | 0 | 52.4 | 54.2 | 0 | 0 | 86.8 | 60 | 0 | 0 | 0 | 0 | 5.9 | 0 |
| Успех размножения, % | 63 | 45 | 31.7 | 4.2 | 12 | 62.2 | 72.1 | 8 | 57.8 | 66.2 | 90.6 | 64.1 | 67.8 | 79.7 | 45.6 | 76 | 0 | 19.3 | 34.2 | 0 | 0 | 82.5 | 47.4 | 0 | 0 | 0 | 0 | 4.2 | 0 |
Брошенные птицами яйца мы отмечали практически ежегодно (рис. 3). Их количество варьировало от 5 до 100% в разные годы. Среди них встречались как насиженные яйца, так и к насиживанию которых птицы не приступали. При этом доля последних была всегда значительно ниже, по сравнению с тем количеством яиц, в которых находились погибшие на различных стадиях развития эмбрионы (табл. 2). Из общей выборки гнезд на долю неоплодотворенных яиц приходилось от 1.4 до 10.5% всех отложенных яиц, при этом “болтуны” насиживались птицами на протяжении всего инкубационного периода. В редких случаях (от 1.2 до 1.5% от всех отложенных яиц) кладка погибала при повреждении гнездовой камеры в результате обвалов осыпей. В некоторых гнездах брошенные яйца исчезали или их находили частично съеденными, что было связано с деятельностью наземных и пернатых хищников (см. раздел “Хищничество”) или терялись где-то в норе.
Количество погибших птенцов варьировало от 3 до 100% в разные годы (рис. 3). Случаи их гибели по вине человека или хищника (учитывалось наличие телесных повреждений) были зарегистрированы достаточно редко. Чаще всего птенцы погибали от голода, и таких мы обнаруживали непосредственно в норах или на выходе из нее. Некоторые уже подросшие птенцы покидали гнезда в достаточно раннем возрасте и не имели шансов на дальнейшее выживание. Высокая смертность птенцов сопровождалась иногда неблагоприятными погодными условиями в различные периоды сезона размножения. В 1990-х гг. массовую гибель птенцов отмечали лишь однажды, в 1990 и 1991 гг., когда большинство птенцов погибло в первые две недели после вылупления. С начала 2000-х гг. такие случаи отмечали уже почти каждый год. В 2004, 2007–2008, 2010–2011, 2014–2015, 2017 и 2019 гг. в течение короткого периода мы наблюдали гибель всех или большинства вылупившихся птенцов. В 1990, 2004 и 2008 гг. среди выживших по итогам сезона были только птенцы из поздних кладок. В 2006, 2009, 2012–2013 гг. некоторые птенцы погибали в течение сезона и в разном возрасте после кратковременных ухудшений погодных условий. В 2016 и 2018 гг. взрослые птицы выкармливали птенцов практически в течение месяца после их вылупления, но в итоге все они погибли к началу августа.
Развитие птенцов. Изучение динамики роста птенцов большой конюги показало значительные колебания их веса, как в многолетнем аспекте, так и на различных этапах гнездового периода. Наиболее высокие показатели ежедневного прироста веса птенцов отмечали в 1999, 2000 и 2003 гг., что отразилось на их хорошей весовой кондиции в течение всего периода пребывания в гнезде (табл. 3, 4). В эти же годы вес слетков, пойманных на территории острова в период их схода в море, был также наиболее высоким. Многие молодые птицы в эти годы были полностью оперены и могли летать. Например, в 2002–2003 гг. масса летных птиц варьировала от 180 до 255 г. В 1999 и 2000 гг. количество летных птенцов составило 50 и 60% от всех отловленных, соответственно, длина крыла у которых варьировала от 120 до 140 мм. У птиц накануне схода в море она составила в среднем 120.75 ± 1.10 (n = 4, 118–123) и 122.87 ± 1.75 (n = 8, 117–130) соответственно. Частота кормления птенцов в эти же годы в среднем составила 3.04 ± 0.21 (n = 21, 1–4) и 3.09 ± 0.21 (n = 22, 1–5) раз в сутки. Вполне понятно, что средняя масса сходивших в море птенцов в разные годы несколько занижена, поскольку в их числе не учитывались птицы, успешно слетевшие в море. В то же время этот показатель хорошо согласовывался с массой птенцов, находившихся в гнездах. Судя по числу отловленных в разные годы слетков, сходящих в море, можно предположить, что в благоприятные годы слетало до 80% молодых птиц. В такие сезоны встречаются три категории слетков. 1) Пешие – частично пуховые и ослабленные птицы, масса которых существенно ниже массы птиц, находящихся в гнезде накануне схода, вероятно из поздних выводков, их количество небольшое. 2) Нелетные – засидевшиеся в гнездах птицы, с недостаточным весом и ослабленные, но полностью оперенные. 3) Летные – хорошо оперенные птицы, в хорошей весовой кондиции, вероятно не долетевшие до водной поверхности.
Таблица 3.
Весовые (г) и возрастные (сут) параметры (среднее ± SE (min–max; n)) птенцов большой конюги на различных этапах гнездового периода
| Год | Вес | Возраст накануне схода в море | Прирост веса, г/сут | ||
|---|---|---|---|---|---|
| новорожденных | максимальный | накануне схода в море | |||
| 19961 | – | – | 183 ± 16.58 (120–246; 8) |
32.3 (29–40; 11) |
– |
| 1999 | 33.83 ± 0.52 (25–40; 3) |
296.00 ± 16.73 (236–350; 6) |
289.00 ± 18.73 (245–340; 6) |
33.41 ± 0.52 (30–35; 12) |
7.38 ± 0.54 (6.2–9.0; 5) |
| 2000 | 29.94 ± 1.07 (24.5–33.5; 9) |
271.50 ± 8.83 (240–330; 12) |
248.75 ± 9.79 (200–315; 12) |
32.82 ± 0.62 (28–39; 17) |
6.64 ± 0.26 (5.3–8.1; 12) |
| 2001 | 33.66 ± 0.72 (32.5–35.3; 3) |
158.42 ± 14.07 (110–215; 7) |
134.90 ± 10.32 (98–195; 10) |
31.16 ± 0.99 (25–37; 12) |
3.47 ± 0.39 (1.9–5.3; 7) |
| 2002 | 30.33 ± 1.85 (20.0–37.8; 9) |
245.62 ± 5.46 (230–270; 8) |
219.00 ± 4.00 (200–240; 10) |
36.52 ± 0.48 (33–40; 17) |
5.14 ± 0.15 (4.4–5.8; 10) |
| 2003 | 32.18 ± 1.64 (25.5–40.8; 8) |
268.33 ± 13.27 (230–320; 6) |
250.00 ± 17.32 (200–290; 5) |
34.72 ± 0.37 (31–37; 18) |
6.25 ± 0.53 (4.8–7.4; 5) |
| 2004 | 32.50 ± 2.33 (24.0–37.5; 5) |
168.33 ± 4.01 (160–180; 6) |
145.00 ± 20.20 (105–170; 3) |
30.60 ± 1.16 (27–33; 5) |
3.86 ± 0.88 (2.3–5.4; 3) |
| 20062 | – | 227.14 ± 14.26 (180–280; 7) |
209.28 ± 11.04 (160–240; 7) |
35.00 ± 0.54 (33–36; 5) |
4.94 ± 0.35 (3.9–5.8; 5) |
Таблица 4.
Весовые и морфометрические параметры (среднее ± SE (min–max; n)) слетков больших конюг, обнаруженных на территории острова Талан в разные годы
| Год | Вес, г | Длина крыла, мм | Длина цевки, мм | Длина клюва, мм | Длина хвоста, мм |
|---|---|---|---|---|---|
| 1987 | 126.20 ± 3.04 (98–210; 60) |
113.58 ± 1.99 (90–206; 61) |
27.03 ± 0.15 (24–30; 52) |
10.64 ± 0.07 (9.5–12.0; 51) |
– |
| 1988 | 131.00 ± 3.88 (102–183; 21) |
– | – | – | – |
| 1989 | 114.90 ± 4.46 (100–125; 5) |
110.50 ± 0.50 (110–111; 2) |
– | – | – |
| 1995 | 134.85 ± 3.06 (89–210; 56) |
111.33 ± 1.02 (94–129; 56) |
– | – | – |
| 19961 | 119.9 ± 1.04 | – | – | – | – |
| 1997 | – | – | – | – | – |
| 1998 | 122.57 ± 0.90 (94–154; 191) |
108.99 ± 0.42 (83–122; 192) |
28.22 ± 0.32 (26.4–29.2; 8) |
10.95 ± 0.16 (10.2–11.4; 8) |
– |
| 1999 | 169.93 ± 8.61 (92–270; 33) |
120.81 ± 2.25 (92–135; 32) |
27.63 ± 0.28 (24.4–30.0; 26) |
10.87 ± 0.18 (9.0–13.1; 26) |
39.92 ± 1.24 (28–50; 25) |
| 2000 | 177.41 ± 8.99 (113–255; 29) |
123.00 ± 1.98 (95–140; 33) |
27.67 ± 0.32 (24.3–32.2; 24) |
11.10 ± 0.18 (9.0–13.2; 24) |
39.75 ± 1.58 (25–58; 24) |
| 2001 | 125.12 ± 0.98 (95–180; 218) |
111.67 ± 0.46 (90–129; 217) |
26.05 ± 0.11 (19.2–34.2; 212) |
10.63 ± 0.04 (9.1–13.2; 213) |
35.05 ± 0.29 (19–43; 209) |
| 2002 | 160.22 ± 6.04 (117–244; 35) |
120.91 ± 1.58 (105–137; 35) |
27.26 ± 0.31 (23.2–30.1; 35) |
10.64 ± 0.11 (9.2–13.2; 35) |
37.89 ± 0.74 (30–47; 28) |
| 2003 | 146.50 ± 5.80 (110–255; 42) |
117.27 ± 1.52 (101–138; 37) |
27.60 ± 0.23 (23.6–31.0; 37) |
10.29 ± 0.11 (8.5–11.5; 37) |
37.86 ± 0.77 (31–49; 37) |
| 2004 | 121.27 ± 1.27 (95–155; 104) |
111.80 ± 0.57 (95–122; 103) |
25.91 ± 0.26 (20.5–28.5; 40) |
10.20 ± 0.09 (9.1–11.6; 40) |
35.71 ± 0.66 (23–43; 41) |
| 2005 | – | – | – | – | – |
| 2006 | 140.67 ± 2.64 (100–200; 58) |
117.48 ± 1.01 (86–131; 54) |
26.40 ± 0.43 (23.6–29.9; 17) |
10.58 ± 0.13 (9.6–11.2; 15) |
38.60 ± 0.70 (30–46; 25) |
| 2007 | 117.30 ± 2.42 (105–135; 13) |
103.33 ± 2.67 (78–112; 12) |
– | – | – |
| 2008 | 109.68 ± 2.92 (80–138; 22) |
104.07 ± 2.65 (61–117; 27) |
– | – | 27.54 ± 1.18 (22–35; 11) |
| 2009 | 113.05 ± 2.47 (84–150; 36) |
112.15 ± 0.86 (97–124; 51) |
– | – | – |
| 2010–2011 | Нет слетков | ||||
| 2012 | 138.17 ± 1.49 (105–205; 119) |
114.79 ± 0.46 (101–128; 119) |
– | – | – |
| 2013 | – | – | – | – | – |
| 2014–2019 | Нет слетков | ||||
В неблагоприятные годы вес птенцов был одинаково низким на всех стадиях их развития. В 2001– 2002, 2004 и 2006 гг. они развивались достаточно слабо и, находясь в гнезде, не набирали должного веса. У слетков, пойманных на пути следования к морю, в эти годы он был еще ниже. Недостаточно высокие показатели веса были отмечены у молодых птиц и в предыдущие годы. Некоторые из них начинали покидать гнезда раньше обычного и до достижения 30-ти суточного возраста. В 1996, 1998, 2001, 2004, 2012 гг. на острове наблюдался массовый сход молодых птиц. Число птиц, прошедших через территорию острова, увеличивалось в 6–7 раз по сравнению с другими годами, что хорошо видно на количестве пойманных в эти годы птиц (табл. 4). В такие сезоны за короткий период обычно сходили птенцы различных возрастных категорий и почти все из них были нелетными, слабыми и часто обильно покрытыми пухом. В 1996 г., например, количество нелетных птенцов составило 60% (Перемитин, 1999а). Задержка темпов роста хорошо отображалась на показателях веса и длины крыла птиц. Подобное явление часто провоцировалось штормовой погодой, но в основе лежит неблагоприятный ход всего гнездового периода. В такие сезоны наблюдалась высокая гибель молодых птиц, как на суше, так и в море.
Прежде чем достигнуть моря, пешие молодые птицы теряют в различные годы от 15 до 40% собственного веса, что значительно осложняет их дальнейшую жизнь. На о-ве Талан это связано с обширной площадью вейниковой террасы в северной части острова, которую птицы вынуждены преодолеть на пути к морю. Довольно часто пешие птицы погибают от истощения, так и не достигнув моря, а вполне летные падают в траву, не достигнув моря. В западной части острова конюги преодолевают пляж около 10 м шириной, и здесь погибают чаще всего изначально ослабленные и недокормленные птицы.
Хищничество
Из наземных и пернатых хищников, причастных к гибели взрослых конюг, их птенцов и кладок на острове обитают сапсан (Falco peregrinus), белоплечий орлан (Haliaeetus pelagicus), вóрон (Corvus corax), тихоокеанская чайка (Larus schistisagus), горностай (Mustela erminea), лисица (Vulpes vulpes) и три вида полевок – красно-серая (Clethrionomys rufocanus), красная (C. rutilus) и экономка (Microtus oeconomus).
Численность сапсанов варьировала. В начале 1990-х гг. их обычно наблюдали во время весенних и осенних миграций, но на острове они не гнездились (Кондратьев и др., 1992). С начала 2000 г. на южном и восточном склонах острова нерегулярно гнездилось по одной паре птиц. Заметно увеличилось и количество соколов, прилетающих с других участков побережья. В настоящее время две пары по-прежнему придерживаются своих территорий, но никаких признаков гнездования не отмечается. При этом заметно сократилось и количество залетных птиц. Сапсан охотится на взрослых птиц во время утреннего и вечернего роения, и чаще всего в качестве жертв выбирает одиночных особей, слетающих со склона или подлетающих к нему. Наблюдались также случаи поимки конюг над водой. Как показали исследования, состав питания сапсана на о-ве Талан полностью зависит от процесса размножения большой конюги. В течение июня большая конюга и в меньшей мере стáрик составляют основу его рациона (табл. 5). В этот период у конюг проходит инкубация, и они регулярно посещают свои гнездовья. В случае успешного для большой конюги вылупления и выкармливания птенцов сокол продолжает активную охоту на этих птиц практически до середины августа, и только при их отсутствии переключается на другую доступную для него добычу. Например, в сезоны 2017–2019 гг., когда наблюдалась массовая гибель кладок и птенцов, взрослые конюги окончательно покинули остров 19 июля, 3 августа и 22 июля, соответственно, что достаточно наглядно отразилось на видовом составе добываемых сапсаном птиц (табл. 5).
Таблица 5.
Результаты учета убитых сапсаном птиц на западном пляже острова Талан
| Вид птиц | 2017 | 2018 | 2019 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| июнь | июль | август | июнь | июль | август | июнь | июль | август | |
| Большая конюга | – | 3 (9%) | – | 19 (59%) | 49 (82%) | 2 (11%) | 16 (59%) | 15 (27%) | 0 |
| Старик | – | 10 (28%) | – | 12 (38%) | 7 (12%) | 1 (5%) | 11 (41%) | 19 (34%) | 0 |
| Белобрюшка | – | 30 (63%) | – | 1 (3%) | 4 (6%) | 12 (63%) | 0 | 22 (39%) | 5 (62%) |
| Другие виды (тупик-носорог, моевка) | – | – | – | 0 | 0 | 4 (21%) | 0 | 0 | 3 (38%) |
На острове постоянно обитают три пары нерегулярно гнездящихся белоплечих орланов. Кроме того, для охоты на морских птиц сюда прилетают молодые и взрослые особи с других участков побережья. Хотя кайры и моевки являются предпочитаемой добычей гнездящихся на острове орланов, доля конюг в их питании была достаточно высокой и составляла 14.6% (Утехина, 2004). Случаи охоты орланов на конюг мы отмечали неоднократно, и обычно это происходило во время утреннего и вечернего роения. Однажды мы наблюдали охоту одновременно трех птиц. Орланы вылавливают птиц как в воздухе над морем, так и сидящих на воде. Несмотря на то, что конюги развивают большую скорость во время полета и способны заныривать в воду, попытки их поимки такими крупными и маломаневренными хищниками часто бывают успешными. Наблюдали случаи, когда орланы отбивали добычу у сапсана, преследуя его в полете и вынуждая бросить жертву.
Тихоокеанские чайки и вóроны обычно подъедают остатки добычи сапсана и тушки уже погибших конюг, выслеживают и убивают подранков, ослабленных и больных птитц. Довольно часто они активно отбивали добычу у сапсана, как в полете, так и на присаде. В течение всего гнездового сезона взрослые особи конюг в их питании составляли от 3 до 9.65% (Кондратьева, 2004). Пуховые птенцы в период их пребывания в гнездах практически недоступны для чаек. Однако в конце июля и в течение августа, когда молодые конюги покидают гнезда и сходят в море, чайки активно выискивают их среди камней, а также патрулируют береговую полосу. В этот период слетки большой конюги в питании чаек достигают 15.1%. Таким же образом поступают и вóроны. Однажды мы наблюдали нескольких птиц (взрослых и молодых), которые в охотничьем азарте в массе убивали молодых конюг, идущих по приливно-отливной зоне берега моря к воде. Увидев очередную жертву, они принимались тут же ловить ее, бросая ранее убитую птицу, и так повторялось многократно. Тихоокеанские чайки и вóроны, вероятно, подбирают брошенные яйца из хорошо просматриваемых поверхностных гнездовых камер или яйца, случайно выкатившиеся наружу. Об этом свидетельствуют находки открыто лежащих расклеванных яиц конюг на вершинном плато или на склонах острова.
Деятельность мышевидных грызунов по отношению к кладкам большой конюги невелика, и, как в случае со стáриком и белобрюшкой (Голубова, 2011; 2015), полевки выступают в качестве “утилизаторов” уже брошенных по разным причинам кладок. Обычно они надгрызают скорлупу яйца и полностью или частично выедают его содержимое. Количество брошенных в течение сезона кладок в разные годы варьировало от 5 до 100%, при этом доля гнезд, в которых впоследствии были съедены кладки, варьировала от 1 до 11% от всех отложенных или от 5 до 64% от всех брошенных. Большинство гнезд конюг располагаются в каменных осыпях и вполне доступны для горностая. Поэтому исчезновение яиц из некоторых из этих гнезд можно напрямую связать с деятельностью этого хищника, хотя визуальных свидетельств у нас не было. В то же время мы наблюдали молодого горностая, который достаточно легко перебегал по пляжу с пуховым птенцом конюги, который по размеру был в половину его тела. Иногда в норах были обнаружены погибшие птенцы с различными травмами на теле, которые также могли быть нанесены горностаем или взрослыми птицами других видов.
Лисы обитали на острове всегда, но их число было разным. В 1990-х гг. здесь наблюдали до 3 пар одновременно, но с начала 2000-х гг. и до настоящего времени здесь постоянно живет одна нерегулярно размножающаяся пара. К очередному летнему сезону лис из прошлогодних выводков (1–4 щенка) никогда не встречали. В зимний период, когда кормовая база лис на острове существенно сокращается, они уходят по льду на материк. Фактов разорения гнезд больших конюг лисами и их нападения на взрослых здоровых птиц не отмечали, хотя они активно охотятся на стáриков (Голубова, 2011; 2018). Лисы, как и горностаи, вероятно, нападают на идущих к морю слетков, поскольку задавленных или обезглавленных молодых конюг на склонах острова находили достаточно часто, а также подбирают трупы уже погибших птиц.
ОБСУЖДЕНИЕ
Согласно многолетним наблюдениям сроки начала гнездования большой конюги на о-ве Талан варьировали. Чаще всего к откладке яиц птицы приступали во второй половине мая и лишь в некоторые годы это происходило в конце мая или первых числах июня. Как показали предыдущие исследования (Голубова, 2007), существенное влияние на сроки размножения морских птиц, в том числе большой конюги, оказывают состояние ледового покрытия Охотского моря. В частности, это сроки освобождения Тайуской губы ото льда, и, как следствие, температура поверхностных морских вод. Наиболее позднее гнездование этого вида было отмечено в 1998–1999, 2001–2003 гг., когда ледовитость Охотского моря была самой высокой за весь период наших исследований (Устинова и др., 2002). В эти годы полное очищение Тауйской губы ото льда отмечалось в период с 27 мая по 27 июня. В некоторые относительно малоледовитые сезоны, например в 2008–2009 и 2012–2013 гг., ледовая обстановка у берегов острова усугублялась ветрами южных румбов, которые в конце мая или в первой декаде июня удерживали льды в прибрежной зоне Тауйской губы, что также способствовало позднему гнездованию большой конюги. Однако такие условия не всегда критично сказывались на сроках размножения этого вида, поскольку птицы кормятся на значительном удалении от колоний, где льдов в этот период уже не бывает. Наличие разреженного прибрежного льда вблизи острова никоим образом не влияло и на активность птиц в море во время утреннего и вечернего роения.
Другим, достаточно важным в северных широтах и влияющим на сроки начала гнездования большой конюги на о-ве Талан фактором является состояние снежного покрова (Голубова, 2007). Птицы прилетают уже в конце апреля и посещают гнездовые колонии, когда те еще покрыты снегом. Интенсивное таяние снега начинается в середине мая, но в годы с обильными и неожиданными снегопадами он остается на склонах острова до конца мая, что также способствует задержке яйцекладки. Подобное наблюдали в 1987, 1989, 2004, 2006–2009 и 2014 гг. При этом, поскольку гнезда большой конюги на о-ве Талан в том или ином количестве располагаются практически по всему периметру острова и по всему высотному профилю, даже в самые неблагоприятные периоды существуют менее или более заснеженные участки, где птицы откладывают яйца раньше или позже других. Некоторые осыпи на северном склоне острова остаются под снегом до середины июня, соответственно и откладка яиц в этих участках происходит позднее. Влияние снежного покрова на сроки размножения большой конюги наблюдали на о-ве Св. Лаврентия, когда начало откладки яиц у этого вида сдвинулись на две недели, и при этом некоторые пары откладывали яйца прямо на снежники (Sealy, 1975). Неожиданные снегопады вызывали задержку начала гнездования большой конюги и в южных частях ареала, в частности на о-ве Булдырь, где в нормальных условиях осыпи освобождаются от снега уже к середине мая (Knudtson, Byrd, 1982; Hipfner, Byrd, 1993). В то же время на мысе Улахпэн (Чукотка), где гнездовья конюг расположены на склонах южной экспозиции и хорошо продуваются теплыми ветрами, поздний сход снега не оказывает влияние на начало сезона их размножения (Конюхов, 1997).
При отсутствии этих лимитирующих факторов главным условием начала размножения планктоноядных чистиковых птиц, в частности большой конюги, является обилие пищи в прибрежных водах (Bedard, 1969a; Конюхов, 1997; Fraser et al., 1999). Весенний биологический сезон в северной части Охотского моря начинается в апреле–мае, когда в некоторые годы значительная часть акватории моря покрыта дрейфующими льдами, и заканчивается в конце июня. В этот период наблюдается пик развития фитопланктона и начинается нерест эвфаузиид (Thysanoessa raschii), продолжающийся до конца сентября. Повсеместно идет размножение различных видов копепод (Calanus glacialis, Neocalanus plumchrus и др.) (Афанасьев и др., 1994; Волков, Ефимкин, 2002). Этот планктон составляет основу питания большой конюги на о-ве Талан, и его обилие в этот период обеспечивает начало ее гнездования – самого раннего среди других обитающих на острове морских птиц (Kitaysky, 1996; Kitaysky, Golubova, 2000; Голубова, 2007).
Согласно нашим исследованиям, до начала 2000-х гг., за исключением лишь двух сезонов, общий успех размножения большой конюги определялся в относительно равной степени гибелью яиц и птенцов, что являлось нормальным ходом процесса размножения морских птиц. В последние годы, помимо сезонов с поголовной гибелью всех птенцов, участились случаи, когда взрослые птицы массово бросали кладки на последних стадиях насиживания, а вылупившихся птенцов мы не отмечали вовсе. Довольно часто это было спровоцировано неблагоприятными погодными условиями, которые временно снижали доступность пищевого ресурса большой конюги и как следствие, частоту посещения колонии и кормления птенцов. На этапе начала вылупления птенцов это приводило к гибели практически всех рожденных птиц, поскольку в этот период они наиболее уязвимы и нуждаются в постоянном присутствии одного из родителей (Sealy, 1968). Снижение интенсивности выкармливания птенцов приводило к раннему сходу уже подросших, а иногда еще пуховых птенцов, не имевших никаких шансов на дальнейшее выживание. Эти же условия определяли в итоге качество покидавших колонию молодых птиц. В норме они должны быть летными, а их вес должен быть максимально приближен к весу взрослых птиц, что позволило бы им благополучно достигнуть моря и адаптироваться к самостоятельной жизни. На о-ве Талан вес слетков был достаточно высоким лишь в некоторые годы, но эти показатели, а также средние приросты веса чаще всего были ниже, чем в других колониях (Fraser et al., 1999; Piatt et al., 1990; Gaston, Jones, 1998). У нас нет регулярных данных по их весу до начала 2000-х гг., но мы можем с уверенностью говорить, что многие поколения молодых птиц в последующие годы были нежизнеспособными, поскольку масса их тела была либо близка к критической отметке в 160 г, либо ниже ее (Конюхов, 1991). При этом достаточно высокие показатели размножения птиц в эти годы не всегда указывали на успешное их гнездование в текущем сезоне, поскольку сошедшие в море молодые птицы имели очень низкую массу тела. Если сопоставить все годы по показателям успеха размножения и качеству покинувших остров слетков, то наиболее удачными для воспроизводства популяции были 3–4 сезона в 1987–1998 и столько же в 1999–2019 гг.
Общее количество обитающих на острове хищников на протяжении ряда лет остается практически неизменным, их влияние на успех размножения большой конюги и состояние численности взрослых птиц различно. Количество съеденных или вовсе исчезнувших из гнезд яиц и пуховых птенцов, по вине обитающих на острове полевок и, возможно, горностая, лисицы, вóрона и тихоокеанской чайки, ежегодно варьировало, однако их доля была незначительной. Активизацию хищнической деятельности полевок в отдельные годы можно было бы объяснить более высоким количеством оставленных без присмотра гнезд в случае неблагоприятных погодных или других условий (например, в 1990 г.). Однако в последние годы, когда доля брошенных кладок была наиболее высокой, число яиц, подвергнувшихся нападению полевок, было незначительным. В большей степени, вероятно, эти случаи связаны с состоянием численности грызунов на острове, их динамикой, а также наличием поверхностных гнезд, доступных для других хищников. На островах Булдырь и Касаточий доля гнезд, где кладки и птенцы подвергались нападению мышевидных грызунов, была также невысокой (Knudtston, Byrd, 1982; Fraser et al., 1999). В то же время на о-ве Св. Лаврентия хищничество полевок, а также песцов и лис являются главными факторами, лимитирующих численность и успех размножения вида (Sealy, 1968; 1982; Searing, 1977; Piatt et al., 1990). Исследования на о-ве Св. Лаврентия показали также, что на участках, подверженных беспокойству со стороны наблюдателя, количество брошенных кладок, погибших или исчезнувших из гнезд птенцов в том числе по вине грызунов, существенно возрастает и успех размножения птиц, соответственно, снижается. Методика наблюдений в наших исследованиях была основана на минимизации беспокойства птиц, хотя полностью исключить этот фактор, вероятно, невозможно. Крупные млекопитающие, такие как песцы и лисицы, способствовали массовому истреблению этого вида на некоторых Алеутских островах. На островах Биг Коньюджи и Шумагине, например, за три месяца лисы убили около 800 больших конюг. Интродуцированная норвежская крыса десятки лет обитает на о-ве Киска, где находится крупнейшая на Алеутских островах колония большой конюги (Byrd et al., 2005). Влияние крыс на численность и успех размножения обитающих здесь мелких чистиковых птиц в разные периоды времени оценивалось неоднозначно. Тем не менее многие авторы склоняются к тому, что уничтожение крыс замедлит сокращение численности птиц в этой колонии (Major et al., 2006; 2007; 2013; Bond, Jones, 2009; Jones, 2010; Bond et al., 2010; 2013).
На о-ве Талан основная опасность для взрослых особей большой конюги исходит от хищных птиц, главным образом, сапсана. В силу своей многочисленности и доступности в дневное время суток этот вид является наиболее предпочитаемым объектом охоты сокола. В составе его питания конюга составляет 30–60% от всех добываемых в течение сезона птиц. В нормальных условиях массовое пребывание больших конюг на острове длится примерно 100 дней – с конца апреля и до середины августа, при этом в течение мая из мелких чистиковых птиц на острове наблюдаются только большие конюги. Стáрики и белобрюшки, которых тоже добывает сапсан, появляются только в начале июня, но уже в конце июля и в первой половине августа стáрики с птенцами с острова уходят. В течение августа здесь остаются немногочисленные белобрюшки и, в случае удачного гнездового сезона, большие конюги. Учитывая эти обстоятельства, а также наши данные по составу питания сапсана, полученные в разные годы, можно предположить, что один сокол может убить 70–80 конюг, если он будет охотиться регулярно и только один раз в сутки. Для нескольких сапсанов и в случае выкармливания ими птенцов эта цифра будет возрастать в разы. Известно (Knudtston, Byrd, 1982), что сапсаны и белоголовые орланы (Haliaeetus leucocephalus) активно добывают больших конюг и конюг-крошек на о-ве Булдырь. Здесь же естественными врагами мелких чистиковых птиц, как взрослых особей, так и сходящих в море птенцов, являются бургомистры. Многочисленные гнездовья большой конюги, конюги-крошки и других морских птиц на о-ве Матыкиль также привлекают пернатых хищников. В 2006 г. здесь было отмечено 6 пар сапсанов, которые имели территориальные участки, и одна пара мохноногого канюка (Buteo lagopus) (Зеленская, 2009). Крупная колония морских птиц расположена на о-ве Ионы, однако значительная удаленность острова от берега сказалась на полном отсутствии здесь дневных хищных птиц, за исключением нескольких десятков тихоокеанских чаек (Андреев и др., 2012). На о-ве Тюлений эти чайки отлавливают и поедают мелких чистиковых птиц, в том числе больших конюг, оказавшихся на лежбищах морского котика (Трухин, 2013).
На островах Берингова моря и тихоокеанского побережья успех размножения большой конюги был относительно высоким практически ежегодно. На о-ве Киска, например, в 2001–2010 гг. этот показатель варьировал от 42 до 85% и в среднем составил 58.5%, на о-ве Касаточий – от 0.45 до 0.77 (в среднем 0.66) в 1996–2008 гг., на о-ве Булдырь – от 0.12 до 0.90 (в среднем 0.76) в 1988–2018 гг. (Bond et al., 2013; Buchheit, Ford, 2008; Pietrzak et al., 2018). На о-ве Талан этот показатель существенно не выбивался из этого ряда практически до 2013 г. хотя сезоны с очень низким или “нулевым” успехом размножения отмечались чаще. Начиная с 2014 г. такая ситуация сделалась нормой, что не отмечалось на других регулярно обследуемых островах. Несколько иная и тревожная ситуация сейчас наблюдается на колониях Берингова моря. На о-ве Св. Лаврентия в 2018–2019 гг. успех размножения большой конюги был, как и на о-ве Талан, “нулевым”, однако до 2017 г. он был достаточно стабильным и относительно высоким (от 0.48 до 0.84) (Piatt et al., 1988; Gall et al., 2006; Sheffield et al., 2009). Такая же обстановка наблюдалась в 2018 г. на островах Прибылова, в том числе и с конюгой-крошкой (А.С. Китайский, персон. сообщ.).
Как известно (Hunt et al., 1993; Gaston, Jones, 1998), первым и необходимым условием образования колоний большой конюги является существование в прибрежных водах зон турбуленций морских вод с хорошо выраженными течениями, апвеллингами и гидрологическими фронтами, где и происходит концентрация зоопланктона. Второе – наличие подходящих местообитаний, в частности островов с обширными каменистыми осыпями, где птицы могли бы устраивать свои гнезда. На гнездование этого океанического вида на небольшом прибрежном о-ве Талан сказались оба фактора, но в первую очередь это было связано с существованием в центральной части Тауйской губы “ядра холода” и устойчивого циклонического круговорота, которые способствуют концентрации скоплений макропланктона (Чернявский, Радченко, 2004; Афанасьев и др., 1994). Все это обеспечивало большой конюге достаточно успешное гнездование на протяжении многих лет и поддерживало ее численность. Вне всяких сомнений, наблюдаемое здесь в последнее десятилетие катастрофически быстрое снижение численности и успеха размножения этого вида, вызвано ухудшением кормовой базы, что возможно связано с гидрологическими изменениями в акватории Тауйской губы.
Современные изменения климата привели к потеплению Охотского моря. С начала 1970-х гг. его ледовитость снижается в среднем на 3.8% за десятилетие (Japan …, 2014). Подобные процессы затрагивают и акватории Берингова и Чукотского морей, что проявляется в уменьшении площади поверхности ледяного покрытия и повышении температуры воды на поверхности моря в летний период. Эти изменения неблагоприятно сказываются на обилии, доступности и распределении холодноводного макропланктона (различные виды эвфаузиид и крупных копепод), составляющих основу питания больших конюг во всем гнездовом ареале, что приводит к изменению состава питания и снижению их успеха размножения (Bedard, 1969; Harrison, 1990; Sheffild et al., 2009; Bond et al., 2011; 2011а). Проведенные нами в 1988–2004 гг. исследования на о-ве Талан также выявили тесную связь между гидрологическим режимом акватории Тауйской губы с динамикой населяющих их гидробионтов, составом питания и успехом размножения морских птиц (Kitaysky, Golubova, 2000). В сезоны с ранним разрушением ледового покрова и более теплыми поверхностными водами успешнее размножались рыбоядные птицы, в то время как сезоны с поздним разрушением льда и холодными поверхностными водами благоприятствовали размножению планктоноядных видов, в частности большой конюге, из-за обилия и лучшей доступности в такие годы эвфаузиид. В последние 30 лет даты разрушения льдов в акватории Тауйской губы варьировали между 20 апреля (1996) и 29 июня (1999), а многолетняя средняя приходилась на 20 мая. В годы, когда успех размножения большой конюги был “нулевой” (2007, 2010–2011, 2014–2019 гг.), очищение акватории Тауйской губы ото льда отмечалось в период между 28 апреля и 18 мая, что, вероятно, не способствовало формированию достаточной кормовой базы большой конюги в период выкармливания птенцов. У нас нет прямых данных по составу питания больших конюг, однако такой признак, как белый цвет их помета на “клубных” камнях (вместо обычно розового после потребления эвфаузиид), который все чаще отмечается в последние годы, указывает на изменение этого состава. Заметным образом изменилось и расположение кормовых полей этого вида (Андреев, Голубова, 2019). Наши наблюдения подтверждают отрывочные данные МагаданНИРО, согласно которым доля группы Euphausiaceae в июньской биомассе зоопланктона Тауйской губы с 50% в 1986 и 1988 гг. снизилась до 17.3, 22.8 и 8.2% к 2004, 2005 и 2009 гг., соответственно. Непосредственно биомасса Thysanoessa raschii от 233.2 в 1986 г. и 179.9 в 1988 г. сократилась до 27.2 мг/м3 в 2009 г. При этом отмечалось возрастание биомассы представителей группы Copepoda (до 50.4% в 2009 г.), главным образом за счет тепловодных и умеренно-холодноводных видов Metridia okhotensis, Neocalanus plumchrus и др., при этом доля холодноводного Calanus glacialis, обычного, хотя и малочисленного в питании большой конюги, значительно снизилась (Результаты …, 2010). Содержание взрослых особей и личинок Thysanoessa raschii в июльских пробах птенцов большой конюги составляло 63.8, 64.8 и 80.4% в 1988, 1989 и 1999 гг. соответственно (Kitaysky, 1996; наши данные).
Обилие эвфаузиид существенно сокращалось в периоды опреснения Тауйской губы в результате мощного выброса после ливневых дождей паводковых вод из материковых рек, впадающих в ее акваторию (Условия формирования …., 1990). За исследуемый период наиболее низкие показатели успеха размножения большой конюги были отмечены в сезоны с продолжительными циклонами, например в 1989 (31.7%), 1990 (4.2%), 2004 (45.6%), 2007 (0%), 2008 (19.3%), 2011 (0%), 2013 (47.4%), 2014–2017 (0%) гг. В дальнейшем мы намерены более обстоятельно проанализировать данные по климату и успеху размножения большой конюги и выяснить, действуют ли эти факторы раздельно или же взаимно дополняют друг друга.
В условиях дефицита эвфаузиид в Тауйской губе могла серьезно возрасти конкуренция большой конюги с тихоокеанской сельдью (Clupea pallasii) за единый пищевой ресурс. В последние годы биомасса сельди существенно возросла, а места ее нагула в течение лета перекрываются с кормовыми полями большой конюги в репродуктивный период (Панфилов, 2014).
Что происходит с динамикой численности и успехом размножения большой конюги в других колониях Охотского моря нам неизвестно, однако острова Ямского архипелага, по-прежнему поддерживают самую высокую численность птиц. В осенний период и в зимний малоледовитый сезон в этой части моря образуются крупные кормовые скопления морских птиц и больших конюг в том числе (Шунтов, 1998; Зеленская, 2009; Артюхин, 2019). На о-ве Ионы, который по площади в 10 раз меньше Талана, численность большой конюги и других планктоноядных птиц также высока. Эти колонии находятся в зоне высокой биологической продуктивности морских вод, при этом удаленность кормовых полей конюг, гнездящихся на островах Ямских и Ионы, была в визуальной доступности (4–10 и 1.5–2 км, соответственно), что должно благоприятствовать выкармливанию птенцов и успеху размножению в целом. В питании больших конюг на о-ве Ионы, как и на Талане преобладали эвфаузииды (Thysanoessa raschii, Th. longipes), встречались рачки Calanus spp. и др. Птицы с о-ва Талан кормились в разные годы на расстоянии от 35–50 или 15–25 км от своих колоний (Андреев и др., 2012; Андреев, Голубова, 2019).
Большие конюги, как и многие другие виды морских птиц, долгоживущие птицы. По разным данным и в зависимости от срока наблюдений, средняя продолжительность жизни особей этого вида составляет около 8 и 9.6 лет. (Jones, 1993; Gaston, Jones, 1998). Для о-ва Талан продолжительность жизни конюг составляла12 лет (Леухина, 1999). Однако максимальный возраст отдельных особей может быть гораздо выше. Так, в 2008 г. на острове была отловлена птица, окольцованная взрослой в 1991 г., соответственно ее возраст составлял как минимум 20 лет (В.А. Зубакин, личное сообщение). Кроме того, для взрослых птиц этого вида характерны высокий уровень гнездового консерватизма, т.е. стремление птиц каждый сезон гнездиться на одном и том же гнездовом участке, и низкий уровень эмиграции в пределах одной колонии (Зубакин, 1990; Зубакин, Зубакина, 1991; Jones, 1993; Gaston, Jones, 1998; Jones et al., 2004). Учитывая эти обстоятельства, многие годы гнездовая популяция большой конюги может поддерживаться за счет взрослого населения птиц. По мнению некоторых авторов (Drew et al., 2018), отсутствие воспроизводства колонии в течение 2–3 лет не может повлиять на сокращение ее численности, однако некая грань, после чего ситуация может резко измениться, безусловно, существует. Первые и значительные признаки сокращения численности конюг на о-ве Талан были отмечены в 2008 г. (Андреев и др., 2010). Успех размножения птиц к этому периоду был выше среднемноголетней отметки на протяжении ряда лет, а в отдельные годы и на очень высоком уровне, что не должно было повлиять на состояние их численности. Лишь в последующие годы, когда численность конюг продолжала падать, но уже более быстрыми темпами, показатели успеха размножения вида были в большинстве случаев “нулевые”. Данные обстоятельства позволяют предполагать, что показатели успеха размножения большой конюги в конце 1990-х и в начале 2000-х гг. не могли повлиять на состояние ее численности на о-ве Талан.
На настоящий момент нет прямых доказательств существования для всей трибы конюг натальной филопатрии, т.е. стремление молодых особей вернуться на место своего рождения (Gaston, Jones, 1998). Такое поведение свойственно, как известно, толстоклювой кайре, сизой чайке и обыкновенной гаге (Bukacin’ski et al., 2000; Sonsthagen et al., 2010; Ibarguchi et al., 2011). Проведенные на о-ве Талан генетические исследования показали отсутствие явных близкородственных группировок среди больших конюг на различных участках колонии, что косвенным образом указывает на отсутствие натальной филопатрии у данного вида птиц (Пшеничникова и др., 2015). Отсутствие натальной филопатрии, а также генетической изоляции между колониями этого вида позволяют предполагать, что молодые птицы свободно расселяются по всему ареалу, присоединяются к стаям взрослых конюг и кочуют в смешанных группах в морях Северной Пацифики (Robinson, Jones, 2013; Пшеничникова и др., 2014; 2015; Pshenichnikova et al., 2015). По достижении половой зрелости они находятся далеко от родных колоний, и при выборе места гнездования важную роль играют, вероятно, доступность и обилие кормовых ресурсов вблизи колоний и лишь вторичную роль – наличие подходящих местообитаний. Если считать, что численность большой конюги на о-ве Талан в большей степени зависит от пополнения популяции молодыми птицами, рожденными в других колониях, то снижение ее численности, при достаточно стабильных и относительно высоких показателях успеха размножения этого вида в других колониях, может указывать на массовую гибель молодых птиц во время миграций. С другой стороны, в условиях отсутствия в Тауйской губе стабильной кормовой базы, остров становится, возможно, менее привлекательным для планктоноядных видов птиц, которые заселяют теперь другие колонии. В этом случае в настоящее время здесь обитают зрелые птицы, которые занимают эти колонии многие десятки лет и продолжают оставаться здесь в силу своего гнездового консерватизма. При таких обстоятельствах сокращение их численности может происходить, главным образом, в результате гибели птиц вследствие естественного физиологического старения или от хищников в сезон размножения. За время ведения мониторинга выживаемость взрослых особей большой конюги постепенно снижалась. В 1988–1991 гг. она составляла 77.6%. В 1994–1998 гг. этот показатель варьировал от 100 до 78.4% (в среднем 88.9%). В 1999 г. возврат взрослых помеченных птиц был самым низким – 18 против 98% в 1998 г. В 2008–2015 гг. она составила 62.3% (Зубакин, Зубакина, 1991; Леухина, Нос, 1999; Леухина, 1999; Vodolazova et al., 2016). В сравнении с Таланом, на о-ве Булдырь выживаемость этого вида в 1992–2000 гг. варьировала от 0.94 в 1993–1994 гг. до 0.76 в 1997–1998 гг. (в среднем 0.859). В 2001–2003 г. этот показатель варьировал в низких пределах от 0.672 до 0.717 и к 2007 г. поднялся до 0.852. В целом, в 1992–2007 гг. он составил 0.795 (Jones et al., 2004; Jones, 2010). На о-ве Касаточий по разным данным (Buchheit, Ford, 2008; Jones, 2010), полученным в 1996–2006 гг., средняя выживаемость большой конюги составила 0.848 и 0.775. На о-ве Киска в 2001–2009 гг. она составила в среднем 0.862 и была выше, чем на островах Булдырь и Касаточий. В 2008–2009 гг. снизилась до 0.75 и в эти годы, была ниже, чем это требуется для стабильности популяции, что в долгосрочной перспективе, как считают исследователи, будет способствовать ее сокращению (Bond et al., 2010; 2013; Jones, 2010; Drew et al., 2018).
Во время осенне-зимних миграций морские птицы, как правило, подвергаются воздействию гораздо большего количества факторов, чем в период размножения, что приводит к массовой гибели как взрослых, так и молодых птиц. В их числе разливы нефти, погодно-климатические и океанографические изменения, которые могут ухудшить состояние кормовой базы птиц. Серьезной угрозой виду являлся дрифтерный лов рыбы, который велся в Охотском и Беринговом морях японскими и российскими судами в 1989–2015 гг. и был закрыт в России в 2016 г. Промысел лосося начинался, как правило, во второй половине мая, когда конюги активно направлялись к местам гнездования, а в некоторых колониях они уже приступали к откладке яиц. Продолжался лов рыбы до конца июля, когда период размножения птиц на колониях подходил к концу, а молодые и взрослые птицы массово откочевывали в открытое море. Среди погибших в сетях в 1993–2003 гг. морских птиц частота встречаемости этого вида варьировала от 8 до 11%, и этот показатель находился в числе самых высоких вместе с кайрами, топорками, глупышами и буревестниками (Артюхин и др., 1999; 2000; 2001а; 2010). Среди погибших конюг встречались взрослые размножавшиеся особи (до 7%) и неполовозрелые, причем последних было большинство (до 56%). В 1993–2008 гг. среднегодовая смертность конюг в различных участках промысла составляла 3.2–12.7 тыс. особей, что на наш взгляд, является подтверждением высокой гибели кочующих в море как молодых птиц, за счет которых и происходит пополнение популяций в различных колониях, так и взрослых.
Согласно существующим данным, в азиатской части ареала может обитать около 5 млн. особей большой конюги, что составляет от 60 до 80% от признанных мировых оценок ее популяции. При этом бóльшая часть птиц этой популяции (около 3 млн особей) гнездится в Охотском море (включая о-ва Курильской гряды). Однако тенденции изменения численности вида в пределах всего ареала не известны. Рост численности больших конюг отмечали на о-ве Касаточий в 1991–2003 гг., однако извержение вулкана 7 августа 2008 г., почти полностью разрушило места обитания этого и других видов морских птиц. В настоящее время мы будем свидетелями того, по какому пути пойдет возрождение этой колонии: птицы либо расселятся на другие участки острова, либо будут искать гнездовья на близлежащем к нему о-ве Киска (Drew et al., 2018). В большинстве колоний оценки численности конюг базируются чаще всего на данных, полученных в прошлом столетии, и они бывают часто несопоставимыми из-за различий в применяемых методиках учета. Исключение составляет о-в Талан, где, как сообщалось ранее, популяция этих птиц последовательно и быстро сокращается (Андреев и др., 2010; Андреев, Голубова, 2019). Однако вполне возможно, что происходящие на острове изменения носят сугубо локальный характер и не отражают состояние численности этого вида в других колониях. Существует мнение (Maftel, Russ, 2014), что снижение численности птиц в некоторых более изученных колониях может противоречить глобальному увеличению их популяции и, что настоящие оценки численности мировой популяции большой конюги далеки от реальности. В 2013 г., например, у северо-восточного побережья Чукотки было отмечено не менее 8.5 млн особей этого вида. Их скопления находились к северу от известных в этом районе колоний, во многих из которых еще продолжался гнездовой период. Несоответствие между этими наблюдениями и популярными сведениями о численности птиц в этом регионе объясняется недооценкой размеров колоний или увеличением глобальной популяции вида.
Список литературы
Андреев А.В., Голубова Е.Ю., 2019. Многолетняя динамика численности и успеха размножения большой конюги Aethia cristatella Pallas, 1769 на острове Талан (Охотское море) // Вестник ТвГУ. Серия “Биология и экология”. № 1 (53). С. 15–30.
Андреев А.В., Голубова Е.Ю., Зубакин В.А., Харитонов С.П., 2010. Численность морских птиц на колониях о. Талан: двадцатилетний тренд // Вестник СВНЦ ДВО РАН. № 2. С. 30–42.
Андреев А.В., Харитонов С.П., Слепцов Ю.А., 2012. Колонии морских птиц острова Ионы (Охотское море) // Зоологический журнал. Т. 91. № 7. С. 843–855.
Артюхин Ю.Б., 1990. Морские колониальные птицы о. Арьего Камня (Командорские острова) // Изучение морских колониальных птиц в СССР. Магадан: ДВО АН СССР. С. 15–18.
Артюхин Ю.Б., 1999. Кадастр колоний морских птиц Командорских островов // Биология и охрана птиц Камчатки. М.: Диалог-МГУ. Вып. 1. С. 25–35.
Артюхин Ю.Б., 1999а. Состояние морских колониальных птиц на острове Медном // Морские птицы Беринги. Магадан: СВНЦ ДВО РАН. С. 38–39.
Артюхин Ю.Б., 2003. Дополнения к “Кадастру колоний морских птиц Курильских островов” // Биология и охрана птиц Камчатки. М.: Изд-во Центра охраны дикой природы. Вып. 5. С. 10–12.
Артюхин Ю.Б., 2016. Средние Курильские острова // Морские ключевые орнитологические территории Дальнего Востока России (под ред. Ю.Б. Артюхина). М.: РОСИП. С. 110–113.
Артюхин Ю.Б., 2019. Зимнее население птиц открытых вод Охотского моря // Биология моря. Т. 45. № 1. С. 8–16.
Артюхин Ю.Б., Бурканов В.Н., Вяткин П.С., 1999. Случайная гибель морских птиц в дрифтерных сетях на промысле лосося японскими судами в исключительной экономической зоне России в 1993–1998 годах // Биология и охрана птиц Камчатки. М.: Диалог-МГУ. Вып. 1. С. 93–111.
Артюхин Ю.Б., Бурканов В.Н., Заочный А.Н., Никулин В.С., 2000. Смертность морских птиц в дрифтерных сетях на японском промысле лососей в российских водах Берингова моря в 1993–1999 годах // Биология и охрана птиц Камчатки. М.: Россельхозакадемия. Вып. 2. С. 110–126.
Артюхин Ю.Б., Трухин А.М., Корнев С.И., Пуртов С.Ю., 2001. Кадастр колоний морских птиц Курильских островов // Биология и охрана птиц Камчатки. М.: Центр охраны дикой природы. Вып. 3. С. 3–59.
Артюхин Ю.Б., Заочный А.Н., Корнев С.И., Никулин В.С., Тестин А.И., 2001а. Смертность морских птиц в дрифтерных сетях на японском промысле лососей в российских водах Берингова моря в 2000–2001 годах // Биология и охрана птиц Камчатки. М.: Изд-во Центра охраны дикой природы. Вып. 3. С. 81–85.
Артюхин Ю.Б., Бурканов В.Н., Никулин В.С., 2010. Прилов морских птиц и млекопитающих на дрифтерном промысле лососей в северо-западной части Тихого океана. М.: Скорость цвета. 264 с.
Афанасьев Н.Н., Михайлов В.И., Чевризов Б.П., Карасев А.И., 1994. Условия формирования, структура и распределение кормовой базы молоди лососевых рыб в Тауйской губе Охотского моря // Биологические основы развития лососеводства в Магаданском регионе: сб. науч. тр. МО ТИНРО. СПб. Вып. 308. С. 25–41.
Велижанин А.Г., 1971. Морские колониальные птицы Курильских островов. Автореф. дис. … канд. биол. наук. Новосибирск. 28 с.
Велижанин А.Г., 1975. Птичьи базары Ямских островов // Охота и охотничье хозяйство. № 7. С. 18–19.
Велижанин А.Г., 1978. Размещение и состояние численности колоний морских птиц на Дальнем Востоке // Актуальные вопросы охраны природы на Дальнем Востоке. Владивосток: ДВНЦ АН СССР. С. 154–173.
Волков А.Ф., Ефимкин А.Я., 2002. Современное состояние планктоноядного сообщества эпипелагиали Охотского моря // Известия ТИНРО. Т. 130. С. 355– 407.
Вяткин П.С., 1986. Кадастр гнездовий колониальных птиц Камчатской области // Морские птицы Дальнего Востока. Владивосток: ДВНЦ АН СССР. С. 20–36.
Вяткин П.С., 2000. Кадастр гнездовий колониальных морских птиц Корякского нагорья и восточного побережья Камчатки // Биология и охрана птиц Камчатки. М.: Изд-во Центра охраны дикой природы. Вып. 2. С. 7–15.
Вяткин П.С., 2016. Остров Верхотурова // Морские ключевые орнитологические территории Дальнего Востока России (под ред. Ю.Б. Артюхина). М.: РОСИП. С. 47–48.
Головкин А.Н., Флинт М.В., 1975. Колониальные гнездовья морских птиц в районе мыса Сердце Камень (Чукотка) // Колониальные гнездовья околоводных птиц и их охрана. М.: Наука. С. 171–173.
Голубова Е.Ю., 2007. Морские колониальные птицы северной части Охотского моря. Автореф. дис. … канд. биол. наук. Владивосток. 22 с.
Голубова Е.Ю., 2011. Мониторинг популяции стáрика (Synthliboramphus antiquus) в северной части Охотского моря // Зоологический журнал. Т. 90. № 10. С. 1216–1229.
Голубова Е.Ю., 2015. Биология размножения белобрюшки (Cyclorrhynchus psittacula) на острове Талан (северная часть Охотского моря) // Зоологический журнал. Т. 94. № 7. С. 832–847.
Голубова Е.Ю., 2018. Динамика численности стáрика Synthliboramphus antiquus (Gmelin, 1789) на о. Талан (Охотское море, Тауйская губа) // Вестник СВНЦ ДВО РАН. № 3. С. 72–86.
Дементьев Г.П., 1951. Отряд чистики // Птицы Советского союза. М.: Сов. наука. Т. 2. С. 169–240.
Дулькейт Г.Д., Шулькин Л.М., 1937. Птицы Шантарских островов // Труды Биол- НИИ при Томском ун-те. Томск. С. 113–136.
Зеленская Л.А., 2001. Распределение и численность морских колониальных птиц на Командорских островах в 1999–2000 годах // Биология и охрана птиц Камчатки. М.: Изд-во Центра охраны дикой природы. Вып. 3. С. 64–71.
Зеленская Л.А., 2009. Численность и распределение птиц на острове Матыкиль (Ямские острова, Охотское море) // Зоологический журнал. Т. 88. № 5. С. 546–555.
Зеленская Л.А., 2018. Морские открытогнездящиеся птицы Ямских островов (Охотское море). Численность и распределение // Зоологический журнал. Т. 97. № 5. С. 572–581.
Зубакин В.А., 1990. Некоторые аспекты гнездовой биологии и социального поведения большой конюги (Aethia cristatella) // Изучение морских колониальных птиц в СССР. Магадан: ДВО АН СССР. С. 9–13.
Зубакин В.А., Зубакина Е.В., 1991. Гнездовой консерватизм, выживаемость и постоянство пар у четырех чистиковых птиц Охотского моря // Материалы 10-й Всес. орнитол. конф. Витебск, 17–20 сент. 1991 г. Книга 1. Ч. 1. Мн.: Навука i тэхнiка. С. 73–74.
Зубакин В.А., Кондратьев А.Я., Конюхов Н.Б., Панов Е.Н., 1992. О численности морских птиц острова Большой Диомид // Изучение морских колониальных птиц в СССР. Институт ДВО РАН. Магадан: СВКНИИ ДВО РАН. С. 12–13.
Иванов А.И., Козлова Е.В., Портенко П.А., Тугаринов А.Я., 1953. Фауна СССР. Ржанкообразные. Подотряд Чистиковые. Ч. 2. М.-Л.: Изд-во АН СССР. 343 с.
Карташев Н.Н., 1961. Птицы Командорских островов и некоторые предложения по их рациональному использованию // Зоологический журнал. Т. 40. № 9. С. 1395–1409.
Карташев Н.Н., 1979. Материалы к биологии чистиковых птиц Командорских островов // Орнитология. Вып. 14. С. 144–149.
Китайский А.С., 1991. Экологические взаимоотношения чистиковых птиц на о-ве Талан (Охотское море) // Материалы 10-й Всес. орнитол. конф. Витебск, 17–20 сент. 1991 г. Книга 1. Ч. 2. Мн.: Навука i тэхнiка. С. 277–278.
Кленова А.В., Бахтурина Д.С., 2014. Особенности сезонной активности и успех размножения колониальных чистиковых птиц на о. Талан в 2013 г. (Охотское море) // Вестник СВНЦ ДВО РАН. № 3. С. 83–87.
Кленова А.В., Зубакин В.А., Зубакина Е.В., Колесникова Ю.А., 2012. Проявление признаков индивидуальности и пола в криках саморекламирования родственных видов конюг (Charadriiformes, Alcidae): большой конюги (Aethia cristatella) и белобрюшки (Cyclorhynchus psittacula) // Зоологический журнал. Т. 91. № 7. С. 869–880.
Кленова А.В., Шиенок А.Н., 2012. Встречи редких видов чистиковых птиц на о. Медном (Командорские острова) летом 2012 г. // Сохранение биоразнообразия Камчатки и прилегающих морей: материалы 13-й международ. научн. конф., посвященной 75-летию со дня рождения известного отечественного специалиста в области лесоведения, ботаники и экологии д.б.н. С.А. Дыренкова. Петропавловск-Камчатский. С. 238–242.
Козлова Е.В., 1957. Ржанкообразные: подотряд чистиковые // Фауна СССР. Птицы. М.-Л.: Изд-во АН СССР. Т. 2. Вып. 3. С. 114–143.
Кондратьев А.Я., 1986. Колонии морских птиц на арктическом побережье крайнего Северо-Востока СССР // Морские птицы Дальнего Востока. Владивосток: ДВНЦ АН СССР. С. 37–47.
Кондратьев А.Я., Зубакин В.А., Голубова Е.Ю, Кондратьева Л.Ф., Харитонов С.П. Китайский А.С., 1992. Фауна наземных позвоночных животных острова Талан // Прибрежные экосистемы северного Охотоморья. Остров Талан. Магадан: СВНЦ ДВО РАН. С. 72–108.
Кондратьев А.Я., Зубакин В.А., Харитонов С.П., 1992а. Методы оценки численности массовых видов морских птиц // Прибрежные экосистемы северного Охотоморья. Остров Талан. Магадан: СВНЦ ДВО РАН. С. 137–152.
Кондратьев А.Я., 1993. Ржанкообразные Северо-Восточной Азии. Автореф. дис. … докт. биол. наук. Владивосток: ДВО РАН. 47 с.
Кондратьев А.Я., Зубакин В.А., Харитонов С.П., Тархов С.В., Харитонова И.А., 1993. Изучение птичьих базаров островов Матыкиль и Коконце (Ямские острова) и полуострова Пьягина // Бюллетень Московского общества испытателей природы. Отд. биол. Т. 98. Вып. 5. С. 21–31.
Кондратьева Л.Ф., 2004. Особенности летнего рациона тихоокеанской чайки Larus schistisagus Stejneger на острове Талан, Охотское море // Биология и охрана птиц Камчатки. М.: Центр охраны дикой природы. Вып. 6. С. 91–96.
Конюхов Н.Б., 1990. Большая конюга // Птицы СССР. Чистиковые. М.: Наука. С. 112–121.
Конюхов Н.Б., 1991. Некоторые особенности биологии конюг на колониях Чукотского полуострова // Изучение морских колониальных птиц в СССР. Магадан: СВКНИИ ДВО АН. СССР. С. 30–32.
Конюхов Н.Б., 1993. Сравнительная биология некоторых видов закрытогнездящихся чистиковых. Дис. … канд. биол. наук: 03.00.08. М. 190 с.
Конюхов Н.Б., 1997. Влияние погодных факторов на биологию размножения чистиковых // Известия РАН. Серия биологическая. № 2. С. 228–234.
Конюхов Н.Б., 2016. Остров Ратманова // Морские ключевые орнитологические территории Дальнего Востока России (под ред. Ю.Б. Артюхина). М.: РОСИП. С. 24–25.
Конюхов Н.Б., 2016а. Сирениковское побережье Чукотки // Морские ключевые орнитологические территории Дальнего Востока России (под ред. Ю.Б. Артюхина). М.: РОСИП. С. 30–32.
Леухина В.А., 1999. Выживаемость большой конюги (результаты 1997–1998 годов) // Морские птицы Берингии. Вып. 4. Магадан: СВНЦ ДВО РАН. С. 21.
Леухина В.А., Нос О.В., 1999. Выживаемость большой конюги на острове Талан в 1996 году // Морские птицы Берингии. Вып. 4. Магадан: СВНЦ ДВО РАН. С. 13–14.
Нечаев В.А., 1986. Новые сведения о морских птицах острова Сахалин // Морские птицы Дальнего Востока. Владивосток: ДВНЦ АН СССР. С. 71–81.
Панфилов А.М., 2014. Динамика возрастного состава и состояние запаса охотской сельди на современном этапе // Магаданский НИИ рыбного хозяйства и океанографии. Отчетная сессия (2013). Отчетная сессия ФГУП “Магадан-НИРО” по результатам научных исследований 2013 года: г. Магадан, 28–31 января 2014 г. Магадан: Типография. С. 116–120.
Перемитин В.Г., 1999. Результаты размножения чистиковых птиц на острове Талан в 1996 году // Морские птицы Берингии. Вып. 4. Магадан: СВНЦ ДВО РАН. С. 7–11.
Перемитин В.Г., 1999а. Анализ развития птенцов белобрюшки и большой конюги на острове Талан в 1996 году // Морские птицы Берингии. Вып. 4. Магадан: СВНЦ ДВО РАН. С. 11–13.
Портенко Л.А., 1973. Птицы Чукотского полуострова и острова Врангеля. Ч. 2. Л.: Наука. 323 с.
Пшеничникова О.С., Сорокин П.А., Кленова А.В., 2014. Популяционная изменчивость большой конюги Aethia cristatella (Alcidae, Charadriiformes) // Поволжский экологический журнал. № 4. С. 570–580.
Пшеничникова О.С., Сорокин П.А., Кленова А.В., Зубакин В.А., 2015. Пространственно-генетическая структура колонии большой конюги (Aethia cristatella Pallas, 1769) по данным контрольного региона митохондриальной ДНК и микросателлитных локусов // Генетика. Т. 5. № 9. С. 1047–1056.
Результаты исследований океанологических, фоновых условий, гижигинско-камчатской, тауйской, охотской сельдей, минтая, черного палтуса, ската, длинноперого шипощека и трески в северной части Охотского моря в 2009 г. Отчет о научно-исследовательской работе лаборатории морских промысловых рыб. Магадан. 2010. Инв. № 002738.
Росляков Г.Е., 1986. Птицы морских побережий Шантарских островов // Морские птицы Дальнего Востока. Владивосток: ДВНЦ АН СССР. С. 66–70.
Росляков Г.Е., Росляков А.Г., 1996. К орнитофауне создаваемого национального парка “Шантарские острова” // Птицы пресных вод и морских побережий юга Дальнего Востока России и их охрана. Владивосток: ДВО РАН. С. 86–92.
Трухин А.М., 2006. Состояние птичьего базара на острове Тюлений (Охотское море) в условиях роста численности ластоногих // Русский орнитологический журнал. Т. 15. Экспресс-вып. 328. С. 794–798.
Трухин А.М., 2016. Остров Тюлений // Морские ключевые орнитологические территории Дальнего Востока России (под ред. Ю.Б. Артюхина). М.: РОСИП. С. 107–109.
Трухин А.М., 2013. Биоценотические связи птиц с сообществом животных на лежбищах ластоногих // Русский орнитологический журнал. Т. 22. Экспресс-вып. 928. С. 2791–2796.
Трухин А.М., Кузин А.Е., 1996. Многолетняя динамика видового состава и численности морских птиц, гнездящихся на острове Тюлений (Охотское море) // Птицы пресных вод и морских побережий юга Дальнего Востока России и их охрана. Владивосток: ДВО РАН. С. 214–221.
Условия формирования, структура и распределение кормовой базы молоди лососевых рыб в Тауйской губе Охотского моря в 1988–1990 гг. Заключительный отчет Магаданского отделения ТИНРО. Магадан. 1990. № гос. рег. 01823005233.
Устинова Е.И., Сорокин Ю.Л., Хен Г.В., 2002. Межгодовая изменчивость термических условий Охотского моря // Известия ТИНРО. Т. 130. С. 44–51.
Утехина И.Г., 1999. Заметки о пролете птиц на о. Талан весной 1998 г. // Морские птицы Беринги. Магадан: СВНЦ ДВО РАН. Вып. 4. С. 16–19.
Утехина И.Г., 2004. Белоплечий орлан Haliaeetus pelagicus (Pallas, 1811) на северном побережье Охотского моря: распространение, численность, экология, миграции. Автореф. дис. … канд. биол. наук. М. 22 с.
Харитонов С.П., 1975. Морские колониальные птицы острова Ионы // Колониальные гнездовья околоводных птиц и их охрана. М.: Наука. С. 184–185.
Харитонов С.П., 1980. Материалы по птицам острова Ионы // Орнитология. Вып. 15. С. 10–15.
Чернявский В.И., Радченко Я.Г., 1994. Физико-географическая характеристика Тауйской губы Охотского моря // Биологические основы развития лососеводства в Магаданском регионе. Сб. науч. трудов МО ТИНРО. СПб. Вып. 308. С. 10–24.
Шунтов В.П., 1998. Птицы дальневосточных морей России. Владивосток: ТИНРО-центр. Т. 1. 423 с.
Яхонтов В.Д., 1974. Птичьи базары Пенжинской губы и их состояние // Материалы VI Всесоюз. орнитол. конф. М.: МГУ. С. 251–252.
Яхонтов В.Д., 1979. Птицы Пенжинского района // Птицы Северо-Востока Азии. Владивосток: ДВНЦ АН СССР. С. 135–162.
Bedard J., 1969. The nesting of the Crested, Least, and Parakeets auklets on St. Lawrence Island, Alaska // Condor. V. 71. P. 386–398.
Bedard J., 1969a. Feeding of the least, crested and parakeet auklets around St. Lawrence Island, Alaska // Canadian Journal of Zoology. V. 47. P. 1025−1050.
Bond A.L., Jones I.L., 2009. Auklet demography and the influence of Norway rats − report on results of monitoring to 2009. Homer, AK: Alaska Maritime NWR.
Bond A.L., Jones I.L., Sydeman W.J., Major H.L., Minobe S., Williams J.C., Byrd G.V., 2011. Reproductive success of planktivorous seabirds in the North Pacific is related to ocean climate on decadal scales // Marine Ecology Progress Series. V. 424. P. 205–218.
Bond A.L., Jones I.L., Williams J.C., Byrd G.V. 2011a. Diet of auklet chicks in the Aleutian Islands, Alaska: similarity among islands, interspecies overlap, and relationships to ocean climate // Journal of Ornithology. https://doi.org/10.1007/s10336-011-0704-3
Bond A.L., Jones I.L., Williams J.C., Byrd G.V., 2013. Survival and reproductive success of Crested Auklets Aethia Cristatella in the presence of introduced Norway Rats Rattus norvegicus // Marine Ornithology. V. 41. P. 41–48.
Bond A.L., Penney E.E., Jones I.L., 2010. Ten years of investigating auklet rat interactions at Kiska Island, Alaska: summary of monitoring from 2001–2010. Homer, AK: Alaska Maritime NWR.
Buchheit R.M., Ford J.C., 2008. Biological monitoring in the central Aleutian Islands, Alaska in 2008: summary appendices. U.S. Fish and Wildl. Serv. Rep., AMNWR 08/12. Homer, Alas. 141 p.
Bukacin’ski D., Bukacin’ska M., Lubjuhn T., 2000. Adoption of chicks and the level of relatedness in common gull, Larus canus, colonies: DNA fingerprint analyses // Animal Behaviour. V. 59. P. 289–299.
Burger J., 1988. Measurement of Growth Rates: The Effect of Sampling Time on Weight in a Seabirds // Growth, Development and Aging. V. 55. P. 109–112.
Byrd G.V., Renner H.M., Renner M., 2005. Distribution patterns and population trends of breeding seabirds in the Aleutian Islands // Fisheries Oceanography. V. 14. P. 139–159.
Del Hoyo J., Elliott A., Sargatal J., 1996. Handbook of the birds of the world. V. 3: Hoatzin to Auks. Barcelona, Spain: Lynx Editions.
Drew G., Piatt J.F., Williams J., 2018. Biological responses of Crested and Least auklets to volcanic destruction of nesting habitat in the Aleutian Islands, Alaska // Auk. V. 135. P. 477–485.
Fraser G., Jones I.L., Williams J.C., Hunter F.N., Schare L., Byrd G.V., 1999. Breeding biology of Crestet Auklets at Buldir and Kasatochi islands, Alaska // Auk. V. 116. № 3. P. 690–701.
Ibarguchi G., Gaston A.J., Friesen V.L., 2011. Philopatry, morphological divergence, and kin groups: structuring in Thick-billed Murres Uria lomvia within a colony in Arctic Canada // Journal Avian Biology. V. 42. P. 134–150.
Gaston A.J., Jones I.L., 1998. The auks: Alcidae // Bird families of the world. V. 4. New York: Oxford University Press. Inc. 349 p.
Gall A.E., Roby D.D., Irons D.D., Rose I.C., 2006. Differential response in chick survival to diet in least and crested auklets // Marine Ecology Progress Series. V. 308. P. 279–291.
Harrison N.M., 1990. Gelatinous zooplankton in the diet of the Parakeet Auklet: comparisons with other auklets // Study Avian Biology. V. 14. P. 114–124.
Hipfner J.M., Byrd G.V., 1993. Breeding biology of the Parakeet Auklet compared to other crevice-nesting species at Buldir Island, Alaska // Colony Waterbirds. V. 16. № 2. P. 128–138.
Hunt G.L., Harrison N.M., Piatt J.F., 1993. Foraging ecology as related to the distribution of planktivorous auklets in the Bering Sea // The status, ecology and conservation of marine birds of the North Pacific. Ottawa: Can. Wildl. Serv. Spec. Publ. P. 28–36.
Japan Meteorological Agency, 2014. Sea ice in the Sea of Okhotsk. Downloaded from: http://www.data.jma.go.jp/ gmd/kaiyou/english/seaice_okhotsk/series_okhotsk_e.html
Jones I.L., 1993. Crested auklet (Aethia cristatella) // The Birds of North America. № 70; ed. by A. Poole, F. Gill. Philadelphia: The Academy of Natural Sciences; Washington, D.C.: The American Ornithologists’ Union.
Jones I.L., 1993a. Sexual differences in bill shape and external measurements of crested auklets // Wilson Bulletin. V. 105. № 3. P. 525–529.
Jones I.L., 2010. Relationships among climate variability, ocean productivity and demography of Aleutian Island, Alaska, populations of three planktivorous seabirds: Least (Aethia pusilla), Crested (A. cristatella) and Whiskered auklets (A. pygmaea) // Final Report, Project 638. Anchorage, AK: North Pacific Research Board. 121 p.
Jones I.L., Hunter F.M., Fraser G., 2000. Patterns in variation of ornaments of crested auklets Aethia cristatella // Journal of Avian Biology. V. 31. P. 119–127.
Jones I.L., Hunter F.M., Robertson G.J., Fraserd G., 2004. Natural variation in the sexually selected feather ornaments of crested auklets (Aethia cristatella) does not predict future survival // Behavioral Ecology. V. 15. № 2. P. 332–337.
Kitaysky A.S., 1996. Behavioural, physiological and reproductive responses of alcids (Alcidae) to variation in food availability: Ph.D. Thesis. IRVIWE: University of California, USA.
Kitaysky A.S., Golubova E.Yu., 2000. Climate change causes contrasting trends in reproductive performance of planktivorous and piscivorous alcids // Journal of Animal Ecology. V. 69. P. 248–262.
Knudtson E.R., Byrd G.V., 1982. Breeding biology of Crested, Least and Whiskered auklets in Buldir Island, Alaska // Condor. V. 84. P. 197–202.
Konyukhov N.B., Bogoslovskaya L.S., Zvonov B.M., Van Pelt T.I., 1998. Seabirds of the Chukotka Peninsula, Russia // Arctic. V. 51. № 4. P. 315–329.
Major H.L., Jones I.L., Byrd G.V., Willians J.C., 2006. Assessing the effects of introduced Norway rats (Rattus norvegicus) on survival and productivity of Least Auklets (Aethia pusilla) // Auk. V. 123. P. 681–694.
Major H.L., Jones I.L., Charette M.R., Diamond A.W., 2007. Variations in the diet of introduced Norway rats (Rattus norvegicus) inferred using stable isotope analysis // Journal of Zoology. V. 271. P. 463–468.
Major H.L., Bond A.L., Jones I.L., Eggleston C.J., 2013. Stability of a seabird population in the presence of an introduced predator // Avian Conservation and Ecology. V. 8. № 1. P. 2. https://doi.org/10.5751/ACE-00564-080102
Maftel M., Russ R., 2014. A mass post-breeding movement of Crested Auklets Aethia cristatella in the Chukchi sea // Marine Ornithology. V. 42. P. 31–34.
North Pacific Seabird Colony Database, 2013.World Seabird Union; Seabird Information Network 2011. North Pacific Seabird Data Portal. (http://axiom.seabirds.net/ maps/north-pacific-seabirds/; accessed 10 November 2013).
Piatt J.F., Hatch S.F., Roberts B.D., Lidster W.W., Wells J.L., Haney J.C., 1988. Populations, productivity, and feeding habits of seabirds on St. Lawrence Island, Alaska. Final Report U.S. Fish and Wildlife Service Alaska, Fish and Wildlife Research Center 1011 East Tudor Road Anchorage, Alaska 99503 Submitted to: Minerals Management Service Environmental Studies Unit 949 East 36th Avenue Anchorage, Alaska 99510.
Piatt J.F., Roberts B.D., Lidster W.W., Wells J.L., Hatch S.A., 1990. Effects of human disturbance on breeding Least and Crested Auklets at St. Lawrence Island, Alaska // Auk. V. 107. P. 342–350.
Pietrzak K.W., Mudge M.L., Bode B.E., Rojek N.A., 2018. Biological monitoring at Buldir Island, Alaska in 2018. U.S. Fish and Wildl. Serv. Rep., AMNWR 2018/15. Homer, Alaska.
Pshenichnikova O.S., Klenova A.V., Sorokin P.A., Zubakin V.A., Konyukhov N.B., Kharitonov S.P., Artukhin Yu.B., 2015. The Crested Auklet, Aethia cristatella (Alcidae, Charadriiformes), does not vary geographically in genetics, morphology or vocalizations // Marine Biology. V. 162. № 6. P. 1329–1342.
Robinson J.L., Jones I.L., 2013. Year-round spatial and temporal distribution of a small, diving seabird, the Crested Auklet (Aethia cristatella), originating from a breeding site at Buldir Island, Aleutian Islands // Pacific Seabird Group 40th Annual Meeting. Abstracts. Portland. P. 61.
Sealy S.G., 1968. A comparative study of breeding ecology and timing in plankton-feeding alcids (Cyclorrhynchus and Aethia spp.) on St. Lavrence Island. Alaska. M.S. thesis. Vancouver: Univ. British Colum.
Sealy S.G., 1982. Voles as a source of egg and nestling loss among nesting auklets // Murrelet. V. 63. № 1. P. 9–14.
Sealy S.G., 1975. Influence of snow on egg-laying in auklets // Auk. V. 92. P. 528–538.
Searing G.F., 1977. Some aspects of the ecology of cliff-nesting seabirds at Kongkok Bay, St. Lawrence Island, Alaska during 1976. U.S. Dep. Commerce, NOAA, Outer Continental Shelf Environmental Assessment Program. Annu. Rep. V. 5. P. 263–412.
Sheffield G.L.M., Roby D.D., Gall A.E., Irons D.B., Rose I.C., 2009. The influence of diet and ocean conditions on productivity of auklets on St. Lawrence Island, Alaska // Marine Ornithology. V. 37. P. 227–236.
Sonsthagen S.A., Talbot S.L., Lanctot R.B., McCracken K.G., 2010. Do common eiders nest in kin groups? Microgeographic genetic structure in a philopatric sea duck // Molecular Ecology. V. 19. P. 647–657.
Walsh H.E., Jones I.L., Friesen V.L., 2005. A test of founder effect speciation using multiple loci in the auklets (Aethia spp.) // Genetics. V. 171. P. 1885–1894.
Vodolazova D.S., Klenova A.V., Zubakin V.A., Zubakina E.V., 2016. Twenty years changes in survival rates of banded auks (Alcidae) on Talan island, Russia // 5th International Eurasian Ornithology congress, 10–13 May 2016, Çanakkale, Turkey. P. 53.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал