Зоологический журнал, 2021, T. 100, № 4, стр. 449-461
Влияние социальных условий на адаптивный гуморальный иммунитет рыжей (Clethrionomys glareolus) и красно-серой (Clethrionomys rufocanus) полевок: экспериментальные исследования
Л. Б. Кравченко *
Томский государственный университет
634050 Томск, Россия
* E-mail: kravchenkolb@mail.ru
Поступила в редакцию 24.01.2020
После доработки 15.10.2020
Принята к публикации 16.10.2020
Аннотация
Влияние плотности населения на адаптивный гуморальный иммунитет рыжей (Clethrionomys glareolus) и красно-серой (C. rufocanus) полевок изучали у особей, родившихся в виварии с мая по август, от самок, изъятых из природы. Содержание полевок после окончания молочного вскармливания в составе выводковых групп моделировало высокую плотность населения и невозможность расселения. Низкую плотность моделировали индивидуальным содержанием животных после отлучения. Использовали температуру и освещение, которые характерны для естественных условий обитания. Показателем гуморального иммунитета считали количество антителпродуцирующих клеток селезенки, образующихся в ответ на введение эритроцитов барана. Исследовали животных в возрасте 20, 40 и 60 дней. Вне зависимости от плотности населения гуморальный иммунитет был выше у рыжей полевки. Половые различия отсутствовали у обоих видов. Влияние плотности социальной среды на иммунитет зависело от вида и сроков рождения особи. Рыжие полевки, без учета сроков рождения, имели более высокий уровень показателя при содержании в выводковых группах. Чувствительность иммунной системы к социальным стимулам зависела от сроков рождения особи. Полевки, родившиеся в мае, вне зависимости от условий содержания имели сходный уровень иммунитета во всех возрастных группах. У особей, родившихся в июне, такие различия появлялись в возрасте 60 дней, а у родившихся в июле и августе – в возрасте 40 дней. Иммунитет красно-серой полевки зависел от плотности населения только опосредованно, через условия терморегуляции. У изолированных двухмесячных особей этого вида, родившихся в августе, низкие температуры среды вызывали иммуносупрессию. Становление иммунной системы у обоих видов полевок конкурировало с процессами роста, не затрагивая половое созревание.
Взаимосвязь между плотностью населения и иммунореактивностью особей в составе популяции лежит в основе многих гипотез, объясняющих естественные колебания численности мелких грызунов. Эти гипотезы основаны на эмпирических данных о связи снижения иммунитета на пике численности с последующим ее падением. В качестве причины иммуносупрессии рассматривают генетические особенности этих особей (Mihok et al., 1985; Lochmiller, 1996), физиологические изменения, вызванные социальным стрессом (Geller, Christian, 1982), или возрастные изменения (Dilman, 1986), связанные со сдвигом демографической структуры популяции в сторону увеличения доли старых особей (Boonstra, 1994). Результатом иммуносупрессии является активация оппортунистических инфекции, связанных с условно патогенными возбудителями. Эта активация приводит к росту смертности и, соответственно, снижению численности (Hart et al., 1985; Mihok et al., 1985; Descoteaux, Mihok, 1986; Smith et al., 1993). В условиях лабораторного и полевого экспериментов показано, что высокая плотность населения имеет также отдаленные последствия, снижая показатели иммунитета и выживаемость потомков первого поколения (Götz et al., 2007; Götz, Stefanski, 2007; Bian et al., 2011; Du et al., 2016; Zhang et al., 2018). Обзоры, аккумулирующие результаты многочисленных экспериментальных исследований, описывают негативное воздействие социального стресса на значительную часть иммунологических показателей (Azpiroz, 2003; Bartolomucci, 2007).
В то же время для мелких мышевидных грызунов известен феномен плотностно-зависимого подавления полового созревания сеголеток, когда в условиях высокой плотности многие особи откладывают размножение на следующий год (Оленев, 2002; Москвитина и др., 2004; Novikov, Moshkin, 1998). С точки зрения компромиссного распределения (trade-off) ресурсов между иммунной и репродуктивной системами, хорошо документированного для животных разных таксономических групп (Лохмиллер, Мошкин, 1999; Sheldon, Verhulst, 1996; Ilmonen et al., 2000; Råberg et al., 2000; McKean, Nunney, 2001; Møller, 2001), освободившиеся при этом ресурсы организма в текущем сезоне могут быть перенаправлены на формирование иммунной системы. Соответственно, увеличение плотности населения должно сопровождаться ростом иммунологических показателей. Подобные противоречия оставляют открытым вопрос об эффектах социальной среды на иммунореактивность членов социума.
Европейская рыжая (Clethrionomys glareolus Schreber 1780) и красно-серая (Cl. rufocanus Sund. 1846) полевки – это широко распространенные виды, составляющие основу населения микромаммалий в лесных сообществах на значительной части евразийского континента (Кошкина, 1966; 1967; Кравченко и др., 2002, 2007; Окулова, Катаев, 2003; Андреева, Окулова, 2009). Хорошая изученность многих аспектов экологии и физиологии этих видов (Stenseth, 1985; Kruszek, 1986; Onodera et al., 2017; Schirmer et al., 2019; Yang et al., 2019) делает их незаменимыми модельными объектами для решения теоретических вопросов. С другой стороны, активное участие рыжей и красно-серой полевок в циркуляции возбудителей многих инфекционных заболеваний (Окулова, Мясников, 1979; Балакирев и др., 2006; Ткаченко и др., 2016; Tersago et al., 2008), определяет практический интерес к любым иммунологическим исследованиям, связанным с этими видами.
Таким образом, целью данной работы была оценка влияния моделированной в условиях вивария высокой плотности населения, сопряженной с невозможностью выселения с материнского участка, на адаптивный гуморальный иммунитет рыжей и красно-серой полевок. Мы предполагаем, что плотность населения может быть положительно связана с иммунореактивностью полевок за счет подавления воспроизводства и перераспределения ресурсов в направлении усиления иммунитета. Ранее нами было показано, что у исследуемых видов существует слабая зависимость полового созревания от плотности населения (Kravchenko et al., 2016). Возможно, что в перераспределении ресурсов участвует не столько собственно половое созревание, сколько интенсивный рост.
МАТЕРИАЛ И МЕТОДИКА
Отлов и содержание животных
Объектами исследования были потомки первого поколения, родившиеся в условиях вивария от самок рыжей и красно-серой полевок, изъятых из природных сообществ в последнем триместре беременности. Согласно литературным данным на иммунитет потомков первого поколения влияет материнский социальный стресс (Götz, Stefanski, 2007; Götz et al., 2007; Bian et al., 2011; Du et al., 2016; Zhang et al., 2018), поэтому отловы проводили в течение длительного периода (2002–2018 гг.) в шести биотопах окрестностей г. Томска, различающихся по видовой структуре населения мышевидных грызунов. Это обеспечило наличие в выборке беременных самок, вынашивающих потомство на разных фазах популяционного цикла и в условиях различного биоценотического окружения. Полученные таким образом показатели иммунитета отражают его изменчивость в пределах видовой нормы реакции. Использование подобных данных, на наш взгляд, позволяет объективно оценить видовые особенности зависимости иммунитета от плотности населения. Работы проводили с мая по август. Отловленных самок размещали в виварии, где содержали индивидуально в пластиковых садках размером 25 × 40 × 12 см при температуре и фотопериоде, которые характерны для естественных условий. Корм (овес, яблоки, свежую траву) и воду предоставляли без ограничений. В качестве гнездового материала использовали хлопковую вату. Дату рождения детенышей устанавливали с помощью ежедневных утренних проверок (9.00–10.00) садков с беременными самками. Различную плотность населения моделировали в условиях вивария, используя два контрастных варианта выращивания потомства. В возрасте 20 дней выводки, которые предполагалось содержать далее – 52 выводка рыжей и 47 выводков красно-серой полевки, делили на две группы, не различающиеся по количеству детенышей (тест Манна-Уитни: Z = 0.57, n1 = 26, n2 = 26, p = 0.57 и Z = 1.43, n1 = 24, n2 = 23, p = 0.15 соответственно). Потомков из первой группы пометов размещали в индивидуальные садки, имитируя низкую плотность населения (n = 120 и n = 105 соответственно рыжей и красно-серой полевок). Детенышей из второй группы пометов выращивали в составе выводков совместно с матерями, моделируя высокую плотность и невозможность расселения с материнского участка (n = 151 и n = 148). Уровень иммунитета у животных оценивали в возрасте 20 дней (n = 61 и n = 62 соответственно рыжей и красно-серой полевок), 40 (n = 115; n = 122) и 60 (n = 156; n = 131). Выбор сроков тестирования обусловлен наличием литературных данных о том, что гуморальный иммунный ответ у лабораторных грызунов (мышь линии BALB) достигает “взрослого” уровня в возрасте 6 недель (Mosier, Cohen, 1975; Burns-Guydish et al., 2005). Всего было исследовано 332 особи рыжей и 315 особей красно-серой полевки. У всех животных измеряли массу тела с точностью до 0.01 г, а в возрасте 40 и 60 дней – массу генеративных органов (семенника у самцов (n = 131 и n = 129 соответственно для рыжей и красно-серой полевок) и матки с яичниками у самок (n = 85 и n = 50)) с точностью до 0.001 г.
Для выявления возможных конкурентных отношений между формированием иммунитета и процессами роста и полового созревания полевок проводили дополнительный анализ. С этой целью: 1) на основе сравнения средних значений массы тела и генеративных органов между группами особей, содержащихся в контрастных условиях, оценивали роль социальной среды как стимула, вовлекающего процессы роста и/или созревания в компромиссные отношения; 2) с помощью корреляционного анализа оценивали на индивидуальном уровне взаимоотношения между иммунореактивностью и массой тела или генеративных органов особи. Так как подобные отношения могли возникать на короткое время и затем могли исчезать, рассматривали обе возрастные группы.
Оценка гуморального иммунитета
В качестве показателя силы адаптивного гуморального иммунного ответа использовали метод локального гемолиза в жидкой среде (Cunningham, 1965). В этом тесте показателем иммунореактивности считают количество антителобразующих клеток (АОК) селезенки, которые формируются в ответ на введение в организм нереплицируемого антигена. Для иммунизации животным интраперитонеально вводили 0.5 мл 2% суспензии эритроцитов барана. На 5-е сутки после иммунизации зверьков выводили из эксперимента методом цервикальной дислокации. Все процедуры с животными осуществляли в соответствии с требованиями Комиссии по биоэтике Биологического института Национального исследовательского Томского государственного университета, согласованными с Европейской конвенцией о защите позвоночных животных для экспериментов или в иных научных целях (ETS N 123 от 18 марта 1986 г.). Для нивелирования различий, связанных с размерами животных, количество АОК относили к массе тела.
Статистическая обработка
Полученные значения иммунитета имели асимметричное распределение (Kolmogorov–Smirnov test, d = 0.16, p < 0.01), которое было приведено к нормальному (d = 0.05, p < 0.1) виду с помощью логарифмирования. Влияние рассматриваемых факторов на гуморальный иммунитет оценивали с помощью многофакторного дисперсионного анализа ANOVA. Сравнение средних по результатам ANOVA проводили LSD-тестом для множественных сравнений. В связи с тем, что распределение значений одного из морфологических показателей (масса матки) было асимметрично (Kolmogorov–Smirnov test, d = 0.16, p < 0.01), для оценки степени корреляции этих параметров с иммунитетом использовали ранговый коэффициент (RS) Спирмена. Парное сравнение массы тела и органов генеративной системы у животных, выращенных в социально-контрастных условиях, как и сравнение размера выводков, проводили с помощью критерия Манна–Уитни (Mann–Whitney U-test).
РЕЗУЛЬТАТЫ
Влияние вида и пола особи
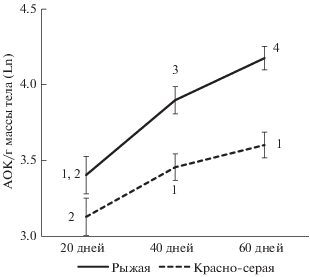
Оценка видовых и половых различий адаптивного гуморального иммунитета с помощью двухфакторного ANOVA обнаружила только видовые особенности (F(1,643) = 38.8, p < 0.0001). Влияние пола особи (F(1,643) = 0.6, p = 0.42), а также совместное воздействие этих факторов (F(1,643) = 0.28, p = 0.6) были не значимы, в связи с чем в дальнейшем анализе пол животных не учитывали. Средние значения количества антителобразующих клеток селезенки в старших возрастных группах (40 и 60 дней) у рыжей полевки были выше по сравнению с красно-серой (рис. 1), тогда как при выходе из гнезда особи исследуемых видов имели сходный уровень иммунореактивности.
Влияние социальной среды
Анализ изменчивости уровня гуморального иммунитета в зависимости от условий содержания (изолированно или выводковыми группами) проводили отдельно для каждого вида, учитывая две возрастные группы (40 и 60 дней). Трехфакторный дисперсионный анализ (факторы: “условия содержания”, “возрастная группа” и “месяц рождения”) показал, что у рыжей полевки активность иммунной системы определялась изолированным действием всех рассматриваемых факторов (F(1,255) = 16.1, p < 0.0001; F(1,255) = 7.5, p < 0.01; F(3,255) = 6.3, p < 0.001 соответственно). На уровне тенденции реакция на введение антигена зависела от совместного влияния условий содержания и сроков рождения особи (F(3,255) = 2.4, p = 0.07). Совместное воздействие всех трех факторов было не достоверно (F(3,255) = 1.4, p = 0.3).
Влияние социальных условий на иммунореактивность красно-серой полевки было значимо только при рассмотрении данных с учетом возраста особей (F(1,237) = 7.6, p < 0.01), или с учетом возраста и сроков рождения (F(3,237) = 3.4, p < 0.02).
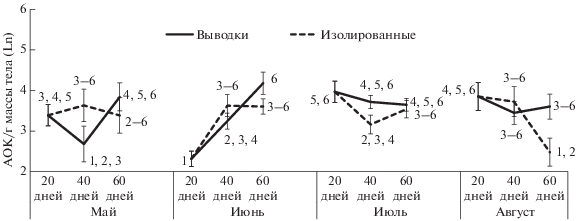
Более детальный анализ, проведенный с использованием LSD-теста, позволил обнаружить видовые особенности зависимости иммунитета от условий содержания. У рыжей полевки эффекты социальной среды зависели от сроков рождения животных. Минимальное влияние на формирование иммунной системы плотность населения оказывала у особей, родившихся в мае (рис. 2). Социальные условия у них только модулировали возрастные изменения иммунитета: в условиях высокой плотности майские полевки после выхода из гнезда демонстрировали рост показателя, тогда как при низкой плотности возрастные изменения адаптивного гуморального иммунитета были не существенны. Для полевок, родившихся в июне, социальная среда была более значима: выращивание в составе выводковой группы приводило к росту иммунореактивности, однако уровня достоверности эти различия достигали только у двухмесячных особей (рис. 2). Полевки, родившиеся в июле и августе, демонстрировали высокую чувствительность иммунной системы к действию социальных факторов уже при выходе из гнезда. Содержание в составе выводка вызывало у них интенсивный рост реакции на введение антигена, определяя более высокие по сравнению с изолированными особями значения показателя уже в 40-дневном возрасте.
Рис. 2.
Возрастные изменения адаптивного гуморального иммунитета у рыжих полевок, родившихся в разные календарные сроки при содержании в контрастных социальных условиях. Одинаковыми цифрами обозначены средние, не различающиеся по критерию LSD (p < 0.05).
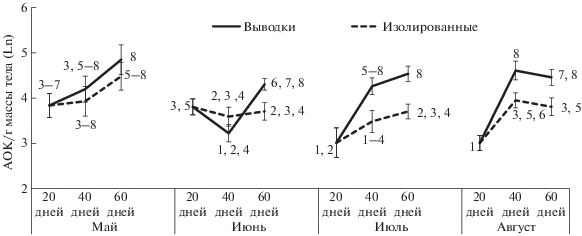
У красно-серой полевки условия содержания оказывали значимое влияние на количество формирующихся АОК только среди животных, родившихся в августе (рис. 3). Индивидуальное содержание этих особей вызывало резкое снижение уровня гуморального иммунитета после 40-дневного возраста, обусловливая значимые различия показателя у двухмесячных полевок, выращенных в контрастных условиях плотности.
Иммунитет и процессы роста и полового созревания
Согласно полученным результатам, масса тела у рыжей полевки в возрасте 40 дней не зависела от социальных стимулов, однако в следующие 20 дней жизни изолированные особи росли быстрее, чем в выводковых группах, и в двухмесячном возрасте они были существенно крупнее (табл. 1). На массу семенника или матки условия содержания не влияли.
Таблица 1.
Масса тела и органов генеративной системы (среднее ± ошибка) особей исследуемых видов при содержании в различных условиях
| Вид | Возраст, дни | Условия содержания | Масса тела, г M ± m (n) |
Масса семенника, мг M ± m (n) | Масса матки, мг M ± m (n) |
|---|---|---|---|---|---|
| Рыжая полевка |
40 | Выводки | 17.7 ± 039 (60) | 98.4 ± 16.61 (29) | 26.7 ± 3.38 (10) |
| Изолированные | 17.8 ± 0.40 (55) | 101.6 ± 16.62 (29) | 28.6 ± 3.09 (12) | ||
| 60 | Выводки | 15.3 ± 0.34* (91) | 93.4 ± 13.73 (43) | 15.1 ± 1.67 (41) | |
| Изолированные | 16.9 ± 0.39 (65) | 95.6 ± 16.32 (30) | 18.9 ± 2.28 (22) | ||
| Красно-серая полевка |
40 | Выводки | 25.1 ± 0.59* (78) | 59.9 ± 14.26 (37) | 39.8 ± 4.93 (8) |
| Изолированные | 27.9 ± 0.78 (44) | 96.8 ± 18.50 (22) | 24.6 ± 3.73 (14) | ||
| 60 | Выводки | 30.4 ± 0.62* (70) | 88.3 ± 13.72 (40) | 17.5 ± 3.73 (14) | |
| Изолированные | 25.5 ± 0.66 (61) | 95.8 ± 15.84 (30) | 21.6 ± 3.73 (14) |
Масса тела у красно-серой полевки зависела от условий содержания в обеих возрастных группах. В первые 20 дней самостоятельной жизни быстрее росли изолированные животные (табл. 1), достигая дефинитивных размеров уже к 40-дневному возрасту. Полевки из выводковых групп росли медленнее, однако продолжительный период роста обеспечивал им более крупные, по сравнению с одиночными особями, размеры тела в двухмесячном возрасте. Скорость полового созревания не зависела от социального окружения.
Корреляционный анализ не выявил у рыжей полевки наличие связи между количеством АОК и массой тела особи в возрасте 40 дней (RS = –0.02, p > 0.05, n = 115). При этом, в двухмесячном возрасте слабая отрицательная связь наблюдалась (RS = –0.18, p < 0.05, n = 156). Реципрокные отношения этих показателей сохранялись и при анализе данных за отдельные месяцы, хотя значимого уровня они достигали только у особей, родившихся в августе (RS = –0.4, p < 0.05, n = 38). Связь между иммунореактивностью самцов и массой семенника отсутствовала в обеих возрастных группах (RS = –0.18, p > 0.05, n = 58; и RS = 0.02, p > 0.05, n = 73 соответственно в 40 и 60 дней). В то же время при помесячном анализе у двухмесячных самцов, родившихся в августе, показатели были связаны положительно (RS = 0.74, p < 0.05, n = 15). У самок рыжей полевки достоверная связь между массой матки и иммунитетом также не выявлена (RS = 0.06, p > 0.05, n = 22; и RS = 0.06, p > 0.05, n = 63 соответственно 40 и 60 дней), а помесячный анализ обнаружил положительную корреляцию этих параметров у двухмесячных особей, родившихся в мае (RS = 0.88, p < 0.05, n = 7).
У красно-серой полевки характер взаимосвязи иммунитета и процессов роста имел возрастные различия. В возрасте 40 дней масса тела и количество АОК находились в слабо выраженных реципрокных отношениях (RS = –0.22, p < 0.05, n = 122). Отрицательный характер взаимосвязи параметров сохранялся и при помесячном анализе, хотя уровня достоверности она достигала только у полевок, родившихся в июле (RS = –0.35, p < 0.05, n = 54). Среди двухмесячных особей этого вида, напротив, была отмечена слабая положительная связь иммунитета и размеров тела (RS = 0.21, p < < 0.05, n = 131). Взаимозависимость иммунореактивности с половым созреванием у красно-серой полевки отсутствовала в возрасте 40 дней (RS = = ‒0.01, p > 0.05, n = 59; и RS = –0.31, p > 0.05, n = 22, соответственно для самцов и самок) и была положительна у двухмесячных особей (RS = 0.38, p < < 0.05, n = 70 и RS = 0.57, p < 0.05, n = 28, самцы и самки). Помесячный анализ обнаружил отрицательные отношения между иммунитетом и массой семенника у 40-дневных самцов, родившихся в мае (RS = –0.89, p < 0.05, n = 6).
ОБСУЖДЕНИЕ
Влияние вида и пола особи
Анализу межвидовых различий устойчивости к заболеваниям у позвоночных посвящено относительно небольшое количество работ. При обнаружении таких различий авторы чаще всего связывают их с экологическими причинами, например со степенью зараженности среды патогенами, обусловленной особенностями климата или самой среды. При этом животные, населяющие регионы с экстремальными условиями – холодными или, напротив, жаркими и сухими, характеризуются более низким иммунитетом по сравнению с видами, населяющими территории с теплым и влажным климатом (Mills et al., 1997). Снижение иммунитета у птиц, населяющих морские побережья, объясняют снижением паразитарной нагрузки, связанным с размыванием возбудителей большим количеством воды (Piersma, 1997). С физическими свойствами среды, ограничивающими возможность передачи и широкого распространения инфекции, связывают низкую иммунореактивность роющих животных (Новиков, 2005). Кроме факторов среды, межвидовые различия иммунологических показателей могут определяться морфологическими, физиологическими или этологическими особенностями особей этих видов. В частности, у ряда таксонов млекопитающих получила подтверждение гипотеза, которая позволяет предположить существование зависимости между системой спаривания и иммунореактивностью (Nunn, 2002; Anderson et al., 2004; Nunn et al., 2004). Согласно этой гипотезе, уровень промискуитета при спаривании, определяющий вероятность передачи возбудителей, является одним из факторов изменения инвестиций в иммунитет. Кроме того, в некоторых случаях прослеживается зависимость между массой тела животных и показателями иммунитета. Так, при анализе 37 видов грызунов была выявлена положительная корреляция между массой тела взрослой особи, усредненной по полу и показателями (общее число лейкоцитов, число нейтрофилов и лимфоцитов) клеток белой крови (Tian et al., 2015).
Систематическая и экологическая близость исследованных нами видов значительно затрудняет объяснение выявленных межвидовых различий уровня гуморального иммунитета. Согласно имеющимся на данный момент представлениям, для них характерны одинаковая пространственно-этологическая структура популяции и одинаковая система спаривания (Громов, 2008), а крупные размеры красно-серой полевки сочетаются с низкой иммунореактивностью, что не поддерживает последнюю из описанных выше закономерностей. Более высокий уровень гуморального иммунного ответа у рыжей полевки в целом соответствует предположению о повышенной иммунореактивности видов, населяющих регионы с теплым климатом. Однако наличие сведений о существенно более высокой, по сравнению с исследуемыми видами, иммунореактивности красной (Cl. rutilus) полевки (Кравченко, Москвитина, 2008), ареал которой простирается на север максимально среди лесных полевок, противоречит этой гипотезе. Учитывая высокие затраты энергетических и пластических ресурсов организма на пролиферативные процессы и синтез антител (Segel, Bar-Or, 1999; Buttgereit et al., 2000; Ots et al., 2001; Shudo, Iwasa, 2001), можно предположить, что уровень гуморального иммунитета зависит от характера питания вида, который во многом определяет уровень обмена веществ (Башенина, 1977), и, соответственно, размер возможных инвестиций в иммунитет. В рамках этого предположения хорошо объяснима низкая иммунореактивность красно-серой полевки – наиболее зеленоядной (Кравченко, 1999) среди лесных полевок. Безусловно, причины различий показателей приобретенного иммунитета у систематически и экологически близких видов крайне интересны и для выявления их необходимы отдельные, специальные исследования.
Как правило, у большинства позвоночных самцы больше страдают от паразитарных инфекций и имеют пониженный иммунный ответ по сравнению с самками (Eidinger, Garrett, 1972; Schuurs, Verheul, 1990; Afoke et al., 1993; Daniels, Belosevic, 1994; Poulin, 1996; Klein et al., 2001). Возможные причины этого детально рассмотрены в больших обзорах (Zuk, 1990; Zuk, McKean 1996; Klein, 2000). Наиболее часто среди причин рассматривают различия в концентрациях половых гормонов. Известно, что тестостерон оказывает иммунносупрессивное действие: в частности, у самцов индийской мягкошерстной крысы (Meltada millardia) выявлена более высокая по сравнению с самками интенсивность нематодной инвазии. Эти различия исчезают после гонадэктомии (Tiuria et al., 1994). Эстрогены, напротив, обладают иммуностимулирующим эффектом (Medina et al., 2000; Bouman et al., 2005; Fish, 2008) – овариэктомированные самки крыс демонстрируют более медленное заживление ран по сравнению с интактными самками (Ashcroft et al., 1997). Другой причиной являются особенности поведения самцов, например бо́льшая подвижность, которая увеличивает вероятность встречи с патогеном (Selby et al., 1980). Кроме того, половую специфику иммунокомпетентности связывают с эволюционными факторами, такими как различия в направленности и силе отбора между полами (Zuk, Stoehr, 2002). Предполагается, что отбор на увеличение инвестиций в воспроизводство за счет снижения устойчивости к заболеваниям должен быть более выражен у самцов, чем у самок. Следовательно, у полигинных видов, у которых конкуренция между самцами максимальна, а вклад в потомство минимален, половые различия иммунокомпетентности должны быть выражены в наибольшей мере. Напротив, у моногамных видов, где вклад в потомство самцов и самок приблизительно одинаков, они могут отсутствовать. Однако проверка этой гипотезы, проведенная на видах рода Microtus (Klein, 2000), показала, что отношения между системой спаривания и иммунитетом неоднозначны и зависят от социального контекста. Не подтвердилась эта гипотеза и при изучении двух видов рода Peromyscus, различающихся системой спаривания (Klein, Nelson, 1997). В этом случае половые различия клеточного иммунитета были обнаружены у моногамных P. californicus и отсутствовали у полигинного P. maniculatus. Таким образом, влияние пола особи, как фактора, модифицирующего характеристики иммунной системы, до сих пор остается не вполне понятным.
Для рыжей и красно-серой полевок характерна промискуитетная система спаривания (Громов, 2008), предполагающая неравный вклад самцов и самок в воспроизводство, и, согласно описанной выше гипотезе, можно было ожидать наличие половых особенностей уровня гуморального иммунитета. Однако в ходе проведенных исследований подобные различия не были выявлены ни у одного из исследуемых видов, что опровергает высказанное предположение. Вместе с тем, наши данные хорошо согласуются с результатами, полученными ранее при изучении гуморального иммунитета рыжей и систематически близкой красной полевок (Moshkin et al., 1998).
Влияние социальной среды
Одной из первых гипотез, объясняющих возникновение циклов динамики численности у мелких мышевидных грызунов, была гипотеза Кристиана, согласно которой повышение плотности популяции приводит к увеличению числа агрессивных контактов между особями, вызывая рост стрессированности, регистрирумый по изменению активности коры надпочечников (Christian, 1950; Geller, Christian, 1982). Глюкокортикоиды регулируют различные функции организма, в том числе подавляют ряд иммунных реакций (Munck et al., 1984; Sapolsky, 2000). Ослабление иммунитета приводит к росту инфицирования животных, снижая их выживаемость. Гипотеза Кристиана получила убедительную поддержку во многих исследованиях. Так, было показано, что связанное с плотностью населения усиление функции коры надпочечников у Microtus pennsylvanicus коррелирует с распространенностью среди полевок пиелонефрита и цистицеркоза (Geller, Christian, 1982). У калифорнийской полевки (Microtus californicus) в год пика увеличивалось число эктопаразитов (Betzli, Pitelka, 1971). Наиболее яркой иллюстрацией негативного влияния социального стресса на иммунитет и выживаемость является полное вымирание взрослых самцов малой сумчатой крысы (Phascogale calura) после сезона спаривания (Bradley, 1987). В основе этого явления лежат чрезмерная агрессия, опосредованная высоким уровнем тестостерона, а также значительное снижение иммунореактивности, обусловленное повышением в крови концентрации глюкокортикоидов, вследствие подавления синтеза транскортина в печени (McDonald et al., 1986; Bradley, 1987).
Вместе с тем, эта стройная гипотеза не всегда находит подтверждение при изучении природных популяций. Далеко не всегда удается выявить положительную связь между плотностью населения и активацией гипоталамо-гипофизарно-адренокортикальной оси. В частности, особи M. pennsylvanicus не проявляли определенной и существенной реакции надпочечников на увеличение численности своей популяции (To, Tamarin, 1977). Корреляция уровня фекальных кортикостероидов с плотностью была выявлена у оленьего хомячка (P. maniculatus), но отсутствовала у полевки гаппери (Clethrionomys gapperi) (Harper, Austad, 2004). Этот же показатель повышался при снижении численности у водяной полевки Шермана (Arvicola scherman) (Charbonnel et al., 2008). Уровень фекального кортикостерона красной полевки снижался у особей в условиях моделированной в виварии высокой плотности населения и не зависел от социальной среды у рыжей и красно-серой полевок (Kravchenko et al., 2016). Не всегда обнаруживается связь между адренокортикальной активностью и иммунитетом. В частности, такая зависимость не была выявлена при исследовании природных популяций красной и рыжей полевок (Moshkin et al., 1998). Взаимосвязь между плотностью населения и уровнем иммунитета также далеко не однозначна. У нескольких видов млекопитающих в естественных условиях обнаружилась положительная зависимость между этими параметрами. В частности, с численностью особей был положительно скоррелирован уровень гамма-глобулина в сыворотке крови у обыкновенной (Microtus arvalis) полевки (Dobrowolska, Adamczewska-Andrzejewska, 1991), количество клеток белой крови, весовые характеристики тимуса и селезенки у красной (Lazutkin et al., 2016), уровень гуморального иммунитета у самок рыжей полевки (Saino et al., 2000), а также количество лейкоцитов и нейтрофилов у домашней кошки (Naidenko et al., 2020).
Полученные нами результаты говорят о наличии видовой специфики в отношениях между плотностью и иммунореактивностью. В соответствии с нашими предположениями, рыжая полевка демонстрировала повышение реакции на введение антигена в условиях моделированной высокой плотности. Известно, что повышение плотности населения сопровождается увеличением как прямых, так и опосредованных контактов между особями. Было показано, что число самцов рыжей полевки, концентрирующихся возле рецептивной самки, в зависимости от плотности населения изменяется от 2–3 до 12 (Чистова, Осипова, 2005). Рост числа контактов (агрессивных, половых) увеличивает вероятность передачи инфекции (Barber, Dingemanse, 2010). В таких условиях рост иммунорезистентности представляется вполне оправданным, так как увеличивает шансы выживания животных. Эффект социальной среды в нашем эксперименте накапливался с возрастом и усиливался во второй половине репродуктивного сезона, проявляясь в более раннем возрасте. Адаптивность сезонного повышения чувствительности к социальным стимулам, вероятно, определяется тем, что успешная зимовка в условиях большой плотности населения, характерной для осенней популяции рыжей полевки (Moshkin et al., 1998; Huitu et al., 2004), возможна лишь при высокой иммунореактивности особей.
У красно-серой полевки зависимость уровня гуморального иммунитета от условий содержания была минимальна, обнаруживаясь только у двухмесячных особей, родившихся в августе (рис. 3). Изолированное содержание вызывало у этих животных значимое снижение иммунитета. Такая иммуносупрессия, на наш взгляд, обусловлена спецификой вида. Ранее японскими исследователями было показано, что индивидуальное содержание красно-серой полевки при +5°С, несмотря на избыточное кормление и фиксируемый рост уровня метаболизма, приводило к потере массы тела и лимфоидных органов, снижению иммунитета (Kusumoto, Saitoh, 2008). Авторы предположили, что это обусловлено дефицитом энергии в связи с ее конкурентным перераспределением на терморегуляцию. С подобным дефицитом, несомненно, столкнулись изолированные особи красно-серой полевки в ходе нашего эксперимента. Возраста двух месяцев они достигали в октябре, когда среднемесячная температура, усредненная за период исследований, составляла 2.5 ± 0.5°С. Несовершенство механизмов получения энергии у этого зеленоядного вида компенсируется наличием адаптаций поведенческого уровня, позволяющих ему заселять холодные регионы континента. В частности показано, что, за исключением единичных случаев, красно-серая полевка переживает зиму в составе выводковых, родственных, или, при отсутствии родственников, в составе неродственных внутривидовых групп (Ishibashi et al., 1998).
Иммунитет и процессы роста и полового созревания
В целом, выявленная нами положительная зависимость между иммунитетом и плотностью населения соответствует представлениям о реципрокных отношениях между репродуктивной и иммунной системами (Лохмиллер, Мошкин, 1999; Martin et al., 2008). Наличие конкурентных отношений и компромиссного перераспределения ресурсов между иммунной и генеративной системами неоднократно отмечалось при исследовании различных групп позвоночных (Deerenberg et al., 1997; Nordling et al., 1998; Moreno et al., 1999; Lochmiller, Deerenberg, 2000). Однако проверка наших результатов с помощью корреляционного анализа не подтвердила наличия подобных отношений у рыжей полевки. При рассмотрении совокупных данных корреляция между массой органов генеративной системы и иммунореактивностью отсутствовала, а все обнаруженные существенные связи при анализе данных за отдельные месяцы были положительными. Кроме того, животные, выращенные в социально контрастных условиях, не различались по средним значениям массы генеративных органов. Все эти факты позволяют предполагать, что у рыжей полевки процесс полового созревания “защищен” от воздействия социальных стимулов и при конкурентном распределении ресурсов имеет определенные преимущества. Подтверждением такому предположению могут служить результаты полевых и лабораторных исследований, говорящие о слабом участии репродуктивных показателей (доля половозрелых, плодовитость) в механизмах регуляции численности этого вида в Томском Приобье (Кравченко, 1999; Kravchenko et al., 2016). Возможно, что эта особенность носит региональный характер и связана с обитанием на периферии ареала.
В то же время наличие у рыжей полевки слабой, но достоверной отрицательной корреляции между уровнем иммунореактивности и массой тела не позволяет исключить существование конкурентных отношений между становлением иммунной системы и процессом роста. Значимые различия по массе тела у полевок, выращенных в контрастных условиях (табл. 1), подтверждают участие социальных стимулов в распределении ресурсов между этими процессами. Согласно нашим данным, у рыжей полевки повышение уровня гуморального иммунитета в условиях высокой плотности населения сопровождается снижением массы тела животных. Подобное вовлечение процессов роста в конкурентные отношения при распределении ресурсов организма хорошо документировано в литературе для птиц (Soler et al., 2003; Brommer, 2004) и млекопитающих (Mauck et al., 2005; Cheynel et al., 2018).
Хотя иммунорезистентность красно-серой полевки зависела от социальных факторов в меньшей степени и только опосредованно, через температурные условия, в онтогенезе у этого вида были выявлены кратковременные конкурентные отношения между формированием иммунной системы и процессами роста и полового созревания. Согласно полученным результатам, в первые 20 дней после выхода из гнезда интенсивный рост животных приводил к дефициту ресурсов, в связи с чем более крупные 40-дневные особи отличались низкой иммунореактивностью. Однако после завершения роста ресурсы направлялись на формирование иммунной системы, и к двухмесячному возрасту отношения между этими функциями становились, напротив, положительными. Наличие достоверных различий по массе тела между животными, содержащимися в контрастных социальных условиях, отмечаемое нами и ранее (Кравченко и др., 2011), свидетельствует о чувствительности ростовых процессов у красно-серой полевки к социальным стимулам и о возможном участии этих стимулов в формировании trade-off отношений между ростом и иммунитетом.
Половое созревание красно-серой полевки, также как у рыжей, в меньшей степени участвовало в процессе перераспределения ресурсов организма. Для взрослых особей была характерна положительная зависимость между массой органов генеративной системы и иммунитетом. В то же время наличие отрицательной корреляции между этими функциями у 40-дневных самцов красно-серой полевки, родившихся в мае, говорит о возможности возникновения конкурентных отношений между ними. Причиной конкуренции, на наш взгляд, является временный дефицит ресурсов, обусловленный ускоренным половым созреванием, которое у животных первых весенних выводков протекает одновременно с интенсивным ростом. В результате у особей, созревающих с максимальной скоростью, снижались показатели иммунитета.
Таким образом, проведенные исследования обнаружили видовые особенности эффектов социальной среды на адаптивный гуморальный иммунитет исследуемых видов. У рыжей полевки в условиях эксперимента высокая плотность населения приводила к росту иммунореактивности животных, причем чувствительность особей к социальным стимулам увеличивалась от весны к осени. Иммунитет красно-серой полевки зависел от социальных факторов только опосредованно, через условия терморегуляции. У обоих видов полевок в выявленных случаях формирования trade-off отношений, связанных с плотностью населения, становление иммунной системы конкурировало с процессами роста и не затрагивало половое созревание.
Список литературы
Андреева Т.А., Окулова Н.М., 2009. Экологические предпочтения лесных полевок // Экология. № 2. С. 149–154.
Балакирев А.Е., Башкирцев В.И., Седова Н.С., Окулова И.М., Транквилевский Д.В., Сикора И.В., Фролова С.М., Лузьянов Е.Н., Шинкоренко Н.Н., Сапельников А.Ф., Ткаченко Е.А., 2006. Эпизоотология геморрагической лихорадки с почечным синдромом в центральном Черноземье // Вопросы вирусологии. Т. 51. № 5. С. 28–32.
Башенина Н.В., 1977. Адаптивные особенности теплообмена мышевидных грызунов. М.: Изд-во МГУ. 296 с.
Громов В.С., 2008. Пространственно-этологическая структура популяций грызунов. М.: Товарищество научных изданий КМК. 581 с.
Кошкина Т.В., 1966. Взаимоотношения близких видов мелких грызунов и регуляция их численности // Фауна и экология грызунов. М.: Изд-во МГУ. Вып. 8. С. 5–27.
Кошкина Т.В., 1967. Популяционная регуляция численности грызунов (на примерах красной полевки тайги Салаира и норвежского лемминга) // Бюллетень Московского общества испытателей природы. Т. 72. Вып. 6. С. 5–19.
Кравченко Л.Б., 1999. Динамика сообщества и популяционные особенности лесных полевок (р. Clethrionomys) поймы Средней Оби. Дис. … канд. биол. наук. Томск. 157 с.
Кравченко Л.Б., Большакова Н.П., Иванова Н.В., Клыкова А.И., Сучкова Н.Г., Москвитина Н.С., 2007. Анализ альфа- и бета-разнообразия сообществ micromammalia и адаптационных стратегий некоторых видов в нарушенной среде // Актуальные проблемы экологии и природопользования Сибири в глобальном контексте: сборник статей в двух частях. Ч. 2. Ред. Кирпотин С.Н. Томск: изд-во Томского политехнического университета. С. 185–189.
Кравченко Л.Б., Москвитина Н.С., 2008. Поведенческие и физиологические особенности трех видов лесных полевок (Clethrionomys, Rodentia, Cricetidae) в связи с пространственной структурой их популяций // Зоологический журнал. Т. 87. № 12. С. 1509–1517.
Кравченко Л.Б., Завьялов Е.Л., Москвитина Н.С., 2011. Половое созревание и возрастная динамика кортикостерона у двух видов лесных полевок (Clethrionomys, Rodentia, Cricetidae) в экспериментальных условиях // Зоологический журнал. Т. 90. № 12. С. 1–9.
Кравченко Л.Б., Москвитина Н.С., Сучкова Н.Г., 2002. Структурно-динамические особенности пойменных сообществ грызунов. // Эколого-биогеохимические исследования в бассейне Оби. Ред. Зуев В.В., Куровский А.В., Шварцева С.Л. Томский научный центр СО РАН, Международный исследовательский центр по физике окружающей среды и экологии. Томск: Изд-во РАСКО. С. 365–387.
Лохмиллер Р.Л., Мошкин М.П., 1999. Экологические факторы и адаптивная значимость изменчивости иммунитета мелких млекопитающих // Сибирский экологический журнал. № 1. С. 37–58.
Москвитина Н.С., Кравченко Л.Б., Мак В.В., Добротворский А.К., Панов В.В., Андреевских А.В., Мошкин М.П., 2004. Иммунореактивность разных демографических групп в городских популяциях полевой мыши, Apodemus agrarius (Rodentia, Muridae) // Зоологический журнал. Т. 83. № 4. С. 480–485.
Новиков Е.А., 2005. Физиологическая цена адаптаций обыкновенной слепушонки (Ellobius talpinus Pall.) к подземному образу жизни в сравнении с наземными видами грызунов. Автореф. дис. … докт. биол. Наук. Новосибирск: Ин-т систематики и экологии животных СО РАН. 35 с.
Окулова Н.М., Катаев Г.Д., 2003. Многолетняя динамика численности красно-серой полевки (Clethrionomys rufocanus, Microtinae, Rodentia) в разных частях ареала // Зоологический журнал. Т. 82. № 9. С. 1095–1111.
Окулова H.М., Мясников Ю.А., 1979. Род Clethrionomys Tilesius, 1850 – рыжие или лесные полевки // Медицинская териология. М.: Наука. С. 158–165.
Оленев Г.В., 2002. Альтернативные типы онтогенеза цикломорфных грызунов и их роль в популяционной динамике (экологический анализ) // Экология. № 5. С. 341–350.
Ткаченко Е.А., Дзагурова Т.К., Бернштейн А.Д., Коротина Н.А., Окулова Н.М., Мутных Е.С., Иванов А.П., Ишмухаметов А.А., Юничева Ю.В., Пиликова О.М., Морозов В.Г., Транквилевский Д.В., Городин В.Н., Бахтина В.А., Соцкова В.Е., 2016. Геморрагическая лихорадка с почечным синдромом (история, проблемы и перспективы изучения) // Эпидемиология и вакцинопрофилактика. Т. 15. № 3 (88). С. 23–34.
Чистова Т.Ю., Осипова О.В., 2005. Половое поведение самок рыжих полевок в природе и экспериментальных группах // Поведение и поведенческая экология млекопитающих. Материалы научной конференции (4–8 октября 2005 г., Черноголовка). М.: Товарищество научных изданий КМК. С. 296–299.
Afoke A.O., Eeg-Olofsson O., Hed J., Kjellman N-I.M., Lindblom B., Ludvigsson J., 1993. Seasonal variation and sex differences of circulating macrophages, immunoglobulins and lymphocytes in healthy school children // Scandinavian Journal of Immunology. V. 37. I. 2. P. 209–215.
Anderson M.J., Hessel J.K., Dixson A.F., 2004. Primate mating systems and the evolution of immune response // Journal of Reproductive Immunology. V. 61. P. 31–38.
Ashcroft G.S., Dodsworth J., van Boxtel E., Tarnuzzer R.W., Horan M.A., Schultz G.S., Ferguson M.W.J., 1997. Estrogen accelerates cutaneous wound healing associated with an increase in TGF-ß1 levels. // Nature Medicine. V. 3. P. 1209–1215.
Azpiroz A., Garmendia L., Fano E., Sanchez-Martin J.R., 2003. Relations between aggressive behavior, immune activity, and disease susceptibility // Aggression and Violent Behavior. V. 8. P. 433–453.
Barber I., Dingemanse N.J., 2010. Parasitism and the evolutionary ecology of animal personality // Philosophical Transactions: Royal Society, Biological Sciences. V. 365. № 1560. P. 4077–4088.
Bartolomucci A., 2007. Social stress, immune functions and disease in rodents // Frontiers in Neuroendocrinology. V. 28. P. 28–49.
Betzli G.O., Pitelka F.A., 1971. Condition and diet of cycling populations of the California vole, Microtus californicus // Journal of Mammalogy. V. 52. P. 141–163.
Bian J.-H., Wu Y., Getz L.L., Cao Y.-F., Chen F., Yang L., 2011. Does maternal stress influence winter survival of offspring in root voles Microtus oeconomus? A field experiment // Oikos.V. 120. I. 1. P. 47–56.
Boonstra R., 1994. Population cycles in microtines: the senescence hypothesis // Evolutionary Ecology. V. 8. P. 196–219.
Bouman A., Heineman M.J., Faas M.M., 2005. Sex hormones and the immune response in humans // Human Reproduction Update. V. 11. P. 411–423.
Bradley A.J., 1987. Stress and mortality in the red-tailed phascogale, Phascogale calura (Marsupialia: Dasyuridae) // General and Comparative Endocrinology. V. 67. P. 85–100.
Brommer J.E., 2004. Immunocompetence and its costs during development: an experimental study in blue tit nestlings // Proceedings of the Royal Society of London B: Biological Sciences. V. 271. P. S110–S113.
Burns-Guydish S.M., Olomu I.N., Zhao H., Wong R.J., Stevenson D.K., Contag C.H., 2005. Monitoring age-related susceptibility of young mice to oral Salmonella enterica serovar typhimurium infection using an in vivo murine model // Pediatric Research. V. 58. I. 1. P. 153–158.
Buttgereit F., Burmester G.-R., Brand M.D., 2000. Bioenergetics of immune functions: Fundamental and therapeutic aspects // Immunology Today. V. 21. I. 4. P. 194–199.
Charbonnel N., Chaval Y., Berthier K., Deter J., Morand S., Palme R., Cosson J.-F., 2008. Stress and demographic decline: a potential effect mediated by impairment of reproduction and immune function in cyclic vole populations // Physiological and Biochemical Zoology. V. 81. I. 1. P. 63–73.
Cheynel L., Douhard F., Gilot-Fromont E., Rey B., Debias F., Pardonnet S., Lemaitre J.-F., 2018. Does body growth impair immune function in a large herbivore? // Oecologia. V. 189. I. 1. P. 55–68.
Christian M., 1950. The adreno-pituitary system and population cycles in mammals. // Journal of Mammalogy V. 31. P. 247–259.
Cunningham A.J., 1965. A method of increased sensitivity for detecting single antibody-forming cells // Nature. V. 207. P. 1106–1107.
Daniels C.W., Belosevic M., 1994. Serum antibody responses by male and female C57Bl/6 mice infected with Giardia muris. // Clinical and Experimental Immunology. V. 97. P. 424–429.
Deerenberg C., Arpanius V., Daan S., Bos N., 1997. Reproductive effort decreases antibody responsiveness // Proceedings of the Royal Society of London B: Biological Sciences. V. 264. P. 1021–1029.
Descoteaux J.-P, Mihok S., 1986. Serologic study on the prevalence of murine viruses in a population of wild meadow voles (Microtus pennsylvanicus) // Journal of Wildlife Diseases. V. 22. P. 314–319.
Dilman V.M., 1986. Ontogenetic model of ageing and disease formation and mechanisms of natural selection // Journal of Theoretical Biology. V. 118. I. 1, 7. P. 73–81.
Dobrowolska A., Adamczewska-Andrzejewska K.A., 1991. Seasonal and long-term changes in serum gamma-globulin levels in comparing the physiology and population density of the common vole, Microtus arvalis Pall. 1779. // Journal of Interdisciplinary Cycle Research. V. 22. № 1. P. 1–19.
Du S.-Y., Cao Y.-F., Nie X.-H., Wu Y., Bian J.-H., 2016. The synergistic effect of density stress during the maternal period and adulthood on immune traits of root vole (Microtus oeconomus) individuals – a field experiment // Oecologia. V. 181. I. 2, 1. P. 335–346.
Eidinger D., Garrett T.J., 1972. Studies of the regulatory effects of the sex hormones on antibody formation and stem cell differentiation // Journal of Experimental Medicine. V. 136. P. 1098–1116.
Fish E.N., 2008. The X-files in immunity: sex-based differences predispose immune response // Immunology. V. 8. P. 737–744.
Geller M.D., Christian J.J., 1982. Population dynamics, adrenocortical function, and pathology in Microtus pennsylvanicus // Journal of Mammalogy. V. 63. № 1. P. 85–95.
Götz A.A., Stefanski V., 2007. Psychosocial maternal stress during pregnancy affects serum corticosterone, blood immune parameters and anxiety behaviour in adult male rat offspring // Physiology and Behavior. V. 90. P. 108–115.
Götz A.A., Wittlinger S., Stefanski V., 2007. Maternal social stress during pregnancy alters immune function and immune cell numbers in adult male Long-Evans rat offspring during stressful life-events // Journal of Neuroimmunology. V. 185. P. 95–102.
Harper J.M., Austad S.N., 2004. Fecal corticosteroid levels in free-living populations of deer mice (Peromyscus maniculatus) and southern redbacked voles (Clethrionomys gapperi) // The American Midland Naturalist. V. 152. P. 400–409.
Hart R.P., Bradshaw S.D., Iveson J.B., 1985. Salmonella infections in a marsupial, the Quokka (Setonix brachyurus), in relation to seasonal changes in condition and environmental stress // Applied and Environmental Microbiology. V. 49. P. 1276–1281.
Huitu O., Norrdahl K., Korpimaki E., 2004. Competition, predation and interspecific synchrony in cyclic small mammal communities // Ecography. V. 27. P. 197–206.
Ilmonen P., Taarna T., Hasselquist D., 2000. Experimentally activated immune defence in female pied flycatchers results in reduced breeding success // Proceedings of the Royal Society of London B: Biological Sciences. V. 267. P. 665–670.
Ishibashi Y., Saitoh T., Kawata M., 1998. Social organization of the vole Clethrionomys rufocanus and its demographic and genetic consequences: a Review // Researches on Population Ecology. V. 40(1). P. 39–50.
Klein S.L. 2000. Hormones and mating system affect sex and species differences in immune function among vertebrates // Behavioural Processes. V. 51. P. 149–166.
Klein S.L., Bird B.H., Glass G.E., 2001. Sex differences in immune responses and viral shedding following Seoul virus infection in Norway rats // The American Journal of Tropical Medicine and Hygiene. V. 65. I. 1. P. 57–63.
Klein S.L., Nelson R.J., 1997. Sex differences in immunocompetence differ between two Peromyscus species // American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. V. 273. I. 2. P. 655–660.
Kravchenko L.B., Moskvitina N.S., Zavyalov E.L., 2016. Dynamics of the fecal corticosterone content in males of red, gray-sided, and bank voles (Myodes, Rodentia, Cricetidae) upon sexual maturation // Biology Bulletin. V. 43. № 9. P. 45–54.
Kruszek M., 1986. Seasonal effects on sexual maturation of male bank voles (Clethrionomys glareolus) // Journal of Reproduction and Fertility. V. 76. P. 83–89.
Kusumoto K., Saitoh T., 2008. Effects of cold stress on immune function in the grey-sided vole, Clethrionomys rufocanus // Mammal Study. V. 33. P. 11–18.
Lazutkin A.N., Yamborko A.V., Kiselev S.V., 2016. Energy and Immune Parameters of Northern Red-Backed Voles (Clethrionomys rutilus) at Different Population Densities in the Kolyma River Basin // Russian Journal of Ecology. V. 47. №. 6. P. 562–567.
Lochmiller R.L., 1996. Immunocompetence and Animal Population Regulation // Oikos. V. 76. № 3. P. 594–602.
Lochmiller R.L., Deerenberg C., 2000. Trade-Offs in Evolutionary Immunology: Just What Is the Cost of Immunity? // Oikos. V. 88. № 1. P. 87–98.
Martin L.B, Weil Z.M., Nelson R.J., 2008. Seasonal changes in vertebrate immune activity: mediation by physiological trade-offs // Philosophical Transactions of the Royal Society B. V. 363. P. 321–339.
Mauck R.A., Matson K.D., Philipsborn J., Ricklefs R.E., 2005. Increase in the constitutive innate humoral immune system in Leach’s Storm-Petrel (Oceanodroma leucorhoa) chicks is negatively correlated with growth rate // Functional Ecology. V. 19(6). P. 1001–1007.
McDonald I.R., Lee A.K., Than K.A., Martin R.W., 1986. Failure of glucocorticoid feedback in males of a population of small marsupials (Antechinus swainsonii) during the period of mating // Journal Endocrinology. V. 108. P. 63–68.
McKean K.A., Nunney L., 2001. Increased sexual activity reduces male immune function in Drosophila melanogaster // Proceedings of the National Academy of Sciences of the USA. V. 98. P. 7904–7909.
Medina K.L., Strasser A., Kincade P.W., 2000. Estrogen influences the differentiation, proliferation, and survival of early B-lineage precursors // Blood. V. 95. P. 2059–2067.
Mihok S., Turner B.N., Iverson S.L., 1985. The characterization of vole population dynamics // Ecological Monographs. V. 55. № 4. P. 399–420.
Mills J.N., Ksiazek T.G., Ellis B.A., Rollin P.E., Nichol S.T., Yates T.L., Gannon W.L., Levy C.E., Engelthaler D.M., Davis T., Tanda D.T., Frampton J.W., Nichols C.R., Peters C.J., Childs J.E., 1997. Patterns of association with host and habitat: Antibody reactive with Sin Nombre virus in small mammals in the major biotic communities of the southwestern United States // American Journal of Tropical Medicine and Hygiene. V. 56. I. 3. P. 273–284.
Møller A.P., Merino S., Brown C.R., Robertson R.J., 2001. Immune defense and host sociality: a comparative study of swallows and martins // American Naturalist. V. 158. P. 136–145.
Moreno J., Sanz J.J., Arriero E., 1999. Reproductive effort and T-lymphocyte cell-mediated immunocompetence in female pied flycatchers Ficedula hypoleuca // Proceedings of the Royal Society of London B: Biological Sciences. V. 266. P. 1105–1109.
Moshkin M.P., Dobrotvorsky A.K., Mak V.V., Panov V.V., Dobrotvorskaya E.A., 1998. Variability of immune response to heterologous erythrocytes during population cycles of red (Clethrionomys rutilus) and bank (Cl. glareolus) voles // Oikos. V. 82. P. 131–138.
Mosier D.E., Cohen P.L., 1975. Ontogeny of mouse T-Iymphocyte function // Biology of aging and development. Thorbecke G.J. (Ed.). V. 3. Boston. MA: Springer US, FASEB Monographs. P. 221–230.
Munck A., Guyre P., Holbrook N., 1984. Physiological functions of glucocorticoids during stress and their relation to pharmacological actions // Endocrine Reviews. V. 5. P. 25–44.
Naidenko S.V., Klyuchnikova P.S., Kirilyuk V.E., Alekseeva G.S., 2020. Effect of population density on leukocytes number in domestic cats // Nature Conservation Research. V. 5(2). P. 89–96.
Nordling D., Andersson, M., Zohari, S., Lars G., 1998. Reproductive effort reduces specific immune response and parasite resistance // Proceedings of the Royal Society B: Biological Sciences. V. 265(1403). P. 1291–1298.
Novikov E., Moshkin M., 1998. Sexual maturation, adrenocortical function and population density of red-backed vole, Clethrionomys rutilus (Pall.) // Mammalia. V. 62. P. 529–540.
Nunn C.L., 2002. A comparative study of leukocyte counts and disease risk in primates // Evolution. V. 56. P. 177–190.
Nunn C.L., Gittleman J.L., Antonovics J., 2004. A comparative study of white blood cell counts and disease risk in carnivores // Proceedings of Royal Society B: Biological Sciences. V. 270. P. 347–356.
Onodera R., Akimoto Y., Shimada T., Saitoh T., 2017. Different population responses of three sympatric rodent species to acorn masting – the role of tannin tolerance // Population Ecology. V.59. I. 1. P. 29-43.
Ots I., Kerminov A., Ivankina E.V., Ilyina T.A., Horak P., 2001. Immune challenge affects basal metabolic activity in wintering great tits // Proceedings of the Royal Society B: Biological Sciences. V. 268. P. 1175–1181.
Piersma T., 1997. Do global patterns of habitat use and migration strategies co-evolve with relative investments in immunocompetence due to spatial variation in parasite pressure? // Oikos. V. 80. I. 3. P. 623–629.
Poulin R., 1996. Sexual inequalities in helminth infections: a cost of being male? // American Naturalist. V. 147. P. 287–295.
Råberg L., Nilsson J.-A., Ilmonen P., Stjernman M., Hasselquist D., 2000. The cost of an immune response: vaccination reduces parental effort // Ecology Letters. V. 3. P. 382–386.
Saino N., Canova L., Fasola M., Martinelli R., 2000. Reproduction and population density affect humoral immunity in bank voles under field experimental conditions // Oecologia. V. 124. P. 358–366.
Sapolsky R.M., 2000. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions // Endocrine Reviews. V. 21. № 1. P. 55–89.
Schirmer A., Herde A., Eccard J.A., Dammhahn M., 2019. Individuals in space: personality-dependent space use, movement and microhabitat use facilitate individual spatial niche specialization // Oecologia. V. 189. I. 3. P. 647–660.
Schuurs A.H.W.M., Verheul H.A.M., 1990. Effects of gender and sex steroids on the immune response // Journal of Steroid Biochemistry. V. 35. P. 157–172.
Sheldon B.C., Verhulst S., 1996. Ecological immunology: costly parasite defences and trade-offs in evolutionary ecology // Trends in Ecology and Evolution. V. 11(8). P. 317–321.
Shudo E., Iwasa Y., 2001. Inducible defense against pathogens and parasites: optimal choice among multiple options // Journal of Theoretical Biology. V. 209(2). P. 233–247.
Segel L.A., Bar-Or R.L., 1999. On the role of feedback in promoting conflicting goals of the adaptive immune system // The Journal of Immunology. V. 163. P. 1342–1349.
Selby L.A., Corwin R.M., Hayes H.M., 1980. Risk factors associated with canine heartworm infection // Journal of the American Veterinary Medical Association. V. 176. P. 33–35.
Smith A.L., Singleton G.R., Hansen G.M., Shellam G., 1993. A serologic survey for viruses and Mycoplasma pulmonis among wild house mice (Mus domesticus) in southeastern Australia // Journal of Wildlife Diseases. V. 29. P. 219–229.
Soler J.J., de Neve L., Perez-Contreras T., Soler M., Sorci G., 2003. Trade-of between immunocompetence and growth in magpies: an experimental study // Proceedings of the Royal Society of London B: Biological Sciences. V. 270. P. 241–248.
Stenseth N.C., 1985. Models for bank vole and wood mouse in The Ecology of Woodland Rodents // Symposium of the Zoological Society of London. V. 55. P. 339–376.
Tersago K., Schreurs A., Linard C., Verhagen R., Van Dongen S., Leirs H., 2008. Population, environmental, and community effects on local bank vole (Myodes glareolus) Puumala virus infection in an area with low human incidence // Vector Borne and Zoonotic Diseases. V. 8. P. 235–244.
Tian J., Courtiol A., Schneeberger K., Greenwood A.D., Czirjak G.A., 2015. Circulating white blood cell counts in captive and wild rodents are influenced by body mass rather than testes mass, a correlate of mating promiscuity // Functional Ecology. V. 29. P. 823–829.
Tiuria R., Horii Y., Tateyama S., Tsuchiya K., Nawa Y., 1994. The Indian soft-furred rat, Millardia meltada, a new host for Nippostrongylus brasiliensis, showing androgendependent sex difference in intestinal mucosal defence // International Journal for Parasitology. V. 24. P. 1055–1057.
To L.P., Tamarin R.H., 1977. The relation of population density and adrenal gland weight in cycling and noncycling voles (Microtus) // Ecology. V. 58. P. 928–934.
Yang Y., Zhang Y., Deng Y., Yi X., 2019. Endozoochory by granivorous rodents in seed dispersal of green fruits // Canadian Journal of Zoology. V. 97. I. 1. P. 42–49.
Zhang X., Yang Y., Du S., Cao Y., Zhou H., Bian J., 2018. Effects of maternal density stress and coccidiosis infection on immunity in root vole offsprings // Acta Theriologica Sinica. V. 38. I. 1. P. 56–65.
Zuk M., 1990. Reproductive strategies and disease susceptibility: an evolutionary viewpoint // Parasitology Today. V. 6. P. 231–233.
Zuk M., McKean K.A., 1996. Sex differences in parasite infections: patterns and processes // International Journal for Parasitology. V. 26. P. 1009–1024.
Zuk M., Stoehr A.M., 2002. Immune defense and host life history // American Naturalist. V. 160. № 4. P. 9–22.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал