Зоологический журнал, 2021, T. 100, № 5, стр. 573-589
Сопоставление морфологической дифференциации командорских песцов (Vulpes lagopus semenovi, Vulpes lagopus beringensis) с межвидовым уровнем различий в родах Urocyon и Vulpes (Canidae)
О. Г. Нанова *
Научно-исследовательский Зоологический музей МГУ
125009 Москва, ул. Большая Никитская, 2, Россия
* E-mail: nanova@mail.ru
Поступила в редакцию 27.06.2020
После доработки 13.09.2020
Принята к публикации 20.09.2020
Аннотация
Песцы (Vulpes lagopus), населяющие Командорские острова – о-в Медный и о-в Беринга, хорошо отличаются от материковых песцов по размеру и форме черепа. Несмотря на подробную изученность этих различий, их уровень относительно изменчивости между близкими видами семейства Canidae оставался не ясен до настоящего исследования. Мы сопоставили уровень краниологических различий между командорскими и материковыми песцами с краниологическими различиями: 1) между серой лисицей (Urocyon cinereoargenteus) и островной лисицей (U. littoralis); 2) в комплексе близких видов песец – американский корсак (V. velox) – американская лисица (V. macrotis). Результаты анализа изменчивости черепа морфометрическими методами показали, что различия между командорскими и материковыми песцами по степени своей выраженности соответствуют межвидовому уровню изменчивости для близких видов лисиц и лисоподобных хищников в семействе Canidae. При этом различия между изученными видами и островными популяциями разнонаправлены и не носят характера выраженного тренда. Наши морфологические данные свидетельствуют в пользу правомерности выделения командорских песцов в отдельный вид V. beringensis Merriam 1902 с двумя подвидами V. b. semenovi Ognev 1931 (о-в Медный) и V. b. beringensis Merriam 1902 (о-в Беринга). Результаты данной работы показывают, что командорские песцы являются уникальной частью биологического разнообразия России и нуждаются в строгой охране.
Островные популяции песцов Командорских о-вов, населяющие о-в Медный (Vulpes lagopus semenovi Ognev 1931) и о-в Беринга (V. l. beringensis Merriam 1902), хорошо отличаются от материковых песцов (V. l. lagopus L. 1758) особенностями морфологии (Цалкин, 1944; Загребельный, Пузаченко, 2006; Пузаченко, Загребельный, 2008; Нанова, 2008, 2009, 2010; Daitch, Guralnick, 2007; Nanova, Prôa, 2017; Nanova et al., 2017; Martin-Serra et al., 2019; Gimranov, in press) и поведения (Загребельный, 2000; Goltsman et al., 2005), а также дистанцированы генетически (Geffen et al., 2007). Морфологические различия столь велики, что командорские песцы были выделены Огневым (1931) в отдельный вид Alopex beringensis Merriam 1902 c двумя подвидами c каждого острова соответственно. Позже командорские песцы стали рассматриваться как конспецифики материковых песцов (Гептнер, Наумов, 1967). В некоторых случаях две популяции командорских песцов рассматривают как единый подвид (например, Wozencraft, 2005; Sillero-Zubiri, 2009), что неверно, т.к. генетические (Geffen et al., 2007) и морфологические (Martin-Serra et al., 2019) различия между песцами о-в Медный и о-в Беринга велики. Кроме того, каждая из этих изолированных популяций обладает своей уникальной историей (Рязанов, 2002; Goltsman et al., 1996; Shienok et al., 2017; Prôa, Nanova, 2020).
Несмотря на подробную изученность особенностей морфологии черепа песцов Командорских о-вов, уровень их различий с материковыми песцами никогда не сопоставлялся с уровнем морфологической изменчивости островных видов и межвидовой изменчивости вообще в семействе Canidae. Во многом это связано с труднодоступностью коллекций, т.к. виды, необходимые для такого рода сравнения, населяют североамериканский континент.
Для получения сравнительной оценки уровня морфологической дифференциации песцов о-в Медный и о-в Беринга от материковых песцов мы сопоставили уровень различий между островными и материковыми песцами с аналогичными параметрами у следующих групп:
1) Род Urocyon, или серые лисицы, является базальной ветвью семейства Canidae (Geffen et al., 1992; Wayne et al., 1997; Bardeleben et al., 2005). Род включает два вида лисоподобных хищников: материковый вид – серая лисица (Urocyon cinereoargenteus Schreber 1775) и островной вид – островная лисица (U. littoralis Baird 1858). Серая лисица является прямым предком островной лисицы, которая заселила острова Чаннел у побережья Калифорнии 10 400–16 000 лет назад (Wayne et al., 1991) в результате единократного акта переселения с материка (George, Wayne, 1991). В настоящий момент островная лисица населяет 6 островов из 8. На каждом острове выделяют отдельный подвид: о-в Сан-Мигель – U. l. littoralis Baird 1858; о-в Санта-Круз – U. l. santacruzae Merriam 1903; о-в Санта-Роза – U. l. santarosae Merriam 1903, о-в Сан-Клементин – U. l. clementae Merriam 1903; о-в Сан-Николас – U. l. dickeyi Grinnel et Linsdale 1930; о-в Санта-Каталина – U. l. catalinae Merriam 1903. Подробно генетические, хромосомные и краниометрические различия островной и серой лисиц исследованы Wayne et al. (1991).
Условия изоляции островных лисиц рода Urocyon во многом сходны с таковыми для командорских песцов. И островные лисицы, и командорские песцы полностью изолированы в течение сходного времени – с конца Плейстоцена – на небольших островах. Площади (км2) островов, населенных лисицами, следующие: острова Чаннел – о-в Сан-Мигель 38, о-в Санта-Круз 250, о-в Санта-Роза 215, о-в Сан-Клементин 147, о-в Сан-Николас 58, о-в Санта-Каталина 194, Командорские острова – о-в Медный 186, о-в Беринга 1667. Кроме того, песцы и серые лисицы – животные одного размерного класса. Средний вес материкового песца 3.0–45 кг, а длина тела от кончика носа до основания хвоста 50–65 см (Audet et al., 2002), средний вес серой лисицы 3–5 кг, а длина тела 54–66 см (Fritzell, Haroldson, 1982; Sillero-Zubiri, 2009).
Тем не менее, командорские песцы крупнее материковых песцов, а островные лисицы мельче серых лисиц. При этом изменение размеров тела у лисиц выражено сильнее по сравнению с песцами. Вес командорских песцов в среднем составляет 4.0–8.8 кг, а длина тела 60–73 см. Средний вес островных лисиц составляет 1.4–2.5 кг, длина тела 45.6–63.4 см (Moore, Collins, 1995; Sillero-Zubiri, 2009).
Представляет интерес сопоставление уровня морфологической дифференциации командорских песцов и островных лисиц от их материковых предков, сформировавшейся в сходных эволюционных условиях у животных одного размерного класса и принадлежащих одному семейству Canidae.
2) Близкие виды рода Vulpes: песец (V. l. lagopus L. 1758), американский корсак (V. velox Say 1823) и американская лисица (V. macrotis Merriam 1888). Согласно генетическим данным, песец, американский корсак и американская лисица – очень близкие виды (Geffen et al., 1992; Mercure et al., 1993; Bardeleben et al., 2005). Согласно генетическим (Geffen et al., 1992; Mercure et al., 1993) и палеонтологическим (Kurten, Anderson, 1980) данным первым около 500 тыс. лет назад от общего предка отделился американский корсак, затем 400–500 тыс. лет назад – песец (Kurten, Anderson, 1980; Savage, Russell,1983). Самый молодой вид – американская лисица – появился около 200 тыс. лет назад (Kurten, Anderson, 1980) и имеет самые выраженные приспособления к аридным условиям. Ранее американского корсака и американскую лисицу рассматривали как подвиды одного вида (Packard, Bowers, 1970; Rohwer, Kilgore, 1973; Dragoo et al., 1990). Позже, на основании генетических и морфологических различий их выделили в два разных вида, разделенных Скалистыми Горами (Mercure et al., 1993). В местах соприкосновения эти виды гибридизируют между собой (Rohwer, Kilgore, 1973). Ареал современного песца не соприкасается с ареалами американского корсака и американской лисицы. Все имеющиеся данные говорят о том, что песец, американский корсак и американская лисица – очень близкие виды. При этом песец сформировал комплекс адаптаций к условиям Арктики (Audet et al., 2002), американская лисица – к пустынному климату (McGrew, 1979). Американский корсак населяет степные и луговые участки (Egoscue, 1979) Северной Америки.
Материковый песец, американский корсак и американская лисица принадлежат к одному размерному классу. Вес американского корсака в среднем составляет 1.6–2.5 кг (Egoscue, 1979; Sillero-Zubiri, 2009), а длина тела – 47.5–54.5 см, вес американской лисицы – 1.6–2.7 кг, а длина тела – 45.5–53.5 см (McGrew, 1979; Sillero-Zubiri, 2009).
Представляет несомненный интерес сопоставление степени морфологической дифференциации изолированных командорских песцов от материковых песцов и в комплексе трех близких материковых видов V. lagopus–V. velox–V. macrotis.
Целью данного исследования было определить, как уровень морфологической дифференциации песцов Командорских о-вов от материковых песцов соотносится с уровнем межвидовой дифференциации лисиц и лисоподобных форм семейства Canidae.
Для этого мы решали следующие задачи:
1) Сопоставить уровень морфологических различий командорских и материковых песцов с уровнем морфологических различий серой (U. cinereoargenteus) и островной лисиц (U. littoralis).
2) Сопоставить уровень морфологических различий командорских и материковых песцов с уровнем различий в комплексе близких видов песец (V. lagopus) – американский корсак (V. velox) – американская лисица (V. macrotis).
МАТЕРИАЛ И МЕТОДЫ
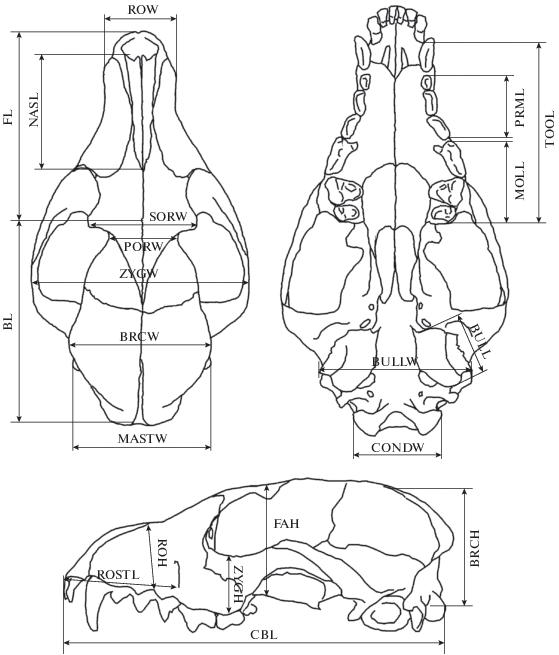
В работе использован 21 промер черепа (рис. 1): кондилобазальная длина черепа (CBL), длина лицевой части (FL), длина мозговой камеры (BL), длина верхнего зубного ряда с клыком (TOOL), длина верхнего ряда малых премоляров (PRML), длина верхнего ряда моляров с хищным зубом (MOLL), длина носовых костей (NASL), длина рострума – расстояние до подглазничного отверстия (ROSTL), скуловая ширина (ZYGW), ширина мозговой коробки (BRCW), расстояние между заглазничными отростками (SORW), ширина рострума на уровне клыков (ROW), мастоидная ширина (MASTW), расстояние между слуховыми барабанами (BULLW), расстояние между мыщелками (CONDW), длина слухового барабана (BULL), высота мозговой коробки в основании саггитального гребня (без слухового барабана) (BRCH), высота черепа в области глазниц (FAH), высота скуловой дуги (ZYGH), высота рострума на уровне второго предкоренного зуба (ROH), заглазничная ширина (PORW). Черепа измеряли электронным штангенциркулем Sylvac. Измеряли только черепа взрослых животных. Возраст определяли, основываясь на степени стертости зубов и облитерации швов (Цалкин, 1944; Загребельный, 2000). Пол животных принимали по этикеточным данным.
В работе использовали следующие выборки. Песцы (V. lagopus): материковая часть Евразии – 118 экз. (60 самцов, 58 самок), о. Медный – 40 экз. (20 самцов, 20 самок); о. Беринга – 40 экз. (20 самцов, 20 самок). Материковая выборка песца включает экземпляры с Чукотки (39 экз.), Архангельской обл. (39 экз.) и окрестностей о. Диксона (40). Эти локалитеты были объединены в один, т.к. ранее было показано, что между ними нет достоверных краниологических различий (Нанова, 2009) и все материковые песцы представляют собой единую популяцию (Dalen et al., 2005).
Серая лисица (U. cinereoargenteus): 13 экз. (7 самцов, 5 самок, 1 пол неизвестен), собранные в штатах США Калифорния (11 экз.) и Орегон (2 экз.). Серые лисицы из этих локалитетов описаны как единый подвид U. c. townsendi Merriam, 1899 и являются ближайшими родственниками островных лисиц (Wayne et al., 1991).
Островная лисица (U. littoralis): о-в Санта-Каталина, подвид U. l. catalinae – 3 экз. (2 самца, 1 самка); о-в Сан-Клемент, подвид U. l. clementae – 4 экз. (4 самки); о-в Сан-Николас, подвид U. l. dickeyi – 8 экз. (2 самца, 6 самок). Островных лисиц с каждого острова рассматривали как самостоятельную выборку.
Ранее с помощью краниометрических исследований было показано, что половые различия черепа у песцов (Нанова, 2009, 2010), серой лисицы и островной лисицы (Collins, 1982) сводятся к размерным (самцы немного больше самок), при этом вариабельность самцов и самок одинакова. В задачи данной работы не входил анализ половых различий, поэтому при анализе данных мы по возможности объединяли самцов и самок.
Американский корсак (V. velox): 7 экз. (6 самцов, 1 самка), собранных в штате Колорадо, США (3 экз.), Монтана, США (2 экз.), Южная Дакота (1 экз.), провинции Альберта, Канада (1 экз.). Внутри вида V. velox существует клинальная размерная изменчивость с севера на юг, и некоторые исследователи предлагают выделять два подвида (V. v. velox Say 1823 и V. v. hebes Merriam 1902; Stromberg, Boyce, 1986), хотя четкой границы между ними нет. В более поздней работе на основе краниологических и генетических данных обосновывается объединение этих форм в одну V. v. velox (Dragoo et al., 1990). Все экземпляры мы объединили в единую выборку.
Американская лисица (V. macrotis): 13 экз. (6 самцов, 7 самок), собранных в штатах США – Юта (4 экз.), Невада (2 экз.), Калифорния (3 экз.), Баия Калифорния (4 экз.). Для V. macrotis предлагают выделять два подвида – более крупный V. m. mutica Merriam 1902, населяющий север Калифорнии, и V. m. macrotis Merriam 1888, населяющий остальной ареал (Waithman, Roest, 1977). Предполагается, что различия между ними обусловлены локальными особенностями климата. Эти две формы Dragoo et al. (1990) предложили объединить в одну на основе краниологических и генетических данных. Черепа V. macrotis из разных локалитетов мы объединили в одну выборку.
Значимые половые различия черепа у V. velox и V. macrotis отсутствуют (Rohwer, Kilgore, 1973; Waithman, Roest, 1977; Stromberg, Boyce, 1986), поэтому самцы и самки исследовались в совокупности.
Исследованные черепа хранятся в коллекциях Зоологического музея МГУ, Москва; Зоологического института РАН, Санкт-Петербург, и Смитсоновского музея Естественной Истории, Вашингтон.
В качестве переменной, характеризующей размер животного, мы выбрали кондилобазальную длину черепа CBL, т.к. она хорошо коррелирует с линейными размерами тела. Выборки сравнили между собой по значению CBL с мощью t-теста Стьюдента. Далее промеры логарифмировали для линеаризации аллометрического эффекта (Huxley, 1932; Pimentel, 1979; Reyment, 1991; Klingenberg, 1996) и сопоставимости изменчивости разных выборок (Wayne et al., 1986).
Для выявления структуры изменчивости проводили анализ главных компонент на логарифмированных данных. Анализ проводили на следующих выборках: 1) только для песцов; 2) для всех исследуемых представителей рода Vulpes – песцов, американского корсака, американской лисицы; 3) для представителей рода Urocyon (серая лисица и островная лисица).
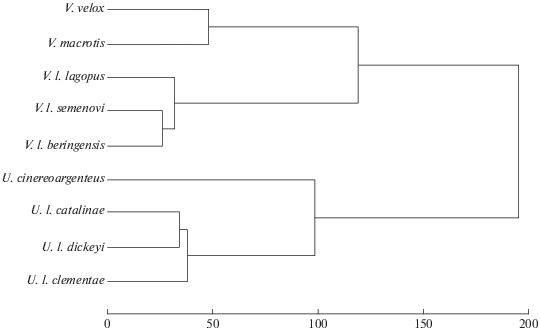
Для оценки морфологических дистанций рассчитывали квадратичные дистанции Махаланобиса. Для визуализации дистанций между центроидами выборок использовали кластерный анализ, метод UPGMA, на матрице квадратичных дистанций Махаланобиса.
Для избавления от размерной и связанной с ней аллометрической изменчивости использовали регрессионный анализ (Klingenberg, 2016). Проводили линейную регрессию каждого признака на кондилобазальную длину черепа CBL отдельно для рода Vulpes и отдельно для рода Urocyon.
Далее регрессионные остатки как переменные формы, свободные от размера и связанной с ним аллометрии, анализировали также как и исходные данные. Проводили анализ главных компонент: 1) только для песцов; 2) для всех исследуемых представителей рода Vulpes – песцов, американского корсака, американской лисицы; 3) для представителей рода Urocyon (серая лисица и островная лисица). Рассчитывали квадратичные дистанции Махаланобиса между отдельными видами и островными популяциями. Для визуализации дистанций между центроидами выборок использовали кластерный анализ, метод UPGMA.
Все расчеты были проведены в программе Statistica 12.
РЕЗУЛЬТАТЫ
Сравнение длин черепа
Средние значения кондилобазальной длины черепа CBL для каждого вида и популяции приведены в табл. 1. Материковые песцы и серые лисицы не различаются по CBL (t = 1.33, p = 0.19). CBL командорских песцов достоверно (t = от –5.9 до –8.14, p < 0.01) больше CBL материковых песцов на 4–5%. CBL островных лисиц достоверно (t = 10.42–17.41, p < 0.01) меньше CBL серых лисиц на 14–23%. CBL американского корсака и американской лисицы достоверно меньше CBL материкового песца (t = 5.87, p < 0.01 и t = 10.90, p < 0.01 соответственно) на 8–11%. Американский корсак и американская лисица не различаются по значению CBL (t = 1.89, p = 0.07)
Таблица 1.
Значения кондилобазальной длины черепа CBL для исследуемых видов и популяций
| Вид/подвид | Пол | N | Mean | Min | Max | Std. Dev. |
|---|---|---|---|---|---|---|
| V. l. lagopus | m | 60 | 124.62 | 118.00 | 130.00 | 2.77 |
| V. l. lagopus | f | 58 | 118.59 | 110.00 | 129.00 | 3.35 |
| V. l. semenovi | m | 20 | 129.65 | 122.00 | 137.00 | 4.55 |
| V. l. semenovi | f | 20 | 123.40 | 117.58 | 129.73 | 2.87 |
| V. l. beringensis | m | 20 | 132.20 | 127.00 | 138.00 | 2.84 |
| V. l. beringensis | f | 20 | 124.85 | 114.00 | 132.00 | 4.22 |
| U. cinereoargenteus | m | 7 | 120.07 | 118.75 | 121.28 | 0.88 |
| U. cinereoargenteus | f | 5 | 119.65 | 115.45 | 126.84 | 5.03 |
| U. cinereoargenteus | – | 1 | 121.16 | 121.16 | 121.16 | – |
| U. l. catalinae | m | 2 | 102.56 | 101.63 | 103.48 | 1.31 |
| U. l. catalinae | f | 1 | 102.98 | 102.98 | 102.98 | – |
| U. l. clementae | f | 4 | 92.55 | 89.02 | 95.92 | 2.82 |
| U. l. dickeyi | m | 2 | 99.99 | 99.11 | 100.86 | 1.24 |
| U. l. dickeyi | f | 6 | 94.43 | 86.32 | 98.76 | 4.54 |
| V. velox | m | 6 | 111.92 | 108.73 | 117.64 | 3.35 |
| V. velox | f | 1 | 114.16 | 114.16 | 114.16 | – |
| V. macrotis | m | 6 | 111.66 | 107.05 | 118.28 | 4.12 |
| V. macrotis | f | 7 | 105.46 | 97.52 | 108.13 | 3.73 |
Многомерный анализ логарифмированных данных (размерная изменчивость включена в анализ)
Анализ главных компонент
Песец V. lagopus (V. l. lagopus, V. l. semenovi, V. l. beringensis)
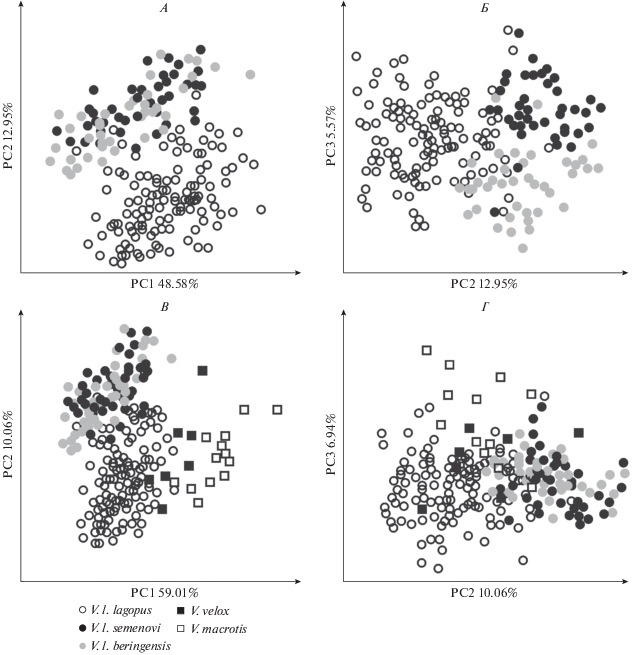
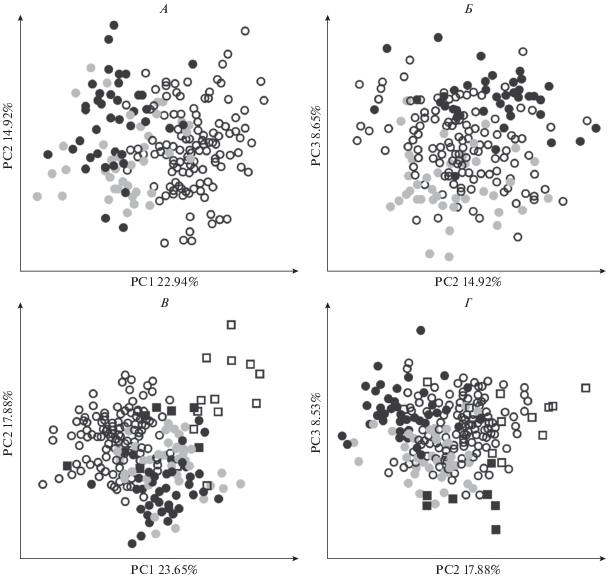
90% общей изменчивости приходится на первые 11 осей главных компонент из 21-й оси. На первую главную компоненту (PC1) приходится 48.58% общей изменчивости, на вторую главную компоненту (PC2) – 12.95%, на третью главную компоненту (PC3) – 5.57%. Различия между материковым и островными подвидами приходятся на PC1, PC2 и PC3 (рис. 2А, 2Б). Песцы о-в Медный отличаются от материковых песцов и песцов о-в Беринга по оси PC3.
Рис. 2.
Распределение экземпляров в пространстве первых трех главных компонент (PC1–PC3) логарифмированных признаков у видов рода Vulpes: А – песец V. lagopus, PC1–PC2; Б – песец V. lagopus, PC2–PC3; В – род Vulpes (виды V. lagopus, V. velox, V. macrotis), PC1–PC2; Г – род Vulpes, PC2–PC3.
Род Vulpes (V. lagopus, V. velox, V. macrotis)
90% общей изменчивости приходится на 8 первых осей главных компонент из 21-й оси. На PC1 приходится 59.01% изменчивости, PC2 – 10.06%, PC3 – 6.94%. Различия между подвидами и видами приходятся на PC1 и на PC2 (рис. 2В, 2Г). Американский корсак и американская лисица отличаются от материкового песца по оси PC1, а также несколько обособлены друг от друга по PC1. Американская лисица обособлена от материкового песца также по PC3. Американский корсак и американская лисица обособлены от командорских песцов по всем трем первым осям главных компонент (PC1–PC3).
Род Urocyon (U. cinereoargenteus, U. littoralis)
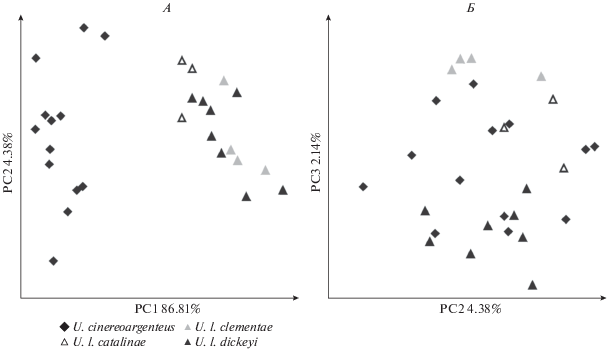
90% изменчивости приходится на первые две оси главных компонент из 21-й оси. На PC1 приходится 86.81% изменчивости, на PC2 – 4.38%, PC3 – 2.14%. Серая лисица и популяции островной лисицы различаются по PC1 и полностью перекрываются по осям PC2 и PC3 (рис. 3).
Рис. 3.
Распределение экземпляров в пространстве первых трех главных компонент (PC1–PC3) логарифмированных признаков у видов рода Urocyon (U. cinereoargenteus, U. littoralis): А – PC1–PC2, Б – PC2–PC3.
Анализ межгрупповых дистанций
Матрица квадратичных дистанций Махаланобиса приведена в табл. 2. Дерево, построенное на основе этой матрицы, изображено на рис. 4. Роды Vulpes и Urocyon обособлены друг от друга. Квадратичные дистанции Махаланобиса между материковыми видами этих двух родов составляют 198.81–214.91. Каждый вид внутри рода также хорошо обособлен друг от друга. В роде Vulpes американский корсак и американская лисица ближе друг к другу (дистанция 47.83), чем каждый из этих видов к материковому песцу (73.03 и 96.96 соответственно). Квадратичные дистанции Махаланобиса между серой лисицей и тремя островными популяциями островной лисицы соответствует 75.20–128.45. Дистанции между тремя островными популяциями островной лисицы составляют 34.15–39.63. Квадратичные дистанции Махаланобиса между материковым песцов и командорскими песцами соответствуют 28.62– 35.01. Дистанция между островными песцами – о-в Медный и о-в Беринга – меньше и равна 25.97.
Таблица 2.
Матрица дистанций между исследуемыми выборками на логарифмированных данных. Ниже диагонали – квадратичные дистанции Махаланобиса, выше диагонали – F-значения. Все дистанции между выборками достоверны на уровне значимости p < 0.01
| Вид/подвид | V. l. lagopus | V. l. semenovi | V. l. beringensis | V. velox | V. macrotis | U. cinereoargenteus | U. l. catalinae | U. l. clementae | U. l. dickeyi |
|---|---|---|---|---|---|---|---|---|---|
| V. l. lagopus | 45.60 | 37.28 | 21.04 | 49.50 | 110.38 | 27.04 | 30.34 | 66.37 | |
| V. l. semenovi | 35.01 | 22.65 | 31.91 | 69.01 | 86.44 | 26.32 | 32.45 | 58.55 | |
| V. l. beringensis | 28.62 | 25.97 | 27.64 | 66.16 | 85.54 | 25.37 | 28.61 | 54.49 | |
| V. velox | 73.03 | 122.84 | 106.41 | 9.49 | 42.63 | 18.35 | 15.34 | 33.45 | |
| V. macrotis | 96.96 | 161.32 | 154.66 | 47.83 | 56.34 | 19.63 | 20.30 | 42.58 | |
| U. cinereoargenteus | 216.20 | 202.07 | 199.97 | 214.91 | 198.81 | 7.99 | 17.13 | 19.77 | |
| U. l. catalinae | 212.01 | 216.28 | 208.51 | 200.36 | 184.72 | 75.20 | 2.96 | 3.25 | |
| U. l. clementae | 179.85 | 204.65 | 180.46 | 138.19 | 152.19 | 128.45 | 39.63 | 4.13 | |
| U. l. dickeyi | 203.19 | 201.43 | 187.46 | 205.49 | 197.22 | 91.55 | 34.15 | 35.52 |
Регрессионный анализ
Значение коэффициентов корреляции R между всеми признаками и CBL и их достоверность, полученные в результате проведения линейной регрессии для родов Vulpes и Urocyon отдельно, приведены в табл. 3. Для всех признаков коэффициент корреляции с CBL выше в роде Urocyon по сравнению с родом Vulpes.
Таблица 3.
Коэффициенты корреляции (R) между CBL и другими промерами черепа для рода Vulpes (число экземпляров N = 218) и Urocyon (N = 28)
| Промеры | Vulpes | Urocyon | ||
|---|---|---|---|---|
| R | p | R | p | |
| FL | 0.87 | 0.000 | 0.98 | 0.000 |
| BL | 0.82 | 0.000 | 0.98 | 0.000 |
| TOOL | 0.81 | 0.000 | 0.90 | 0.000 |
| PRML | 0.58 | 0.000 | 0.90 | 0.000 |
| MOLL | 0.80 | 0.000 | 0.91 | 0.000 |
| NASL | 0.70 | 0.000 | 0.97 | 0.000 |
| ROSTL | 0.88 | 0.000 | 0.98 | 0.000 |
| ZYGW | 0.69 | 0.000 | 0.98 | 0.000 |
| BRCW | 0.23 | 0.001 | 0.95 | 0.000 |
| SORW | 0.63 | 0.000 | 0.93 | 0.000 |
| ROW | 0.83 | 0.000 | 0.90 | 0.000 |
| MASTW | 0.87 | 0.000 | 0.98 | 0.000 |
| BULLW | 0.82 | 0.000 | 0.98 | 0.000 |
| CONDW | 0.87 | 0.000 | 0.92 | 0.000 |
| BULL | 0.19 | 0.005 | 0.94 | 0.000 |
| BRCH | 0.08 | 0.260 | 0.91 | 0.000 |
| FAH | 0.81 | 0.000 | 0.91 | 0.000 |
| ZYGH | 0.79 | 0.000 | 0.85 | 0.000 |
| ROH | 0.85 | 0.000 | 0.92 | 0.000 |
| PORW | 0.22 | 0.001 | 0.47 | 0.011 |
Многомерный анализ регрессионных остатков (размерная изменчивость и простая аллометрия исключены из анализа)
Песец V. lagopus (V. l. lagopus, V. l. semenovi, V. l. beringensis)
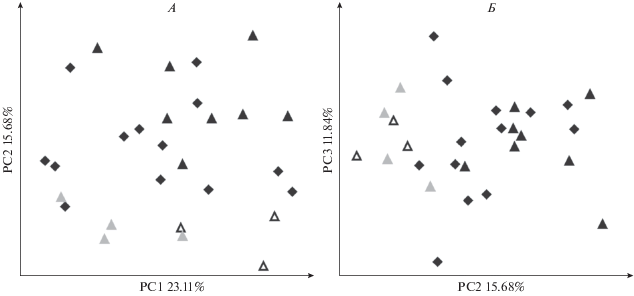
90% изменчивости приходится на первые 14 осей главных компонент из 20. На PC1 – 22.94% изменчивости, PC2 – 14.92%, PC3 – 8.65%. Корректировка размерной и связанной с ней аллометрической изменчивости уменьшает на 25.64% долю изменчивости, приходящуюся на PC1. После корректировки размерной изменчивости различия между материковым и командорскими подвидами песца сохраняются и приходятся на оси PC1, PC2 и PC3 (рис. 5А, 5Б). О-в Медный в этом случае лучше дифференцирован по осям PC1– PC3 от материкового песца, чем о-в Беринга.
Рис. 5.
Распределение экземпляров в пространстве первых трех главных компонент (PC1–PC3) регрессионных остатков для представителей рода Vulpes: А – песец (V. lagopus), оси PC1–PC2; Б – песец (V. lagopus), оси PC2–PC3; В – род Vulpes (виды V. lagopus, V. velox, V. macrotis), оси PC1–PC2; Г – род Vulpes (виды V. lagopus, V. velox, V. macrotis), оси PC2–PC3. Обозначения выборок такие же как на рис. 2.
Род Vulpes (V. lagopus, V. velox, V. macrotis)
90% изменчивости приходится на 13 первых осей главных компонент из 20. На PC1 – 23.65%, PC2 – 17.88%, PC3 – 8.53%. Таким образом, корректировка размерной и связанной с ней аллометрической изменчивости уменьшает на 35.36% долю изменчивости, приходящуюся на PC1. Американский корсак в значительной степени перекрывается с песцами о. Беринга по осям PC1 и PC2 и отличается от песцов по PC3 (рис. 5В, 5Г). Американская лисица заметно отделена и от всех песцов, и от американского корсака по осям PC1–PC2.
Род Urocyon (U. cinereoargenteus, U. littoralis)
90% изменчивости приходится на первые 10 осей главных компонент. На PC1 – 23.11%, PC2 – 15.68%, PC3 – 11.84%. Корректировка размерной и связанной с ней аллометрической изменчивости уменьшает на 63% долю изменчивости, приходящуюся на PC1. Два вида – серая лисица и островная лисица, а также отдельные популяции островной лисицы полностью перекрываются в пространстве осей PC1, PC2 и PC3 (рис. 6).
Рис. 6.
Распределение экземпляров в пространстве первых трех главных компонент (PC1–PC3) регрессионных остатков для представителей рода Urocyon: А – оси PC1–PC2, Б – оси PC2–PC3. Обозначения выборок такие же как на рис. 3.
Анализ межгрупповых дистанций
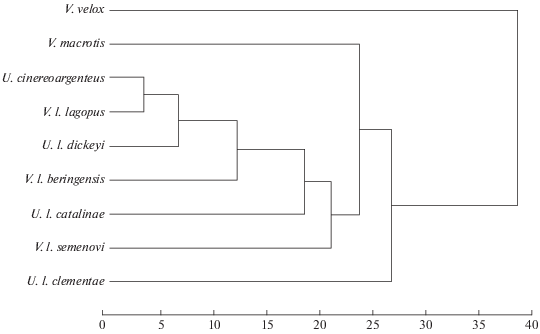
Матрица квадратичных дистанций Махаланобиса приведена в табл. 4. Дерево, построенное на основе этой матрицы, изображено на рис. 7. Роды Vulpes и Urocyon перестали быть обособлены друг от друга. Квадратичные дистанции Махаланобиса между материковыми видами этих двух родов составляют 3.23–30.96. Дистанции между всеми тремя материковыми видами рода Vulpes (V. lagopus, V. velox, V. macrotis) близки и составляют 29.95–43.91. Квадратичные дистанции Махаланобиса между серой лисицей и тремя островными популяциями островной лисицы соответствует 4.88–21.21. Дистанции между тремя островными популяциями островной лисицы составляют 29.10–29.99. Квадратичные дистанции Махаланобиса между материковым песцом и командорскими песцами соответствуют 16.15–22.11. Дистанция между островными песцами о-ва Медный и о-ва Беринга – равна 25.82.
Таблица 4.
Матрица дистанций между исследуемыми выборками на регрессионных остатках
| Вид/подвид | V. l. lagopus | V. l. semenovi | V. l. beringensis | V. velox | V. macrotis | U. cinereoargenteus | U. l. catalinae | U. l. clementae | U. l. dickeyi |
|---|---|---|---|---|---|---|---|---|---|
| V. l. lagopus | 23.75 | 22.19 | 13.35 | 16.13 | 1.74 | 2.63 | 2.40 | 2.87 | |
| V. l. semenovi | 22.11 | 23.75 | 11.55 | 10.32 | 5.57 | 3.59 | 4.98 | 4.43 | |
| V. l. beringensis | 16.15 | 25.82 | 7.32 | 7.79 | 3.76 | 3.61 | 3.23 | 3.65 | |
| V. velox | 43.91 | 42.15 | 26.73 | 8.38 | 6.48 | 5.04 | 3.17 | 7.59 | |
| V. macrotis | 29.95 | 22.88 | 17.27 | 40.02 | 5.38 | 3.65 | 4.73 | 4.70 | |
| U. cinereoargenteus | 3.23* | 12.35 | 8.33 | 30.96 | 17.99 | 2.38 | 1.60 | 1.11 | |
| U. l. catalinae | 19.57 | 27.95 | 28.16 | 52.22 | 32.53 | 21.21 | 2.22 | 2.92 | |
| U. l. clementae | 13.47 | 29.75 | 19.33 | 27.11 | 33.63 | 11.34* | 28.14 | 3.68 | |
| U. l. dickeyi | 8.32 | 14.44 | 11.91 | 44.22 | 20.66 | 4.88* | 29.10 | 29.99 |
Примечания. Ниже диагонали – квадратичные дистанции Махаланобиса, выше диагонали – F-значения. Дистанции между группами, различия между которыми недостоверны, отмечены *: U. cinereoargenteus – V. lagopus, p = 0.029; U. cinereoargenteus – U. l. clementae. p = 0.055; U. cinereoargenteus – U. l. dickeyi, p = 0.338. Остальные дистанции между выборками достоверны на уровне значимости p < 0.01.
ОБСУЖДЕНИЕ
Использованные методы анализа линейных промеров черепа
Животные изменчивы по размеру и форме тела. Это, в частности, относится к черепу и другим частям скелета. Изменчивость формы, связанная с размером, является аллометрической (Huxley, 1924, 1932; Huxley, Teissier, 1924; Klingenberg, 1996, 2016). Изменчивость формы, не связанная с размером, является не аллометрической изменчивостью. Как правило, размерная изменчивость берет на себя бо́льшую часть общей изменчивости при работе с линейными промерами. Для того чтобы исследовать изменчивость формы, недостаточно удалить изометрический размер из данных, т.к. изменчивость формы, определяемая аллометрической зависимостью от размера, остается в данных. Общепринятый способ работы с аллометрией на линейных промерах – это регрессионный анализ, позволяющий получать аллометрические зависимости для отдельных признаков (Claude, 2011; Zelditch et al., 2012; Klingenberg, 1996). Важно, что признаки при этом должны быть логарифмированы, чтобы перевести степенную аллометрическую зависимость в линейную (Huxley, 1932; Pimentel, 1979; Reyment, 1991; Klingenberg, 1996). Для коррекции размерной и аллометрической компоненты в данных используют регрессионные остатки (residuals), являющиеся переменными формы, свободными от влияния размера (Claude, 2011; Zelditch et al., 2012; Klingenberg, 1996).
В нашей работе был проведен анализ двух типов данных: 1) Логарифмированные данные. Этот анализ позволил оценить в основном размерную изменчивость, вклад которой в общую изменчивость наибольший; 2) Регрессионные остатки. Этот анализ позволил оценить изменчивость формы, не зависимой от размерной изменчивости. Без такого разделения оценить изменчивость формы невозможно, т.к. все линейные промеры в той или иной степени скоррелированы с размерной изменчивостью.
Некоторые исследователи для разделения изменчивости размера и формы предлагают использовать анализ главных компонент (Atchley et al., 1981; Jolicoeur, 1963). Действительно, первая главная компонента берет на себя значительную долю размерной изменчивости (PC1), а изменчивость формы распределяется по остальным главным компонентам. Это хорошо видно и при анализе наших данных. Тем не менее важно помнить, что это разделение не полное. На PC1 также приходится некоторая часть изменчивости формы, а на остальные главные компоненты – часть размерной изменчивости (Somers, 1989; Claude et al., 1996).
Анализ главных компонент – стандартный метод для анализа структурированности изменчивости (Marcus, 1990; Zelditch et al., 2012). Анализ числа осей, берущих на себя основную долю изменчивости, анализ долей изменчивости, распределенных на первых главных компонентах (PC1–PC3, несущих основную нагрузку по изменчивости), позволил сравнить амплитуду и структуру различий в группах материковые песцы – командорские песцы, серые лисицы – островные лисицы, песцы – американский корсак – американская лисица. Сопоставление результатов анализа главных компонент на логарифмированных данных и регрессионных остатках позволило оценить роль размерной изменчивости в этих группах.
Краниологическая изменчивость песцов (V. l. lagopus, V. l. semenovi, V. l. beringensis)
Командорские песцы несколько крупнее материковых песцов (Огнев, 1931; Цалкин, 1944). Если судить по длине черепа, то разница составляет 4–5%. Песцы Командорских о-вов отличаются от материковых песцов формой черепа, и эти различия не определяются аллометрической изменчивостью (Нанова, 2008, 2009; Martin-Serra et al., 2019). Песцы о-ва Медный и о-ва Беринга различаются между собой по форме черепа (но не по размеру), но эти различия слабее, чем различия обеих этих островных популяций и материковых песцов (Загребельный, Пузаченко, 2006; Пузаченко, Загребельный, 2008; Nanova, Prôa, 2017; Nanova et al., 2017; Martin-Serra et al., 2019). Песец о-ва Медный наиболее сильно отличается по пропорциям черепа от материковых песцов. Как было показано ранее, эти особенности пропорций черепа песца о-ва Медный формируются как особенности индивидуальных возрастных траекторий (Нанова, 2010). После коррекции размерной изменчивости различия между командорскими и материковыми песцами сохраняются, что показывают результаты анализа главных компонент и анализ дистанций Махаланобиса.
Изменчивость в роде Urocyon (U. cinereoargenteus, U. littoralis)
Морфологические различия черепа серой и островной лисиц изучены на логарифмированных признаках в работе Wayne et al. (1991), т.е. исследовалась вся изменчивость в совокупности без выделения размерной изменчивости и изменчивости формы. Авторами было показано, что серые и островные лисицы хорошо различаются морфологически, в частности серые лисицы значительно крупнее островных лисиц.
Для оценки того, насколько устойчив результат по оценке краниометрической изменчивости в роде Urocyon, мы сравнили дистанции между группами, полученные в настоящей работе, и дистанции между группами, полученные Wayne et al. (1991). В исследовании Wayne et al. (1991) использовались дистанции Махаланобиса, а в нашей работе рассчитывались квадратичные дистанции Махаланобиса. Для сопоставления результатов был извлечен корень из квадратичных дистанций Махаланобиса, полученных в данной работе для тех популяций Urocyon, что были нам доступны. Сравнение дистанций для соответствующих групп приведено в табл. 5. Как видно, дистанции, полученные в данной работе и Wayne et al. (1991), очень близки. Т.е. результат оказался устойчив даже при условии, что размер наших выборок (N = 3–13 экз.) меньше, чем размер выборок Wayne et al. 1991 (N = 16–76). Кроме того, мы использовали несколько отличающийся набор признаков. Такая схожесть результатов свидетельствует о том, что размерные различия – основной фактор изменчивости, который выявляется при анализе логарифмированных признаков.
Таблица 5.
Сопоставление дистанций Махаланобиса между выборками, полученными Wayne et al. 1991 (первое значение) и в данной работе (значение после косой черты)
| Вид/подвид | U. cinereoargenteus | U. l. catalinae | U. l. clementae |
|---|---|---|---|
| U. l. catalinae | 9.58/8.67 | ||
| U. l. clementae | 12.41/11.33 | 6.38/6.30 | |
| U. l. dickeyi | 11.8/9.57 | 5.26/5.84 | 5.26/5.96 |
Как видно из предыдущих работ (Wayne et al., 1991; Collins, 1983) и наших результатов, островные лисицы значительно мельче материковых серых лисиц. Если оценивать эти различия по длине черепа, то они составляют 14–23%.
Анализ изменчивости формы черепа в роде Urocyon ранее не проводился. Наши результаты показали, что корректировка размерной изменчивости убирает значительную долю изменчивости из данных по Urocyon. Во-первых, при изъятии размера из данных изменчивость становится значительно менее структурированной. Так, со включенным размером 90% общей изменчивости приходится на первые две главные компоненты, а при изъятии размера 90% изменчивости распределяется уже на десяти первых осях. Во-вторых, при корректировке размера доля изменчивости, приходящаяся на PC1, а именно эта ось берет на себя основные размерные различия, уменьшается на 63.7% (с 86.81 до 23.11%). Для сравнения, у песцов доля изменчивости, приходящаяся на PC1, при корректировке размера снижается на 25.64% (с 48.58 до 22.94%). В-третьих, при корректировке данных на размер серая лисица и островная лисица полностью перекрываются между собой в пространстве первых трех главных компонент (PC1–PC3). Островные лисицы также полностью перекрываются между собой. Это подтверждается и анализом дистанций, которые становятся минимальны и не достоверны.
Полученные результаты анализа изменчивости в роде Urocyon показывают, что основные различия межу серыми лисицами и островными лисицами обусловлены размерной и связанной с ней аллометрической изменчивостью. Различия по форме черепа между серыми и островными лисицами отсутствуют.
Сравнение изменчивости островных популяций у песцов и в роде Urocyon
Наши данные показали, что размерные различия между островными и серыми лисицами выражены значительно сильнее, чем между командорскими и материковыми песцами. Так, командорские песцы на 4–5% крупнее материковых песцов. Островные лисицы на 14–23% мельче серых лисиц. Согласно нашим данным, различия в форме черепа выражены значительно сильнее между командорскими песцами и материковыми песцами, чем между островными лисицами и серыми лисицами. Фактически, различий по форме черепа между островными и серыми лисицами мы не обнаружили. Тогда так различия в форме черепа хорошо выражены между командорскими песцами и материковыми песцами. Особенно заметно по форме черепа отличается песец о-в Медный.
Изменения размеров животных на островах – распространенное явление (Foster, 1964). Для млекопитающих отмечена общая закономерность, названная островным правилом (“island rule”; Lomolino, 1985), уменьшения размеров тела на островах для крупных животных и увеличения размеров на островах для мелких животных. Уменьшение или увеличение размеров тела на островах может происходить достаточно быстро по сравнению с темпами эволюции на материке (Millien, 2006). Изменение размеров тела в условиях островной изоляции и островное правило обусловлено многими экологическими факторами (Lomolino, 1985; Adler, Levins, 1994; Meiri et al., 2004), основной из которых – обедненная среда обитания на островах. Как правило, острова характеризуются ограниченностью кормовых ресурсов, сниженным прессом хищников и уровнем межвидовой конкуренции. Следует иметь ввиду, что каждый частный случай имеет свои особенности, которые могут изменить направление изменчивости на противоположное.
Песец и серая лисица относятся к животным среднего размерного класса, между собой по размеру они очень близки. Заселив острова, предки островных лисиц значительно уменьшились в размерах (Collins, 1983). Во многом это может объясняться ограниченностью кормовых ресурсов этих лисиц на островах. Так, фауна позвоночных животных островов Чаннел обеднена (Wenner, Johnson, 1980). Значительную часть рациона островных лисиц составляют насекомые и фрукты (Laughrin, 1977; Moore, Collins, 1995). Для серых лисиц, напротив, млекопитающие являются основным кормовым ресурсом (Fritzell, Haroldson, 1982). Размер тела и скоррелированный с ним размер черепа – важный отличительный признак между островными и серыми лисицами. Однако по форме черепа эти два вида не различаются.
Командорские песцы, напротив, увеличились в размере по сравнению с материковыми песцами (Огнев, 1931; Цалкин, 1944; Vibe, 1967; Frafjord, 1993). При этом размерные различия у материковых и островных песцов выражены слабее по сравнению с различиями у серых и островных лисиц. С другой стороны, командорские песцы хорошо отличаются от материковых песцов по форме черепа (Нанова, 2008, 2009; Martin-Serra et al., 2019), не связанной с размером, что стало возможно выявить с помощью современных методов разделения размера и формы. В наших предыдущих работах было показано, что особенности формы черепа командорских песцов могли сформироваться как результат комплекса причин – эффекта основателя и отбора, сформировавшего адаптации к питанию крупной добычей (Nanova et al., 2017; Nanova, Prôa, 2017). Грызуны – основной корм песцов в материковой тундре – отсутствовали на Командорских о-вах до открытия их человеком, а на о-в Медный отсутствуют до сих пор. Основным кормовым ресурсом в период размножения для командорских песцов служат колонии морских птиц (Загребельный, 2000; Нанова, 2006; Гольцман и др., 2010), в основном глупыша, а в зимнее время – выбросы моря, в основном, трупы морских млекопитающих. Череп командорских песцов (особенно песца о-в Медный) более устойчив к нагрузкам, позволяет развивать бо́льшую силу укуса и эффективнее удерживать и разделывать добычу (Nanova et al., 2017). Прохождение командорских песцов через бутылочные горлышки численности, характерные для островных популяций, могли эффективно фиксировать результаты отбора, тем самым ускоряя темпы эволюции на островах (Prôa, Nanova, 2020). Увеличение размеров командорских песцов также может быть связано с питанием более крупной добычей.
Изменчивость близких видов в роде Vulpes
Мы сравнили степень краниологических различий между командорскими и материковыми песцами, с одной стороны, и между тремя близкими видами – песцом (материковым), американским корсаком и американской лисицей, с другой стороны. Наши результаты показали, что краниологические различия между командорскими и материковыми песцами сопоставимы по степени своей выраженности с межвидовыми различиями песца, американского корсака и американской лисицы.
Американский корсак и американская лисица меньше материкового песца (различия на 8–11%), при этом между собой не различаются по размеру черепа. Командорские песцы крупнее материкового песца (различия на 4–5%). Анализ изменчивости формы показал, что американский корсак и американская лисица хорошо различаются между собой именно по форме черепа. Песцы также близки по форме черепа к этим двум видам как американский корсак и американская лисица между собой. Различия по форме черепа между песцами командорских островов и материковым песцом сопоставимы с различиями по форме черепа между песцом, американским корсаком и американской лисицей.
Песец, американский корсак и американская лисица – близкие виды, их возраст составляет 200–500 тысяч лет. В настоящее время ареал песца циркумполярен и не соприкасается с ареалами двух других рассматриваемых видов. Несмотря на то, что песец приобрел ряд выраженных морфологических адаптаций к условиям Арктики (благодаря которым его ранее даже выделяли в отдельный род Alopex), по краниологическим признакам он очень близок к своим сестринским видам – американскому корсаку и американской лисице. Ареалы американского корсака и американской лисицы разделены географическим барьером, но в некоторых местах соприкасаются. Существует несколько точек зрения на их таксономию – одни исследователи предлагали рассматривать их как подвиды или полувиды одного надвидового комплекса (Packard, Bowers, 1970; Rohwer, Kilgore, 1973; Dragoo et al., 1990), другие же – как самостоятельные виды (Geffen et al., 1992; Mercure et al., 1993; Bardeleben et al., 2005). В настоящий момент принята точка зрения о видовом статусе американского корсака и американской лисицы (Wozencraft, 2005; Sillero-Zubiri, 2009).
Командорские песцы изолированы от материка, видимо, с момента последнего оледенения, т.е. около 10 тысяч лет. При этом морфологические отличия черепа островных песцов соответствуют изменениям между материковыми видами возрастом 200–500 тысяч лет. Данный факт подтверждает точку зрения, что эволюция на островах происходит ускоренными темпами (Millien, 2006; Cardini et al., 2007).
Сравнительный анализ краниологической изменчивости нескольких видов лисиц и лисоподобных хищников показал, что:
1) Уровень различий между командорскими песцами и материковым песцом сходен с уровнем различий между островным и материковым видами рода Urocyon. Различия в этих группах носят разный характер. В роде Urocyon хорошо выражены размерные различия и отсутствуют различия в форме черепа, не связанной с размерами. У командорских и материковых песцов присутствуют размерные различия, хотя они не столь резки, как в роде Urocyon. Командорские песцы отличаются от материковых по форме черепа. Особенно эти отличия выражены у песца о-ва Медный.
2) Уровень краниологических различий между командорскими и материковыми песцами сопоставим с уровнем краниологических различий в группе хорошо различимых видов – песец, американский корсак, американская лисица, возраст которых составляет 200–500 тысяч лет.
Уровень морфологических различий между командорскими песцами и материковым песцом соответствует видовому. Этот факт свидетельствует в пользу правомерности выделения Огневым (1931) командорских песцов в отдельный вид Vulpes beringensis Merriam 1902 с двумя подвидами V. b. semenovi Ognev 1931 (о-в Медный) и V. b. beringensis Merriam 1902 (о-в Беринга).
Однако для окончательного подтверждения данного факта нужен сравнительный генетический анализ. В настоящий момент, несмотря на то, что филогенетика семейства Canidae – крайне популярная область исследований, данные, позволяющие напрямую сопоставить уровень генетических различий между командорскими и материковыми песцами и другими близким видами, отсутствуют. Исследования разных видов проводили на разных участках генома и разными методами (Dragoo et al., 1990; Geffen et al., 1992; Mercure et al., 1993; Bardeleben et al., 2005; Wayne et al., 1991; Geffen et al., 2007). В работе Geffen et al. (2007) по циркумполярной изменчивости песцов показано с использованием контрольного региона mtDNA и 11 микросаттелитных локусов, что командорские песцы значительно дистанцированы от всех остальных песцов, включая другие островные популяции. При этом генетически между собой песцы о-в Медный и о-в Беринга ближе, чем с остальными песцами. Для оценки того, насколько сильно морфологически командорские песцы дифференцированы от материковых по сравнению с другими изолированными популяциями, необходим комплексный анализ морфологической изменчивости островных песцов на всем циркумполярном ареале.
Список литературы
Гептнер В.Г., Наумов Н.П., 1967. Млекопитающие СССР. Т. 2. Ч. 1. М.: Высшая школа. 1003 с.
Гольцман М.Е., Нанова О.Г., Сергеев С.Н., Шиенок А.Н., 2010. Использование кормовых ресурсов репродуктивными семьями песцов (Alopex lagopus semenovi Ognev 1931, Mammalia: Canidae) на о-ве Медный (Командорские о-ва) // Зоологический журнал. Т. 89. № 10. С. 1246–1263.
Загребельный С.В., 2000. Командорские подвиды песца (Alopex lagopus beringensis Merriam, 1902 и Alopex lagopus semenovi Ognev, 1931): особенности островных популяций. Дис. … канд. биол. наук. МГУ им. Ломоносова. 166 с.
Загребельный С.В., Пузаченко А.Ю., 2006. Изменчивость черепа песцов беринговского Alopex lagopus beringensis, медновского A. l. semenovi и материкового A. l. lagopus подвидов (Carnivora, Canidae) // Зоологический журнал. Т. 85. № 8. С. 1007–1023.
Нанова О.Г., 2006. Использование песцом (Alopex lagopus semenovi Ognev, 1931) кормовых ресурсов на о-ве Медный (Командорские о-ва). Дипломная работа. Москва, МГУ имени М.В. Ломоносова. 68 с.
Нанова О.Г., 2008. Анализ изменчивости щечных зубов трех видов псовых (Mammalia: Canidae) методами стандартной и геометрической морфометрии // Сборник трудов Зоологического музея МГУ. Т. 49. С. 413–427.
Нанова О.Г., 2009. Структура морфологического разнообразия признаков черепа и зубов трех видов хищных млекопитающих (Mammalia: Carnivora). Дис. … канд. биол. наук. МГУ им. Ломоносова. 222 с.
Нанова О.Г., 2010. Возрастная изменчивость морфометрических признаков черепа материкового песца (Alopex lagopus lagopus) и песца командорских островов (A. l. beringensis, A. l. semenovi; Mammalia // Зоологический журнал. Т. 89. № 7. С. 871–881.
Огнев С.И., 1931. Звери Восточной Европы и Северной Азии. Т. 2. М.-Л.: Главнаука. 776 с.
Пузаченко А.Ю., Загребельный С.В., 2008. Изменчивость черепа песцов (Alopex lagopus, Carnivora, Canidae) Евразии // Зоологический журнал. Т. 87. № 9. С. 1106–1123.
Рязанов Д.А., 2002. Песец (Alopex lagopus) Командорских островов // Зоологический журнал. Т. 81. № 7. С. 878–887.
Цалкин В.И., 1944. Географическая изменчивость в строении черепа песцов Евразии // Зоологический журнал. Т. 23. № 4. С. 156–169.
Adler G.H., Levins R., 1994. The island syndrome in rodent populations // The Quarterly Review of Biology. V. 69. P. 473–490.
Atchley W.R., Rutledge J.J., Cowley D.E., 1981. Genetic components of size and shape. 2. Multivariate covariance patterns in the rat and mouse skull // Evolution. V. 35. № 6. P. 1037–1055.
Audet A.M., Robbins B.C., Larivière S., 2002. Alopex lagopus // Mammalian Species. V. 713. P. 1–10.
Bardeleben C., Moore R.L., Wayne R.K., 2005. A molecular phylogeny of the Canidae based on six nuclear loci // Molecular Phylogenetics and Evolution. V. 37. P. 815–831.
Cardini A., Thorington R.W., Polly P.D., 2007. Evolutionary acceleration in the most endangered mammal of Canada: speciation and divergence in the Vancouver Island marmot (Rodentia, Sciuridae) // Journal of Evolutionary Biology. V. 20. P. 1833–1846.
Claude J., 2011. Morphometrics with R. NY: Springer. 316 p.
Claude J., Jolliffe I.T., Zuur A.F., Ieno E.N., Smith G.M., 1996. Multivariate analyses of morphometric turtle data – size and shape // Advances in Morphometrics. Marcus L.F., Corti M., Loy A., Naylor G.J.P., Slice D.E. (Eds) P. 529–546.
Collins P.W., 1982. Origin and differentiation of the island fox: A study on evolution in insular populations. Santa Barbara, California: University of California. Master’s Thesis. 303 p.
Collins P.W., 1983. The origin of island foxes. Santa Barbara Museum of Natural History Museum Bulletin. V. 59. P. 1–2.
Dalén L., Fuglei E., Hersteinsson P., Kapel C.M.O., Roth J.D., Samelius G., Tannerfeldt M., Angerbjörn A., 2005. Population history and genetic structure of a circumpolar species: the arctic fox // Biological Journal of the Linnean Society. V. 84. P. 79–89.
Daitch D.J., Guralnick R.P., 2007. Geographic variation in tooth morphology of the arctic fox, Vulpes (Alopex) lagopus // Journal of Mammalogy. V. 88. № 2. P. 384–393.
Dragoo J.W., Choate J.R., Yates T.L., O’Farrell T.P., 1990. Evolutionary and Taxonomic Relationships among North American Arid-Land Foxes // Journal of Mammalogy. V. 71. № 3. P. 318–332.
Egoscue H.J., 1979. Vulpes velox // Mammalian species. V. 122. P. 1–5.
Foster B.J.,1964. Evolution of mammals on islands // Nature. V. 202. P. 234–235.
Frafjord K., 1993. Circumpolar size variation in the skull of the arctic fox Alopex lagopus // Polar Biology. V. 13. P. 235–238.
Fritzell E.K., Haroldson K.J., 1982. Urocyon cinereoargenteus // Mammalian Species. V. 189. P. 1–8.
Geffen E., Mercure A., Girman D.J., Macdonald D.W., Wayne R.K., 1992. Phylogenetic relationships of the fox-like canids: mitochondrial DNA restriction fragment, site and cytochrome beta sequence analyses // Journal of Zoology. V. 228. P. 27–39.
Geffen E., Waidyaratne S., Dalén L., Angerbjörn A., Vila C., Hersteinsson P., Fuglei E., White P.A., Goltsman M.E., Kapel C.M., et al., 2007. Sea ice occurrence predicts genetic isolation in the Arctic fox // Molecular Ecology. V. 16. P. 4241–4255.
George S.B., Wayne R.K., 1991. Island foxes. A model for conservation genetics // Terra. V. 30. P. 18–23.
Gimranov D.O., in press. The structure of the upper teeth of the red fox (Vulpes vulpes) and arctic fox (V. lagopus) with an analysis of dental variability in insular forms // Russian Journal of Theriology.
Goltsman M.E., Kruchenkova E.P., Macdonald D.W., 1996. The Mednyi Arctic foxes: treating a population imperilled by disease // Oryx. V. 30. № 4. P. 251–258.
Goltsman M.E., Kruchenkova E.P., Sergeev S.N., Volodin I.A., Macdonald D.W., 2005. “Island syndrome” in a population of arctic fox (Alopex lagopus) from Mednyi Island // Journal of Zoology. V. 267. P. 405–418.
Huxley J.S., 1924. Constant differential growth-ratios and their significance // Nature. V. 114. P. 895–896.
Huxley J.S., 1932. Problems of relative growth. London: Methuen. 1st edition. 276 p.
Huxley J.S., Teissier G., 1924. Terminology of relative growth // Nature. V. 137. P. 780–781.
Jolicoeur P., 1963. The multivariate generalization of the allometry equation // Biometrics. № 19. P. 497–499.
Klingenberg C.P., 1996. Multivariate allometry // Advances in Morphometrics. Marcus L.F., Corti M., Loy A., Naylor G.J.P., Slice D.E. (Eds). NY-London: Plenum Press. P. 23–49.
Klingenberg C.P. 2016. Size, shape, and form: concepts of allometry in geometric morphometrics // Development Genes and Evolution. V. 226. P. 113–137.
Kurten B., Anderson E., 1980. Pleistocene mammals of North America. NY: Columbia University Press. 442 p.
Laughrin L.L., 1977. The island fox; a field study of its behavior and ecology. Ph.D. dissert. The University of California, Santa Barbara. 83 p.
Lomolino M.V., 1985. Body size of mammals on islands. The island rule reexamined // The American Naturalist. V. 125. P. 310–316.
Marcus L., 1990. Traditional morphometrics // Proceedings of the Michigan Morphometrics Workshop. Rohlf F.J., Bookstein F.L. (Eds). Michigan: The University of Michigan Museum of Zoology Ann Arbor. P. 77–123.
Martín-Serra A., Nanova O., Varón-González C., Ortega G., Figueirido B., 2019. Phenotypic integration and modularity drives skull shape divergence in the arctic fox (Vulpes lagopus) from the Commander Islands // Biology Letters. V. 15: 20190406. https://doi.org/10.1098/rsbl.2019.0406
McGrew J.C., 1979. Vulpes macrotis // Mammalian species. V. 123. P. 1–6.
Meiri S., Dayan T., Simberloff D., 2004. Body size of insular carnivores: little support for the island rule // The American Naturalis. V. 163. № 3. P. 469–479.
Mercure A., Ralls K., Koepfli K.P., Wayne R.K., 1993. Genetic subdivisions among small canids: mitochondrial DNA differentiation of swift, kit, and arctic foxes // Evolution. V. 47. № 5. P. 1313–1328.
Millien V., 2006. Morphological evolution is accelerated among island mammals // PLOS Biology. V. 4. № 11: e384. https://doi.org/10.1371/journal.pbio.0040384
Moore C.M., Collins P.W., 1995. Urocyon littoralis // Mammalian species. V. 489. P. 1–7.
Nanova O., Prôa M., 2017. Cranial features of mainland and Commander Islands arctic foxes Vulpes lagopus reflect their diverging foraging strategies // Polar Research. V. 36 (S1). E68-E72. http:// dx.doi.org/https://doi.org/10.1080/17518369.2017.1310976
Nanova O.G., Prôa M., Fitton L., Evteev A.A., O’Higgins P., 2017. Comparison of cranial performance between mainland and two island subspecies of the Arctic fox Vulpes lagopus (Carnivora: Canidae) during simulated biting // Biological Journal of the Linnean Society. V. 120. № 4. P. 923–935.
Packard R.L., Bowers J.H., 1970. Distributional notes on some foxes from western Texas and eastern New Mexico // Southwestern Naturalist. V. 14. P. 450–451.
Pimentel R.A., 1979. Morphometrics: The multivariate analysis of biological data. Dobuque: Kendall/Hunt Publishing Company. 276 p.
Prôa M., Nanova O., 2020. Severe population bottleneck in the 1970s caused cranial morphology to change in Mednyi Island subspecies of arctic fox // Mammalia. V. 84. № 2. P. 162–170.
Reyment R.A., 1991. Multidimensional palaeobiology. Oxford: Pergamon Press. 377 p.
Rohwer S.A., Kilgore D.L., Jr., 1973. Interbreeding in the aridland foxes, Vulpes velox and V. macrotis // Systematic Zoology. V. 22. P. 157–165.
Savage D.E., Russell D.E., 1983. Mammalian paleofaunas of the world. London: Addison-Wesley Publ. Co. 432 p.
Shienok A., Mamaev E., Mikhnevich J., Ploshnitsa A., 2017. Population dynamics of the Bering arctic fox (Vulpes lagopus beringensis) // 5th International conference in arctic fox Biology. Université du Québec à Rimouski, Québec, Canada. P. 56.
Sillero-Zubiri C., 2009. Family CANIDAE (Dogs) // Handbook of the Mammals of the World. V. 1: Carnivores. Wilson D.E., Mittermeier R.A. (Eds). Barcelona: Lynx Edicions. 352–447 p.
Somers K.M., 1989. Allometry, isometry and shape in principal components analysis // Systematic Zoology. 38. P. 169–173.
Stromberg M.R., Boyce M.S., 1986. Systematics and Conservation of the swift fox, Vulpes velox, in North America // Biological conservation. V. 35. P. 97–110.
Vibe C., 1967. Arctic animals in relation to climatic fluctuations. Meddelelser om Grønland. V. 170. № 5. Copenhagen: C. A. Reitzel. P. 103–117.
Waithman J., Roest A., 1977. A taxonomic study of the kit fox, Vulpes macrotis // Journal of Mammalogy. V. 58. № 2. P. 157–164.
Wayne R.K., George S.B., Gilbert D., Collins P.W., Kovach S.D., Girman D., Lehman N., 1991. A morphologic and genetic study of the island fox, Urocyon littoralis // Evolution. V. 45. № 8. P. 1849–1868.
Wayne R.K., GeVen E., Girman D.J., KoeppXi K.P., Lau L.M., Marshall C.R., 1997. Molecular systematics of the Canidae // Syst. Biol. V. 46. P. 622–653.
Wayne R.K., Modi W. S., O’Brien S. J., 1986. Morphological variability and asymmetry in the cheetah (Acinonyx jubatus), a genetically uniform species // Evolution. V. 40. P. 78–85.
Wenner A.M., Johnson D.L., 1980. Land vertebrates on the California Channel lslands: sweepstakes or bridges? // The California Islands: proceedings of a multidisciplinary symposium. Power D.M. (Ed.). Santa Barbara, California: Santa Barbara Museum of Natural History. P. 497–530.
Wozencraft W.C., 2005. Oder Carnivora // Mammal Species of the World. A Taxonomic and Geographic Reference (3rd ed). Wilson D.E., Reeder D.M. (Eds). Baltimore: Johns Hopkins University Press. P. 532–628.
Zelditch M.L., Swiderski D.L., Sheets H.D., 2012. Geometric Morphometrics for Biologists. A Primer. 2nd edition. Academic Press. 488 p.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал