Зоологический журнал, 2021, T. 100, № 7, стр. 809-822
Морфотипическая характеристика первого верхнего моляра (М1) бурого (Ursus arctos) и белого (Ursus maritimus) медведей (Carnivora, Ursidae)
Д. О. Гимранов *
Институт экологии растений и животных УрО РАН
620144 Екатеринбург, Россия
* E-mail: djulfa250@rambler.ru
Поступила в редакцию 23.04.2020
После доработки 09.08.2020
Принята к публикации 17.08.2020
Аннотация
Изучено строение первого верхнего моляра (М1) бурого (Ursus arctos) и белого (U. maritimus) медведей, выделено 7 признаков, обладающих полиморфизмом, приведены их описания. Строение М1 у материковых U. arctos достаточно однообразно, популяции U. arctos с о-ва Хоккайдо отличаются большим числом редких морфотипов и большей усложненностью. В целом М1 у бурого и белого медведей является мало изменчивым зубом, по сравнению с резцами и премолярами. В эволюционном отношении М1 у представителей рода Ursus изменяется достаточно слабо. Установлено, что бурого медведя можно достоверно дифференцировать от белого медведя на основе строения М1. Зубы белого медведя видоизменяются по своеобразному пути, не совпадающему с традиционным сценарием изменения зубов у гиперкарниворных хищников. U. arctos обладает большим количеством прогрессивных характеристик в строении М1, в то время как М1 U. maritimus сочетает в себе как прогрессивные, так и примитивные черты, наряду со свойственными только этому виду особенностями.
Публикация является продолжением работы по изучению изменчивости зубов бурого (Ursus arctos (L. 1758)) и белого (U. maritimus (Phipps 1774)) медведей. Ранее опубликованы результаты исследования по изменчивости резцов и четвертых премоляров у этих видов (Гимранов, Косинцев, 2017; Гимранов, 2018). В этой работе внимание будет уделено верхнему первому моляру (М1). На сегодняшний день изменчивость качественных зубных признаков в отряде хищных млекопитающих Carnivora описана у некоторых представителей семейства Canidae (Szuma, 2007, 2011; Tedford et al., 2009), Mustelidae (Wolsan, 1988, 1989) и Felidae (Sotnikova, Nikolskiy, 2006). Работ, в которых описана вариабельность зубных признаков у представителей семейства Ursidae, не много (Rabeder, 1999; Барышников, 2007). Статистические данные о качественных признаках зубов современных бурого и белого медведей отсутствуют. Из всех элементов скелета зубы чаще всего сохраняются не поврежденными в отложениях четвертичного времени. Без изучения особенностей строения зубов современных таксонов невозможно интерпретировать изменения зубных структур, происходившие в геологическом масштабе времени. Более подробно об актуальности исследований и выборе именно бурого и белого медведей в рамках изучения изменчивости зубов хищных млекопитающих можно найти в нашей предыдущей работе (Гимранов, Косинцев, 2017). Там же приводится обзор литературных данных по проблеме изменчивости зубов у представителей рода Ursus. В задачи настоящего исследования входят описание зубных признаков верхнего первого моляра (М1), составление морфотипических схем, вычисление показателя усложненности коронки зуба и описание видовых диагностических признаков.
МАТЕРИАЛ И МЕТОДЫ
Исследованы краниологические коллекции Зоологического музея МГУ (Москва), Зоологического института РАН (Санкт-Петербург), Музея ИЭРиЖ УрО РАН, Зоологического музея ТомГУ, коллекционных фондов ИСиЭЖ СО РАН, The Hokkaido University Museum (Саппоро, Япония), Hokkaido Museum (Саппоро, Япония), Department of Archaeology, the University of Tokyo (Токоро, Япония), Shiretoko Museum (Шари, Япония). Географическое распределение изученных выборок медведей приведено в работе по изменчивости резцов (Гимранов, Косинцев, 2017).
Локалитеты изученных особей (черепов) бурого медведя объединялись в крупные выборки. Кавказ горный: Азербайджанская республика (n = 3), Грузия (n = 2), Республика Абхазия (n = 2), Республика Дагестан (n = 3), Карачаево-Черкесская Республика (n = 3), Республика Северная Осетия-Алания (n = 16), Чеченская Республика (n = 2); Кавказ равнинный: Республика Адыгея (n = 55), Краснодарский край (n = 8); Центр европейской части России: Костромская обл. (n = 4), Московская обл. (n = 1), Смоленская обл. (n = 4), Тверская обл. (n = 6), Ярославская обл. (n = 1); Север европейской части России: Архангельская обл. (n = 5), Вологодская обл. (n = 11), Ленинградская обл. (n = 38), Мурманская обл. (n = 5), Новгородская обл. (n = 14), Псковская обл. (n = 8), Республика Карелия (n = 3); Урал южный: Республика Башкортостан (n = 10), Оренбургская обл. (n = 1); Урал северный и средний: Коми (n = 31); Свердловская обл. (n = 18); Пермская обл. (n = 3), Тюменская обл. (n = 3), Ханты-Мансийский автономный округ (n = 3), Ямало-Ненецкий автономный округ (n = 1), Урал северный без точного локалитета (n = 11); Западная Сибирь: Новосибирская обл. (n = 3), Томская обл. (n = 22), Тюменская обл. (n = 29); Алтай: Республика Алтай (n = 19); Прибайкалье: Иркутская обл. (n = 16); Центральная Сибирь: Красноярский край (n = 22); Восточная Сибирь: Республика Саха (n = 9), Магаданская обл. (n = 3), Чукотский автономный округ (n = 2); Приморье: Приморский край (n = 16); Камчатка: Камчатский край (n = 115); острова Дальнего Востока: Сахалинская обл. (n = 10); Япония: западная часть о-ва Хоккайдо (n = 40), центральная часть о-ва Хоккайдо (n = 55), восточная часть о-ва Хоккайдо (n = 56), без точного локалитета о-в Хоккайдо (n = 27). Общая выборка по виду 719 особей. Общее количество изученных зубов составляет 1398 экз.
Локалитеты и число изученных особей (черепов) белого медведя: группа “Ямал” включает в себя экземпляры из Архангельской обл. (n = 27) и Ямало-Ненецкого автономного округа (n = 18); группа “Таймыр” состоит из экземпляров, собранных с севера Красноярского края (n = 69); группа “Сибирь (северо-восток)” включает в себя экземпляры с севера Республики Саха (n = 26) и из Чукотского автономного округа (n = 58), группа “Северный Ледовитый океан” состоит из экземпляров, не имеющих точных локалитетов (n = 32). Общая выборка по виду 230 особей. Общее количество изученных зубов составляет 458 экз.
Характеристика выделенных морфотипов приведена в табл. 1. При описании морфотипов М1 изучали форму основания буккальной части коронки зуба, наличие пара- и метастилей (рис. 1A), присутствие прото- и постметаконулей (рис. 1B), наличие энтметаконуля (рис. 1C) и развитость лингвального цингулюма (рис. 1D). При описании структуры коронки M1 большинство названий признаков использовалось согласно Rabeder (Rabeder et al., 2009), с некоторыми изменениями, касающимися энтметаконуля (entMec) по Jiangzuo (Jiangzuo et al., 2019) и метаконуля (Mec) (личное сообщение Qigao Jiangzuo), а также авторскими дополнениями, касающимися протоконуля (Prc) и постметаконуля (postMec). Показатель усложненности рассчитывался на основе частоты встречаемости простых и сложных морфотипов (Rabeder, 1999). Значение фактора для каждого морфотипа приведено в табл. 1. Разделение выборок по полу не производилось. В наших предыдущих работах были проанализированы премоляры у особей бурого медведя с известным полом с целью оценки степени проявления полового диморфизма в частотах морфотипов (Гимранов, 2018). Было показано, что статистически значимые различия между самцами и самками отсутствуют. Выборки о-ва Хоккайдо сгруппированы в соответствии с группами, выделенными на основании молекулярно-генетических данных (Hirata et al., 2013). Статистическая оценка различий в долях морфотипов между материковыми и островными популяциями бурого медведя, а также между двумя видами медведей проводилась с помощью критерия χ2. Расчет значений χ2 проведен с использованием пакета PAST (Hammer et al., 2001). Черепа бурого и белого медведей, имеющие разные морфотипы правого и левого зуба, при проведении данного исследования не встречены.
Таблица 1.
Характеристика выделенных морфотипов М1 бурого и белого медведей
| Часть зуба | Морфотип | Фактор | Характеристика морфотипа |
|---|---|---|---|
| Буккальный отдел (паракон-метаконный) | А1 | 2 | На буккальной стороне коронки между параконом (Pa) и метаконом (Me) имеется глубокая вырезка, присутствует парастиль (Pas) |
| А2 | 2 | На буккальной стороне коронки имеется глубокая вырезка, присутствует метастиль (Mes) | |
| А3 | 3 | На буккальной стороне коронки имеется глубокая вырезка, присутствуют парастиль и метастиль | |
| В1 | 2 | На буккальной стороне коронки между параконом и метаконом вырезка слабая или отсутствует, присутствует парастиль | |
| В2 | 2 | На буккальной стороне коронки вырезка слабая или отсутствует, присутствует метастиль | |
| В3 | 3 | На буккальной стороне коронки вырезка слабая или отсутствует, присутствуют парастиль и метастиль | |
| С | 4 | На буккальной стороне коронки между параконом и метаконом имеется выступ, присутствуют парастиль и метастиль | |
| Лингвальный отдел (протоконный) | А1 | 3 | Имеются протокон (Pr), мезокон (Mes) и метаконуль (Mec) |
| А2 | 4 | Имеются протокон, мезокон, метаконуль и протоконуль (Prc) | |
| А3 | 4 | Имеются протокон, мезокон, метаконуль и постметаконуль (postMec) | |
| А4 | 5 | Имеются протокон, мезокон, метаконуль, протоконуль и постметаконуль | |
| Дистальный отдел (энтметаконуль) | А1 | 1 | На дистальной части зуба площадка (или бассейн) энтметаконуля (entMec) не выражена |
| А2 | 2 | На дистальной части зуба площадка (или бассейн) энтметаконуля хорошо развита | |
| Лингвальный цингулюм (в баллах) |
1 | 1 | Лингвальный цингулюм (Cinl) имеется под мезоконом |
| 2 | 1.5 | Лингвальный цингулюм имеется под мезоконом и незначительно выходит за границы мезокона | |
| 3 | 2 | Лингвальный цингулюм имеется под мезоконом и развивается в основании протокона или метаконуля | |
| 4 | 2.5 | Лингвальный цингулюм имеется под мезоконом и развивается в основании протокона и метаконуля | |
| 5 | 3 | Лингвальный цингулюм полный: заходит на антериальную и постериальную часть зуба |
Рис. 1.
Морфотипы М1 бурого и белого медведей (название элементов зуба см. табл. 1): А – буккальный отдел (паракон-метаконный), В – лингвальный отдел (протоконный), С – дистальный отдел (энтметаконуль), D – лингвальный цингулюм (в баллах).
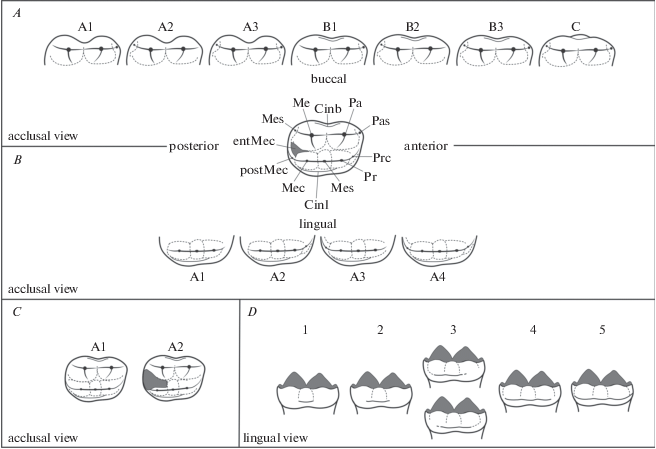
РЕЗУЛЬТАТЫ
Морфотипы буккального (паракон-метаконный) отдела М1. Во всех популяциях U. arctos значительно доминирует морфотип В3 (табл. 2). У бурого медведя Кавказа, европейской части России и Урала встречаются морфотипы В1 и В2 (2.9–7.9%), которые отсутствуют у особей из азиатской части России, за исключением одного случая на Алтае. В европейской части России у бурых медведей морфотип С является редким (1.6–6.0%), тогда как в азиатской части его значения достаточно высоки (9.3–25.0%). Однако в популяции U. arctos, обитающей на Камчатке, морфотип С встречен единожды (0.9%). На о-ве Хоккайдо все изученные зубы бурого медведя демонстрируют морфотип В3, за исключением одного случая на западе о-ва Хоккайдо. Поэтому между выборками бурых медведей с материка и о-ва Хоккайдо не обнаружены значимые статистические различия в частотах морфотипов буккального отдела М1 (табл. 3). У U. maritimus доминирующими морфотипами являются А3 (77.3%). Между бурым и белым медведями выявлены достоверно значимые различия (табл. 3). Отметим, что в выборках U. maritimus из Ямала и северо-востока Сибири морфотип А2 (13.3–15.4%) преобладает над морфотипом А1 (2.2–7.7%). Белые медведи с п-ова Таймыр имеют обратное соотношение редких морфотипов: А1 (11.6%) преобладает над А2 (4.3%). Между выборками белого медведя различия недостоверны.
Таблица 2.
Число и частоты морфотипов буккального (паракон-метаконный) отдела М1
| Вид | Географическая область | Морфотипы | N | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| A1 | A2 | А3 | В1 | В2 | В3 | С | ||||
| U. arctos | Кавказ горный | n | 0 | 0 | 0 | 0 | 0 | 31 | 0 | 31 |
| % | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 100.0 | 0.0 | |||
| Кавказ равнинный | n | 0 | 0 | 0 | 5 | 0 | 57 | 1 | 63 | |
| % | 0.0 | 0.0 | 0.0 | 7.9 | 0.0 | 90.5 | 1.6 | |||
| Центр европейской части России | n | 0 | 0 | 0 | 0 | 0 | 16 | 0 | 16 | |
| % | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 100.0 | 0.0 | |||
| Север европейской части России | n | 0 | 0 | 0 | 5 | 1 | 73 | 5 | 84 | |
| % | 0.0 | 0.0 | 0.0 | 6.0 | 1.2 | 86.8 | 6.0 | |||
| Средний и Северный Урал | n | 0 | 0 | 0 | 2 | 0 | 68 | 0 | 70 | |
| % | 0.0 | 0.0 | 0.0 | 2.9 | 0.0 | 97.1 | 0.0 | |||
| Южный Урал | n | 0 | 0 | 0 | 0 | 0 | 11 | 0 | 11 | |
| Западная Сибирь | n | 0 | 0 | 0 | 0 | 0 | 49 | 5 | 54 | |
| % | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 90.7 | 9.3 | |||
| Алтай | n | 0 | 0 | 0 | 0 | 0 | 14 | 5 | 19 | |
| % | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 73.7 | 26.3 | |||
| Центральная Сибирь | n | 0 | 0 | 0 | 0 | 0 | 19 | 3 | 22 | |
| % | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 86.4 | 13.6 | |||
| Якутия | n | 0 | 0 | 0 | 1 | 0 | 8 | 0 | 9 | |
| Юго-Восточная Сибирь | n | 0 | 0 | 0 | 0 | 0 | 14 | 2 | 16 | |
| % | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 87.5 | 12.5 | |||
| Приморье | n | 0 | 0 | 0 | 0 | 0 | 12 | 4 | 16 | |
| % | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 75.0 | 25.0 | |||
| Острова Дальнего Востока | n | 0 | 0 | 0 | 0 | 0 | 10 | 0 | 10 | |
| Камчатка | n | 0 | 0 | 0 | 0 | 0 | 114 | 1 | 115 | |
| % | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 99.1 | 0.9 | |||
| Север Дальнего Востока | n | 0 | 0 | 0 | 0 | 0 | 5 | 0 | 5 | |
| Общее: | n | 0 | 0 | 0 | 13 | 1 | 504 | 26 | 544 | |
| % | 0.0 | 0.0 | 0.0 | 2.4 | 0.2 | 92.6 | 4.8 | |||
| Остров Хоккайдо (запад) | n | 0 | 0 | 0 | 1 | 0 | 39 | 0 | 40 | |
| % | 0 | 0 | 0 | 2.5 | 0 | 97.5 | 0 | |||
| Остров Хоккайдо (центр) | n | 0 | 0 | 0 | 0 | 0 | 55 | 0 | 55 | |
| % | 0 | 0 | 0 | 0 | 0 | 100.0 | 0 | |||
| Остров Хоккайдо (восток) | n | 0 | 0 | 0 | 0 | 0 | 56 | 0 | 56 | |
| % | 0 | 0 | 0 | 0 | 0 | 100.0 | 0 | |||
| Остров Хоккайдо* | n | 0 | 0 | 0 | 0 | 0 | 26 | 0 | 26 | |
| % | 0 | 0 | 0 | 0 | 0 | 100.0 | 0 | |||
| Общее: | n | 0 | 0 | 0 | 1 | 0 | 176 | 0 | 177 | |
| % | 0.0 | 0.0 | 0.0 | 0.6 | 0.0 | 99.4 | 0.0 | |||
| Общее по виду: | n | 0 | 0 | 0 | 14 | 1 | 680 | 26 | 721 | |
| % | 0.0 | 0.0 | 0.0 | 1.9 | 0.1 | 94.4 | 3.6 | |||
| U. maritimus | Ямал | n | 1 | 6 | 35 | 0 | 2 | 1 | 0 | 45 |
| % | 2.2 | 13.3 | 77.9 | 0.0 | 4.4 | 2.2 | 0.0 | |||
| Таймыр | n | 8 | 3 | 56 | 0 | 0 | 2 | 0 | 69 | |
| % | 11.6 | 4.3 | 81.2 | 0.0 | 0.0 | 2.9 | 0.0 | |||
| Сибирь (северо-восток) | n | 6 | 12 | 55 | 1 | 0 | 4 | 0 | 78 | |
| % | 7.7 | 15.4 | 70.5 | 1.3 | 0.0 | 5.1 | 0.0 | |||
| Северный Ледовитый океан* | n | 3 | 2 | 27 | 0 | 0 | 0 | 0 | 32 | |
| % | 9.4 | 6.3 | 84.3 | 0.0 | 0.0 | 0.0 | 0.0 | |||
| Общее по виду: | n | 18 | 23 | 173 | 1 | 2 | 7 | 0 | 224 | |
| % | 8.0 | 10.3 | 77.3 | 0.4 | 0.9 | 3.1 | 0.0 | |||
Таблица 3.
Статистический уровень различий между частотами морфотипов М1 медведей, оценка критерием χ2
| Отдел зуба | Вид | χ2 | p | df | N |
|---|---|---|---|---|---|
| Буккальный отдел (паракон-метаконный) | U. arctos (материк*) | 6.34 | 0.0964 | 3 | 544 |
| U. arctos (о-в Хоккайдо) | 177 | ||||
| U. arctos | 185.97 | <0.0001 | 6 | 721 | |
| U. maritimus | 224 | ||||
| Лингвальный отдел (протоконный) | U. arctos (материк) | 8.11 | 0.0439 | 3 | 392 |
| U. arctos (о-в Хоккайдо) | 147 | ||||
| U. arctos | 124.08 | <0.0001 | 3 | 539 | |
| U. maritimus | 224 | ||||
| Дистальный отдел (энтметаконуль) | U. arctos (материк) | 58.64 | <0.0001 | 1 | 447 |
| U. arctos (о-в Хоккайдо) | 175 | ||||
| U. arctos | 97.26 | <0.0001 | 1 | 622 | |
| U. maritimus | 230 | ||||
| Лингвальный цингулюм (в баллах) |
U. arctos (материк) | 20.18 | 0.0005 | 4 | 511 |
| U. arctos (о-в Хоккайдо) | 167 | ||||
| U. arctos | 81.35 | <0.0001 | 4 | 678 | |
| U. maritimus | 230 |
Морфотипы лингвального (протоконного) отдела М1. Во всех представительных выборках бурого медведя доминирующим морфотипом является А1 (76.3–95.7%). Редкие морфотипы А2 и А3 (4.1 и 8.4%) не имеют выраженной географической закономерности в распределении частот (табл. 4). Только у U. arctos, обитающего на севере европейской части России, был отмечен морфотип А4 (0.3%). Популяции бурого медведя, обитающие на о-ве Хоккайдо, между собой не обнаруживают четких различий в частотах выделенных морфотипов. При этом островные медведи заметно отличаются от материковых частым присутствием морфотипа А3 (15.6–29.7%) и редкой встречаемостью морфотипов А2 и А4 (по 0.7%). Несмотря на это, достоверно значимых статистических различий в частотах морфотипов лингвального отдела М1 между бурым медведем о-ва Хоккайдо и материковым бурым медведем не обнаружено (табл. 3). Морфотипическое разнообразие у U. maritimus ниже, чем у U. arctos. Между бурым и белым медведями выявлены достоверно значимые различия (табл. 3). У белого медведя встречены только морфотипы А1 и А2, из которых значительно доминирует морфотип А2 (73.8–86.7%). Частота встречаемости морфотипа А2 колеблется в пределах от 13.3 до 26.2% (табл. 4). Выборки U. maritimus достаточно сходны между собой, и значимых статистических различий между ними не выявлено.
Таблица 4.
Число и частоты морфотипов лингвальной части М1
| Вид | Географическая область | Лингвальный отдел (протоконный) |
N | Дистальный отдел (энтметаконуль) |
N | Лингвальный цингулюм (в баллах) |
N | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| А1 | А2 | А3 | А4 | A1 | A2 | 1 | 2 | 3 | 4 | 5 | ||||||
| U. arctos | Кавказ горный | n | 22 | 1 | 0 | 0 | 23 | 11 | 12 | 23 | 0 | 18 | 11 | 1 | 0 | 30 |
| % | 95.7 | 4.3 | 0 | 0 | 47.8 | 52.2 | 0.0 | 60.0 | 36.7 | 3.3 | 0.0 | |||||
| Кавказ равнинный | n | 39 | 1 | 6 | 0 | 46 | 21 | 32 | 53 | 2 | 25 | 31 | 2 | 0 | 60 | |
| % | 84.8 | 2.2 | 13.0 | 0.0 | 39.6 | 60.4 | 3.3 | 41.7 | 51.7 | 3.3 | 0.0 | |||||
| Центр европейской части России |
n | 10 | 0 | 2 | 0 | 12 | 7 | 7 | 14 | 0 | 5 | 10 | 0 | 0 | 15 | |
| % | 0.0 | 33.3 | 66.7 | 0.0 | 0.0 | |||||||||||
| Север европейской части России |
n | 62 | 3 | 9 | 1 | 75 | 32 | 46 | 78 | 2 | 37 | 39 | 2 | 0 | 80 | |
| % | 82.7 | 4.0 | 12.0 | 1.3 | 41.0 | 59.0 | 2.5 | 46.3 | 48.8 | 2.5 | 0.0 | |||||
| Средний и Северный Урал | n | 46 | 3 | 3 | 0 | 52 | 50 | 17 | 67 | 3 | 26 | 20 | 9 | 3 | 61 | |
| % | 88.5 | 5.8 | 5.8 | 0.0 | 74.6 | 25.4 | 4.9 | 42.6 | 32.8 | 14.8 | 4.9 | |||||
| Южный Урал | n | 8 | 0 | 1 | 0 | 9 | 7 | 2 | 9 | 2 | 4 | 5 | 0 | 0 | 11 | |
| Западная Сибирь | n | 29 | 5 | 4 | 0 | 38 | 17 | 27 | 44 | 7 | 28 | 12 | 4 | 0 | 51 | |
| % | 76.3 | 13.2 | 10.5 | 0.0 | 38.6 | 61.4 | 13.7 | 54.9 | 23.5 | 7.8 | 0.0 | |||||
| Алтай | n | 8 | 0 | 1 | 0 | 9 | 3 | 12 | 15 | 1 | 9 | 6 | 2 | 0 | 18 | |
| % | 20.0 | 80.0 | 5.6 | 50.0 | 33.3 | 11.1 | 0.0 | |||||||||
| Центральная Сибирь | n | 9 | 0 | 2 | 0 | 11 | 1 | 9 | 10 | 0 | 10 | 10 | 1 | 0 | 21 | |
| % | 0.0 | 47.6 | 47.6 | 4.8 | 0.0 | |||||||||||
| Юго-Восточная Сибирь | n | 6 | 0 | 0 | 0 | 6 | 2 | 3 | 5 | 1 | 2 | 6 | 1 | 0 | 10 | |
| Якутия | n | 5 | 0 | 1 | 0 | 6 | 4 | 5 | 9 | 0 | 7 | 2 | 0 | 0 | 9 | |
| Приморье | n | 6 | 0 | 1 | 0 | 7 | 7 | 1 | 8 | 2 | 11 | 2 | 0 | 0 | 15 | |
| % | 13.3 | 73.3 | 13.3 | 0.0 | 0.0 | |||||||||||
| Острова Дальнего Востока | n | 10 | 0 | 0 | 0 | 10 | 6 | 3 | 9 | 0 | 7 | 2 | 1 | 0 | 10 | |
| Камчатка | n | 77 | 3 | 3 | 0 | 83 | 44 | 54 | 98 | 2 | 55 | 56 | 2 | 0 | 115 | |
| % | 92.8 | 3.6 | 3.6 | 0.0 | 44.9 | 55.1 | 1.7 | 47.8 | 48.7 | 1.7 | 0.0 | |||||
| Север Дальнего Востока | n | 5 | 0 | 0 | 0 | 5 | 1 | 4 | 5 | 0 | 2 | 2 | 1 | 0 | 5 | |
| Общее: | n | 342 | 16 | 33 | 1 | 392 | 213 | 234 | 447 | 22 | 246 | 214 | 26 | 3 | 511 | |
| % | 87.2 | 4.1 | 8.4 | 0.3 | 47.7 | 52.3 | 4.3 | 48.1 | 41.9 | 5.1 | 0.6 | |||||
| U. arctos | Остров Хоккайдо (запад) | n | 25 | 0 | 11 | 1 | 37 | 1 | 39 | 40 | 6 | 17 | 12 | 4 | 0 | 39 |
| % | 67.6 | 0.0 | 29.7 | 2.7 | 2.5 | 97.5 | 15.4 | 43.6 | 30.8 | 10.3 | 0.0 | |||||
| Остров Хоккайдо (центр) | n | 37 | 1 | 7 | 0 | 45 | 0 | 54 | 54 | 20 | 14 | 17 | 0 | 0 | 51 | |
| % | 82.2 | 2.2 | 15.6 | 0.0 | 0.0 | 100.0 | 39.2 | 27.5 | 33.3 | 0.0 | 0.0 | |||||
| Остров Хоккайдо (восток) | n | 32 | 0 | 8 | 0 | 40 | 1 | 53 | 54 | 9 | 26 | 15 | 2 | 0 | 52 | |
| % | 80.0 | 0.0 | 20.0 | 0.0 | 1.9 | 98.1 | 17.3 | 50.0 | 28.8 | 3.8 | 0.0 | |||||
| Остров Хоккайдо* | n | 21 | 0 | 4 | 0 | 25 | 0 | 27 | 27 | 10 | 10 | 5 | 0 | 0 | 25 | |
| % | 84.0 | 0.0 | 16.0 | 0.0 | 0.0 | 100.0 | 40.0 | 40.0 | 20.0 | 0.0 | 0.0 | |||||
| Общее: | n | 115 | 1 | 30 | 1 | 147 | 2 | 173 | 175 | 45 | 67 | 49 | 6 | 0 | 167 | |
| % | 78.2 | 0.7 | 20.4 | 0.7 | 1.1 | 98.9 | 26.9 | 40.1 | 29.3 | 3.6 | 0.0 | |||||
| Общее по виду: | n | 457 | 17 | 63 | 2 | 539 | 215 | 407 | 622 | 67 | 313 | 263 | 32 | 3 | 678 | |
| % | 84.8 | 3.2 | 11.7 | 0.4 | 34.6 | 65.4 | 9.9 | 46.2 | 38.8 | 4.7 | 0.4 | |||||
| U. maritimus | Ямал | n | 6 | 39 | 0 | 0 | 45 | 45 | 0 | 45 | 26 | 19 | 0 | 0 | 0 | 45 |
| % | 13.3 | 86.7 | 0.0 | 0.0 | 100.0 | 0.0 | 57.8 | 42.2 | 0.0 | 0.0 | 0.0 | |||||
| Таймыр | n | 11 | 54 | 0 | 0 | 65 | 69 | 0 | 69 | 50 | 19 | 0 | 0 | 0 | 69 | |
| % | 16.9 | 83.1 | 0.0 | 0.0 | 100.0 | 0.0 | 72.5 | 27.5 | 0.0 | 0.0 | 0.0 | |||||
| Сибирь (северо-восток) | n | 22 | 62 | 0 | 0 | 84 | 84 | 0 | 84 | 58 | 20 | 6 | 0.0 | 0.0 | 84 | |
| % | 26.2 | 73.8 | 0.0 | 0.0 | 100.0 | 0.0 | 69.0 | 23.8 | 7.1 | 0.0 | 0.0 | |||||
| Северный Ледовитый океан* | n | 5 | 25 | 0 | 0 | 30 | 32 | 0 | 32 | 21 | 9 | 2 | 0 | 0 | 32 | |
| % | 16.7 | 83.3 | 0.0 | 0.0 | 100.0 | 0.0 | 65.6 | 28.1 | 6.3 | 0.0 | 0.0 | |||||
| Общее по виду: | n | 44 | 180 | 0 | 0 | 224 | 230 | 0 | 230 | 155 | 67 | 8 | 0 | 0 | 230 | |
| % | 19.6 | 80.4 | 0.0 | 0.0 | 100.0 | 0.0 | 67.4 | 29.1 | 3.5 | 0.0 | 0.0 | |||||
Морфотипы дистального (энтметаконуль) отдела М1. У бурого медведя наблюдается достаточно близкое соотношение частот морфотипов дистального отдела, морфотип А2 почти во всех выборках является доминирующим (табл. 4). Исключением является выборка медведей с Урала, где доминирует морфотип А1 (74.6%). Бурые медведи с о-ва Хоккайдо отличаются от материковых бурых медведей почти полным доминированием морфотипа А2 (98.9%). Морфотип А1 у них встречен только в двух случаях. Поэтому по строению дистальной части М1 популяции U. arctos, населяющие о-в Хоккайдо, достоверно отличаются от других популяций (табл. 3). У U. maritimus не встречено морфотипа А2 (табл. 4). Между бурым медведем и белым медведем, по частоте встречаемости обсуждаемых морфотипов, получены значимые статистические различия (табл. 3).
Развитость лингвального цингулюма М1. В материковых популяциях бурого медведя не обнаружено географической закономерности в строении лингвального цингулюма (табл. 4). Доминируют цингулюмы развитостью в 2 и 3 балла: в некоторых регионах чаще встречаются зубы с плохо развитым цингулюмом (2 балла), в других регионах больше особей с цингулюмом средней степени развитости (3 балла). Цингулюмы развитостью в 1 и 4 балла встречаются редко. Хорошо развитый цингулюм в 5 баллов отмечен в трех случаях U. arctos только на Урале. В целом островные популяции бурого медведя имеют достаточно часто встречающийся слабо развитый лингвальный цингулюм (1 балл). Подобное строение цингулюма является доминирующим в популяциях центральной части о-ва Хоккайдо (39.2%). Медведи с восточной части острова имеют особенности: только у них отмечена развитая форма лингвального цингулюма, соответствующая четырем баллам. Между выборками бурых медведей с материка и с о-ва Хоккайдо получены достоверные статистические различия на уровне р = 0.0005 (табл. 3). Между выборками бурого и белого медведей обнаружены значимые статистические различия (табл. 3). У белого медведя наиболее часто встречается слабо развитый лингвальный цингулюм (1 балл). Стоит отметить, что у белых медведей Ямала высока частота встречаемости (42.2%) плохо развитого лингвального цингулюма (2 балла), тогда как в остальных выборках этот показатель ниже (23.8–28.1%). Лингвальный цингулюм средней степени развитости (3 балла) отмечен только в популяциях U. maritimus, обитающих на Северо-востоке Сибири и в популяциях без точно установленного локалитета. Между выборками белого медведя различия недостоверны.
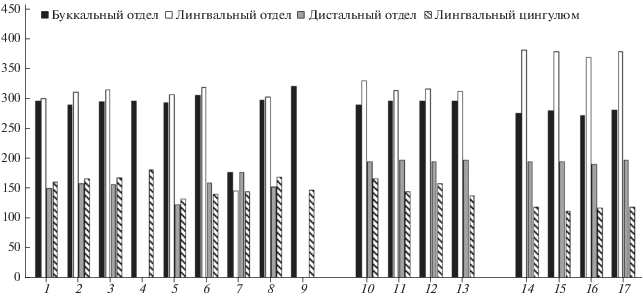
Усложненность зубов. Как и описание морфотипов, характеристика их усложненности приведена отдельно для каждой части М1 (табл. 5, рис. 2). Буккальный и лингвальный отделы М1 у материковых бурых медведей выглядят примерно одинаково усложненными во всех исследуемых выборках. Можно отметить очень низкие показатели усложненности в группе с Алтая, что может быть связано с малочисленностью выборки. Наиболее усложнен буккальный отдел М1 в популяциях бурых медведей Приморья и Западной Сибири, лингвальный отдел в популяциях медведей Западной Сибири и Севера европейской части России, дистальный отдел у медведей, населяющих Алтай и Западную Сибирь. Лингвальный цингулюм наиболее усложнен у бурых медведей центральной части России и Камчатки. Строение коронки М1 у материковых бурых медведей достаточно сходно. Однако популяции бурого медведя с о-ва Хоккайдо существенно отличаются от материковых животных увеличением усложненности всех отделов зуба. Внутри острова наиболее усложненными М1 обладают медведи, живущие в западной и восточной частях острова (табл. 5, рис. 2). У белого медведя между выборками также не наблюдаются существенные различия в строении М1. Отметим, что этому виду принадлежит наибольшая степень усложненности лингвального отдела. Буккальный отдел М1 усложнен в целом меньше, чем у бурых медведей. Усложненность дистального отдела у белых медведей сравнима с показателями бурых медведей с о-ва Хоккайдо. U. maritimus имеет наименьшую степень развитости (усложненности) лингвального цингулюма М1 среди всех изученных выборок (табл. 5, рис. 2).
Таблица 5.
Показатель усложненности М1 бурого и белого медведей
| Вид | Географическая область | Буккальный отдел | Лингвальный отдел | Дистальный отдел | Лингвальный цингулюм | Общее по зубу |
|---|---|---|---|---|---|---|
| U. arctos | Кавказ горный | 300.0 | 304.3 | 152.2 | 163.3 | 919.9 |
| Кавказ равнинный | 293.7 | 315.2 | 160.4 | 169.2 | 938.4 | |
| Север европейской части России | 298.8 | 318.7 | 159.0 | 169.4 | 945.8 | |
| Центр европейской части России | 300.0 | 0.0 | 0.0 | 183.3 | ||
| Средний и Северный Урал | 297.1 | 311.5 | 125.4 | 134.4 | 868.5 | |
| Западная Сибирь | 309.3 | 323.7 | 161.4 | 143.1 | 937.4 | |
| Алтай | 178.9 | 147.4 | 180.0 | 147.2 | 653.5 | |
| Юго-Восточная Сибирь | 137.5 | 0.0 | 0.0 | 0.0 | ||
| Камчатка | 300.9 | 307.2 | 155.1 | 170.9 | 934.1 | |
| Приморье | 325.0 | 0.0 | 0.0 | 150.0 | ||
| Общее: | 308.6 | 184.4 | 99.4 | 130.1 | 885.4 | |
| Остров Хоккайдо (запад) | 293.0 | 335.0 | 198.0 | 168.0 | 994.0 | |
| Остров Хоккайдо (центр) | 300.0 | 318.0 | 200.0 | 147.0 | 965.0 | |
| Остров Хоккайдо (восток) | 300.0 | 320.0 | 198.0 | 160.0 | 978.0 | |
| Остров Хоккайдо* | 300.0 | 316.0 | 200.0 | 140.0 | 956.0 | |
| Общее: | 298.3 | 322.3 | 199.0 | 153.8 | 973.3 | |
| Общее по виду: | 303.4 | 253.3 | 149.2 | 141.9 | 929.3 | |
| U. maritimus | Ямал | 280.0 | 386.7 | 197.8 | 121.1 | 985.6 |
| Таймыр | 284.1 | 383.1 | 197.1 | 113.8 | 978.0 | |
| Сибирь (северо-восток) | 275.6 | 373.8 | 192.9 | 119.0 | 961.3 | |
| Северный Ледовитый океан* | 284.4 | 383.3 | 200.0 | 120.3 | 988.0 | |
| Общее по виду: | 281.0 | 381.7 | 196.9 | 118.5 | 978.2 |
Рис. 2.
Уровень усложненности М1 в выборках бурого медведя и белого медведя. Бурый медведь: 1 – Кавказ горный, 2 – Кавказ равнинный, 3 – Север европейской части России, 4 – центр европейской части России, 5 – Урал северный и средний, 6 – Западная Сибирь, 7 – Алтай, 8 – Камчатка, 9 – Приморье, 10 – остров Хоккайдо (запад), 11 – о-в Хоккайдо (центр), 12 – о-в Хоккайдо (восток), 13 – о-в Хоккайдо (без точного локалитета). Белый медведь: 14 – Ямал, 15 – Таймыр, 16 – Сибирь (северо-восток), 17 – Северный ледовитый океан (без точного локалитета).
ОБСУЖДЕНИЕ
Бурый медведь. Ранее нам удалось установить некоторую географическую закономерность в изменчивости строения коронок резцов и четвертых премоляров (Р4 и р4) у U. arctos (Гимранов, Косинцев, 2017; Гимранов, 2018). Строение коронки М1 у материковых бурых медведей достаточно сходное. Однако популяции бурого медведя с о-ва Хоккайдо существенно отличаются от материковых животных увеличением усложненности всех отделов зуба. Можно заключить, что М1 у бурого медведя является мало изменчивым зубом, по сравнению с резцами и премолярами (Гимранов, Косинцев, 2017; Гимранов, 2018). На М1 имеется большее количество изменчивых признаков, чем на резцах и премолярах, поэтому создается впечатление о его (М1) достаточной изменчивости. Однако каждый отдельный признак проявляет слабую изменчивость в изученных выборках. Бурого медведя можно достоверно дифференцировать от белого медведя на основе строения М1. Дифференцирующими признаками являются отсутствие протоконуля, наличие энтметаконуля и развитый лингвальный цингулюм. Бурого медведя можно достоверно отличить от белого медведя по строению буккальной части М1, а именно по отсутствию глубокой вырезки между параконом и метаконом.
Белый медведь. У белого медведя не наблюдается существенных различий в строении М1 между выборками. Можно заключить, что М1 у белого медведя, также как и у бурого медведя, является мало изменчивым зубом, по сравнению с резцами и премолярами (Гимранов, Косинцев, 2017; Гимранов, 2018). Белого медведя можно достоверно дифференцировать от бурого медведя на основе строения М1. Дифференцирующими признаками являются наличие протоконуля, отсутствие энтметаконуля и очень слабый (в данном случае редукция) лингвальный цингулюм. Также белого медведя можно достоверно отличить от бурого медведя по строению буккальной части М1, а именно по глубокой вырезке между параконом и метаконом.
Белый медведь относительно недавно отделился от общего ствола с бурыми медведями (Hailer et al., 2012; Bidon et al., 2014), но за короткое время приобрел большое количество уникальных адаптаций, в том числе произошла редукция зубной системы (Барышников, 2007; Slater et al., 2010). О быстрой адаптации зубов U. maritimus при переходе к полностью хищническому образу жизни свидетельствуют также полученные ранее данные (Гимранов, 2018): Р4 приобретает колющий хищнический вид с одной или двумя вершинами (потеря протокона, как основного давящего элемента, увеличение режущей функции зуба). Как и у Р4 (Гимранов, 2018), у М1 стили расположены в одну линию с главными буграми (параконом и метаконом). Можно предположить, что стили удлиняют главное лезвие зуба и участвуют в процессе разрезания пищи. Однако это заключение не согласуется с полученными результатами. У U. maritimus отмечена высокая доля редких морфотипов буккальной части М1 с редукцией одного из стилидов (18%). Функционально противоположное значение стилям имеет развитие конулей на Р4 и М1. Эти бугры у медведей участвуют в процессе раздавливания пищи. У белых медведей часто присутствует протоконуль (80%).
При переходе к облигатному хищничеству можно ожидать, что белый медведь, как и другие гиперкарниворные хищники (Felidae), будет закреплять и развивать такие элементы, как стилиды и будет избавляться от таких элементов, как конули на Р4, М1 или М2. Но мы наблюдаем иную ситуацию. Описанный сценарий в какой-то степени справедлив для Р4, с оговоркой, что зуб U. maritimus проявляет своеобразие в колющей, а не режущей функции. Для М1 сформулированный сценарий не подходит, т.к. этот зуб у белого медведя не развивает режущих функций. Наблюдается редукция зуба за счет утраты стилей, энтметаконуля и сокращения лингвального лезвия. При этом зуб увеличивает давящую функцию за счет протоконуля. Редукция зубов у белого медведя происходит в результате утраты их основных функций. Исследователи полагают, что это связано с потреблением мягкой пищи, основу которой составляют детеныши ластоногих (Slater et al., 2010). Поэтому интересной особенностью этих животных является то, что, не смотря на чисто хищническую стратегию питания, зубы у них видоизменяются по своеобразному сценарию. Резцы более приспособлены к хищничеству (Гимранов, Косинцев, 2017), как и клыки, которые сильно увеличены (Барышников, 2007), премоляры приобретают колющий вид (Гимранов, 2018), М1 утрачивает дополнительные элементы, связанные с разрезанием пищи. Почему М1 у белого медведя имеется протоконуль, не свойственный бурому медведю, остается не ясным.
Интересной особенностью строения М1 у изученных видов медведей является то, что, в отличие от четвертых премоляров, у которых доля ассиметричных морфотипов достаточно велика (Гимранов, 2018), первый моляр не имеет ассиметричных вариантов строения. Отметим, что у пяти особей U. maritimus, добытых на о-ве Врангеля, и одной особи с о-ва Комсомольская Правда на обеих сторонах челюсти отсутствовали изучаемые зубы. Явных следов прижизненной утери М1 нами не зафиксировано. У U. arctos подобные патологии не встречены.
Эволюционные изменения М1 в роде Ursus. Одним из самых древних представителей рода Ursus является U. minimus (Devèze de Chabriol et Bouillet 1827), который появляется на рубеже миоцена и плиоцена (Барышников, 2007; Wagner, 2010). Некоторые находки мелких плиоценовых медведей Евразии и Северной Америки иногда относят в отдельный род Protarctos (Kretzoi 1945), объединяющий четыре вида (Wang et al., 2017). На протяжении плиоцена разнообразие рода Ursus увеличивается: появляются U. thibetanus (G. Cuvier 1823) и U. americanus (Pallas 1870), в позднем плиоцене появляется U. etruscus (G. Cuvier 1823) (Барышников, 2007; Krause et al., 2008; Bon, Elalouf, 2010; Wagner, 2010), все четыре вышеперечисленных вида относятся к подроду Euarctos. В раннем плейстоцене появляются U. deningeri (von Reichenau 1904) и U. dolinenesis (Garcia et Arsuaga 2001) (Kurtén, 1968; García, Arsuaga, 2001; Wagner, Čermák, 2012), которые могут быть самыми ранними представителями линии пещерных медведей (подрод Spelearctos). В то же время U. etruscus или U. dolinensis могут быть предками линии бурых медведей (подрод Ursus). На данный момент подрод Spelearctos насчитывает 7 видов (Baryshnikov, Puzachenko, 2019; Barlow et al., 2020), которые условно можно разделить на 4 большие группы: денингероидные медведи (U. deningeri, U. deningeroides (Mottl 1964)), кавказский пещерный медведь (U. kudarensis (Baryshnikov 1985)), уральский пещерный медведь (U. kanivetz (Vereshchagin 1973)), европейский пещерный медведь (U. spelaeus (Rosenmüller 1794)) и два вида малых пещерных медведей (U. rossicus (Borissiak 1930) и U. savini Andrew 1922).
M1 у U. minimus демонстрирует отсутствие или слабую выраженность парастиля и метастиля, отсутствие протоконуля и постметаконуля, развитый лингвальный цингулюм, почти не развитый энтметаконуль и выпуклую форму буккального края основания коронки (Барышников, 2007; Wagner et al., 2011). Подобные черты в строении М1 характерны и для представителей рода Protarctos (Wang et al., 2017). Выше описанные состояния признаков можно считать базальными, примитивными для рода Ursus. Строение зубов U. thibetanus и U. americanus очень сходно с таковым у U. minimus (Барышников, 2007; Wagner et al., 2011). Гималайский медведь часто имеет парастиль и метастиль, выпуклую форму основания буккального края коронки, отсутствие протоконуля и постметаконуля (не опубликованные данные автора). Также по нашим наблюдениям у современного гималайского медведя нередко отсутствует мезокон, лингвальный цингулюм часто сильно редуцирован. Барибалу свойственно наличие парастиля и метастиля, слабовыпуклая или ровная форма основания буккального края коронки М1, отсутствие протоконуля и постметаконуля, очень слабое развитие энтметаконуля и лингвального цингулюма (не опубликованные данные автора).
Строение зубов у U. etruscus и U. dolinensis сходно между собой и с U. arctos. У U. etruscus имеются слаборазвитые стили на М1 (как правило, один из двух), примерно в половине случаев имеется энтметаконуль, достаточно часто наблюдается хорошо развитый лингвальный цингулюм, изогнутый буккальный край основания коронки и наличие протокона, мезокона и метаконуля без дополнительных элементов (Mazza, Rustioni, 1992; Барышников, 2007; Petrucci, Sardella, 2009; Wagner et al., 2011; Koufos et al., 2018; Medin et al., 2017; Jiangzuo et al., 2017; Medin et al., 2019). M1 U. dolinensis по многим перечисленным признакам схож с M1 U. etruscus, причем, в отличие от последнего, у U. dolinensis развиты оба стиля (Garcia, Arsuaga, 2001).
В целом строение зубов у пещерных медведей достаточно своеобразно и отличается от других представителей рода Ursus (Барышников, 2007). Ранние денингероидные пещерные медведи уже имели ряд признаков, отличающих их от этрусского медведя. Речь идет о таких признаках, как развитые пара- и метастили, развитая площадка энтметаконуля, наличие постметаконуля и средняя степень развитости лингвального цингулюма (Барышников, 2007; Rabeder et al., 2009; Wagner, Cermak, 2012). Пещерные медведи (U. spelaeus sensu lato) позднего плейстоцена имеют хорошо развитые пара- и метастили, хорошо развитую площадку метаконуля, постметаконуль, хорошо развитый лингвальный цингулюм и иногда раздвоенный мезокон (Grandal d’Anglade, 1993; Baryshnikov, 1998; Rabeder, 1999; Барышников, 2007). Малый или русский пещерный медведь U. rossicus отличается от других пещерных медведей более усложненными коронками зубов. Несмотря на это, строение М1 у U. rossicus очень схоже с таковым других позднеплейстоценовых пещерных медведей (Борисяк, 1932; Барышников, 2007).
Строение М1 плейстоценового U. arctos, которого иногда выделяют в отдельный подвид U. a. priscus, очень сходно со строением современного бурого медведя (Capasso Barbato et al., 1990; Rabeder et al., 2009; Baryshnikov, 2010; Marciszak et al., 2015; Marciszak et al., 2019).
В эволюционном отношении М1 у представителей рода Ursus изменяется достаточно слабо, по сравнению с премолярами (Гимранов, 2018). Основными элементами зуба, которые варьируют в эволюционном масштабе времениу представителей рода Ursus являются стили, постметаконуль, энтметаконуль и лингвальный цингулюм. Отсутствие или слабое развитие стилей также как и энтметаконуля является примитивным состоянием. Также архаичным состоянием является хорошо развитый лингвальный цингулюм. Наличие хорошо развитых стилей и энтметаконуля является прогрессивным состоянием, также как и редуцированный цингулюм. Прогрессивным состоянием, по-видимому, можно считать наличие постметаконуля (характерно для пещерных медведей) и протоконуля (характерно для белого медведя). U. arctos обладает большим количеством прогрессивных характеристик в строении М1, в то время как М1 U. maritimus сочетает в себе как прогрессивные, так и примитивные черты, наряду с некоторыми уникальными, свойственными только этому виду, особенностями. Это может объясняться переходом от всеядного или даже травоядного типа питания (бурый медведь) к облигатному хищничеству.
ЗАКЛЮЧЕНИЕ
Для первого верхнего моляра М1 бурого и белого медведей выделено и описано 7 признаков, обладающих изменчивостью: форма основания буккального края коронки, наличие пара- и метастилей, наличие энтметаконуля, постметаконуля и протоконуля, а также развитость лингвального цингулюма. Строение М1 в популяциях U. arctos, населяющих материк, очень сходно. У островных популяций U. arctos отмечается большее число редких морфотипов и, как следствие, увеличение значения показателя усложненности. Сочетание примитивных (развитый энтметаконуль) и прогрессивных (наличие постметаконуля и редуцированного лингвального цингулюма) характеристик отличает U. arctos с о-ва Хоккайдо от материковых U. arctos. В целом М1 у бурого и белого медведей является мало изменчивым зубом, по сравнению с резцами и премолярами.
Бурого медведя можно достоверно дифференцировать от белого медведя на основе строения М1. Признаками, характерными для U. arctos, являются отсутствие протоконуля, наличие площадки энтметаконуля и развитый лингвальный цингулюм. Признаками, характерными для U. maritimus, являются глубокая вырезка буккального края основания коронки между параконом и метаконом, наличие протоконуля, отсутствие энтметаконуля и сильно редуцированный лингвальный цингулюм. Несмотря на то, что U. maritimus является почти полностью облигатным хищником, сценарий изменения зубов у этого вида не совпадает с подобными сценариями для других гиперкарниворных хищников. Зубы у белого медведя видоизменяются по своеобразному пути: резцы становятся более приспособленными к захвату добычи, как и клыки, которые сильно увеличены, премоляры приобретают колющий вид, М1 утрачивает дополнительные элементы, связанные с разрезанием пищи, при этом развивая давящие элементы.
В эволюционном отношении М1 у представителей рода Ursus изменяется достаточно слабо. Основными элементами зуба, которые варьируют в эволюционном масштабе времени у представителей рода Ursus, являются стили, постметаконуль, энтметаконуль и лингвальный цингулюм. U. arctos обладает большим количеством прогрессивных характеристик в строении М1, в то время как М1 U. maritimus сочетает в себе как прогрессивные, так и примитивные черты, наряду с некоторыми уникальными, свойственными только этому виду особенностями. Это может объясняться “возвращением” от всеядного или травоядного типа питания (бурый медведь) к активному хищничеству, от которого медвежьи “отказались” в процессе эволюции.
Список литературы
Барышников Г.Ф., 2007. Медвежьи (Carnivora, Ursidae). (Фауна России и сопредельных стран. Млекопитающие. Т. I. Вып. 5). СПб.: Наука. 541 с.
Борисяк А.А., 1932. Новая раса пещерного медведя из четвертичных отложений Северного Кавказа // Труды Палеозоологического института. Т. 1. С. 137– 201.
Гимранов Д.О., 2018. Морфотипическая характеристика четвертых премоляров бурого (Ursus arctos) и белого (Ursus maritimus) медведей (Carnivora, Ursidae) // Зоологический журнал. Т. 97. № 2. С. 205–223.
Гимранов Д.О., Косинцев П.А., 2017. Морфотипическая изменчивость резцов бурого (Ursus arctos) и белого (Ursus maritimus) медведей (Carnivora, Ursidae) // Зоологический журнал. Т. 96. № 5. С. 547–562.
Barlow A., Paijmans Johanna L.A., Alberti F., Gasparyan B., Bar-Oz G., et al., 2020. Middle Pleistocene cave bear genome calibrates the evolutionary history of Palearctic bears // Current Biology. In press. https://ssrn.com/abstract=3523359 or https://doi.org/10.2139/ssrn.3523359
Baryshnikov G., 1998. Cave bears from the Paleolithic of the Greater Caucasus // Quaternary Paleozoology in the Northern Hemisphere. Saunders J.J., Styles B.W., Baryshnikov G.F., eds. Springfield: Illinois State Museum Scientific Papers. P. 69–118.
Baryshnikov G.F., 2010. Late Pleistocene brown bear (Ursus arctos) from the Caucasus // Russian Journal of Theriology. V. 9. № 1. P. 9–17.
Baryshnikov G.F., Puzachenko A.Y., 2019. Morphometry of upper cheek teeth of cave bears (Carnivora, Ursidae) // Boreas. V. 48. P. 581–604.
Bon C., Elalouf J.M., 2010. Cave Bear Genomics in the Paleolithic Painted Cave of Chauvet-Pont d’Arc // Evolutionary Biology – Concepts, Molecular and Morphological Evolution. Pontarotti P. eds. Berlin, Heidelberg: Springer. P. 343–356.
Bidon T., Janke A., Fain S.R., Eiken H.G., Hagen S.B., et al., 2014. Brown and polar bear Y chromosomes reveal extensive male-biased gene flow within brother lineages // Molecular Biology and Evolution. V. 31. P. 1353–1363.
Capasso Barbato L., Minieri M.R., Petronio C., Vigna Taglianti A., 1990. Strutture dentarie di Ursus arctos e di Ursus spelaeus della grotta di Monte Cucco (Sigillo, Perugia, Italia) // Bollettino della Societa Paleontologica Italiana. V. 29. № 3. P. 321–333.
Garcia N., Arsuaga J.L., 2001. Ursus dolinensis: a new species of Early Pleistocene ursid from Trinchera Dolina, Atapuerca (Spain) // Earth and Planetary Sciences. V. 332. P. 717–725.
Grandal d’Anglade A., 1993. El Oso de las cavernas en Galicia: El yacimiento de Cova Eiros // Nova Terra. V. 8. P. 1–285.
Hailer F., Kutschera V.E., Hallström B.M., Klassert D., Fain S.R., et al., 2012. Nuclear genomic sequences reveal that polar bears are an old and distinct bear lineage // Science. V. 336. P. 344–347.
Hammer O., Harper D.A.T., Ryan P.D., 2001. Paleontological Statistics Software Package for Education and Data Analysis // Palaeontologia Electronica. V. 4. № 1. P. 1–9.
Hirata D., Mano T., Abramov A.V., Baryshnikov G.F., Kosintsev P.A., et al., 2013. Molecular phylogeography of the brown bear (Ursus arctos) in Northeastern Asia based on analyses of complete mitochondrial DNA sequences // Molecular Biology and Evolution. V. 30. P. 1644–1652.
Jiangzuo Q., Liu J., Chen J., 2019. Morphological homology, evolution, and proposed nomenclature for bear dentition // Acta Palaeontologica Polonica. V. 64. № 4. P. 693–710.
Jiangzuo Q., Liu J., Wang Y., Jin C., Liu S., et al., 2017. New materials of Ursus etruscus from Jinyuan cave of Luotuo Hill, Dalian and a brief review of Ursus cf. etruscus in China // Quaternary science. V. 37. № 4. P. 828–837.
Koufos G.D., Konidaris G.E., Harvati K., 2018. Revisiting Ursus etruscus (Carnivora, Mammalia) from the Early Pleistocene of Greece with description of new material // Quaternary International. V. 497. P. 222–239.
Krause J., Unger T., Noçon A., Malaspinas A.-S., Kolokotronis S.-O., 2008. Mitochondrial genomes reveal an explosive radiation of extinct and extant bears near the Miocene-Pliocene boundary // BMC Evolutionary Biology. V. 8. P. 1–12.
Kurtén B., 1968. Pleistocene mammals of Europe. Weidenfeld ans Nicolson, London. 317 p.
Marciszak A., Schouwenburg C., Lipecki G., Talamo S., Shpansky A., et al., 2019. Steppe brown bear Ursus arctos “priscus” from the Late Pleistocene of Europe // Quaternary International. V. 534. P. 158–170.
Marciszak A., Stefaniak K., Mackiewicz P., Ridush B., 2015. Ursus arctos L., 1758 from Bukovynka Cave (W Ukraine) in an overview on the fossil brown bears size variability based on cranial material // Quaternary International. V. 357. P. 136–148.
Mazza P., Rustioni M., 1992. Morphometric revision of the Eurasian species Ursus etruscus Cuvier // Palaeontographia Italica. V. 79. P. 101–146.
Medin T., Martínez-Navarro B., Madurell-Malapeira J., Figueirido B., Kopaliani G., et al., 2019. The bears from Dmanisi and the first dispersal of early Homo out of Africa // Scientific Reports. V. 9. № 17752. https://doi.org/10.1038/s41598-019-54138-6
Medin T., Martínez-Navarro B., Rivals F., Madurell-Malapeira J., Ros-Montoya S., et al., 2017. Late Villafranchian Ursus etruscus and other large carnivorans from the Orce sites (Guadix-Baza basin, Andalusia, southern Spain): Taxonomy, biochronology, paleobiology, and ecogeographical context // Quaternary International. V. 431 B. P. 20–41.
Petrucci M., Sardella R., 2009. Ursus etruscus Cuvier, 1823 from the Early Pleistocene of Monte Argentario (Southern Tuscany, Central Italy) // Bollettino della Societa Paleontologica Italiana. V. 48. № 2. P. 89–94.
Rabeder G., 1999. Die Evolution des Höhlenbärengebisses // Mitteilungen der kommission für quartärforschung der österreichischen akademie der Wissenschaften. V. 11. P. 1–102.
Rabeder G., Pacher M., Withalm G., 2009. Early Pleistocene bear remains from Deutsch-Altenburg (Lower Austria) // Mitteilungen der kommission für quartärforschung der österreichischen akademie der Wissenschaften. V. 17. P. 1–135.
Slater G.J., Figueirido B., Louis L., Yang P., Van Valkenburgh B., 2010. Biomechanical consequences of rapid evolution in the polar bear lineage // PLoS One. V. 5. № 11: e13870.
Sotnikova M.V., Nikolskiy P., 2006. Systematic position of the cave lion Panthera spelaea (Goldfuss) based on cranial and dental characters // Quaternary International. № 3. P. 218–228.
Szuma E., 2007. Geography of dental polymorphism in red fox Vulpes vulpes and its evolutionary implications // Biological Journal of the Linnean Society. V. 90. P. 61–84.
Szuma E., 2011. Ecological and evolutionary determinants of dental polymorphism in the arctic fox Vulpes (Alopex) lagopus // Annales Zoologici Fennici. V. 48. P. 191–213.
Tedford R.H., Wang X., Taylor B.E., 2009. Phylogenetic systematics of the North American fossil Caninae (Carnivora: Canidae) // Bulletin of the American Museum of Natural History. V. 325. P. 1–218.
Wagner J., 2010. Pliocene to early middle Pleistocene ursine bears in Europe: a taxonomic overview // Journal of the National Museum. Natural History Series. V. 179. P. 197–215.
Wagner J., Cermak S., 2012. Revision of the early Middle Pleistocene bears (Ursidae, Mammalia) of Central Europe, with special respect to possible co-occurrence of spelaeoid and arctoid lineages // Bulletin of Geosciences. V. 87. P. 461–496.
Wagner J., Čermák S., Horáček I., 2011. The presence of Ursus ex gr. minimus-thibetanus in the Late Villányian and its position among the Pliocene and Pleistocene black bears in Europe // Quaternaire. Hors-série. V. 4. P. 39–58.
Wang X., Rybczynski N., Harington C., White S., Tedford R., 2017. A basal ursine bear (Protarctos abstrusus) from the Pliocene High Arctic reveals Eurasian affinities and a diet rich in fermentable sugars // Scientific Reports. V. 7. № 1. https://doi.org/10.1038/s41598-017-17657-8
Wolsan M., 1988. Morphological variations of the ferst upper molar in the genus Martes (Carnivora, Mustelidae) // Memoirs du Museum National d’Histoire Naturelle (France). Serie C. Sciences de la Terre. V. 53. P. 241–254.
Wolsan M., 1989. Dental polymorphism in the genus Martes (Carnivora: Mustelidae) and its evolutionary significance // Acta Theriologica. V. 34. P. 545–593.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


