Зоологический журнал, 2021, T. 100, № 7, стр. 723-744
Материалы по фауне и экологии коловраток Урала. Семейство Trichocercidae (Rotifera, Eurotatoria, Ploima). Рода Ascomorphella, Trichocerca
А. Г. Рогозин *
Южно-Уральский Федеральный научный центр Минералогии
и Геоэкологии Уральского отделения РАН
456317 Челябинская обл, Миасс, Россия
* E-mail: rogozin57@gmail.com
Поступила в редакцию 15.05.2020
После доработки 16.07.2020
Принята к публикации 24.07.2020
Аннотация
Обобщен материал по распространению на Урале родов коловраток (Rotifera) из семейства Trichocercidae на основе исследований автора и анализа литературных источников. Указаны места находок, приведены данные по морфологии, биологии, количественному развитию и индикаторным свойствам видов в водоемах Урала.
Настоящая работа – дальнейшее обобщение материала по коловраткам отряда Ploima на Урале. Она продолжает сведение в единое целое накопленных за столетие данных по фауне и экологии Rotifera Урала на основе материалов, опубликованных в период с 1910 г. по настоящее время, а также собственных исследований автора, проведенных на водоемах Южного Урала и Зауралья с 1986 по 2019 г. В предыдущих работах (Рогозин, 2018, 2019, 2020) было рассмотрено семейство Brachionidae. В настоящей статье рассматривается еще одно крупное семейство – Trichocercidae Harring 1913. Для тех видов, по которым у нас было достаточно количественных данных для расчетов, приведены индивидуальная индикаторная значимость и индикаторный вес (последний можно рассматривать также как показатель стено-/эврибионтности, Рогозин, 2018б), характеризующие особенности биологии видов (отношение к температуре воды (Рогозин и др., 2015), сапробности (Рогозин, 2018а) и трофическому типу водоема (Рогозин, 2018б)). Полученные на местном материале, эти данные наиболее объективны в региональных географических условиях. В случае отсутствия подобных сведений использованы литературные данные, применимость которых, конечно, более ограничена.
В семейство Trichocercidae в настоящее время входят 3 рода – Ascomorphella Wiszniewski 1953, Trichocerca Lamarck 1801 и Elosa Lord 1891 (Кутикова, 1970; Shiel, Koste, 1992), первые два встречаются в водоемах Урала.
Род Ascomorphella Wiszniewski 1953. Монотипический род с единственным представителем – A. volvocilola (Plate 1886 ).
Ascomorphella volvocilola (Plate 1886 )
До сих пор единственная находка вида в одном экземпляре сделана Опариной (1923) в оз. Песчаном в прибрежье Камы (окрестности Перми). Обнаружен в колониальной водоросли Volvox globator L. 1758. Общая длина особи 138 мкм.
Один из немногих паразитических видов коловраток, обитает в вольвоксах. Специфика местообитания может служить объяснением исключительной редкости находок A. volvocilola в регионе. Как отметил Кирк (Kirk, 1998), успешное внедрение и размножение коловратки в колонии водоросли (в развивающихся весной ооспорах) требует высокой численности вольвокса в конкретном водоеме в течение очень долгого времени. Это, как правило, не реализуется в уральских водоемах, здесь вольвоксы хотя и широко распространены, но малочисленны и довольно редко встречаются. Не способствует успеху A. volvocilola и слишком короткий вегетативный сезон. В более южных регионах эта коловратка способна существенно влиять на популяции Volvox (Ganf et al., 1983).
Сладечеком (Sládeček, 1983) отнесен к бетамезосапробам (индивидуальный сапробный индекс 1.5).
A. volvocilola распространен во всех зоогеографических зонах, кроме Антарктики и Пацифики. В России известен из многих, преимущественно западных регионов.
Род Trichocerca Lamarck 1801. Обширный род включает более сотни видов, из которых на Урале обнаружено 25. Два из них – T. gracilis (Tessin 1890) и T. sejunctipes (Gosse 1886) – в настоящее время считают species inquirenda (Segers, 2007).
Trichocerca bicristata (Gosse 1887)
Две находки на Урале сделаны в оз. Песчаное и р. Курья в прибрежье Камы (Опарина, 1923) и в пойменных озерах Камы (Вершинин, 1953). Оценка численности дана вербально: “немного” и “единичные экземпляры”. Встречался в июле и августе. По замерам Опариной длина тела 289, ширина 120 мкм, длина левого пальца ноги 240 мкм, что соответствует средним значениям для вида.
Обитатель зарослей водной растительности, детрита и песка, изредка встречается в планктоне (Кутикова, 1970). По другим данным – пелагический вид (Morales-Baquero et al., 1989). В небольших заросших водоемах может достигать высокой численности и может быть доминирующим видом (Green, 2001). Очевидно, эвритермный, встречается при температуре от 8 до 24.5°С (Shiel, Koste, 1992). Об этом же свидетельствуют находки вида на широте Полярного Урала на п-ве Ямал (Богданов и др., 1997). По некоторым сведениям (Xue et al., 2014), предпочитает эвтрофные воды, богатые биогенными веществами. По данным Сладечека (Sládeček, 1983), олигосапроб (1.0) с высоким индикаторным весом.
Вид распространен по всей территории России. Встречается во всех зоогеографических областях, кроме Антарктики.
Trichocerca bidens (Lucks 1912)
Вид был неоднократно встречен в озерах Ильменской группы на Южном Урале в предгорьях Ильменского хребта (Аргаяш, Большой Кисегач, Большое Миассово, Сириккуль и др.) экспедициями А.О. Таусон и Н.В. Бондаренко, эти данные относятся к концу 1930-х гг. и не были опубликованы. Кутикова (1970) упоминает этот вид для Челябинской обл., но литературный источник, которым она пользовалась, установить не удалось. В опубликованных материалах этот вид указан для Среднего Предуралья (р. Кама и пойменные озера – Таусон, 1946, 1947; Вершинин, 1953). Во всех случаях были обнаружены единичные особи. Наша единственная находка T. bidens сделана в оз. Большое Миассово. Размеры: длина тела 180–186, длина пальцев ноги 52–55 мкм. Вид встречался в пелагиали в июле в верхнем слое воды (0–10 м), прогретом до 22ºС. Плотность популяции 600–800 экз./м3.
Обитатель торфяных болот и неглубоких заросших и заболоченных водоемов (Кутикова, 1970). Может быть приурочен к зоне сапропелей в небольших озерах глубиной до 11 м (Jersabek, 1995) или к речным илистым отложениям с суглинком и макрофитным детритом на мелководье (Ермолаева, 2015). По-видимому, эвритермный вид, поскольку встречается в больших количествах как в относительно холодных (8–12°С), так и прогретых свыше 30°С водах (Chittapun et al., 2007). Эврибионтен также по отношению к концентрации кислорода и рН воды (Jersabek, Bolortsetseg, 2010). Как показали исследования высокогорных водоемов Мексики, вид индифферентен к содержанию биогенных веществ и мутности (Muñoz-Colmenares, Sarma, 2017). Сладечеком (Sládeček, 1983) отнесен к олигобетамезосапробам (1.3) с хорошим индикаторным весом.
В России распространен по всей территории. Встречается во всех зоогеографических областях, кроме Антарктики.
Trichocerca brachyura (Gosse 1851)
Первая находка на Урале – в мелководном заросшем оз. Черненькое в предгорьях Ильменского хребта на Южном Урале (неопубликованные данные А.О. Таусон, 1937 г.). В дальнейшем был встречен в Предуралье в р. Кама (Таусон, 1946, 1947) и на Среднем Урале в оз. Шарташ (Балабанова, 1949).
Обитатель мелких заросших водоемов, болот, псаммона (Кутикова, 1970). Может быть доминантом в сообществах коловраток эвтрофных водоемов с низкой прозрачностью (Geng et al., 2005). Тем не менее Сладечеком (Sládeček, 1983) отнесен к олигосапробам (1.1) с высоким индикаторным весом, что может быть связано с приуроченностью к болотным водам. Проточность, по-видимому, отрицательно влияет на развитие T. brachyura (Czerniawski, Domagała, 2010).
Распространен на всей территории России. Встречается во всех зоогеографических областях Земли.
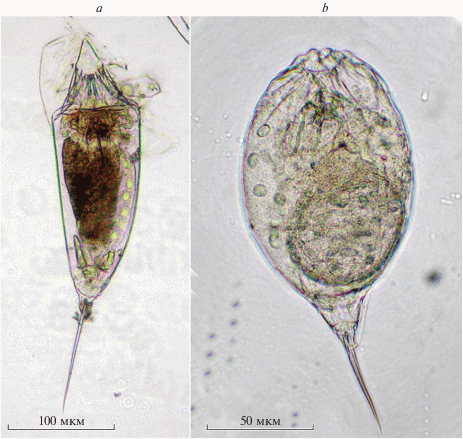
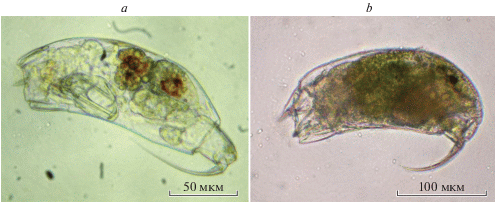
Trichocerca capucina (Wierzejski et Zacharias 1893) (рис. 1a)
Рис. 1.
Trichocercidae из южноуральских водоемов: a – Trichocerca capucina (Wierzejski et Zacharias 1893) из оз. Еловое, b – T. dixonnuttalli (Jennings 1903) из оз. Малый Теренкуль.
Первые и весьма многочисленные находки вида в южноуральских озерах Каслинской и Ильменской групп (Акакуль, Алабуга, Аргаяш, Большие Касли, Большое и Малое Миассово, Киреты, Сунгуль, Увильды и др.) относятся к началу прошлого века (Фурман, Тиебо, 1910). Они были впоследствии неоднократно подтверждены (Масленникова, 1941; Подлесный, Троицкая, 1941; Рогозин, 2009). Встречен и в водоемах лесостепного Зауралья (Макарцева, 1978; Огородникова, 1977). Самая южная находка на Урале – в р. Урал в степных районах Оренбуржья (Муравейский, 1923; Акатова, 1954). Достаточно много находок на Среднем Урале и в Предуралье, особенно в р. Кама и озерах ее бассейна (Балабанова, 1949; Красновская, 1949; Таусон, 1934, 1946 и др.).
Размеры по нашим данным: длина тела 370–398, левого пальца ноги 110–115, правого 33–37 мкм. Опарина (1923) приводит длину тела 260, левого пальца 80 мкм.
Планктонный вид, встречающийся в пелагиали и фитали (Кутикова, 1970). Наши данные с этим согласуются: хотя коловратка встречалась и в небольших заросших водоемах, основное местообитание на Урале – пелагиаль крупных озер. По всему массиву данных (более 560 проб) встречаемость T. capucina составляет 10%, в том числе в пелагиали – более 80%. Теплолюбивый вид, как и большинство Trichocerca (Segers, 2003), что подтверждают наши данные по уральским водоемам (Рогозин и др., 2015). Trichocerca capucina – термобионт (2.4), крайне редко встречающийся в холодных водах (с температурой не ниже 8°С). Поэтому и на Урале, и в других регионах Земли с умеренным климатом является “летним” видом (Herzig, 1987), в очень холодных и медленно прогреваемых водоемах может достигать максимума развития осенью (Makarov et al., 2019). В исследованных нами озерах Южного Урала T. capucina в подавляющем большинстве случаев встречалась в июле и августе, в период максимального прогрева воды и лишь изредка – в июне и сентябре. В исследованных нами глубоких озерах (свыше 20 м) T. capucina концентрировалась преимущественно в верхних наиболее теплых слоях воды (0–10 м), никогда не опускаясь ниже глубины 15 м. Подобные же результаты получены и в более теплых регионах планеты (Baloch et al., 1998). Это подтверждает характеристику коловратки как эпилимнического вида (Matveeva, 1986) и соответствует свойствам термобионта, обитающего в умеренном климате. Что касается других свойств вида, то T. capucina стенобионтный галофоб, избегающий минерализации более 200 мг/дм3 (Bielańska-Grajner, Cudak, 2014).
Наибольшая плотность популяции – 14.5 тыс. экз./м3 при биомассе 0.103 г/м3 – отмечена в оз. Большое Миассово в восточных предгорьях Ильменского хребта на Южном Урале в августе. Средняя же численность T. capucina невелика и составляет 1930 ± 872 экз./м3, часто не превышая 1 тыс. экз./м3. Большинство уральских авторов оценивают численность T. capucina по глазомерной шкале как “немного” или “единично” (Масленникова, 1941; Макарцева, 1978 и др.), в отдельных случаях отмечают массовое размножение в конце лета (озеро Аргаяш, Макарцева, 1978). Малочисленность может объясняться разными причинами. Во-первых, тем, что это – хищная коловратка (питается, высасывая яйца других планктонных коловраток, Schmidt-Rhaesa, 2014), и в силу специфики питания не достигает массового развития. Во-вторых, стенобионтость с ярко выраженным предпочтением хорошо прогретых вод сильно укорачивает длительность вегетации в холодных уральских водоемах и не позволяет T. capucina достигать высокой численности. В-третьих, вид пелагический, предпочитающий относительно крупные водоемы, а в них пелагиаль в уральском климате прогревается особенно медленно. Первая причина, очевидно, основная, т.к. постоянно низкая численность T. capucina отмечена и в теплых, круглогодично прогретых водах (Ramírez García et al., 2002).
Согласно нашим данным T. capucina мезотрофный вид (индивидуальный индекс 1.3) с довольно высоким показателем стенобионтности (3.62). Это отличается от материалов ряда авторов, считающих Trichocerca, в том числе и T. capucina приуроченными к эвтрофным водам (Ruttner-Kolisko, 1974; Bērziņš, Pejler, 1989; Geng et al., 2005). Такое противоречие может быть связано как с более точным методом количественного определения индикаторных свойств (Рогозин и др., 2015; Рогозин, 2018б) в отношении трофности водоема, так и с различиями этих свойств в разных природно-географических зонах. Несмотря на теплолюбивость и, следовательно, встречаемость в период наибольшей продуктивности водоемов, вид в условиях Урала устойчиво приурочен к олиго- и мезотрофным озерам. Выявленные нами сапробные свойства T. capucina кардинально отличаются от данных Сладечека по Европе. Сладечек (Sládeček, 1983) относит вид к олигосапробам (1.2) с высоким индикаторным весом, на Урале он показывает себя как бетаальфамезосапроб (2.1), тяготеющий к умеренно загрязненным водам. Особенного противоречия с мезотрофностью вида здесь нет, поскольку сапробность не является полным аналогом трофности, хотя эти понятия иногда используются как синонимы (Шитиков и др., 2003). Противоречие с данными Сладечека по сапробности достаточно характерно для данных по водоемам Урала и уже обсуждалось нами в отдельной работе (Рогозин, 2018а).
Вид известен на всей территории России. Встречается во всех зоогеографических областях, кроме Пацифики и Антарктики.
Trichocerca cavia (Gosse 1886)
Вид упомянут в монографии Кутиковой (1970) как встречающийся в Челябинской области (Южный Урал), однако первоначальный источник сведений обнаружить не удалось, авторство, место и время той находки пока неизвестны. Второй и пока последний раз T. cavia на Урале была обнаружена нами в заросшем мелководном оз. Большой Таткуль (восточные предгорья Ильменского хребта на Южном Урале) в прибрежной зоне среди роголистника, урути и элодеи. Размеры: длина тела 90–117, длина пальцев ноги 30–35 мкм. Данных о количественном развитии нет, встречались единичные особи.
Литературные данные по биологии T. cavia скудны. Как и многие другие виды рода, обитает преимущественно в заросших, заболоченных водоемах, часто среди погруженных мхов, иногда встречается в планктоне; в зарослевых участках может быть весьма многочисленным (Ejsmont-Karabin, 1995). Согласно данным Сладечека (Sládeček, 1983) – хороший индикатор олигобетамезосапробности.
Известен во многих регионах России от Центра до Восточной Сибири. Встречается во всех зоогеографических областях, кроме Пацифики и Антарктики.
Trichocerca collaris (Rousselet 1896)
Единственное упоминание о находке вида на Урале имеется в рукописном отчете студента МГУ Н.В. Бондаренко (1938 г.), работавшего на Ильменском озере (предгорья Ильменского хребта на Южном Урале, окрестности г. Миасс). Ссылка на него приводится в монографии автора (Рогозин, 1995). Trichocerca collaris известен во многих водоемах Центральной России, в Поволжье, на Крайнем Севере. Как и предыдущий, этот вид – обитатель заросших водоемов и болот, где встречается среди микроводорослевых матов, мхов (Riccia, Sphagnum). По-видимому, эвритермный (диапазон от 8 до 28°С) и встречается, например, как в низовьях Енисея (Грезе, 1957), так и в верховьях Нила (Iskaros et al., 2008). Обычно приурочен к кислым водам (с pH до 3.7) (Pejler, Bērziņš, 1993; Jersabek, Bolortsetseg, 2010). Как и многие другие “болотные” виды – олигобетамезосапроб (Sladeček, 1983).
Известен во многих регионах России от Центра до Восточной Сибири. Встречается во всех зоогеографических областях, кроме Пацифики и Антарктики.
Trichocerca cylindrica (Imhof 1891)
Первые находки в южноуральских озерах Каслинской группы (Аргаяш, Большие Касли, Киреты) относятся к началу прошлого века (Фурман, Тиебо, 1910). Впоследствии вид обнаружили и в других озерах восточных предгорий Южного Урала – Аракуль, Большое и Малое Миассово (Драбкова, Сорокин, 1979; Любимова, 1981; Макарцева, 1978; Рогозин, 1995), а также многих других водоемах Ильменской группы (рукописные материалы А.О. Таусон, Н.В. Бондаренко и др.). Встречен и в озерах лесостепного Зауралья –Кундравинском (Козлова, 1966), Смолино (Речкалов, Марушкина, 2005), Аргазинском водохранилище на р. Миасс (Козлова, Шилкова, 1966) и в степных водоемах (Любимова, 1975). Самое южное обнаружение на Урале – в р. Урал в степных районах Оренбуржья (Акатова, 1954). Достаточно много находок на Среднем Урале и в Предуралье, особенно в р. Кама и озерах ее бассейна (Таусон, 1934, 1935, 1946; Вершинин, 1953). Самая северная точка, где встречена T. cylindrica на Урале, – притоки Нижней Оби (Богданов и др., 2005). Размеры по нашим данным: длина тела 300–320, левого пальца ноги 250–262, правого 18–22 мкм.
Планктонный вид, обитающий также в зоне фитали (Кутикова, 1970). Встречаемость по всему массиву наших проб в озерах Южного Урала составляет менее 1.5%, а из них в пелагиали озер – 75%. Биология вида сходна с рассматривавшимся выше T. capucina. Термобионт (2.4), приуроченный к периоду максимального прогрева воды (август–начало сентября), при этом держится в эпилимнионе, не опускаясь ниже 10 м глубины, или в мелководных заливах. Отмечена обратная зависимость среднесуточной численности T. cylindrica от температуры воды (Ермолаева и др., 2016). Несмотря на выраженную теплолюбивость T. cylindrica, в настоящее время принято считать, что субтропических и тропических регионах встречается его вид-двойник T. chattoni (de Beauchamp 1907), а T. cylindrica “холодноводный” (так в источнике – Segers, 2003), хотя правильнее считать его тепловодным, но приуроченным к водоемам умеренного климата.
Мяэметс (Mäemets, 1983) для эстонских озер, а вслед за ним и Андроникова (1996) по совокупности литературных данных относят T. cylindrica к индикаторным эвтрофным видам. По нашим данным, T. cylindrica – типичный мезотрофный вид с индивидуальным трофическим индексом 1.0 и наибольшей индикаторной значимостью (5.0), т.е. является стенобионтом. Хотя в подавляющем большинстве работ не приводятся количественные данные по T. cylindrica, лишь одна из зарегистрированных на Урале встреч T. cylindrica (включая неопубликованные материалы) относится к эвтрофным водоемам, остальные встречи – к мезо- и олигомезотрофным водоемам. Следовательно, на Урале T. cylindrica не может считаться не только индикатором эвтрофии, но и вообще видом, предпочитающим эвтрофные условия. Спорность эвтрофного индикаторного статуса T. cylindrica обсуждалась и ранее (Pejler, Bērziņš, 1993).
Индивидуальный сапробный индекс T. cylindrica по нашим данным 1.4 (с индикаторной значимостью 3.62. Это согласуется с приводимыми Сладечеком (Sládeček, 1983) – 1.2 и 4 соответственно.
Согласно нашим данным, наибольшая численность T. cylindrica 1.6 тыс. экз./м3, средняя за сезон – 1200 ± 210 экз./м3, вид встречался только в августе и сентябре при наибольшем прогреве воды. Летне-осенний максимум в развитии вида (при сходных количественных показателях) отмечен и в озерах Северной Америки (Stemberger et al., 1979), и в северной Индии (Irfan et al., 2013).
Питается водорослями, преимущественно золотистыми (Barrabin, 2000), и яйцами других планктонных коловраток (Schmidt-Rhaesa, 2014).
В озерах Южного Урала T. cylindrica иногда бывает одним из основных видов планктона. Любимова (1981) приводит 60% встречаемость вида в олиготрофном оз. Аракуль (восточные предгорья Южного Урала) при биомассе в среднем за сезон 0.003 г/м3. Согласно ее же данным (Любимова, 1975), T. cylindrica – один из массовых видов в прудах Чесменского рыбхоза в лесостепной зоне на юге Челябинской обл. Trichocerca cylindrica – одна из руководящих форм планктона в оз. Аргаяш (предлесостепное Зауралье) по материалам ленинградских гидробиологов (Макарцева, 1978; Драбкова, Сорокин, 1979). Большей частью вид малочислен (600–900 экз./м3), и наибольшего развития в уральских озерах достигает только в конце лета (Козлова, 1966; Козлова, Шилкова, 1966). То что T. cylindrica нередко имеет очень высокую встречаемость при низкой численности, отмечали и зарубежные исследователи (Stanachkova et al., 2017).
Известен во многих регионах России от Карелии до Дальнего Востока. Встречается во всех зоогеографических областях, кроме Пацифики и Антарктики.
Trichocerca dixonnuttalli (Jennings 1903) (рис. 1b)
Впервые отмечен в озерах восточных предгорий Южного Урала Ильменское и Малое Миассово в середине 1930-х гг. экспедицией А.О. Таусон (как Diurella inermis; данные не опубликованы), а затем в нижнем течении р. Урал (Акатова, 1954), собственно, уже за пределами Урала даже в его широком понимании. Мы встречали этот вид в предгорьях Ильменского хребта в планктоне озер Большое Миассово (Рогозин, 1995, упомянут как T. inermis) и Малый Теренкуль (Рогозин, 2009а). Размеры по нашим данным: длина тела 89–113, левого пальца ноги 38–48, правого 23–27 мкм.
Немногочисленные данные по двум озерам не позволяют сделать обоснованные выводы о биологии вида. Он встречался только в летние месяцы или в начале осени (с июня по начало сентября). Численность колебалась от 300 до 24 тыс. экз./м3 и была максимальной в июле в литорали. Учитывая сезон встречаемости и трофические типы озер, можно предполагать термофильные свойства T. dixonnuttalli и приуроченность к мезоэвтрофным водам. По совокупности имеющихся данных мы можем отнести T. dixonnuttalli к бетамезосапробам, тогда как по Сладечеку (Sládeček, 1983) – это ярко выраженный олигосапроб. По литературным данным, встречается в водоемах от ультраолиготрофных до эвтрофных, как среди растительности, так и в пелагиали (Jersabek, Bolortsetseg, 2010), а также в псаммоне и во мху (Кутикова, 1970; Набережный, 1984).
Широко распространен на территории европейской части России и на Северном Кавказе. По-видимому, отсутствует или редок восточнее Урала. Встречается во всех зоогеографических областях, кроме Пацифики и Антарктики.
Trichocerca elongata (Gosse 1886) (рис. 2a)
Рис. 2.
Trichocercidae из южноуральских водоемов: a – Trichocerca elongata (Gosse 1886) из оз. Большой Еланчик, b – T. longiseta (Schrank 1802) из Миньярского пруда на р. Сим.
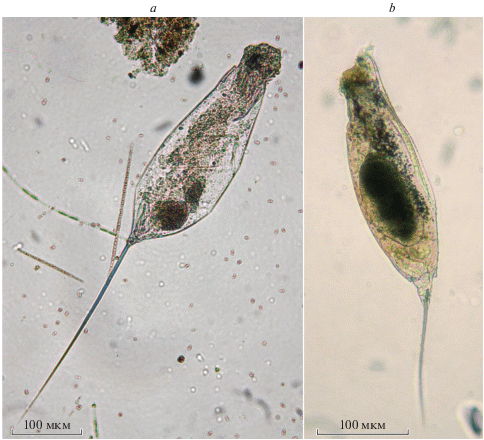
Впервые найден в Среднем Приуралье в окрестностях Перми (Оборинский пруд, Опарина, 1923), в дальнейшем в Каме (Таусон, 1946) и озерах ее поймы (Вершинин, 1953), в озерах восточных предгорий Южного Урала Большой Кисегач, Сириккуль, Черненькое (данные А.О. Таусон и Н.В. Бондаренко конца 1930-х гг., не опубликованы), Большое и Малое Миассово, Большой Еланчик (данные автора). Найден также в реках Урал (Акатова, 1954) и Миасс (Шершневское водохранилище, данные автора). Самое северное нахождение – в притоках Нижней Оби (Богданов и др., 2004). Размеры по нашим данным: длина тела 357–395, левого пальца ноги 280–300, правого – 55–59 мкм. Опарина (1923) приводит длину тела 340, левого пальца 272 мкм.
Обитатель прибрежий водоемов, преимущественно фитали, часто среди нитчатых водорослей, водных мхов, полупогруженных макрофитов (Кутикова, 1970; Jersabek, Bolortsetseg, 2010). По нашим данным, стенобионтный термофильный вид (2.1), встречающийся в теплое время года в прогретых водах (с июля по сентябрь). Отмечена обратная зависимость среднесуточной численности T. elongata от температуры воды (Ермолаева и др., 2016). Как показали мексиканские исследователи, температурный режим действует на T. elongata кумулятивно с концентрацией растворенного кислорода и хлорофилла а (Contreras et al., 2009). Помимо температуры воды, существенное значение для T. elongata имеет водородный показатель (рН), причем только при обитании в литоральной зоне; в пелагиали значимыми оказываются концентрации нитратов и фосфатов (Vázquez-Sánchez et al., 2014). Это совпадает с данными китайских исследователей, отмечавших предпочтение T. elongata богатых биогенными веществами озер (Xue et al., 2014). По-видимому эвригалинный вид, встречающийся помимо пресных и даже ультрапресных (исследованные озера Урала) в соленых водах (Saygi et al., 2011). Питается зелеными нитчатыми водорослями (Oedogoniales), возможно, монофаг (Pourriot, 1970).
Согласно нашим данным, T. elongata относится к стенобионтным мезотрофным видам (индивидуальный трофический индекс 1.0), по отношению к органическому загрязнению воды – бетамезосапроб (1.8). Здесь обнаруживается существенное отличие от данных по Центральной Европе (Sládeček, 1983), где коловратка проявляет себя как олигосапроб (1.0).
Наибольшая численность популяции T. elongata отмечена в сентябре в мезотрофном оз. Большой Еланчик – 12 тыс. экз./м3. В основном этот показатель колебался между 400 и 2 тыс. экз./м3. Как и другие виды рода, вид обычно немногочислен, очевидно, ввиду достаточно узкого экологического диапазона и специфики питания. В более теплом климате эта коловратка может быть одним из доминирующих видов планктона, причем в эвтрофных водах (Xue et al., 2014), где она демонстрирует хорошую устойчивость к выеданию планктоядными рыбами (Yoshida et al., 2003).
Известен по всей территории России. Встречается во всех зоогеографических областях, кроме Пацифики и Антарктики.
Trichocerca gracilis (Tessin 1890)
Известны две находки на Урале – в р. Кама (Таусон, 1946) и в озерах ее поймы (Вершинин, 1953). В настоящее время большинством исследователей признано, что T. gracilis – species inquirenda ввиду неудовлетворительного описания (Segers, 2007). Установить, с каким из валидных видов имели дело А.О. Таусон и Н.В. Вершинин, пока не представилось возможным. Тем не менее, мы приводим упоминание о T. gracilis, т.к. будущие исследования рано или поздно позволят ответить на этот вопрос.
Trichocerca iernis (Gosse 1887)
На Урале известны две находки этого вида – в Приуралье в р. Кама (Таусон, 1947) и на Среднем Урале в оз. Шарташ в Екатеринбурге (Балабанова, 1949). Данные о количественном развитии не приводятся.
Обитатель водной растительности (Кутикова, 1970), в частности роголистника (Green et al., 1984) и пузырчатки (Jersabek, Bolortsetseg, 2010). В летнее время может достигать значительной численности, более 300 тыс. экз./м3 (Gürbüzer et al., 2017). Хотя вид признан эвритермным (Jersabek, Bolortsetseg, 2010), на распространение и развитие популяций T. iernis положительное влияние оказывают температура воды, а также сравнительно высокая минерализация и щелочные условия (рН до 8.76 – Jersabek, Bolortsetseg, 2010), в то же время он избегает вод с высоким содержанием биогенных веществ (Adamczuk et al., 2015). По другим данным коловратка предпочитает неглубокие богатые растворенным органическим веществом водоемы (Arimoro, Oganah, 2010). Олигосапроб (Sládeček, 1983).
Имеет космополитическое распространение, и не найден только в Антарктиде. В России известен в основном западнее Урала. Редкость находок на Урале, скорее всего, связана с малой изученностью фитали большинства даже хорошо исследованных водоемов.
Trichocerca longiseta (Schrank 1802) (рис. 2b)
Первые находки вида сделаны еще в 1923 г. в Приуралье в озерах Источное, Осиновое, Песчаное и в р. Юрчим в Пермском крае (Опарина, 1923). Впоследствии обнаружен в р. Кама (Таусон, 1947) и пойменных озерах ее среднего течения (Вершинин, 1953). В южном Приуралье встречен в р. Урал (Акатова, 1954). На Южном Урале найден в озерах восточных предгорий (Большое Миассово – Рогозин, 1995; Большой Ишкуль, Тургояк – неопубликованные данные автора), а в западных предгорьях – в Миньярском пруду на р. Сим (Рогозин, 2007). Распространяется вплоть до Полярного Урала (озера восточного макросклона и притоки Нижней Оби – Богданов и др., 2004, 2005). Размеры по нашим данным: длина тела 221–355, передних шипов – 13–18 и 46–49, левого пальца – 112–186, правого пальца 22–26 мкм. Опарина (1923) приводит длину тела 306, левого пальца – 170, переднего наибольшего шипа – 51 мкм.
Как и большинство других видов рода – житель фитали в прибрежной зоне водоемов, псаммона, реже встречается в планктоне (Кутикова, 1970). Рядом исследователей считается перифитонным видом, обитает среди зеленых нитчатых водорослей, сфагновых мхов, ила и крупнозернистого детрита в стоячих и текучих водах (Jersabek, Bolortsetseg, 2010). По данным некоторых исследований, T. longiseta сохраняет одинаково высокое обилие и в пелагической области, и среди макрофитов при инвазии последних в зону открытой воды (Sipaúba-Tavares et al., 2017). Предпочитает хорошо прогретые воды с щелочной реакцией и высоким содержанием растворенного кислорода (Duggan et al., 1998).
Единичные находки не позволяют дать заключение об экологии вида в Уральском регионе. В работах уральских гидробиологов количественные данные о нем отсутствуют. Согласно литературным данным, T. longiseta эвритермный, эвригалинный вид (Jersabek, Bolortsetseg, 2010), обитающий в чистых водах (олигосапроб по: Sládeček, 1983). В наших пробах численность коловратки составляла от 50 до 1.1 тыс. экз./м3. Вид может достигать высокой плотности популяции и выступать в качестве субдоминанта в зоопланктонных сообществах (Kim, Joo, 2000).
Распространен по всей территории России. Сравнительная редкость находок на Урале связана, как и в случаях с другими Trichocerca, со слабой изученностью населяемых биотопов и относительной малочисленностью. Встречается во всех зоогеографических областях Земли, кроме Антарктики.
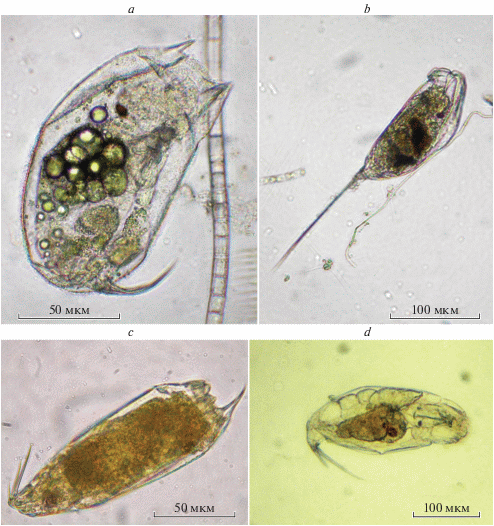
Trichocerca porcellus (Gosse 1886) (рис. 3a)
Рис. 3.
Trichocercidae из южноуральских водоемов: a – Trichocerca porcellus (Gosse 1886) из Аргазинского водохранилища на р. Миасс, b – T. rattus f. carinata (Ehrenberg 1830) из оз. Сугояк, c – T. similis (Wierzejski 1893) из оз. Большой Еланчик, d – T. tenuior (Gosse 1886) из р. Малый Кизил.
Первые находки вида сделаны в начале 1920-х гг. в озерах Дикое, Источное, Ласьвинское бассейна р. Кама (Опарина, 1923). Несколько позже был обнаружен в р. Кама и ее пойменных озерах (Таусон, 1946, 1947; Вершинин, 1953). В конце 1930-х гг. благодаря рыбохозяйственным исследованиям гидробиологов на озерах Уфалейско-Каслинской и Кисегач-Миассовской групп в восточных предгорьях Южного Урала (Большой Иртяш, Большой Ишкуль, Большие Касли, Киреты, Малое Миассово, Силач, Синара, Сунгуль и др.) были сделаны многочисленные находки этого вида (Масленникова, 1941; неопубликованные материалы Н.В. Бондаренко и А.О. Таусон). Последние по времени обнаружения вида сделаны автором в озерах восточных предгорий Южного Урала Аракуль, Большой Еланчик, Иткуль, Большое Миассово, Малый Теренкуль и в Аргазинском водохранилище на р. Миасс уже в нынешнем тысячелетии. Размеры по нашим данным: длина тела 123–157, левого пальца ноги 48–57, правого 38–42 мкм. Опарина (1923) приводит длину тела 140–170, пальцев 50 мкм.
По литературным данным, T. porcellus – обитатель придонных участков и фитали озер, болот, псаммона, перифитона, встречается и в пелагиали (Кутикова, 1970). Как эуплантонный вид отмечен в эвтрофных водоемах (Jersabek, Bolortsetseg, 2010), с чем согласуются наши данные – в эвтрофном оз. Малый Теренкуль вид встречался только в планктоне. В то же время, отмечен в пелагиали мезотрофных и олиготрофных озер (Аракуль, Большой Еланчик, Иткуль). Это согласуется с данными Матвеевой (Matveeva, 1986) по мезотрофному оз. Глубокое в Московской обл., в котором T. porcellus появился в 1980-е гг. именно в пелагиали; в Южной Америке нередко становится одним из доминирующих в олиготрофных водоемах (Schmid-Araya, 1993). В оз. Большое Миассово обнаружен как в псаммоне прибрежной зоны, так и в эпилимнионе пелагиали. В целом, в исследованных озерах Урала ведет себя скорее как эупланктонный вид. Размеры по нашим данным: длина тела 130–144, левого пальца ноги – 45–48, правого пальца – 37–40 мкм.
По отношению к температурному фактору коловратка может считаться эвритермным видом (индикаторный вес, означающий по-существу стенобионтность, очень низкий – 1.33) с незначительным предпочтением холодных вод (индивидуальный термоиндекс – 1.3). В литературе также характеризуется как эвритермный (Jersabek, Bolortsetseg, 2010). По отношению к трофности водоема T. porcellus показывает себя на Урале как мезоэвтроф (индивидуальная индикаторная значимость 1.6 со средним индикаторным весом 2.96), что соответствует данным по эстонским озерам (Mäemets, 1983), а по отношению к органическому загрязнению – как бетамезосапроб (индивидуальная индикаторная значимость 1.7 с хорошим индикаторным весом 3.98), тогда как в Европе ведет себя как олигосапроб (1.2 по: Sládeček, 1983). Согласно данным других исследователей, T. porcellus вообще демонстрирует черты эврибионта с безразличным отношением к таким факторам среды, как температура и прозрачность воды, минерализация, содержание растворенного кислорода, концентрация биогенных веществ (Adamczuk et al., 2015). Отмечена и его устойчивость к кислым водам (Jersabek, Bolortsetseg, 2010).
Очевидно благодаря своей экологической пластичности T. porcellus один из наиболее обильных и распространенных видов рода на Урале. Максимальная численность, отмеченная нами, – 10.8 тыс. экз./м3 в верхнем створе Аргазинского водохранилища в августе. Средняя по всему массиву проб 2820 ± 1614 экз./м3. Первые встречи вида – в июне, основное развитие приходится на середину лета, а также на позднюю осень. Например, в Аргазинском водохранилище средняя численность в ноябре была свыше 5.5 тыс. тыс. экз./м3. Такая сезонная динамика определяется эвритермностью T. porcellus, которая также отражается и в вертикальном распределении вида, – он бывает многочислен как в хорошо прогретом эпилимнионе, так и в более холодных придонных слоях воды. Это также подтверждает данные об эврибионтности вида в отношении растворенного кислорода. Так, в оз. Большое Миассово в августе численность T. porcellus в поверхностном слое воды (0–5 м) составляла 1 тыс. экз./м3 при температуре 21.3°С и 105% насыщении воды кислородом, а в гиполимнионе (15–20 м глубины) – 3.8 тыс. экз./м3 при температуре 8.3°С и 2% содержании кислорода.
Вид известен на всей территории России, от Заполярья до южных регионов. Распространен во всех зоогеографических областях, кроме Пацифики и Антарктики.
Trichocerca pusilla (Lauterborn 1898)
Первая находка вида сделана на южной границе региона в р. Урал в Оренбурге (Муравейский, 1923). Затем был обнаружен во многих озерах восточно-предгорного лимнологического района Южного Урала: Большой Иртяш, Большой Ишкуль, Большие Касли, Киреты, Кундравинское, Малое Миассово, Силач, Синара, Сириккуль, Сунгуль и др. (Масленникова, 1941 и неопубликованные материалы А.О. Таусон). Нами этот вид встречен в озерах Южного Урала Серебры и Табанкуль. На Среднем Урале найден в р. Кама и пойменных озерах ее среднего течения (Керенцева и др., 1946; Таусон, 1947; Вершинин, 1953). Размеры по нашим данным: длина 65–105, левого пальца ноги – 38–48 мкм.
Эупланктонный вид, встречающийся также в потамопланктоне среди макрофитов (Кутикова, 1970; Jersabek, Bolortsetseg, 2010). Большинство находок T. pusilla на Урале сделано именно в пелагическом планктоне. К сожалению, авторы не указывали численность коловратки, глазомерные оценки обилия в неопубликованных работах – “единично” или “мало”. Имеющиеся собственные данные недостаточны и не позволяют автору дать количественную оценку экологических свойств вида в уральских водоемах. Учитывая летнюю встречаемость (в большинстве случаев июнь–август), можно предположить, что вид относится к теплолюбивым. Мы встречали T. pusilla при температуре воды не ниже 18°С. По литературным данным, летний или летне-осенний вид (Herzig, 1987), обитает при температуре выше 10°С (Jersabek, Bolortsetseg, 2010) или даже 12°С (May et al., 2001). Есть указания на температурный оптимум развития вида в пределах 25–29°С (Yin et al., 2018). Фуссманн (Fussmann, 1993) прямо называет его “летним” стенотермным видом. Важность температурного фактора для T. pusilla показана и другими исследованиями, причем помимо теплых вод он предпочитает и высокое содержание кислорода (Adamczuk et al., 2015). Хотя считается, что вид эвригалинный (Jersabek, Bolortsetseg, 2010) и переносит минерализацию до 4 г/м3 (Bielańska-Grajner, Cudak, 2014), на Урале он пока обнаружен только в пресных водах.
Trichocerca pusilla отнесен к мезоэвтрофным (Mäemets, 1983) или типично эвтрофным видам (Kuczyńska-Kippen, Pronin, 2018; Yin et al., 2018). Некоторые ученые даже относят T. pusilla к индикаторам эвтрофных условий (Cannon, Stemberger, 1978). Обилие вида положительно коррелирует с содержанием в воде нитратов, нитритов и фосфатов (Plangklang et al., 2019). Однако, согласно другим данным, T. pusilla избегает высокого содержания биогенных веществ азотной и фосфорной групп (Adamczuk et al., 2015). Подавляющее большинство озер на Урале, в которых он найден, относятся к мезотрофному или олигомезотрофному типу. Однако, как уже упоминалось, в них он встречался единично или в малом обилии. Наши находки в мезоэвтрофном оз. Серебры и эвтрофном оз. Табанкуль показывают численность вида от 15 до 38 тыс. экз./м3. В мезотрофном с признаками эвтрофии китайском оз. Сианху была зарегистрирована численность T. pusilla свыше 10 тыс. экз./м3, и он являлся одним из доминирующих видов (Wen et al., 2017). Очевидно, коловратка предпочитает эвтрофные воды, но обитает и в других типах водоемов вплоть до олигомезотрофных. Тем более что ее индикаторные свойства соответствуют олигосапробности (1.3 по: Sládeček, 1983).
Численность представителей Trichocerca свыше 10 тыс. экз./м3 весьма значительна для уральских водоемов, однако T. pusilla может быть более обильным. По сведениям Мэй с соавторами (May et al., 2001), вид питается колониальными диатомовыми водорослями рода Aulacoseira, от развития которых главным образом и зависит численность коловратки, которая достигает пика в 1–3 млн экз./м3 в период “цветения” и падая до 100 тыс. экз./м3 в период депрессии водорослей. Aulacoseira широко распространены и обильны в водоемах региона, однако подобных вспышек численности T. pusilla здесь не наблюдается. Возможно, дело в том, что развитие этих диатомовых в озерах Урала происходит при температуре воды ниже оптимума T. pusilla.
Вид известен на всей территории России. Распространен во всех зоогеографических областях Земли, кроме Антарктики.
Trichocerca rattus (Müller 1776) (рис. 3b)
Вид представлен на Урале двумя формами, помимо типичной T. rattus f. rattus (Müller 1776) это T. rattus f. carinata (Ehrenberg 1830). Первая находка на Урале – в оз. Песчаное в окрестностях Перми (Опарина, 1923, типичная форма). На Среднем Урале в дальнейшем обнаружен в р. Кама (Керенцева и др., 1946 – типичная форма, Таусон, 1946 – T. rattus f. carinata). На Южном Урале также известны обе формы: в озерах предгорий Ильменского хребта Кармаккуль, Савелькуль, Сириккуль и предлесостепном оз. Кундравинское (неопубликованные данные А.О. Таусон и автора) – типичная, в лесостепном оз. Сугояк в окрестностях Челябинска – T. rattus f. carinata (данные автора). Trichocerca rattus распространяется вплоть до Полярного Урала, где обнаружена в водоемах бассейна р. Кара (Богданова, 2003) и озерах его восточного макросклона (Богданов и др. 2004). Размеры по нашим данным: типичная форма длина тела 182–187, левого пальца ноги – 170–172 мкм; f. carinata длина тела 157–168, левого пальца 142–148 мкм. Опарина (1923) для типичной формы приводит длину тела 204, левого пальца – 153 мкм.
Перифитонный и бентосный вид, встречающийся преимущественно в заболоченных водоемах, редко в планктоне и псаммоне (Jersabek, Bolortsetseg, 2010). В оз. Савелькуль (предгорья Ильменского хребта на Южном Урале) найден нами в песчаном заторфованном грунте, заросшем фонтиналисом (Fontinalis antipyretica) и тростником (Phragmites australis) на глубине 0.2 м. В лесостепном оз. Сугояк в окрестностях Челябинска встречен в прибрежной заболоченной зоне среди тростника, болотницы (Eleocharis mamillata) и осок (Carex spp.).
Недостаток собственных данных и отсутствие литературных материалов о количественном развитии вида в водоемах региона не позволяют оценить экологические свойства вида в условиях Урала. По литературным источникам эвритермный с некоторым предпочтением холодных вод (Jersabek, Bolortsetseg, 2010) или даже криофильный (Segers, 2003), что согласуется с данными о распространении вида вплоть до Полярного Урала (редкий случай для представителей рода Trichocerca). Это один из немногих видов коловраток, обнаруженных в Антарктиде. Относительно содержания кислорода и рН воды вид демонстрирует черты эврибионта (Jersabek, Bolortsetseg, 2010). Питается колониальными нитчатыми водорослями, разрывая нити и высасывая содержимое клеток (Ecology and General Biology, 2014). Как и многие другие виды, приуроченные к болотным местообитаниям, T. rattus выраженный олигосапроб (1.0–1.1, Sládeček, 1983).
По нашим наблюдениям, численность T. rattus колеблется от 600 до 9 тыс. экз./м3, причем он более многочислен у поверхности субстрата, чем в открытой воде. Это совпадает с данными Хани и соавторов (Harney et al., 2013): в одном из индийских прудов численность вида в перифитоне достигала 8–9 тыс. экз./м3. Согласно глазомерным оценкам обилие T. rattus в неопубликованных работах уральских гидробиологов определено как “единично”, “очень мало” и “немного”, при этом в оз. Сириккуль это один из основных видов зоопланктона по встречаемости.
Известен на всей территории России. Распространен во всех зоогеографических областях Земли.
Trichocerca rousseleti (Voigt 1902)
Первая находка – в оз. Малый Кисегач в восточных предгорьях Южного Урала (1938 г., неопубликованные материалы Н.В. Бондаренко). В Предуралье обнаружен в р. Кама и ее пойменных озерах (Таусон, 1946; Вершинин, 1953). Количественные данные по развитию T. rousseleti авторы не приводят.
Редкость находок этого вида на Урале вызывает удивление, поскольку он обитает в наиболее изученном гидробиологами биотопе – планктоне озер и рек, где нередко бывает одним из доминирующих видов (Yoshida et al., 2000; Haberman, Künapp, 2002). Нам за 35 лет исследований южноуральского планктона он не встретился ни разу.
По-видимому, эвритермный вид. С одной стороны, относится к типично летним в озерах северного полушария (Herzig, 1987) и достигает максимума развития в летнее время при наибольшем прогреве воды, как, например, в крупных озерах Эстонии (Haberman, Künapp, 2002), когда в августе он составляет до 20% численности зоопланктона (Haberman, 1995). С другой стороны, отмечен как холодноводный (Segers, 2003). Обилие T. rousseleti может регулироваться веслоногими раками, в частности, Eurytemora affinis (Brandl, 2005).
Отмечен как индикатор эвтрофии эстонскими исследователями (Haberman, Künapp, 2002; Haldna, Haberman, 2014), однако встречается в озерах всех трофических типов от эвтрофных до ультраолиготрофных (Jersabek, Bolortsetseg, 2010). Озеро Малый Кисегач, в котором сделана единственная находка T. rousseleti на Южном Урале, – олигомезотрофное. Вряд ли вид может считаться индикатором эвтрофии, по крайней мере, он себя таковым не показывает за пределами Эстонии. Статус вида как олигосапроба (1.0) с высоким индикаторным весом (5) (Sládeček, 1983) также не согласуется с характеристикой индикатора эвтрофии.
Известен на всей территории России, а также во всех зоогеографических областях, кроме Неотропической, Антарктики, Пацифики.
Trichocerca ruttneri Donner 1953
Единственная на Урале находка сделана автором в заболоченном озерном деривате в бассейне оз. Большое Миассово в восточных предгорьях Ильменского хребта на Южном Урале. Размеры: длина тела 120, левого пальца ноги – 51, правого пальца ноги – 22 мкм. В основном обитает в планктоне озер (Кутикова, 1970), где может быть одним из многочисленных и доминирующих видов (Dagne et al., 2008; Dorak, 2013). В вышеупомянутой работе Дагне с соавторами указано, что максимальной численности (до 200 тыс. экз./м3) T. ruttneri достигает в июне, и это имеет место в субэкваториальном климате. Как летний вид, численность которого значимо зависит от температуры воды, T. ruttneri упомянут и в последней цитированной работе, посвященной водоемам субтропиков. Зегерс (Segers, 2003) напрямую называет вид тепловодным. Только в июне и июле он встречался в водоемах Эстонии (Viro, Haberman, 2005). Очевидно, вид является термобионтом, встречающимся при температуре от 13.5°С и выше (Jersabek, Bolortsetseg, 2010). Возможно, теплолюбивостью вида с его тяготением к районам субтропического, тропического и субэкваториального климата объясняется редкость находок как на Урале, так и на территории России в целом. Тем не менее T. ruttneri – всесветно распространенный вид, неизвестный лишь в Пацифике и Антарктике.
Trichocerca sejunctipes (Gosse 1886)
Единственная находка на Урале – в восточных предгорьях Ильменского хребта на Южном Урале в оз. Малый Теренкуль (Рогозин, 2009а). Вид был обозначен как species inquirenda Зегерсом (Segers, 2007). Точная идентификация вида требует дальнейших исследований.
Trichocerca similis (Wierzejski 1893) (рис. 3c)
Все находки этого вида сделаны только на Южном Урале в озерах восточных предгорий и прилегающей лесостепи. Первые сведения относятся к середине 1970-х гг., когда T. similis был обнаружен экспедицией ленинградских гидробиологов в озерах Аргаяш, Малое Миассово и Кундравинское (Макарцева, 1978; Драбкова, Сорокин, 1979). В дальнейшем встречен в других озерах этого района – Большое Миассово (Рогозин, 2000), Табанкуль (Рогозин, 2006), Увильды (Рогозин, 2009), Большой Еланчик, Еловое, Иткуль, Большой Ишкуль, Большой Кисегач, Малый Теренкуль, Тургояк, а также в Аргазинском и Шершневском водохранилищах на р. Миасс (материалы автора).
Размеры по нашим данным: длина тела 128–154, длина левого пальца 39–49, правого пальца – 24–32 мкм. Длина передних шипов по 24–30 мкм.
Эупланктонный вид пресноводных озер и прудов, в том числе заболоченных (Jersabek, Bolortsetseg, 2010), по некоторым сведениям предпочитает полигумозные водоемы (Mäemets, 1983; Pejler, Bērziņš, 1993) и даже может считаться индикатором таких вод (Steinberg, 2003). Часто встречается среди водной растительности, в потамопланктоне (Кутикова, 1970; Jersabek, Bolortsetseg, 2010). Все наши находки вида на Урале относятся к пелагическим и, реже, литоральным участкам довольно крупных озер и, как правило, не приурочены ни к растительности, ни к заболоченным водам. Это одна из наиболее часто встречающихся планктонных коловраток из Trichocercidae, вторая по частоте после T. capucina (7.6% по всему массиву проб).
По отношению к температурному фактору коловратка согласно нашим исследованиям, – термобионт (термоиндекс вида 2.8 с показателем стенобионтности 4.03). Встречалась в летний период с июля по сентябрь (крайне редко в июне и октябре), преимущественно в августе, когда вода в уральских озерах достигает максимального прогрева. Как правило, в августе вид имеет не только наивысшую встречаемость, но и наиболее многочислен. В менее суровом климате сезонное развитие T. similis гораздо длительнее, но и там для T. similis характерен летне-осенний пик численности, когда вид может быть одним из доминирующих видов зоопланктона (Eckert, Walz, 1998; Ramírez-Garćia et al., 2002), в том числе в сильно прогретых (свыше 30°С) водоемах (Plangklang et al., 2019). В то же время имеются сведения об эвритермности вида (Jersabek, Bolortsetseg, 2010), и даже о том, что с ростом температуры воды обилие T. similis снижается (Nandini et al., 2005). Тем не менее в условиях Урала T. similis проявляет себя как выраженный термобионт. Это подтверждается не только сезонной динамикой, но и вертикальным распределением T. similis в толще воды, которое было изучено нами в оз. Большое Миассово (предгорья Ильменского хребта в окрестностях г. Миасс). Вертикальное распределение, очевидно, определяется термобионтностью вида – наибольшая численность зарегистрирована в эпилимнионе (рис. 4a), ниже термоклина обилие вида резко снижается и становится минимальным в придонных, наиболее холодных слоях. Схожие результаты получены при исследовании водоемов в Мексике (Nandini et al., 2008). В целом, как показал Деветтер (Devetter, 1998), температурный фактор – один из наиболее значимых для развития T. similis.
Рис. 4.
Динамика численности Trichocerca similis в оз. Большое Миассово (Южный Урал): a – вертикальное распределение (1 – численность, 2 – температура), b – cезонная динамика T. similis и Cladocera.
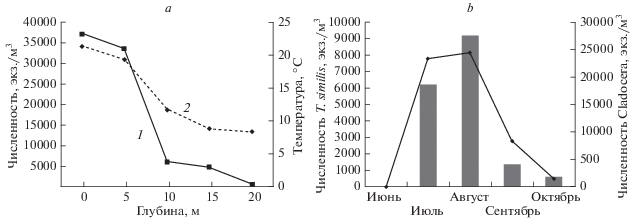
Численность вида также положительно коррелирует с концентрацией растворенного кислорода (Plangklang et al., 2019). Коловратка предпочитает пресные воды, хотя может встречаться и в солоноватых (Bielańska-Grajner, Cudak, 2014). Мы находили T. similis только в пресных и даже ультрапресных озерах Южного Урала. Среди других абиотических факторов среды на T. similis благоприятно влияют повышенное содержание фосфатов и ионов аммония, а водоемов с высокой прозрачностью коловратка, по-видимому, избегает (Adamczuk et al., 2015, Czerniawski et al., 2013). Последнее не удивительно, т.к. T. similis по литературным данным, приурочена к эвтрофным условиям (Frutos et al., 2009), может встречаться даже в гипертрофных водоемах (Mäemets, 1983). Однако на Урале коловратка проявляет себя как мезоэвтроф (индивидуальная индикаторная значимость 1.5 с индикаторным весом 3.55). Этому соответствует и то, что она в условиях Урала является альфамезосапробом (индикаторная значимость 3.0, индикаторный вес 4.92). По данным Сладечека (Sládeček, 1983), в водоемах Европы T. similis – олигосапроб (индикаторная значимость 1.3, индикаторный вес 4). Олигосапробность мало сочетается с приуроченностью к эвтрофным и гипертрофным водам и в данном случае, скорее всего, связана с обитанием T. similis в гумифицированных водоемах Европы. Очевидно, биология вида различается в разных ландшафтно-географических зонах Земли.
Как и другие виды рода, T. similis – альгофаг с широким спектром потребляемых водорослей, в полигумозных водоемах питается золотистыми (Chrysophyta) (Pejler, Bērziņš, 1993), обильными в таких водах.
По данным многих исследователей, будучи одним из обычных составляющих зоопланктона, T. similis, как правило, немногочислен и его обилие обычно составляет 1.0–1.2 тыс. экз./м3 (Ramírez-Garćia et al., 2002; Güher, 2019; Nandini et al., 2008). По всему массиву наших проб средняя численность вида составила 10 836 ± 9302, а максимальная – 206.4 тыс. экз./м3 (гиперэвтрофное оз. Табанкуль в восточных предгорьях Ильменского хребта), что значительно превышает величину, обычно указываемую для T. similis.
Если рассматривать сезонную динамику вида, то можно еще раз отметить нехарактерный для большинства планктонных коловраток летний (июль–август) пик численности (рис. 4b). Обычно в этот период происходит конкурентное исключение коловраток кладоцерами, которые в разгар лета достигают наибольшего обилия. В данном случае, как мы видим (рис. 4b), не только нет конкуренции за пищевые ресурсы, но наблюдается синхронная динамика T. similis и Cladocera, определяемая, очевидно, сходной реакцией на температурный фактор. Согласно имеющимся данным, T. similis не испытывает характерного для коловраток конкурентного вытеснения со стороны мелких кладоцер (Eckert, Walz, 1998) и дафний (Gilbert, 1989), что и подтверждают наши наблюдения. Известно, что хищные кладоцеры и личинки Chaoborus существенно влияют на популяцию T. similis (Devetter, 1998; Wallace, Starkweather, 1983), однако летняя численность взрослых копепод и коретры в исследованных озерах очень низка. Вопрос о способах избегания T. similis конкурентного вытеснения со стороны кладоцер требует дополнительных исследований.
Широко распространенный вид, известный на всей европейской территории России, а также отдельными находками на Урале, в Сибири и на Дальнем Востоке. Встречается во всех зоогеографических областях Земли, кроме Антарктики.
Trichocerca stylata (Gosse 1851)
Первые находки вида на Урале сделаны еще в начале 20 в. (Фурман, Тиебо, 1910) в озерах восточных предгорий Южного Урала Большой Иртяш, Кажакуль, Большие Касли, Киреты и др. В дальнейшем обнаружен практически во всех исследованных озерах этого района, относящихся к Каслинской и Кисегач–Миассовской системам (Масленникова, 1941; неопубликованные материалы Н.В. Бондаренко, А.О. Таусон и автора). Отмечен в лесостепном Зауралье (оз. Кундравинское – Макарцева, 1978). Найден и в более южных районах – в бассейнах рек Урал и Сакмара в районе Оренбурга (Муравейский, 1923). В Предуралье зарегистрирован в р. Кама и озерах ее бассейна (Опарина, 1923; Таусон, 1934; Керенцева и др., 1946; Вершинин, 1953), на Среднем Урале – в оз. Большой Шарташ в окрестностях Екатеринбурга (Балабанова, 1949).
Размеры исследованных особей из оз. Большой Кисегач: длина тела 131–152, левого пальца – 43–47 мкм, правый палец рудиментарный. Опарина (1923) приводит длину тела 130, левого пальца – 35–43 мкм, длину переднего шипа 17 мкм.
Эупланктонный вид в пресных озерах и реках, реже встречается в потамопланктоне, в болотистых и солоноватых водах, согласно некоторым данным галофоб (Кутикова, 1970; Jersabek, Bolortsetseg, 2010).
Во всех уральских работах, где упомянут T. stylata, его численность не указана, наших данных недостаточно для определения аутэкологических характеристик вида. Согласно литературным данным, это, как и большинство Trichocerca, летний стенотермно–тепловодный вид (Herzig, 1987; Bērziņš, Pejler, 1989). Есть данные и о весеннем максимуме развития T. stylata (May, O’Hare, 2005). В уральских озерах и реках он обнаруживался преимущественно в июле и августе в период максимального прогрева воды. Отмечена также приуроченность к нейтральным и слабощелочным водам (Bērziņš, Pejler, 1987), которые, кстати, характерны для предгорных водоемов Урала.
Некоторыми авторами T. stylata считается индикатором гипертрофных условий (Rosińska et al., 2019), хотя для вида характерна отрицательная реакция на высокое содержание в воде нитратов (Mantovano et al., 2019), а по данным Сладечека (Sládeček, 1983), T. stylata – олигосапроб (индикаторная значимость 1.3, индикаторный вес 4). Все находки на Южном Урале сделаны в озерах мезотрофного или олиготрофного типа, а в эвтрофных или тем более гипертрофных озерах он ни разу не встречался.
Единственная находка T. stylata с количественными данными сделана нами в олиготрофном оз. Большой Кисегач в восточных предгорьях Ильменского хребта на Южном Урале (численность 8.4 тыс. экз./м3, биомасса 0.0075 г/м3) в августе в литоральной зоне. В большинстве озер Южного Урала, по глазомерной оценке авторов работ, численность T. stylata охарактеризована как “единично” или “редко”. Одной из основных форм зоопланктона по встречаемости в количестве “много” обнаружена только в озерах Кундравинское (лесостепное, с повышенной минерализацией) и Большой Ишкуль (ультрапресное предгорное) (Рогозин, 1995). Как один из доминирующих видов отмечен многими авторами в водоемах разных природно-географических зон (May, O’Hare, 2005; Frutos et al., 2009; Mantovano et al., 2019 и другие).
В России распространен повсеместно. Встречается во всех зоогеографических областях Земли, кроме Антарктики.
Trichocerca sulcata (Jennings 1894)
Обнаружен в восточных предгорьях Ильменского хребта на Южном Урале в озерах Аргаяш и Ильменское (неопубликованные данные А.О. Таусон) и в р. Кама (Таусон, 1946).
Обитатель прибрежной зоны водоемов среди водной растительности (Кутикова, 1970), может считаться тихопланктонным (Miracle et al., 1995). Отнесен к олигосапробам (1.1) с высоким индикаторным весом (5) (Sládeček, 1983).
В России встречается нечасто, но известен, по крайней мере, от европейской территории до Алтая. Распространен в Голарктике, в Неотропической и Австрало-Полинезийской зоогеографических областях.
Trichocerca tenuior (Gosse 1886) (рис. 3d)
Впервые был найден в начале 1920-х гг. в Приуралье в водоемах бассейна Камы и в самой реке, где впоследствии был встречен неоднократно (Опарина, 1923; Таусон, 1946, 1947; Вершинин, 1953). На Южном Урале обнаружен нами в озерах восточных предгорий Большой Ишкуль, Большое Миассово (данные не опубликованы), в Аргазинском водохранилище на р. Миасс (Рогозин, 2013), в р. Малый Кизил (приток Урала, данные автора). В других районах пока неизвестен, однако встречался вблизи границ Полярного Урала на полуострове Ямал (Богданов и др., 1997). Размеры по нашим данным: длина тела 170–187, левого пальца – 54–55, правого пальца – 35–37 мкм. Опарина (1923) приводит длину тела 170, левого пальца – 69, правого – 40 мкм.
Trichocerca tenuior обитатель псаммона и перифитона в литорали водоемов, в прудах и болотах, редко встречается в открытой воде (Кутикова, 1970; Segers, 2003). Обнаружен как в летние месяцы в период сильного прогрева воды, так и в конце осени при остывании воды ниже 8°С, что соответствует указаниям на его эвритермность (Jersabek, Bolortsetseg, 2010; Bertani et al., 2011). Это же подтверждается и данными о распространении вида до Заполярья. Предпочитает нейтральные воды с рН 7 (Bērziņš, Pejler, 1987). На распространение и развитие вида влияет проточность водоема – при ее усилении в литоральной зоне T. tenuior исчезает из планктона (Визер и др., 2016). Trichocerca tenuior относится к олигобетамезосапробам (Sládeček, 1983), индикаторные свойства вида посредственные.
Наибольшая зарегистрированная нами численность T. tenuior составляла 1.2 тыс. экз./м3 (верхний створ Аргазинского водохранилища). Для большинства фито- и псаммофильных видов Trichocerca это обычная величина, по данным других исследований, T. tenuior может быть одним из доминирующих видов в фитали (Duggan et al., 1998).
В России известен на всей территории. Встречается везде, кроме Антарктиды.
Trichocerca tigris (Müller 1786) (рис. 5a)
Рис. 5.
Trichocercidae из южноуральских водоемов: a – Trichocerca tigris (Müller 1786) из оз. Большое Миассово, b – T. weberi (Jennings 1903) из Аргазинского водохранилища на р. Миасс.
Впервые выявлен в Приуралье в р. Кама и пойменных озерах ее бассейна в конце 1940-х – начале 1950-х гг. (Таусон, 1946, 1947; Вершинин, 1953). На Южном Урале встречен автором в оз. Большое Миассово (восточные предгорья Ильменского хребта) в небольшом заросшем заливе в июле. В других районах Урала неизвестен, однако найден вблизи границ Полярного Урала в нижней Оби и Обской губе (Ермолаева, 2017).
Размеры по нашим данным: длина тела 231, пальцев 105–107 мкм. Данных о количественном развитии в уральских водоемах нет.
Как и многие другие Trichocerca, обитатель фитали в стоячих и текучих водах, болот (Кутикова, 1970) и врéменных водоемов (Куликова, 2015). Встречается среди детрита, песка, во мхах, на макрофитах в перифитоне (Jersabek, Bolortsetseg, 2010). Может входить в состав комплекса комменсалов на двустворчатых моллюсках (Bołtruszko, 2010). Во многих водоемах Европы T. tigris – один из доминирующих видов в литоральной зоне (The production ecology…, 2009). Как и другие виды рода – олигосапроб с хорошим индикаторным весом (Sládeček, 1983).
Известен на всей территории России, имеет космополитическое распространение, включая Антарктику.
Trichocerca weberi (Jennings 1903) (рис. 5b)
Впервые найден в Приуралье, в болоте на берегу р. Кама (Опарина, 1923). Дальнейшие немногочисленные находки сделаны на Южном Урале – в оз. Большое Миассово в предгорьях Ильменского хребта (Рогозин, Щетинина, 1989) и в Аргазинском водохранилище на р. Миасс (Рогозин, 2013). Размеры по нашим данным: длина тела 92–97, длина пальцев 34–36 мкм. Опарина (1923) приводит длину тела 125 мкм.
Обитатель прудов и болот (Кутикова, 1970), литорали озер среди макрофитов, мхов, детрита, реже в открытой воде, в пелагиали (De Smet, 1993; Jersabek, Bolortsetseg, 2010). Нам встречался в пелагической области водоемов на глубине от 3 до 22 м при температуре от 6.9 до 24.9°С. Широкий температурный диапазон встречаемости вида отмечен и в других случаях, некоторые авторы считают его эвритермным (Jersabek, Bolortsetseg, 2010). Согласно нашим расчетам, T. weberi – криофильный вид (1.0) с показателем стено-/эврибионтности 2.0, предпочитающий воды с температурой не выше 13°С. Косвенно такие биологические свойства вида подтверждает факт его распространения за Полярным Кругом (Ермолаева, 2017). Коловратка обитает при содержании кислорода в широком диапазоне (от 2 до 13 мг/л), оптимум, по-видимому, составляет 8 мг/л (Bērziņš, Pejler, 1989). Столь же широк диапазон рН (5.96–8.95), при котором встречается вид (Jersabek, Bolortsetseg, 2010), что позволяет ему жить как в кислых болотных, так и в щелочных водах в период массового “цветения” водорослей. Сведения о приуроченности T. weberi к водам определенной трофности, по-видимому, отсутствуют. Нам вид встречался в мезотрофных условиях, имеются данные об обитании в эвтрофных и дистрофных (очевидно, олигодистрофных) водоемах (Jersabek, Bolortsetseg, 2010). Сладечек (Sládeček, 1983) определяет T. weberi как отличный индикатор олигосапробных вод (1.1).
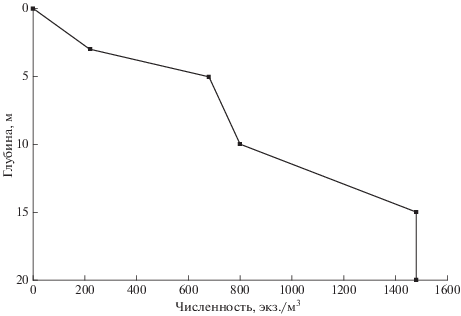
Trichocerca weberi – одна из немногих хищных коловраток, наибольшего обилия достигает в условиях массового развития детритоядных видов и альгофагов (Cervantes-Martinez, Gutiérrez-Aguirre, 2015). Численность T. weberi, как и большинства видов рода, обычно невелика. Нами зарегистрированы величины от 600 до 3.7 тыс. экз./м3. Такие показатели соответствуют данным других исследователей: в водоемах Польши – 1 тыс. экз./м3 (Goździejewska, Tucholski, 2011), в водоемах Мексики в благоприятных условиях может достигать обилия в 5 тыс. экз./м3 (Cervantes-Martinez, Gutiérrez-Aguirre, 2015). Тихопланктонный характер вида подтверждается данными о его вертикальном распределении, изученном нами в летний период в оз. Большое Миассово в восточных предгорьях Ильменского хребта на Южном Урале (рис. 6). Несмотря на встречаемость по всей толще воды, кроме поверхностного слоя, T. weberi концентрируется в глубоких слоях, значительно ниже термоклина. Наибольшая численность вида (3.7 тыс. экз./м3) отмечена в этом же озере на глубине 10 м в литоральной зоне (дно – 10.5 м).
Рис. 6.
Распределение численности Trichocerca weberi (Jennings 1903) по глубине южноуральского оз. Большое Миассово в июле.
Известен на всей территории России, имеет космополитическое распространение (кроме Антарктики).
Род Trichocerca на Урале представлен широко распространенными как в России, так и на всей планете видами. Большинство из них – обитатели мелких, часто заболоченных водоемов и болот, заросшей литорали озер и рек, живущие в перифитоне, псаммоне и среди донного детрита, и лишь немногие относятся к эупланктонным или тихопланктонным видам. Работы уральских гидробиологов посвящены преимущественно исследованию планктона. Сочетание этих обстоятельств приводит к тому, что на Урале обнаружено значительное число видов Trichocerca, однако находки большинства из них редки, а сведения о количественном развитии фрагментарны или вовсе отсутствуют. Лишь несколько эупланктонных видов (T. capucina, T. cylindrica, T. porcellus, T. similis) изучены относительно неплохо. Следует учесть и тот момент, что коловратки семейства Trichocercidae редко образуют многочисленные популяции, и вероятность их находок в рутинно обрабатываемых гидробиологических пробах не очень велика. Аутэкологические характеристики уральских представителей Trichocerca приведены в табл. 1.
Таблица 1.
Основные биологические характеристики видов рода Trichocerca на Урале
| Вид | Экологические свойства | Максимальная численность, экз./м3 | Средняя численость, экз./м3 |
|---|---|---|---|
| bicristata | tpl, pph, psm, eut?, etr?, о? | – | – |
| bidens | bts, psm, eut?, o-β? | 800 | – |
| brachyura | pph, psm, o? | – | – |
| capucina | epl, tbi, hlp, mtr, β-α | 14 500 | 1930 ± 872 |
| cavia | tpl, pph, o-β? | – | – |
| collaris | pph, bts, eut, acp, o-β? | – | – |
| cylindrica | epl, tbi, mtr, o | 1600 | 1200 ± 210 |
| dixonnuttali | epl, psm, pph, met, β | 24 000 | – |
| elongata | pph, tph, ehl, mtr, β | 12 000 | – |
| iernis | pph, eut?, alp, o? | – | – |
| longiseta | tpl, pph, psm, eut?,ehl?, o? | 1100 | – |
| porcellus | tpl, pph, psm, bts, eut, ehl?, met, β | 10 800 | 2820 ± 1614 |
| pusilla | epl, pph, tph?, oxp?,etr?, o? | 38 000 | – |
| rattus | pph, bts, psm, tpl, eut?, o? | 9000 | – |
| rousseleti | epl, eut?, etr?, o? | – | – |
| ruttneri | epl, pph, tbi?, o? | – | – |
| similis | epl, pph?, tbi, oxp, hlp, met, α | 206 400 | 10 800 ± 2800 |
| stylata | epl, pph, tph?, hlp, o? | 8400 | – |
| sulcata | tpl?, pph?, o? | – | – |
| tenuior | psm, pph, tpl, eut, o-β? | 1200 | – |
| tigris | pph, psm, bts, o? | – | – |
| weberi | epl, pph?, bts?, cph, mtr, o? | 3700 | 970 ± 679 |
Примечания. epl – эупланктонный, tpl – тихопланктонный, pph – перифитонный, psm – псаммофильный, bts – бентосный; eut – эвритермный, tbi – термобионт, tph – термофил, cph – криофил;ehl – эвригалинный, hlp – галофоб; acp – ацидофил, alp – алкалифил; oxр – оксифил; mtr – мезотрофный, met – мезоэвтрофный, etr – эвтрофный; o – олигосапроб, o-β – олигобетамезосапроб, β-α – бетаальфамезосапроб, α – альфамезосапроб.
Распространение большинства видов рода тяготеет к южным районам Урала. Очевидно, это связано с теплолюбивостью многих их них. Даже те Trichocerca, которые в ротаториологической литературе признаны эвритермными, на самом деле могут не являться таковыми. Обитание вида в широком диапазоне температур не обязательно означает его эвритермность, важно то, как его обилие и встречаемость распределяются по градиенту температурного фактора (Рогозин и др., 2015). По нашим данным, это распределение для Trichocerca смещено в сторону теплых вод.
Неисследованость на Урале многих характерных местообитаний Trichocercidae позволяет предполагать, что список видов этого семейства еще будет пополнен новыми находками. Вероятно, будут обнаружены T. intermedia (Stenroos 1898), найденный на сопредельной территории в Северном Казахстане в заросшем эвтрофном оз. Ситово (Ермолаева, 2013), T. lophoessa (Gosse 1886) и T. mucosa (Stokes 1896), известные из водоемов Поволжья, а кроме того, будет будет обнаружен T. uncinata (Voigt 1902), который населяет рдесты в фитали озер, псаммон и болотные местообитания, и встречен в водоемах как к западу, так и к востоку от Урала.
Проведенное исследование еще раз показало, насколько слабо изучена гидрофауна Урала. Фактически, этот итог 110-летнего изучения местных водоемов дает лишь самую начальную основу для дальнейших работ по выявлению биологического разнообразия этой огромной территории.
Список литературы
Акатова Н.А., 1954. Исследование зоопланктона р. Урала и некоторых водоемов поймы в районе дер. Январцево Западно-Казахстанской области // Труды Зоологического ин-та АН СССР. Т. 16. С. 517–531.
Андроникова И.Н., 1996. Структурно-функциональная организация зоопланктона озерных экосистем разных трофических типов. СПб.: Наука. 189 с.
Балабанова З.М. 1949. Материалы к озеру Большой Шарташ // Труды Уральского отделения ВНИИОРХ. Т. 4. С. 75–128.
Богданов В.Д., Богданова Е.Н., Головатин М.Г., Добринский Н.Л., Корытин Н.С., Кряжимский Ф.В., Магомедова М.А., Мельниченко И.П., Морозова Л.М., Пасхальный С.П., Сосин В.Ф., Штро В.Г., 1997. Мониторинг биоты полуострова Ямал в связи с развитием объектов добычи и транспортировки газа. Екатеринбург: Изд-во УРЦ “Аэрокосмология”. 192 с.
Богданов В.Д., Богданова Е.Н., Госькова О.А., Мельниченко И.П., Степанов Л.Н., Ярушина М.И., 2004. Биоресурсы водных экосистем Полярного Урала. Екатеринбург: УрО РАН. 168 с.
Богданов В.Д., Богданова Е.Н., Гаврилов А.Л., Мельниченко И.П., Степанов Л.Н., Ярушина М.И., 2005. Экологическое состояние притоков Нижней Оби (реки Харбей, Лонготъеган, Щучья). Екатеринбург: Изд-во Уральского ун-та. 236 с.
Богданова Е.Н., 2003. К изучению зоопланктона Полярного Урала (зоопланктон бассейна р. Кара) // Биологические ресурсы Полярного Урала. Вып. 3. Ч. 2. С. 23–29.
Вершинин Н.В., 1953. К биологии пойменных озер р. Камы, затопляемых Молотовским водохранилищем // Известия Естественно-научного ин-та при Молотовском гос. ун-те. Т. 13. Вып. 7. С. 519–564.
Визер Л.С. Прусевич Л.С., Визер А.М., Дорогин М.А., Матвеева Е.П., 2016. Зоопланктон Новосибирского водохранилища в период экстремальной водности // Вестник рыбохозяйственной науки. Т. 3. № 2. С. 92–99.
Грезе Б.С., 1957. Кормовые ресурсы рыб р. Енисея // Известия ВНИИОРХ. Т. 61. С. 3–284.
Драбкова В.Г., Сорокин И.Н., 1979. Озеро и его водосбор – единая природная система. Л.: Наука. 196 с.
Ермолаева Н.И., 2013. Некоторые результаты исследования зоопланктона озер Северного Казахстана // Аридные экосистемы. Т. 19. № 4. С. 91–103.
Ермолаева Н.И., 2015. Зоопланктон и качество воды р. Ишим в северном Казахстане // Аридные экосистемы. Т. 21. № 3. С. 72–83.
Ермолаева Н.И., 2017. Видовой состав и пространственное распределение зоопланктона Обской губы и Гыданской губы // Водные и экологические проблемы Сибири и Центральной Азии. Труды III Всерос. научной конференции с международным участием. Институт водных и экологических проблем СО РАН. С. 91–99.
Ермолаева Н.И., Зарубина Е.Ю., Двуреченская С.Я., 2016. Суточная динамика гидрохимических показателей и зоопланктона в литорали Новосибирского водохранилища // Поволжский экологических журнал. № 2. С. 155–166.
Керенцева Н.П., Набоких Л.Н., Егошин В.В., 1946. Гидробиология р. Камы на участке Оханск–Галево // Ученые записки Молотовского гос. ун-та. Т. 4. Вып. 2. С. 17–26.
Козлова И.В., 1966. Планктон озера Кундравинского // Труды Уральского отделения СибНИИРХ. Т. 7. С. 77–83.
Козлова И.В., Шилкова Е.В., 1966. Планктон Аргазинского водохранилища // Труды Уральского отделения СибНИИРХ. Т. 7. С. 17–24.
Красновская М.П., 1949. Карась озера Янычково и его значение как основного объекта хозяйства Вверхне-Тавдинских озер, Свердловской области // Труды Уральского отделения ВНИИОРХ. Т. 4. С. 213–273.
Куликова Т.П., 2015. Зоопланктон водных объектов города Петрозаводска (Карелия) // Труды Карельского научного центра РАН. № 2. С. 71–88.
Кутикова Л.А., 1970. Коловратки фауны СССР. Л.: Наука. 744 с.
Любимова Т.С., 1975. Продукционные возможности зоопланктона выростных прудов Чесменского рыбхоза // Труды Уральского отделения СибНИИРХ. Т. 9. Вып. 1. С. 201–210.
Любимова Т.С., 1981. Зоопланктон горного озера Аракуль (Южный Урал) и его продукция // Гидробиологическая характеристика различных рыбохозяйственных водоемов Европейской части РСФСР. Сборник научных трудов НИИ озерного и речного рыбного хозяйства. № 162. С. 56–68.
Масленникова Л.И., 1941. Материалы по гидробиологии Уфалейских озер // Труды Уральского отделения ВНИИОРХ. Т. 3. С. 24–36.
Макарцева Е.С., 1978. Видовой состав и продуктивность зоопланктона // Эколого-продукционные особенности озер различных ландшафтов Южного Урала. Л.: Наука. С. 150–188.
Муравейский С.Д., 1923. Наблюдения над весенним планктоном реки Урала и его стариц // Русский гидробиологический журнал. Т. 2. С. 14–23.
Набережный А.И., 1984. Коловратки водоемов Молдавии. Кишинев: Штиинца. 328 с.
Огородникова Е.М., 1977. Зоопланктон Шершневского водохранилища и его роль в оценке качества воды // Вопросы биогенного загрязнения и регулирования качества вод Урала. Красноярск: Изд-во СибНИИ гидротехники и мелиорации. С. 27–39.
Опарина Н.Я., 1923. К фауне коловраток окрестностей г. Перми // Труды Биологического научно-исследовательского ин-та при Пермском гос. ун-те. Т. 1. Вып. 9–10. С. 165–175.
Подлесный А.В., Троицкая В.И., 1941. Ильменские озера и их рыбохозяйственная оценка // Труды Уральского отделения ВНИИОРХ. Т. 3. С. 121–174.
Речкалов В.В., Марушкина Е.В., 2005. Исследование видового состава и динамики зоопланктона озера Синеглазово // Вестник Челябинского гос. ун-та. Т. 12. № 1. С. 15–22.
Рогозин А.Г., Щетинина О.В., 1989. Кадастр коловраток Ильменского заповедника // Фауна и флора Ильменского заповедника. Свердловск: УрО АН СССР. С. 42–52.
Рогозин А.Г., 1995. Коловратки Челябинской области. Миасс: ИГЗ УрО РАН. 128 с.
Рогозин А.Г., 2000. Зоопланктон / Экология озера Большое Миассово. Миасс: ИГЗ УрО РАН. С. 128–165.
Рогозин А.Г., 2006. Зоопланктон гипертрофного водоема на примере озера Табанкуль (Южный Урал): биологическое разнообразие и биология некоторых видов коловраток // Известия Челябинского научного центра. Вып. 3. С. 78–82.
Рогозин А.Г., 2007. О зоопланктоне водоемов западных предгорий Южного Урала (Миньярский пруд на реке Сим) // Известия Челябинского научного центра. Вып. 3. С. 75–79.
Рогозин А.Г., 2009. Зоопланктон озера Увильды // Известия Челябинского научного центра. Вып. 1. С. 62–67.
Рогозин А.Г., 2009а. Зоопланктон озера Малый Теренкуль // Известия Челябинского научного центра. Вып. 3. С. 28–33.
Рогозин А.Г., 2013. Зоопланктон Аргазинского водохранилища (Южный Урал) и его многолетние изменения // Биология внутренних вод. № 2. С. 25–33.
Рогозин А.Г., 2018. Материалы по фауне и экологии коловраток Урала. Семейство Brachionidae (Rotifera, Eurotatoria, Ploima). Рода Anuraeopsis, Brachionus, Notholca // Зоологический журнал. Т. 97. № 7. С. 773–783.
Рогозин А.Г., 2018а. Виды зоопланктона – индикаторы сапробности в водоемах Урала // Вода: химия и экология. № 7–9. С. 103–109.
Рогозин А.Г., 2018б. О системе биоиндикации трофических условий в водоемах // Химия, физика, биология, математика: теоретические и прикладные исследования: Сборник статей по материалам XI–XII Междунар. научно-практической конференции “Химия, физика, биология, математика: теоретические и прикладные исследования”. № 5–6(6). М.: Интернаука. С. 10–15.
Рогозин А.Г., 2019. Материалы по фауне и экологии коловраток Урала. Семейство Brachionidae (Rotifera, Eurotatoria, Ploima). Род Keratella // Зоологический журнал. Т. 98. № 7. С. 732–748.
Рогозин А.Г., 2020. Материалы по фауне и экологии коловраток Урала. Семейство Brachionidae (Rotifera, Eurotatoria, Ploima). Рода Kellicottia, Plationus, Platyias // Зоологический журнал. Т. 99. № 3. С. 243–252.
Рогозин А.Г., Снитько Л.В., Тимошкин О.А., 2015. Термоиндикаторные свойства видов зоопланктона и их измерение // Водные ресурсы. Т. 42. № 1. С. 85–91.
Таусон А.О., 1934. Гидробиологический очерк озер верхней Камы // Труды Пермского биологического ин-та. Т. 6. Вып. 1–2. С. 103–118.
Таусон А.О., 1935. Дикое озеро и его биология // Ученые записки Пермского гос. ун-та. Т. 1. Вып. 2–3. С. 3–55.
Таусон А.О., 1946. Зоопланктон р. Камы на участке с. Галево – р. Белая // Известия Естественно-научного ин-та при Молотовском гос. ун-те. Т. 12. Вып. 5. С. 155–167.
Таусон А.О., 1947. Планктон верхней Камы // Ученые записки Молотовского гос. ун-та. Т. 4. Вып. 2. С. 3–16.
Фурман О., Тиебо М., 1910. Фауна некоторых озер Урала: Предварительная заметка // Труды Уральского общества любителей естествознания. Т. 30. С. 69–82.
Шитиков В.К., Розенберг Г.С., Зинченко Т.Д., 2003. Количественная гидроэкология: методы системной идентификации. Тольятти: ИЭВБ РАН. 463 с.
Adamczuk M., Mieczan T., Tarkowska-Kukuryk M., Demetraki-Paleolog A., 2015. Rotatoria–Cladocera–Copepoda relations in the long-term monitoring of water quality in lakes with trophic variation (E. Poland) // Environmental Earth Sciences. V. 73. P. 8189–8196.
Arimoro F.O., Oganah A.O., 2010. Zooplankton community responses in a perturbed tropical stream in the Niger delta, Nigeria // The Open Environmental & Biological Monitoring Journal. V. 3. P. 1–11.
Baloch W.A., Maeda H., Saisho T., 1998. Seasonal abundance and vertical distribution of zooplankton in Lake Ikeda, Southern Japan // Microbes and Environments. V. 13. № 1. P. 1–8.
Barrabin J.M., 2000. The rotifers of Spanish reservoirs: Ecological, systematical and zoogeographical remarks // Limnetica. V. 19. P. 91–167.
Bertani I., Segers H., Rossetti G., 2011. Biodiversity down by the flow: new records of monogonont rotifers for Italy found in the Po River // Journal of Limnology. V. 70. № 2. P. 321–328.
Bērziņš B., Pejler B., 1987. Rotifer occurrence in relation to pH // Hydrobiologia. V. 147. P. 107–116.
Bērziņš B., Pejler B., 1989. Rotifer occurrence in relation to temperature // Hydrobiologia. V. 175. P. 223–231.
Bielańska-Grajner I., Cudak A., 2014. Effects of salinity on species diversity of rotifers in anthropogenic water bodies // Polish Journal of Environmental Studies. V. 23. № 1. P. 27–34.
Bołtruszko J.M., 2010. Epizoic communities of Rotifera on freshwater bivalves // International Journal of Oceanography and Hydrobiology. V. 39. № 4. P. 75–82.
Brandl Z., 2005. Freshwater copepods and rotifers: predators and their prey // Hydrobiologia. V. 546. P. 475–489.
Cannon J.E., Stemberger R.S., 1978. Zooplankton (especially crustaceans and rotifers) as indicators of water quality // Transactions of American Microscopy Society. V. 97. № 1. P. 16–35.
Cervantes-Martinez A., Gutiérrez-Aguirre M.A., 2015. Physicochemistry and zooplankton of two karstic sinkholes in the Yucatan Peninsula, Mexico // Journal of Limnology. V. 74. № 2. P. 382–393.
Chittapun S., Pholpunthin P., Segers S., 2007. Diversity of rotifer fauna from five coastal peat swamps on Phuket Island, Southern Thailand // Science Asia. V. 33. P. 383–387.
Contreras J.J., Sarma S.S.S., Merino-Ibarra M., Nandini S., 2009. Seasonal changes in the rotifer (Rotifera) diversity from a tropical high altitude reservoir (Valle de Bravo, Mexico) // Journal of Environmental Biology. V. 30. № 2. P. 191–195.
Czerniawski R., Domagała J., 2010. Zooplankton communities of two lake outlets in relation to abiotic factors // Central European journal of biology. V. 5. № 2. P. 240–255.
Czerniawski R., Pilecka-Rapacz M., Domagała J., 2013. Zooplankton communities of inter-connected sections of lower River Oder (NW Poland) // Central European Journal of Biology. V. 8. № 1. P. 18–29.
Dagne A., Herzig A., Jersabek C.D.,Tadesse Z., 2008. Abundance, species composition and spatial distribution of planktonic rotifers and crustaceans in Lake Ziway (Rift Valley, Ethiopia) // Internationale Revue der gesamten Hydrobiologie und Hydrographie. V. 93. № 2. P. 210–226.
De Smet W.H., 1993. Report on rotifers from Barentsøya, Svalbard (78°30′ N). Fauna Norvegica. Series A. V. 14. P. 1–26.
Devetter M., 1998. Influence of environmental factors on the rotifer assemblage in an artificial lake // Hydrobiologia. V. 387/388. P. 171–178.
Dorak Z., 2013. Zooplankton abundance in the lower Sakarya River basin (Turkey): Impact of environmental variables // Journal Black Sea/Mediterranean Environment. V. 19. № 1. P. 1–22.
Duggan I.C., Green J.D., Thompson K., Shiel R.J., 1998. Rotifers in relation to littoral ecotone structure in Lake Rotomanuka, North Island, New Zealand // Hydrobiologia. V. 387. P. 179–197.
Eckert B., Walz N., 1998. Zooplankton succession and thermal stratification in the polymictic shallow Muggelsee (Berlin, Germany): A case for the intermediate disturbance hypothesis? // Hydrobiologia. V. 387/388. P. 199–206.
Ecology and General Biology: Thorp and Covich’s Freshwater Invertebrates. 2014. V. 1. Amsterdam: Academic Press. 1118 p.
Ejsmont-Karabin J., 1995. Rotifer occurrence in relation to age, depth and trophic state of quarry lakes // Hydrobiologia. V. 313/314. P. 21–28.
Frutos M.S., Neif P.D., Neif J.J., 2009. Zooplankton abundance and species diversity in two lakes with different trophic state (Corrientes, Argentina) // Acta Limnologica Brasiliensia. V. 21. № 3. P. 367–375.
Fussmann G., 1993. Abundance, succession and morphological variation of planktonic rotifers during autumnal circulation in a hypertrophic lake Heiligensee, Berlin) // Hydrobiologia. V. 255/256. P. 353–360.
Ganf G.G., Shiel J.J., Merrick C.J., 1983. Parasitism: the possible cause of the collapse of a Volvox population in Mount Bold Reservoir, South Australia. Australian Journal of Marine and Freshwater Research. V. 34. № 3. P. 489–494.
Geng H., Xie P., Deng D., Zhou Q., 2005. The rotifer assemblage in a shallow, eutrophic chinese lake and its relationships with cyanobacterial blooms and crustacean zooplankton // Journal of Freshwater Ecology. V. 20. № 1. P. 93–100.
Gilbert J.J., 1989. The effect of Daphnia interference on a natural rotifer and ciliate community: Short-term bottle experiments // Limnology and Oceanography. V. 34. № 3. P. 606–617.
Goździejewska A., Tucholski S., 2011. Zooplankton of fish culture ponds periodically fed with treated wastewater // Polish Journal of Environmental Studies. V. 20. № 1. P. 67–79.
Green J., 2001. Variability and instability of planktonic rotifer associations in Lesotho, southern Africa // Hydrobiologia. V. 446. Issue 1. P. 187–194.
Green J., Moghraby A.I. el, Ali M.M., 1984. A faunistic reconaissance of Lakes Kundi and Keliak, western Sudan / Limnology and Marine Biology in the Sudan. Dordrecht: Springer. 374 p.
Güher H., 2019. Diversity and abundance of Rotifera in Kadıköy reservoir of Turkey // Journal of the Institute of Science and Technology. V. 9. № 2. P. 636–646.
Gürbüzer P., Buyurgan Ő., Tekatli C., Altindağ A., 2017. Species diversity and community structure of zooplankton in three different types of water body within the Sakarya River Basin, Turkey // Turkish Journal of Zoology. V. 41. № 6. P. 848–859.
Haberman J., 1995. Dominant rotifers of Võrtsjärv (Estonia) // Hydrobiologia. V. 313/314. P. 313−317.
Haberman J., Künapp H., 2002. Mean zooplankter weight as a characteristic feature of an aquatic ecosystem // Proceedings of the Estonian Academy of Sciences. Biology. Ecology. V. 51. Issue 1. P. 26–44.
Haldna M., Haberman J., 2014. Indices of zooplankton community as valuable tools in assessing the trophic state and water quality of eutrophic lakes: Long term study of Lake Võrtsjärv // Journal of Limnology. V. 72. № 2. P. 61–71.
Harney N.V., Dhamani A.A., Andrew R.J., 2013. Rotifer diversity of Malhara pond of Bhadrawati, Disthandrapur (M.S.), India // International Journal of Life Sciences. V. 1. № 1. P. 32–36.
Herzig A., 1987. The analysis of planktonic rotifer populations: A plea for long-term investigations // Hydrobiologia. V. 147. P. 163–180.
Irfan J., Yousuf A.R., Parveen M., 2013. Species composition and habitat preference of Rotifera in Ahansar Lake // Journal of Computer Engineering. V. 9. Issue 1. P. 41–48.
Iskaros I., Bishai R.M., Mokhtar F.M., 2008. Comparative study of zooplankton in Aswan reservoir and the river Nile at Aswan, Egypt // Egyptian Journal of Aquatic Reseach. V. 34. № 2. P. 260–284.
Jersabek C.D., 1995. Distribution and ecology of rotifer communities in high-altitude alpine sites – a multivariate approach // Hydrobiologia. V. 313/314. P. 75–89.
Jersabek C.D., Bolortsetseg E., 2010. Mongolian rotifers (Rotifera, Monogononta) – a checklist with annotations on global distribution and autecology // Proceedings of the Academy of Natural Sciences of Philadelphia. V. 159. P. 119–168.
Kim H.-W., Joo G.-J., 2000. The longitudinal distribution and community dynamics of zooplankton in a regulated large river: a case study of the Nakdong River (Korea) // Hydrobiologia. V. 438. P. 171–184.
Kirk D.L., 1998. Volvox: A Search for the molecular and genetic origins of multicellularity and cellular differentiation. Cambridge: Cambridge University Press. 400 p.
Kuczyńska-Kippen N., Pronin M., 2018. Diversity and zooplankton species associated with certain hydroperiods and fish state in field ponds // Ecological Indicators. V. 90. P. 171–178.
Makarov M.M., Kucher K.N., Naumova E.Yu., 2019. Vertical distribution of zooplankton after rapid change in temperature and chlorophyll concentration // Limnology and Freshwater Biology. № 1. P. 177–180.
Mantovano T., Braghin L., Schwind L.T.F., Tiburcio V.G., Bonecker C.C., Lansac-Tôha F.A., 2019. Zooplankton communities show contrasting productivity variables thresholds in dammed and undammed systems // Limnetica. V. 38. № 2. P. 669–682.
Matveeva L.K., 1986. Pelagic rotifers of Lake Glubokoe from 1897 to 1984 // Hydrobiologia. V. 141. P. 45–54.
May L., Bailey-Watts A., Kirika A., 2001. The relationship between Trichocerca pusilla (Jennings), Aulacoseira spp. and water temperature in Loch Leven, Scotland, U.K. // Hydrobiologia. V. 446. P. 29–34.
May L., O’Hare M., 2005. Changes in rotifer species composition and abundance along a trophic gradient in Loch Lomond, Scotland, UK // Hydrobiologia. V. 546. P. 397–404.
Mäemets A., 1983. Rotifers as indicators of lake types in Estonia // Hydrobiologia. V. 104. Issue 1. P. 357–361.
Miracle M.R., Alfonso M.T., Vicente E., Koste W., 1995. Rotifers of spring pools in the coastal marshland of Albufera of Valencia Natural Park // Limnetica. V. 11. № 2. P. 39–47.
Morales-Baquero R., Cruz-Pizarro L., Carillo P., 1989. Patterns in the composition of the rotifer communities from high mountain lakes and ponds in Sierra Nevada (Spain) // Hydrobiologia. V. 186/187. P. 215–221.
Muñoz-Colmenares M., Sarma S.S.S., 2017. Seasonal variations of rotifers from the high altitude Llano reservoir (State of Mexico, Mexico) // Journal of Environmental Biology. V. 38. P. 1171–1181.
Nandini S., Ramírez-García P., Sarma S.S.S., 2005. Seasonal variations in the species diversity of planktonic rotifers in Lake Xochimilco, Mexico // Journal of Freshwater Ecology. V. 20. Issue 2. P. 287–294.
Nandini S., Merine-Ibarra M., Sarma S.S.S., 2008. Seasonal changes in the zooplankton abundances of the reservoir Valle de Bravo (State of Mexico, Mexico) // Lake and Reservoir Management. V. 24. P. 321–330.
Pejler B., Bērziņš B., 1993. On the ecology of Trichocercidae (Rotifera) // Hydrobiologia. V. 263. P. 55–59.
Plangklang N., Boonyanusith C., Athibai S., 2019. Species richness and abundance of monogonont rotifers in relation to environmental factors in the UNESCO Sakaerat Biosphere Reserve, Thailand // Journal of Threatened Taxa. V. 11. № 9. P. 14087–14100.
Pourriot R., 1970. Quelques Trichocerca (Rotifères) et leurs régimes alimentaires // Annales d’Hydrobiologie. V. 1. P. 155–171.
Ramírez-García P., Nandini S., Sarma S.S.S., Robles Valderrama E., Cuesta I., Hurtado M.D., 2002. Seasonal variations of zooplankton abundance in the freshwater reservoir Valle Bravo (Mexico) // Hydrobiologia. V. 467. Issue 1. P. 99–108.
Rosińska J., Romanowicz-Brzozowska W., Kozak A., Gołdyn R., 2019. Zooplankton changes during bottom-up and top-down control due to sustainable restoration in a shallow urban lake // Environmental Science and Pollution Research International. V. 26. № 19. P. 19575–19587.
Ruttner-Kolisko A., 1974. Plankton rotifers. Biology and taxonomy. Die Binnengewasser. V. 26. Part 1. 146 p.
Saygi Y., Gündüz E., Demircalp F.Y., Çağlar S.S., 2011. Seasonal patterns of the zooplankton community in the shallow, brackish Liman Lake in Kızılırmak Delta, Turkey // Turkish Journal of Zoology. V. 35. № 6. P. 783–792.
Schmid-Araya J.M., 1993. Rotifer communities from some Araucanian lakes of southern Chile // Hydrobiologia. V. 255. Issue 1. P. 397–409.
Schmidt-Rhaesa A. (ed.), 2014. Gastrotricha and Gnathifera: Hangbook of Zoology. Göttingen: Hubert & Co. GmbH & Co. KG. 365 p.
Segers H.H., 2003. A biogeographical analysis of rotifers of the genus Trichocerca Lamarck, 1801 (Trichocercidae, Monogononta, Rotifera), with notes on taxonomy // Hydrobiologia. V. 500. P. 103–114.
Segers H.H., 2007. Annotated checklist of the rotifers (Phylum Rotifera), with notes on nomenclature, taxonomy and distribution // Zootaxa. Vol. 1564. P. 1–104.
Shiel R., Koste W., 1992. Rotifera from Australian inland waters. VIII. Trichocercidae (Rotifera: Monogononta) // Transactions of the Royal Society of South Australia, incorporating the records of the South Australian Museum. V. 116. № 1. P. 1–27.
Sipaúba-Tavares L.H., Anatriello C.B., Milstein A., Millan R.N., Scardoeli-Truzzi B., 2017. Macrophyte–environment relationships during a monospecific and a multispecific massive invasion in a fishpond // Tropical Plant Research. V. 4. Issue 3. P. 471–479.
Sládeček V., 1983. Rotifers as indicators of water quality // Hydrobiologia. V. 100. P. 169–201.
Stanachkova M., Stefanova M., Kozuharov D., Raikova-Petrova G., Fikovska E., 2017. Community structure of zooplankton as key factor for self-purification capacity of Iskar reservoir // Ecological Engineering and Environment Protection. V. 9. P. 39–46.
Steinberg C.E.W., 2003. Ecology of humic substances in freshwaters. Berlin–Heidelberg: Springer-Verlag. 281 p.
Stemberger R.S., Cannon J.E., Bricker F.J., 1979. Spatial and seasonal structure of rotifer communities in Lake Huron. Duluth: Environmental Research Laboratory Office of United States EPA. 162 p.
The production ecology of wetlands : the IBP synthesis, 2009. New York: Cambridge University Press. 592 p.
Vázquez-Sánchez A., Reyes-Vanegas G., Nandini S., Sarma S.S.S., 2014. Diversity and abundance of rotifers during an annual cycle in the reservoir Valerio Trujano // Inland Waters. V. 4. P. 293–302.
Viro T., Haberman J., 2005. Annotated list of rotifers of Lake Võrtsjärv // Proceedings of the Estonian Academy of Sciences. Biology, ecology. V. 54. № 1. P. 53–66.
Wallace R.L., Starkweather P.L., 1983. Clearance rates of sessile rotifers: In situ determinations // Hydrobiologia. V. 104. Issue 1. P. 379–383.
Wen X., Zhai P., Feng R. Yang R., Xi Y., 2017. Comparative analysis of the spatio-temporal dynamics of rotifer community structure based on taxonomic indices and functional groups in two subtropical lakes // Scientific Reports. V. 7. № 578. https://doi.org/10.1038/s41598-017-00666-y
Xue D., Weisong F., Li W., Ye S., Liu J., Zhang T., Zhongjie L., 2014. Response of rotifer community to environmental changes in five shallow lakes in the middle reach of Changjiang River, China // Chinese Journal of Oceanology and Limnology. V. 32. № 5. P. 1083–1091.
Yin L., Yu J., Yinjiang Z., Linxuan C., Lijing C., 2018. Rotifer community structure and its response to environmental factors in the Backshore Wetland of Expo Garden, Shanghai // Aquaculture and Fisheries. V. 3. Issue 2. P. 90–97.
Yoshida T., Ban S., Takenouchi T., Aono T., Ishikawa Y., Mikami H., Takano K., Imada K., Yasutomi R., Takeuchi K., 2000. Top-down control of population dynamics of the dominant rotifers in two mesotrophic lakes in Hokkaido, Japan // Archiv für Hydrobiologie. V. 148. № 4. P. 481–498.
Yoshida T., Urabe J., Elser J.J., 2003. Assessment of ‘top-down’ and ‘bottom-up’ forces as determinants of rotifer distribution among lakes in Ontario, Canada // Ecological Research. V. 18. P. 639–650.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


