Зоологический журнал, 2021, T. 100, № 8, стр. 843-866
Геобиохимические и эволюционные предпосылки кембрийской скелетной революции
Е. Б. Наймарк *
Палеонтологический институт РАН
117647 Москва, Россия
* E-mail: naimark_e@mail.ru
Поступила в редакцию 02.06.2020
После доработки 31.07.2020
Принята к публикации 04.08.2020
Аннотация
Повышение содержания планетарного кислорода в позднем докембрии запустило целый комплекс взаимосвязанных процессов: животные получили возможность увеличивать размеры за счет многоклеточности, многоклеточные животные начали быстро наращивать морфологическое и экологическое разнообразие; увеличение размеров и диверсификация неизбежно потребовали наличия опорных и двигательных структур. Становление многоклеточности также обозначает эволюцию комплекса адгезивных молекул и внеклеточного матрикса, включающего коллаген и хитин. Адгезивный комплекс, коллаген и хитин в силу своих химических свойств имеют высокую аффинность к положительно заряженным катионам кальция, магния и других металлов. При росте количества растворенного кальция в океане – а этот рост тоже связан с оксигенизацией планеты – появление минерализованных структур у организмов с таким молекулярным хозяйством становится высоковероятным. Эти минеральные структуры, как показывает разносторонний набор данных, никак не унаследованы от одноклеточных скелетных предшественников. Сначала появляются животные с простыми поверхностно минерализованными тканями, затем минерализованные структуры усложняются и стабилизируются. Их формирование может быть реализовано за счет самых разных, относительно простых и изменчивых, биохимических средств. Появление в составе тканей многоклеточных животных макромолекул с высоким сродством к катионам металлов означает не только возможность биоминерализации, но также повышение вероятности консервации мягких тканей соединениями Al, Si, P в илистых осадках, что означает образование богатой летописи мягкотелых многоклеточных. Все эти процессы складываются в мозаику взаимосвязанных явлений, обусловливающих как быструю диверсификацию многоклеточных, появление у них органических и затем минеральных скелетов, так и сохранение мягких и минерализованных структур в различных осадочных породах – все это компоненты кембрийского “взрыва”.
Кембрийский феномен – внезапное появление на границе кембрия и докембрия разнообразных многоклеточных животных – одно из самых загадочных явлений в эволюционной истории. Во времена Ч. Дарвина оно казалось необъяснимым, сам Дарвин считал (гл. 10 Происхождения видов), что докембрийские остатки организмов погребены в глубоких осадках на океанском дне, при этом бесскелетная часть эволюции, как он писал, имела крайне мало шансов оставить след в ископаемой летописи. До начала 20-го века обсуждалась биологическая природа Eozoon, описанного в 1865 г. Уильямом Доусоном. На тот момент эозоон был единственным, кого можно было рассматривать как вероятное докембрийское ископаемое. Позже, в 1894 г., эозоон признали метаморфической структурой, формирующейся при высоких температурах, и кембрийская жизнь снова осталась без возможных предшественников. В следующем десятилетии было выдвинуто предположение, что на границе кембрия и докембрия живые организмы обзавелись минеральными скелетами, которые и обеспечили сохранение остатков отмерших организмов в виде окаменелостей (Daly, 1907). Отсюда, если учесть ничтожный, по мнению ученых того времени, потенциал фоссилизации мягкотелых животных, и следовал феномен видимого в ископаемой летописи внезапного появления жизни на планете.
Однако в середине 20-го века во всем мире была открыта богатая докембрийская бесскелетная фауна. Стало понятно, что минеральные скелеты для архивирования прошлой жизни не обязательны: в ископаемой летописи тем или иным образом сохраняются остатки мягкотелых многоклеточных организмов. Мало того, от бактерий и их полисахаридного чехла, как стало понятно к концу 20-го века, тоже остаются фоссилии, наглядно демонстрирующие раннюю историю земной жизни (обзор в: Schopf, 1999).
Логичным следствием всего этого комплекса открытий стало переосмысление кембрийского феномена. Если сохранение бесскелетных форм возможно, то отсутствие фоссилий говорит об отсутствии животных, следовательно, многоклеточные животные могли возникнуть именно тогда, на границе кембрия и докембрия. Данная версия противоречит постепенности эволюционных преобразований, так как эдиакарские и раннекембрийские представители многоклеточных животных имеют сравнительно сложную морфологию. Альтернативная позиция допускает наступление на планете неких условий, обеспечивших образование фоссилий как скелетных, так и бесскелетных форм. Эта версия страдает отсутствием теоретических концепций о формировании фоссилий бесскелетных форм и скудостью соответствующей феноменологии.
С разработкой и удешевлением методик молекулярного анализа были предложены реконструкции филогенезов различных групп многоклеточных с датировками точек ветвления. В результате стало очевидно, что в эволюционной истории всех известных групп животных обособляется особый интервал, от которого не остается следов в ископаемой летописи, но который предшествует как диверсификации группы, так и появлению ее скелетных представителей (обзоры: Erwin et al., 2011; Reiss et al., 2015; Cunningham et al., 2017). Природа этого разрыва пока не ясна. Даже больше: вопрос о его природе начал оформляться лишь в последнее десятилетие, когда набрались результаты молекулярных реконструкций разных таксонов, и статистики начали осторожнее интерпретировать имеющийся набор исходных данных (Budd, Mann, 2020).
Как в эту острую проблематику (практически мировоззренческого толка) вписывается вопрос о происхождении минерализованных скелетов? Ясно, что главный интерес эволюционистов уже сместился к мягкотелым животным, так как минерализованные скелетные формы – и не первые представители многоклеточных животных (молекулярные реконструкции), и не первые сохранившиеся в ископаемой летописи (летопись мягкотелых). Однако все же проблематика кембрийской скелетной революции исключительно интересна для эволюционистов. В ней соединяются биологические и геохимические процессы – косное и живое, порождая в результате видимый эффект скелетизации. В этом смысле изучение скелетной эволюции шире, чем изучение эволюции мягкотелых, и шире, чем изучение эволюции геохимических условий жизни.
Эволюционная проблематика минерального скелетообразования в настоящее время фокусируется на следующих вопросах. Насколько сближено во времени появление скелетных и бесскелетных форм у различных групп, и какова природа этой близости? Почему скелеты появляются в различных группах в узком временнóм интервале именно вокруг границы докембрия/кембрия? Какова роль скелетов, в том числе и минеральных, в мире ранних многоклеточных? Почему скелеты у разных животных, одноклеточных и многоклеточных, строятся из несходных минералов? К этим вопросам с обязательностью примыкают и датировка ранних скелетных и бесскелетных ископаемых, и их морфологическая интерпретация, а также широкий круг взаимосвязанных задач по тафономии, расшифровке механизмов фоссилизации у мягкотелых и скелетных форм, выявление факторов среды, отвечающих за эти процессы. В данной статье предлагается обзор имеющихся сведений по данным темам.
Под скелетными минеральными образованиями здесь подразумеваются наружные покровные структуры (панцири, раковины), внутренние покровные и осевые структуры (таблички, склериты, шипы, спикулы), а также части ротового вооружения (ротовые и глоточные зубы). Здесь не рассматриваются патологические биоминеральные образования, постройки строматолитов, органо-минеральные молекулы, которые тоже иногда включают в перечень биоминеральных образований.
РАННИЕ ИСКОПАЕМЫЕ ФОРМЫ С МИНЕРАЛЬНЫМИ СКЕЛЕТАМИ
Очевидно, что в истории жизни одноклеточные формы животных предваряли многоклеточные, поэтому логично было бы ожидать появления в ископаемой летописи одноклеточных скелетных животных до многоклеточных. Рассмотрим, какие одноклеточные эукариоты с минеральными скелетами известны в докембрийской ископаемой летописи?
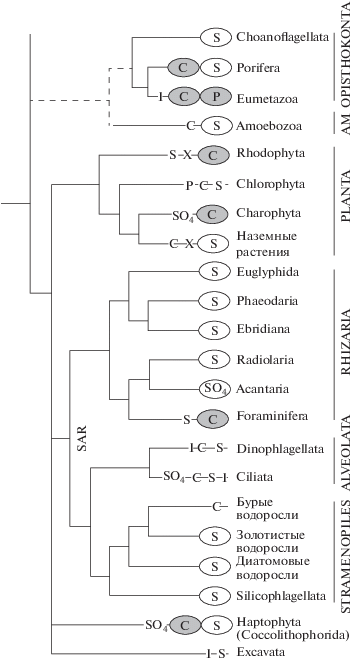
В современной филогении эукариот выделяется шесть клад: Opisthokonta, Amoebozoa, Plants, Chromalveolata, Rhizaria, Excavata (рис. 1). Порядок отделения этих клад от общего предкового корня пока не определен. Клада Opisthokonta объединяет животных, грибы и хоанофлагеллят. В Amoebozoa входят группы одноклеточных и колониальных (многоклеточных) Dictyostelia и Myxogastria. Среди амебозой имеются представители с минерализованными наружными раковинами – это группа одноклеточных раковинных амеб, скорее всего, сборная (Lahr et al., 2013).
Рис. 1.
Реконструкция филогенетических связей основных клад эукариот; вертикальными линиями показаны основные клады, AM – Amoebozoa, клада Excavata (внизу) не обозначена линией. Эллипсами показано преобладание в кладе форм с минеральными скелетами. Характерные биоминералы: C – известковые, S – кремниевые, SO4 – сульфат Sr у радиолярий, сульфат Ba/Sr у харовых водорослей и фораминифер (по: Krejci et al., 2011), фосфаты у зеленых водорослей по: Domozych et al., 1991; I – оксиды и сульфиды железа, X – оксалаты. Схема с изменениями по: Knoll, Kotrc, 2015, данные по биоминералам по: Hendry et al., 2018.
Самые ранние находки раковинных амеб 778–742 ± 6 млн лет (Porter, Knoll, 2000; Porter et al., 2003) известны из неопротерозойской формации Квагунт (Kwagunt) в Аризоне. Из 9 видов раковинных амеб, описанных из этой формации, 8 предположительно имели органическую раковину, а девятый вид, Melicerion poikilon Porter et al. 2003, имел раковинку с интересной сотообразной структурой. В ископаемом виде эта раковинка выглядит в виде вазы с минеральными округлыми бляшками, промежутки между которыми выполнены соединениями железа. Такие формы, по мнению авторов работы (Porter, Knoll, 2000), могли получиться, если на органических промежутках между исходно минеральными чешуями осаждалось железо в том или ином виде. Таким образом, M. poikilon видится на сегодняшний день древнейшим представителем протистов с минерализованным секретируемым скелетом.
Опубликованы описания находок раковинных амеб из архейских слоев Лехтинской структуры в Карелии (2.8 млрд лет) с видимой характерной чешуйчатой минерализованной раковиной, однако сами авторы признали их засорением (Розанов, Астафьева, 2020). Другие находки микроорганизмов из тех же образцов, в которых авторы усматривают очень мелких раковинных амеб, тоже, возможно, являются современным загрязнением, так как доказательства их первичного присутствия в образцах выглядят недостаточными (изучались недавно сделанные сколы).
Несколько моложе раковинные амебы из Юкона, формация Коал Крик (Coal Creek), возраст вмещающих слоев 742 ± 6 млн лет (Strauss et al., 2014). Раковины этих амеб, возможно, были органическими, а не минерализованными. Это следует из их тафономии: в одном слое встречены одинаковые по морфологии формы со стенками и из кремнезема, и из фосфата или карбоната кальция. Поэтому предполагается, что в ходе захоронения исходно органическая раковина могла замещаться различными минералами. Этот и предыдущий примеры показывают, что отличить исходную биоминерализацию от диагенетической является задачей совсем не тривиальной.
Амебы c агглютинированной раковиной найдены в позднепротерозойских слоях в Намибии и Монголии. К сожалению, для слоев с этими находками пока даны широкие возрастные рамки: 746–635 млн лет для формации Растхоф (Rasthof) в Намибии, 659–635 млн лет для формации Тайшир (Taishir, входит в цаганоломскую группу) в Монголии (Bosak et al., 2011; Moore et al., 2017). В Замбии, в слоях формации Каконтве (Kakontwe), перекрывающих осадки стурского оледенения (т.е. возможная нижняя граница 727 млн лет, а датировок верхней границы нет), найдены предположительные остатки амеб с агглютинированной раковиной (Moore et al., 2017). Не менее интересны вазообразные формы из формации Урукам (Urucum) в Бразилии, возраст которой определен широким интервалом 889–587 млн лет: но это, по всей вероятности, раковинные амебы с исходно органической стенкой, окремненной в ходе диагенеза (Morais et al., 2017). К настоящему времени известно более двадцати позднепротерозойских местонахождений в разных частях света, в которых описаны различные виды раковинных амеб (обзор в Morais et al., 2017). Однако из них, по-видимому, лишь M. poikilon были исходно минерализованными.
Помимо раковинных амеб следует упомянуть остатки одноклеточных организмов и отдельные склериты из формации Фифтинмайл (Fifteenmile) в северо-восточной Канаде. Слои с этими ископаемыми датируются возрастным интервалом 810.6–717.4 млн лет. Изначально, исходя из внешнего сходства с Chrysophyta, предполагалось, что данные склериты были кремниевыми, а их носителей отнесли к самым ранним биоминерализаторам (Allison, Hilgert, 1986). Однако последующий анализ показал, что они сложены органическими молекулами и фосфатом кальция, а их филогенетическое родство не яснo (Knoll, Kotrc, 2015). Позже микроструктурный анализ выявил упорядоченность в укладке апатитовых гранул в этих склеритах, и была выдвинута гипотеза, что фосфатизация данных склеритов первичная, а не вторично-диагенетическая (Cohen et al., 2017). Эти склериты иллюстрируют короткий (по-видимому) эпизод самой ранней биоминерализации; он мог быть следствием врéменнoго повышения концентрации фосфора в палеоокеане (Cohen et al., 2017).
Кроме раковинных амеб и “безродных” склеритов из Юкона обсуждаются находки и других одноклеточных простейших. Например, органостенные кубки из известняков Монголии, возрастом 710–635 млн лет, напоминающие инфузорий Tintiniida (Bosak et al., 2011). Следует также упомянуть публикацию Баттерфилда (Butterfield, 2009), где из коллекции органостенных ископаемых из формации Винниат (Wynniatt) в Арктической Канаде (возраст 743 млн лет) выделено одно ископаемое, напоминающее губку или хоанофлаггелята. Однако, по мнению Антклиффа с соавторами (Antcliffe et al., 2014), для подобной интерпретации нет никаких “морфологических” оснований. Других одноклеточных эукариот со скелетами или без них, ведущих к линии животных, пока не найдено.
Фораминиферы вместе с радиоляриями представляют кладу Rhizaria. Диверсификация фораминифер начинается, по-видимому, только в кембрии (Culver, 1994), при этом известны и более ранние представители этой группы. Фораминиферы со скелетом – Platysolenites с трубчатой агглютинированной раковиной – зарегистрированы в поздневендском материале скважины Восток 3 в западной Сибири (Конторович и др., 2008). К ранним однокамерным агглютинированным фораминиферам может также относиться вазообразная форма из позднего эдиакария южного Китая (Hua et al., 2010). Однако к данной интерпретации следует относиться с известной осторожностью: у южнокитайских организмов поверхностный минерализованный слой кремниевый, что для агглютинированных фораминифер совсем не характерно. Помимо упомянутых форм, есть интересная и взвешенная морфологическая трактовка скелетного организма Palaeopascichnus linearis из поздней эдиакарской эпохи. Это, вероятно, представитель многокамерных фораминифер с агглютинированной “окантовкой” из кристаллов кальцита (Kolesnikov et al., 2018). Кстати, авторы обращают внимание также на двойника Palaeopascichnus – на Orbisiana linearis из южного Китая, представителя ланьтяньской биоты (632–576 млн лет: Yuan et al., 2011), у которого нет следов такой окантовки. Если принять данную интерпретацию Palaeopascichnus, то происхождение фораминифер с многокамерными скелетными элементами нужно удревнить до позднего докембрия. Фораминиферы с известковой раковиной появляются только в ордовике.
Самые ранние скелетные радиолярии зарегистрированы в раннем кембрии Южного Китая (верхи терреновской эпохи, Stage 2: Chang et al., 2018). Чуть моложе радиолярии атдабанского-ботомского возраста, Stage 3, они известны не только из Южного Китая, но и из Горного Алтая (Ma et al., 2019; Obut, Danelian, 2019). Достоверность более ранних находок оспаривается (обзор ранних радиолярий в Aitchison et al., 2017).
Скелеты у многоклеточных животных появляются в ископаемой летописи около 550 млн лет назад: их находки известны из поздней эдиакарской эпохи Намибии, Сибири, Испании, Китая, Монголии, Бразилии, Парагвая, США и Канады. Из них к ранним скелетным многоклеточным относят 15 ископаемых родов. Среди них проблематичные остатки Suvorovella, Sinotubulites, а также Namapoikia. Эти три рода, возможно, близки к Porifera (Wood, Penny, 2018). Также найдены скелетные представители Cloudina и Namacalathus. Первые – это возможные представители книдарий, и менее вероятно, кольчатых червей, судя по наличию у них продольного деления (Schiffbauer et al., 2020). Namacalathus сближают с лофотрохозоями (Zhuravlev et al., 2012; Wood et al., 2017). У всех этих форм, кроме Namacalathus, скелеты организованы в виде тонкой, относительно простой поверхностной структуры из арагонита или магнезиального кальцита (Wood et al., 2017).
Наилучшим образом изучена микроструктура скелетов Namacalathus: их минеральный скелет представляет собой слой толщиной около 60 мкм, состоящий из параллельно уложенных удлиненных кристаллов кальцита. Скелет Cloudina состоит из слоев с разными характеристиками кристаллов: тонкие слои грануловидных кристаллов перемежаются с более толстыми слоями из удлиненных кристаллов. Маловероятно, что подобные образования являются продуктом посмертной поверхностной минерализации (Zhuravlev et al., 2012; Schiffbauer et al., 2020). Поэтому их с полным основанием можно считать скелетными животными, а не тафономическими артефактами.
Для трех ранних многоклеточных форм с минеральными скелетами известны морфологические аналоги, но без следов биоминерализации или скелетов. Это пары Suvorovella – Eoporpita medusa, Cloudina – Conotubus, Sinotubulites – Corumbella. По всей вероятности, скелеты у этих ранних эдиакарских животных формировались в результате простой минерализации наружных тканей в условиях повышенного содержания кальция и магния в морской воде (Wood et al., 2017). Минерализация происходила, по-видимому, по упорядоченно организованной белковой матрице.
Самые ранние бесспорные скелетные губки, а точнее их спикулы, описаны из китайской формации Яньцзяхэ (Yanjiahe), из базального слоя раннего кембрия (Chang et al., 2017). В химическом составе данных спикул преобладает кремний, и это не вторичное окремнение, а именно исходный состав спикул. Вместе с кремнистыми спикулами были найдены образования из фосфата кальция, похожие по форме на спикулы. Но эти последние признаны псевдоморфозами минеральной (абиотической) природы. Аналогичные по составу и морфологии структуры известны из формации Доушаньтуо докембрийского возраста, так что и эти ранние формы следует, скорее всего, считать минеральными псевдоморфозами (Chang et al., 2017).
Вид Gravestokia pharetroniensis Reitner 1992 из Южной Австралии – это один из самых ранних представителей губок со скелетом из карбоната кальция. Раннекембрийская Gravestokia росла на биогермах археоциат, стенки которых построены из кальцита. Кстати, если археоциат относить к губкам, то появление у губок известкового скелета нужно удревнить до томмотского века (терреновская эпоха).
Ископаемые губки известны из более ранних эпох: это Namapoikia и Eocyathispongia позднеэдиакарского возраста. Отнесение Eocyathispongia к губкам не признается некоторыми исследователями из-за необычной для губок картины роста, из-за формы и расположения пор и из-за толщины пинакодермы, в полтора раза превышающей таковую у современных губок (Botting, Muir, 2018). Но предлагаемые интерпретации, в особенности их широчайший диапазон – “водоросли, амебы или другие не-метазои”, – заставляют неспециалистов подождать более определенной версии. У Namapoikia и Eocyathispongia никаких следов спикул не выявлено, и скорее всего, отсутствие спикул вряд ли нужно считать результатом посмертного растворения биоминералов. Eocyathispongia и Namapoikia являлись, по всей видимости, первично бесспикульными, подобными современным Oscarella.
Обсуждая древнейших губок, нельзя не отметить фосфатизованные остатки Otavia antiqua Brain et al. 2012 из формаций Отави (Otavi) и Нама (Nama) в Намибии. Возраст слоев с находками в Отави 760 и 635 млн лет, а в Нама 548 млн лет. Этот организм, изученный по тысяче экземпляров, обладал наружной стенкой, пронизанной многочисленными порами, а также в ней имелись немногочисленные крупные отверстия; внутренняя часть была заполнена клеточным лабиринтом с полостью в центральной части. Авторы исследования интерпретировали Otavia как губкоподобный организм, посчитав маловероятным, что эти образования имели бактериальное происхождение, так как никаких обычных бактериальных форм не было обнаружено (Brain et al., 2012). Однако минерализованных структур и у Otavia нет.
В австралийской формации Трезона (Trezona), ограниченной временны́м интервалом между двумя оледенениями 710–635 млн лет, тоже найдены фоссилии с губкоподобной морфологией: эллипсоидные, без следов симметрии, заполненные сетью внутренних каналов, открывающихся наружу отверстиями. Были они изначально минерализованы или нет, сказать невозможно (Maloof et al., 2010). Интересна и интерпретация Thectardis из местонахождения Мистейкен Пойнт на Ньюфаундленде (возраст 578 млн лет) как организма с губкоподобной организацией. Thectardis представляет собой треугольные отпечатки, на которых видна система внутренних каналов; согласно модели, вода по этим каналам двигалась, по-видимому, примерно так же, как и в губках (Sperling et al., 2011). Но и здесь не заметно следов биоминерализации.
Критический (и весьма беспощадный) обзор находок предполагаемых докембрийских губок и их биомаркеров предложили Антклифф с коллегами (Antcliffe et al., 2014). В частности, Otavia на основе тафономических несостыковок и исходно ненадежных морфологических интерпретаций признана этими авторами первично минеральным, а не биологическим образованием. Очевидно, что специалистам по губкам еще предстоят дискуссии о ранней морфологии и биохимии древних представителей.
Так или иначе, но отсутствие скелетных губок в докембрийское время заставляет предположить, что губки приобрели минеральные скелеты только в начале кембрия, а в докембрийское время губки вообще не имели спикул или спикулы были слабоминерализованными. Такие губки со слабоминерализованными кремниевыми скелетными структурами (т.е. с высоким соотношением органического материала к минеральному) известны из раннекембрийских отложений южного Китая (формация Hetang) – это Vasispongia delicata Tang, Xiao 2019 (Tang et al., 2019). Микроволокнистая структура органического материала этих слабоминерализованных спикул похожа на аналогичные по форме, но чисто органические образования у губок эдиакарского возраста. Это может указывать на то, что спикульный скелет сформировался на базе существующих органических структур за счет поверхностной минерализации. Иными словами, картина напоминает ту, что описана для ранних скелетных проблематик докембрия.
В этой связи интересно упомянуть Zhegallina из атдабана Монголии (Ушатинская, 2004). Этот организм имел брахиоподоподобное строение – похожая форма билатерально-симметричных створок с видимыми местами прикрепления мускулов, на одной из створок видна выемка для прохода прикрепительной ножки, а на другой створке – край прямой. При общей схожести как общей формы, так и деталей строения, на раковинке Zhegallina отсутствует верхушка, которая могла сформироваться только на минерализованной раковине. Автор находки приходит к выводу, что этот брахиоподоподобный организм имел первично органическую (возможно, хитиновую) раковину.
Таким образом, самые ранние одноклеточные с минеральными скелетами известны в породах неопротерозоя в возрастном интервале 778–635 млн лет. Среди этих ранних форм имеются виды и с минеральной, и с первично органической раковиной, из них последние явно преобладают. Самые ранние многоклеточные животные с минеральными скелетами (проблематики, вероятные книдарии и губки) найдены в слоях эдиакарского возраста (550 млн лет), а древнейшие бесспорные спикулы губок пока относятся к раннекембрийскому возрасту. Описанные ранние скелеты характеризуются относительно простой организацией и представляют собой поверхностную минерализацию покровов. Такие скелеты могли образоваться на базе предшествующих органических конструкций.
МИНЕРАЛЬНОЕ РАЗНООБРАЗИЕ РАННИХ СКЕЛЕТОВ
Биоминерализация в том или ином виде свойственна представителям большинства линий эукариот (Hendry et al., 2018) (рис. 1). Известно около 78 классов биоминералов (Ehrlich, 2019), однако скелеты животных, за несколькими любопытными исключениями, построены из фосфата и карбоната кальция (в первом случае это в основном минерал даллит, а во втором – кальцит или арагонит) и аморфного кремнезема (Knoll, Kotrc, 2015).
У представителей одноклеточных эукариот основной скелетный минерал – это кремнезем (рис. 1). В кладах Rhizaria, Stramenophyta и Amebozoa скелеты в большинстве своем кремниевые; только у сестринской к ним группе Haptophyta (Coccolithophorida) – известковые. Нужно, однако, не забывать, что скелетные кокколитофориды появились лишь в раннем триасе, их диверсификация началась в мезозойских океанах, тогда как остальные линии с минеральными скелетами сформировались уже к раннему кембрию. Тогда же, в мезозое, стали разнообразны динофлагелляты и силикофлагелляты, носители кремневых скелетов.
Среди Amebozoa некремниевые скелеты, по всей видимости, представляют редчайшие исключения (Knoll, Kotrc, 2015).
В кладу Rhizaria включены скелетные линии как с известковыми скелетами (фораминиферы), так и с кремниевыми скелетами (радиолярии), но в обеих линиях имеются исключения. У фораминифер самые ранние кембрийские представители имели органическую раковину или иногда агглютинированную (см. выше), a в ордовике появилось большое разнообразие фораминифер с секретируемыми известковыми раковинами. Кремниевые скелеты у фораминифер чрезвычайно редки: например, секретируемый кремниевый скелет есть у современной глубоководной Miliammellus Saidova et Burmistrova 1978, а агглютинированные раковины из кремниевых частиц характерны для вымершего мелового рода Rzehakina (Bovee, 2012).
К радиоляриям относится интересная группа Acantharia: сначала она рассматривалась как отряд или подкласс в типе Radiolaria, потом ее признали сестринской к Radiolaria линией, однако современные молекулярные исследования помещают ее среди других четырех ныне существующих отрядов Radiolaria (Suzuki, Aita, 2011). У акантарий скелет не кремниевый, а целестиновый (сульфат стронция).
Известен ископаемый одноклеточный организм Protolagena из позднего докембрия Намибии и Южного Китая (обзор по: Wood et al., 2017). У Protolagena, по-видимому, имелась секретируемая известковая раковина. Но филогенетическая привязка Protolagena не ясна, ассоциациия с однокамерными фораминиферами Lagenidae основана лишь на внешнем сходстве.
Таким образом, в кладе Rhizaria кремниевые скелеты (у радиолярий) появились в ископаемой летописи в кембрийское время, а известковые секретируемые скелеты (у фораминифер) в ордовике, хотя пока не ясно, насколько эта разница отражает реальную картину, а не отсутствие известных ископаемых или специфику наших приемов выявления и анализа посмертного диагенеза организмов.
Фосфатная биоминерализация у одноклеточных редка, хотя и встречается. Например, из фосфата и карбоната кальция состоят минерализованные ажурные пояски или сеточки у некоторых инфузорий (обзор по: Lemloh, 2016). Хотя эти структуры трудно причислить к настоящим скелетам, но их функция, как и у скелетов, скорее всего опорная.
В противоположность одноклеточным у многоклеточных животных кремниевые скелеты известны только у губок демоспонгий, гексактинеллид и гомосклероморф, зато широко распространены скелеты на основе карбоната и фосфата кальция (рис. 2). У губок кремниевые и известковые скелеты появились, судя по известным находкам, более или менее синхронно в томмотском веке (Stage 2) раннего кембрия.
Рис. 2.
Реконструкция филогенетических связей основных клад Metazoa; цифры – оценка времени ветвления клад, млн лет. Эллипсами показано наличие в кладе представителей с минерализованными скелетами: С – известковые, S – кремниевые, P – фосфатные. Схема по: Telford et al., 2015, с дополнениями по: Sweet, Donoghue, 2001; Moysiuk et al, 2017; Shu et al., 2017; Giribet; Edgecombe, 2019; Olempska et al., 2019; датировки точек ветвлений по: Dohrmann, Wörheide, 2017.
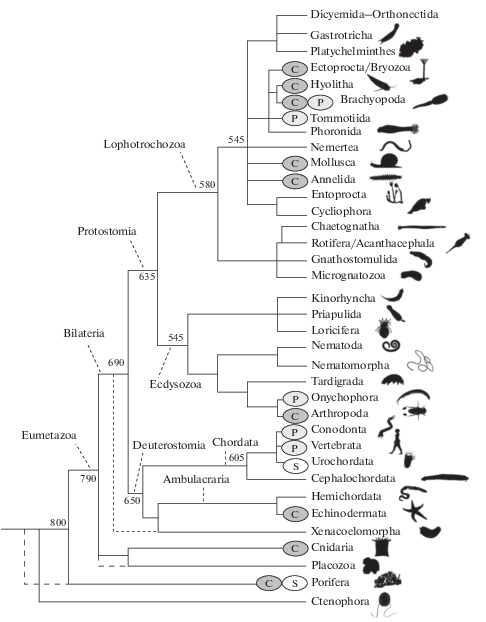
Как упоминалось выше, скелеты самых ранних книдарий – позднеэдиакарских – были построены, по-видимому, из арагонита. Арагонитовые скелеты приобрели в раннем кембрии моллюски, проблематичные группы Coeloscleritophora, Coleolida и, вероятно, анабаритиды и Cambroclavida. Вслед за ними в раннем кембрии появились кальцитовые археоциаты, карбонатные брахиоподы, известковые губки, несколько позже – трилобиты с панцирем из кальцита и хитина, иглокожие с внутренним скелетом из высокомагнезиального кальцита (Porter, 2010).
В раннем кембрии появились брахиоподы как с известковой, так и с фосфатной раковиной. Какие из них появились раньше и почему у этой группы раковины столь разные, пока не ясно. Известно, что у фосфатных брахиопод есть ферменты, позволяющие усваивать фосфор из пищи, а у известковых брахиопод таких ферментов нет (Iwata, 1981). Трудно сказать, что является здесь первичным, а что вторичным – наличие ферментов позволило строить раковину или необходимость заставила фосфатных брахиопод изобрести ферменты для усвоения фосфатов.
У томмотиид – близкой к брахиоподам группе – раковина состояла из фосфата кальция, а хиолиты – вторая сестринская группа – имели раковину из арагонита. И те, и другие являются характерными, повсеместно распространенными элементами раннекембрийской фауны. Тогда же в раннем кембрии появились и другие многочисленные группы беспозвоночных с карбонатными раковинами, а в позднем кембрии – конодонты со скелетными элементами из фосфата кальция. Эти последние, согласно реконструкциям по сохранившимся мягким тканям, принадлежат линии хордовых (Sweet, Donoghue, 2001).
Нужно отметить, что многие представители кембрийской мелкораковинной фауны, которые в ископаемом виде снабжены фосфатными раковинами, изначально имели, вероятно, известковые скелеты, которые вторично заместились в ходе диагенеза в фосфатоносных обстановках (Porter, 2004). Это, вероятно, справедливо для протоконодонтов, которых в настоящее время относят к щетинкочелюстным. Протоконодонтов традиционно считали животными, имеющими фосфатные скелетные элементы. Однако, скорее всего, это не так: фосфат кальция в их ротовом вооружении появился в результате замещения исходно органических покровов. Об этом свидетельствует явное морфологическое сходство ротового вооружения протоконодонтов с соответствующими элементами современных щетинкочелюстных (Szaniawski, 2002). У других ископаемых щетинкочелюстных (например, у Ankalodous sericus) щетинки и зубчики состояли, по все видимости, из хитина, а не из фосфата кальция (обзор по: Shu et al., 2017).
Подавляющему большинству представителей клады экдизозой свойственна известковая минерализация скелетов. Относительно уверенно можно утверждать, что из всей этой клады лишь для Microdictyon, которых принято сближать с онихофорами, характерна фосфатная биоминерализация (Yang et al., 2015). У Микродиктиона скелетные склериты, покрывающие тело, по-видимому, изначально были сложены фосфатом кальция. Современные онихофоры не имеют минерализованных скелетных элементов.
В принципе в различных группах животных (см. ниже) описываются ископаемые формы с предположительной минерализацией фосфатами. Однако в каждом случае доказать первичность фосфатной биоминерализации, а не вторичное фосфатное замещение исключительно трудно по трем причинам. Первая – фосфаты являются одним из консервирующих агентов для мягких тканей, поэтому если мягкое тело сохраняется в ископаемой летописи, то с высокой вероятностью в нем окажется фосфор, и скорее всего в виде фосфата кальция, также характерного для биоминерализации. Вторая причина в том, что известковые структуры даже на нано-размерном уровне при вторичном замещении фосфатом кальция сохраняют свои форму и размеры (Gilbert et al., 2019). Иными словами, наличие фосфатных микро- и наноструктур не позволит уверенно утверждать исходно фосфатную биоминерализацию. Третья причина состоит в посмертной адсорбции фосфатов мягкими тканями: в опытах по фоссилизации ракообразных показано, что кутикула ракообразных, как и их мышцы, за несколько недель инкубации в морской воде (искусственной) насыщаются фосфатами вдесятеро против исходного химического состава (Briggs, Kear, 1994).
Фосфатная биоминерализация предполагалась у кембрийской группы фосфатокопин, скорее всего сборной, которую традиционно было принято сближать с остракодами Bradoriida. Находки фосфатокопин известны из Китая, Англии, Швеции, Польши, северной Америки, Сибири, и все они приурочены к фосфатоносным слоям. Поэтому фосфатный состав их панциря является, по всей видимости, результатом посмертной фосфатной минерализации (см. обзор Olempska et al., 2019).
Есть данные о фосфатных добавках в самом наружном слое экзоскелетов некоторых трилобитов (Teigler, Towe, 1975; Dalingwater et al., 1991). Однако изучение диагенетических изменений указывает, что конкретные панцири были исходно построены из хитина и кальцита (McAllister, Brand, 1989), так что и в этом случае фосфатная минерализация, скорее всего, вторична. И опять же, показательны в этом смысле вышеупомянутые тафономические эксперименты, показывающиe быстрое насыщение кутикулы ракообразных соединениями фосфора. При этом нельзя исключить присутствие в наружном слое кальцитовой кутикулы трилобитов не окристаллизованной фосфатной фазы, а просто каких-то фосфатных добавок, как это имеет место, например, у современных омаров Homarus americanus (Mergelsberg et al., 2019).
Также известен Phytophilaspis – членистоногое из ботомского века (ранний кембрий) Сибири (Ivantsov, 1999). Это животное в целом напоминает трилобитов – сегментированное тело с продольной осью, голова с лицевыми швами и крупными глазами по бокам глабели, гипостом характерной “трилобитовой” конфигурации. Но у фитофиласписа наружные покровы были, по всей видимости, устроены иначе, чем у трилобитов. Экзоскелет у них был не трехслойный, как у трилобитов, а однослойный, а если и был минерализован, то слабо. Об этом свидетельствуют складки на покровах, что исключено для жесткого минерализованного панциря. Сама же минерализация могла быть и фосфатной (Lin et al., 2010), так как на шлифах покровов фитофиласписа обнаружены грануловидные пятна с повышенным содержанием фосфора и кальция. Если эти гранулы не являются результатом селективной адсорбции фосфатов какими-то органическими структурами эпикутикулы, то фитофиласписа следует рассматривать как пример первичной фосфатной биоминерализации членистоногих. Phytophilaspis вместе с другими близкими родами членистоногих с неминерализованным хитиновым скелетом (Sinoburius, Xandarella) составляет сестринскую по отношению к трилобитам линию (Paterson et al., 2010): и те, и другие появились в раннем кембрии.
К экдизозоям относится кембрийско-силурийская группа Palaeoscolecida, которую по строению глоточного аппарата сближают с современными приапулидами. Подавляющее большинство палеосколецид происходит из фосфатных слоев различных формаций, поэтому неудивительно, что их покровы и глоточное вооружение содержит повышенное количество фосфора. Однако в нижнеордовикском лагерштетте Фезоата некоторые экземпляры палеосколецид (превосходной сохранности) найдены в глинистых сланцах, и у них глоточные зубцы содержат фосфор и кальций, а пространство между зубцами – нет (Martin et al., 2016). В этом случае можно с большей уверенностью говорить о первично фосфатизованном глоточном вооружении, хотя нужно иметь в виду, что ни у каких современных приапулид и родственных им киноринхов и лорицифер биоминерализация не известна.
В целом невозможно определить, какие скелеты – фосфатные или карбонтаные – появляются раньше; они, судя по ископаемой летописи, сформировались более или менее одновременно в разных линиях многоклеточных (Murdock, Donoghue, 2011). Что же касается становления известковых скелетов, то данные по различным разрезам указывают на более раннее появление арагонитовых скелетов или же в некоторых разрезах кальцитовые и арагонитовые скелеты появляются одновременно (Porter, 2010). Является ли такое первенство следствием термодинамически приоритетного осаждения карбоната кальция на органике в виде арагонита, а не кальцита, или же условия окружающих вод в позднем докембрии благоприятствовали осаждению арагонита – пока не ясно.
Не могу удержаться от соблазна упомянуть в этой связи интересный пример с появлением биоминерализации у муравьев-листорезов Acromyrmex echinatior Forel 1899 (Li et al., 2020). У этих муравьев поверхность тела покрыта тонким (~2 мкм) слоем высокомагнезиального кальцита. Кальцитовый слой формируется на 8-й день после выхода взрослого муравья из куколки, кристаллизуясь, по всей видимости, на специфических для этого вида белковых молекулах экзокутикулы. Данная биоминерализация не является результатом пассивного осаждения кальцита из внешней среды, так как на кутикуле мертвого муравья кальцит осаждается в виде арагонита, а не высокомагнезиального кальцита. Эксперименты показали, что усиленный минералами наружный покров защищает муравья в схватках с более сильным противником и что, вероятно, еще важнее, снижает чувствительность к обычным для муравьев патогенам (см. ниже о триггерах биоминерализации).
Среди экзотических слагаемых в скелетах нужно отметить минералы железа. В первую очередь, следует назвать классический пример биоконтролируемого ожелезнения – это зубы моллюсков, с которых собственно и началось систематическое изучение явления биоминерализации (Lowenstam, 1967). Из менее известных, но не менее интересных примеров назову еще два – это губки Hippospongia communis и моллюски Chrysomallon squamiferum. У средиземноморских мягких H. communis спонгиновые волокна имеют нано-кристаллические включения гетита, отчасти отсюда и темно-охристый цвет этих губок (Ehrlich, 2019). У глубоководного моллюска C. squamiferum, обитателя черных курильщиков, наружный слой раковины сложен сульфидом железа (грейгитом). Не только раковина, но и нога, подобно рыцарским латам, покрыта “железными” пластинами (Yao et al., 2010). Гранулы грейгита заключены в упорядоченно уложенные органические капсулы, организующие стабильный по строению поверхностный слой. Это позволяет уверенно утверждать, что железо здесь – не дополнительное включение, а биологически контролируемый компонент микроструктуры раковины. Ясно, что такой необычный скелет может существовать только в низкокислородных и насыщенных железом обстановках, подобных ландшафтам черных курильщиков, в любых других условиях железо бы быстро окислялось, теряя свои свойства. В целом пример с моллюском Chrysomallon показывает, насколько несложно для многоклеточных, осваивающих необычные и даже экзотические для группы условия, дополнить скелет новыми минералами.
Очень интересен вопрос, почему у одноклеточных и многоклеточных организмов скелеты столь различны по минеральному составу: у одноклеточных преобладают кремниевые скелеты, а у многоклеточных – известковые или фосфатные. Нолл и Котрк в своей обзорной статье по биоминерализации простейших (Knoll, Kotrc, 2015) обсуждают гипотезу о конструктивных преимуществах аморфного кремнезема. Кремнезем даже в микронной размерности представляет собой высокопористый прочный материал, легко соединяющийся с органическими макромолекулами, что как раз и требуется для построения скелетов протистов. Кристаллы карбоната кальция накладывают конструктивные ограничения для построения скелетных элементов микроорганизмов. Многоклеточные тоже могли бы использовать такой удобный материал, как аморфный кремнезем, но растворенного в воде кремния, как считается, слишком мало для “крупного производства”, так что многоклеточным пришлось выбрать для этой цели менее дефицитный, хотя и более грубый материал на основе солей кальция. Других гипотез пока нет, хотя и эта требует ревизии: многоклеточные стеклянные губки вырастают до значительных размеров, также донные одноклеточные с кремнистым скелетом, например диатомовые водоросли, могут образовывать крупные скопления, и им, очевидно, хватает кремния для построения своих раковин. При обсуждении различий биоминералов одноклеточных и многоклеточных не может не удивлять отсутствие фосфатной биоминерализации у одноклеточных при известной востребованности биофосфатизации у многоклеточных. Напомню, что фосфатные гранулы – это вполне обычный внутриклеточный компонент одноклеточных организмов, так что при необходимости он мог бы быть рекрутирован на построение скелета. Следовательно, для одноклеточных должно было быть какое-то иное – и серьезное – ограничение для использования фосфата и карбоната кальция в скелетах, а для многоклеточных – кремния. Это, по-видимому, вопрос к биохимикам.
Таким образом, у одноклеточных и многоклеточных допустимы скелеты на основе и кремниевых, и кальциевых минералов. У одноклеточных нет настоящих скелетов из фосфата кальция, а для многоклеточных такие обычны. Ранние минеральные скелеты у одноклеточных, скорее всего, кремниевые, а известковые появляются несколько позже и существенно менее востребованы в одноклеточном хозяйстве. У многоклеточных минеральные скелеты в подавляющем большинстве состоят из карбоната или фосфата кальция, и те и другие появляются, видимо, одновременно. Предполагается, что разница в материальной основе скелетов одноклеточных и многоклеточных связана с лучшими микроконструктивными особенностями аморфного кремнезема, при этом растворенного в воде кремния не хватает для построения крупных скелетов многоклеточных. Однако данная гипотеза явно нуждается в пересмотре.
ФИЛОГЕНЕЗ СКЕЛЕТНЫХ ОРГАНИЗМОВ
Даже только из различия материальной основы скелетов одноклеточных и многоклеточных очевидно, что скелеты многоклеточных формировались не на основе скелетов их одноклеточных предков, а независимым образом. Иначе многоклеточных с кремниевыми скелетами было бы больше. Однако более информативной в этом смысле может быть реконструкция филогенезов линий одноклеточных и многоклеточных скелетных организмов.
Скелетные формы многоклеточных имеются в сестринских кладах первичноротых и вторичноротых, в кладах линяющих (Ecdysozoa) и лофотрохозоев (Lophotrochozoa), причем во всех имеются и фосфатные, и известковые скелеты. Если представить происхождение скелетов сходной минеральной основы от общего предка, то придется допустить, что в ходе эволюции скелеты терялись независимо 13 раз; если же придерживаться независимого приобретения одинаковых по минералогии скелетов, то получится, что в крупных кладах скелеты независимо возникали 14 раз (Murdock, Donoghue, 2011).
Рассмотрим подробнее происхождение известковых скелетов в тех группах, где присутствуют и эндогенные скелеты, и агглютинированные, и органостенные таксоны. На таких группах удобно видеть, насколько жестко наследуются скелеты. Для этого нужно рассмотреть группировку скелетных и бесскелетных представителей на филогенетических кладах, и на этом основании судить о наследовании или независимом происхождении минеральных скелетов. Судя по молекулярным реконструкциям, у фораминифер в целом агглютинированные раковины возникали независимо не менее семи раз. В группе в основном органостенных фораминифер Monotalamida минеральные раковинки появлялись по крайней мере дважды. А известковые секретируемые раковины появились независимым образом в пяти линиях фораминифер (см. обзор Pawlowski et al., 2013).
У кораллов (Anthozoa) известковый скелет формировался, по-видимому, не менее четырех раз (Romano, Cairns, 2000). Даже в пределах одного семейства Hydractiniidae (класс Hydrozoa) предполагают двукратное появление скелетов. Hydractiniidae – это сравнительно молодое семейство гидромедуз (оно появилось 65 млн лет назад), которое включает около полусотни видов без минеральных скелетов. Однако три вида все же приобрели известковые скелеты, а у некоторых представителей внутри гастродермы содержатся арагонитовые гранулы. Три скелетных вида на филогенетическом дереве Hydractiniidae разобщены, и их положение согласуется с положением лишь с видами-предшественниками, имеющими арагонитовые гранулы. Таким образом, данный пример наглядно демонстрирует независимое происхождение скелетов.
В целом, множественность происхождения скелетов в разных линиях у беспозвоночных животных говорит о независимом происхождении и относительной незамысловатости биохимического обслуживания процесса биоминерализации (Miglietta et al., 2010).
Нельзя не упомянуть еще об одной эволюционной возможности – о горизонтальном переносе генов, вовлеченных в построение минеральных скелетов. Один из показательных примеров такого рода – губка Astrosclera willeyana Lister 1900. Она относится к классу Demospongia и имеет известковый скелет, формирующийся из арагонитовых сферулитов. Как выяснилось, при их образовании работает ген белка, названного сферулином. Этот ген, оказывается, был заимствован губкой у симбиотических протеобактерий. Как показал анализ внутриклеточных структур губки, этот ген работает не у симбионтов-бактерий (что было бы естественно предположить), а в клетке самой губки (Jackson et al., 2011; Jackson, Wörheide, 2013).
Другой пример доказанного горизонтального переноса генов, связанных с биоминерализацией, относится к эволюции диатомовых водорослей (хотя биоминерализацию водорослей и растений я здесь не рассматриваю, но пример все же стоит упоминания). Доказано, что диверсификация диатомовых резко ускорилась в результате вовлечения в их метаболизм множества бактериальных генов. Среди этих генов были и те, что регулируют фиксацию кремния из воды и построение кремниевой раковинки. Получается, что биоминерализация диатомовых водорослей в известной мере унаследована от бактерий (Bowler et al., 2008). В настоящее время трудно представить масштаб влияния на скелетообразование горизонтального генетического обмена между самыми отдаленными категориями организмов, но в любом случае недооценивать его не следует.
Краткий обзор филогенезов показывает, что минеральные скелеты возникали параллельно в различных кладах и многоклеточных, и одноклеточных организмов. По-видимому, и у тех, и у других для организации скелетообразования не требуется значительных перестроек генома, поэтому скелеты быстро формируются, когда в том возникает нужда и складываются подходящие условия.
МОЛЕКУЛЯРНАЯ ОСНОВА СКЕЛЕТООБРАЗОВАНИЯ
С развитием методов геномики и протеомики появились надежды очертить минимальный исходный набор органических молекул, необходимых для скелетообразования, а также понять, какие преобразования в геноме необходимы для обретения минерального скелета. Предполагалось, что из такой молекулярной основы можно будет выявить биохимические свойства гипотетического скелетообразующего предка, который потом путем наращивания и трансформации своего исходного молекулярного набора мог породить широкий спектр скелетных наследников. Для биологически контролируемой минерализации обязательны, по крайней мере, три компонента: матрица для нуклеации биоминералов, средства доставки минеральных ионов к местам нуклеации, ферменты, обеспечивающие топографическую точность связи и снижающие энергетические затраты биоминерализации. В простейшем случае изучается весь этот трехкомпонентный комплекс, потому что разделить эти компоненты непросто.
Для кремниевых скелетов различных организмов детально изучен транспортный компонент биоминерализации: определены наборы транспортеров кремния (silica transporters, SIT) и проанализирована их экспрессия (Marron et al., 2016). У одноклеточных организмов имеется пять групп SIT, и их распределение по филогенетическому древу хаотично. У губок присутствует только одна группа SIT, самая распространенная среди биоминерализаторов кремния. Так как SIT присутствуют у некоторых организмов, не имеющих скелетов (к примеру, у колониальной амебы Dictyostelium), то авторы исследования предположили, что SIT изначально функционировали для удаления избытка кремния из клетки, а затем они были востребованы для иной – обратной – функции, для переноса ионов кремния в клетку.
У моллюсков определили около пятисот белков, участвующих в скелетообразовании (очевидно, что это общая сумма трех компонентов) (Marin et al., 2016). У ракообразных таких белков, по крайней мере, несколько десятков: они контролируют адсорбцию кальция, связывание его с хитином, многие участвуют в регуляции линьки и декальцификации. Так, у морского желудя Balanus amphitrite при скелетообразовании экспрессируется 52 белка, разделенных на 11 функциональных групп. У брахиопод Laqueus rubellus выявлено около 40 скелетообразующих белков (Isowa et al., 2015).
Для представления об исходном репертуаре скелетообразующих агентов (белков и генов) важно выделить общее и различное, оценив его соотношение: общее может быть той исходной основой, от которой стартовала эволюция скелетов. Показательным в этом смысле является сравнение модельных видов моллюсков: устриц Pinctada (двустворчатые) и гастропод Lottia gigantea и Haliotis. У изученных видов устриц было выявлено наибольшее число белков раковины – 67. Из них с видами рода Haliotis оказался один общий белок (у видов этого рода определено всего 18 раковинных белков), а с морским блюдечком – 8 общих белков (у этого вида определено 32 белка). У двух видов гастропод нашлось всего 2 общих белка, пересечений во всех трех модельных группах не нашлось вовсе (Marie et al., 2013). Авторы исследования заключают, что общей чертой белкового репертуара раковины являются белки, имеющие в своей основе простые низкомолекулярные повторы. Такого рода белки, по их мнению, могли появляться независимо в разных линиях моллюсков.
Арагонитовые и кальцитовые раковины моллюсков строятся с участием различных вариантов полиморфных белков, и общих среди них лишь три (Zhang, Zhang, 2006). Среди белков скелетома (белки раковины), общих для всех моллюсков, отмечается перлюцин с доменом лектина С-типа (С-тип означает зависимый от Са); перлюцин обеспечивает связывание кальция при образовании перламутрового слоя.
Фосфатные скелеты хордовых и брахиопод построены с помощью совершенно неродственных ферментов, и как показано, кроме минералогии, не имеют ничего общего. В геноме, транскриптомe и протеоме лингулы не нашлось ни одного сходного участника построения фосфатной раковины, аналогичного тем, что участвуют в построении костной ткани у позвоночных. Зато нашлось несколько аналогов в геномах моллюсков с карбонатной раковиной (Luo et al., 2015). Как указывают авторы упомянутой работы, очевидно, что фосфатная минерализация эволюционировала независимо у групп с этим типом биоминералов.
Подобно минералогическому сходству, филогенетическая близость видов также не обязательно означает сходство белков раковины. У любого моллюска белковый репертуар раковины состоит из мозаики древних и продвинутых элементов. Древние элементы – карбоангибраза, ингибиторы протеаз, пероксидазы, фосфатазы – обычны для иных функций, но рекрутированы скелетомом для участия в биоминерализации. Как подобная функциональная реорганизация, так и структура новообразованных пептидов с включениями многочисленных простых (10–200 аминокислот) повторов свидетельствуют о высокой эволюционной пластичности комплекса скелетомов (Kocot et al., 2016).
Показательный в этом смысле пример дают наземные гастроподы Euhadra quaesita, у которых помимо раковины имеется минерализованное образование, известное как “мешок любовных стрел”. Оно представляет собой вытянутые кальцитовые (арагонитовые) кристаллы, которые эти гермафродитные моллюски пускают в ход при спаривании, протыкая тело партнера для доставки своих половых продуктов в его внутреннюю полость. Скелетом E. quaesita составляют 54 белка, из которых лишь семь являются общими со скелетообразующими белками других моллюсков. Минерализацию “любовных стрел” контролируют четыре белка, из них два общих со скелетомом раковины. Сравнение генов семи консервативных белков скелетома у разных моллюсков показывает, что некоторые из них, по-видимому, произошли за счет независимых мутаций в разных линиях. Один из этих консервативных белков, с доменом CBM-14, обнаружен в составе протеома “любовных стрел”, но его аналог найден не в “родной” раковине, а в раковине другого наземного брюхоногого моллюска Cepaea nemoralis (Shimizu et al., 2019). Общая картина свидетельствует о многочисленных независимых генетических преобразованиях, сопровождавших формирование белков скелета у моллюсков.
Также были попытки выявить минимальный белковый репертуар скелетообразования на базе скелетомов иглокожих (морских ежей, звезд и офиур (Flores, Livingston, 2017). В скелетоме морского ежа большую долю составляют лектины С-типа и т.н MSP-130-подобные белки (оба участвуют в доставке кальция в клетку). Белки с данными доменами имеются и у офиур, хотя у них разнообразие этих белков существенно меньше, а их генетическая последовательность отличается от последовательности морских ежей отсутствием характерных повторов. Однако у морских звезд нет ни лектинов С-типа, ни белков MSP-130. В трех группах иглокожих имеются функционально аналогичные белки, но их аминокислотные последовательности заметно различаются, соответственно различается и их генетическая основа. По всей видимости, для построения скелетов важна только конечная форма белка (и заряд), а она может сложиться из разных аминокислотных последовательностей. При этом у иглокожих имеется несколько общих, консервативных, белков скелетома, например фибриноген С-типа. У общих предков иглокожих он, по-видимому, связывал кальций на поверхностной органической ткани, а затем его функцию частично или полностью взяли на себя образовавшиеся de novo белки скелетных спикул. Таким образом у иглокожих, как и у моллюсков, сложилась мозаика древних и новообразованных белков. У иглокожих нашлись такие консервативные белки, которые, как ни удивительно, оказались общими с позвоночными. Например, липопротеины низкой плотности. У иглокожих они вовлечены в построение скелетных элементов, а у позвоночных участвуют в доставке кальция в везикулах к местам нуклеации при росте костей. Иными словами, у вторичноротых определенная роль отведена нескольким базовым белкам, которые унаследованно участвуют в построении скелетов.
Обзор скелетообразующих биохимических элементов у широчайшего круга многоклеточных в совокупности с экспериментами по биоминерализации позволил сначала Тоу (Towe, 1970), а затем Эрлиху (Ehrlich, 2010) выдвинуть гипотезу о первичном участии хитина и коллагена в формировании скелетов многоклеточных. На его взгляд, коллаген и хитин следует считать универсальной органической матрицей для образования скелетов любого минерального состава. Действительно, коллаген или хитин в обязательном порядке присутствуют в покровных и скелетообразующих тканях всех животных. Эти макромолекулы входят в состав т.н. базальной пластинки, лежащей под слоем эпидермальных клеток, а также внеклеточного матрикса мезенхимных клеток (Вестхайде, Ригер, 2008). Хитин и коллаген способны просто в силу своих химических свойств, даже в отсутствие специальных ферментов, образовывать химические связи с ионами кальция и кремния. В подтверждение данной гипотезы Эрлих (Ehrlich, 2010) указывает не только на обязательное присутствие этих макромолекул в опорных структурах животных, но и приводит ряд успешных экспериментов по связыванию коллагена и хитина с аморфным кремнеземом. Автор, к сожалению, не делает попытки объяснить, почему у многоклеточных, у которых хитин или коллаген (а обычно и то, и другое) имеется, кремниевые скелеты настолько редки, а у одноклеточных без коллагена и хитина как раз формируются кремниевые скелеты. Данное замечание не перечеркивает коллаген-хитиновую гипотезу, но требует дополнительного осмысления фактов. Так или иначе, но пока трудно говорить о причинной связи двух феноменов – появления коллагена и хитина и биоминерализации – только на основе их широкого распространения, однако факт участия молекул коллагена и хитина в организации скелетов безусловно игнорировать нельзя. Вполне возможно, что эволюция коллаген- или хитин-содержащих тканей послужила предпосылкой для появления скелетов у многоклеточных. У одноклеточных матрицей биоминерализации могли быть как предшественники хитина и коллагена, так и совсем другие молекулы. Пока что этот вопрос остается полностью открытым.
Ясно, что у многоклеточных присутствует целый ряд белков, которые могут при необходимости обеспечить доставку и связывание минералообразующих агентов. Эта задача, по-видимому, имеет множество возможных решений, поэтому трудно ожидать строгой филогенетической унаследованности в кладах скелетных форм. Возможно, что общим знаменателем является лишь эволюционное формирование коллаген- или хитин-содержащих тканей у многоклеточных: либо хитин и коллаген были первичной матрицей для биоминерализации, либо в их синтезе прямо или косвенно участвуют эффективные молекулы-биоминерализаторы.
АБИОТИЧЕСКИЕ И БИОТИЧЕСКИЕ ТРИГГЕРЫ СКЕЛЕТООБРАЗОВАНИЯ
Абиотические триггеры. Итак, имеется гипотеза, что предпосылкой появления минеральных скелетов было формирование тканей с хитином или коллагеном. Наряду с этим предложен ряд идей, ставящих на первое место изменение условий среды: в океане увеличилась концентрация кальция или концентрация кремния, или кислорода и в результате животные получили достаточное количество энергии и материала, необходимое для скелетообразования.
Из “средовых” гипотез раньше других обсуждалась кислородная гипотеза. Действительно, увеличение концентрации кислорода в окружающей среде может в принципе повлиять на скелетообразование, причем двояким образом. Во-первых, построение скелета – весьма энергозатратный процесс, поэтому такую роскошь можно себе позволить лишь при относительно высоком уровне кислорода; в противном случае кислород будет приоритетно тратиться на синтез более необходимого коллагена (Towe, 1970). Кроме того, оксигенизация среды ведет к увеличению скорости карбонатного осадконакопления. Механизм этой связи опосредован увеличением терригенного стока в океаны, вероятно, в связи с деятельностью аэробных наземных литотрофов (Peters, Gaines, 2012; Wood et al., 2017a).
Гипотеза о “кальциевом” триггере базируется на двух фактах. Во-первых, концентрация растворенного кальция, по всей вероятности, действительно возросла, так как в кембрии по сравнению с эдиакарием объем карбонатных осадков увеличился в два-шесть раз (Shields, Mills, 2017). Во-вторых, в эдиакарских разрезах богатая скелетная фауна приурочена к слоям с известняками. Именно в мощных известняках, а не в глинистых сланцах, найдены очень крупные по размеру скелетные организмы, рифы с известковым цементом, крупные арагонитовые оолиты (Wood et al., 2017a). Все это вместе – образование известкового цемента, оолитов и карбонатных осадков – может иметь место, если обстановка благоприятствует химическому осаждению кальция, т.е. при повышенной концентрации кальция и/или при относительном увеличении щелочности воды. Действительно, проведены модельные расчеты, согласно которым концентрация кальция в воде эдиакарского океана достигла 18 mМ, тогда как в современном океане концентрация ионов кальция 10.6 mМ (цит. по: Mendoza-Becerril et al., 2016). Нужно отметить, что если принять вполне обоснованную гипотезу о повышении содержании кальция в воде как триггера скелетообразования, то требует дополнительного объяснения появление не только кальциевых, но и кремниевых скелетов, например, у радиолярий и губок Demospongia (Schuster et al., 2018).
Высказывались идеи, что темпы осаждения карбонатов кальция увеличились на границе докембрия/кембрия из-за насыщения воды углекислотой (Tucker, 1992). Однако в этом случае следует ожидать скорее снижения темпов накопления карбонатных пород из-за подкисления воды.
Минеральный состав известковых скелетов относительно быстро отвечает на изменение химического состава воды. Известно, что чем выше содержание магния в воде, тем больше устойчивость арагонита. Если воспользоваться этой зависимостью и сравнить соотношение известковых и арагонитовых раковин с динамикой Ca/Mg в палео-океане на интервале позднего докембрия-фанерозоя, то окажется, что в течение “низкомагниевых” фаз было больше морских видов с кальцитовой раковиной, а в течение “высокомагниевых” фаз – больше арагонитовых скелетов (Zhuravlev, Wood, 2008). Это в целом говорит о возможности быстрой подстройки к среде у скелетообразователей, что в переводе на молекулярный язык означает пластичность молекулярного скелетообразующего инструментария.
Однако такое “правильное” соотношение химизма океана и минералогии скелетов выполняется лишь для новых родов и семейств, т.е. для тех групп, которые начинают формироваться в конкретную эпоху высоко- или низкомагниевого океана: из 37 новообразованных таксонов лишь 2 получили скелеты с несоответствующей минералогией (Porter, 2010). Но в пределах уже существующих групп скелетные представители редко изменяли минералогию скелетов, а если и меняли, то необязательно в согласии с внешними условиями. Иными словами, если состав воды менялся, то это совсем не означало, что и скелеты переключатся с исходной минералогии на новую (см. обзор таких изменений Porter, 2010). Поэтому гипотеза внешнего химического триггера для скелетообразования выглядит правдоподобно для новых формирующихся групп, но в дальнейшем их скелет будет сохранять свой состав, как бы ни изменялось внешнее химическое окружение.
Также обсуждались версии переключения с кислого океана на более щелочной на границе докембрия и кембрия (Towe, 1970). Теоретически при повышенном содержании углекислоты в воде реакция среды (рН) должна быть более кислой, соответственно естественное осаждение солей кальция, вероятно, должно снижаться. В настоящее время эта гипотеза обсуждается не слишком активно, так как биологически опосредованное осаждение кальция может происходить и при пониженных рН. Однако нельзя не отметить, что рН океанической воды монотонно увеличивалась от слабокислого (рН 6.5) состояния в раннем протерозое к современному щелочному (рН 8.2) состоянию (Krissansen-Totton et al., 2018). Однако ошибка определения палео-рН настолько велика, что пока рано говорить о каких-то корреляциях. Когда появятся более точные оценки, тогда можно будет рассуждать о возможном отсутствии или присутствии зависимостей.
Экологические триггеры. Раннекембрийское разнообразие увеличилось исключительно быстро, заполнились все ступени трофической пирамиды, включая и хищников. Соответственно у потенциальных жертв появилась необходимость защиты от хищников, а у хищников – необходимость быстрее передвигаться. И то и другое предполагает наличие прочных структур, обеспечивающих ту или иную защиту, – панцирей, шипов или специализированной мускулатуры, прикрепленной к твердой основе. Данная гипотеза в настоящее время приоритетна и цитируется во многих публикациях по скелетообразованию в кембрии. Слабая сторона этой гипотезы в том, что ее трудно проверить. Как и в случае с коллагеновой/ хитиновой органической матрицей, здесь обсуждается корреляция двух синхронных явлений – экологической диверсификации и скелетообразования, и оба явления проявляются сразу в большом числе таксономических групп. Они оба могут следствием какого-то общего явления, тем более что скелет, в том числе и минеральный, выполняет не только защитную функцию, но и ряд других, не менее важных, и эти функции трудно разграничить. В первую очередь следует обратить внимание на функцию формообразования.
Скелет, если понимать этот термин широко, имеется у любого живого организма, как одноклеточного, так и многоклеточного. Клетка без опорных структур превращается в плоскую каплю, которая к тому же не способна ни к какому виду движения. Так что скелет нужен любой клетке и в любых обстоятельствах: без него жизненное пространство клетки, и в буквальном, и в экологическом смысле, будет крайне нестабильным. В отсутствие сколько-нибудь стабильного жизненного пространства эволюция не идет: непонятно, к чему приспосабливаться. Если гены обеспечивают относительную стабильность живого во времени, то от скелета зависит стабильность этого живого в пространстве.
Скелет одноклеточного организма – это цитоскелет; в связи с ним могут находиться дополнительные наружные и/или внутренние органические или минерализованные укрепляющие структуры: теки, раковинки, таблички, спикулы, сеточки, бляшки и т.д. Движение клетки опосредуется жгутиками или ресничками или клеточными выпячиваниями, которые во всех случаях связаны с цитоскелетом. У многоклеточного организма цитоскелет уже, по всей видимости, не может эффективно поддерживать форму, в особенности крупную и массивную, эту функцию берут на себя новообразованные специализированные опорные ткани и структуры. Например, у полипов медуз, которых считают классическим примером животных с гидроскелетом, в эктодерме в обязательном порядке присутствуют разнообразные укрепляющие образования на основе хитина (Mendoza-Becerril et al., 2016). Минерализованные элементы скелетов прочнее органических, поэтому если нет ограничений по энергетическим и материальным ресурсам, то минерализованные опорные элементы легко могут появиться. Как описано выше, для их образования существует множество разнообразных биохимических решений. Вполне может быть, что животные с минерализованными элементами появились в ответ на увеличение размеров животных, так как это удобный способ создать опору крупному организму; также это возможность разнообразить форму организмов и их движение для освоения новой ресурсной базы. Кстати, и у одноклеточных минерализованный скелет способствует образованию крупных организмов. Примером могут служить нуммулиты, достигающие нескольких сантиметров в диаметре. Защитная функция видится вторичной по отношению к этим двум первоочередным задачам – стабилизации формы и освоению ресурсов. Так или иначе, но опорная и формообразующая функции могут вполне эффективно выполняться структурами на основе универсальных органических молекул: полисахарида хитина и полипептида коллагена (и целлюлозы в различных кладах водорослей и растений), – минеральный компонент лишь дополняет их, по всей вероятности, увеличивая пределы прочности. С этой точки зрения минеральный скелет должен появляться после органического и, по всей видимости, на его основе. Это подтверждается последовательностью появления органических и неорганических скелетов в различных группах. Если бы первоочередной была защитная функция, то минеральные скелеты могли бы появляться до органических.
По-видимому, в позднедокембрийское время в результате каких-то геохимических процессов, возможно, связанных с увеличением уровня свободного кислорода, изменился химический состав океанической воды: в ней увеличилось содержание катионов Са. Это существенно облегчило осаждение кальция на поверхности органических тканей, где массово присутствуют отрицательно заряженные радикалы макромолекул (белков, полисахаридов). В ходе своего эволюционного развития многоклеточные увеличивали размеры (а иначе зачем нужна многоклеточность), осваивали разнообразные экологические ниши, а также вырабатывали средства защиты и нападения. Все это требовало стабилизации формы и образования специальных двигательных конструкций. Эти функции и взяли на себя сначала органические, а затем минерализованные структуры.
ТАФОНОМИЯ СКЕЛЕТНЫХ И БЕССКЕЛЕТНЫХ ФОРМ
Согласно классическим представлениям, минеральный скелет в ходе фоссилизации сохраняется, постепенно замещаясь различными солями из окружающих поровых вод. Таким образом, мягкие ткани исчезают, а минерализованные части подвергаются диагенезу, в той или иной степени меняющему их исходный минеральный состав.
Классические модели фоссилизации скелетных форм не учитывают изменение кислотности (в большинстве случаев подкисление) вокруг разлагающихся остатков. Сдвиг рН может формироваться в тонкодисперсных осадках, препятствующих диффузии накопленных продуктов распада органики. В результате образуется градиент рН вокруг разлагающегося объекта. Не менее важно, каковы показатели рН в верхнем слое осадков, где органические остатки проходят первые и, вероятно, самые важные этапы консервации и фоссилизации; в современном океане рН верхнего слоя тонкодисперсных осадков колеблется вокруг рН 6.5 при рН океанической воды 8–8.4. А кислотность вокруг разлагающейся органики еще меньше (Zhu et al., 2006). Кислая реакция в некоторых тонкодисперсных осадках с захороненной органикой, как показывают эксперименты, сохраняется не менее полутора лет (Naimark et al., 2016, 2018). В таких условиях слабоминерализованные ткани могут потерять минеральную часть за счет растворения. Вероятно, именно это произошло с остатками трилобитов Ogygopsis, Pagetia и агностидами Ptychagnostus из знаменитого местонахождения сланцы Бёрджес (Burgess Shale) (Pushie et al., 2014). Как показывает элементное картирование, в покровных тканях этих членистоногих, исходно минерализованных карбонатом кальция, остались лишь следовые количества кальция.
Самые распространенные тонкодисперсные осадочные породы сложены глинистыми минералами. Некоторые глинистые осадки, например, с преобладанием каолинита сами по себе имеют кислую реакцию (до рН 6.0) даже в морской воде нормальной солености. Однако некоторые глинистые осадки, содержащие высокое количество разлагающейся органики, могут не понижать кислотность среды, а повышать, к таким осадкам относятся натриевый монтмориллонит и, вероятно, клинохлор.
Процессы подкисления среды и, следовательно, растворения минеральных компонентов теоретически должны приостанавливаться или даже менять вектор в условиях карбонатного, т.е. щелочного, осадконакопления. Отсюда можно ожидать, что (слабо)минерализованные элементы известковых скелетов будут сохраняться в карбонатных осадках, но не в глинистых или алевролитовых, а органические скелеты без минеральных включений – в глинистых осадках (Cohen, Macdonald, 2015). Не случайно ранние эдиакарские животные с минеральным скелетом обнаружены в известняках, а не в глинистых фациях. Что касается кремниевых скелетов, то они при захоронении могут растворяться в условиях щелочного градиента, однако этот вопрос практически не изучен.
Разработка модели фоссилизации в условиях резкого градиента кислотности позволит пересмотреть наши представления об отсутствии ископаемых с минеральным скелетом в докембрийских осадках. Ее применение выглядит многообещающе, так как в докембрийских обстановках осадконакопления преобладали глинистые фации, а не карбонатные, которые, как было рассмотрено в предыдущем разделе, начинают доминировать лишь с начала фанерозоя.
Второе важное замечание со стороны тафономии касается природы ископаемой летописи мягкотелых животных и того, как она может быть связана со скелетной летописью. Выше уже обсуждался вопрос о возможных экологических триггерах скелетообразования, однако тафономия позволяет взглянуть на дело с другого ракурса.
На сегодняшний день большая часть кембрийского разнообразия описана из лагерштеттов – местонахождений, где в том или ином виде сохраняются мягкие ткани животных и растений, т.н. фауны “исключительной” сохранности. Если к началу 21 века было описано не более полусотни таких местонахождений, то теперь их число уже близко к 700 (Muscente et al., 2017). Это означает, что природа лагерштеттов вовсе не “исключительна”, а наоборот, вполне обычна, просто палеонтологи в своих изысканиях руководствовались иными задачами и методами поиска.
По всей видимости, формирование лагерштеттов реализуется при весьма широком круге условий, из них необходимыми являются лишь немногие: 1) быстрое (катастрофическое) захоронение в тонкодисперсном осадке, 2) высокое количество захороненной органики, 3) относительно легкая гидролизация минералов осадка при сдвиге рН либо в кислую, либо в сильнощелочную сторону, 4) при их гидролизе высвобождение в окружающий раствор Al3+ , Si4+ , ${\text{PO}}_{4}^{{3 - }}$ (в виде гидроокисей). Связанные с органикой, эти (и, возможно, другие) соединения обладают консервирующими свойствами и препятствуют бактериальному разложению. Любые другие катионы, высвобождающиеся при гидролизе осадка, выступают как минерализующие агенты. Очевидно, что сочетание этих четырех условий не является редкостью, поэтому при целенаправленных поисках наверняка будут открыты еще сотни лагерштеттов.
Одно из этих четырех условий связано не с внешними, а с внутренними биологическими, свойствами – это быстрое связывание органических молекул с консервирующими ионами Al, Si, P (здесь нужно заметить, что анионы фосфора всегда связываются с органическими молекулами в виде фосфата кальция, т.е. опосредовано через катионы кальция). Иными словами, в биохимическом арсенале организмов должны быть специфические молекулы с сильным отрицательным зарядом, которые могут без всяких посредников легко связываться с данными консервантами. Молекулы с такими свойствами есть – это т.н. комплекс адгезивных молекул (CAM: семейства кадгеринов, интегринов, селектинов, интерлейцинов, муцинов) и связанный с ним внеклеточный матрикс. Этот комплекс обеспечивает контакты клеток между собой и с органическими или неорганическим субстратом. Очевидно, что его эволюция связана именно с многоклеточными, хотя некоторые его компоненты имеются и у бактерий, и у одноклеточных. Так, муцины входят в состав полисахаридного матрикса бактерий, гены кадгеринов обнаружены у хоанофлагеллят, вероятных предков губок. Предполагается, что у хоанофлагеллят кадгерины выполняли функцию прикрепления клеток к неорганическим субстратам (King et al., 2008). Что касается внеклеточного матрикса, то его обязательным компонентом у многоклеточных являются, в частности, коллаген и хитин.
Так как комплекс CAM появился и эволюционировал для обеспечения клеточных контактов и контактов клеточного слоя с субстратом, то большинство CAM могут самопроизвольно связываться с заряженными катионами. Например, одна из групп CAM – это интегрины, исходно имеющие высокое сродство к Ca2+ (Brown et al., 2018); также и кадгерины эффективно связываются с Ca2+ (Sotomayor, Schulten, 2008). Поэтому побочным эффектом появления этих молекул у многоклеточных оказалась возможность посмертной консервации остатков за счет быстрого связывания CAM с различными катионами, в том числе и с консервирующими соединениями Al, Si, Р.
Одноклеточные эукариоты не обладают данным комплексом САМ, поэтому не связывают на своей поверхности катионы металлов. Если, например, инкубировать в растворе Al3+ (квасцов или хлорида алюминия) одноклеточные и многоклеточные стадии колониальной амебы Dictyostelium, то Al будет связываться только с многоклеточными структурами, но не с одиночными амебами (Naimark et al., 2020). Следовательно, сохранение бесскелетных протистов и одноклеточных стадий колониальных форм в ископаемой летописи очень маловероятно. Докембрийское разнообразие бесскелетных форм, с точки зрения биохимии, отражает, вероятно, становление адгезивного комплекса у многоклеточных животных.
Другое следствие появления CAM у многоклеточных – это возможность построения минеральных скелетов. Если появляется эффективный молекулярный инструмент для связывания минеральных катионов, то он будет востребован для тех или иных биологических нужд. Тем более, что сами CAM заякорены внутри клетки на цитоскелете, так что наружные минеральные микроструктуры должны неизбежно оказаться в опосредованном контакте с внутренним формообразующим каркасом. Так, у иглокожих среди исходных скелетообразующих белков был фибриноген, связанный с адгезивным белком интегрином. Также интересным примером в этом смысле являются белки скелета коралла Acropora millepora: из 36 выделенных белков 15 оказались различными элементами CAM (Ramos-Silva et al., 2013). Среди них муцин, ко-адгезин, фактор Виллебранда и т.д. – все и они могут напрямую связываться либо с катионами металлов (муцин), либо с коллагеном или хитином (например, домен типа А фактора Виллебранда). Таким образом, адгезивные молекулы многоклеточных в силу своих химических свойств могут способствовать консервации и фоссилизации, но также и опосредовать появление минеральных скелетов. Так что становление адгезивного комплекса неизбежно влечет за собой как появление богатой ископаемой летописи, так и появление минеральных скелетов у многоклеточных. Неудивительно, что оба явления сближены во времени.
Предложенное выше объяснение относительной синхронизации двух глобальных явлений – формирование разнообразной ископаемой летописи и скелетов у животных – с позиций модели фоссилизации в слабокислых условиях не противоречит гипотезе CAM, а дополняет ее. Первое объяснение устанавливает кембрийский временнóй рубеж появления богатой ископаемой летописи, а второе объяснение – принципиальную синхронизацию двух явлений.
В заключении еще раз подчеркну важные моменты данного параграфа. Первые этапы фоссилизации проходят в верхних слоях осадка, где при разложении органики формируется градиент кислотности, в основном со сдвигом в кислую сторону. Существующие на сегодняшний день модели не учитывают данное обстоятельство. Между тем именно оно может объяснить отсутствие известковых скелетов у ранних скелетных форм: в слабокислых условиях они могут просто растворяться. Ожидать их сохранения можно, вероятно, в карбонатных фациях, где сдвиг кислотности существенно слабее. Молекулярной основой фоссилизации ранних многоклеточных являлся, вероятно, комплекс адгезивных молекул, имеющих сильное сродство к заряженным катионам металлов и кремния. Тот же комплекс в силу того же сродства к заряженным соединениям кальция и кремния мог участвовать в организации минерализованных структур многоклеточных. Отсюда неизбежное сближение во времени диверсификации многоклеточных с продвинутыми адгезивными комплексами и появление у них минеральных скелетов. Такой взгляд на тафономию “кембрийского взрыва” предлагается впервые и требует дальнейшего осмысления и подтверждения.
ЗАКЛЮЧЕНИЕ
Данный обзор позволяет обрисовать широкий круг фактов и гипотез, связанных с обретением минеральных скелетов, которые при всей своей мозаичности соединяются в относительно целостную картину (рис. 3).
Рис. 3.
Схема процессов, формирующих ископаемую летопись многоклеточных животных, в том числе и с минеральными скелетами (объяснение в тексте). Стрелками с одним и двумя векторами показано соответственно одностороннее и двустороннее влияние. График общей диверсификации в кембрии по: Na, Kiessling, 2015; авторские рисунки ранних животных с минеральными скелетами (вверху – Suvorovella, слева –Namacalathus, справа – Cloudina) по: Wood et al., 2017 с разрешения авторов.
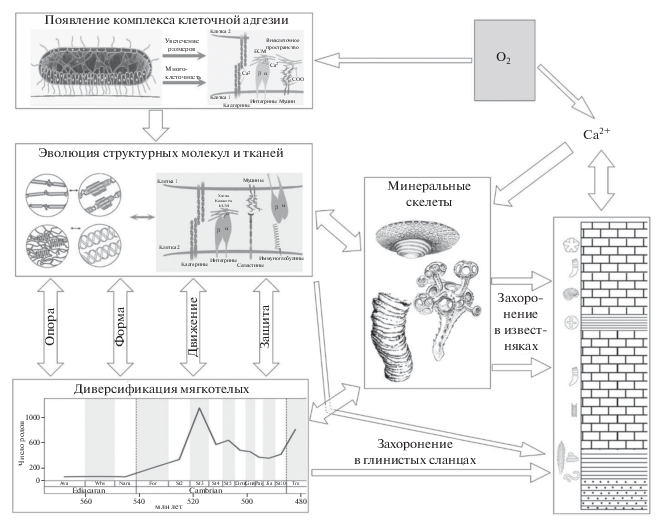
Согласно молекулярным реконструкциям, появление многоклеточных эукариот по разным оценкам попадает в интервал 840 –650 млн лет, а появление самых ранних многоклеточных животных оказывается около отметки 650 млн лет (Cunningham et al., 2017). Древнейшие ископаемые остатки животных датируются возрастом 580 млн лет, а древнейшие остатки животных с минеральным скелетом – 550 млн лет. Древнейшие ископаемые одноклеточные эукариоты, ведущие к кладе животных (опистоконты), не известны, а ископаемые представители сестринской клады одноклеточных – раковинных амеб, в том числе и с минеральной раковиной, – найдены по всему миру в неопротерозойских породах возрастом 778–635 млн лет; хотя в более молодых слоях они не известны. Пока непонятна природа разрыва между датировками молекулярных филогений различных клад эукариот и древнейшими ископаемыми представителями соответствующих клад. Также остается под вопросом причина отсутствия ископаемых находок одноклеточных эукариот на временнóм интервале 635–540 млн лет.
Минеральные скелеты формировались независимо много раз и в различных кладах одноклеточных и многоклеточных, каждый раз на основе предшествующих органических опорных и покровных структур.
Ископаемая летопись одноклеточных с минеральными скелетами начинается с раковинных амеб, хотя найденные раковинные амебы в большинстве своем имели органическую раковину. Выяснение исходного состава раковины требует в каждом случае нетривиального подхода и анализа. У одноклеточных скелеты построены преимущественно на основе минералов кремния, хотя имеются и одноклеточные с известковыми скелетами. Наиболее разнообразные и массовые скелетные группы – фораминиферы и радиолярии – появляются в раннем кембрии: сначала появляются фораминиферы с известковой раковиной, а после них кремниевые радиолярии.
Вещественная минеральная основа ранних скелетов многоклеточных – это карбонат или фосфат кальция; минералы кремния имеются только в скелетах демоспонгий. И известковые, и фосфатные, и кремниевые скелеты многоклеточные животные приобрели в раннем кембрии, хотя раньше других в ископаемой летописи появляются, по-видимому, известковые скелеты. Ясно, что скелеты многоклеточных не унаследованы от одноклеточных предков, а формировались независимо в различных эволюционных линиях.
Молекулярная основа построения скелетов разнообразна и также свидетельствует о независимом формировании минеральных скелетов. В каждой группе комплекс скелетообразующих белков (генов) представляет собой мозаичное сочетание консервативных и новообразованных доменов, перетасованных в разном порядке, причем новообразованные домены могут легко заменять консервативные. По всей видимости, органическая основа скелета, а также транспортные белки минералообразующих элементов – это быстро и сравнительно легко меняющийся комплекс. Среди молекул, теоретически способных к эффективному осаждению скелетообразующих элементов, нужно назвать коллаген, хитин и молекулы адгезивного комплекса. Все они имеют химическое сродство к катионам металлов, поэтому могут служить матрицей для нуклеации минералов. Молекулы адгезивного комплекса могли быть, по-видимому, древнейшим предшественником скелетообразующей – на основе кальция – органической матрицы у многоклеточных животных. У одноклеточных адгезивный комплекс представлен очень скудно, поэтому их скелеты строятся с помощью принципиально иной молекулярной базы. Не случайно одноклеточные имеют в основном кремниевые скелеты, тогда как многоклеточные – в основном кальциевые.
Формы с минерализованными скелетами начали формироваться, когда увеличилось содержание кислорода в атмосфере и океане. Многоклеточные животные получили возможность увеличить свой размер, так как кислорода уже было достаточно, чтобы обеспечить им нескольких клеточных слоев за счет пассивной диффузии. При укрупнении размеров у организма возникает необходимость совершенствовать опорные структуры и двигательный аппарат. Это требуется для поддержания формы и эффективного снабжения крупного организма в первую очередь кислородом, а затем и пищей; также при освоении нового ресурсного пространства требуется стабильная форма. Все это обеспечивается наличием жесткого скелетного каркаса. С появлением хищников оказывается востребованной и защитная функция твердых скелетных элементов. Твердые конструкции и защитные элементы могут быть построены из чисто органического вещества, однако минерализованные материалы в этом смысле надежнее.
Минерализацию ранних животных могло облегчить, по крайней мере, два фактора – биотический и абиотический. Биотический – это появление адгезивного комплекса молекул и связанных с ними внеклеточного матрикса, коллагена и хитина. Эти молекулы имеют сильное химическое сродство к катионам металлов и соединениям кремния. К абиотическим факторам относится уже упомянутое увеличение концентрации кислорода в воде, в результате которого возрос объем карбонатного осадконакопления и растворенного в воде кальция. Последнее способствовало химическому осаждению кальция на покровных тканях животных, следовательно, могло ускорить становление минерализованных скелетов на основе карбоната и фосфата кальция.
Карбонатное осадконакопление также изменило возможность сохранения известковых скелетов. В богатых органикой глинистых осадках рН сдвигается в слабокислую сторону, поэтому слабоминерализованные структуры растворяются, но при этом могут сохраняться остатки органических тканей (если на них быстро осаждаются консервирующие ионы Al и Si). Однако в карбонатных осадках реакция среды остается щелочной, и это способствует сохранению исходно минерализованных тканей. Поэтому при увеличении объема карбонатного осадконакопления резко возросла вероятность сохранения известковых и фосфатных скелетов.
Таким образом, повышение содержания кислорода на планете запустило целый комплекс взаимосвязанных процессов. Во-первых, животные увеличились в размерах и стали разнообразнее как морфологически, так и экологически. А это, в свою очередь, потребовало совершенствования опорных и двигательных структур. Во-вторых, становление многоклеточности и соответствующее формирование комплекса адгезивных молекул и связанного с ними внеклеточного матрикса, коллагена и хитина привело к формированию ископаемой летописи мягкотелых в глинистых сланцах и аргиллитах. В-третьих, увеличилось количество растворенного кальция в океане, следовательно животные получили в достатке материал для построения известковых и фосфатных скелетов, которые с большей вероятностью, чем мягкие ткани сохраняются в карбонатных осадочках; при этом шансы сохранения мягких тканей снизились. Все эти процессы невозможно отделить один от другого, как невозможно понять кембрийский феномен, односторонне фокусируя внимание лишь на одном из этих процессов.
Список литературы
Вестхайде В., Ригер Р., 2008. Зоология беспозвоночных. Т. 1: от простейших до моллюсков и артропод. Пер. с нем. М.: Товарищество научных изданий КМК. 512 с.
Контоpович А.Э., Ваpламов А.И., Гpажданкин Д.В., Каpлова Г.А., Клец А.Г., и др., 2008. Pазpез венда воcточной чаcти западно-cибиpcкой плиты (по pезультатам буpения паpаметpичеcкой cкважины Воcток-3) // Геология и геофизика. Т. 49. № 12. С. 1238–1247.
Розанов А.Ю., Астафьева М.М., 2020. Архейские эукариоты: новый взгляд // Палеонтологический журнал. № 1. С. 3–5.
Ушатинская Г.Т., 2004. Древнейшая брахиопода с органическим покровом из нижнего кембрия Монголии // Палеонтологический журнал. № 4. С. 10–16.
Aitchison J.C., Suzuki N., Caridroit M., Danelian T., Noble P., 2017. Paleozoic radiolarian biostratigraphy // Geodiversitas. V. 39. № 3. P. 503–531.
Allison C.W., Hilgert J.W., 1986. Scale microfossils from the early Cambrian of northwest Canada // Journal of Paleontology. V. 60. P. 973–1015.
Antcliffe J.B., Callow R.H., Brasier M.D., 2014. Giving the early fossil record of sponges a squeeze // Biological Reviews of the Cambridge Philosophical Society. V. 89. № 4. P. 972–1004.
Bovee E.C., 2012. Distribution and forms of siliceous structures among protozoa // Silicon and Siliceous Structures in Biological Systems. Simpson T.L., Volcani B.E. (Ed.). New York-Heidelberg-Berlin: Springer. P. 233–281.
Bosak T., Macdonald F., Lahr D., Matys E., 2011. Putative Cryogenian ciliates from Mongolia // Geology. V. 39. № 12. P. 1123–1126.
Bowler C., Allen A., Badger J., Grimwood J., Jabbari K., et al., 2008. The Phaeodactylum genome reveals the evolutionary history of diatom genomes // Nature. V. 456. P. 239–244.
Botting J.P., Muir L.A., 2018. Early sponge evolution: A review and phylogenetic framework // Palaeoworld. V. 27. № 1. P. 1–29.
Brain ‘Bob’ C.K., Prave A.R., Hoffmann K., Fallick A.E., Botha A., et al., 2012. The first animals: ca. 760-million-year-old sponge-like fossils from Namibia // South African Journal of Science. V. 108. № 1–2. P. 83–90.
Briggs D.E.G., Kear A.J., 1994. Decay and Mineralization of Shrimps // Palaios. V. 9. № 5. P. 431–456.
Brown K.L., Banerjee S., Feigley A., Abe H., Blackwell T.S., et al., 2018. Salt-bridge modulates differential calcium-mediated ligand binding to integrin α1- and α2-I domains // Sci. Rep. V. 8. № 2916 [Электронный ресурс]. Режим доступа: https://doi.org/10.1038/s41598-018-21231-1
Budd G., Mann R., 2020. Survival and selection biases in early animal evolution and a source of systematic overestimation in molecular clocks // Interface Focus: Royal Society Special papers. V. 10. 20190110 [Электронный ресурс]. Режим доступа: https://doi.org/10.1098/rsfs.2019.0110
Butterfield N.J., 2009. Modes of pre-Ediacaran multicellularity // Precambrian Research. V. 173. P. 201–211.
Chang S., Feng Q., Clausen S., Zhang L., 2017. Sponge spicules from the lower Cambrian in the Yanjiahe Formation, South China: The earliest biomineralizing sponge record // Palaeogeography, Palaeoclimatology, Palaeoecology. V. 474. P. 36–44.
Chang S., Feng Q., Zhang L.J., 2018. New Siliceous Microfossils from the Terreneuvian Yanjiahe Formation, South China: The Possible Earliest Radiolarian Fossil Record // Earth Sciences. V. 29. № 4. P. 912–918.
Cunningham J.A., Liu A.G., Bengtson S., Donoghue P.C.J., 2017. The origin of animals: Can molecular clocks and the fossil record be reconciled? // BioEssays. V. 39. № 1. P. 1–12.
Cohen P.A., Macdonald F.A., 2015. The Proterozoic Record of Eukaryotes // Paleobiology. V. 41. № 4. P. 610–632.
Cohen P.A., Strauss J.V., Rooney A., Sharma M., Tosca N., 2017. Controlled hydroxyapatite biomineralization in an ~810 million-year-old unicellular eukaryote // Science Advances. V. 3. №6. e1700095 [Электронный ресурс]. Режим доступа: https://advances.sciencemag.org/ content/3/6/e1700095
Culver S.J., 1994. Early Cambrian foraminifera from the southwestern Taoudeni Basin, West Africa // Journal of Foraminiferal Research. V. 24. № 3. P. 191–202.
Dalingwater J.E., Hutchinson S.J., Mutvei H., Siveter D.J., 1991. Cuticular ultrastructure of the trilobite Ellipsocephalus polytomus from the Middle Cambrian of Öland, Sweden // Palaeontology. V. 34. № 1. P. 205–217.
Daly R.A., 1907. Limeless ocean of pre-Cambrian time // Amer. J. of Sci. Ser. 4. V. 23. P. 93–115.
Dohrmann M., Wörheide G., 2017. Dating early animal evolution using phylogenomic data // Scientific Reports. V. 7. 3599 [Электронный ресурс]. Режим доступа: https://doi.org/10.1038/s41598-017-03791-w
Domozych D.S., Wells B., Shaw P.J., 1991. Basket scales of the green alga, Mesostigma viride: chemistry and ultrastructure // J. Cell Sci. V. 100. P. 397–407.
Ehrlich H., 2010. Chitin and collagen as universal and alternative templates in biomineralization // Int. Geol. Rev. V. 52. № 7–8. P. 661–699.
Ehrlich H., 2019. Marine biological materials of invertebrate origin // Biologically-Inspired Systems. V. 13. Gorb S.N. (Ed.). Cham: Springer Nature. 329 p.
Erwin D.H., Laflamme M., Tweedt S.M., Sperling E.A., Pisani D., et al., 2011. The Cambrian conundrum: early divergence and later ecological success in the early history of animals // Science. V. 334. P. 1091–1097.
Flores R.L., Livingston B.T., 2017. The skeletal proteome of the sea star Patiria miniat and evolution of biomineralization in echinoderms // BMC Evolutionary Biology. V. 17. № 125 [Электронный ресурс]. Режим доступа: https://bmcevolbiol.biomedcentral.com/articles/ 10.1186/s12862-017-0978-z
Gilbert P.U.P.A., Porter S.M., Sun C.-Y., Xiao S., Gibson B.M., et al., 2019. Biomineralization by particle attachment in early animals // PNAS. V. 116. № 36. P. 17659–17665.
Hendry K.R., Marron A.O., Vincent F., Conley D.J., Gehlen M., et al., 2018. Competition between silicifiers and non-silicifiers in the past and present ocean and its evolutionary impacts // Frontiers Marine Sciences. [Электронный ресурс]. Режим доступа: https://doi.org/10.3389/fmars.2018.00022
Hua H., Chen Z., Yuan X.L., Xiao S., Cai Y., 2010. The earliest Foraminifera from southern Shaanxi, China // Science of China: Earth Sciences. V. 53. P. 1756–1764.
Isowa Y., Sarashina I., Oshima K., Kito K., Hattori M., et al., 2015. Proteome analysis of shell matrix proteins in the brachiopod Laqueus rubellus // Proteome Sci. V. 13. [Электронный ресурс]. Режим доступа: https://doi.org/10.1186/s12953-015-0077-2
Iwata K., 1981. Ultrastructure and calcification of the shells in inarticulate brachiopods. Part 1. Ultrastructure of the shell of Lingula unguis (Linnaeus) // Journal of the Geological Society of Japan. V. 87. № 6. P. 405–415.
Ivantsov A.Yu., 1999. Trilobite-like arthropod from the Lower Cambrian of the Siberian Platform // Acta Palaeontologica Polonica. V. 44. № 4. P. 455–466.
Jackson D.J., Macis L., Reitner J., Wörheide G., 2011. A horizontal gene transfer supported the evolution of an early metazoan biomineralization strategy // BMC Evolutionary Biology. V. 11. № 238 [Электронный ресурс]. Режим доступа: https://doi.org/10.1186/1471-2148-11-238
Jackson D.J., Wörheide G., 2013. Symbiophagy and biomineralization in the “living fossil” Astrosclera willeyana // Autophagy. V. 10. № 3. P. 1–8.
King N., Westbrook M.J., Young S.L., Kuo A., Abedin M., et al., 2008. The genome of the choanoflagellate Monosiga brevicollis and the origin of metazoans // Nature. V. 451. P. 783–788.
Knoll A.H., Kotrc B., 2015. Protistan skeletons: a geologic history of evolution and constraint // Evolution of Lightweight Structures. Hamm C. (Ed.). Dordrecht: Springer. P. 1–16.
Kocot K.M., Aguilera F., McDougall C., Jackson D.J., Degnan B.M., 2016. Sea shell diversity and rapidly evolving secretomes: insights into the evolution of biomineralization // Frontiers in Zoology. V. 13. № 23 [Электронный ресурс]. Режим доступа: https://doi.org/10.1186/s12983-016-0155-z
Kolesnikov A.V., Rogov V.I., Bykova N.V., Danelian T., Clausen S., et al., 2018. The oldest skeletal macroscopic organism Palaeopascichnus linearis // Precambrian Research. V. 316. P. 24–37.
Krejci M.R., Wasserman B., Finney L., McNulty I., Legnini D., et al., 2011. Selectivity in biomineralization of barium and strontium // J. Structural Biol. V. 176. № 2. P. 192–202.
Krissansen-Totton J., Arney G.N., Catling D.C., 2018. Constraining the climate and ocean pH of the early Earth with a geological carbon cycle model // PNAS. V. 115. № 16. P. 4105–4110.
Lahr D.J.G., Grant J.R., Katz L.A., 2013. Multigene phylogenetic reconstruction of the Tubulinea (Amoebozoa) corroborates four of the six major lineages, while additionally revealing that shell composition does not predict phylogeny in the Arcellinida // Protist. V. 164. № 3. P. 323–339.
Lemloh M.L., 2016. Biomineralization in ciliates // Key Engineering Materials. V. 672. P. 40–46.
Li H., Sun C.-Y., Fang Y., Carlson C.M., Xu H., et al., 2020. Biomineral armor in leaf-cutter ants // bioRxiv. [Электронный ресурс]. Режим доступа: https://doi.org/10.1101/2020.05.18.102962
Lin J.-P., Ivantsov A.Y., Briggs D.E.G., 2010. The cuticle of the enigmatic arthropod Phytophilaspis and biomineralization in Cambrian arthropods // Lethaia. V. 44. № 3. P. 344–349.
Lowenstam H.A., 1967. Lepidocrocite, an apatite mineral, and magnetic in teeth of chitons (Polyplacophora) // Science. V. 156. № 3780. P. 1373–1375.
Luo Y., Takeuchi T., Koyanagi R., Yamada L., Kanda M., et al., 2015. The Lingula genome provides insights into brachiopod evolution and the origin of phosphate biomineralization // Nature Communications. V. 6. [Электронный ресурс]. Режим доступа: https://doi.org/10.1038/ncomms9301
Ma Q., Feng Q., Cao W., Zhang L., Ye Y., et al., 2019. Radiolarian fauna from the Chiungchussuan Shuijingtuo Formation (Cambrian Series 2) in Western Hubei Province, South China // Science of China: Earth Sciences. V. 62. P. 1645–1658.
McAllister J.E., Brand U., 1989. Primary and diagenetic microstructures in trilobites // Lethaia. V. 22. P. 101–111.
Maloof A., Rose C., Beach R., Samuels B.M., Calmet C.C., et al., 2010. Possible animal-body fossils in pre-Marinoan limestones from South Australia // Nature Geosciences. V. 3. P. 653–659.
Martin E.L.O., Lerosey-Aubril R., Vannier J., 2016. Palaeoscolecid worms from the Lower Ordovician Fezouata Lagerstätte, Morocco: Palaeoecological and palaeogeographical implications // Palaeogeography, Palaeoclimatology, Palaeoecology. V. 460. P. 130–141.
Marie B., Jackson D.J., Ramos-Silva P., Zanella-Cléon I., Guichard N., Marin F., 2013.The shell-forming proteome of Lottia gigantea reveals both deep conservations and lineage-specific novelties // FEBS Journal. V. 280 (1). P. 214–232.
Marin F., Bundeleva I., Takeuchi T., Immel F., Medakovic D., 2016. Organic matrices in metazoan calcium carbonate skeletons: Composition, functions, evolution // Journal of Structural Biology. V. 196. № 2. P. 98–106.
Marron A.O., Ratcliffe S., Wheeler G.L., Goldstein R.E., King N., et al., 2016. The evolution of silicon transport in eukaryotes // Molecular Biology and Evolution. V. 33. № 12. P. 3226–3248.
Mergelsberg S.T., Ulrich R.N., Xiao S., Dove P.M., 2019. Composition Systematics in the Exoskeleton of the American Lobster, Homarus americanus and Implications for Malacostraca // Frontiers of Earth Sciences. V. 7. [Электронный ресурс]. Режим доступа: https://doi.org/10.3389/feart.2019.00069
Mendoza-Becerril M.A., Maronna M.M., Pacheco M., Simões M.G., Leme J.M., et al., 2016. An evolutionary comparative analysis of the medusozoan (Cnidaria) exoskeleton // Zoological Journal of Linnean Society. V. 178. № 2. P. 206–225.
Miglietta M.P., McNally L., Cunningham C.W., 2010. Evolution of calcium-carbonate skeletons in the Hydractiniidae // Integrative and Comparative Biology. V. 50. № 3. P. 428–435.
Moore K.R., Bosak T., Macdonald F.A., Lahr D.J.G., Newman S., Settens C., Pruss S.B., 2017. Biologically agglutinated eukaryotic microfossil from Cryogenian cap carbonates // Geobiology. V. 15. № 4. P. 499–515.
Morais L., Fairchild T.R., Lahr D.J.G., Rudnitzki I.D., Schopf J.W., et al., 2017. Carbonaceous and siliceous Neoproterozoic vase-shaped microfossils (Urucum Formation, Brazil) and the question of early protistan biomineralization // Journal of Paleontology. V. 91. № 3. P. 393–406.
Moysiuk J., Smith M., Caron J., 2017. Hyoliths are Palaeozoic lophophorates // Nature. V. 541. P. 394–397.
Murdock D.J.E., Donoghue P.C.J., 2011. Evolutionary origins of animal skeletal biomineralization cells tissues organs // Cells Tissues Organs. V. 194. № 2–4. P. 98–102.
Muscente A.D., Schiffbauer J.D., Broce J., Laflamme M., O’Donnell K., et al., 2017. Exceptionally preserved fossil assemblages through geologic time and space // Gondwana Research. V. 48. P. 164–188.
Na L., Kiessling W., 2015. Diversity partitioning during the Cambrian radiation // PNAS. V. 112. № 15. P. 4702–4706.
Naimark E., Kalinina M., Shokurov A., Boeva N., Markov A., et al., 2016. Decaying in different clays: implications for soft-tissue preservation // Palaeontology. V. 59. P. 583–595.
Naimark E., Kalinina M., Shokurov A., Markov A., Zaytseva L., et al., 2018. Mineral composition of host sediments influences the fossilization of soft tissues // Canadian Journal of Earth Sciences. V. 55. P. 1271–1283.
Naimark E., Kirpotin D., Boeva N., Gmoshinsky V., Kalinina M., et al., 2020. Taphonomic experiments imply a possible link between the evolution of multicellularity and the fossilization potential of soft-bodied organisms // Ecology and Evolution. V. 11. № 2. P. 1037–1056.
Olempska E., Maas A., Waloszek D., Eriksson M.E., 2019. Exceptionally well-preserved Orsten-type phosphatocopid crustaceans from the Cambrian of Poland // Acta Palaeontologica Polonica. V. 64. № 1. P. 19–39.
Obut O.T., Danelian T., 2019. What is the age of the earliest Cambrian polycystine radiolarians and what do they look like? Insights from the Gorny Altai (South of western Siberia) // Estudios Geologicos, IMECT Short Absracts. V. 75. № 2. P. 25–26.
Paterson J.R., Edgecombe G.D., García-Bellido D.C., Jago J.B., Gehling J.G., 2010. Nektaspid arthropods from the lower Cambrian Emu Bay shale Lagerstätte, South Australia, with a reassessment of lamellipedian relationships // Palaeontology. V. 53. № 2. P. 377–402.
Pawlowski J., Holzmann M., Tyszka J., 2013. New supraordinal classification of Foraminifera: Molecules meet morphology // Marine Micropaleontology. V. 100. P. 1–10.
Peters S.E., Gaines R.R., 2012. Formation of the ‘Great Unconformity’ as a trigger for the Cambrian explosion // Nature. V. 484. P. 363–366.
Porter S., 2004. Closing the phosphatization window: Testing for the influence of taphonomic megabias on the pattern of small shelly fossil decline // Palaios. V. 19. P. 178–183.
Porter S., 2010. Calcite and aragonite seas and the de novo acquisition of carbonate skeletons // Geobiology. V. 8. № 4. P. 256–277.
Porter S., Knoll A., 2000. Testate amoebae in the Neoproterozoic Era: Evidence from vase-shapes microfossils in the Chuar Group, Grand Canyon // Paleobiology. V. 26. P. 360–385.
Porter S.M., Meisterfeld R., Knoll A., 2003. Vase-shaped microfossils from the Neoproterozoic Chuar Group, Grand Canyon: a classification guided by modern testate amoebae // Journal of Paleontology. V. 77. P. 409–429.
Ramos-Silva P., Kaandorp J., Huisman L., Marie B., Zanella-Cléon I., et al., 2013. The skeletal proteome of the coral Acropora millepora: the evolution of calcification by co-option and domain shuffling // Molecular Biology and Evolution. V. 12. № 9. P. 2099–2112.
Pushie M.J., Pratt B.R., Macdonald T.C., George G.N., Pickering I.J., 2014. Evidence for biogenic copper (hemocyanin) in the middle Cambrian arthropod Marrella from the Burgess Shale // Palaios. V. 29. № 10. P. 512–524.
Reis M., Thawornwattana Y., Angelis K., Telford M.J., Donoghue P.C., et al., 2015. Uncertainty in the timing of origin of animals and the limits of precision in molecular timescales // Current Biology. V. 25. P. 2939–2950.
Romano S.L., Cairns S.D., 2000. Molecular phylogenetic hypotheses for the evolution of Scleractinian corals // Bull. Mar. Sci. V. 67. P. 1043–1068.
Shields G.A., Mills B.J.W., 2017. Tectonic controls on the long-term carbon isotope mass balance // PNAS. V. 114. № 17. P. 4318–4323.
Schiffbauer J.D., Selly T., Jacquet S.M., et al., 2020. Discovery of bilaterian-type through-guts in cloudinomorphs from the terminal Ediacaran Period // Nature Commun. V. 11. № 205 [Электронный ресурс]. Режим доступа: https://doi.org/10.1038/s41467-019-13882-z
Shimizu K., Kimura K., Isowa Y., Oshima K., Ishikawa M., et al., 2019. Insights into the evolution of shells and love darts of land snails revealed from their matrix proteins // Genome Biology and Evolution. V. 11. № 2. P. 380–397.
Schopf J.W., 1999. Cradle of Life: The Discovery of Earth’s Earliest Fossils. Princeton: Princeton Univ. Press. 367 p.
Shu D., Conway-Morris S., Han J., Cuthill J.F.H., Zhang Z., et al., 2017. Multi-jawed chaetognaths from the Chengjiang Lagerstätte (Cambrian, Series 2, Stage 3) of Yunnan, China // Palaeontology. V. 60. № 6. P. 763–772.
Schuster A., Vargas S., Knapp I.S., Pomponi S.A., Toonen R.J., et al., 2018. Divergence times in demosponges (Porifera): first insights from new mitogenomes and the inclusion of fossils in a birth-death clock model // BMC Evolutionary Biology. V. 18. № 114. [Электронный ресурс]. Режим доступа: https://doi.org/10.1186/s12862-018-1230-1
Sotomayor M., Schulten K., 2008. The allosteric role of the Ca++ switch in adhesion and plasticity of C-cadherin // Biophysical Journal. V. 94. P. 4621–4633.
Sperling E.A., Peterson K.J., Laflamme M., 2011. Rangeomorphs, Thectardis (Porifera?) and dissolved organic carbon in the Ediacaran oceans // Geobiology. V. 9. № 1. P. 24–33.
Strauss J.V., Rooney A.D., Macdonald F.A., Brandon A.D., Knoll A.H., 2014. 740 Ma vase-shaped microfossils from Yukon, Canada: Implications for Neoproterozoic chronology and biostratigraphy // Geology. V. 42. № 8. P. 659–662.
Suzuki N., Aita Y., 2011. Radiolaria: achievements and unresolved issues: taxonomy and cytology // Plankton and Benthos Research. V. 6. № 2. P. 69–91.
Sweet W.C, Donoghue P.C.J., 2001. Conodonts: Past, present, future // J. of Paleontology. V. 75. № 6. P. 174–1184.
Szaniawski H., 2002. New evidence for the protoconodont origin of chaetognaths // Acta Palaeontologica Polonica. V. 47. № 3. P. 405–419.
Tang Q., Wan B., Yuan X., Muscente A.D., Xiao S., 2019. Spiculogenesis and biomineralization in early sponge animals // Nature Communication. V. 10. № 3348 [Электронный ресурс]. Режим доступа: https://doi.org/10.1038/s41467-019-11297-4
Teigler D., Towe K.M., 1975. Microstructure and composition of the trilobite exoskeleton // Fossils and Strata. № 4. P. 137–149.
Telford M.J., Budd G., Philippe H., 2015. Phylogenomic insights into animal evolution // Current Biology. V. 25. № 19. P. R876–R887.
Towe K.M., 1970. Oxygen-collagen priority and the early metazoan fossil record // PNAS. V. 65. № 4. P. 781–788.
Tucker M., 1992. The Precambrian-Cambrian boundary: seawater chemistry, ocean circulation and nutrient supply in metazoan evolution, extinction and biomineralization // Journal of the Geological Society. V. 149. № 4. P. 655–668.
Wood R., Ivantsov A.Yu., Zhuravlev A.Yu., 2017. First macrobiota biomineralization was environmentally triggered // Royal Soc. Proc. В. 20170059 [Электронный ресурс]. Режим доступа: https://doi.org/10.1098/rspb.2017.0059
Wood R.A., Zhuravlev A.Yu., Sukhov S.S., Zhu M., Zhao F., 2017a. Demise of Ediacaran dolomitic seas marks widespread biomineralization on the Siberian Platform // Geology. V. 45. № 1. P. 27–30.
Ortega-Hernández J., Gerber S., Butterfield N.J., Hou J., et al., 2015. Early Cambrian superarmored lobopodian from China // PNAS. V. 112. № 28. P. 8678–8683.
Yao H., Dao M., Imholt T., Huang J., Wheeler K., et al., 2010. Protection mechanisms of the iron-plated armor of a deep-sea hydrothermal vent gastropod // PNAS. V. 107. № 3. P. 987–992.
Yuan X., Chen Z., Xiao S., Zhou C., Hua H., 2011. An early Ediacaran assemblage of macroscopic and morphologically differentiated eukaryote // Nature. V. 470. P. 390–393.
Yang J., Ortega-Hernández J., Gerber S., Butterfield N.J., Hou J., et al., 2015. Early Cambrian superarmored lobopodian from China // PNAS. V. 112. P. 8678–8683.
Zhang C., Zhang R., 2006. Matrix proteins in the outer shells of molluscs // Marine Biotechnology. V. 8. P. 572–586.
Zhu Q., Aller R.C., Fan Y., 2006. Two-dimensional pH distributions and dynamics in bioturbated marine sediments // Geochimica et Cosmochimica Acta. V. 70. P. 4933–4949.
Zhuravlev A.Yu., Wood R.A., 2008. Eve of biomineralization: Controls on skeletal mineralogy // Geology. V. 36. P. 923–926.
Zhuravlev A.Yu., Liñán E., Gámez Vintaned J.A., Debrenne F., Fedorov A.B., 2012. New finds of skeletal fossils in the terminal Neoproterozoic of the Siberian Platform and Spain // Acta Palaeontologica Polonica. V. 57. № 1. P. 205–224.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


