Зоологический журнал, 2022, T. 101, № 1, стр. 3-13
Жизненный цикл рачка Limnocalanus macrurus Sars 1863 (Copepoda, Calaniformes, Centropagidae) в Онежском озере
Ю. Ю. Фомина a, *, М. Т. Сярки a, **
a Институт водных проблем Севера КарНЦ РАН
185030 Петрозаводск, Россия
* E-mail: rambler7780@rambler.ru
** E-mail: MSyarki@yandex.ru
Поступила в редакцию 29.10.2020
После доработки 12.04.2021
Принята к публикации 14.04.2021
- EDN: VYEXSF
- DOI: 10.31857/S0044513421110064
Аннотация
Limnocalanus macrurus Sars 1863 (Calaniformes, Centropagidae Giesbrecht 1892) – гляциально-морской реликт. В пелагиали Онежского озера, одного из Великих озер Европы, рачок круглогодично входит в состав доминирующего комплекса зоопланктона. L. macrurus является моноцикличным видом, с одной генерацией и зимним размножением. В результате анализа многолетних данных были изучены основные особенности жизненного цикла рачка в Петрозаводской губе и центральной части Онежского озера. Средние показатели в столбе воды за вегетационный сезон в заливе ниже, чем в центре озера, по численности – в 2 раза (2.7 против 5.5 тыс. экз./м2), по биомассе – в 1.7 раз (0.82 против 1.36 г/м2), среднемноголетние максимумы по численности ниже в 1.6 раз (5.6 против 9.0 тыс. экз./м2), по биомассе – в 2 раза (1.41 против 2.83 г/м2). Выявлено смещение сроков весеннего развития L. macrurus Петрозаводской губы; здесь развитие начинается на 2–3 декады раньше из-за разницы термических режимов районов. Несмотря на климатические изменения, отмеченные в последние десятилетия, заметных изменений обилия L. macrurus в озере не выявлено.
Онежское озеро – это крупный, второй после Ладожского озера, пресноводный водоем Европы. В последние десятилетия в Онежском озере отмечено увеличение безледоставного периода и периода “биологического лета” (Filatov et al., 2018). Пресноводный зоопланктон является чувствительным индикатором состояния экосистемы, поскольку его жизненные циклы синхронизированы с сезонными колебаниями в окружающей среде (Nilssen, Wærvågen, 2000). Многие авторы отмечают, что климатические изменения влияют на численность, видовой состав и структуру зоопланктонного сообщества (Лазарева, Соколова, 2013; Adrian, Deneke, 1996; Anneville et al., 2007; Wagner, Adrian, 2009; Hampton et al., 2014; Izmest’eva et al., 2016). Также в зоопланктоне были зафиксированы сдвиги сроков фенологических явлений и изменение параметров жизненного цикла отдельных его видов (Лазарева, Соколова, 2013; Gerten, Adrian, 2000, 2002; Adrian et al., 2006; Winder et al., 2009). Поэтому представляет интерес изучить жизненный цикл доминантных видов Онежского оз., одним из которых является Limnocalanus macrurus.
Limnocalanus macrurus Sars 1863 – гляциально-морской реликт (Сущеня и др., 1986; Arbačiauskas, Kalytytė, 2010); обычно этот вид относится к холодноводным стенотермным (Филимонова, 1965; Roff, Cartel, 1972; Vanderploeg et al., 1998; Ривьер, 2012), однако некоторые авторы считают, что его правильнее классифицировать как холодноводный эвритермный (Сущеня и др., 1986). L. macrurus – голарктический вид, известный в озерах Канадского Арктического архипелага на Крайнем Севере (82° с.ш.) и 80° с.ш. на полярном архипелаге Шпицберген в Северном Ледовитом океане (Vanderploeg et al., 1998). По классификации Пидгайко (1984), L. macrurus относится к холодноводному комплексу умеренных широт 50°–60° с.ш., типичный представитель слабоминерализованных озер. Как и все гляциально-морские реликты, рачок обитает в глубоких водоемах с выраженным гиполимнионом.
Рачок распространен также в Великих озерах Северной Америки, которые простираются от 42° с.ш. до 67° с.ш. В более глубоких, холодноводных и олиготрофных водоемах имеет тенденцию к доминированию (Roff, Cartel, 1972; Vanderploeg et al., 1998; Kane et al., 2004). L. macrurus отмечен в озерах Белоруссии: Южный Волос, Северный Волос, Струстно, Дрисвяты, Ричи, Долгое, Бобыно, Сита на широте 55° с.ш, в пресных озерах Скандинавии, Латвии, Кольского п-ова, в озерах бассейна Верхней Волги: Бородаевское, Вашкинское, Корбозеро и других (Сущеня и др., 1986; Ривьер, 2012). По данным Куликовой (2004, 2007, 2010, 2012), в ходе исследований по инвентаризации биологических ресурсов озер Карелии L. macrurus отмечен в 56 озерах из 556 исследованных: 14 в бассейне Онежского оз., 8 в бассейне р. Шуя, 17 в северной части бассейна Ладожского оз., 17 в бассейне Белого моря. В Ладожском оз. является массовым видом, где, в отличие от онежских особей, характеризуется несколько бо́льшими размерами (Куликова, Сярки, 2000).
В Онежском оз. L. macrurus встречается круглогодично, зимой является одним из основных видов планктона. Рачок обеспечивает питание основных промысловых рыб-планктофагов, ряпушки и корюшки, которые составляют 50–85% в уловах Онежского оз. (Лукин, Георгиев, 2010).
Фрагментарные сведения о развития L. macrurus в Онежском оз. были собраны в результате исследований в 1964–1965 годах (Филимонова, 1966) и 1964–1967 годах (Смирнова, 1972). Накопленные многолетние данные Института водных проблем Севера (Петрозаводск) позволили провести их комплексный анализ и выявить характерные особенности жизненного цикла рачка в озере. Особое внимание было уделено его состоянию в зимний период.
Цель работы – изучение жизненного цикла веслоногого рачка Limnocalanus macrurus в пелагиали различных районов Онежского оз. и современного состояния его популяций в условиях климатических изменений.
МАТЕРИАЛ И МЕТОДИКА
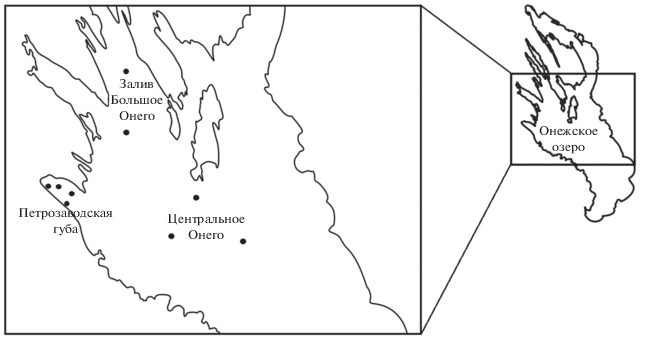
В основу работы положены данные комплексных съемок лаборатории гидробиологии ИВПС КарНЦ РАН с 1988 по 2017 гг. в период вегетации (июнь–октябрь). Применялась стандартная методика для сетного отбора и камеральной обработки проб (Методические рекомендации…, 1984). Отбор материала производили с помощью сети Джеди (диаметр 18.5 см; с диаметром пор 100 мкм) фракционно по слоям: 0–5, 5–10, 10–25, 25–50, 50–75 и далее до дна. Пробы зоопланктона центральной части озера были отобраны на трех станциях в Центральном плесе озера и на двух станциях в заливе Большое Онего (всего 5 станций) (рис. 1). Всего было отобрано 217 проб: июнь – 57 (8 съемок), июль – 75 (8 съемок), август – 67 (8 съемок), сентябрь–октябрь – 18 (6 съемок). Глубина станций в заливе Большое Онего варьировала от 70 до 110 м, в Центральном Онего – от 40 до 80 м. Данные по зоопланктону Центрального Онего и глубоководного залива Большое Онего были объединены, поскольку эти районы имеют хороший водообмен, а также сходны по гидротермическому режиму и трофическим характеристикам (Ефремова, 2010; Филатов и др., 2010). Планктонная система центрального района озера в настоящее время характеризуется как олиготрофная, что подтверждается низким уровнем хлорофилла а (2.7 мкг/л) и общего фосфора (табл. 1) (Сабылина, 2015).
Таблица 1.
Химический состав воды в Петрозаводской губе (ПГ) и центральной части озера (ЦЧ) по сезонам
| Сезон | Σи, мг/л | Цветность, град. |
Робщ, мкг/л |
Feобщ, мг/л |
БПК5, мг О2/л |
О2, % насыщения |
Доля автохтонного ОВ, % | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ПГ | ЦЧ | ПГ | ЦЧ | ПГ | ЦЧ | ПГ | ЦЧ | ПГ | ЦЧ | ПГ | ЦЧ | ПГ | ЦЧ | |
| Весна | 31.2 | 37.6 | 57 | 23 | 22 | 8 | 0.42 | 0.07 | 0.78 | 0.64 | 86–98 | 92–96 | 20 | 72 |
| Лето | 36 | 38 | 32 | 19 | 15 | 10 | 0.15 | 0.08 | 1.80 | 1.39 | 88–96 | 91–100 | 58 | 56 |
| Осень | 27.1 | 33.4 | 15 | 25 | 20 | 12 | 0.21 | 0.03 | 0.98 | – | 90 | 84–94 | – | – |
| Зима | 32 | – | 50 | 18 | 23 | 8 | 0.32 | – | 1.56 | – | 79–90 | – | 45 | 45 |
Зоопланктон заливов изучался на примере Петрозаводской губы (4 станции) (рис. 1). Всего было отобрано 225 проб: июнь – 56 (10 съемок), июль – 58 (9 съемок), август – 72 (11 съемок), сентябрь–октябрь – 39 (8 съемок). Глубина станций изменялась от 10 до 28 м. Термический режим залива отличается от основного плеса. Так, термобар в Петрозаводской губе проходит в третьей декаде мая, а в центральном районе – в середине июня. Переход температуры воды через 10°С в заливе происходит в первой декаде июня, в центре озера – вначале июля. Продолжительность “биологического лета” для Петрозаводской губы составляет в среднем 115 сут, для центральной части – в среднем 88 сут (табл. 2).
Таблица 2.
Среднемноголетние температуры воды по районам
| Период | Слой | Петрозаводская губа | Центральная часть |
|---|---|---|---|
| Зима (март) | Поверхностный | 0.1 | 0.4 |
| Придонный | 1.6 | 2.8 | |
| Весна (июнь) | Поверхностный | 10.2 | 4.1 |
| Придонный | 4.9 | 3.3 | |
| Раннее лето (июль) | Поверхностный | 14.9 | 13.8 |
| Придонный | 5.8 | 4.3 | |
| Позднее лето (август) | Поверхностный | 15.8 | 15.2 |
| Придонный | 6.4 | 4.6 | |
| Осень (сентябрь–октябрь) | Поверхностный | 11.4 | 9.8 |
| Придонный | 8.3 | 5.3 | |
| Июнь–октябрь | Поверхностный | 12.8 | 11.0 |
| Придонный | 6.0 | 4.2 |
Химический состав вод Петрозаводской губы формируется в основном за счет речного стока (95% – р. Шуя), обогащенного биогенами, железом и гуминовыми веществами. Особенно велико влияние речных вод на залив зимой в период ледостава и весной в период прохождения термобара, когда водообмен с центральным плесом озера ограничен, в это время водные массы Петрозаводской губы представлены на 52–62% шуйскими водами. После прохождения термобара показатели химического состава воды в заливе близки к озерным (табл. 1). Летом и осенью доля озерных вод достигает 82–86%. Петрозаводская губа испытывает значительную антропогенную нагрузку (промышленно-бытовые стоки, дренажные, ливневые воды города, водный транспорт). По содержанию хлорофилла а (3.3 мкг/л) и концентрации общего фосфора (18 мкг/л) залив имеет мезотрофный статус (Сабылина, 2015а; Лозовик и др., 2019).
Зимнее состояние описано по материалам, полученным в рамках Российско-Швейцарского мультидисциплинарного проекта “Lake Ladoga: life under ice interplay of under-ice processes by global change” в марте 2015–2017 гг. (в одни и те же даты) на станции в центральной части Петрозаводской губы.
Для сопоставимости количественных данных из районов с различными глубинами анализировались величины численности и биомассы в столбе воды под квадратным метром.
Плавные кривые среднемноголетней сезонной динамики показателей получали сглаживанием ранжированных временных рядов методом скользящего среднего. Ввиду высокой изменчивости и нерегулярности рядов данных применялся метод скользящего среднего в модификации двойного сглаживания, который позволяет выявить основные особенности динамики величин по показателю сезонности (сутки с начала года) (Сярки, 2013).
Средние значения представлены со стандартной ошибкой. Для определения связи температуры воды с обилием L. macrurus с учетом его возрастной структуры, а также для анализа многолетних изменений численности и биомассы рачка использовали коэффициент корреляции Спирмена (p < 0.05).
РЕЗУЛЬТАТЫ
В Онежском оз. Limnocalanus macrurus встречается круглогодично на всех пелагических станциях. Размножение рачка происходит в зимний период, поэтому первые науплиусы появляются подо льдом. Науплиальные стадии рачка (N3) в Петрозаводской губе были обнаружены в первой половине января, в марте их численность в столбе воды достигала 10.3 тыс. экз./м2 (396 экз./м3), в среднем их количество составляло 2.3 тыс. экз./м2 (86 экз./м3). Доля науплиусов в популяции по численности в это время варьировала от 85 до 100%.
В марте науплиусы были сосредоточены в слое 0–10 м (рис. 2). Взрослые рачки образовывали скопления в слое ниже 15 м.
Рис. 2.
Вертикальное распределение численности (N, тыс. экз./м2) Limnocalanus macrurus в разные сезоны: 1 – самцы, 2 – самки, 3 – старшие копеподитные стадии, 4 – младшие копеподитные стадии, 5 – науплиусы.

Младшие копеподитные стадии (CI–CIII) в Петрозаводской губе появлялись в начале марта. В конце мая–начале июня численность младших копеподитов снижалась и составляла в среднем 1.2 тыс. экз./м2 (51 экз./м3). С третьей декады июня в планктоне наблюдались только единичные особи данной возрастной группы. В начале июня численность старших копеподитных стадий (CIV–CV) достигала в среднем 3.3 тыс. экз./м2 (130 экз./м3), их доля в популяции составляла 50%. К концу июня их численность снизилась в среднем до 34%. Интересно, что в оз. Верхнее в этот период доля данной возрастной группы в структуре популяции L. macrurus схожа (33%) (Selgeby, 1975). С конца июня количество старших копеподитов уменьшалось и с начала августа в пробах были отмечены лишь единичные особи (рис. 3).
Рис. 3.
Динамика численности (N, тыс. экз./м2) возрастных групп Limnocalanus macrurus в Петрозаводской губе: 1 – самцы, 2 – самки, 3 – старшие копеподитные стадии, 4 – младшие копеподитные стадии.
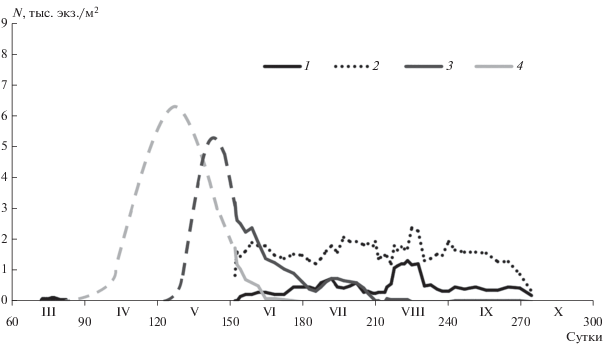
Таким образом, длительность развития от первой науплиальной стадии до взрослого рачка составляла 6–7 месяцев, что согласуется с данными других авторов по озерам Чар, Верхнее и Петрозеро (Тимакова, 1981; Roff, Cartel, 1972; Selgeby, 1975). По результатам исследования в заливе Джоржия оз. Гурон L. macrurus развивался быстрее и достигал взрослой стадии примерно за 6 месяцев (Carter, 1969).
Самцы и самки присутствовали в планктоне на протяжении всего годового цикла. Зимой подо льдом отмечена низкая плотность взрослых рачков 0.04–0.27 тыс. экз./м2 (2–10 экз./м3). В вегетационный период численность самцов колебалась от 0.04 до 4.9 тыс. экз./м2 (от 2 до 190 экз./м3), самок – от 0.04 до 17.2 тыс. экз./м2 (от 2 до 640 экз./м3). Доля самцов в популяции варьировала от 1 до 67%, в среднем 20%, самок – от 1 до 95%, в среднем 47%. В конце июля–начале августа все копеподиты линяли и достигали стадии взрослых особей.
В центральной части Онежского оз. науплии в планктоне появлялись позже, чем в Петрозаводской губе с апреля до начала июля (Куликова, 1982). В начале июня численность младших копеподитных стадий зарегистрирована в среднем 7.3 тыс. экз./м2 (0.09 тыс. экз./м3), с июня их численность постепенно снижалась. Со второй декады июля данная возрастная группа единично наблюдалась в планктоне.
В начале июня численность старших копеподитных стадий составила в среднем 1.6 тыс. экз./м2 (0.02 тыс. экз./м3), доля их в популяции – в среднем 17%. К концу июня количество копеподитов в популяции рачка увеличивалось (в среднем 2.9 тыс. экз./м2, или 0.04 тыс. экз./м3) и доля составляла в среднем 56%. Со второй половины июля численность старших копеподитных стадий снижалась, и с конца июля они встречались в планктоне единично (рис. 4).
Рис. 4.
Динамика численности (N, тыс. экз./м2) возрастных групп Limnocalanus macrurus в центральной части Онежского оз. 1–4 – как на рис. 3.

В вегетационный период в столбе воды численность самцов колебалась от 0.02 до 5.0 тыс. экз./м2 (от 1 до 106 экз./м3), самок – от 0.02 до 8.5 тыс. экз./м2 (от 1 до 163 экз./м3). Максимальная доля самцов в популяции составляла 53% (в среднем 22%), самок – 95% (в среднем 45%).
В июне среднемноголетние количественные показатели численности популяции L. macrurus в столбе воды в Петрозаводской губе были отмечены в 1.8 раз ниже, чем в центральной части, доля взрослых рачков в заливе была почти в 6 раза больше. Многолетние значения биомассы рачка в заливе и центре озера были схожи (табл. 3).
Таблица 3.
Средняя численность, биомасса и структура популяции Limnocalanus macrurus по районам в июне
| Район | Численность, тыс. экз./м2 | Биомасса, г/м2 | Численность, тыс. экз./м3 | Биомасса, г/м3 | Количество старших копеподитов, % |
|---|---|---|---|---|---|
| Петрозаводская губа | 4.8 ± 0.77 | 1.05 ± 0.13 | 0.18 ± 0.03 | 0.040 ± 0.014 | 47 ± 7 |
| Центральная часть | 8.5 ± 1.06 | 0.94 ± 0.18 | 0.13 ± 0.02 | 0.014 ± 0.003 | 8 ± 3 |
Максимумы по численности и по биомассе L. macrurus расходятся во времени. Максимальные значения численности отмечены в начале июня, а многолетние максимумы биомассы регистрировались в середине августа. Количественные показатели в столбе воды в Петрозаводской губе были ниже зафиксированных в центральной части озера, по численности – в 1.6 раз, по биомассе – в 2 раза (табл. 4).
Таблица 4.
Среднемноголетние максимальные значения численности и биомассы популяции Limnocalanus macrurus по районам
| Район | Численность, тыс. экз./м2 | Биомасса, г/м2 | Численность, тыс. экз./м3 | Биомасса, г/м3 |
|---|---|---|---|---|
| По численности | ||||
| Петрозаводская губа | 5.6 ± 0.96 | 1.17 ± 0.16 | 0.22 ± 0.04 | 0.045 ± 0.006 |
| Центральная часть | 9.0 ± 2.30 | 0.51 ± 0.17 | 0.11 ± 0.03 | 0.006 ± 0.002 |
| По биомассе | ||||
| Петрозаводская губа | 3.6 ± 1.43 | 1.41 ± 0.47 | 0.14 ± 0.05 | 0.053 ± 0.017 |
| Центральная часть | 8.0 ± 0.79 | 2.83 ± 0.27 | 0.15 ± 0.03 | 0.051 ± 0.009 |
Средние за вегетационный сезон показатели в столбе воды в заливе также не достигали отмеченных в центре озера, численность была ниже в 2 раза, биомасса – в 1.7 раз (табл. 5).
Таблица 5.
Средние за вегетационный сезон показатели популяции Limnocalanus macrurus по районам
| Район | Численность, тыс. экз./м2 | Биомасса, г/м2 | Численность, тыс. экз./м3 | Биомасса, г/м3 |
|---|---|---|---|---|
| Петрозаводская губа | 2.7 ± 0.34 | 0.82 ± 0.10 | 0.10 ± 0.01 | 0.032 ± 0.004 |
| Центральная часть | 5.5 ± 0.44 | 1.36 ± 0.12 | 0.09 ± 0.01 | 0.022 ± 0.002 |
Коэффициенты корреляции Спирмена между годом наблюдений (1988–2017 гг.) и численностью и биомассой популяции за вегетационный период (июнь, июль, август, сентябрь, октябрь) оказались статистически незначимыми.
Анализ изменчивости обилия по возрастной структуре и температуры воды показал, что в Петрозаводской губе численность и биомасса младших копеподитов достоверно уменьшалась с увеличением температуры поверхности воды в июне (r = –0.72, p = 0.05, n = 11), а в центральной части – в июле (r = –0.74, p = 0.05, n = 13).
ОБСУЖДЕНИЕ
Limnocalanus macrurus – моноцикличный вид, что обусловлено его происхождением, арктические морские каланоидные копеподы имеют одну генерацию в год. Рачок способен запасать восковые эфиры, которые не только помогают ему пережить неблагоприятные зимние периоды, но и являются строительным материалом для продукции яиц (Vanderploeg et al., 1998). В пелагиали Онежского оз. сформировались оптимальные условия для рачка, жизненный цикл которого происходит в диапазоне от 0 до 10–12°С (оптимальная температура 10–12°С, максимальная – 18–21°С) (Сущеня и др., 1986; Ривьер, 2012).
Появление науплиусов L. macrurus в первой половине января с максимумом в конце марта также было отмечено в исследовании жизненного цикла рачка в оз. Чар (Канадский Арктический архипелаг) (Roff, Cartel, 1972). В зимний период в Петрозаводской губе науплиальные стадии рачка концентрируются в верхних слоях, поскольку там сосредоточен их основной корм – водоросли. Изучение подледного вертикального распределения фитопланктона в Петрозаводской губе показало, что наибольшие концентрации хлорофилла а отмечаются в слоях до 10 м (Suarez et al., 2019). Поскольку L. macrurus является прямым вертикальным мигрантом, взрослые рачки в дневное время предпочитают опускаться в придонные слои воды, а в ночное время поднимаются в верхние слои (рис. 2) (Сущеня и др., 1986).
Период размножения у L. macrurus составляет около 4 мес. Самки рачка не имеют яйцевых мешков, а выметывают яйца в воду, в дальнейшем их развитие происходит на дне водоема. Откладка яиц продолжается 6–7 суток. Плодовитость одной самки варьирует от 15 до 26 яиц. Развитие яиц зависит от температуры, чем выше температура, тем меньше продолжительность эмбрионального развития. Так, при температуре 0°С время развития составляет 26 сут, при 1.5 и 2°С – 25 и 23 сут, соответственно (Сущеня и др., 1986; Ривьер, 2012).
В исследовании жизненного цикла L. macrurus в арктическом оз. Чар было показано, что 1 стадия науплий рачка развивается в течение 20 сут, 2 стадия – 22 сут, 3 стадия – 14 сут, 4 стадия – 15 сут, 5 и 6 стадии – 11 и 15 сут соответственно (Roff, Cartel, 1972). Судя по времени эмбрионального и науплиального развития, размножение у L. macrurus в Онежском оз. начинается в первой половине ноября. В оз. Мичиган размножение рачка зарегистрировано с ноября по май (Vanderploeg et al., 1998).
По данным Харт (Hart, 1990), среднее соотношение каждой стадии равно: C1 –14.7%, C2 – 14.7, С3 – 16.0, С4 – 23.6, С5 – 31%. Учитывая это, можно вычислить продолжительность стадий развития: C1 – 18 сут, C2 – 18, С3 – 20, С4 – 30, С5 – 37 сут. Эти данные позволяют нам определить структуру популяции в период отсутствия наблюдений с апреля до конца мая. Максимумa численности младшие копеподитные стадии, по-видимому, достигли во второй половине апреля–начале мая. Старшие копеподитные стадии L. macrurus, вероятно, появлялись в планктоне в начале мая, максимума достигали во второй половине мая (рис. 3).
Сроки развития копеподитов до взрослых рачков в Онежском оз. довольно схожи с наблюдаемыми в озерах Петрозеро, Гурон, Чар. Период превращения старших копеподитов в половозрелых особей может сдвигаться, т.е. могут наблюдаться фазовые сдвиги, что отмечалось в заливе Джоржия оз. Гурон (Carter, 1969) (табл. 6).
Таблица 6.
Сроки окончания развития старших копеподитных стадий в популяциях Limnocalanus macrurus в разных озерах
| Водоем | Сроки | Источник |
|---|---|---|
| Петрозаводская губа Онежского оз. | 26.07–01.08 | Наши данные |
| Центральная часть Онежского оз. | 01.08–05.08 | Наши данные |
| Пертозеро | 07.08 | Тимакова, 1981 |
| Залив Джоржия оз. Гурон | 23.09 | Carter, 1969 |
| Оз. Чар | 20.08–05.09 | Roff, Cartel, 1972 |
Сравнение динамики популяций Limnocalanus macrurus в разных районах озера показало, что для рачка характерен моноцикличный характер сезонной динамики как в Петрозаводской губе, так и в центральной части озера. Весной развитие возрастных стадий рачка по районам определяeтся особенностями их термических режимов (табл. 2), и в Петрозаводской губе начало развития наблюдается на 2–3 декады раньше (рис. 3, 4).
В столбе воды средние количественные показатели за вегетационный сезон, а также среднемноголетние максимумы численности и биомассы L. macrurus Петрозаводской губы были ниже, чем в центральном районе озера. По сравнению с центром в заливе создаются неблагоприятные гидрохимические условия, особенно в весенний период, когда в Петрозаводской губе отмечено высокое содержание гумуса, об этом косвенно свидетельствуют высокая цветность воды и низкая доля автохтонного органического вещества (табл. 1). Исследованиями последнего десятилетия показано, что преобладание органического вещества аллохтонного происхождения может привести к ухудшению качества пищи для зоопланктона из-за отсутствия в нем незаменимых жирных кислот (Kelly et al., 2014; Brett et al., 2017). Качество пищи влияет на эффективность роста и размножения веслоногих рачков (Ban, 1994; Cook et al., 2007) и определяется в первую очередь содержанием высоконенасыщенных жирных кислот. Незаменимые жирные кислоты способствуют интенсивному росту, размножению и большей продукции зоопланктона. Также жирные кислоты входят в состав липидов клеточных мембран и увеличивают её текучесть, это особенно важно для организмов, которые остаются активными при низких температурах (Brett et al., 1997; Kainz etal., 2009; Ravetetal., 2010). Кроме того, в экспериментах было показано, что гуминовые вещества оказывают отрицательное влияние на развитие веслоногих ракообразных и их науплий (Carlsson et al., 1995). Возможно, особенности в развитии популяции L. macrurus в Петрозаводской губе связаны с влиянием речных вод, воздействие которых усиливается в весенний период, когда происходит интенсивное развитие популяции.
Потепление климата оказывает на озерные экосистемы многофакторное воздействие. Так, в водоемах отмечены изменения уровня воды, температуры эпилимниона, периодов термической стратификации и ледостава, содержания растворенного органического вещества и других характеристик. Реакция водных сообществ на такие колебания факторов среды имеет сложный характер (Adrian et al., 2009). Так, под воздействием климатических изменений в оз. Женева были отмечены изменения в структуре сообщества зоопланктона в сторону увеличения доли калянид, в Рыбинском водохранилище зарегистрирован рост численности веслоногих рачков (в 1.8 раза) (Anneville et al., 2007; Korneva et al., 2019).
По нашим данным, заметных изменений обилия вида в Онежском оз. не происходит. Это можно объяснить сохранением естественных условий для обитания рачка в пелагиали озера. Аналогичная ситуация описана для стенотермного рачка Epischurella baikalensis в оз. Байкал. По данным исследований, в водоеме отмечено увеличение летних температур поверхности воды на 2°С, несмотря на это, численность доминантного холодолюбивого рачка E. baikalensis значительно не уменьшилась. Авторы связывают это с тем, что вид имеет возможность покидать верхние слои и опускаться ниже летнего термоклина, где отмечается постоянство температур (Hampton et al., 2014; Izmest’eva et al., 2016). Таким же образом, Limnocalanus macrurus не зависит от потепления поверхностных слоев в Онежском оз., поскольку предпочитает слои ниже 10 м (рис. 2) (Смирнова, 1972; Куликова, Щурова, 1980; Куликова и др., 1997).
Скорость роста веслоногих рачков в значительной степени зависит от температуры воды. Показано, что увеличение температуры приводит к уменьшению времени развития науплиальных и копеподитных стадий (Hart, 1990), таким образом, младшие копеподиты достигают стадии старших копеподитов раньше. Особенности температурного режима района определяют сроки массового перехода рачков из одной стадии в другую. В Петрозаводской губе уменьшение количества младших копеподитных стадий наблюдается в июне, в центральном районе озера – в июле (рис. 3, 4), что согласуется с наблюдаемыми различиями в сроках термических явлений в этих районах (Ефремова, 2010). Для других возрастных стадий коэффициенты корреляции Спирмена между обилием и температурой воды оказались недостоверными в силу большой изменчивости показателей.
ЗАКЛЮЧЕНИЕ
Веслоногий рачок Limnocalanus macrurus является основным компонентом зоопланктона Онежского оз. и важным кормовым объектом для рыб-планктофагов. Рачок является моноцикличным видом, с одной генерацией и зимним размножением.
На основе многолетних данных (1988–2017 гг.) были изучены основные особенности жизненного цикла рачка в Петрозаводской губе и центральной части Онежского оз. Средние количественные показатели за вегетационный сезон и среднемноголетние максимумы L. macrurus в заливе ниже отмеченных в центре озера. Из-за разницы в термическом режиме районов весеннее развитие в Петрозаводской губе происходило на 2–3 декады раньше.
Несмотря на климатические изменения, отмеченные в последние десятилетия, заметных изменений обилия L. macrurus в озере не выявлено.
Список литературы
Ефремова Т.А., Сабылина А.В., Лозовик П.А., 2013. Лабильные органические вещества (углеводы, липиды и белки) в Онежском озере // Труды Карельского научного центра РАН. № 6. С. 96–104.
Ефремома Т.В., 2010. Термический режим // Онежское озеро. Атлас. Отв. ред. Филатов Н.Н. Петрозаводск: Карельский научный центр РАН. С. 55–66.
Калинкина Н.М., Теканова Е.В., Сабылина А.В., Рыжаков А.В., 2019. Изменения гидрохимического режима Онежского озера с начала 1990-х годов // Известия РАН. Серия географическая. № 1. С. 62–72.
Куликова Т.П., 1982. Зоопланктон залива Большое Онего и его продуктивность // Лимнологические исследования на заливе Онежского озера Большое Онего. Отв. ред. Асанович Т.А. Л.: Зоологический институт АН СССР. С. 130–155.
Куликова Т.П., 2004. Зоопланктон водных объектов бассейна реки Шуя. Петрозаводск: КарНЦ РАН. 124 с.
Куликова Т.П., 2007. Зоопланктон водных объектов бассейна Онежского озера. Петрозаводск: КарНЦ РАН. 223 с.
Куликова Т.П., 2010. Зоопланктон водных объектов бассейна Белого моря. Петрозаводск: КарНЦ РАН. 325 с.
Куликова Т.П., 2012. Зоопланктон водных объектов северной части бассейна Ладожского озера. Петрозаводск: КарНЦ РАН. 192 с.
Куликова Т.П., Кустовлянкина H.Б., Сярки М.Т., 1997. Зоопланктон как компонент экосистемы Онежского озера. Петрозаводск: Карельский научный центр РАН. 112 с.
Куликова Т.П., Сярки М.Т., 2000. Современное состояние зоопланктона в глубоководных районах Ладожского и Онежского озер // Ладожское озеро. Мониторинг, исследование современного состояния и проблемы управления Ладожским озером и другими большими озерами. Петрозаводск: КарНЦ РАН. С. 202–207.
Куликова Т.П., Щурова Л.Э., 1980. Метазойный зоопланктон Петрозаводской губы Онежского озера // Гидробиология Петрозаводской губы Онежского озера. Петрозаводск. Отв. ред. Николаев И.И., Помазовская И.В. С. 74–96.
Лазарева В.И., Соколова Е.А., 2013. Динамика и фенология зоопланктона крупного равнинного водохранилища: отклик на изменение климата // Успехи современной биологии. Т. 133. № 6. С. 564–574.
Лозовик П.А., Зобков М.Б., Бородулина Г.С., Токарев И.В., 2019. Оценка внешнего водообмена заливов озер по химическим показателям воды // Водные ресурсы. Т. 46. № 1. С. 91–101.
Лукин А.А., Георгиев А.П., 2010. Рыбы // Онежское озеро. Атлас. Отв. ред. Филатов Н.Н. Петрозаводск: Карельский научный центр РАН. С. 124–126.
Методические рекомендации по сбору и обработке материалов в гидробиологических исследованиях на пресноводных водоемах. Зоопланктон и его продукция, 1984. Л.: ГосНИОРХ. 33 с.
Пидгайко М.Л., 1984. Зоопланктон водоемов европейской части СССР. М.: Наука. 208 с.
Ривьер И.К., 2012. Холодноводный зоопланктон озер бассейна Верхней Волги. Ижевск: Пермяков С.А. 390 с.
Сабылина А.В., 1999. Современный гидрохимический режим озера // Онежское озеро. Экологические проблемы. Отв. ред. Филатов Н.Н. Петрозаводск: Карельский научный центр РАН. С. 58–108.
Сабылина А.В., 2015. Химический состав воды Онежского озера // Крупнейшие озера-водохранилища Северо-Запада европейской территории России: современное состояние и изменения экосистем при климатических и антропогенных воздействиях. Отв. ред. Филатов Н.Н. Петрозаводск: Карельский научный центр РАН. С. 72–77.
Сабылина А.В., 2015а. Химический состав губ Онежского озера, подверженных антропогенному загрязнению // Крупнейшие озера-водохранилища Северо-Запада европейской территории России: современное состояние и изменения экосистем при климатических и антропогенных воздействиях. Отв. ред. Филатов Н.Н. Петрозаводск: Карельский научный центр РАН. С. 77–80.
Сабылина А.В., Лозовик П.А., Зобков М.Б., 2010. Химический состав воды Онежского озера и его притоков // Водные ресурсы. Т. 37. № 6. С. 717–729.
Смирнова Т.С., 1972. Планктонные коловратки и ракообразные // Зоопланктон Онежского озера. Отв. ред. Николаев И.И. Л.: Наука. С. 126–240.
Сущеня Л.М., Семенченко В.П., Вежновец В.В., 1986. Биология и продукция ледниковых реликтовых ракообразных. Минск: Наука и техника. 160 с.
Сярки М.Т., 2013. Изучение траектории сезонной динамики планктона с помощью метода двойного сглаживания // Принципы экологии. № 1 (5). С. 61–67.
Тимакова М.В., 1981. Рост и развитие лимнокалянуса в оз. Пертозере // Материалы семинара по проблеме “Биологические ресурсы Белого моря и внутренних водоемов Европейского Севера” 23–25 января 1980 г., Петрозаводск. Отв. ред. Кадетова З.Ф., Щемелева А.В. Петрозаводск: Карельский филиал АН СССР. С. 87–89.
Филатов Н.Н., Тимакова Т.М., Литвиненко А.В., 2010. Общая характеристика озера // Онежское озеро. Атлас. Отв. ред. Н.Н. Филатов. Петрозаводск: Карельский научный центр РАН. С. 15–17.
Филимонова З.И., 1965. Низшие ракообразные планктона озер Карелии // Фауна озер Карелии. Беспозвоночные. Отв. ред. Полянский Ю.И. М.–Л.: Наука. С. 111–146.
Филимонова З.И., 1966. Limnocalanus grimaldii macrurus (SARS) в озерах Карелии // Тезисы докладов XIII научной конференции по изучению внутренних водоемов Прибалтики. Тарту: Академия наук Эстонской ССР. С. 182–183.
Adrian R., Deneke R., 1996. Possible impact of mild winters on zooplankton succession in eutrophic lakes of the Atlantic European area // Freshwater Biology. № 36. P. 757–770.
Adrian R., O’Reilly C. M., Zagarese H., Baines S B., Hessen D.O. et al., 2009. Lakes as sentinels of climate change // Limnology and Oceanography. V. 54 (6, part 2). P. 2283–2297.
Adrian R., Wilhelm S., Gerten D., 2006. Life-history traits of lake plankton species may govern their phenological response to climate warming // Global Change Biology. V. 12. P. 652–661.
Anneville O., Molinero J. C., Souissi S., Balvay G., Gerdeaux D., 2007. Long-term changes in the copepod community of Lake Geneva // Oxford J. of Plankton Research. Supplement 1. V. 29. P. 49–59.
Arbačiauskas K., Kalytytė D., 2010. Occurrence and interannual abundance variation of glacial relict calanoids Limnocalanus macrurus and Eurytemora lacustris in Lithuanian lakes // Acta Zoologica Lituanica. V. 20. № 1. P. 61–67.
Ban S., 1994. Effect of temperature and food concentration on post-embryonic development, egg production and adult body size of calanoid copepod Eurytemora affinis // Journal of Plankton Research. V. 16 (6). P. 721–735.
Brett M.T., Bunn S.E., Chandra S., Galloway A.W.E., Guo F. et al., 2017. How important are terrestrial organic carbon inputs for secondary production in freshwater ecosystems? // Freshwater Biology. V. 62. P. 833–853.
Brett M.T., Müller-Navarra D.C., 1997. The role of highly unsaturated fatty acids in aquatic food-web processes // Freshwater Biology. № 38. P. 483–499.
Carlsson P., Graneli E., Tester P., Boni L. 1995. Influences of riverine humic substances on bacteria, protozoa, phytoplankton, and copepods in a coastal plankton community // Marine Ecology Progress Series. V. 127 (1–3). P. 213–221.
Carter J.C.H., 1969. Life Cycles of Limnocalanus macrurus and Senecella calanoides, and seasonal abundance and vertical distributions of various planktonic copepods, in Parry Sound, Georgian Bay // Journal of the Fisheries Research Board of Canada. V. 26. № 10. P. 2543–2560.
Cook K B., Bunker A., Hay S., Hirst A.G., Speirs D.C., 2007. Naupliar development times and survival of the copepods Calanus helgolandicus and Calanus finmarchicus in relation to food and temperature, Journal of Plankton Research. V. 29. Issue 9. P. 757–767.
Efremova T.A., Sabylina A.V., Lozovik P.A, Slaveykova V.I., Zobkova M.V., Pasche N., 2019. Seasonal and spatial variation in hydrochemical parameters of Lake Onego (Russia): insights from 2016 field monitoring // Inland Waters. P. 1–13. https://doi.org/10.1080/20442041.2019.1568097
Filatov N.N., Kalinkina N.M., Tekanova E.V., 2018. Modern changes in the ecosystem of Lake Onego with climate warming // Limnology and Freshwater Biology. № 1. P. 15–17.
Gerten D., Adrian R., 2000. Climate-driven changes of spring phytoplankton dynamics and the sensitivity of shallow polymictic lakes to the North Atlantic Oscillation // Limnology and Oceanography. V. 45 (5). P. 1058–1066.
Gerten D., Adrian R., 2002. Species-specific changes in the phenology and peak abundance of freshwater copepods in response to warm summers // Freshwater Biology. № 47. P. 2163–2173.
Hampton S.E., Gray D.K., Izmest’eva L.R., Moore M.V., Ozersky T., 2014. The rise and fall of plankton: long-term changes in the vertical distribution of algae and grazers in Lake Baikal, Siberia // PLOS one. V. 9. Issue 2. P. 1–10.
Hart R.C., 1990. Copepod post-embryonic durations: pattern, conformity, and predictability. The realities of isochronal and equiproportional development, and trends in the copepodid-naupliar duration ratio // Hydrobiologia. V. 206. P. 175–206.
Izmest’eva L.R., Moore M.V., Hampton S.E., Ferwerda C.J., Gray D.K. et al., 2016. Lake-wide physical and biological trends associated with warming in Lake Baikal // Great Lakes Research. P. 6–17.
Kainz M.J., Perga M.-E., Arts M.T., Mazumder A., 2009. Essential fatty acid concentrations of different seston sizes and zooplankton: a field study of monomictic coastal lakes // Journal of plankton research. V. 31. № 6. P. 635–645.
Kane D.D., Gannon J.E., Culver D.A., 2004. The Status of Limnocalanus macrurus (Copepoda: Calanoida: Centropagidae) in Lake Erie // Great Lakes Research. V. 30 (1). P. 22–30.
Kelly P.T., Solomon C.T., Weidel B.C., Jones S.E., 2014. Terrestrial carbon is a resource, but not a subsidy, for lake zooplankton // Ecology. V. 95 (5). P. 1236–1242.
Korneva L.G., Lazareva V.I., Mineeva N.M., Sigareva L.E., Sokolova E.A.et al., 2019. The State and Dynamics of Biological Communities in the Rybinsk Reservoir under Climate Changes // Journal of Siberian Federal University. Biology. V.12 (2). P. 160–179.
Nilssen J.P., Wærvågen S.B., 2000. Superficial ecosystem similarities vs autecological stripping: the “twin species” Mesocyclops leuckarti (Claus) and Thermocyclops oithonoides (Sars) – seasonal habitat utilisation and life history traits // Journal of Limnology. V. 59 (2). P. 79–102.
Ravet J.L., Brett M.T., Arhonditsis G.B., 2010. The effects of seston lipids on zooplankton fatty acid composition in Lake Washington, Washington, USA // Ecology. V. 91 (1). P. 180–190.
Roff J.C., Cartel J.C.H., 1972. Life cycle and seasonal abundance of the copepods Limnocalanus macrurus Sars in a high arctic lake // Limnology and Oceanography. V. 17 (3). P. 363–370.
Selgeby J.H., 1975. Life Histories and Abundance of crustaceanzooplankton in the Outlet of Lake Superior, l971–72 // Journal of the Fisheries Research Board of Canada. V. 32 (4). P. 461–470.
Suarez E.L., Tiffay M.-C, Kalinkina N., Tchekryzheva T., Sharov A. et al., 2019. Diurnal variation in the convection-driven vertical distribution of phytoplankton under ice and after ice-off in large Lake Onego (Russia) // Inland Waters. P. 1–12. https://doi.org/10.1080/20442041.2018.1559582
Vanderploeg H.A., Cavaletto J.F., Liebig J.R., Gardner W.S., 1998. Limnocalanus macrurus (Copepoda: Calanoida) retains a marine arctic lipid and life cycle strategy in Lake Michigan // Plankton Research. V. 20 (8). P. 1581–1597.
Wagner C., Adrian R., 2009. Exploring lake ecosystems: hierarchy responses to long-term change? // Global Change Biology. V. 15. P. 1104–1115.
Winder M., Schindler D.E., Essington T.E., Litt A.H., 2009. Disrupted seasonal clockwork in the population dynamics of a freshwater copepod by climate warming // Limnology and Oceanography. V. 54 (6, part 2). P. 2493–2505.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал