Зоологический журнал, 2022, T. 101, № 11, стр. 1203-1215
Рост, питание личинок и молоди Rapana venosa (Gastropoda, Muricidae) в экспериментальных условиях
А. В. Пиркова a, Л. В. Ладыгина a, *
a ФИЦ Институт биологии южных морей имени А.О. Ковалевского РАН
299011 Севастополь, пр. Нахимова, 2, Россия
* E-mail: lvladygina@yandex.ru
Поступила в редакцию 12.03.2022
После доработки 30.06.2022
Принята к публикации 05.07.2022
- EDN: MOGZYG
- DOI: 10.31857/S0044513422110101
Аннотация
В экспериментальных условиях изучали развития личинок, рост и питание молоди рапаны (Rapana venosa), вселенца в Черное море. При сбалансированной диете, состоящей из 6 видов микроводорослей, и температуре воды 22–23°С продолжительность планктонных стадий составила 22 сут. Процесс метаморфоза закончился при переходе на хищнический тип питания на 25-е сут после выхода личинок из яйцевых капсул. Выявлены случаи каннибализма среди молоди рапаны. Уточнены размеры ювенильных особей рапаны, способных перфорировать раковины двустворчатых моллюсков. В раковине одной мидии наблюдали от одного до пяти отверстий разной формы. Наиболее часто рапаны перфорировали тонкий край раковин мидий с проекцией отверстия на край мантии; реже всего – с проекцией на передние сократительные мускулы ноги. Исследование перфорированных отверстий с помощью электронного сканирующего микроскопа показало, что рапаны размерами 20–25 мм перфорируют раковины мидий радулой и растворяют секретом, выделяемым вспомогательным органом перфорации. Установлены зависимости масс-размерных характеристик (Wобщ = 0.002H2.9377, R 2 = 0.9769), интенсивности питания (P = 0.64H2.8769, R 2 = 0.9699) и диаметра перфорированных отверстий (d = 170.78e0.1029H, R 2 = 0.9403) в раковинах спата мидий от высоты раковины рапаны.
Рапана (Rapana venosa (Valenciennes 1846)) – хищный морской брюхоногий моллюск, обитающий в прибрежных водах Китая, Кореи и Японии (Чухчин, 1984; Chandler et al., 2008), вселенец в Черное море (Драпкин, 1953). В течение двух десятилетий моллюск распространился по всему морю, кроме наиболее опресненных участков северо-западной части (Иванов, 1961). Основным пищевым объектом рапаны являются устрицы и мидии (Чухчин, 1984). Помимо питания мидией Mytilus galloprovincialis (Lamarck 1819) и устрицей Ostrea edulis (Linne 1758), рапаны питаются и другими двустворчатыми моллюсками: Cardium, Pecten, Tapes и Venus (Alyakrinskaya, 2002; Золотарев, Евченко, 2010; Саенко, Шаганов, 2021).
Во время метаморфоза личинки R. venosa меняют тип питания: от фитофага они переходят к хищничеству (Чухчин, 1984; Wei et al., 1999; Yu et al., 2018). Как установлено для хищного брюхоногого моллюска Babylonia areolata (Link 1807), на этом этапе онтогенеза происходит смена пищеварительных ферментов: амилазы и целлюлазы (ферментов, расщепляющих растительную пищу) на липазу (фермента, расщепляющего животную пищу) (Wei et al., 2007).
Перфорация раковин – первый способ нападения рапаны на двустворчатых моллюсков. Молодь перфорирует раковины при помощи радулы – органа пищеварительной системы (Cesari, Mizzan, 1993; Harding et al., 2008; Mina Eisapour et al., 2015) и вспомогательного органа перфорации (accessory boring organ, ABO) (Carriker, 1981). Радула состоит из жестких зубов на гибкой кутикулярной мембране. Радулярные зубы прикрепляются к мембране поперечными рядами (Harding et al., 2008; Mina Eisapour et al., 2015). Длина и ширина радулы, количество поперечных рядов радулярных зубов увеличиваются в зависимости от размеров раковины моллюска (Harding et al., 2008). Вспомогательный орган перфорации (ABO) расположен в средне- передневентральной части стопы (Carriker, 1981).
Согласно опубликованным данным, перфорация может осуществляться механическим, химическим или комбинированным способом (Alyakrinkaya, 2002). Растворяют раковину вещества, выделяемые вспомогательным органом перфорации (АВО): кислота (возможно, HCI), неизвестные хелатирующие соединения и ферменты, содержащиеся в гипертоническом мукоидном секрете, рН которого 3.8–4.1 (Carriker, 1981). Ранее было известно, что перфорируют раковины двустворчатых моллюсков молодые рапаны с высотой раковины до 35 мм (Чухчин, 1984; Harding et al., 2008). Взрослые особи рапаны (R. venosa) вскрывают моллюсков без перфорации раковины. R. venosa – раздельнополый моллюск. Самки откладывают оплодотворенные яйца в капсулы длиной от 6 до 3.5 см. В каждой капсуле содержится 200–1000 яиц (Чухчин,1984). По экспериментальным данным разных авторов, внутрикапсулярное развитие личинок рапаны может происходить в течение 12–26 сут (Chung et al., 1993; Harding, 2006; Saglam, Duzgunes, 2007; Harding et al., 2008; Пиркова, Ладыгина, 2018) и продолжительность развития зависит от температуры и солености воды (Ban Shaojun et al., 2014). Наиболее короткий период инкубации (12 дней) отмечен при температуре воды 34°С и солености 30‰ (Ban Shaojun et al., 2014). При солености воды 18−28‰ и температуре 18.3−20.4°С продолжительность развития рапаны составила от 17 (Chung et al., 1993) до 21 сут (Harding, 2006). После выхода из яйцевых капсул личинки плавают в планктоне в течение 24–42 сут до окончания метаморфоза (Harding, Mann, 2003; Harding, 2006). В зависимости от морфологии раковины они были условно разделены на четыре стадии (Harding, 2006) и пять стадий (Pan et al., 2013); а в зависимости от количества оборотов и формы велума – на шесть стадий (Yu et al., 2020). Изучен темп роста личинок рапаны в экспериментальных условиях при составе корма из трех видов микроводорослей: I. galbana, Pl. subcordi formis, Ch. vulgaris (Wei et al., 1999) и Pseudoisochrysis sp., Chaetoceros sp., Tetraselmis sp. (Harding, 2006), а также определена оптимальная плотность посадки личинок на разных стадиях развития − 0.1 экз./мл (Yu et al., 2020). Из литературных источников известно, что метаморфоз педивелигеров в экспериментальных условиях наблюдался при размерах раковины от 1180 до1240 мкм (Harding, 2006) или от 1250 до 1500 мкм (Pan et al., 2013; Yu et al., 2020).
Однако в литературе нет данных о зависимости продолжительности развития планктонных стадий личинок от состава корма. Отсутствуют сведения о росте, интенсивности питания и выборе способа нападения на жертву ювенильных особей рапаны разного размера и возраста.
МАТЕРИАЛ И МЕТОДЫ
Материалом для работы послужили личинки и молодь рапаны, выращенные в питомнике. В бухте Ласпи (ЮБК: 44°24′56″ N, 33°42′19″ E) на глубине 6 м (12.07.2017 г.) были отобраны семь половозрелых особей рапаны. В лабораторных условиях их содержали при температуре 22.0−23.0°С и постоянной аэрации. Смену воды проводили через сутки. В качестве корма были использованы мидии, выращенные на мидийной ферме (внешний рейд Севастопольской бухты). 19.07.2017 г. самка рапаны с высотой раковины 58.0 мм отложила кладку на раковину живой мидии. Мидию с кладкой рапаны перенесли в отдельную емкость с профильтрованной морской водой и аэрацией. В течение 20 сут смену воды проводили с интервалом 1–2 сут.
Личинок рапаны, вышедших из яйцевых капсул 07.08.2017 г., собрали на газ-сите с размером ячеи 280 мкм. Выращивали в профильтрованной аэрируемой морской воде при температуре 22–23°С. Обмен воды проводили через каждые двое суток при помощи газ-сита. Кормили личинок смесью микроводорослей Isochrysis galbana (Parke 1949), Phaeodactylum tricornutum (Bohlin 1897), Tetraselmis suecica (Kylin Butcher 1959) суммарной концентрации 200 тыс. кл./мл в соотношении клеток 3 : 2 : 1. Начиная с шестисуточного возраста (стадия среднего велигера), концентрацию микроводорослей увеличили до 300 тыс. кл./мл с добавлением Emiliania huxleyi (Lohmann 1967), Rhodomonas salina (Wislouch) Hill & Wetherbee 1989)), а также Chlorella vulgaris f. suboblonga (Andreeva 1975). Плотность посадки личинок рапаны уменьшали по мере их развития: на стадии раннего велигера – 2 тыс. лич./л; среднего велигера – 1 тыс. лич./л; позднего велигера и педивелигера – 600 тыс. лич./л1 (Пиркова и др., 2016). Количество личинок определяли, отбирая штемпель-пипеткой 3 раза по 1 мл, предварительно сконцентрировав их в объеме 1 л. Контроль личиночного развития осуществляли при помощи микроскопов МБС-9 и МИКМЕД-6.
На стадии педивелигера (22-е сут выращивания) личинок рапаны разделили и поместили в две емкости. В одну из них, кроме микроводорослей, добавили спат мидий с длиной раковины около 2 мм. После завершения метаморфоза произвольно отобранные 67 экз. рапаны выращивали при плотности посадки 13 экз./л и температуре воды от 23.4 до 12.1°С.
До пятимесячного возраста в качестве корма для молоди рапаны использовали спат мидий размерами до 5 мм, полученный и выращенный в лабораторных условиях по описанной ранее методике (Холодов и др., 2017). Начиная с 159 сут (средние значения высоты раковины около 13.70 мм) рапан кормили мидиями (размерами более 12 мм), отобранными на мидийной ферме. Корм подавали в избытке и пополняли по мере потребления; микроводоросли для спата мидий добавляли ежедневно. Для выявления критических размеров, при которых рапаны способны перфорировать раковины, на 270-е сут выращивания молодь рапаны трех размерных групп: 25.9–36.3, 20.2–25.0 и 11.5–18.0 мм посадили в разные емкости.
Высоту (H, мкм) раковин личинок рапаны (по 10 экз.); высоту (H, мм) и ширину (D, мм) раковин молоди рапаны (в количестве 67 экз. в возрасте 1 сут и в количестве 29 экз. в возрасте 115 сут); длину раковин мидий (L, мм) (перфорированных – 1095 экз., вскрытых без перфорации 4156 экз.), которыми кормили рапан, а также диаметр перфорированных отверстий (1321 отв.) измеряли при помощи окуляр-микрометра и микроскопа МБС-9 в камере Богорова. Линейные характеристики молоди рапаны возрастом от 159 до 279 сут (по 28 экз.) определяли цифровым штангенциркулем (ШЦ-1 “Зубр”, с точностью до 0.01 мм). Структуру перфорированных отверстий в раковинах мидий изучали при помощи электронного сканирующего микроскопа SEM Hitachi SU 3500.
Для определения суточных рационов рапаны были рассчитаны формулы зависимостей общего сырого веса мидий (1) и веса раковины (2) от их длины:
где: 2.40 ≤ L, мм ≤ 39.74 – диапазон размеров мидий, используемых в качестве кормовых объектов; Wобщ, мг – общий сырой вес мидий; Wрак, мг – вес раковины мидий; R 2 – коэффициент детерминации.Суточный рацион (или абсолютную интенсивность питания) молоди рапаны определяли по формуле (Чухчин, 1984):
Аппроксимации зависимостей общего сырого веса, ширины раковины, суточного рациона, диаметра и доли перфорированных отверстий в раковинах мидий от высоты раковин рапаны, а также общего веса и веса раковин мидий от их длины выполнены в лицензионной программе “Диаграмма”(Word, 2003) и представлены в виде уравнений. Средние значения и доверительные интервалы линейных параметров моллюсков были подсчитаны по программе “Excel”.
РЕЗУЛЬТАТЫ
Развитие личинок рапаны
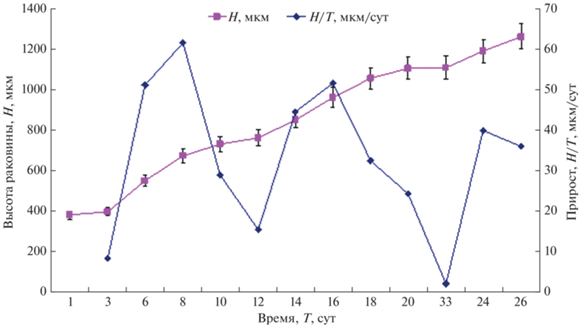
Ранее было установлено, что продолжительность внутрикапсулярного развития рапаны при 23°С составила 20 сут (Пиркова, Ладыгина, 2018). Раковина велигеров, вышедших из яйцевых капсул, в 1.25 оборота коричневого цвета с вкраплениями в виде оранжевых точек. Высота раковин составила 382.5 ± 15.3, ширина – 332.0 ± 17.5 мкм (рис. 1А). У основания велума различимы два глазка диаметром 16 мкм. Велум раннего велигера двулопастный, не окрашенный, с двумя рядами ресничек: коротких и длинных. Передняя лопасть велума длиннее (410 мкм), чем задняя (367 мкм). Движение ресничек направлено в одну сторону, и личинки, плавая в толще воды, образуют т.н. “воронки”, поднимаясь к поверхности, и удерживаются поверхностным натяжением воды. Возможно, в природных условиях, таким образом, происходит их расселение. Личинки сразу же начинали питаться, при помощи ресничек велума отфильтровывая микроводоросли и направляя их в ротовое отверстие. По мере роста у личинок с высотой раковины 552.0 ± 53.1 мкм (средний велигер, возраст 6 сут) происходит раздвоение лопастей велума (рис. 1B). У позднего велигера, при высоте раковины 733.0 ± 63.3 мкм и диаметре глазка 24 мкм (через 10 сут после выхода из яйцевых капсул) велум состоит из четырех лопастей (рис. 1C). Длина передних лопастей около 810, задних лопастей около 780 мкм. Раздвоенный велум личинок рапаны из планктона Черного моря был описан ранее как систематический признак (Чухчин, 1972). В эксперименте высота раковины педивелигеров составила 1057.5 ± 42.3, ширина – 857.0 ± 34.33 мкм (возраст 18 сут); нога белая, подвижная; размеры велума уменьшились. Педивелигеры всплывали в толщу воды (рис. 1D) или передвигались по дну емкости при помощи ноги и велума (рис. 1E). Ресничками велума личинки собирали осевшие микроводоросли со стенок емкости и раковин других педивелигеров. В опыте с добавлением спата мидий процесс метаморфоза личинок рапаны завершился на 25-е сут выращивания с выживаемостью 38.7%. У личинок не стало велума, нога увеличилась в размерах, сбоку ноги стала видна крышечка (оперкулум) (рис. 1F). После окончания метаморфоза среднее значение высоты раковины составило 1236.5 ± 73.5, ширины раковины – 903.5 ± 30.5 мкм. Динамика роста и прирост личинок рапаны, за период от момента выхода из яйцевых капсул до окончания метаморфоза, представлены на рис. 2.
Рис. 1.
Планктонные стадии личинок и молодь рапаны (Rapana venosa): A – ранний велигер (возраст 1 сут), B – средний велигер (возраст 6 сут), C – поздний велигер (возраст 10 сут), D – педивелигер “плавающий” (возраст 18 сут), E – педивелигер “ползающий” (возраст 20 сут), F – молодь рапаны (возраст 25 сут); 1 – раковина, 2 – велум, 3 – задние лопасти велума, 4 – передние лопасти велума, 5 – нога, 6 – глазок, 7 – крышечка (оперкулум). Масштаб, мкм: A – 143, B – 186, C – 289, D – 345, E – 320, F – 266.

Среднесуточный прирост личинок рапаны
На стадии раннего велигера (возраст личинок 1–5 сут) среднесуточный прирост составил 8.4 мкм сут–1 (см. рис. 2). Личинок выращивали при плотности посадки 2 тыс./л. На 6–8-е сут (стадия среднего велигера) темп роста личинок возрос до 56.3 мкм/сут, т.к. плотность посадки была уменьшена в два раза, а концентрация корма увеличена до 300 тыс. кл./мл. В состав корма добавили E. huxleyi, Rh. salina, а также Ch. vulgaris f. suboblonga, что предотвратило развитие инфузорий в культуре личинок. Известно, что эта микроводоросль − природный антибиотик, подавляющий развитие микроорганизмов в воде (Богданов, 2007). На 12-е сут среднесуточный прирост личинок снизился до 15.5 мкм/сут, что совпало с переходом в стадию позднего велигера. На 14–16 сут при плотности посадки 600 лич./л темп роста педивелигеров увеличился до 47 мкм/сут. Снижение прироста на 22-е сут до 2.1 мкм/сут, вероятно, связано с прохождением метаморфоза и переходом молоди рапаны на хищнический тип питания, что подтверждено наличием перфорированных раковин спата мидии (диаметр отверстий 162.5 мкм) и перфорированных раковин двух экземпляров рапаны (диаметр отверстий около 150.0 мкм). В опыте, где корм состоял только из микроводорослей, раковины педивелигеров были хрупкими и разрушались при обмене воды. Личинки погибли на 31-е сут выращивания, не пройдя метаморфоз.
Рост молоди рапаны
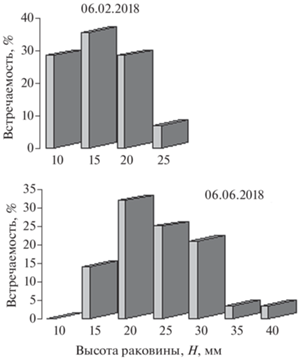
За период исследования средние значения высоты раковины рапаны увеличились от 1.26 до 21.66 мм. Однако абсолютные значения линейных параметров в конце эксперимента различались в три раза (12.4 и 37.0 мм) (табл. 1). На рис. 3 представлены гистограммы распределения размерного состава молоди рапаны с интервалом в 4 мес. Выделяются три размерные группы: медленнорастущие (до 10 мм), быстрорастущие (до 25 мм) и особи со средними темпами роста (15–20 мм). Доля медленнорастущих особей превысила долю быстрорастущих в 4 раза и составила 28.6%. По мере роста доля медленнорастущих особей снизился до 14%; выделились две группы быстрорастущих моллюсков: 35 и 40 мм (по 3.6%), а пик численности, приходящийся на размерную группу 15 мм, сместился на 20 мм.
Таблица 1.
Весовые и размерные характеристики, а также рацион молоди рапаны (Rapana venosa)
| Дата | T, сут | n, экз. | Раковина | H/C | ΔH, мм/сут |
Средний общий вес, Wобщ ± i, мг |
ΔWобщ мг/сут |
Рацион, мг/экз. сут | |
|---|---|---|---|---|---|---|---|---|---|
| высота, H min–max, мм; средняя высота, H ± i, мм |
средняя ширина раковины, C ± i, мм |
||||||||
| 2017.31.08 | 1 | 67 | 1.05–1.30; 1.26 ± 0.81 | 0.63 ± 0.03 | 2.00 | − | – | − | − |
| 01.09 | 2 | 67 | 1.05–1.75; 1.34 ± 0.11 | 0.69 ± 0.05 | 1.94 | 0.08 | − | − | 0.0362 |
| 07.09 | 8 | 62 | 1.15–1.81; 1.51 ± 0.18 | 0.81 ± 0.31 | 1.86 | 0.03 | − | − | 0.0604 |
| 08.09 | 9 | 60 | 1.20–2.75; 1.96 ± 0.30 | 1.14 ± 0.22 | 1.72 | 0.45 | − | − | 0.0312 |
| 09.09 | 10 | 58 | 1.65–3.25; 2.13 ± 0.69 | 1.26 ± 0.46 | 1.69 | 0.17 | − | − | 0.0435 |
| 12.09 | 13 | 56 | 1.70–3.50; 2.39 ± 0.61 | 1.45 ± 0.53 | 1.65 | 0.09 | 2.59 ± 0.13 | − | 0.0732 |
| 14.09 | 15 | 55 | 1.85–3.70; 2.68 ± 0.70 | 1.67 ± 0.41 | 1.60 | 0.15 | 3.62 ± 0.18 | 0.51 | 0.0859 |
| 16.09 | 17 | 52 | 2.05–4.85; 2.92 ± 0.48 | 1.84 ± 0.27 | 1.59 | 0.12 | 4.66 ± 0.23 | 0.52 | 0.1454 |
| 19.09 | 20 | 48 | 2.15–5.56; 3.77 ± 0.59 | 2.46 ± 0.37 | 1.53 | 0.28 | 9.87 ± 0.49 | 1.74 | 0.1903 |
| 21.09 | 22 | 44 | 2.22–6.20; 4.06 ± 0.66 | 2.68 ± 0.44 | 1.51 | 0.15 | 12.27 ± 0.74 | 1.20 | 0.1744 |
| 23.09 | 24 | 41 | 2.30–6.75; 4.68 ± 0.69 | 3.13 ± 0.46 | 1.50 | 0.31 | 18.62 ± 1.11 | 3.18 | 0.4768 |
| 26.09 | 27 | 41 | 2.50–7.63; 4.93 ± 0.61 | 3.31 ± 0.42 | 1.49 | 0.08 | 21.70 ± 1.52 | 1.03 | 0.5053 |
| 28.09 | 29 | 40 | 2.60–8.50; 5.10 ± 0.52 | 3.44 ± 0.34 | 1.48 | 0.09 | 23.97 ± 1.44 | 1.14 | 1.2152 |
| 30.09 | 31 | 40 | 2.70–8.72; 5.56 ± 0.55 | 3.77 ± 0.37 | 1.47 | 0.23 | 30.89 ± 1.85 | 3.46 | 1.0337 |
| 03.10 | 34 | 39 | 2.62–9.60; 6.25 ± 0.58 | 4.20 ± 0.40 | 1.49 | 0.23 | 49.99 ± 3.50 | 9.55 | 1.0454 |
| 05.10 | 36 | 39 | 2.70–9.83; 6.67 ± 0.61 | 4.58 ± 0.42 | 1.46 | 0.21 | 52.73 ± 2.64 | 1.37 | 1.6503 |
| 07.10 | 38 | 39 | 2.80–10.50; 7.10 ± 0.67 | 4.89 ± 0.48 | 1.45 | 0.22 | 63.35 ± 4.43 | 5.31 | 1.6018 |
| 10.10 | 41 | 38 | 3.30–11.49; 7.74 ± 0.66 | 5.37 ± 0.50 | 1.44 | 0.21 | 81.64 ± 4.08 | 6.10 | 1.6910 |
| 12.10 | 43 | 38 | 3.60–12.15; 8.16 ± 0.69 | 5.67 ± 0.55 | 1.44 | 0.21 | 95.35 ± 4.75 | 6.86 | 1.8344 |
| 14.10 | 45 | 38 | 3.90–12.80; 8.59 ± 0.74 | 5.99 ± 0.53 | 1.43 | 0.22 | 110.87 ± 5.54 | 7.76 | 3.1240 |
| 17.10 | 48 | 37 | 5.00–14.50; 9.22 ± 0.78 | 6.45 ± 0.51 | 1.43 | 0.21 | 136.50 ± 8.19 | 8.54 | 5.6024 |
| 19.10 | 50 | 37 | 5.10–15.10; 9.42 ± 0.81 | 6.59 ± 0.55 | 1.43 | 0.10 | 145.38 ± 10.18 | 4.44 | 1.8523 |
| 21.10 | 52 | 37 | 5.10–16.00; 9.6 3± 0.85 | 6.75 ± 0.59 | 1.43 | 0.11 | 155.11 ± 9.31 | 4.87 | 3.4983 |
| 24.10 | 55 | 37 | 5.10–16.70; 9.93 ± 0.87 | 6.97 ± 0.64 | 1.42 | 0.10 | 169.73 ± 11.88 | 4.87 | 5.2681 |
| 26.10 | 57 | 37 | 5.20–16.90; 10.13 ± 0.91 | 7.11 ± 0.69 | 1.42 | 0.10 | 179.97 ± 10.80 | 5.12 | 3.1762 |
| 28.10 | 59 | 37 | 5.20–17.30; 10.44 ± 0.88 | 7.34 ± 0.67 | 1.42 | 0.16 | 196.64 ± 13.76 | 8.34 | 4.3187 |
| 31.10 | 62 | 37 | 5.20–17.60; 10.64 ± 0.91 | 7.48 ± 0.72 | 1.42 | 0.07 | 207.91 ± 14.55 | 3.76 | 5.1552 |
| 07.11 | 69 | 36 | 5.50–17.90; 11.05 ± 0.93 | 7.78 ± 0.69 | 1.42 | 0.06 | 232.34 ± 18.59 | 3.49 | 6.0026 |
| 21.11 | 83 | 34 | 5.70–18.40; 11.94 ± 0.97 | 8.43 ± 0.65 | 1.42 | 0.06 | 291.71 ± 20.42 | 4.24 | 6.6512 |
| 15.12 | 107 | 30 | 5.80–19.40; 12.82 ± 1.10 | 9.08 ± 0.85 | 1.41 | 0.04 | 359.48 ± 28.75 | 2.83 | 11.4239 |
| 23.12 | 115 | 29 | 6.20–20.30; 12.96 ± 1.33 | 9.18 ± 0.99 | 1.41 | 0.02 | 371.13 ± 33.40 | 5.83 | 17.2034 |
| 2018.06.02 | 159 | 28 | 8.50–23.29; 13.70 ± 1.56 | 9.72 ± 1.14 | 1.41 | 0.02 | 436.89 ± 39.31 | 1.49 | 11.6089 |
| 07.03 | 188 | 28 | 9.60–29.30; 16.60 ± 1.80 | 11.84 ± 1.20 | 1.40 | 0.10 | 767.97 ± 38.39 | 11.42 | 11.7590 |
| 04.04 | 216 | 28 | 9.70–31.70; 17.58 ± 2.02 | 12.56 ± 1.56 | 1.40 | 0.04 | 908.91 ± 45.44 | 5.03 | 16.0861 |
| 25.04 | 237 | 28 | 9.80–33.30; 18.24 ± 2.16 | 13.04 ± 1.63 | 1.40 | 0.03 | 1012.84 ± 50.64 | 4.95 | 30.6863 |
| 11.05 | 253 | 28 | 10.70–35.40; 19.59 ± 2.34 | 14.03 ± 1.77 | 1.40 | 0.08 | 1249.22 ± 62.45 | 14.77 | 42.5817 |
| 22.05 | 264 | 28 | 10.90–35.70; 20.30 ± 2.31 | 14.55 ± 1.79 | 1.40 | 0.06 | 1386.95 ± 69.35 | 12.52 | 46.2757 |
| 28.05 | 270 | 28 | 11.50–36.30; 20.80 ± 2.34 | 14.91 ± 1.85 | 1.40 | 0.08 | 1489.72 ± 74.49 | 17.13 | 69.7233 |
| 06.06 | 279 | 28 | 12.40–37.00; 21.66 ± 2.30 | 15.54 ± 1.74 | 1.39 | 0.10 | 1678.01 ± 83.90 | 20.92 | 62.0863 |
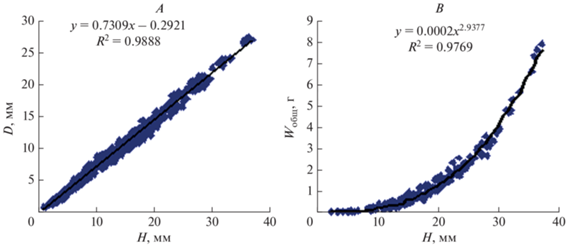
Рост раковины молоди рапаны подчинялся строгой изометрии. Пропорционально высоте увеличивалась ширина раковины. Установлена линейная зависимость ширины от высоты раковины (рис. 4A). Зависимость общего сырого веса от высоты раковины рапаны описывается степенной функцией. В размерном диапазоне 2.3–37.0 мм зарегистрирована положительная аллометрия прижизненного общего веса моллюсков относительно длины раковины (рис. 4B). Отношение высоты к ширине раковины (H/C) по мере роста изменялось от 2.0 до 1.39 и в среднем составило 1.58 (см. табл. 1). Среднесуточные линейный и весовой приросты моллюсков за исследуемый период колебались, соответственно, от 0.02 до 0.45 мм/сут (средневзвешенное значение 0.13 мм/сут) и от 0.51 до 20.92 мг/сут (средневзвешенное значение 5.89 мг/сут).
Рис. 4.
Зависимость ширины (A) и общего сырого веса (B) от высоты раковины молоди рапаны (Rapana venosa).
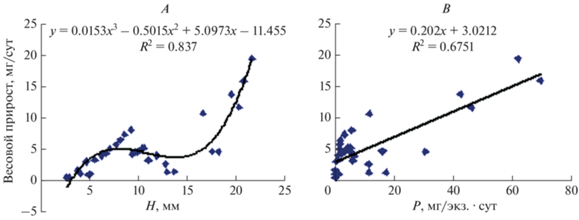
С увеличением линейных размеров увеличивался среднесуточный весовой прирост молоди рапаны. Зависимость описывается полиномом третьей степени (рис. 5A). Такая сложная зависимость весового прироста от высоты раковины рапаны указывает на влияние и других факторов, в частности температуры. Так, снижение весового прироста рапан размерного диапазона 9.22− 13.7 мм произошло в течение 73 сут (с 23.12.2017 по 07.03.2018 г.) при понижении температуры воды с 16 до 12°С по причине уменьшения рациона (рис. 5B). А с повышением температуры воды с 16 до 22°С потребление пищи увеличивается (Mei-JieYanga et al., 2019), что связано с изменением как активности пищеварительных ферментов (Wei et al., 2007), так и состава микрофлоры пищеварительного тракта (Mei-JieYanga et al., 2019). Зависимость весового прироста от рациона описывается линейной функцией (см. рис. 5B).
Рис. 5.
Зависимость среднесуточного весового прироста молоди рапаны (Rapana venosa) от: A – высоты раковины (H, мм), B – рациона (Р, мг/экз. · сут).
Интенсивность питания (Р, мг/экз. · сут) увеличивалась по мере линейного и весового роста рапаны. Зависимость суточного рациона от высоты раковины представлена в виде степенной функции (рис. 6A); зависимость рациона от общего сырого веса – в виде линейной функции (рис. 6B).
Рис. 6.
Зависимость рациона молоди рапаны (Rapana venosa) от: A – высоты (H, мм) раковины, B – общего сырого веса (Wобщ, мг).
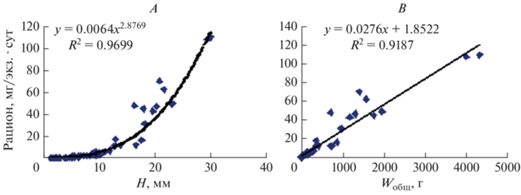
Один экземпляр размерами 10.64 ± 9.12 мм потреблял в сутки 5.1552 мг мягких тканей мидии, что составило 2.48% от общего веса. Рацион рапаны размерами 21.66 ± 2.30 мм составил 62.0863 мг/сут (см. табл. 1), что несколько ниже, чем было ранее определено для размерной группы 15−25 мм (Чухчин, 1984). По нашим расчетам, за весь период исследования (279 сут) суммарное значение потребленного корма одним моллюском составило 2760.48 мг, что в 1.64 раза превышает их индивидуальный вес. Отсюда, одной рапаной было потреблено 1023.5 экз. мидий размерами 5.0 мм.
Способы нападения молоди рапаны на мидий
Наблюдения под микроскопом позволили проследить нападение молоди рапаны на мидий. Прикрепляясь ногой к раковине жертвы, рапана перфорировала раковину моллюска при помощи радулы, поворачиваясь вправо и влево. После перфорации раковины рапана просовывала хобот в отверстие и радулой откусывала мягкие ткани жертвы, одновременно глоткой отсасывая тканевую жидкость мидии (рис. 7А). Хобот при этом вытягивался, поворачиваясь в разные стороны, и рапана выедала мягкие ткани, независимо от расположения отверстия в раковине. В раковине одной мидии отмечено от одного до пяти отверстий (рис. 7B) разной формы: круглой, овальной или с зубчатыми краями, причем диаметр наружного отверстия всегда был больше внутреннего. Диаметр перфорированных отверстий зависел от размеров молоди рапаны. Так, рапана с высотой раковины 1.335 мм перфорировала отверстие диаметром 195.94 мкм; с высотой раковины 21.4 мм – 1544 мкм. Установлена экспоненциальная зависимость диаметра перфорированного отверстия в раковинах мидий от среднего значения высоты раковины (H, мм) молоди рапаны:
Рис. 7.
Способы нападения молоди рапаны (Rapana venosa) на мидию (Mytilus galloprovoncialis): A – перфорация раковины и выедание мягких тканей мидии при помощи хобота (указано стрелкой), B – пять отверстий в створках одной мидии, C – нападение 10 экз. молоди рапаны на одну крупную мидию, D – “удушение” мидии двумя рапанами, E – мидия в устье раковины рапаны (указано стрелкой), F – выделение молодыми рапанами биотоксина (указано стрелкой) вблизи мидии. Масштаб, мм: A, B – 1.0; C – 9.0; D – 15.0; E – 3.5; F – 12.0.

За весь период исследования доля раковин мидий с одним отверстием составила 84.6% (926 экз.); с двумя – 11.35% (124 экз.); с тремя – 3.1% (34 экз.); с четырьмя – 0.9% (10 экз.) и пятью – 0.1% (1 экз.).
Предпочтения в выборе рапанами мидий определенного размера не было выявлено. Если двустворчатый моллюск превосходил их по размерам, то в нападении участвовало несколько молодых рапан (рис. 7C). Как и взрослые особи, они применяли способ “удушения” – ногой сжимали створки мидии, периодически послабляя силу сдавливания, пока мидия не откроется (рис. 7D). Рапаны размерами от 4.68 и до 21.66 мм могли открывать раковины мидий и без перфорации, например, ногой втягивали мидию в устье раковины (рис. 7E). При этом края створок жертвы попадали внутрь вентральной педальной железы (Чухчин, 1970) и, очевидно, вспомогательного органа перфорации (АВО), находящегося над вентральной педальной железой (Carriker, 1981). Отмечено также выделение рапанами (высота раковины около 12 мм) вблизи мидии биотоксина в виде белого “облака” (рис. 7F), которое быстро растворилось в воде. Мидия приоткрывала створки и рапаны с помощью хобота выедали мягкие ткани.
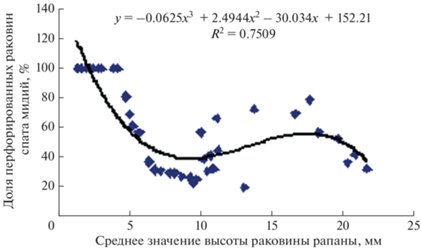
Доля потребленных рапанами мидий без перфорации раковины возрастала с увеличением размеров хищников. Зависимость доли перфорированных раковин мидий от размеров молоди рапаны описывается полиномом 3-й степени и показывает уменьшение доли перфорированных створок с увеличением размеров рапаны от 1.51 до 21.66 мм (рис. 8). По мере роста, начиная с размеров около 5 мм, молодые особи рапаны, кроме перфорации раковин двустворчатых моллюсков, применяли другие способы нападения.
Рис. 8.
Зависимость доли перфорированных раковин мидий от среднего значения высоты раковины молоди рапаны (Rapana venosa).
После разделения молоди рапаны на три размерные группы (25.9−36.3, 20.2−25.0 и 11.5−18.0 мм) было установлено, что рапаны первой размерной группы при нападении, как правило, открывали мидий без перфорации раковин, а особи второй и третьей размерных групп перфорировали раковины и вскрывали мидии без перфорации. Так, за период с 28.05. по 06.06.2018 г. рапанами первой размерной группы были вскрыты 100% мидий без перфорации раковин (13 экз.); рапанами второй и третьей размерных групп по 4 экз. мидий без перфорации и соответственно 5 и 7 экз. − с перфорацией (от 1 до 3 отверстий).
В процессе выращивания наряду с перфорированными раковинами мидий обнаруживали перфорированные раковины молодых рапан. На 88-е сут в результате каннибализма их количество снизилось с 67 до 37 экз., а плотность посадки уменьшилась с 17 до 9 экз./л. Известно, что каннибализм является важным детерминантом численности поселения рапаны (Yu et al., 2018). Перфорирование отверстий в раковинах мидий не приурочено к определенному участку раковины. Наиболее часто молодь рапаны перфорировала тонкий край раковин мидий с проекцией на край мантии (36.93%). Раковины с проекцией отверстия на мантию и жабры составили 26.15%; на мантию и пищеварительную систему – 16.92%; на мускул-аддуктор – 9.23%; на мантию и сердце – 6.15%; на мантию и передние сократительные мускулы ноги – 4.62%. Количество перфорированных правых и левых створок мидий составило соответственно 562 и 532.
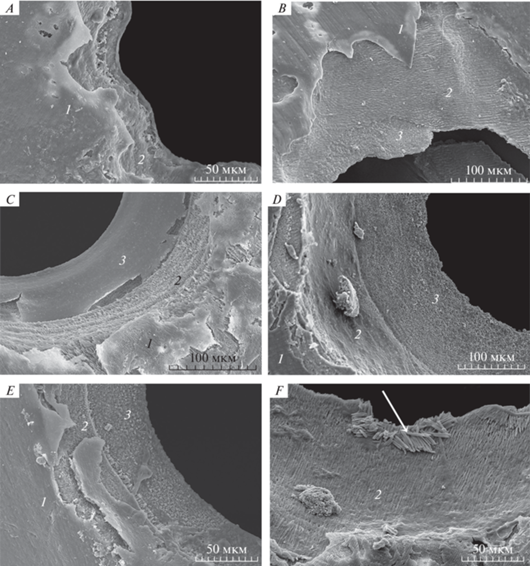
Известно, что микроструктура раковины мидии M. galloprovincialis состоит из трех слоев: верхнего – периостракума (конхиолина), среднего – призматического (кальцита) и внутреннего – перламутрового (арагонита) (Checa et al., 2014). Электронно-микроскопические исследования микроструктуры края отверстий, перфорированных молодью рапаны в возрасте 10 сут, показали наличие зубчатых краев в трех слоях раковины мидий (рис. 9A), что свидетельствует об использовании только радулы. Наличие поврежденных участков конхиолинового слоя вблизи отверстия – это следы зубчиков радулы (рис. 9B–9C, 9E). Отверстия, перфорированные молодью рапаны размерами 20−25 мм зубчатые в верхнем конхиолиновом слое – следы радулы; гладкие края отверстий в среднем и внутреннем слоях раковины мидии – явные признаки растворения раковины химическими веществами (рис. 9D–9F). Кристаллы среднего слоя раковины, расположенные в одной плоскости (рис. 9B), и группа кристаллов призматического слоя ростового края раковины мидии (рис. 9F) свидетельствуют о том, что рапаны перфорируют раковины и радулой, и химическими веществами, растворяющими как кристаллы карбоната кальция, так и органическую прослойку, соединяющую кристаллы.
Рис. 9.
Электронно-микроскопические фотографии отверстий в раковинах мидии Mytilus galloprovincialis, перфорированных молодью рапаны (Rapana venosa) при помощи радулы (A); радулы и растворением секретом, выделяемым вспомогательным органом перфорации (B–F); 1 – периостракум, 2 – призматический слой, 3 – перламутровый слой раковины мидий. Стрелкой указана группа кристаллов призматического слоя ростового края раковины.
ОБСУЖДЕНИЕ
По способу питания пелагические личинки рапаны относятся к фильтраторам. Основной пищей личинок являются одноклеточные микроводоросли (Чухчин, 1984). Известно, что при использовании в качестве корма микроводорослей видов I. galbana, Pl. subcordi formis, Ch. vulgaris (Wei et al., 1999) или микроводорослей Pseudoisochrysis sp., Chaetoceros sp., Tetraselmis sp. (Harding, 2006) (относящихся к трем классам золотистые, диатомовые и зеленые) продолжительность планктонных стадий развития рапаны составила, соответственно, 30−35 и 30–42 сут. В нашем эксперименте продолжительность выращивания личинок рапаны от момента выхода из яйцевых капсул до окончания метаморфоза составила 25 сут. При этом в состав корма личинкам на стадии среднего велигера (возраст 6 сут), кроме I. galbana и Em. huxleyi (золотистые), P. tricornutum (диатомовые), T. suecica и Ch. vulgaris f. suboblonga (зеленые), была добавлена микроводоросль R. salina (криптофитовые), отличающаяся высоким содержанием липидов – 41% (Холодов и др., 2017). В состав корма для личинок каждой стадии развития подбирали микроводоросли с разными размерами клеток: от 5−6 мкм – для личинок на стадии раннего велигера и 10−15 мкм – для педивелигеров. При использовании в качестве корма микроводорослей с указанными морфологическими и биохимическими характеристиками для личинок рапаны отмечены быстрые темпы роста и развития.
В природных условиях интенсивность роста рапаны в значительной степени зависит от обеспеченности пищей. При недостатке пищевых объектов наблюдается замедление роста (Чухчин, 1984). По литературным данным, в районе Анапской банки в местах с богатым крупноразмерным бентосом (мыс Большой Утриш, коса Тузла) крупноразмерные особи рапаны (более 50 мм) образуют достаточно изолированные группировки, а основное пространство Анапского мелководья занимает группировка мелкоразмерной рапаны (25−35 мм) (Переладов, 2013). Известно также, что “там, где основными объектами питания рапаны являются мелкие венериды и митилиды, сформировались популяции, состоящие из “карликовых” особей. Особенно мелкий средний размер половозрелых особей (43 мм), при незначительном диапазоне размерного ряда (30−55 мм), характерен для популяции бухты Ласпи, обитающей на песчаном грунте” (Бондарев, 2010). Однако в эксперименте корм подавался в избытке и не был лимитирующим фактором роста. Молодь рапаны были потомками одной самки и одного возраста. Развитие личинок и молоди рапаны проходило в идентичных условиях. При этом минимальные и максимальные размеры моллюсков различались в два-три раза (см. табл. 1). Доля медленнорастущих особей значительно превышала быстрорастущих (см. рис. 3). Вероятно, индивидуальная изменчивость темпов роста молоди рапаны – это генетически детерминированный признак. Быстрорастущие ювенильные особи рапаны быстрее развиваются и, таким образом, могут стать половозрелыми раньше, чем медленнорастущие. Для брюхоногого моллюска Crepidula fornicata (Linnaeus 1758) было показано, что разница между быстро- и медленнорастущими особями увеличивалась с увеличением индекса разнообразия производителей, что объясняется множественным типом скрещивания – полиандрией (Le Cam et al., 2009). Полиандрия – распространенное репродуктивное поведение, которое характерно и для рапаны R. venosa (Чухчин, 1961; Xue et al., 2016). Значительная доля карликовых особей в популяции рапаны бухты Ласпи (Бондарев, 2010), где была отобрана самка рапаны, предполагает высокую вероятность копуляции с карликовыми самцами и как следствие – высокая доля медленнорастущих потомков.
Таким образом, в экспериментальных условиях при сбалансированном корме из шести видов микроводорослей, оптимальной плотности посадки личинок, температуре воды 22.0–23.0°С и солености 18‰ продолжительность планктонных стадий составила 22 сут. Метаморфоз личинок завершился на 25-е сут с переходом на хищнический образ жизни. Установлены предельные размеры ювенильных особей рапаны – до 25 мм, способных перфорировать раковины двустворчатых моллюсков. Электронно-микроскопические исследования края отверстий в раковинах мидий свидетельствуют о применении молодью рапаны как механического, так и химического способов перфорации. Выявленная вариабельность темпов роста молоди рапаны может быть обусловлена полиандрией, обеспечивающей высокое генетическое разнообразие и объясняющей адаптивные возможности репродуктивной стратегии и эврибионтность вида R. venosa.
Список литературы
Богданов Н.И., 2007. Суспензия хлореллы в рационе сельскохозяйственных животных. Пенза. 2-е изд. 48 с.
Бондарев И.П., 2010. Морфогенез раковины и внутривидовая дифференциация рапаны Rapana venosa (Valenciennes, 1846) // Ruthenica: Русский малакологический журнал. Вып. 20. № 2. С. 69−90.
Драпкин Е.И., 1953. Новый моллюск в Черном море // Природа. № 9. С. 92−95.
Золотарёв П.Н., Евченко О.В., 2010. Некоторые черты биологии и оценка запаса рапаны Rapana venosa (Gastropoda: Muricidae) в северо-восточной части Черного моря в 1988–1994 гг. // Вопросы рыболовства. Т. 11. № 3 (43). С. 442−452.
Иванов А.И., 1961. Расширение ареала рапаны (Rapana bezoar) и проникновение ее в северо-западную часть Черного моря // ДАН. Вып. 141. № 4. С. 991− 993.
Переладов М.В., 2013. Современное состояние популяции и особенности биологии рапаны (Rapana venosa) в северо-восточной части Черного моря // Труды ВНИРО. Т. 150. С. 8−20.
Пиркова А.В., Ладыгина Л.В., Холодов В.И., 2016. Зависимость темпа роста личинок рапаны Rapana venosa (Valenciennes, 1846) от концентрации корма и плотности их посадки // Материалы Междунар. науч. конф. “Окружающая среда и человек. Современные проблемы генетики, селекции и биотехнологии”. Ростов-на-Дону. 5−8 сент., 2016. С. 440−442.
Пиркова А.В., Ладыгина Л.В., 2018. Эмбриональное и личиночное интракапсулярное развитие рапаны Rapana venosa (Valenciennes, 1846) (Gastropoda, Muricidae) // Российский журнал биологических инвазий. № 4. С. 53−64.
Саенко Е.М., Шаганов В.В., 2021. Пространственное распределение и биологические характеристики рапаны в прибрежной зоне юго-восточного побережья Крыма (Черное море) // Вопросы рыболовства. Т. 22. № 1. С.48−63.
Холодов В.И., Пиркова А.В., Ладыгина Л.В., 2017.Выращивание мидий и устриц в Черном море. 2-е издание, дополненное. Воронеж: ООО “Издат-Принт”. 508 с.
Чухчин В.Д., 1961. Размножение рапаны (Rapana bezoar L.) в Черном море // Труды Севастопольской биологической станции / Отв. ред. Водяницкий В.А. Севастополь. Т. XIV. С. 163−168.
Чухчин В.Д., 1970. Функциональная морфология рапаны. Киев: Наукова думка. 138 с.
Чухчин В.Д., 1972. Пелагические личинки брюхоногих моллюсков – Gastropoda // Определитель фауны Черного и Азовского морей / Отв. ред. Водяницкий В.А. Киев: Наукова думка. Т. 3. С. 167−176.
Чухчин В.Д., 1984. Экология брюхоногих моллюсков Черного моря. Киев: Наукова думка. 176 с.
Alyakrinskaya I.O., 2002. Morphofunctional Properties of Nutrition of Certain Predatory Gastropods // Biology Bulletin. V. 29. № 6. P. 589–600.
Ban Shaojun, Zhang Tao, Pan Hengqian, 2014. Effects of temperature and salinity on the development of embryos and larvae of the veined rapa whelk Rapana venosa (Valenciennes, 1846) // Chinese Journal of Oceanology and Limnology. V. 32. № 4. P. 773−782.
Carriker M.R., 1981. Shell penetration and feeding by naticacean and muricacean predatory gastropods: a synthesis // Malacologia. V. 20. № 2. P. 403−422.
Cesari P., Mizzan. L., 1993. Osservazioni su Rapana venosa (Valenciennes, 1846) in cattivita (Gastropoda: Muricidae, Thaidinae // Bollettino del Museo Civico di Storia Naturalea di Venezia. № 42. P. 9−21.
Chandler E.A., McDowell J.R., Graves J.E., 2008. Genetically monomorphic invasive populations of the rapa whelk, Rapana venosa // Molecular. Ecology. V. 17. № 18. P. 4079–4091.
Checa A.G, Pina C.M., Osuna-Mascaro A.J., Rodri’gues-Navarro A.B., Harper E.M., 2014. Crystalline organization of the fibrous prismatic calcitic layer of the Mediterranean mussel Mytilus galloprovincialis // European Journal of Mineralogy. V. 26. № 4. P. 495–505.
Chung E.Y., Kim S.Y., Kim Y.G., 1993. Reproductive ecology of the purple shell Rapana venosa (Gastropoda: Muricidae), with special reference to the reproductive cycle, depositions of eggs capsules and hatchings of larvae // Korean J. Malacology. № 9. P. 1–15.
Harding J.M., Mann R., 2003. Current status and potential establishment range for veined rapa whelk Rapana venosa on the US East coast // Aquatic Invaders: The Digest of National Aquatic Nuisance Species Clearinghouse. V. 14. P. 1–7.
Harding J.M., 2006. Growth and development of veined rapa whelk Rapana venosa veligers // J. of Shellfish Research. V. 25. № 3. P. 941−946.
Harding J.M., Gera S.M., Mann R., 2008. Radula morphology in veined rapa whelks, Rapana venosa (Valenciennes, 1846) (Gastropoda: Muricidae) from Chesapeake Bay, USA // The Nautilus. V. 122. № 4. P. 217–227.
Le Cam S., Pechenik J. A., Cagnon M., Viard F., 2009. Fast versus Slow Larval Growth in an Invasive Marine Mollusc: Does Paternity Matter? // J. of Heredity. V. 100. № 4. P. 455–464.
Mei-JieYanga, Hao Songa, Li-Na Suna, Zheng-LinYua, ZhiHua et al., 2019. Effect of temperature on the microflora community composition in the digestive tract of the veined rapa whelk (Rapana venosa) revealed by 16S rRNA gene sequencing // Comparative Biochemistry and Physiology. Part D 29. P. 145–153.
Mina Eisapour, Seed Jafar Seyfabadi, Behnam Daghooghi, 2015. Comparative Radular Morphology in Some Intertidal Gastropods along Hormozgan Province, Iran // J. Aquac. Res. Development. V. 6. № 4. P. 1−3.
Pan Y., Qiu T., Zhang T., Wang P., Ban S., 2013. Morphological studies on the early development of Rapana venosa // Journal of Fisheries of China. V. 37. № 10. P. 1503−1512 (abstract).
Sağlam H., Düzgüneş E., 2007. Deposition of egg capsule and larval development of Rapana venosa (Gastropoda: Muricidae) from the south-eastern Black Sea // J. Mar. Biol. Ass. U.K. V. 87. P. 953−957.
Wei L., Qiu S., Wang B., Sun X., Wang X., 1999. Studies on the reproductive biology of Rapana venosa // Fish. Sci. V. 23. P. 150–155.
Wei Y.J., Huang B., Ke C.H., Xu Y.B., Wang D.X., 2007. Activities of several digestive enzymes of Babylonia areolata Link (Gastropoda: buccinidae) during early development // J. Trop. Oceanogr. V. 26. № 1 (abstract).
Xue D.-X., Zhang T., Liu J.-X., 2016. Influences of population density on polyandry and patterns of sperm usage in the marine gastropod Rapana venosa // Scientific Reports. V. 6. Article number: 23461. https://doi.org/10.1038/srep23461
Yu Z.L., Wang H., Song H., Bai Y.C., Sun J.C. et al., 2018. Cannibalism by the juveniles of the gastropod Rapana venosa (Muricidae) reared under laboratory conditions // J. of Molluscan Studies. V. 84. № 3. P. 303−309.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал