Зоологический журнал, 2022, T. 101, № 4, стр. 363-377
Морфология личинок креветок рода Birulia (Decapoda, Thoridae) из восточной части Охотского моря
Н. А. Седова *
Камчатский государственный технический университет (КамчатГТУ)
683003 Петропавловск-Камчатский, Россия
* E-mail: sedova67@bk.ru
Поступила в редакцию 03.03.2021
После доработки 24.05.2021
Принята к публикации 07.06.2021
- EDN: DQPISE
- DOI: 10.31857/S0044513422040109
Аннотация
Описаны зоэа II и зоэа III двух видов рода Birulia (семейство Thoridae) – B. sachalinensis и B. kishinouyei – из восточной части Охотского моря. Их личиночное развитие оказалось сходным с таковым у двух видов рода Spirontocaris. Личинки Birulia, в отличие от личинок других родов семейства Thoridae, имеют морфологические особенности карапакса, плеона и отдельных конечностей: супраорбитальные и птеригостомиальные шипы отсутствуют, шип на скафоцерите у зоэа III отсутствует; базиподит и коксоподит максиллулы вооружены бóльшим количеством щетинок. Наблюдается гетерохрония в развитии конечностей. Вылупление и развитие личинок данного рода происходят в мае–июле на внутреннем шельфе.
В уловах ихтиопланктонных сетей в восточной части Охотского моря над глубинами 15–76 м в первой половине лета 2014–2016 гг. обнаружены необычные личинки двух видов креветок семейства Thoridae. Личинки представлены II и III стадиями зоэа. Один из этих видов имеет необычные выросты в передней части карапакса и очень длинные шипы на плеональных сомитах. За двадцатилетний период наших исследований планктона прикамчатских вод подобные личинки были обнаружены несколько раз только в водах Западной Камчатки.
Birulia – редкие сублиторальные креветки. Биология их практически не изучена. B. sachalinensis Brazhnikov 1903 обнаружена в заливах Терпения и Анива, вдоль восточного побережья Сахалина и в Тауйской губе на глубинах не более 50 м (Бражников, 1907; Кобякова, 1936, 1955; Марин, 2013; Бандурин, Карпинский, 2015). B. kishinouyei (Yokoya 1930) распространена от северной части Охотского моря до северо-восточной части о-ва Хонсю на глубинах от 30 до 60 м (Кобякова, 1979; Марин, 2013). Эти виды обитают также в Японском море на глубинах от 3 до 200 м (Komai, Komatsu, 2009).
Зоэа II и зоэа III, не имеющие плеонарных шипов, а также выростов на карапаксе, были нами отнесены к виду B. sachalinensis, поскольку известно, что у зрелых эмбрионов этого вида шипы на плеонарных сомитах не развиты (Макаров, 1968). Взрослые особи данного вида обнаружены как в северной, так и в южной частях Охотского моря (Кобякова, 1962; Komai, Komatsu, 2009; Бандурин, Карпинский, 2015). Поскольку в дальневосточных морях обитает всего 2 вида рода Birulia, вторую серию личинок можно отнести к B. kishinouyei. Последний вид широко распространен в Охотском море (Марин, 2013).
Цель работы – описать особенности морфологии личинок креветок рода Birulia, обитающих в восточной части Охотского моря, и охарактеризовать их отличия от других представителей семейства Thoridae.
МАТЕРИАЛ И МЕТОДИКА
Материалом для данной работы послужили сборы планктона над глубинами 5–560 м, выполненные сотрудниками КамчатНИРО в восточной части Охотского моря в июне–июле 2014, 2015, и 2016 гг. (табл. 1). Орудие лова – ихтиопланктонная коническая сеть с диаметром входного отверстия 80 см и шагом ячеи 0.56 мм. Выполняли вертикальный тотальный лов в слое 500–0 м и от дна до поверхности при меньших глубинах. Места поимки личинок показаны на рис. 1.
Таблица 1.
Использованный материал
| Вид | Стадия | Дата поимки | Глубина места, м | Количество, экз. |
|---|---|---|---|---|
| B. kishinouyei | II | 20.06.2014 | 37 | 1 |
| III | 20.06.2014 | 17–37 | 3 | |
| 25.06.2015 | 31 | 1 | ||
| 06.07.2015 | 18 | 1 | ||
| 18.06.2016 | 15 | 1 | ||
| B. sachalinensis | II | 09.06.2015 | 31 | 1 |
| III | 07.06.2015 | 76 | 1 | |
| 23.06.2015 | 25 | 1 |
Рис. 1.
Места поимок личинок Birulia kishinouyei и B. sachalinensis в восточной части Охотского моря: А – 2014 г., В – 2015 г., С – 2016 г.

Личинок, фиксированных в 4%-ном формалине, изучали под микроскопом при увеличении 32×, 56×, 120×. Изучали строение карапакса, плеона, тельсона и отдельных конечностей. На рисунках изображали только те щетинки и шипы, которые сохранились на имеющихся экземплярах. Часть длинных щетинок изображали обрезанными. Опушение щетинок в большинстве случаев на рисунке не показывали, чтобы не “загромождать” изображение. Общую длину личинки измеряли от конца рострума до заднего края тельсона с помощью окуляр-микрометра с точностью до 0.1 мм, длину карапакса – от основания рострума до заднего края карапакса.
Обозначения и сокращения: А1 – антеннула, А2 – антенна, Ср – карапакс, GV – общий вид личинки, АР – передняя часть, Мх1 – максиллула, Мх2 – максилла, Md – мандибулы, Мр1–3 – первая–третья пары максиллипед, Р1–Р5 – первая–третья пары переопод, pl – плеоподы, Т – тельсон, a.i. – appendix interna. Прочерк – отсутствие данных.
РЕЗУЛЬТАТЫ
II стадия зоэа
Единственная личинка поймана 20.06.2014 на глубине 37 м в северной части района исследования. Общая длина личинки 6.7 мм, длина карапакса 1.8 мм.
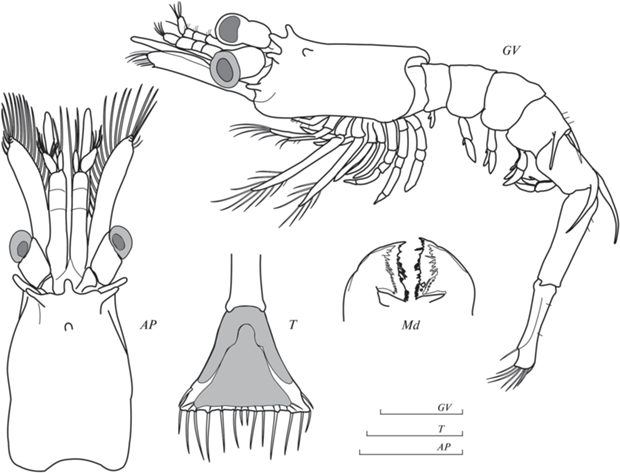
Рострум короткий, закруглен на конце. На переднем конце карапакса расположены 4 выроста, направленных в стороны (рис. 2GV, 2AP). Супраорбитальные шипы отсутствуют. Птеригостомиальный шип отсутствует, антеровентральный край карапакса гладкий. Глаза цилиндрические.
Дорсолатеральные шипы на 4 и 5 плеональных сомитах очень длинные (рис. 2GV). Шипы на 5-м сомите в 2 раза длиннее, чем на 4-м. Тельсон отделен от анального сомита, без выемки на терминальном крае. На тельсоне 8 пар щетинок разной длины. Анальный шип отсутствует (рис. 2T). Уроподы отсутствуют.
Рис. 2.
Морфология тельсона, мандибул и общего вида II зоэа Birulia kishinouyei: GV – общий вид личинки, АР – передняя часть, Т – тельсон, Md – мандибулы. Масштаб 1 мм.
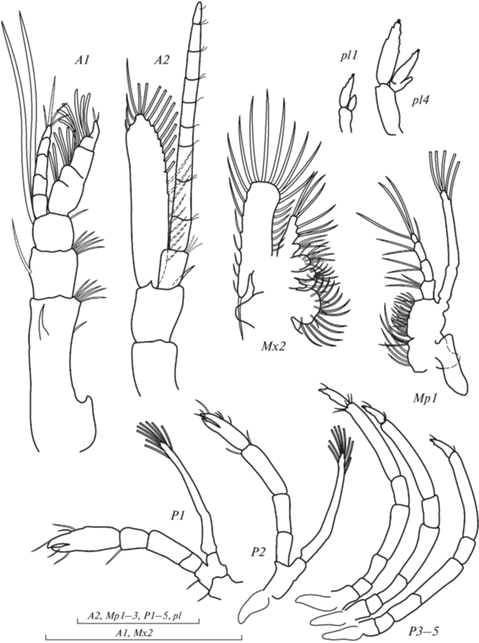
Основание антеннулы трехсегментное. Экзоподит 5-сегментный, вооружен 4 рядами сенсорных щетинок и 1 апикальной щетинкой. Эндоподит несегментированный, с длинной апикальной щетинкой (рис. 3A1). Основание антенны состоит из двух сегментов. Жгутик антенны ненамного длиннее скафоцерита, на конце 2 очень маленькие щетинки. Основание жгутика отделилось. На конце скафоцерита отделено 2 узких членика, на внутренне-терминальном крае 25 опушенных щетинок. На внешнем крае 3 короткие щетинки. Шип на скафоцерите отсутствует (рис. 3A2).
Через кутикулу мандибул просвечивает следующая стадия (рис. 2Md). Коксоподит максиллулы несет 11 щетинок, базиподит – на одной максиллуле 16 щетинок, вторая конечность повреждена; эндоподит с 5 щетинками и коротким шипиком в основании. Коксоподит и базиподит максиллы (Мх2) двулопастные, вооружены колючими щетинками (рис. 3Mx2). Эндоподит несет, соответственно, 4, 2, 1 + 2, 1 + 3 щетинки. Экзоподит максиллы вооружен 28 опушенными щетинками.
Эндоподит Мр1 4-члениковый, вооружен 4, 2, 3, 1 + 3 щетинками. Экзоподит нерасчлененный, несет 4 длинные терминальные и 1 субтерминальную щетинки с длинным опушением. Коксоподит с 4 парами щетинок. Базиподит с 16–17 колючими щетинками, расположенными в 4 ряда, и крупным эпиподитом (рис. 3Мр1). На экзоподите второй пары максиллипед 13–14 очень длинных щетинок. Эндоподит Мр1 5-члениковый, вооружен 1 + 3, 1 + 2, 1 + 1, 3, 1 + 5 щетинками. Коксоподит с 1 щетинкой, базиподит с 10 колючими щетинками, расположенными в 4 ряда, эпиподит отсутствует (рис. 3Мр2). На экзоподите третьей пары ногочелюстей (Мр3) 14 длинных щетинок (рис. 3 Мр1–3). На обеих Мр3 отсутствовал базиподит и эндоподит (явная аномалия).
Рис. 3.
Морфология конечностей II зоэа Birulia kishinouyei : А1 – антеннула, А2 – антенна, Мх2 – максилла, Мр1–3 – первая–третья пары максиллипед, Р1–Р5 – первая–третья пары переопод, pl1– первый плеопод, pl4 – четвертый плеопод. Масштаб 1 мм.

Первая и вторая пары переопод двуветвистые, без плавательных щетинок, с клешней. Третья–пятая пары переопод одноветвистые, членистые (рис. 3P1, 3Р2, 3Р3–5). Первая пара плеопод двуветвистая, намного меньше остальных плеопод, с неотделившимся протоподитом, вторая–пятая пары плеопод двухветвистые без щетинок, но с отделенным протоподитом и зачатком a.i. (рис. 3 pl1, 3pl4).
III стадия зоэа
6 экз. пойманы в северной части района в период с 18 июня по 6 июля над глубиной 15–37 м. Общая длина 7.5–8.0 мм. Карапакс 1.9–2.2 мм.
Морфология карапакса – как у предыдущей стадии. Дорсолатеральные шипы на 4 и 5 плеональных сомитах очень длинные (рис. 4GV). Шипы на 5-м сомите в 1.5 раза длиннее, чем на 4-м. Форма тельсона несколько различалась у отдельных экземпляров (рис. 4Т, 4Т *). Тельсон у большинства экземпляров слегка расширяется к дистальному концу, с небольшой выемкой на заднем крае. На тельсоне 6 пар терминальных щетинок, 1 пара угловых шипов и 1 пара латеральных шипов (рис. 4T). Шип на экзоподите уропод отсутствует. Эндоподит уропод относительно крупный, как это характерно для IV стадии зоэа большинства каридных креветок, с 24 терминальными щетинками. Длина уропод у отдельных особей несколько различается. Через кутикулу трех личинок этой стадии можно увидеть следующую стадию зоэа с более узким тельсоном, с таким же количеством терминальных щетинок и с парой латеральных шипов. Следовательно, данный вид проходит в своем личиночном развитии не менее четырех стадий зоэа.
Рис. 4.
Морфология тельсона и общего вида III зоэа Birulia kishinouyei: GV – общий вид личинки, Т и Т *– варианты морфологии тельсона. Масштаб 1 мм.

Основание антеннулы 3-сегментное, первый сегмент с длинным вентральным шипом. Экзоподит антеннулы состоит из 5 сегментов, эндоподит несегментированный. На конце эндоподита 1 длинная щетинка и 2–3 короткие (рис. 5A1). Конец скафоцерита несегментированный. На скафоцерите 26–30 щетинок. Шип на скафоцерите отсутствует. Шип в основании жгутика короткий. Жгутик антенны намного длиннее скафоцерита, с 2 короткими апикальными щетинками, конец закруглен (рис. 5A2).
Мандибулы имеют строение, характерное для зоэа семейства Thoridae (рис. 5Md). По количеству и форме зубцов III стадия почти не отличается от предыдущей стадии. Эндоподит максиллулы с 5 щетинками. Коксоподит максиллулы у большей части экземпляров с 13 щетинками на обеих конечностях (у одного экземпляра на одной коксе было 11 щетинок, на другой – 13). Базиподит Мх1 у половины пойманных экземпляров вооружен на одной конечности 17 щетинками, на другой конечности – 18 щетинками. У остальных личинок на одной максиллуле базиподит вооружен 18 щетинками, на другой максиллуле – 19. Экзоподит максиллы (скафогнатит) с 28–30 щетинками. Как правило, количество щетинок на левом и правом скафогнатите несколько различается. Эндоподит несет 4 + 1, 2, 3, 3 щетинки. Кокосоподит двулопастной, с 16–20 и 2 + 1 щетинками, соответственно. Каждая из двух лопастей базиподита вооружена 5 + 1 колючими щетинками (рис. 5Мх2).
Рис. 5.
Морфология конечностей III зоэа Birulia kishinouyei. Масштаб 1 мм. Обозначения как на рис. 2, 3.

Мр1 с крупным эпиподитом и 5 длинными щетинками на экзоподите. Коксоподит вооружен 7 щетинками, базиподит несет 2, 5, 5 + 1, 3 + 1 щетинок. Эндоподит 4-члениковый, несет 4, 2, 1 + 2, 1 + 3 щетинки, соответственно (рис. 5Мр1). Мр2 без эпиподита, с 13 длинными щетинками на экзоподите. Коксоподит вооружен 1 щетинкой, базиподит несет 1, 2, 3, 2 щетинок. Эндоподит 5-члениковый, несет 1 + 2, 1, 1, 1 + 5 щетинки, соответственно (рис 5Мр2). Мр3 без эпиподита, с 14 длинными щетинками на экзоподите. Базиподит несет 3 щетинки. Эндоподит 5-члениковый, несет 2, 1 + 1, 1 + 1, 2 + 2, 1 + 4 щетинки, соответственно (рис. 5 Мр3).
В основании всех переопод и максиллипед имеются жабры. Экзоподит первой пары переопод (Р1) с 8 щетинками, экзоподит Р2 с 6–8 плавательными щетинками. Клешня Р1 крупнее клешни Р2. Р3–Р5 членистые, одноветвистые, слегка раздвоенные на конце (рис. 5P1–Р5). Плеоподы крупные, хорошо развитые, двуветвистые у половины особей с короткими шипами на обеих ветвях (у остальных эти шипики отсутствовали), с хорошо заметным a.i. на второй-пятой парах. Первая пара плеопод меньше по размеру, без a.i. (рис. 5pl). Анальный шип имеется.
II стадия зоэа
Обнаружен всего один экземпляр на юго-западном шельфе Камчатки 09.06.2015 над глубиной 31 м. Общая длина 7.5 мм. Карапакс 2.2 мм.
Рострум отсутствует. Птеригостомиальный шип отсутствует. В передней части антеровентрального края карапакса имеется 1 небольшой зубчик. Супраорбитальные шипы отсутствуют (рис. 6GV). Тельсон своеобразной формы, почти без выемки, с 7 парами терминальных щетинок и парой субтерминальных щетинок, отделен от анального сомита. Через покровы просвечивает следующая стадия зоэа с 7 парами терминальных щетинок и короткими латеральными шипами. Уроподы отсутствуют (рис. 6T).
Рис. 6.
Морфология общего вида и тельсoна II зоэа B. sachalinensis. Масштаб 1 мм. Обозначения как на рис. 2, 3.

Основание антеннулы трехсегментное. Экзоподит и эндоподит А1 5-члениковые, на конце эндоподита 2 короткие и 1 длинная щетинки (рис. 7A1). Основание антенны состоит из двух сегментов. Жгутик антенны 9-члениковый, почти в 2 раза длиннее скафоцерита, основание жгутика отделилось. Конец жгутика закруглен, с 2 маленькими апикальными щетинками. На скафоцерите 23–25 щетинок. Шип на скафоцерите отсутствует, на конце пластины отделено 3 членика (рис. 7A2).
Строение мандибул как у предыдущего вида. Коксоподит максиллулы с 11 щетинками, на одном базиподите 16 щетинок, на другом – 17. Эндоподит Мх1 с 5 щетинками и коротким шипиком. Кокосоподит максиллы двулопастный, вооружен 16–17 и 2 колючими щетинками, соответственно. Базиподит двулопастной, с 9 колючими щетинками на каждой лопасти. Эндоподит несет, соответственно, 4, 2, 1 + 2, 1 + 3 щетинки. На скафогнатите одной максиллы 25 опушенных щетинок, на другой – 28 (рис. 7Мх2)
Рис. 7.
Морфология конечностей II зоэа B. sachalinensis. Масштаб 1 мм. Обозначения как на рис. 2, 3.

Экзоподит первой пары ногочелюстей нерасчлененный, несет 4 длинные терминальные и 1 субтерминальную щетинку. Эндоподит Мр1 4-члениковый, вооружен 3, 2, 2, 1+3 щетинками. Коксоподит с крупным эпиподитом и 7 щетинками. Базиподит с 18–19 колючими щетинками (рис. 7Мр1). На экзоподите Мр2 8–10 щетинок, эпиподит отсутствует. Эндоподит 5-члениковый, вооружен 1 + 3, 1, 1, 12, 1 + 3 щетинками. Коксоподит с 1 щетинкой, базиподит с 8 колючими щетинками (рис. 7Мр2). Мр3 без эпиподита, с 13 длинными опушенными щетинками на экзоподите одной конечности и с 12 плавательными щетинками на экзоподите другой конечности (рис. 7Мр3). Коксоподит с 1 щетинкой, базиподит с 3 колючими щетинками. Эндоподит 5-члениковый, вооружен 2, 1, 0, 2 + 1, 1 + ? щетинками. Апикальные щетинки на эндоподите обломаны.
Переоподы членистые, хорошо развиты. Р1 и Р2 с клешней, двуветвистые, без плавательных щетинок на экзоподитах. Р1–Р3 одноветвистые (рис. 7P1–Р5). В основании переоподов и максиллипед имеются жабры. Плеональные сомиты гладкие, без шипов и выростов. Анальный шип маленький. Плеоподы двуветвистые с отделившимся протоподитом. Первая пара плеопод без a.i. На второй–четвертой парах эта структура имеется в виде зачатка (рис. 7pl1, 7pl4).
III стадия зоэа
Один экземпляр пойман в южной части шельфа западной Камчатки 7.06.2015 над глубиной 76 м, второй – в центральной части района 23.06.2015 над глубиной 25 м. Общая длина 7.1–8.5 мм. Карапакс 2.1–2.4 мм.
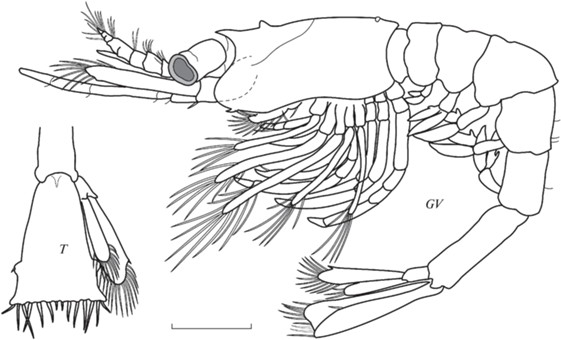
Рострум отсутствует. Птеригостомиальный шип отсутствует. В передней части антеровентрального края карапакса у первого экземпляра обнаружен 1 зубчик, у второго экземпляра край карапакса гладкий. Супраорбитальные шипы отсутствуют (рис. 8GV). Тельсон своеобразной формы, почти без выемки, с 7 парами терминальных щетинок и парой очень коротких тонких латеральных шипов. Экзоподит уроподов без шипа. Эндоподит уроподов намного короче экзоподита, с большим количеством терминальных щетинок (рис. 8Т).
Рис. 8.
Морфология общего вида и тельсона III зоэа B. sachalinensis. Масштаб 1 мм. Обозначения как на рис. 2, 3.
Экзоподит и эндоподит антеннулы состоят из 5 сегментов. На конце эндоподита 1 длинная щетинка и 3 короткие (рис. 9 A1). На скафоцерите 24–26 щетинок, шип отсутствует. Шип в основании жгутика тонкий. Жгутик антенны намного длиннее скафоцерита, с 1 короткой субтерминальной щетинкой, конец закруглен. Основание жгутика с 3–4 короткими терминальными щетинками (рис. 9A2).
Рис. 9.
Морфология конечностей III зоэа B. sachalinensis. Масштаб 1 мм. Обозначения как на рис. 2, 3.
Мандибулы как у предыдущего вида. Коксоподит максиллулы с 11 щетинками на обеих конечностях. Базиподит максиллулы у первого экземпляра вооружен на одной конечности 17 щетинками, а на другой конечности – с 18. У второго экземпляра на одной максиллуле базиподит вооружен 18 щетинками, другой максиллуле – 19. Коксальный сегмент Мх2 двулопастной, с 12 + 5 и 2 щетинками соответственно. Базиподит двулопастной, с 7 щетинками на каждой лопасти. Эндоподит с 3, 2, 1, 3 щетинками. Экзоподит максиллы (скафогнатит) с 24–26 щетинками (рис. 9Мх2).
Мр1 с очень крупным эпиподитом, 4 терминальными и 1 субтерминальной щетинками на экзоподите. Коксоподит вооружен 7 колючими щетинками, базиподит несет 19–20 щетинок. Эндоподит 4-члениковый, несет 3, 2, 2, 1 + 3 щетинки, соответственно (рис 9Мр1). Мр2 с маленьким эпиподитом в виде бугорка, с 12 длинными опушенными щетинками на экзоподите. Коксоподит Мр2 вооружен 1 щетинкой, базиподит несет 9–10 щетинок, эндоподит 5‑члениковый, несет 2, 1, 1, 1 + 5 щетинки соответственно. Мр3 без эпиподита, с 13–14 щетинками на экзоподите. Базиподит несет 3 щетинки. Эндоподит 5-члениковый, вооружен 2, 1, 1 + 1, 2 + 1, 1 + 4 щетинками, соответственно.
Переоподы членистые, хорошо развиты. Р1 и Р2 с клешней, двуветвистые с 8 плавательными щетинками на экзоподитах. В основании всех переопод и максиллипед имеются жабры. Клешня Р1 намного крупнее клешни Р2. Р3–Р5 членистые, одноветвистые, слегка раздвоенные на конце (рис. 9P1–9Р5).
Плеональные сомиты гладкие, без шипов и выростов. Анальный шип крупный. Плеоподы двуветвистые с отделившимся основанием и парой коротких апикальных шипов на каждой ветви. Первая пара плеопод без a.i. На второй–четвертой парах эта структура развита хорошо (рис. 9pl1, 9pl4).
ОБСУЖДЕНИЕ
В российских дальневосточных морях обитают представители 6 родов креветок семейства Thoridae: Birulia, Eualus, Heptacarpus, Lebbeus, Latreutes, Spirontocaris (Виноградов, 1947, 1950; Макаров, 1966; Марин, 2013). Описания личинок большинства тихоокеанских видов рода Eualus были сделаны хотя бы для младших зоэа (Williamson, 1957; Pike, Williamson, 1964; Иванов, 1971; Haynes, 1978, 1981; Squires, 1993; Yang et al., 2001; Yang, Kim, 2006). Имеются описания 6 видов личинок рода Heptacarpus (Needler, 1934; Yamashita, Hayashi, 1979, 1980, 1980а, 1984; Haynes, 1981; Yang, Kim, 2005). Из рода Lebbeus описаны личинки четырех видов (Иванов, 1971; Haynes, 1978, 1985; Squires, 1993; Yang, Okuno, 2004). Зоэа многих представителей рода Spirontocaris из дальневосточных морей хотя бы частично описаны (Stephensen, 1916; Pike, Williamson, 1961; Иванов, 1971; Hayashi, 1977; Haynes, 1981, 1984; Squires, 1993; Perkis, 1994; Седова, 2020). Существуют также описания зоэа трех видов рода Latreutes (Kim, Hong, 1999; Yang, Park, 2004; Yang, 2005, 2007). Род Birulia – единственный в этом списке, чьи личинки не описаны, поэтому обнаруженные зоэа были отнесены нами к данному роду.
При определении личиночной стадии исходили из того, что у I стадии зоэа антеннулы даже при значительном укорочении развития, как у Lebbeus и Argis, должны иметь несегментированное основание, а количество терминальных щетинок на тельсоне, как правило, меньше по сравнению с последующими стадиями, на одну пару. II стадия зоэа не должна иметь свободных уроподов, основание антеннулы двух-, трехсегментное, на тельсоне 8–9 пар терминальных щетинок. На III стадии зоэа при незначительном укорочении развития появляются уроподы, эндоподит которых короче экзоподита (Седова, 2019). На последующих стадиях появляются латеральные шипы на тельсоне, ширина тельсона постепенно уменьшается, уроподы удлиняются, а строение антеннул, переоподов и плеоподов усложняется. Количество сегментов экзоподита и эндоподита антеннулы обычно у каждой следующей стадии увеличивается на один. Количество щетинок на скафогнатите и базиподите максиллулы увеличивается. Плеоподы развиваются так же постепенно.
У описанных ранее видов с сильно укороченным развитием I стадия зоэа имеет несегментированное основание. Например, у зоэа I Lebbeus armatus (Owen 1839) и L. polaris (Sabine 1821) – основание А1 несегментированное (Иванов, 1971; Squires, 1993). Не имеет сегментации основание и у младших личинок родов Argis, Sclerocrangon, Notocrangon (Иванов, 1971; Макаров, 1973; Squires, 1993; Sedova, Grigorev, 2018). Исключение – виды, не имеющие пелагических планктотрофных личинок. Пример – Sclerocrangon rex Komai et Matsuzaki 2016, личинки которого остаются на плеоподах, где они заканчивают свой метаморфоз (Hibino et al., 2020). Эти личинки, по мнению данных авторов, лецитрофные. Уроподы у таких личинок развиваются не ранее чем на III стадии или отсутствуют на всех стадиях зоэа. Плеоподы развиты уже у зоэа I. Переоподы у этих видов членистые, имеют сформированные клешни, а во многих случаях – и плавательные щетинки на экзоподитах. Основание антеннулы у зоэа II трехсегментное.
В Охотском море 19 июня 1963 г. в центральной части западно-камчатского шельфа на станции с глубиной 20 м Макаровым (1968) была поймана личинка, морфология которой соответствует нашей B. kishinouyei II стадии. Макаров обозначил ее Hippolytidae № 1. Единственное отличие от нашего экземпляра – короткие щетинки на экзоподитах Р1 и Р2. Поскольку у данной личинки отсутствовали уроподы при хорошо развитых антеннулах, переоподах и плеоподах (явная гетерохрония развития конечностей), Макаров предположил, что этот вид имеет сильно укороченное развитие. Эмбрионы, вынутые из яиц самки B. sachalinensis из коллекции Института океанологии АН СССР, оказались совершенно лишенными выростов на карапаксе и плеоне (Макаров, 1968). Макаров отмечает, что у этих эмбрионов развитие конечностей соответствовало типу личинок без укорочения развития, и поэтому данная личинка не может принадлежать к виду B. sachalinensis.
Младшие зоэа Birulia, пойманные в восточной части Охотского моря, по нашему мнению, не могут быть отнесены к I стадии, как это предполагал Макаров (1968). У этих личинок основание антеннулы трехсегментное, а экзоподиты переоподов несут длинные щетинки. Оба обстоятельства не характерны для самых младших личинок каридных креветок даже с укороченным развитием.
Личиночное развитие креветок рода Birulia оказалось близким к двум видам рода Spirontocaris – S. phippsi и неидентифицированному виду из этого же рода (предположительно, S. gurjanovae Kobjakova 1955). По степени развития конечностей на соответствующих стадиях эти виды оказались похожими (табл. 2). Отличие S. phippsi и неидентифицированного вида Spirontocaris от большинства личинок каридных креветок – строение эндоподита уроподов на III стадии. В отличие от других видов, эндоподит у этих двух видов несет не 2, а 13–20 щетинок. У этих личинок имеется уже на II стадии зоэа крупная вполне сформированная клешня, двухветвистые плеоподы и 5-сегментный экзоподит А1. Эти признаки характерны и для зоэа Birulia. На II cтадии зоэа S. phippsi, B. sachalinensis и B. kishinouyei имеют 4-сегментные экзоподиты антеннул, хорошо развитые плеоподы, 3-сегментное основание А1 и развитые щетинки на экзоподитах переоподов. Самые младшие личинки вышеперечисленных видов имеют большое количество щетинок на скафогнатите и на коксоподите максиллулы. Эти признаки отличают описанных личинок от большинства представителей креветок семейства Thoridae.
Таблица 2.
Сравнение морфологии B. sachalinensis, B. kishinouyei, S. phippsi и Spirontocaris sp.
| Признак | Стадия | B. sachalinensis | B. kishinouyei | S. phippsi | Spirontocaris sp. |
|---|---|---|---|---|---|
| Длина, мм | II | 7.5 | 6.7 | 8.0–8.7 | 8.5 |
| III | 7.1–8.5 | 7.5–8.0 | 9.5 | – | |
| Рострум | II | Отсутствует | Короткий, тупой | До края глаз, острый | Длинный, острый |
| III | Отсутствует | Короткий, тупой | Короче глаз | – | |
| Количество зубчиков на карапаксе | II | 1 | Отсутствуют | Отсутствуют | 4 |
| III | 1–0 | Отсутствуют | Отсутствуют | – | |
| Количество щетинок на базиподите Мх1 | II | 16(17) | 16 | 18–20 | 20–21 |
| III | 17(18)–18(19) | 17(18)–18(19) | 24 | – | |
| Супраорбитальные шипы | II | Отсутствуют | Отсутствуют | Имеются | Имеются |
| III | Отсутствуют | Отсутствуют | Имеются | – | |
| Птеригостомиальный шип | II | Отсутствуют | Отсутствуют | Имеется | Имеется |
| III | Отсутствуют | Отсутствуют | Имеется | – | |
| Количество щетинок на коксе Мх1 | II | 11 | 11 | 10–11 | 13 |
| III | 11 | 13 | 13 | – | |
| Количество щетинок на скафогнатите | II | 25(28) | 28 | 31–32 | 28–30 |
| III | 24–26 | 28–30 | 31 | – | |
| Плеональные шипы | II | Отсутствуют | 4 и 5 сегмент | 4 и 5 сегмент | 4 и 5 сегмент |
| III | Отсутствуют | 4 и 5 сегмент | 4 и 5 сегмент | 4 и 5 сегмент | |
| Количество апикальных щетинок на эндоподите А1 | II | 3 | 1 | 1 | 2 |
| III | 2–3 | 2–3 | 1 | – | |
| Конец скафоцерита | II | 3 членика | 2 членика | 1–2 членика | 2 членика |
| III | Нерасчлененный | Нерасчлененный | 1 членик | – | |
| Шип скафоцерита | II | Отсутствует | Отсутствует | Длинный | Длинный |
| III | Отсутствует | Отсутствует | Длинный | – |
У некоторых экземпляров зоэа III, отнесенных нами к B. kishinouyei, через покровы тельсона и других конечностей просвечивает следующая стадия, которая по всем признакам не может быть декаподитной. Следовательно, данный вид имеет не менее четырех стадий зоэа. S. phippsi в прикамчатских водах, как и в атлантических, имеет 4 стадии зоэа (Squires, 1993; Седова, 2020). Можно говорить о средней степени укорочения личиночного развития у этих видов. У некоторых видов с укорочением развития до трех стадий зоэа уроподы появляются не ранее III стадии, как у Notocrangon antarcticus (Pfeffer 1887) (Макаров, 1973). У других видов, как у L. polaris, уроподы отсутствуют на всех личиночных стадиях (Squires, 1993). У представителей рода Argis, имеющих факультативную третью стадию зоэа, уроподы тоже отсутствуют (Sedova, Grigorev, 2018). Тем не менее у всех вышеперечисленных видов имеется гетерохрония в развитии конечностей на первых стадиях, характерная для видов с укороченным развитием.
Вылупление личинок креветок рода Birulia происходит, вероятно, в районе внутреннего шельфа в местах с глубиной моря не более 100 м. Личинки B. sachalinensis, по нашим расчетам, начинают выходить в планктон южной части района исследования в начале мая, а в северной части – в конце мая. Продолжительность развития удалось определить предположительно – около двух месяцев. Оседать на грунт на малых глубинах, по нашим расчетам, эти креветки начинают в начале июля. В эти же сроки в данном районе развиваются личинки Eualus belcheri (Bell 1855) и Mesocrangon intermedia (Stimpson 1860) (Седова, 2019).
ЗАКЛЮЧЕНИЕ
Сопоставление степени дифференциации конечностей личинок и зоэа близких видов, описанных в данной работе, показало, что они соответствуют II и III стадиям. Пойманные в восточной части Охотского моря зоэа II и III отличались от личинок других родов семейства Thoridae морфологией карапакса, плеона и отдельных конечностей. Две серии пойманных личинок объединяет ряд признаков: отсутствие супраорбитальных шипов, отсутствие птеригостомиального шипа, базиподит максиллулы у зоэа II вооружен 16 (17) щетинками, у зоэа III – 17–18 (18–19) щетинками, коксоподит максиллулы вооружен 11 щетинками у зоэа II, наличие двух апикальных щетиночек и закругленного на конце жгутика антенны, отсутствие шипа на скафоцерите у старших личинок, практически прямой задний край тельсона, гетерохрония в развитии конечностей.
От представителей рода Eualus личинки Birulia отличаются наличием экзоподитов только на первых двух парах переоподов (у личинок Eualus они развиты на трех или четырех парах, но никогда – на двух), а также отсутствием шипа на скафоцерите у зоэа III.
От зоэа Heptacarpus наши личинки отличаются более ранним развитием плеоподов и переоподов. Экзоподиты переоподов у личинок Heptacarpus, в отличие от имеющихся у нас личинок, появляются сначала на первой паре, а у старших зоэа имеются уже на четырех парах переоподов. Жгутики у Heptacarpus намного короче скафоцерита до V–VI стадии зоэа, клешня формируется не ранее V стадии. У личинок Birulia клешня хорошо развита уже у младших личинок, а количество переоподов с экзоподитами остается неизменным.
К роду Lebbeus данных личинок не представляется возможным отнести из-за имеющихся на переоподах экзоподитов, которые отсутствуют у представителей рода Lebbeus, а также из-за отсутствия шипа на скафоцерите, развитого у всех видов Lebbeus.
По большинству наиболее важных признаков эти зоэа оказались близкими к представителям рода Spirontocaris. Главное отличие от личинок рода Spirontocaris – отсутствие супраорбитальных шипов и шипа на скафоцерите. Большинство других признаков сближает представленных личинок с зоэа рода Spirontocaris.
Род Lathreutes в прикамчатских видах не обитает. Кроме того, у личинок этого рода плеоподы появляются на поздних стадиях, а шип скафоцерита имеется уже на III стадии. Экзоподиты на переоподах у видов Lathreutes развиваются постепенно, на более поздних стадиях.
Расчеты показывают, что массовое вылупление B. kishinouyei происходит в первой половине июня и завершается через 50 дней в умеренные по тепловому балансу годы и через 40 дней – в теплые годы. Самые первые (ранние) личинки этого вида в планктоне, предположительно, появляются в середине мая. Их развитие происходит в течение 60–65 дней в умеренные годы и в течение 50–55 дней – в теплые годы. Оседание на грунт молоди B. kishinouyei должно происходить во второй половине июля.
Список литературы
Бандурин К.В., Карпинский М.Г., 2015. Креветки северной части Охотского моря. М.: Изд-во ВНИРО. 214 с.
Бражников В.К., 1907. Материалы по фауне русских восточных морей, собранные шхуною “Сторож” в 1899–1902 гг. (Доложено в заседании Физ.-мат. отд-ния 15 дек. 1904 г.). Санкт-Петербург: тип. Имп. Акад. Наук. 185 с.
Виноградов Л.Г., 1947. Десятиногие ракообразные Охотского моря // Известия ТИНРО. Т. 25. С. 67–124.
Виноградов Л.Г., 1950. Определитель креветок, раков и крабов Дальнего востока // Известия ТИНРО. Т. 33. С. 179–358.
Иванов Б.Г., 1971. Личинки некоторых дальневосточных креветок в связи с их систематическим положением // Зоологический журнал. Т. L. Вып. 5. С. 657–665.
Кобякова З.И., 1936. Зоогеографический обзор фауны Decapoda Охотского и Японского моря // Труды Ленинградского общества естествоиспытателей. Т. 65. Вып. 2. С. 185–228.
Кобякова З.И., 1955. Новые виды десятиногих раков из южной части Курило-Сахалинского региона // Труды Зоологического института Академии наук СССР. Т. 18. С. 235–242.
Кобякова З.И., 1962. Новые или редкие виды десятиногих раков (Decapoda, Malacostraca) из района Курильских островов // Исследования дальневосточных морей СССР. № 8. С. 243–247.
Кобякова З.И., 1979. Особенности распределения десятиногих раков (Decapoda, Crustacea) на шельфе Курильских островов // Биология шельфа Курильских островов. М.: Наука. С. 95–111.
Макаров Р.Р., 1966. Личинки креветок, раков-отшельников и крабов западнокамчатского шельфа и их распределение. М.: Наука. 164 с.
Макаров Р.Р., 1968. Об укорочении личиночного развития у десятиногих ракообразных (Crustacea, Decapoda) // Зоологический журнал. Т. 47. Вып. 3. С. 348–359.
Макаров Р.Р., 1973. Личиночное развитие антарктической креветки Notocrangon antarcticus (Decapoda, Crangonidae) // Зоологический журнал. Т. LII. Вып. 8. С. 1149–1155.
Марин И.Н., 2013. Малый атлас десятиногих ракообразных России. М.: Товарищество научных изданий КМК. 145 с.
Седова Н.А., 2019. Морфология и экология личинок каридных креветок морских вод Камчатки и Чукотки. Петропавловск-Камчатский: КамчатГТУ. 180 с. ISBN 978-5-328-00391-9
Седова Н.А., 2020. Особенности личиночного развития креветок рода Spirontocaris (Decapoda, Thoridae) из северо-западной части Тихого океана // Вестник Камчатского государственного технического университета [Bulletin of Kamchatka State Technical University]. Вып. 51. С. 73–82.
Hayashi K.-I., 1977. Studies on the hippolytid shrimps from Japan – VI. The genus Spirontocaris Bate // The Journal of the Shimonoseki. University of Fisheries. V. 25 (3). P. 155–136.
Haynes E.B., 1978. Description of larvae of a hippolytid shrimp, Lebbeus groenlandicus, reared in situ in Kachemak Bay, Alaska // Fishery Bulletin. V. 76 (2). P. 457–465.
Haynes E.B., 1981. Early zoeal stages of Lebbeus polaris, Eualus suckleyi, E. fabricii, Spirontocaris arcuata, S. ochotensis, and Heptacarpus camtschaticus (Crustacea, Decapoda, Caridea, Hippolytidae) and morphological characterization of zoeae of Spirontocaris and related genera // Fishery Bulletin. V. 79 (3). P. 421–440.
Haynes E.B., 1984. Description of early stage zoeae of Spirontocaris murdochi (Decapoda, Hippolytidae) reared in the laboratory // Fishery Bulletin. V. 82 (3). P. 523–528.
Haynes E.B., 1985. Morphological development, identification, and biology of larvae of Pandalidae, Hippolytidae, and Crangonidae (Crustacea, Decapoda) of the northern north Pacific Ocean // Fishery Bulletin. V. 83. P. 501–521.
Hibino M., Matsuzaki K., Konishi K., 2020. First stage larva of the deep-sea giant shrimp Sclerocrangon rex (Decapoda, Caridea, Crangonidae) under laboratory conditions // Crustacean Research. V. 49. P. 9–14. https://doi.org/10.18353/crustacea.49.0_9
Kim J.N., Hong S.Y., 1999. Larval Development of Latreutes laminirostris (Decapoda: Hippolytidae) reared in the laboratory // Journal of Crustacean Biology. V. 19 (4). P. 762–781.
Komai T., Komatsu H., 2009. Deep-sea Shrimps and Lobsters (Crustacea: Decapoda) from Northern Japan, Collected during the Project “Research on Deep-sea Fauna and Pollutants off Pacific Coast of Northern Japan” // Fujita T. (Ed.) Deep-sea Fauna and Pollutants off Pacific Coast of Northern Japan. National Museum of Nature and Science Monographs. V. 39. P. 495–580.
Needler A.B., 1934. Larvae of some British Columbia Hippolytidae // Contributions to Canadian Biology. V. 8. P. 237–242.
Perkis H.C., 1994. Larvae of Caridean Shrimp (Crustacea, Decapoda) from Sheepscot Bay, Main // Main Naturalist. V. 2. № 2. P. 81–90.
Pike R.B., Williamson D.I., 1961. The larvae of Spirontocaris and related genera (Decapoda, Hippolytidae) // Crustaceana. V. 2. P. 187–207.
Pike R.B., Williamson D.I., 1964. The larvae of some species of Pandalidae (Decapoda) // Crustaceana. № 6. P. 265– 284.
Sedova N.A., Grigoryev S.S., 2018. Morphological features of larvae of the genus Argis Kroyer 1842 (Decapoda, Crangonidae) from coastal Kamchatka and adjacent waters // Zoosystematica Rossica. V. 27 (1). P. 11–33.
Squires H.J., 1993. Decapod Crustacean Larvae from Ungava Bay // Journal of Northwest Atlantic Fishery Sciens. V. 15. 168 p.
Stephensen K., 1916. Zoogeographical investigations of certain fjords in Southern Greenland, vith special reference to Crustacea, Pycnogonida, and Echinodermata // Medd. om Grønland. V. LIII. P. 232–238.
Williamson D.I., 1957. Crustacea: Decapoda: Larvae V. Caridea Family Hippolytidae // The sea: International Council for the Exploration of Fiches D’Identification du Zooplankton. Cons. Perm. Int. Explor. Mer. Fiche V. 68. P. 1–5.
Yamashita K., Hayashi K., 1979. Larvae of Decapoda, Macrura in the vicinity of Miyazima aquarium, Miyazima, the Seto Inland Sea I. Heptacarpus rectirostris (Stimpson) (Caridea, Hippolytidae) // Proceedings of Japanese Society of Systematic Zoology. V. 17. P. 45–51. [In Japanese]
Yamashita K., Hayashi K., 1980. Larvae of Decapoda, Macrura in the vicinity of Miyazima aquarium, Miyazima, the Seto Inland Sea II. Heptacarpus pandaloides (Stimpson) and H. geniculatus (Stimpson) (Caridea, Hippolytidae) // Proceedings of Japanese Society of Systematic Zoology. V. 19. P. 16–23. [In Japanese]
Yamashita K., Hayashi K., 1980a. Larvae of Decapoda, Macrura in the vicinity of Miyazima aquarium, Miyazima, the Seto Inland Sea II. Heptacarpus pandaloides (Stimpson) and H. geniculatus (Stimpson) (Caridea, Hippolytidae) // Proceedings of Japanese Society of Systematic Zoology. V. 19. P. 16–23. [In Japanese]
Yamashita K., Hayashi K., 1984. Larvae of Decapoda, Macrura in the vicinity of Miyazima aquarium, Miyazima, the Seto Inland Sea III. Eualus leptognathus (Stimpson) (Caridea, Hippolytidae) // Proceedings of Japanese Society of Systematic Zoology. V. 28. P. 19–28. [In Japanese]
Yang H.J., 2005. Larval development of Latreutes anoplonix reared in the laboratory // Journal of Crustacean Biology. V. 25 (3). P. 462–479.
Yang H.J., 2007. Larval development of Latreutes acicularis Ortmann (Crustacea:Decapoda: Hippolytidae) reared in the laboratory // Integrative Biosciences. V. 11. P. 79–92.
Yang H.J., Kim C.H., 2005. Zoeal stages of Hectacarpus futilirostris (Decapoda, Crustacea. Hippolytidae) reared in the laboratory // Crustaceana. V. 78 (5). P. 543–564.
Yang H.-J., Kim W., 2006. First Zoeas of Eualus leptognathus (Decapoda: Caridea: Hippolytidae) Hatched in the Laboratory // The Korean Society of Systematic Zoology. V. 22. Issue 2. P. 117–120.
Yang H.J., Ko H.S., Kim C.H., 2001. The first zoeal stage of Eualus sinensis (Yu, 1931) (Decapoda, Caridea, Hippolytidae), with a key to the known hippolytid first zoeae of Korea and adjacent waters // Crustaceana. V. 74 (1). P. 1–9.
Yang H.J., Okuno J., 2004. First larvae of Lebbeus comanthi and Thor amboinensis (Decapoda: Hippolytidae) hatched in the laboratory // Korean Journal of Biological Sciences. V. 8. № 1. P. 19–25. https://doi.org/10.1080/12265071.2004.9647729
Yang H.J., Park J.B., 2004. Redescription of the first zoea of Latreutes laminirostris (Decapoda: Caridea: Hippolytidae) // J. Natu Sci, Silla Univ. V. 13. P. 43–47.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


