Зоологический журнал, 2022, T. 101, № 9, стр. 963-974
Особенности тканевой организации женской половой системы скребня Acanthocephalus tenuirostris (Palaeacanthocephala, Echinorhynchida)
Т. В. Давыденко a, *, В. П. Никишин a, **
a Институт биологических проблем Севера ДВО РАН
685000 Магадан, ул. Портовая, 18, Россия
* E-mail: sesha17@mail.ru
** E-mail: nikishin@ibpn.ru
Поступила в редакцию 29.07.2021
После доработки 22.08.2021
Принята к публикации 06.09.2021
- EDN: RAQREW
- DOI: 10.31857/S0044513422070030
Аннотация
Изучена гистологическая и ультратонкая организация элементов женской половой системы скребня Acanthocephalus tenuirostris (Achmerov et Dombrowskaja-Achmerova 1941). Показано, что фрагментированный яичник (яйцевые шары) состоит из соматического (синцитиального) и герминативного (симпластического или синцитиального) компонентов. От герминативного синцития обособляются ооциты, оставаясь в окружении соматического синцития, оплодотворяются и окружаются оболочкой оплодотворения. Затем большинство зигот перемещается в “полость” тела и продолжает развитие в свободном состоянии; однако некоторые из них какое-то время могут развиваться в составе яйцевого шара и даже могут формировать на поверхности оболочки оплодотворения наружную эмбриональную оболочку (Е1). Установлено, что стенки маточного колокола, яйцеводов и матки образованы уникальной двуслойной тканью, наружный слой которой представлен миофиламентами, а внутренний слой – цитоплазмой с преобладанием в ней митохондрий; для этой ткани характерно формирование межклеточного материала. Ядра этой ткани имеют признаки ядерной секреции по аналогии с ядрами некоторых мышечных клеток скребней. Обнаружено, что стенка матки не является сплошной и представлена несколькими крупными блоками подобной ткани, разделенными узкими пространствами с межклеточным материалом. Такое строение не соответствует имеющемуся мнению о симпластической организации матки.
Согласно сложившимся к настоящему времени представлениям зачаток яичника (или, в англоязычной литературе, рудимент яичника) скребней в процессе онтогенеза разделяется на отдельные фрагменты, яйцевые шары, которые свободно располагаются в лигаментном мешке или в “полости” тела (псевдоцеломе) (Nicholas, 1967; Parshad, Crompton, 1981; и др.). У многих видов, например у Moniliformis moniliformis, эта фрагментация происходит еще в период развития скребня в промежуточном хозяине, и уже на стадии цистаканта яйцевые шары определяются отчетливо (Asaolu et al., 1981; и др.). По другим данным, рудимент яичника, содержащий зачаточные яйцевые шары, наблюдался у этого вида вплоть до седьмого дня развития в окончательном хозяине (Atkinson, Byram, 1976); у близкого вида M. clarki они отмечались также только у особей из окончательного хозяина (Crook, Grundmann, 1964). В связи с фрагментацией яичника возникает вопрос об оплодотворении: по мнению одних авторов, оно может происходить после отделения яйцеклеток от яйцевого шара (Van Cleave, 1953; Guraya, 1969; Marchand, Mattei, 1976; и др.), по данным других – когда яйцеклетки находятся в составе яйцевого шара (Meyer, 1933; Crompton, 1985; и др.). В последнем случае образовавшиеся зиготы одеваются оболочкой и претерпевают два деления дробления, одновременно отделяясь от яйцевого шара (Иванова-Казас, 1975). Дальнейшее эмбриональное развитие продолжается в свободном состоянии и завершается образованием яйца, состоящего из эмбриональной личинки (акантора) и эмбриональных оболочек (Crompton, 1985).
Другим характерным признаком элементов женской половой системы скребней является их синцитиальная (по терминологии разных авторов) организация, причем в виде многоядерных образований устроены как яйцевые шары (Parshad, Guraya, 1977; Marchand, Mattei, 1980; Crompton, 1985), так и яйцевыводящие пути (Петроченко, 1956; Whitfield, 1968; Asaolu, 1980; Herlyn, Röhrig, 2003). Однако описания ультраструктуры последних не всегда полные и не представляют неопровержимые доказательства их синцитиальной организации. Например, по общему мнению, стенка матки образована мышечной тканью, при этом отмечается не только ее мышечный характер (Meyer, 1931; и др.), но и описывается ее многослойность (Asaolu, 1980).
Таким образом, существующие представления о тканевой организации половой системы самок скребней зачастую неполные и иногда существенно различаются. Сведения о начальном этапе эмбрионального развития также весьма противоречивы. Эти представления могут быть уточнены и дополнены в результате планомерного изучения тканевой организации скребней и ее развития в онтогенезе с привлечением большего количества видов (Parshad, Crompton, 1981; Crompton, 1985). В настоящем сообщении представлены результаты изучения женской половой системы скребня Acanthocephalus tenuirostris.
Скребень A. tenuirostris относится к числу наиболее массовых паразитов рыб Дальнего Востока, включая северное Приохотье (Атрашкевич и др., 2005). Паразит обладает патогенным эффектом, что в совокупности с широким распространением и часто высокой интенсивностью инвазии определяет актуальность его исследования. Предварительные результаты исследований частично были опубликованы ранее (Давыденко, Никишин, 2017, 2018).
МАТЕРИАЛ И МЕТОДИКА
Паразиты были получены в результате неполного гельминтологического вскрытия восточносибирских хариусов (Thymallus arcticus pallasii Valenciennes in Cuvier et Valenciennes 1848) (по: Черешнев и др., 2005), отловленных в среднем течении р. Буюнда – правого притока р. Колыма. Обнаруженных скребней фиксировали в 70% спирте для гистологических исследований и в 2% глутаровом альдегиде на фосфатном буфере (pH 7.4) для изучения ультраструктуры. Для гистологии образцы обезвоживали в спиртах возрастающей концентрации и заключали в парапласт. Срезы изготовляли на санном микротоме, окрашивали гематоксилин-эозином и исследовали в световом микроскопе Olympus CX41. Для электронной микроскопии после альдегидной фиксации образцы фиксировали в 1% тетраоксиде осмия на таком же буфере, обезвоживали и заключали в смесь эпона и аралдита. В процессе обезвоживания образцы проводили через 1% уранилацетат в 70%-ном спирте. Полутонкие срезы, окрашенные смесью (в соотношении 1 : 1) 1% метиленового синего и 1% кристаллического фиолетового, исследовали с помощью светового микроскопа Olympus CX41 с использованием фотокамеры Olympus E-420. Ультратонские срезы получали с помощью микротомов LKB (Швеция) и PT-PC (США). Часть срезов контрастировали цитратом свинца по Рейнольдсу (Reynolds, 1963). Исследования на ультратонких срезах проводили с использованием трансмиссионных электронных микроскопов JEM1011 и JEM1400PLUS и фотокамер SIS Veleta. Полученные фотографии обрабатывали с помощью комплекса программ CorelDRAW 12.
Свето-микроскопически исследованы шесть самок, электронно-микроскопически – две самки. Кроме того, обоими методами исследовано несколько погибших самок.
РЕЗУЛЬТАТЫ
Половая система самки исследованных скребней A. tenuirostris состоит из яйцевых шаров, выводных путей и яиц разной степени зрелости.
Размеры яйцевых шаров на полутонких срезах варьируют от 76 × 38 мкм до 215 × 112 мкм (рис. 1A–1C). В их составе отчетливо выделяются два компонента: соматический и герминативный. Соматический компонент (в англоязычной литературе – поддерживающий, или поверхностный, синцитий (Marchand, Mattei, 1980; Crompton, 1985; и др.)) имеет сетчатую внешность со многими просветами и отличается общей невысокой электронной плотностью. На срезах яйцевых шаров в этом синцитии мы наблюдали только одно соматическое ядро, размерами 8.3 × 6.2 мкм, а на некоторых срезах ядра вообще не наблюдались. Ядро соматического компонента отличается от герминативных ядер неровными очертаниями и включает относительно светлую кариоплазму и ядрышко диаметром до 3.8 мкм; скопления гетерохроматина не выявлялись (рис. 1C). Цитоплазма соматического компонента довольно рыхлая, содержит округлые или овальные митохондрии, часто образующие скопления по его периферии. Внешняя поверхность синцития неровная, с короткими выростами, которые вследствие их неправильной формы существенно отличаются от типичных микроворсинок.
Рис. 1.
Яйцевые шары скребня Acanthocephalus tenuirostris: A – молодые яйцевые шары (световая микроскопия, полутонкий срез), B – молодой яйцевой шар (электронная микроскопия), C – зрелый яйцевой шар (электронная микроскопия); De – развивающееся яйцо, Li – лигамент, Ob – яйцевые шары, Oo – ооциты, Os – оогониальный синцитий, Sn – ядро соматического синцития. Масштаб, мкм: A – 20; B – 5; C – 10.
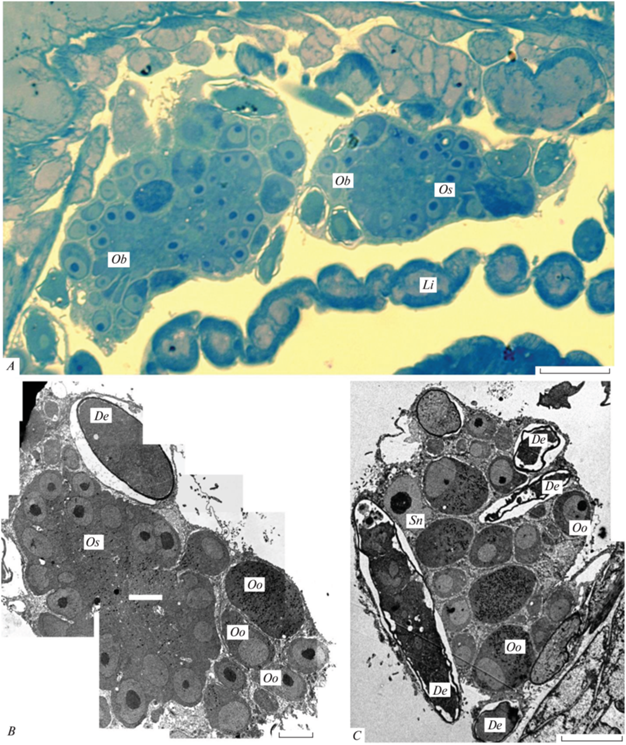
Герминативный, или оогониальный, компонент в одних яйцевых шарах располагается в их центральной части, занимая на одном срезе примерно половину площади шара, содержит до двух и более десятков ядер и, таким образом, характеризуется симпластической организацией (рис. 1A–1B). Формирующиеся и сформированные ооциты в таком яйцевом шаре немногочисленны и обнаруживаются в его периферийных участках; такие шары мы рассматриваем как молодые. В других шарах, которые представляются более зрелыми, наибольшую площадь среза занимают ооциты, а по периферии часто видны формирующиеся яйца; оогониальный компонент в таких шарах либо минимален по площади и может иметь синцитиальную или симпластическую организацию, либо вовсе не наблюдается (рис. 1C).
Цитоплазма герминативного компонента отличается несколько более высокой электронной плотностью, чем цитоплазма соматического. По всей его площади рассеяны округлые кортикальные гранулы, диаметром 0.2–0.3 мкм; наблюдается тенденция их концентрации в центральном участке симпласта. Ядра герминативного компонента, напротив, располагаются преимущественно по его периферии и характеризуются почти правильной округлой формой, размерами 4.3–4.9 × 5.7–6 мкм и крупными ядрышками до 2.5 мкм в диаметре (рис. 1A–1B). В некоторых участках симпласта наблюдаются пары ядер, располагающиеся рядом друг с другом, что предполагает недавние деления (рис. 2A). По периферии герминативного компонента обособляются его фрагменты, включающие ядро и цитоплазму с некоторым количеством кортикальных гранул; после полного отделения от герминативного синцития эти фрагменты представляют собой ооциты, которые, однако, остаются окруженными соматическим синцитием (рис. 2A). Количество кортикальных гранул в них варьирует от одного-двух десятков до сотни и более на срезе, что мы объясняем разной степенью зрелости ооцитов.
Рис. 2.
Ооциты скребня Acanthocephalus tenuirostris: A – отделение ооцита от оогониального синцития, B – формирование оболочки оплодотворения, C – развивающиеся яйца в составе яйцевого шара, D – фрагменты сперматозоидов в яйцевом шаре; De – развивающееся яйцо, Fe – оболочка оплодотворения, Fo – оплодотворенные ооциты, On – ядра оогониального синцития, Oo – ооцит, Os – оогониальный синцитий, Ss – соматический синцитий. Белыми стрелками обозначены кортикальные гранулы. Черной стрелкой обозначена двуслойная оболочка оплодотворения. Двойными стрелками обозначены сперматозоиды в продольном и поперечном сечениях. Масштаб, мкм: A, B, D – 5; C – 10.

Во многих яйцевых шарах наблюдаются оплодотворенные яйцеклетки, окруженные оболочкой оплодотворения – пластинкой электронно-плотного материала, толщиной 0.3–0.4 мкм (рис. 1C; 2B–2C). В некоторых случаях эта оболочка находится в процессе образования, о чем свидетельствует ее фрагментарная внешность (рис. 2B); в этих случаях толщина ее фрагментов значительно превышает толщину “обычной” оболочки оплодотворения и может достигать 1 мкм. В разных зиготах эта оболочка несколько различается по своей структуре. В одних случаях она образована гомогенным материалом высокой электронной плотности, сравнимой с плотностью материала кортикальных гранул. У других зигот оболочка оплодотворения определяется как двухслойная (рис. 2C). Наружный слой, относительно более плотный, толщиной 0.06 мкм, тогда как более толстый внутренний слой образован менее плотным материалом; его толщина достигает 0.4 мкм. Оба слоя могут или вплотную прилегать друг к другу, или разделяться пространством разной ширины. Варьирующие по ширине пространства также наблюдаются между оболочкой оплодотворения и формирующимся яйцом.
Внутри яйцевого шара в узких пространствах между ооцитами наблюдались фрагменты спермиев (рис. 2D). В периферических участках некоторых яйцевых шаров иногда наблюдаются удлиненные развивающиеся яйца, эмбрионы в которых содержат предположительно более четырех ядер (рис. 1C); структуру эмбриональных оболочек этих яиц определить не удалось.
Выводные пути исследованных скребней состоят из маточного колокола, яйцеводов, матки и влагалища (рис. 3A–3D). Маточный колокол имеет форму неправильного овала (рис. 3A); толщина его стенки примерно равна толщине стенки матки и составляет в среднем 12–13 мкм. Стенка колокола отчетливо двуслойная. Наружный слой представляет собой пласт сократительных элементов, ориентированных в кольцевом направлении и организованных в своеобразные блоки, разделенные плотными септами. Внутренний слой – цитоплазматический; в нем на парафиновом препарате вблизи яйцевода мы наблюдали два ядра (рис. 3B).
Рис. 3.
Женская половая система скребня Acanthocephalus tenuirostris: A, B – общий вид (световая микроскопия), A – полутонкий срез образца, заключенного в эпоксидную смолу. Прямоугольником выделено ядро в стенке матки, электронно-микроскопический снимок которого можно увидеть на рис. 4A; стрелкой показано отверстие в стенке маточного колокола с незрелым яйцом; B, C, D – срезы препаратов, заключенных в парапласт; C – яйцеводы. Фигурной скобкой показано скопление ядер в начале матки, D – мышечные сфинктеры влагалища с видимыми ядрами; Li – лигамент, Nu – ядро, Ob – яйцевые шары, Od – яйцеводы, Te – тегумент, Ub – маточный колокол, Ut – матка, Va – влагалище, Vs – сфинктеры влагалища. Масштаб, мкм: A, B – 20; C, D – 100.
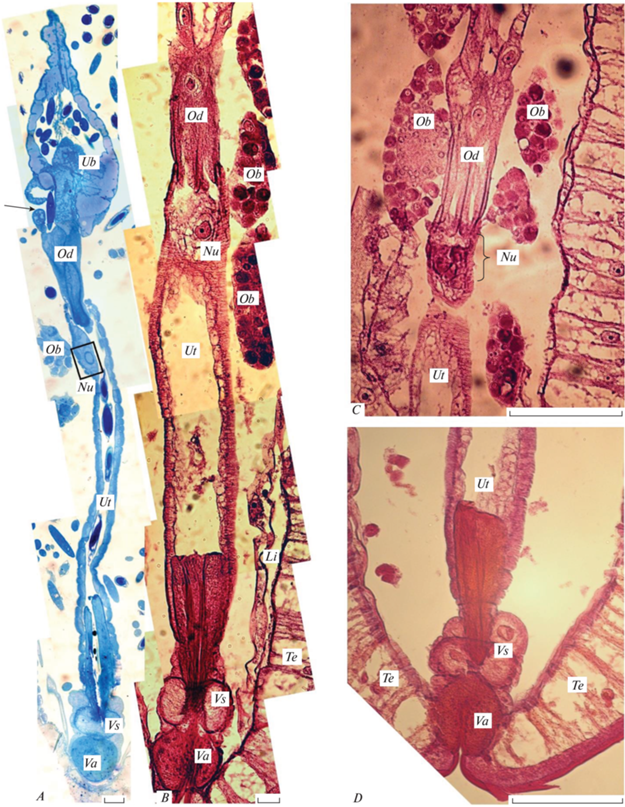
Морфология проксимальной и дистальной частей маточного колокола несколько различается. В проксимальной части колокола его стенка характеризуется поперечными складками, окрашивающимися интенсивнее остальной однородной цитоплазмы. Дистальная часть стенки маточного колокола с одной стороны утолщается до 50 мкм, охватывая яйцеводы, с другой стороны утолщение стенки не столь значительно, до 24 мкм, и на этом участке располагается отверстие яйцевыводящего аппарата, через которое незрелые яйца, попавшие в колокол, перемещаются в полость тела для дозревания (рис. 3A). От маточного колокола начинаются два коротких яйцевода (длиной около 113 мкм), которые дистальными участками глубоко вдаются в матку (рис. 3A–3C). Ткань стенок яйцеводов, подобно стенке маточного колокола, состоит из двух слоев, наружного, сократительного, и внутреннего, цитоплазматического. На парафиновом срезе в цитоплазматическом слое стенки каждого яйцевода наблюдали по одному ядру (рис. 3B).
Длина матки составляет около 414 мкм. Ее стенка, толщиной до 11 мкм, образована двумя отчетливыми слоями, примерно одинаковыми по толщине: внешним (сократительным), толщиной 5–6 мкм, и внутренним (цитоплазматическим), толщиной около 5 мкм (рис. 4A–4D). Внешний слой включает сократительные элементы, ориентированные в кольцевом направлении и связанные с электронно-плотными септами, пересекающими этот слой перпендикулярно поверхности матки. Внутренний слой заполнен умеренно плотной цитоплазмой с включением мелких овальных митохондрий, концентрирующихся вблизи пласта сократительных элементов, а также вдоль внутренней границы стенки матки (рис. 4B). К внешней поверхности стенки матки прилежит слой рыхло организованного филаментного межклеточного материала. Слой такого же материала, но менее толстый, наблюдается в просвете матки, на ее внутренней поверхности. Такой же рыхлый филаментный материал, также более выраженный в непосредственной близости сократительных элементов, покрывает стенки яйцеводов и маточного колокола. С периодичностью в 20–30 мкм стенка матки разделена на отдельные блоки щелевидными промежутками, заполненными филаментами межклеточного материала (рис. 4B, 4E). Наиболее ярко это разделение выявляется в погибших, полностью расправленных, скребнях (рис. 4C).
Рис. 4.
Ультраструктура стенки матки скребня Acanthocephalus tenuirostris: A – ядро в стенке матки (фрагмент, выделенный прямоугольником на рис. 3A); B – стенка матки; C – стенка матки погибшего скребня; D – фрагмент рис. 4A, выделенный черным прямоугольником, при большем увеличении; E – фрагмент рис. 4B, выделенный белым прямоугольником, при большем увеличении; Im – межклеточный материал, Mf – миофиламенты, Nu – ядро, Ut – матка. Звездочками показан просвет между фрагментами стенки матки. Одинарными стрелками показан материал, прилегающий к внутренней поверхности ядерной оболочки; двойными – сходный материал в окружающей цитоплазме. Масштаб, мкм: A – 5; B – 10; C – 2; D, E – 2.

В верхней части матки внутренний цитоплазматический слой ее стенки расширен до 30 мкм. На парафиновых срезах в этой части матки мы наблюдали скопление ядер (рис. 3B, 3С). На полутонком и тонком срезах наблюдалось одно ядро, размерами 18.8 × 10 мкм. Оно окружено слоем умеренно-плотной эндоплазмы, толщиной 0.4 мкм, включает менее плотную, чем эндоплазма, кариоплазму и содержит округлое ядрышко, диаметром 4.6 мкм, и несколько округлых электронно-плотных включений неясной природы, диаметром до 0.7 мкм; гетерохроматин не выявляется (рис. 3A, 4A). Оболочка ядра слабоволнистая. К внутренней поверхности внутренней ядерной мембраны прилежит узкий слой плотного материала; слой подобного материала в виде протяженных фрагментов также наблюдается в эктоплазме вокруг ядра (рис. 4A).
Дистальный отдел матки охватывает верхнюю часть влагалища (рис. 3A–3C). Толщина его стенок в верхней части составляет 24.2 мкм, а в нижней части достигает 38 мкм. Влагалище опоясывают два сфинктера, внутренний, толщиной 36.7 мкм, и наружный, толщиной 34.3 мкм, в стенке каждого из которых мы наблюдали по два ядра (рис. 3C). Диаметр ядер, обнаруженных в стенке наружного сфинктера, 15.0, внутреннего – 13.2 мкм. Сфинктеры и дистальная часть матки окружены светлой тканью неясной структуры. На парафиновых срезах видно, что стенка влагалища переходит в наружную часть тегумента метасомы скребня.
В матке одной самки наблюдали четыре зрелых яйца, веретенообразной формы (рис. 3A); зрелые яйца, наряду с незрелыми, обнаруживали также в “полости” тела. Показателем зрелости является наличие в каждом из них эмбриональной личинки (акантора), содержащей в переднем конце оформленную железу проникновения и окруженной четырьмя полностью развитыми эмбриональными оболочками (рис. 5). Поверхностная оболочка (терминология эмбриональных оболочек и пространств между ними дана по: Marchand, 1984), Е1, тонкая, мембраноподобная. Оболочка Е2 заметно толще и плотная. Оболочка Е3 очень толстая и подразделяется на несколько слоев: крайние Е3а и Е3с, внешне напоминающие мембраны, и центральный Е3b, заполненный зернистым материалом умеренной плотности. Оболочка Е4 относительно тонкая, плотно прилегает к поверхности акантора и образована электронно-плотным материалом. В середине яйца находится “центральная ядерная масса”; в ее составе преобладают “фибриллярные тельца” (термин по: Никишин, Краснощеков, 1986), среди которых определяются редкие мелкие герминативные ядра.
ОБСУЖДЕНИЕ
Исследованные самки скребня Acanthocephalus tenuirostris являются вполне зрелыми, о чем свидетельствует наличие в них зрелых яиц, которые наблюдались как в “полости” тела самок, так и в их матке.
Полученные результаты подтверждают существующие представления о составе яйцевых шаров из герминативного (оогониального) и соматического компонентов, а также ооцитов разной степени зрелости (Crompton, 1985; и др.). Соматический компонент во всех случаях предположительно организован в виде синцития. Хотя в его составе на одном срезе мы всегда наблюдали только одно ядро, мы сохраняем за ним устоявшийся термин “синцитий”, предполагая, что дальнейшие исследования серийных срезов смогут подтвердить синцитиальный характер соматического компонента.
У скребней Moniliformis moniliformis и Polymorphus minutus в составе соматического синцития авторы выделяют медуллярную и кортикальную зоны, а также слой довольно длинных микроворсинок на его поверхности (Crompton, Whitfield, 1974). У исследованных нами скребней мы не обнаружили типичных микроворсинок и не смогли показать подобное разделение. Различия в организации соматического синцития, возможно, обусловлены разным возрастом исследованных скребней или яйцевых шаров.
Герминативный компонент, по общепринятому мнению, имеет синцитиальную организацию (Marchand, Mattei, 1980; и др.). У исследованных нами скребней в центральных участках яйцевых шаров герминативный компонент в большинстве случаев организован в виде симпласта. Однако в периферических участках незадолго до обособления от него ооцитов этот компонент однозначно является синцитием.
Примечательной особенностью яйцевых шаров скребня Acanthocephalus tenuirostris являются ооциты, покрытые оболочкой оплодотворения. Этот факт подтверждает имеющееся мнение об оплодотворении яйцеклеток еще до отделения их от яйцевых шаров (Meyer, 1933; Иванова-Казас, 1975; Crompton, 1985; и др.). Дополнительным аргументом в пользу этого мнения являются фрагменты спермиев в просветах соматического синцития (рис. 2D). В то же время мы не наблюдали свободных ооцитов в “полости” тела исследованных скребней, в отличие, например, от скребня Pallisentis golvani, у которого эти структуры были отмечены (Marchand, Mattei, 1976). Тем не менее немногочисленность имеющихся данных не позволяет полностью исключить возможность отделения ооцитов от яйцевых шаров с их последующим оплодотворением, согласно предположению других авторов (Van Cleave, 1953; Nicholas, Hynes, 1963; Guraya, 1969; Anantaraman, Subramoniam, 1975; и др.).
Процесс формирования оболочки оплодотворения ранее был описан на примере скребня Breizacanthus sp. (Marchand, Mattei, 1980). Авторы констатировали, что оплодотворение происходит после отделения ооцита от яйцевого шара, и по совершении оплодотворения из содержимого кортикальных гранул яйцеклетки формируется оболочка оплодотворения. У исследованных нами скребней, как уже говорилось, оплодотворение яйцеклеток и, соответственно, образование вокруг них оболочки оплодотворения происходило в период нахождения их в составе яйцевых шаров. Процесс ее образования был сходен с описанным аналогичным процессом у Breizacanthus sp. (Marchand, Mattei, 1980): в обоих случаях он начинается с выделения на поверхность зиготы содержимого кортикальных гранул в виде довольно толстых массивов, толщина которых по мере их слияния в единую оболочку уменьшается. Однако механизм выделения содержимого кортикальных гранул на поверхность зиготы остается неясным. В дальнейшем электронная плотность материала, образующего оболочку оплодотворения, несколько снижается, и на ее поверхности выделяется тонкий, более электронно-плотный слой. Двуслойный характер оболочки оплодотворения, окружающей некоторые зиготы, отмечается впервые. Такая оболочка сходна с начальным этапом образования эмбриональных оболочек (скорлупы) яиц скребней, описанным у скребня Arhythmorhynchus petrochenkoi (Никишин, 1995), и ее наружный электронно-плотный слой, вероятно, представляет собой элемент Е1 скорлупы зрелых яиц (Marchand, 1984; Никишин, 1995). Таким образом, можно констатировать, что, по крайней мере, в некоторых случаях у исследованных скребней эмбриональные оболочки начинают формироваться еще в период нахождения зиготы в составе яйцевого шара. Этот вывод вполне согласуется с наблюдением в составе яйцевых шаров развивающихся эмбрионов в состоянии дробления.
В яйцевых шарах Acanthocephalus tenuirostris мы не смогли обнаружить ооцитов в состоянии атрезии, дегенерирующих в случае отсутствия оплодотворения, как это отмечено некоторыми авторами (Crompton, Whitfield, 1974; Parshad, Guraya, 1978; Marchand, Mattei, 1980).
Второй особенностью яйцевых шаров скребня A. tenuirostris являются единичные эмбрионы, явно претерпевшие как минимум несколько делений дробления и принявшие удлиненную форму, характерную для созревающих яиц. При этом явные признаки инволюции в них не наблюдались. Задержка отделения развивающихся эмбрионов от яйцевого шара может быть вызвана механическими причинами или может быть следствием некоторой аномалии в его функционировании.
Стенки выводных путей A. tenuirostris (маточного колокола, яйцеводов и матки) образованы модифицированной мышечной тканью, особенностью которой является наличие сократительных элементов в виде пласта в ее внешней части. Почти такое же строение имеет стенка лигамента скребня Neoechinorhynchus beringianus, отличаясь, однако, лишь тем, что в стенке лигамента сократительные элементы организованы не в виде сплошного пласта, а в виде отдельных зон, перемежающихся цитоплазматическими участками без миофиламентов (Кусенко, Никишин, 2017). Прилежащие к стенкам выводных путей скопления межклеточного филаментного материала не являются неожиданностью. У Moniliformis moniliformis в составе стенки матки были описаны три слоя: наружный мышечный, средний цитоплазматический и внутренний тонкий, фиброзный; сходное строение имеют стенки лигаментных мешков (Asaolu, 1980). У исследованных нами скребней слой филаментного материала обнаружен как на внешней поверхности яйцевыводящих путей, так и на внутренней, однако в первом случае этот слой был развит значительно лучше, чем во втором. Очевидно, что филаментный материал находится за пределами стенок элементов половой системы. Ранее было показано, что синтез такого материала у скребней, у которых, как известно, отсутствует соединительная ткань, характерен для клеток кожной мускулатуры (Никишин, 2004) и для лигамента (Кусенко, Никишин, 2017). Можно предполагать, что ткани скребней, включающие миофиламенты, специализированы не только к сократительной функции, но и к синтезу межклеточного материала.
Неожиданным оказалось разделение стенки матки на своеобразные блоки, особенно ярко выраженное у погибших скребней. Ранее на примере других видов скребней было показано, что матка представляет собой двуядерный синцитий (в действительности, с позиций строгой гистологии, симпласт), структура которого мало варьирует у разных видов скребней (Asaolu, 1980; Herlin, Röhrig, 2003). У исследованных нами A. tenuirostris каждый блок стенки матки был окружен мембраной, к внешней стороне которой примыкал слой межклеточного материала, что свидетельствует о прижизненном разделении стенки матки. Интерпретация этого факта в настоящий момент невозможна без проведения специальных исследований на серийных срезах. Остается неясным, пронизывают ли эти просветы стенку матки в виде отверстий неправильной формы, или они опоясывают матку полностью. В последнем случае интересно выяснить, представляет ли каждый блок моноядерное или симпластическое образование.
По своему ультратонкому строению обнаруженное ядро стенки матки сходно с ядрами гигантских мышечных (ретикулярных) клеток, располагающихся в основании пресомы скребня Filicollis anatis (Никишин, 2000, 2004). В обоих случаях ядра характеризуются относительно крупными размерами, большими четкими ядрышками, отсутствием значительных скоплений гетерохроматина и признаками “ядерной секреции” плотного материала. Предполагалось, что секретируемый материал отлагается на внутренней поверхности ядерной оболочки, затем выделяется, вероятно, через ядерные поры, в цитоплазму и перемещается к периферии клетки (симпласта) к пласту сократительных элементов (Никишин, 2000, 2004). Вероятно, аналогичный процесс происходит и в ядрах стенки матки; по крайней мере, в обнаруженном ядре наблюдается и слой материала на внутренней поверхности ядерной оболочки, и полоска похожего материала в цитоплазме, окружающего ядро. Дальнейшие исследования должны прояснить, характеризуются ли подобными особенностями ядра других отделов яйцевыводящих путей.
При описании органов половой системы самок скребней в разных публикациях нередко используют термин “синцитий”, что, на наш взгляд, не всегда приемлемо. Как минимум, во многих, если не во всех, случаях стенки этих органов организованы в виде типичных симпластов с расположением ядер в сплошном пласте цитоплазмы, а не в отдельных цитоплазматических “карманах” (цитонах), как это наблюдается у типичных синцитиев. У скребней типичная синцитиальная структура характерна для соматического и иногда для герминативного компонентов яйцевых шаров.
Список литературы
Атрашкевич Г.И., Орловская О.М., Регель К.В., Михайлова Е.И., Поспехов В.В., 2005. Паразитические черви животных Тауйской губы // Биологическое разнообразие Тауйской губы Охотского моря. Отв. ред. Черешнев И.А. Владивосток: Дальнаука. С. 175– 251.
Давыденко Т.В., Никишин В.П., 2017. Исследование половой системы самки скребня Acanthocephalus tenuirostris // Чтения памяти академика К.В. Симакова. Отв. ред. Горячев Н.А. Магадан: СВКНИИ ДВО РАН. С. 124–126.
Давыденко Т.В., Никишин В.П., 2018. Организация женской и мужской половых систем скребня Acanthocephalus tenuirostris // Биоразнообразие паразитов. Труды Центра паразитологии. Т. 50. Отв. ред.: Мовсесян С.О. М.: Товарищество научных изданий КМК. С. 78–79.
Иванова-Казас О.М., 1975. Сравнительная эмбриология беспозвоночных животных. Простейшие и низшие многоклеточные. Новосибирск: Наука. 402 с.
Кусенко К.В., Никишин В.П., 2017. Тканевая организация лигамента скребня Neoechinorhynchus beringianus Mikhailova et Atrashkevich, 2008) (Acanthocephala, Eoacanthocephala) // Биология внутренних вод. № 2. С. 25–29.
Никишин В.П., 1995. Структура и формирование эмбриональных оболочек у скребней Arhythmorhynchus petrochenkoi // Паразитология. Т. 29. № 5. С. 398–403.
Никишин В.П., 2000. “Ядерная секреция” в гигантских мышечных клетках скребня Filicollis anatis // Цитология. Т. 42. № 5. С. 429–431.
Никишин В.П., 2004. Субповерхностная мускулатура скребней (Acanthocephala) и ее роль в образовании межклеточного материала // Известия РАН. Серия биологическая. № 6. С. 716–731.
Никишин В.П., Краснощеков Г.П., 1986. Микроморфология “центральной ядерной массы” аканторов скребней Polymorphus magnus // Цитология. Т. 28. № 11. С. 1261–1263.
Петроченко В.И., 1956. Акантоцефалы (скребни) домашних и диких животных. Т. 1. М.: Издательство Академии наук СССР. 436 с.
Черешнев И.А., Назаркин М.В., Шестаков А.В., Скопец М.Б., Грунин С.И., 2005. Морские и пресноводные рыбы Тауйской губы // Биологическое разнообразие Тауйской губы Охотского моря. Отв. ред. Черешнев И.А. Владивосток: Дальнаука. С. 545–575.
Anantaraman S., Subramoniam T., 1975. Oogenesis in Acanthosentis oligospinus n. sp., an acanthocephalan parasite of the fish, Macrones gulio // Proceedings of the Indian Academy of the Sciences. V. 82B. P. 139–145.
Asaolu S.O., 1980. Morphology of the reproductive system of female Moniliformis dubius (Acanthocephala) // Parasitology. V. 81. № 2. P. 433–446.
Asaolu S.O., Whitfield P.J., Crompton D.W.T., Maxwell L., 1981. Observations on the development of ovarian balls of Moniliformis (Acanthocephala) // Parasitology. V. 83. № 1. P. 23–32.
Atkinson K.H., Byram J.E., 1976. The structure of the ovarian ball and oogenesis in Moniliformis dubius (Acanthocephala) // Journal of Morphology. V. 148. № 2. P. 391–426.
Crompton D.W.T., Whitfield P.J., 1974. Observations on the functional organization of the ovarian balls of Moniliformis and Polymorphus (Acanthocephala) // Parasitology. V. 69. № 3. P. 429–443.
Crompton D.W.T., 1985. Reproduction // Biology of the Acanthocephala. Ed. by D.W.T. Crompton, B.B. Nickol. Cambridge: Cambridge University press. P. 213–271.
Crook J.R., Grundmann A.W., 1964. The life history and larval development of Moniliformis clarki (Ward, 1917) // Journal of Parasitology. V. 50. № 5. P. 689–693.
Guraya S.S., 1969. Histochemical observations on the developing acanthocephalan oocyte // Acta Embryologiae Experimentalis. V. 1. № 2. P. 147–155.
Herlyn H., Röhrig H., 2003. Ultrastructure and overall organization of ligament sac, uterine bell, uterus and vagina in Paratenuisentis ambiguous (Acanthocephala, Eoacanthocephala) – the character evolution within the Acanthocephala // Acta Zoologica (Stockholm). V. 84. № 3. P. 239–247.
Marchand B., 1984. The elaboration of the acanthor shell of Acanthosentis acanthuri (Acanthocephala) // Journal of Parasitology. V. 70. № 5. P. 712–718.
Marchand B., Mattei X., 1976. Presence de flagelles spermatiques dans les spheres ovariennes des eoacanthocephales // Journal of Ultrastructure Research. V. 56. № 3. P. 331–338.
Marchand B., Mattei X., 1980. Fertilisation in Acanthocephala. II. Spermatozoon penetration of oocyte, transformation of gametes and elaboration of the fertilization membrane // Journal of Submicroscopic Cytology. V. 12. № 1. P. 95–105.
Meyer A., 1931. Das urogenitale Organ von Oligacanthorhynchus taenioides (Diesing) ein neuer Nephridialtypus bein den Acanthocephalen // Zeitschrift für Wissenschaftliche Zoologies. Abteilung A. V. 138. P. 88–98.
Meyer A., 1933. Acanthocephala // In Dr H. G. Bronn’s Klassen und Ordnungen des Tierreichs. V. 4. P. 333–582.
Nicholas W.L., 1967. The biology of the Acanthocephala // Advances in Parasitology. V. 5. P. 205–246.
Nicholas W.L., Hynes H.B.N., 1963. The embryology of Polymorphus minutus (Goeze, 1972) (Acanthocephala) // Proceedings of the Zoological Society of London. V. 141. № 4. P. 791–801.
Parshad V.R., Guraya S.S., 1977. Morphological and histochemical observations on the ovarian balls of Centrorhynchus corvi (Acanthocephala) // Parasitology. V. 74. P. 243–253.
Parshad V.R., Guraya S.S., 1978. Morphological and histochemical observations on oocyte atresia in Centrorhynchus corvi (Acanthocephala) // Parasitology. V. 77. № 2. P. 133–138.
Parshad V.R., Crompton D.W.T., 1981. Aspects of acanthocephalan reproduction // Advances in Parasitology. V. 19. P. 73–138.
Reynolds E.S., 1963. The use of lead citrate at high pH as an electronopaque stain in electron microscopy // Journal of Cell Biology. V. 40. P. 43–44.
Van Cleave H.J., 1953. Acanthocephala of North American mammals // Illinois Biological Monographs. V. 23. P. 1–179.
Whitfield P.J., 1968. A histological description of the uterine bell of Polymorphus minutus (Acanthocephala) // Parasitology. V. 58. P. 671–682.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал



