Биоорганическая химия, 2020, T. 46, № 4, стр. 418-424
Одновременное применение Cy5-модифицированных производных дезоксиуридина и дезоксицитидина в ПЦР
С. А. Лапа 1, Т. О. Гусейнов 1, А. С. Павлов 1, В. Е. Шершов 1, В. Е. Кузнецова 1, А. С. Заседателев 1, А. В. Чудинов 1
1 ФГБУН Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, ул. Вавилова, 32, Россия
Поступила в редакцию 23.12.2019
После доработки 26.12.2019
Принята к публикации 31.12.2019
Аннотация
Изучены особенности одновременного встраивания в растущую цепь ДНК модифицированных Cy5-дезоксиуридинов (Cy5-dU) и дезоксицитидинов (Cy5-dC) в ПЦР с Taq ДНК-полимеразой. Исследования проводили для попарного встраивания нуклеотидов, модифицированных флуорофорами, обладающими суммарным положительным, нейтральным и отрицательным зарядом. Варьировали долю модифицированых дезоксинуклеозидтрифосфатов (Cy5-dUTP и Cy5-dCTP) к природным аналогам (dTTP и dCTP) от 0 до 100% каждого в реакции, т.е. до полного замещения. Проводили сравнение с индивидуальным встраиванием соответствующих модифицированных производных. Пары (Cy5-dU + Cy5-dC) применяли для амплификации фрагментов бактериальных геномов длиной 126, 283 и 370 пар оснований. Увеличение длины амплифицируемого фрагмента ДНК снижало выход продукта при использовании Cy5-модифицированных нуклеотидов в выбранных условиях амплификации. Электроотрицательные Cy5-dNTPs проявляли наименьший ингибирующий эффект на ПЦР, в то время как электронейтральные – обеспечивали большую плотность встраивания меток в растущую цепь ДНК.
ВВЕДЕНИЕ
Ферментативное получение модифицированных ДНК интенсивно используется как для введения меток в молекулярно-генетическом анализе, так и для расширения физико-химических свойств молекулярных сенсоров и модифицированных аптамеров [1].
Наиболее распространенным модифицированным субстратом ДНК-полимераз является дезоксиуридинтрифосфат (dUTP) с различными функциональными группами, введенными по С5-положению пиримидинового цикла [1–3]. Меньшее распространение модифицированных производных трифосфатов дезоксицитидина (dCTP) и пуриновых оснований (dATP, dGTP) связано с более сложным синтезом. В последнее время появляются сообщения об успешном применении модифицированных dCTP в ферментативных реакциях амплификации ДНК [4, 5]. Идет активный поиск новых производных трифосфатов как пиримидиновой, так и пуриновой природы [6–8].
Важной задачей является изучение одновременного множественного встраивания модифицированных нуклеотидов в одну цепь ДНК. Преимуществами одновременного использования разноименных модифицированных нуклеотидов (например, dU и dC) является, с одной стороны, увеличение чувствительности анализа при ферментативном введении меток, с другой – расширение спектра мишеней для создания высокоспецифичных аптамеров с несколькими модифицированными группами [9, 10].
На сегодняшний момент данных по одновременному использованию нескольких модифицированных трифосфатов недостаточно. Одна из первых успешных попыток параллельного введения различных модифицированных нуклеотидов в процессе амплификации ДНК была осуществлена в 2003 году [11]. Описан ПЦР-продукт, при получении которого природные трифосфаты в ПЦР были замещены модифицированными dUTP, dCTP и dATP. В коротком сообщении не обсуждалось практическое применение полученных результатов. В 2017 году введение двух модифицированных оснований в одну цепь ДНК было применено для поиска высокоспецифичных аптамеров к белковой мишени [10]. Установлено, что нахождение определенных парных комбинаций модифицированных нуклеотидов может приводить к более высокому сродству к мишени, увеличивать метаболическую стабильность и ингибирующий терапевтический эффект по сравнению с аптамерами, содержащими одну модификацию.
Ранее нами было показано, что в ПЦР с короткой ДНК-матрицей бактериального генома [12] и короткой синтетической матрицей [13] – наиболее подходящими субстратами являются Cy5-модифицированные dU с нейтральным электрическим зарядом флуорофора. При этом изучали только индивидуальное введение в ДНК каждого из модифицированных производных.
В настоящей работе изучено одновременное применение в ПЦР аналогов dU и dC, модифицированных индодикарбоцианиновыми красителями (ряд Cy5) с различным зарядом флуорофора. В качестве ДНК-матриц применены фрагменты бактериальных геномов различной длины. Амплификацию матриц проводили с помощью Taq ДНК-полимеразы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучено поведение Cy5-производных трифосфатов дезоксиуридина (Cy5-dU) и дезоксицитидина (Cy5-dC) в качестве субстратов Taq ДНК-полимеразы в ПЦР при замещении природных dTTP и dCTP. Флуорофоры, введенные по пиримидиновому основанию дезоксинуклеозидов, различались суммарным электрическим зарядом – положительным, нейтральным и отрицательным – и по этому признаку были распределены на пары Cy5-dU1 (+) и Cy5-dC1 (+), Cy5-dU2 (0) и Cy5-dC2 (0), Cy5-dU3 (–) и Cy5-dC3 (–), где в скобках указано значение суммарного заряда флуорофора. Структуры соединений приведены на рис. 1.
Рис. 1.
Структуры Cy5-модифицированных производных трифосфата дезоксиуридина (Cy5-dU) и дезоксицитидина (dC) с различным суммарным зарядом флуорофора, присоединенного по 5-положению нуклеинового основания: (+) – положительный суммарный заряд, (0) – цвиттерион (распределенный электронейтральный) и (–) – отрицательный суммарный заряд.
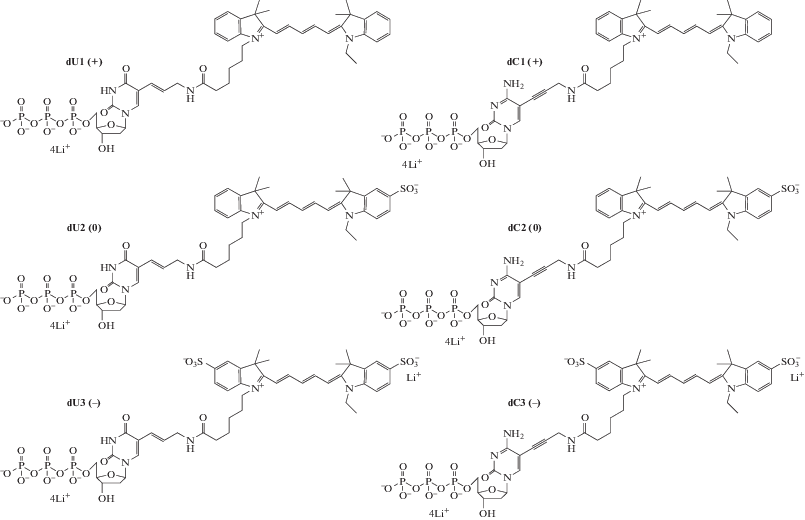
Пиримидиновое основание производных дезоксиуридина связано по 5-положению с флуоресцентеными красителями через аминоаллильный линкер Е-транс двойной связью. Пиримидиновое основание производных дезоксицитидина связано по 5-положению с флуоресцентными красителями через аминопропаргильный линкер тройной связью. Модифицированные производные пиримидиновых нуклеотидов с обоими вариантами линкеров, связанными с 5-положением, ориентируют заместители в широкую бороздку двухспиральной ДНК и способны восприниматься ДНК-полимеразами в качестве субстратов [14, 15].
Проводили замену в реакционной смеси одного из природных dNTP на каждый из модифицированных аналогов индивидуально в отдельных реакциях. Массовую долю модифицированного производного по отношению к соответствующему природному трифосфату дезоксинуклеозида увеличивали от 0 до 100%. Для амплификации использовали фрагмент rpoB-гена Mycobacterium tuberculosis. Ингибирующий эффект определяли по оптической плотности ПЦР-продуктов при электрофоретическом разделении реакционной смеси.
Изучали субстратное поведение и эффект ингибирования ПЦР при одновременном использовании разноименных модифицированных нуклеотидов в одной реакции ПЦР (Cy5-dU + Cy5-dC) по сравнению с индивидуальным использованием одного производного (Cy5-dU или Cy5-dC). При этом массовые доли модифицированных производных увеличивали соответственно, т.е. 0% Cy5-dU + 0% Cy5-dC, 5% Cy5-dU + 5% Cy5-dC – и так далее до полного замещения природных dT и dC при сохранении постоянной суммарной концентрации (Cy5-dU + dT) и (Cy5-dC + dC), которая составляла 200 мкМ. Выход измеряли по оптической плотности соответствующих полос электрофорезного геля с помощью программы ImageJ (NIH, США). Данные приведены в табл. 1. Выход для каждого модифицированного производного и их комбинаций нормировали на выход с применением в реакции только природных дезоксинуклеозидтрифосфатов (соответствует столбцу табл. 1 с массовой долей замены 0%). Одновременное использование разноименных модифицированных производных не приводило к статистически значимому увеличению ингибирующего эффекта по сравнению с использованием их по-отдельности в тех же концентрациях. Т.е. не наблюдали накопления эффекта ингибирования при совместном применении. Наиболее сильно выраженный ингибирующий эффект в ПЦР наблюдали для модифицированных dU и dC с суммарным положительным зарядом, минимальный – для отрицательно-заряженных.
Таблица 1.
Сравнительные нормированные выходы продуктов при ПЦР-амплификации фрагмента гена rpoB Mycobacterium tuberculosis, определенные по оптической плотности полосы целевого продукта в электрофорезном геле. Массовая доля модифицированного дезоксинуклеозида указана в процентах по отношению к общему количеству одноименного модифицированного и немодифицированного трифосфата дезоксинуклеозида. Нормировка произведена на выход реакции с использованием только природных дезоксинуклеозидтрифостфатов
| Модифицированный субстрат | Массовая доля, % | |||||
|---|---|---|---|---|---|---|
| 0 | 10 | 25 | 50 | 75 | 100 | |
| dUTP1 (+) | 1.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
| dUTP2 (0) | 1.00 | 0.31 | 0.17 | 0.00 | 0.00 | 0.00 |
| dUTP3 (–) | 1.00 | 0.9 | 0.69 | 0.13 | 0.02 | 0.00 |
| dCTP1 (+) | 1.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
| dCTP2 (0) | 1.00 | 0.48 | 0.19 | 0.00 | 0.00 | 0.00 |
| dCTP3 (–) | 1.00 | 1.00 | 0.81 | 0.15 | 0.03 | 0.00 |
| dUTP1 (+) + dCTP1 (+) | 1.00 | 0.01 | 0.00 | 0.00 | 0.00 | 0.00 |
| dUTP2 (0) + dCTP2 (0) | 1.00 | 0.45 | 0.12 | 0.00 | 0.00 | 0.00 |
| dUTP3 (–) + dCTP3 (–) | 1.00 | 1.14 | 0.95 | 0.11 | 0.01 | 0.00 |
Суммарно-электронейтральные производные с распределенным зарядом (цвиттер-ионы), при заметном ингибирующем эффекте, показывали хорошую плотность встраивания в растущую цепь ДНК. В то время как отицательно заряженные, при минимальном ингибирующем эффекте, демонстрировали минимальную же плотность встраивания. Субстратную эффективность определяли по совокупности показателей кинетики амплификации (эффективность амплификации Е) и плотности встраивания метки в растущую цепь ДНК. Плотность встраивания и эффективность амплификации определяли с помощью гибридизационного анализа и ПЦР в режиме реального времени, соответственно, как описано в [12, 16]; полученные данные будут обсуждены в отдельной публикации.
Изучали возможность применения пар (Cy5-dU + Cy5-dC) для амплификации фрагментов бактериальных геномов длиной 126, 283 и 370 п. о. Наблюдали усиление ингибирующего влияния модификаций на ПЦР с увеличением длины ПЦР-продуктов. Результаты амплификации бактериальных генетических мишеней различной длины приведены на рис. 2. Заметно снижение электрофоретической подвижности для электронейтральных Cy5-dNTPs по мере увеличения массовой доли модифицированных производных в реакционной смеси. По-видимому, это связано с возрастанием суммарного количества встроившихся электронейтральных производных в растущую цепь ДНК, т.е. с возрастанием плотности метки на одну молекулу ПЦР-продукта. Из рис. 2 видно, что при попарном одновременном введении в реакцию разноименных модифицированных нуклеотидов сохранялась зависимость от заряда флуорофора, обнаруженная ранее при индивидуальном введении модификаций. При попарном введении производных dU и dC с электроположительными флуорофорами наблюдался наибольший ингибирующий эффект, с электроотрицательными – наименьший.
Рис. 2.
Агарозный электрофорез продуктов ПЦР с бактериальных геномных мишеней различной длины с использованием пар Cy5-модифицированных производных дезоксиуридина и дезоксицитидина (замещение от 0 до 100% к природным аналогам для каждого dNTP в паре). L – маркер длин двухцепочечной ДНК GeneRuler 50bp (ThermoScientific, США), NC – отрицательный контроль. Цифровые обозначения над лунками геля обозначают процент замещения в ПЦР каждого из пары природных dTTP и dCTP на соотвествующие Cy5-модифицированные аналоги при сохранении постоянной суммарной концентрации (Cy5-dNTP + природный dNTP) 200 мкМ. Окрашивание бромистым этидием.

Наблюдалась тенденция уменьшения выхода продукта с увеличением длины используемой матрицы для амплификации. Очевидно, при выбранных параметрах ПЦР длина амплифицируемого фрагмента существенно влияет на выход ПЦР-продуктов с увеличением массовой доли Cy5-модифицированных субстратов. Следует ожидать, что оптимизация условий ПЦР для амплификации длинных фрагментов, а именно увеличение временных интервалов стадии элонгации праймеров, способно увеличить выход модифицированного целевого продукта.
Увеличение плотности встраивания метки за счет одновременного применения разноименных модифицированных нуклеотидов способно повысить чувствительность молекулярно-генетического анализа. Применение флуоресцентно-модифицированных dC в дополнение к dU, учитывая отсутствие наблюдаемого накопительного эффекта ингибирования при совместном использовании, когда суммарная концентрация модификации увеличивается в два раза по сравнению с индивидуальным использованием, предпочтительно для анализа ГЦ-богатых последовательностей.
По результатам исследования можно заключить, что при одновременном введении в ПЦР Cy5-модифицированных производных разноименных нуклеотидов, наименьшим ингибирующим эффектом на ДНК-полимеразу обладают соединения с отрицательным зарядом флуорофора. При этом, по данным гибридизационного анализа, наибольшая плотность введения меток достигается при попарном использовании электронейтральных Cy5-модифицированных производных dU и dC, но с меньшим выходом целевого продукта.
Выход целевых продуктов амплификации при одновременном использовании модифицированных dU и dC в ПЦР уменьшается с увеличением длины ПЦР-продуктов и с увеличением массовой доли модифицированных производных в реакционной смеси.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Модифицированные трифосфаты дезоксинуклеозидов
Cy5-модифицированные производные трифосфата дезоксиуридина и дезоксицитидина синтезировали по методу, описанному в [12, 17].
ДНК-матрицы для исследования субстратной эффективности Cy5-модифицированных трифосфатов дезоксинуклеозидов
В работе использованы образцы геномной ДНК Mycobacterium tuberculosis из коллекции Лаборатории биологических микрочипов ФГБУН ИМБ РАН (Россия). Образцы геномной ДНК Staphylococcus aureus и Legionella pneumophila предоставлены ФБУН ГНЦ ПМБ (Россия). В качестве ДНК-матриц для амплификации использовали три бактериальных генетических мишени различной длины, принадлежащих возбудителям легочных инфекций человека.
А. Фрагмент гена rpoB из деконтаминированной геномной ДНК Mycobacterium tuberculosis, штамм H37rv; праймеры: прямой f1272 (5'-CGCCGCGATCAAGGAGTTCT-3') и обратный r1398 (5'-TCACGTGACAGACCGCCGGG-3') [18]. Длина ПЦР-продукта – 126 п. о.
Для двух других бактериальных мишеней конструировали видоспецифичные праймеры и оптимизировали условия ПЦР.
Б. Фрагмент гена ebpS из деконтаминированной геномной ДНК Staphylococcus aureus, штамм ATCC 25923; праймеры: прямой ebpS-f1 (5'-ACTCGACTGAGGATAAAGCGTCT-3') и обратный ebpS-r1 (5'-CCTCCAAATATCGCTAATGCACC-3'). Длина ПЦР-продукта – 283 п. о.
В. Фрагмент гена sidA из деконтаминированной геномной ДНК Legionella pneumophila, штамм ATCC 33152; праймеры: прямой sidA-f1 (5'-TTCCACTGGTGGGTGGGGTTTTG-3') и обратный sidA-r1 (5'-TCATGTTGGAGTTCTATGGCACG-3'). Длина ПЦР-продукта – 370 п. о.
Полимеразная цепная реакция
Для всех Cy5-модифицированных трифосфатов дезоксиуридина и дезоксицитидина проводили ПЦР как при индивидуальной замене соответствующего природного нуклеотида, так и при попарной замене от 0 до 100% каждого в реакционной смеси. Использовали Taq ДНК-полимеразу (Thermo Scientific, США), количество которой в реакционную смесь брали согласно рекомендациям производителя. Реакционная смесь содержала 200 мкM каждого из природных дезоксинуклеозидтрифосфатов dATP и dGTP. Количество природных dTTP и dCTP варьировали в зависимости от массовой доли при их замене на модифицированные аналоги при соблюдении суммарной концентрации (Cy5-dUTP + dTTP), равной 200 мкМ, и суммарной концентрации (Cy5-dCTP + dCTP), также равной 200 мкМ. Замену природного нуклеотида на флуоресцентный аналог проводили с увеличением массовой доли последнего от 0 до 100%, т.е. до полного замещения природного аналога. Матрицы для амплификации добавляли в реакционную смесь в количестве 105 копий на реакционную пробирку.
Температурно-временной профиль ПЦР состоял из предварительной денатурации при 95°С в течение 3 мин, за которой следовали 40 циклов: 95°С в течение 30 с, 66°С в течение 30 с, 72°С в течение 40 с и далее завершающая инкубация при 72°С в течение 5 мин.
Список литературы
Hollenstein M. // Molecules. 2012. V. 17. P. 13 569–13 591.
Pinheiro V.B., Holliger P. // Trends Biotechnol. 2014. V. 32. P. 321–328.
Lapa S.A., Chudinov A.V., Timofeev E.N. // Mol. Biotechnology. 2016. V. 58. P. 79–92.
Sandin P., Stengel G., Ljungdahl T., Börjesson K., Macao B., Wilhelmsson L.M. // Nucleic Acids Res. 2009. V. 37. P. 3924–3933.
Kielkowski P., Cahová H., Pohl R., Hocek M. // Bioorg. Med. Chem. 2016. V. 24. P. 1268–1276.
Matyašovský J., Perlíková P., Malnuit V., Pohl R., Hocek M. // Angew Chem. Int. Ed. Engl. 2016. V. 55. P. 15 856–15 859.
Brázdilová P., Vrábel M., Pohl R., Pivonková H., Havran L., Hocek M., Fojta M. // Chemistry. 2007. V. 13. P. 9527–9533.
Yan J., Yuan Y., Mu R., Shang H., Guan Y. // J. Biosci. 2014. V. 39. P. 795–804.
Diafa S., Hollenstein M. // Molecules. 2015. V. 14. P. 16 643–16 671.
Gawande B.N., Rohloff J.C., Carter J.D., von Carlowitz I., Zhang C., Schneider D.J., Janjic N. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. 2898–2903.
Kuwahara M., Hososhima S., Takahata Y., Kitagata R., Shoji A., Hanawa K., Ozaki A.N., Ozaki H., Sawai H. // Nucleic Acids Res Supp. 2003. V. 3. P. 37–38.
Shershov V.E., Lapa S.A., Kuznetsova V.E., Spitsyn M.A., Guseinov T.O., Polyakov S.A., Stomahin A.A., Zasedatelev A.S., Chudinov A.V. // J. Fluoresc. 2017. V. 27. P. 2001–2016.
Zasedateleva O.A., Vasiliskov V.A., Surzhikov S.A., Kuznetsova V.E., Shershov V.E., Guseinov T.O., Smirnov I.P., Yurasov R.A., Spitsyn M.A., Chudinov A.V. // Nucleic Acids Res. 2018. V. 46. e73.
Giller G., Tassara T., Angerer B., Muhlegger K., Amacker M., Winter H. // Nucleic Acids Res. 2003. V. 31. P. 2630–2635.
Kuwahara M., Nagashima J., Hasegawa M., Tamura T., Kitagata R., HanaWa K., Hasoshima S., Kasamatsu T., Ozaki H., Sawai H. // Nucleic Acids Res. 2006. V. 34. P. 5383–5394.
Лапа С.А., Волкова О.С., Спицын М.А., Шершов В.Е., Кузнецова В.Е., Гусейнов Т.О., Заседателев А.С., Чудинов А.В. // Биоорган. химия. 2019. Т. 45. С. 392–402. [Lapa S.A., Volkova O.S., Spitsyn M.A., Shershov V.E., Kuznetsova V.E., Guseinov T.O., Zasedatelev A.S., Chudinov A.V. // Russ. J. Bioorg. Chem. V. 45. P. 392–402.]
Гусейнов Т.О., Кузнецова В.Е., Шершов В.Е., Спицын М.А., Лапа С.А., Заседателев А.С., Чудинов А.В. // Биоорган. химия. 2018. Т. 44. С. 233–237. [Guseinov T.O., Kuznetsova V.E., Shershov V.E., Spitsyn M.A., Lapa S.A., Zasedatelev A.S., Chudinov A.V. // Russ. J. Bioorg. Chem. V. 44. P. 184–187.]
Mikhailovich V., Lapa S., Gryadunov D., Sobolev A., Strizhkov B., Chernyh N., Skotnikova O., Irtuganova O., Moroz A., Litvinov V., Vladimirskii M., Perelman M., Chernousova L., Erokhin V., Zasedatelev A., Mirzabekov A. // J. Clin. Microbiol. 2001. V. 39. P. 2531–2540.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


