Биоорганическая химия, 2020, T. 46, № 4, стр. 360-368
Флуоресцентные метки в биологии. Пространственная организация
Н. В. Плетнева 1, Е. А. Горячева 1, И. В. Артемьев 1, С. Ф. Архипова 1, В. З. Плетнев 1
1 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, ГСП-7, Россия
Поступила в редакцию 28.01.2020
После доработки 13.02.2020
Принята к публикации 18.02.2020
Аннотация
В клеточной биологии для визуализации и изучения процессов в живых организмах, мониторинга экспрессии генов, локализации и миграции интересующих белков и клеток, определения жизненно важных внутриклеточных характеристик широко используются флуоресцентные метки различной природы. В обзоре рассмотрены пространственная организация, а также достоинства и недостатки наиболее перспективных молекулярных инструментов, получивших широкое применение в биологии.
ВВЕДЕНИЕ
Бурное развитие направлений по созданию флуоресцентных инструментов как низкомолекулярной, так и белковой природы продиктовано насущными потребностями биологии и биомедицины для изучения процессов в живых организмах. Значительный прогресс в этой области был отмечен в последнее время двумя Нобелевскими премиями по химии: 2008 г. – за открытие и использование зеленого флуоресцентного белка GFP и 2014 г. – за создание флуоресцентной микроскопии сверхвысокого разрешения. В настоящее время создание флуоресцентных меток для биологии развивается по четырем направлениям: 1) органические и неорганические низкомолекулярные флуорофоры, 2) GFP-подобные белки с хромофором, образующимся в как часть полипептидной цепи результате посттрансляционной модификации, 3) фоторецепторы (домены фитохромов и флавопротеинов), автокаталитически связывающие присутствующие в клетке природные хромофоры, 4) флуороген-активирующие белки (антитела и липокалины), образующие нековалентные специфические комплексы с органическими низкомолекулярными флуорогенами различной природы. Создание новых флуоресцентных конструкций на основе белковых платформ включает рациональный дизайн, основанный на сайт-направленном мутагенезе, и направленную эволюцию, основанную на оптимизации свойств методом случайного мутагенеза.
I. ОРГАНИЧЕСКИЕ И НЕОРГАНИЧЕСКИЕ НИЗКОМОЛЕКУЛЯРНЫЕ ФЛУОРОФОРЫ
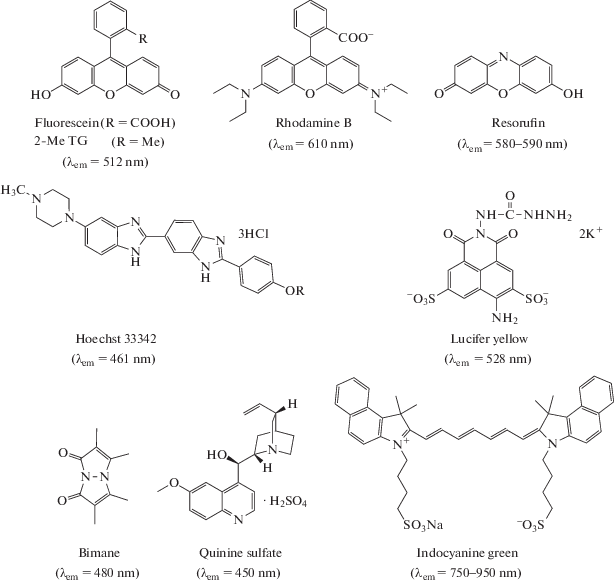
Флуоресцентные органические соединения, представленные многочисленной группой малых молекул, формируют ансамбль эффективных инструментов для визуализации процессов в живых клетках и организмах. С момента первого синтеза флуоресцеина в 1871 г. органические низкомолекулярные флуорофоры успешно используются в клеточной биологии [1–4]. Индивидуальные флуорофоры нашли применение для стехиометрического маркирования практически любого белка даже в живых клетках. Другие флуорофоры обладают свойством специфического связывания с ДНК или с биологическими мембранами. В настоящее время разнообразие свойств таких флуоресцентных меток позволяет определять ионы металлов и рН среды, изучать активность ферментов и сигнальных молекул. Благодаря высокой яркости и фотостабильности метки локализуются с нанометрической точностью современными высокочувствительными методами спектроскопии – PALM (photoactivated localization microscopy), STORM (stochastic optical reconstruction microscopy) [5, 6]. Используемые в практике флуорофоры относятся к группе красителей, представленной большим набором химических структур (рис. 1) [4]. Соединения характеризуются плоской структурой с сопряженной π-электронной системой.
Рис. 1.
Примеры химических структур синтетических органических низкомолекулярных флуорофоров [4], демонстрирующих эмиссию в голубой (с условным центром при ~460 нм), зеленой (~515), желтой (~540), красной (~610) и ближней инфракрасной (~800 нм) областях спектра.
Неорганические низкомолекулярные флуорофоры (называемые квантовыми точками) на основе металлов с полупроводниковыми свойствами дают дополнительные возможности для биологических исследований [7]. Эти метки в виде флуоресцентных солюбилизированных нанокристаллов вводятся в изучаемый объект непосредственно или после присоединения к их поверхности специальных распознающих молекул (антител или олигонуклеотидов), обеспечивающих адресное связывание. Будучи внедренными в полимерные матрицы в форме коллоидных нанокристаллов они становятся чрезвычайно устойчивыми. Квантовые точки обладают уникальными оптическими характеристиками – высокой фотостабильностью, яркой флуоресценций (до 10 цветов в видимом диапазоне) с узким симметричным пиком (в отличие от органических красителей, имеющих длинноволновый “хвост”) и широкой полосой возбуждения, которая позволяет возбуждать нанокристаллы разных цветов одним источником излучения. Эти свойства, а также высокая фотостабильность нанокристаллов, делают их идеальными флуорофорами для многоцветного спектрального мечения биологических объектов. Уникальные свойства нанокристаллов позволяют использовать их практически во всех системах мечения и визуализации биологических объектов (за исключением в качестве экспрессируемых генетически внутриклеточных меток, к которым относятся широко известные флуоресцентные белки). На основе неорганических флуорофоров конструируют элементы электронных и оптоэлектронных устройств, сенсоры для анализов вещества в микрообъемах, различные флуоресцентные, хемилюминесцентные и фотоэлектрохимические датчики.
II. GFP-ПОДОБНЫЕ БЕЛКИ
Наиболее широкое применение в качестве генетически кодируемых меток нашли GFP-подобные флуоресцентные белки (ФБ) из морских организмов [8]. Природные ФБ (~27 кДа) и их синие, зеленые, желтые, красные и дальнекрасные генно-инженерные варианты показывают экстраординарную способность спонтанно генерировать флуоресценцию. Спектральное разнообразие ФБ сделало возможным многоцветное мечение биологических тканей. Благодаря свойству флуоресценции GFP-подобные белки широко используются в клеточной биологии, биотехнологии и биомедицине в качестве биомаркеров для визуализации процессов в живых организмах, мониторинга экспрессии генов, локализации и миграции интересующих белков и клеток, определения жизненно важных внутриклеточных характеристик, таких как рH, концентрация ионов, температуры. Молекулярные инструменты на их основе нашли успешное применение при изучении развития раковой опухоли у животных in vivo, включая перемещение раковых клеток, инвазию, метастазирование, ангиогенез, а также для быстрого скрининга потенциальных лекарственных средств. В этой связи, просматривается хорошая перспектива использования отдельных фототоксичных генно-инженерных вариантов для фотоиндуцированной терапии рака у человека [9]. Уникальность свойств ФБ предопределила создание специфичных биосенсоров различного назначения (в частности, для измерения концентрации ионов, активностей отдельных ферментов), основанных на методе индуктивно-резонансного переноса энергии в донорно-акцепторных FRET (Forster resonance energy transfer) парах. В большинстве случаев, практическое применение ФБ требует создания мономерных вариантов с эмиссией в дальнекрасной области спектра, обладающих высоким квантовым выходом, высокой скоростью созревания хромофора и фотостабильностью. Флуоресцентные белки, обладающие эмиссией в красной и особенно в дальнекрасной (длина волны эмиссии λэм > 610 нм) областях спектра, представляют особый практический интерес для визуализации биологических процессов. Их излучение характеризуется более высокой проницаемостью через биологические ткани по сравнению с эмиссией меньшей длиной волны. Кроме того, излучение в дальнекрасной области, характеризуемое большей длиной волны и, соответственно, меньшей энергией кванта, вызывает меньшее повреждение маркируемых биологических объектов. В более сложных конструкциях биосенсоров исключительно актуальной остается задача создания эффективных FRET-пар на основе желто/оранжевых доноров и красных/дальнекрасных акцепторов. При рациональном конструировании биомаркеров/биосенсоров важно понять, каким образом особенности стереохимии белка определяют его основные фотофизические свойства, включая скорость и полноту созревания, склонность к олигомеризации и характеристики цветового спектра. Эти знания необходимы для разработки рационального подхода по созданию улучшенных вариантов, удовлетворяющих требуемым критериям для практического использования.
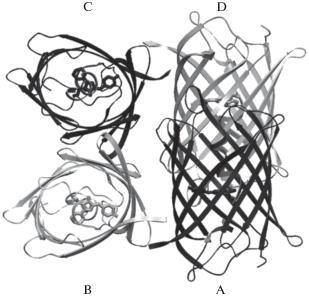
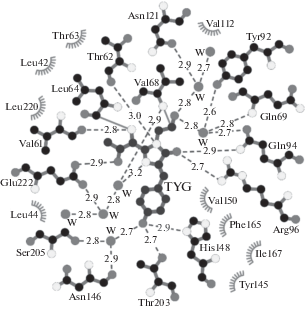
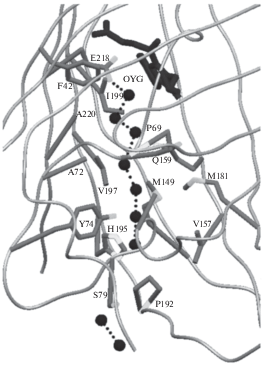
Их пространственная структура принимает форму закрытого с торцов β-бочонка, сформированного из 11-ти антипараллельных β-тяжей и одной α-спирали, в середине которой располагается хромофор, образованный из трех аминокислотных остатков Х-Tyr-Gly в результате посттрансляционной автокаталитической модификации в присутствии молекулярного кислорода (рис. 2) [10–12]. Первый остаток – вариабельный, остальные два – консервативные. Олигомерная структура ФБ дикого типа представлена димерами или тетрамерами (рис. 3). Мономеры в составе димера тяготеют к антипараллельному взаимному расположению, а димеры в составе тетрамера – к перпендикулярному. Поверхность мономеров в тетрамере формирует два типа стабилизирующих олигомерную структуру межсубъединичных интерфейсов: ИФ1 – между субъединицами в одном димере и ИФ2 – между субъединицами в разных димеров (рис. 4) [13]. Олигомерная структура на интерфейсах стабилизирована большим количеством водородных связей между гидрофильными остатками, солевых мостиков между заряженными остатками (Lys/Arg и Glu/Asp) и гидрофобными кластерами между неполярными остатками. Хромофор располагается в центральной полости, сформированной из ближайших аминокислотных остатков (рис. 5). Фотофизические характеристики таких ФБ в значительной степени зависят от структуры зрелого хромофора и его ближайшего аминокислотного окружения. Остатки вокруг хромофора образуют между собой развитую сеть водородных связей, которая в свою очередь активно взаимодействует с хромофором путем образования водородных связей, как прямых, так и опосредованных молекулами воды. В структурах фототоксичных представителей GFP-подобных белков, KillerRed и KillerOrange, обнаружен уникальный канал, простирающийся от области хромофора до торцевой части β-бочонка (рис. 6) [14, 15]. Канал заполнен цепочкой из связанных водородными связями молекул воды, предположительно формирующую транспортную систему для генерируемых токсичных форм кислорода.
Рис. 2.
(a) Пространственная структура GFP-подобных белков, (б) структура хромофора в белках дикого типа (сопряженная система двойных связей выделена серым фоном).
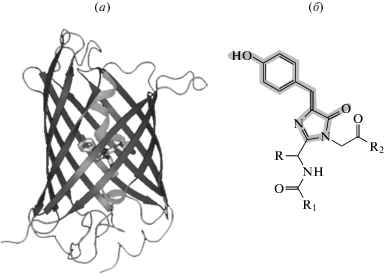
Рис. 4.
Типичные структуры интерфейсов GFP-подобных белков, демонстрирующие стабилизирующее взаимодействие боковых цепей (а) между мономерами в димере и (б) между мономерами разных димеров в тетрамере.
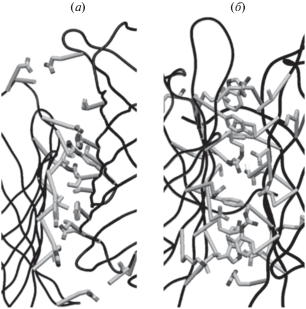
Рис. 6.
Внутренний канал в структуре красного GFP-подобного белка KillerRed с цепочкой связанных водородными связями молекул воды, осуществляющей транспорт активных форм кислорода (показаны шариками) [14].
III. ФЛУОРЕСЦЕНТНЫЕ МЕТКИ НА ОСНОВЕ ФОТОРЕЦЕПТОРОВ
Другая уникальная группа флуоресцентных белков представлена светочувствительными фоторецепторами, способными автокаталитически связывать присутствующие в клетке природные хромофоры. Эти инструменты отличаются природой белковой платформы, представленной в основном бактериальными фитохромами и нуклеотид-связывающими доменами флавопротеинов (LOV, BLUF), а также природой связанного хромофора, среди которых наиболее часто фигурируют биливердин, флавинмоно(ди)нуклеотид (ФМН и ФДН) и флавинадениндинуклеотид (ФАДН) [16–19]. Биомаркеры и биосенсоры на основе природных и генно-инженерных вариантов фоторецепторов обладают уникальными фотофизическими характеристиками, отсутствующими у GFP-подобных маркеров – флуоресценцией в ближней инфракрасной области, независимостью от кислорода, малыми размерами и повышенной фотосенсибилизационной активностью. Благодаря своим уникальным возможностям, они позволяют детектировать, визуализировать и контролировать биологические процессы с исключительно высокой пространственно-временной точностью. Эта особенность обусловливает специфику их применения в качестве генетически кодируемых флуоресцентных биомаркеров, биосенсоров и оптогенетических инструментов. Флуоресцентные биомаркеры на их основе, излучающие в ближней инфракрасной области (λэм > 700 нм), позволяют визуализировать процессы в глубинных отделах биологических тканей. Генетически кодируемые фотосенсибилизаторы, генерирующие активные формы кислорода (синглетный кислород или супероксид анион), позволяют целевым образом инактивировать индивидуальные белки, органеллы, клетки, нуклеиновые кислоты. В качестве оптогенетических меток они нашли эффективное применение в исследованиях работы нервных клеток.
К одной из наиболее перспективных белковых платформ, используемых для создания флуоресцентных биомаркеров, относятся фитохромы. Они найдены в различных источниках – растениях, грибах, водорослях, бактериях и состоят из четырех доменов. Способность таких биомаркеров поглощать и испускать свет в дальнекрасной и ближней-инфракрасной спектральных областях обусловлена способностью одного из доменов белка связывать линейный хромофор тетрапирролового ряда. Одна из наиболее распространенных флуоресцентных конструкций на основе бактериальных фитохромов обладает способностью специфически связывать биливердин – флуорофор, присутствующий в клетке и представляющий собой продукт деградации гемоглобина [16, 20, 21]. Поглощение света вызывает фотоизомеризацию биливердина относительно одной из его связей и последующее его ковалентное связывание в полости белка. На основе фрагмента белка, состоящего из светочувствительного PAS и биливердин-связывающего GAF-доменов, а также на основе только GAF-домена, был осуществлен генно-инженерный дизайн серии эффективных флуоресцентных конструкций с эмиссией в дальнекрасной и ближней инфракрасной областях (рис. 7) [16, 20, 21]. Структура PAS-домена построена из β шпильки и трех α-спиралей, фланкирующих шпильку с трех сторон – слева, справа и сверху. Ключевой хромофор-связывающий GAF-домен принимает структуру α-β-α сэндвича, состоящего из 5-сегментного β-слоя и двух α-спиралей, формирующих хромофор-связывающую полость, а также трех α-спиралей с противоположной от β-слоя стороны. В связывающей полости разных генно-инженерных вариантов фитохромов хромофор может образовывать ковалентную связь, как с двумя остатками Cys20 и Cys253 одновременно, так и с каждым из них по отдельности.
Необходимость использования хромофор-несущей платформы на основе нуклеотид-связывающих доменов (LOV, BLUF) флавопротеинов [17–19, 22, 23] вызвана рядом внутренних ограничений GFP-подобных белков, а именно: потребность в кислороде при созревании хромофора, относительно большие размеры, ограниченная способность проникновения через клеточные мембраны и существенно пониженная стабильность при рН < 5. Генно-инженерные варианты этих доменов способны на начальном этапе нековалентно связывать флуорофоры – ФМН, ФДН или ФАДН (кофакторы, присутствующие в растительных и животных клетках), которые при фотовозбуждении светом в диапазоне 300–500 нм образует ковалентную связь с остатком цистеина белка.
К основному преимуществу ФМН/ФДН/ ФАДН-связывающих конструкций относят независимость их образования от кислорода; при переходе из аэробной среды в анаэробную флуоресцентный сигнал остается неизменным. Они характеризуются небольшим размером – порядка 100–150 аминокислотных остатков (относительно 238 в GFP белках), продолжительным временем жизни, достигающим 5.7 нс, и повышенной стабильностью фотофизических характеристик в широком диапазоне рН. Пространственная структура LOV/BLUF доменов флавопротеинов относится к α/β типу и представляет собой изогнутый смешанного типа β-слой из 5 β-тяжей, фланкированный 4 α-спиралями – по две с каждой стороны (рис. 8) [22, 24–27]. Генно-инженерные методы позволяют адаптировать внутреннюю полость домена к высокоаффинному связыванию ФМН/ ФДН кофакторов. На основе LOV-домена (Arabidopsis phototropin) был сконструирован эффективный флуоресцентный фотосенсибилизатор с высоким квантовым выходом (~0.47), названный miniSOG (mini Singlet Oxygen Generator) [28, 29]. Это небольшая мономерная конструкция (106 остатков; λэм ~ 500/528 нм), связывающая ФМН с субнаномолярной аффинностью и обладающая уникальным свойством фототоксичности. При облучении светом (~450 нм) miniSOG генерирует токсичную форму кислорода (синглетный кислород). Это свойство нашло эффективное использование при мечении, окислении и инактивации целевых белков и клеточных органелл.
IV. БИОМАРКЕРЫ НА ОСНОВЕ ФЛУОРОГЕН-АКТИВИРУЮЩИХ БЕЛКОВ
В последнее время получили развитие новые направления по созданию флуоресцентных конструкций, основанных на органических красителях (флуорогенах), которые в растворе не флуоресцентны, но проявляют яркую флуоресценцию в специфическом нековалентном комплексе с флуороген-активирующими белками (ФАБ) [30].
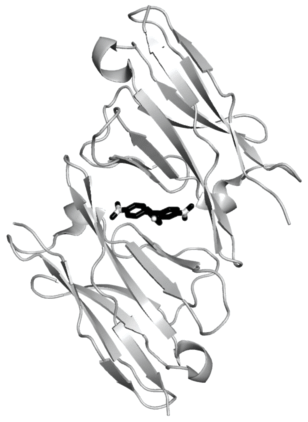
Одно из них связано с конструированием специфических комплексов антител с флуорогенами различной природы. В качестве примера можно привести тройной комплекс легкой цепи (L5*VLs) вариабельного домена антитела человека (несущим по сравнению с диким типом одну мутацию Leu89Ser) с зеленым малахитовым красителем (MG) [31]. Полученный комплекс демонстрирует эмиссию в дальнекрасной области спектра (λэм ~ 670 нм), характеризующуюся повышенной проницаемостью через биологические ткани. Причем его флуоресценция сравнима по яркости (QY ~ ~ 0.24) с такими коммерческими ФБ, как EGFP [32] и mCherry [33]. В структуре тройного комплекса одна молекула MG располагается в полости между двумя расположенными антипараллельно иммунобелковыми мономерами, имеющими β-структурную природу (рис. 9).
Рис. 9.
Структура тройного комплексa легкой цепи вариабельного домена антитела человека с зеленым малахитовым флуорофором [31].
Другое перспективное направление связано с созданием флуоресцентных конструкций на основе липид-переносящих белков – липокалинов (18–40 кДа) [34–36]. Несмотря на существенное различие в аминокислотной последовательности, липокалины характеризуются удивительно похожей пространственной структурой, представляющей собой β-бочонок из 8 антипараллельных скрученных вокруг центральной оси β-тяжей и С‑концевой α-спирали [37–41]. Структура липокалинов характеризуется наличием узкой вытянутой полости, которую с помощью мутагенеза можно адаптировать для специфического связывания и активации низкомолекулярных флуорогенов различной природы. На рис. 10 показана структура генно-инженерного варианта липокалина FluA, полученная из билин-связывающего белка путем 16 аминокислотных замен в связывающей полости и обладающая высоким родством к флуоресцеину [39]. Совсем недавно на основе генно-инженерного варианта бактериального липокалина Blc и синтетического GFP-подобного хромофора была получена серия ярких желтых флуоресцентных биомаркеров, обладающих по сравнению со спектрально-близкими GFP-подобными белками существенно более высокой фотостабильностью [42]. Специфичность связывания в структуре комплекса была достигнута за счет комплементарности взаимного расположения полярных частей хромофора и связывающей полости.
ЗАКЛЮЧЕНИЕ
Широкий диапазон исследований в клеточной биологии, биотехнологии и биомедицине постоянно выдвигает разнообразные требования к созданию специализированных соединений различного цветовой гаммы для практического использования в качестве флуоресцентных маркеров изучаемых биологических объектов. Исследования по созданию и структурно-функциональному изучению новых перспективных биомаркеров продолжаются. Перед разработчиками встают все более сложные задачи по получению совершенных молекулярных инструментов различного цветового диапазона с улучшенными фотофизическими характеристиками. При создании новых флуоресцентных меток с улучшенными свойствами важную роль играют рентгеноструктурные исследования. Они позволяют установить структурно-функциональные взаимосвязи биомаркеров, которые служат руководством для целенаправленного изменения их свойств в соответствии с требованиями современных методов исследований.
Список литературы
Wysocki L.M., Lavis L.D. // Curr. Opin. Chem. Biol. 2011. V. 15. P. 752–759.
van de Linde S., Aufmkolk S., Franke C., Holm T., Klein T., Loschberger A., Proppert S., Wolter S., Sauer M. // Chem. Biol. 2013. V. 20. P. 8–18.
Terai T., Nagano T. // Pflugers Arch. 2013. V. 465. P. 347–359.
Xu W., Zeng Z., Jiang J.H., Chang Y.T., Yuan L. // Angew. Chem. Int. Ed. Engl. 2016. V. 55. P. 13 658–13 699.
Heilemann M., van de Linde S., Schuttpelz M., Kasper R., Seefeldt B., Mukherjee A., Tinnefeld P., Sauer M. // Angew Chem. Int. Ed. Engl. 2008. V. 47. P. 6172–6176.
Shroff H., Galbraith C.G., Galbraith J.A., Betzig E. // Nat. Methods. 2008. V. 5. P. 417–423.
Олейников В.А. // Природа. 2010. Т. 3. С. 22–28.
Chudakov D.M., Matz M.V., Lukyanov S., Lukyanov K.A. // Physiol. Rev. 2010. V. 90. P. 1103–1163.
Hoffman R.M. // Curr. Top. Dev. Biol. 2005. V. 70. P. 121–144.
Tsien R.Y. // Annu. Rev. Biochem. 1998. V. 67. P. 509–544.
Pletnev V.Z., Pletneva N.V., Sarkisyan K.S., Mishin A.S., Lukyanov K.A., Goryacheva E.A., Ziganshin R.H., Dauter Z., Pletnev S. // Acta Crystallogr. D Biol. Crystallogr. 2015. V. 71. P. 1699–1707.
Pletnev V.Z., Pletneva N.V., Lukyanov K.A., Souslova E.A., Fradkov A.F., Chudakov D.M., Chepurnykh T., Yampolsky I.V., Wlodawer A., Dauter Z., Pletnev S. // Acta Crystallogr. D Biol. Crystallogr. 2013. V. 69. P. 1850–1860.
Pletneva N.V., Pletnev S., Pakhomov A.A., Chertkova R.V., Martynov V.I., Muslinkina L., Dauter Z., Pletnev V.Z. // Acta Crystallogr. D Struct. Biol. 2016. V. 72. P. 922–932.
Pletnev S., Gurskaya N.G., Pletneva N.V., Lukyanov K.A., Chudakov D.M., Martynov V.I., Popov V.O., Kovalchuk M.V., Wlodawer A., Dauter Z., Pletnev V. // J. Biol. Chem. 2009. V. 284. P. 32 028–32 039.
Pletneva N.V., Pletnev V.Z., Sarkisyan K.S., Gorbachev D.A., Egorov E.S., Mishin A.S., Lukyanov K.A., Dauter Z., Pletnev S. // PLoS One. 2015. V. 10. P. e0145740.
Anders K., Essen L.O. // Curr. Opin. Struct. Biol. 2015. V. 35. P. 7–16.
Mukherjee A., Schroeder C.M. // Curr. Opin. Biotechnol. 2015. V. 31. P. 16–23.
Shcherbakova D.M., Shemetov A.A., Kaberniuk A.A., Verkhusha V.V. // Annu. Rev. Biochem. 2015. V. 84. P. 519–550.
Buckley A.M., Petersen J., Roe A.J., Douce G.R., Christie J.M. // Curr. Opin. Chem. Biol. 2015. V. 27. P. 39–45.
Piatkevich K.D., Subach F.V., Verkhusha V.V. // Nat. Commun. 2013. V. 4. P. 2153.
Bhattacharya S., Auldridge M.E., Lehtivuori H., Ihalainen J.A., Forest K.T. // J. Biol. Chem. 2014. V. 289. P. 32 144–32 152.
Christie J.M., Hitomi K., Arvai A.S., Hartfield K.A., Mettlen M., Pratt A.J., Tainer J.A., Getzoff E.D. // J. Biol. Chem. 2012. V. 287. P. 22 295–22 304.
Walter J., Hausmann S., Drepper T., Puls M., Eggert T., Dihne M. // PLoS One. 2012. V. 7. P. e43 921.
Anderson S., Dragnea V., Masuda S., Ybe J., Moffat K., Bauer C. // Biochemistry. 2005. V. 44. P. 7998–8005.
Jung A., Domratcheva T., Tarutina M., Wu Q., Ko W.H., Shoeman R.L., Gomelsky M., Gardner K.H., Schlichting I. // Proc. Natl. Acad. Sci. USA. 2005. V. 102. P. 12 350–12 355.
Rollen K., Granzin J., Panwalkar V., Arinkin V., Rani R., Hartmann R., Krauss U., Jaeger K.E., Willbold D., Batra-Safferling R. // J. Mol. Biol. 2016. V. 428. P. 3721–3736.
Wu Q., Gardner K.H. // Biochemistry. 2009. V. 48. P. 2620–2629.
Xu S., Chisholm A.D. // Sci Rep. 2016. V. 6. P. 21 271.
Shu X., Lev-Ram V., Deerinck T.J., Qi Y., Ramko E.B., Davidson M.W., Jin Y., Ellisman M.H., Tsien R.Y. // PLoS Biol. 2011. V. 9. P. e1 001 041.
Bruchez M.P. // Curr. Opin. Chem. Biol. 2015. V. 27. P. 18–23.
Szent-Gyorgyi C., Stanfield R.L., Andreko S., Dempsey A., Ahmed M., Capek S., Waggoner A.S., Wilson I.A., Bruchez M.P. // J. Mol. Biol. 2013. V. 425. P. 4595–4613.
Плетнева Н.В., Плетнев С.В., Богданов А.М., Горячева Е.А., Артемьев И.В., Суслова Е.А., Архипова С.Ф., Плетнев В.З. // Биоорган. химия. 2014. Т. 40. С. 414–420. [Pletneva N.V., Pletnev S.V., Bogdanov A.M., Goriacheva E.A., Artem’ev I.V., Suslova E.A., Arkhipova S.F., Pletnev V.Z. // Russ. J. Bioorg. Chem. 2014. V. 40. P. 383–389.]
Shu X., Shaner N.C., Yarbrough C.A., Tsien R.Y., Remington S.J. // Biochemistry. 2006. V. 45. P. 9639–9647.
Flower D.R. // Biochem. J. 1996. V. 318 (Pt 1). P. 1–14.
Bishop R.E. // Biochim. Biophys. Acta. 2000. V. 1482. P. 73–83.
Skerra A. // FEBS J. 2008. V. 275. P. 2677–2683.
Huber R., Schneider M., Mayr I., Muller R., Deutzmann R., Suter F., Zuber H., Falk H., Kayser H. // J. Mol. Biol. 1987. V. 198. P. 499–513.
Korndorfer I.P., Schlehuber S., Skerra A. // J. Mol. Biol. 2003. V. 330. P. 385–396.
Korndorfer I.P., Beste G., Skerra A. // Proteins. 2003. V. 53. P. 121–129.
Ghosh S., Yu C.L., Ferraro D.J., Sudha S., Pal S.K., Schaefer W.F., Gibson D.T., Ramaswamy S. // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 11 513–11 518.
Campanacci V., Nurizzo D., Spinelli S., Valencia C., Tegoni M., Cambillau C. // FEBS Lett. 2004. V. 562. P. 183–188.
Bozhanova N., Baranov M., Klementieva N., Sarkisyan K., Gavrikov A., Yampolsky I., Zagaynova E., Lukyanov S., Lukyanov K., Mishin A. // Chem. Sci. 2017. V. 8. P. 7138–7142.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия