Биоорганическая химия, 2022, T. 48, № 2, стр. 240-252
Получение гуманизированного антитела 5D3Hu К опухолевому антигену prame
М. В. Ларина 1, *, Ю. П. Финашутина 2, Н. А. Лыжко 2, В. А. Мисюрин 2, В. Н. Новоселецкий 3, Д. А. Долгих 1, 3, О. Н. Солопова 4, А. М. Мойсенович 3, Д. С. Балабашин 1, Т. К. Алиев 1, 5, А. В. Мисюрин 6, М. П. Кирпичников 1, 3
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 ФБГУ “НМИЦ онкологии им. Н.Н. Блохина”
115478 Москва, Каширское ш., 23, Россия
3 Московский государственный университет им. М.В. Ломоносова, биологический факультет
119991 Москва, Ленинские горы, 1/12, Россия
4 Всероссийский научный центр молекулярной диагностики и лечения
117638 Москва, Симферопольский бульвар, 8, Россия
5 Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1/3, Россия
6 ООО “Генотехнология”
117437 Москва, ул. Профсоюзная, 104, Россия
* E-mail: marya.larina@gmail.com
Поступила в редакцию 30.04.2021
После доработки 13.08.2021
Принята к публикации 26.08.2021
- EDN: FIWLNG
- DOI: 10.31857/S0132342322020130
Аннотация
Антиген PRAME, представляющий собой значимую мишень для моноклональных антител, – это онкоспецифический маркер, который активен на всех стадиях дифференцировки опухолевых клеток и вызывает спонтанный T-клеточный ответ. В данной работе на основе моноклонального антитела 5D3 мыши к белку PRAME было сконструировано гуманизированное антитело 5D3Hu и наработано в клетках CHO (клетки опухоли яичников китайского хомячка). Показано, что гуманизированное антитело 5D3Hu обладает высокой аффинностью по отношению к антигену (1.4 нМ), связывается как с рекомбинантным, так и с нативным белком PRAME, а также оказывает ингибирующее действие на пролиферацию PRAME-положительных клеточных линий. Полученные результаты позволяют рассматривать мАТ 5D3Hu в качестве перспективного терапевтического средства для лечения онкологических заболеваний, при которых наблюдается гиперэкспрессия белка PRAME.
ВВЕДЕНИЕ
Белок PRAME (PReferentially expressed Antigen in MElanoma) впервые был выделен из клеток меланомы [1]. PRAME – раково-тестикулярный антиген (РТА), гиперэкспрессия которого наблюдается при многих онкологических заболеваниях, в том числе при меланоме, нейробластоме и онкогематологических заболеваниях [1–8]. При этом в большинстве здоровых тканей, за исключением мужских половых клеток, экспрессия антигена PRAME отсутствует, что делает его привлекательной мишенью для иммунотерапии. Хотя белок PRAME чаще рассматривается как внутриклеточный, были получены данные о его мембраносвязанной форме [9, 10]. Таким образом, антиген PRAME может быть доступен на поверхности опухолевых клеток для терапевтических моноклональных антител (мАТ).
Эффективная и безопасная терапия опухолевых заболеваний основана на идее о том, что злокачественно перерожденные клетки (клетки новообразований) могут быть специфически распознаны и уничтожены, в то время как здоровые клетки останутся неповрежденными. Хотя известно немало опухолеассоциированных антигенов, включая белки с опухолеспецифическими мутациями, измененным характером гликозилирования, изменения экспрессии различных белков в опухолевых клетках, большая часть опухолеспецифических маркеров и опухолеассоциированных антигенов в настоящее время не может быть использована в качестве мишени для направленной терапии с помощью низкомолекулярных агентов или мАТ.
За последние три десятилетия мАТ превратились из инструмента исследователей в эффективный метод терапии заболеваний. Первое терапевтическое мАТ было получено с помощью гибридомной технологии в результате иммунизации мышей. Однако исследования показали [11–13], что введение чужеродного антитела может вызывать сильный иммунный ответ у пациента, прежде всего образование антимышиных антител (HAMA – human anti-mouse antibody). В результате антитела мыши нейтрализуются антителами человека и довольно быстро выводятся из организма, что в итоге приводит к ограниченной эффективности терапии уже на ранней стадии лечения. Более того, при использовании антител мыши или других чужеродных для человека антител для терапии различных заболеваний, последующее лечение другими антителами мыши может быть неэффективным или даже опасным из-за сильного иммунного ответа организма на антитела мыши.
Для снижения иммуногенности мАТ мыши и возможных неблагоприятных реакций, обусловленных иммуногенностью, антитела или их части могут быть гуманизированы. Клинические исследования показали, что гуманизированные антитела в целом значительно менее иммуногенны, чем антитела мыши и химерные мАТ, более безопасны и лучше переносятся пациентами [14, 15].
Ранее нами в результате иммунизации мышей рекомбинантным белком PRAME было получено мАТ 5D3, характеризующееся высокой аффинностью по отношению к данному антигену. Целью настоящей работы было получение гуманизированного мАТ 5D3, исследование его антиген-связывающих свойств и влияния на пролиферацию PRAME-экспрессирующей клеточной линии меланомы человека MelP.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дизайн вариабельных доменов гуманизированного антитела 5D3Hu. Гуманизированное мАТ 5D3Hu получали на основе мАТ 5D3 мыши [16]. Для гуманизации использовали наиболее широко используемый метод гуманизации –трансплантацию гипервариабельных участков (CDR – Complementarity-determining region) мАТ 5D3. Данный метод гуманизации мАТ, полученных с помощью гибридомной технологии, предполагает пересадку CDR-участков антитела мыши на каркасные области вариабельных доменов (FR – Framework Region – каркасная область) иммуноглобулинов человека.
В качестве источника FR-участков антител человека мы использовали последовательности зародышевых линий антител человека, наиболее гомологичные последовательностям мАТ 5D3 мыши. Источником FR-последовательностей могут быть как зрелые мАТ, так и гены зародышевой линии иммуноглобулинов человека. Преимущество использования последовательностей зрелых мАТ – доступность их пространственных моделей, полученных на основе экспериментальных данных (рентгеноструктурного анализа). В то же время использование генов зародышевой линии позволяет избежать потенциальной иммуногенности, связанной с гиперсоматическими мутациями, возникающими в процессе созревания иммуноглобулина G. Также в результате сравнения моделей антител, полученных в результате проведения рентгеноструктурного анализа, было показано, что антитела на основе зародышевых генов имеют более пластичную структуру, чем зрелые антитела [17, 18]. Такая структура теоретически может помогать избегать конформационных конфликтов между CDR-участками мыши и FR-областями человека при гуманизации и, следовательно, предотвращать потерю аффинности.
Аминокислотные последовательности легкой и тяжелой цепей мАТ 5D3 мыши сравнивали с последовательностями зародышевых линий человека в сервисе IgBLAST (https://www.ncbi.nlm.nih.gov/igblast/) и отбирали последовательности зародышевых линий антител человека с большей степенью идентичности и меньшим числом неблагоприятных замен.
Для легкой цепи мАТ 5D3 наибольшую степень идентичности демонстрирует последовательность зародышевой линии IGKV2-30*02 для V-сегмента и IGKJ1*01 для J-сегмента, а для тяжелой цепи наиболее гомологичный V-сегмент относится к зародышевой линии IGHV3-48*01 и J-сегмент – к линии IGHJ4*03. Степень идентичности V-сегментов мАТ 5D3 мыши и выбранных генов иммуноглобулинов человека составила 82.5% для вариабельного домена тяжелой цепи и 85.7% для вариабельного домена легкой цепи.
Участки CDR оставляли без изменений, а каркасные участки антитела мыши заменяли на гомологичные участки антитела человека. Картирование вариабельных доменов мАТ 5D3 и определение границ CDR-участков и FR-областей проводили в соответствии с номенклатурой Кабата [19].
При замене каркасных областей мыши на участки антитела человека может произойти изменение конформации антиген-связывающего участка антитела, что, в свою очередь, может привести к потере аффинности гуманизированного мАТ. Для предотвращения подобного эффекта может оказаться целесообразным введение так называемых “возвратных” аминокислотных замен в каркасные области антитела человека, когда один или несколько а.о. заменяются на соответствующие а.о. мыши. В каркасных областях вариабельных доменов антител есть участки, которые отвечают за стабилизацию гипервариабельных участков [20–22], известные также как зона Вернье. Возвратные замены а.о., входящих в зону Вернье, могут оказать положительный эффект для сохранения аффинности гуманизированного мАТ.
При выборе необходимых возвратных замен также большое значение имеет анализ остатков, участвующих в образовании водородных и электростатических связей с а.о., входящими в CDR. Для идентификации таких остатков FR-областей может быть использован сравнительный конформационный анализ трехмерных моделей вариабельных доменов антител мыши и гуманизированного антитела, полученных с применением алгоритмов молекулярной динамики.
Модели пространственной структуры антитела мыши и гуманизированного антитела получали методом моделирования на основании гомологии с использованием веб-сервиса Rosetta Antibody [23]. Полученные модели дополнительно оптимизировали с учетом растворителя, для чего в программе Gromacs [24] проводили расчет молекулярной динамики моделей в водном растворе при температуре 300 К и физиологической концентрации NaCl в течение 10 нс. Расчет молекулярной динамики показал, что модели принимают свои равновесные конформации уже через 1 нс.
Из анализа полученных пространственных моделей следует, что введенные в ходе гуманизации замены а.о. в FR-участках легкой и тяжелой цепей антитела 5D3 мыши не оказали существенного влияния на ход основной цепи углеродного скелета, и модельные структуры вариабельных доменов антитела 5D3 и гуманизированного антитела 5D3Hu демонстрируют высокое сходство (среднеквадратичное отклонение по Cα-атомам 1.0 Å). Отметим, что некоторые замены, в частности Q18P в VL (вариабельный домен легкой цепи) и P74A в VH (вариабельный домен тяжелой цепи), привели к заметному локальному искажению хода основной цепи углеродного скелета, однако конформация остатков, образующих вероятную поверхность паратопа антитела, не претерпела значительных изменений.
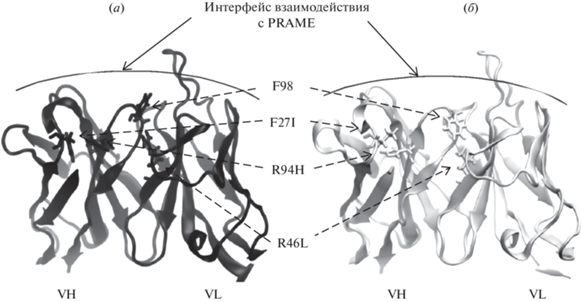
Исключением стали замены I27F (FR1) и H94R (FR3) в VH и L46R (FR2) в VL (рис. 1). Остаток I27 в VH антитела мыши входит в состав паратопа, а остаток H94 непосредственно примыкает к нему изнутри белковой глобулы, будучи полностью заглубленным. При введении замен I27F и H94R (при гуманизации) стэкинг-взаимодействие между новыми остатками приводит к тому, что боковая цепь остатка F27 становится заглубленной, а боковая цепь R94 – частично экспонированной (рис. 1а). Это отражается на электростатических и гидрофобных свойствах поверхности паратопа антитела, что может негативно сказаться на взаимодействии антитела с антигеном. Аналогично, остаток L46 в VL антитела мыши лежит на интерфейсе взаимодействия VH–VL (рис. 1б), и введение замены L46R в VL приводит к вытеснению боковой цепи остатка F98 VH в область, прилегающую к паратопу антитела (рис. 1а). Таким образом, для соответствия конформации паратопа гуманизированного антитела конформации паратопа антитела мыши и сохранения взаимодействия с эпитопом было решено ввести возвратные мутации в каркасных участках VH (F27I, R94H) и VL (R46L) гуманизированного мАТ 5D3Hu.
Рис. 1.
Сравнение моделей вариабельных доменов легкой (VL) и тяжелой (VH) цепей гуманизированного антитела 5D3Hu без обратных замен (а) и родительского мАТ 5D3 мыши (б). Отмечены замены аминокислотных остатков в каркасных областях, значительно повлиявшие на пространственную структуру антитела при пересадке CDR-участков мАТ 5D3 на каркасные области антитела человека: R46L в легкой цепи, F27I и R94H в тяжелой цепи. Также отмечен остаток F98, входящий в состав CDR-участка тяжелой цепи антитела, на положение боковой цепи которого значительно повлияла гуманизация (до введения обратных замен).
На основании полученных аминокислотных последовательностей вариабельных доменов тяжелой и легкой цепей гуманизированного антитела 5D3Hu путем оптимизации кодонов составляли кодирующие последовательности тяжелой и легкой цепей гуманизированного антитела 5D3Hu. Последовательности вариабельных доменов родительского мАТ 5D3 мыши, ближайших гомологов иммуноглобулинов человека и гуманизированного мАТ 5D3Hu приведены на рис. 2.
Рис. 2.
Сравнение аминокислотных последовательностей вариабельных доменов мАТ 5D3, ближайших гомологов иммуноглобулинов человека и полученного гуманизированного мАТ 5D3Hu. Рамками выделены гипервариабельные участки, подчеркиванием отмечены а.о. зоны Вернье, серым выделены обратные замены в каркасных областях гуманизированного мАТ 5D3Hu.

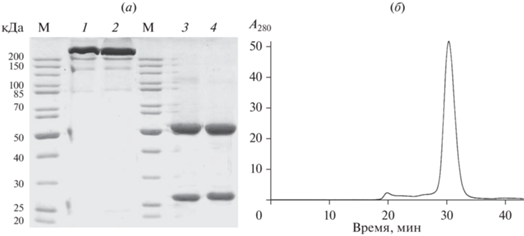
Получение рекомбинантных химерного мАТ 5D3chim и гуманизированного мАТ 5D3Hu. Химерное мАТ 5D3chim (включающее в себя вариабельные домены родительского мышиного антитела и константные домены каппа-цепи и IgG1 человека) было сконструировано для использования в качестве контроля. Для получения рекомбинантных антител 5D3chim и 5D3Hu использовали транзиентную экспрессию в клетках CHO (клетки опухоли яичников китайского хомячка). Клетки CHO трансфицировали двумя экспрессионными плазмидами, полученными на основе вектора pcDNA3.4, кодирующие отдельно легкую (LC) и тяжелую (HC) цепи химерного мАТ 5D3chim и гуманизированного мАТ 5D3Hu. На 5'-конец последовательностей легких и тяжелых цепей антител помещали лидерные пептиды мАТ 5D3 мыши, обеспечивающие секрецию рекомбинантных антител в культуральную среду. Полученными векторами трансфицировали суспензионные клетки CHO. Очистку рекомбинантных химерного и гуманизированного мАТ проводили с помощью аффинной хроматографии на колонке HiTrap MabSelect SuRe. Чистоту полученных мАТ оценивали с помощью ПААГ и ВЭЖХ (рис. 3). В очищенных препаратах рекомбинантных мАТ были выявлены тяжелые и легкие цепи, характеризующиеся подвижностью в ПААГ в восстанавливающих условиях, соответствующей расчетным молекулярным массам 50 и 25 кДа (рис. 3а).
Рис. 3.
Оценка чистоты препаратов рекомбинантных антител 5D3chim и 5D3Hu. (а) – Электрофореграмма препаратов антител 5D3chim и 5D3Hu в 10%-ном SDS-ПААГ: 1, 2 – 4 мкг мАТ 5D3chim и 5D3Hu в невосстанавливающих условиях; 3, 4 – 4 мкг мАТ 5D3chim и 5D3Hu в восстанавливающих условиях, М – маркер молекулярных масс; (б) – аналитическая гель-фильтрационная хроматография очищенного мАТ 5D3Hu.
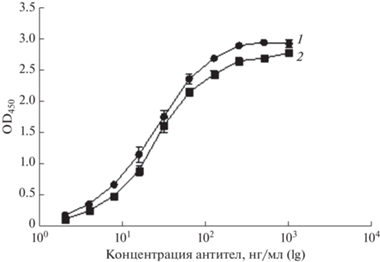
Биохимическая и иммунохимическая характеристика рекомбинантных мАТ 5D3chim и 5D3Hu. Специфическое связывание гуманизированного мАТ 5D3Hu с белком PRAME и сравнение его с химерным мАТ 5D3chim, включающим в себя вариабельные домены родительского антитела мыши и константные домены κ-цепи и IgG1 человека, проводили методом непрямого ИФА. Для проведения ИФА использовали рекомбинантный белок PRAME, экспрессированный в клетках E. coli, как описано ранее [25]. Было показано, что полученное в результате гуманизации мАТ5D3Hu связывается с антигеном PRAME аналогично химерному мАТ5D3chim, содержащему вариабельные домены родительского мАТ. Таким образом, проведение гуманизации не повлияло на способность специфического связывания антитела с антигеном (рис. 4).
Рис. 4.
Непрямой иммуноферментный анализ взаимодействия химерного мАТ 5D3chim (1) и гуманизированного мАТ 5D3Hu (2) с рекомбинантным белком PRAME.
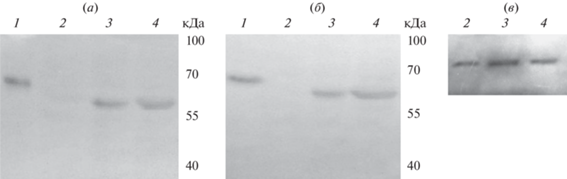
Для подтверждения специфичности полученного гуманизированного мАТ 5D3Hu проводили вестерн-иммуноблоттинг рекомбинантного белка PRAME и суммарных клеточных лизатов PRAME-положительных опухолевых линий MelP и K562, а также линии эмбриональных фибробластов WI-38, не экспрессирующей PRAME. При анализе антител методом иммуноблоттинга было показано (рис. 5), что как родительское мАТ 5D3 мыши, полученное ранее [26], так и гуманизированное мАТ 5D3Hu распознают рекомбинантный белок PRAME – на электрофореграмме он представлен в виде полосы с молекулярной массой ~60 кДа, что соответствует рассчитанной. Также исследуемые антитела распознавали нативный белок в опухолевых клеточных линиях меланомы человека MelP и миелоидного лейкоза K562, где ген PRAME экспрессируется на высоком уровне (данные не приведены). В клетках фибробластов человека, в которых отсутствует экспрессия гена PRAME, ни с одним из исследованных антител белок не был обнаружен.
Рис. 5.
Иммуноблоты рекомбинантного белка PRAME и клеточных лизатов с антителами к белку PRAME: (а) – мАТ 5D3, (б) – мАТ 5D3Hu, (в) – актин. Для анализа использовали 0.5 мкг рекомбинантного белка на дорожку ПААГ и по 30 мкг общего белка лизатов клеток; 1 – рекомбинантный белок PRAME, 2 – линия эмбриональных фибробластов WI-38, 3 – линия меланомы MelP, 4 – линия миелоидного лейкоза К562.
Определение аффинности химерного мАТ 5D3chim и гуманизированного мАТ 5D3Hu. Измерение константы диссоциации (Kd) комплексов мАТ 5D3chim и мАТ 5D3Hu с антигеном проводили с использованием биосенсора Attana Cell A200 (Attana, Швеция). Для этого через чип с иммобилизованным на нем рекомбинантным белком PRAME пропускали раствор с различными концентрациями мАТ 5D3Hu. Кинетические параметры ассоциации и диссоциации были записаны и представлены в виде сенсограмм для гуманизированного мАТ 5D3Hu (рис. 6а) и для химерного мАТ 5D3chim (рис. 6б). Для расчета Kd использовали модель связывания 1 : 1, Kd определяли как соотношение koff/kon.
Рис. 6.
Анализ связывания химерного антитела 5D3chim (а) и гуманизированного мАТ 5D3Hu (б) с белком PRAME и для определения Kd с использованием биосенсора Attana Cell A200.
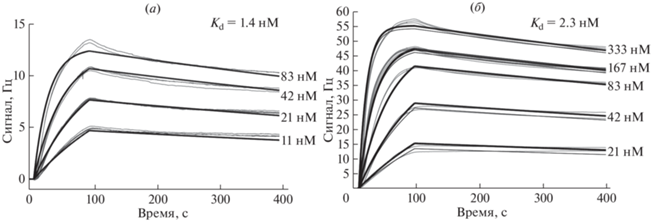
Как показано на рис. 6, мАТ 5D3Hu характеризуется высокой аффинностью по отношению к белку PRAME, при этом Kd составляет 1.4 нМ, что сравнимо с Kd химерного антитела 5D3chim, равной 2.3 нМ.
Выявление белка PRAME в клетках с использованием гуманизированного мАТ 5D3Hu методом флуоресцентной микроскопии. В экспериментах по иммунофлуоресцентному выявлению антигена PRAME использовали клетки линии меланомы человека MelP. В качестве отрицательного контроля использовали клетки линии фибробластов человека WI-38, не экспрессирующие белок PRAME. Большинство литературных данных указывают на внутриклеточную локализацию белка PRAME [3, 6]. В частности, было показано наличие белка PRAME в клеточном ядре и цитоплазме. Однако некоторые исследователи подтвердили наличие PRAME на поверхности опухолевых клеток как больных онкогематологическими заболеваниями, так и на поверхности клеток опухолевых линий человека K562 и THP-1 [10]. Это особенно важно, т.к. наличие белка на поверхности опухолевых клеток – необходимое условие для его использования в качестве мишени для иммунотерапии, в том числе с помощью моноклональных антител.
При исследовании образцов, полученных после иммунофлуоресцентной обработки гуманизированными антителами 5D3Hu (рис. 7а), антителами 5D3 мыши (рис. 7б), а также коммерческими антителами к белку PRAME (рис. 7в) живых клеток меланомы человека линии MelP, на поверхности клеток был выявлен флуоресцентный сигнал. Его распределение носило как аморфный, так и кластеризованный характер во всех опытных образцах. В то же время на поверхности PRAME-отрицательных клеток WI-38 сигнала обнаружено не было (рис. 7г).
Рис. 7.
Выявление белка PRAME на клеточной мембране с использованием конфокальной микроскопии. Клетки меланомы человека линии MelP, обработанные мАТ 5D3Hu (а, зеленый), мАТ 5D3 (б, зеленый) и коммерческими поликлональными антителами к PRAME (в, зеленый). Ядра выявляли с применением красителя Hoechst 33342 (синий). В качестве контроля использовали PRAME-негативные клетки линии WI-38 (г). Масштабный отрезок – 10 мкм.
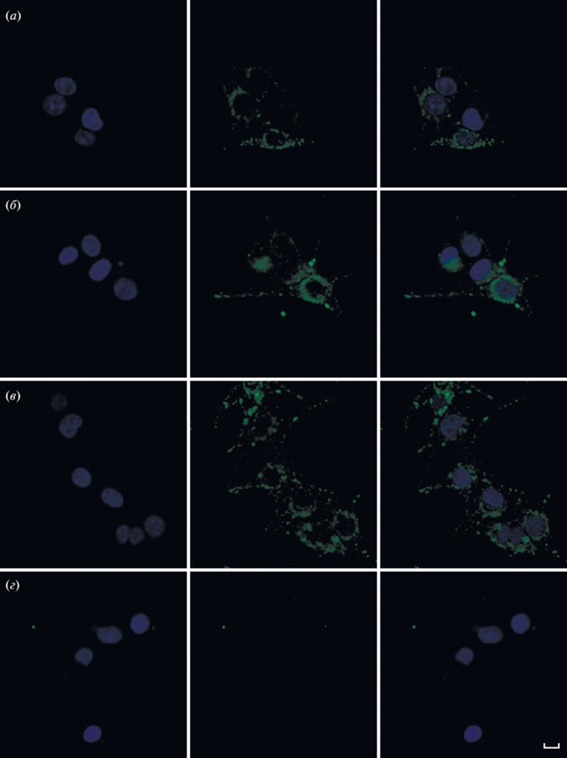
Полученные результаты демонстрируют наличие белка PRAME, доступного для связывания с мАТ, на поверхности клеток линии меланомы человека MelP. Также было показано, что гуманизированное мАТ 5D3Hu связывается с нативным белком PRAME на поверхности клеток, как и родительское мАТ 5D3 мыши (рис. 7а и 7б), что подтверждает сохранение специфичности антитела 5D3Hu после гуманизации и возможность рассматривать его в качестве перспективного средства для иммунотерапии PRAME-позитивных опухолей, в частности меланомы.
Антипролиферативная активность гуманизированного мАТ 5D3Hu. Для изучения антипролиферативного действия гуманизированного мАТ 5D3Hu на PRAME-позитивные опухолевые клетки проводили серию экспериментов по измерению клеточного индекса линии меланомы человека MelP с использованием клеточного анализатора в режиме реального времени xCELLigence. Для оценки антипролиферативной активности мАТ 5D3Hu проводили совместную инкубацию клеток линии MelP с гуманизированным антителом 5D3Hu или мАТ 5D3 мыши с конечными концентрациями в лунке 100 мкг/мл, а также с гуманизированным мАТ 1C5Hu (специфичным к гликопротеину вируса бешенства) с конечной концентрацией в лунке 100 мкг/мл, которое использовали в качестве отрицательного контроля.
Полученные результаты эксперимента по совместной инкубации антител с клетками линии MelP, демонстрирующие ингибирующую пролиферацию активность в отношении PRAME-позитивной клеточной линии, представлены на рис. 8. Скорость роста клеток после добавления к ним PBS и антитела 1C5 не различалась (p = 0.5465). По сравнению с клетками, растущими при добавлении к ним контрольного антитела 1C5, у клеток, инкубированных с антителами против PRAME, наблюдалось замедление клеточного роста. Было показано статистически значимое снижение скорости пролиферации клеток MelP после добавления к ним мАТ 5D3 мыши и гуманизированного мАТ 5D3Hu, которое составило, соответственно, 19% (p = 0.0026) и 18% (p = = 0.0031) по сравнению с контролем. Статистически значимых различий влияния на клеточную пролиферацию линии MelP между мАТ 5D3 мыши и гуманизированным мАТ 5D3Hu не наблюдалось (p = 0.7814).
Рис. 8.
Изменение клеточного индекса клеток меланомы человека линии MelP при их инкубации с мАТ 5D3Hu и 5D3 с конечной концентрацией в лунке 100 мкг/мл (красная линия – 1C5 – гуманизированное антитело к вирусу бешенства; зеленая линия – 5D3Hu; синяя линия – 5D3). Стрелкой отмечено время добавления мАТ.
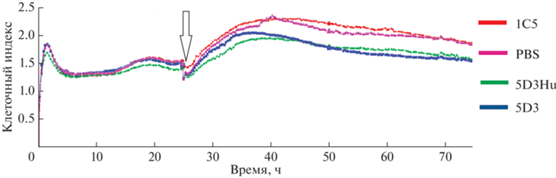
Таким образом, было показано, что гуманизированное антитело 5D3Hu обладает антипролиферативной активностью по отношению к клеткам линии MelP, как и родительское мАТ 5D3 при сравнении с контрольным антителом, не связывающим белок PRAME. Полученные данные подтверждают сохранение антипролиферативной активности мАТ 5D3 после гуманизации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и оборудование. В работе использовали следующие реактивы: питательные среды DMEM и RPMI 1640, эмбриональную телячью сыворотку (FCS), L-глутамин (Invitrogen, США), раствор пенициллин-стрептамицин-фунгизон (Anti-anti) (Invitrogen, США), флаконы и планшеты для культивирования эукариотических клеток (Greiner Bio-One, США), планшеты для ИФА (Nunc MaxiSorp, Thermo Scientific, Дания), однокомпонентный субстрат тетраметилбензидин (TMB) (НПО “БиоТест Системы”, Россия), эндонуклеазы рестрикции (Thermo Scientific, США), ДНК-полимеразу Tersus (Евроген, Россия), DMSO (Sigma, США), бактоагар, дрожжевой экстракт, триптон (BD, Франция). Остальные химические реактивы были получены из коммерческих источников и использованы без предварительной очистки.
Оборудование: наноспектрофотометр Implen P300 (Implen, Германия); камера для горизонтального электрофореза 15 × 20 (Хеликон, Россия); камера для вертикального электрофореза Mini-Protean 3 cell, источник питания Power Pack Basic (Bio-Rad, США); колонка с носителем HiTrap MabSelect Sure объемом 5 мл (GE Healthcare Life Sciences, США); хроматограф Acta Pure 25, суперпетля объемом 150 мл, колонка Superdex 200 GL объемом 23.5 мл (GE Healthcare Life Sciences, США).
Клетки. В работе использовали штамм E. coli XL1_Blue (recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F' proAB lacIqZΔM15 Tn10 (Tetr)]) (Stratagene, США).
Конструирование экспрессионных векторов для получения рекомбинантных химерного мАТ 5D3chim и гуманизированного мАТ 5D3Hu. Для получения экспрессионных векторов, кодирующих легкую и тяжелую цепи химерного мАТ 5D3chim, использовали вариабельные домены мАТ 5D3 мыши и константные области легкой κ-цепи и тяжелой цепи IgG1 человека. Фрагменты ДНК, кодирующие вариабельные домены мАТ 5D3, были получены в результате реакции обратной транскрипции и амплификации, как описано ранее [21]. Вариабельные домены были объединены с лидерным пептидом и соответствующими константными областями (константным доменом легкой κ-цепи человека и константной областью антитела IgG1 человека), а на 5'-конец каждой цепи антитела была добавлена последовательность Козак. Экспрессионные кассеты, кодирующие легкую и тяжелую цепи мАТ 5D3chim, клонировали отдельно по сайтам NheI/XhoI в экспрессионый вектор pcDNA 3.4 (Invitrogen, США). Кодирующие последовательности вариабельных доменов VH и VL гуманизированного мАТ 5D3Hu получали методом химико-ферментативного синтеза из перекрывающихся олигонуклеотидов. Вариабельные домены также были объединены с лидерным пептидом и соответствующими константными областями (константным доменом легкой κ-цепи человека и константной областью антитела IgG1 человека) и клонированы отдельно по сайтам NheI/XhoI в экспрессионный вектор pcDNA3.4.
Транзиентная экспрессия химерного мАТ 5D3chim и гуманизированного мАТ 5D3Hu в клетках CHO. Для секреторной экспрессии химерного антитела 5D3chim и гуманизированного антитела 5D3Hu использовали клетки линии, созданной на основе линии CHO (клетки яичников китайского хомячка). За 24 ч до трансфекции клетки пересевали в концентрации 4 × 106 кл./мл в 30 мл культуральной среды в колбу Эрленмейера. Трансфекцию клеток проводили с использованием трансфекционного агента Lipofectamine 2000 (Invitrogen, США) в соответствии с рекомендациями производителя. Для трансфекции использовали комбинацию очищенных плазмидных векторов, содержащих отдельно гены легкой и тяжелой цепей гуманизированного антитела 5D3Hu либо химерного мАТ5D3chim. Культивирование проводили в течение 14 сут при 37°С в атмосфере, содержащей 8% СО2, при перемешивании на орбитальном шейкере со скоростью 135 об/мин до снижения количества живых клеток в культуре до уровня 0.3 × 106 кл./мл.
После завершения культивирования клетки осаждали центрифугированием при скорости вращения 1200 об/мин в течение 10 мин. Затем супернатант, содержащий мАТ 5D3Hu или 5D3chim, центрифугировали в течение 30 мин при скорости вращения 4000 об/мин при 4°С и стерилизовали раствор мАТ фильтрованием через мембрану с размером пор 0.22 мкм. К супернатанту добавляли 0.1 объема 10× PBS, азид натрия и PMSF до конечных концентраций 7.5 и 1.4 мМ соответственно.
Выделение и очистка мАТ 5D3Hu и 5D3chim. Очистку гуманизированного мАТ 5D3Hu и 5D3chim проводили методом аффинной хроматографии на колонке объемом 5 мл, содержащей носитель HiTrap MabSelect SuRe (GE Healthcare, США). Колонку уравновешивали 5 объемами буфера Tris-HCl (20 мМ Tris-HCl, 150 мМ NaCl, pH 7.2) и наносили культуральную жидкость со скоростью 2–3 мл/мин при давлении не более 0.5 МПа. После этого колонку промывали 5 объемами буфера Tris-HCl (20 мМ Tris-HCl, 150 мМ NaCl, pH 7.2). Антитела элюировали цитратным буфером (20 мМ лимонная кислота, 200 мМ NaCl, рН 3.0). Фракцию, содержащую целевой белок, нейтрализовали добавлением 0.1 объема буфера для нейтрализации (1 М Tris-HCl, pH 8.0). Детекцию белков в ходе хроматографии осуществляли по поглощению при длине волны 280 нм. Элюат диализовали против PBS, дважды меняя раствор, и стерилизовали фильтрацией через фильтры Millex-GV (0.22 мкм), полученные препараты хранили при 4°C.
Наличие и чистоту целевого белка в полученной фракции анализировали с помощью электрофореза в восстанавливающих и невосстанавливающих условиях в 10%-ном ПААГ по методу Лэммли [27]. В лунки вносили по 3 мкг исследуемого образца. В качестве стандартов молекулярных масс использовали смесь белков 10–200 кДа (Thermo Fisher Scientific, США). Для разделения белка в восстанавливающих условиях образец анализировали в присутствии 2-меркаптоэтанола. Чистоту препарата определяли с помощью аналитической гель-фильтрационной хроматографии на колонке Superdex 200-10/300-GL (GE Healthcare, США) в 100 мМ Tris-HCl-буфере (pH 8.0), содержащем 150 мМ NaCl.
Непрямой ИФА. Рекомбинантный белок PRAME сорбировали в лунках иммунологического планшета в концентрации 2 мкг/мл в карбонатном буфере в течение ночи при 4°С. Планшет промывали трижды буфером PBST (фосфатно-солевой буфер с 0.05% Tween-20), затем блокировали раствором 0.5% БСА в PBS при комнатной температуре в течение часа и промывали 3 раза PBSТ. Антитела наносили в 100 мкл блокирующего буфера в концентрациях от 1000 до 2 нг/мл с двукратными разведениями. Планшет промывали 5 раз PBST, затем наносили раствор антител против IgG человека, конъюгированных с пероксидазой хрена (A9044, Sigma, США), в разведении 1 : 20 000 и инкубировали при комнатной температуре в течение часа. Планшет промывали 7 раз PBSТ, затем в лунки добавляли раствор субстрата – тетраметилбензидина (Иммунотех, Россия). Реакцию останавливали, добавляя 50 мкл 10%-ного раствора серной кислоты.
Оптическое поглощение измеряли при длине волны 450 нм на планшетном спектрофотометре Microplate Reader 680 (Bio-Rad, США).
Определение константы диссоциации (Kd). Аффинность гуманизированного антитела 5D3Hu измеряли на биосенсоре Attana Cell A200 (Attana, Швеция), использующем технологию QCM (quartz crystal microbalance). Рекомбинантный белок PRAME (40 мкг/мкл) иммобилизировали на сенсорный чип LNB-carboxyl, пришивая белок ковалентно через аминогруппы. Эксперименты по связыванию гуманизированного антитела 5D3Hu с рекомбинантным белком PRAME проводили в буферном растворе HEPES, содержащем 0.005% полисорбата 20 (25 мкл/мин, 22°C). Четыре серийных разведения гуманизированного антитела 5D3Hu (в концентрацииях 12.5, 6.3, 3.1 и 1.6 мкг/мл) либо пять серийных разведений химерного мАТ 5D3chim (50, 25, 12.5, 6.3 и 3.1 мкг/мл) наносили на чип с иммобилизованным белком PRAME в трех повторах, каждое разведение в случайном порядке. Чип регенерировали раствором глицина (10 мМ, pH 1.5) в течение 30 с перед каждым циклом связывания. Перед каждой инъекцией антитела проводили инъекцию буфера, которую использовали как референс при обработке результатов с помощью программного обеспечения Attana Attester (Attana, Швеция). Для расчета Kd использовали модель связывания 1 : 1.
Иммуноблоттинг. После электрофоретического разделения препарата рекомбинантного белка PRAME и клеточных лизатов белки из геля переносили на PVDF-мембрану с использованием буфера для переноса (25 мМ Tris, 192 мМ глицин, 20%-ный метанол, рН 8.5). Неспецифическую сорбцию на мембране блокировали 5%-ным раствором БСА в течение 2 ч при комнатной температуре и промывали 3 раза буфером TBST (20 мМ Tris, 150 мМ NaCl, 0.1% Tween-20, рН 7.6). После этого мембрану помещали в раствор различных антител к белку PRAME в конечной концентрации 3 мкг/мл и инкубировали при 4°С в течение ночи. После трехкратной промывки буфером TBST мембрану инкубировали в растворе соответствующего антивидового антитела, конъюгированного с пероксидазой хрена, в течение 1 ч при комнатной температуре. Далее мембрану 3 раза промывали TBST и добавляли однокомпонентный преципитирующий субстрат диаминобензидин. Мембрану инкубировали в течение 5–10 мин, после чего реакцию останавливали, промывая мембрану дистиллированной водой.
Конфокальная микроскопия. Суспензию клеток меланомы человека линии MelP с концентрацией 104 кл./мл в среде культивирования состава DMEM (ПанЭко, Россия), содержащей 10% фетальной бычьей сыворотки (HyClone, США) и 100 мкг/мл гентамицина (Gibco, США), вносили в 35-мм чашку Петри, содержащую стерильное покровное стекло, по 2 мл на каждую чашку, и помещали во влажный инкубатор с установленной температурой 37°С и 5%-ным содержанием СО2. На третий день культивирования образцы трехкратно отмывали холодным раствором PBS и инкубировали с антителами 5D3Hu (1 : 600), 5D3 мыши (1 : 1200) или коммерческими антителами к PRAME (1 : 100, поликлональные антитела кролика к PRAME, HPA045153, Atlas Antibodies, Швеция) при 4°С в течение 45 мин. После этого клетки пятикратно отмывали от несвязавшихся антител и добавляли вторичные антитела мыши к антителам IgG козы, меченные красителем Alexa 488 (Invitrogen, США), антитела козы к IgG человека, меченные красителем Alexa 488, и антитела козы к IgG кролика, меченные красителем Alexa 488 (Invitrogen, США), при 4°С в течение 20 мин, несвязавшиеся антитела трижды отмывали PBS. Изображения получали с применением микроскопа Eclipse Ti-E с конфокальным модулем A1 (Nikon Corporation, Япония) и объективом Apo TIRF Plan Fluor 63 × 1.49 (Nikon Corporation, Япония).
Ингибирование пролиферации клеточной линии MelP. Для изучения антипролиферативного действия гуманизированного мАТ 5D3Hu на PRAME-позитивные опухолевые клетки проводили серию экспериментов по измерению клеточного индекса линии меланомы человека MelP с использованием клеточного анализатора в режиме реального времени xCELLigence (ACEA Biosciences, США). Изучение изменения пролиферативного потенциала клеток с использованием системы xCELLigence происходит за счет измерения электрического импеданса, который измеряется при контакте плазматической мембраны клетки с поверхностью электрода и выражается в изменении электрического потенциала клетки. Изменение величины электрического импеданса под действием антител (либо других цитотоксических агентов) показывает изменение клеточного индекса. Данные изменения выражаются в виде графика в логарифмической системе координат в режиме реального времени.
Клетки линии MelP инкубировали совместно с гуманизированным антителом 5D3Hu и мАТ 5D3 мыши с конечными концентрациями в лунке 100 мкг/мл. В качестве отрицательного контроля использовали гуманизированное мАТ 1C5Hu (специфичное к гликопротеину вируса бешенства) с конечной концентрацией в лунке 100 мкг/мл. Клетки линии MelP снимали с подложки с помощью среды RPMI 1640 (Sigma-Aldrich, США) и ресуспендировали в той же среде. Затем подсчитывали концентрации клеток в камере Горяева, клетки засевали в лунки 16-луночного культурального планшета с концентрацией клеток 2.5 × 104 кл./мл c 10%-ным содержанием фетальной бычьей сыворотки. Время инкубации клеток в лунках прибора xCELLingence составляло 24 ч до добавления моноклональных антител либо PBS при 37°С и 5% СО2. После 24 ч инкубации клеток очередной цикл работы прибора приостанавливали. К клеткам в лунках культурального 16-луночного планшета добавляли гуманизированное антитело 5D3Hu, мАТ 5D3 мыши либо контрольное мАТ 1C5Hu до конечной концентрации 100 мкг/мл. После инкубации клеток с исследуемыми антителами в течение 48 ч эксперимент останавливали и рассчитывали процент ингибирования пролиферации клеток MelP по сравнению с контролем по следующий формуле:
Для статистического анализа данных был выбран критерий Уилкоксона, поскольку полученные данные имели ненормальное распределение. Различия считали статистически значимыми при p < 0.05. Для анализа использовали программу STATISTICA v.10 (StatSoft Inc., США).
ЗАКЛЮЧЕНИЕ
В данной работе проведена гуманизация антитела 5D3 мыши, распознающего опухолеспецифичный антиген PRAME, гиперэкспрессия которого наблюдается при многих онкологических заболеваниях, а в здоровых тканях он отсутствует. Гуманизация проведена методом трансплантации CDR-участков антитела мыши, при этом в качестве доноров каркасных областей вариабельных доменов мАТ были использованы последовательности генов антител зародышевой линии человека. Для предотвращения возможной потери аффинности, которая нередко происходит при гуманизации антител, на основании сравнения и анализа пространственных моделей родительского антитела мыши и гуманизированного антитела были выбраны возвратные замены. Были выявлены аминокислотные остатки FR-участков последовательностей иммуноглобулинов человека, которые предположительно влияли на конформацию паратопа антитела. С целью уменьшения конформационных различий паратопов гуманизированного антитела и родительского антитела мыши было решено ввести возвратные мутации в каркасные участки VH (F27I, R94H) и VL (R46L) гуманизированного мАТ 5D3Hu. Гуманизированное мАТ 5D3Hu, как и контрольное химерное антитело 5D3chim, содержащее вариабельные домены мАТ 5D3 мыши, было экспрессировано в транзиентной культуре клеток СНО.
Показано, что полученное гуманизированное антитело 5D3Hu специфически связывается с рекомбинантным белком PRAME, а также распознает нативный белок PRAME в лизатах PRAME-экспрессирующих клеточных линий MelP и K562. Аффинность полученного мАТ 5D3Hu по отношению к антигену не изменилась в результате гуманизации, при этом Kd составила 1.4 нМ, что не уступает Kd химерного антитела 5D3chim, равной 2.3 нМ. Также методом флуоресцентной микроскопии было показано, что белок PRAME на поверхности клеток линии меланомы человека MelP связывается как с гуманизированным мАТ 5D3Hu, так и с родительским мАТ 5D3.
С использованием клеточного анализатора xCELLigence в режиме реального времени было исследовано влияние антител к белку PRAME на скорость роста линии MelP. Полученные результаты демонстрируют антипролиферативную активность как гуманизированного мАТ 5D3Hu, так и мАТ 5D3 мыши в отношении PRAME-позитивной клеточной линии.
Таким образом, в данной работе было получено гуманизированное мАТ 5D3Hu, специфически связывающее раково-тестикулярный антиген PRAME и обладающее потенциально низкой иммуногенностью, что позволяет рассматривать мАТ 5D3Hu в качестве перспективного терапевтического средства для лечения онкологических заболеваний, при которых наблюдается гиперэкспрессия белка PRAME.
Список литературы
Epping M.T., Bernards R. // Cancer Res. 2006. V. 66. P. 10639–10642. https://doi.org/10.1158/0008-5472.CAN-06-2522
Oberthuer A., Hero B., Spitz R., Berthold F., Fischer M. // Clin. Cancer Res. 2004. V. 10. P. 4307–4313. https://doi.org/10.1158/1078-0432.CCR-03-0813
Wadelin F., Fulton J., McEwan P.A., Spriggs K.A., Emsley J., Heery D.M. // Mol. Cancer. 2010. V. 9. P. 1–10. https://doi.org/10.1186/1476-4598-9-226
Proto-Siqueira R., Figueiredo-Pontes L.L, Panepucci R.A., Garcia A.B., Rizzatti E.G., Nascimento F.M., Ishikawa H.C.F., Larson R.E., Falcão R.P., Simpson A.J., Gout I., Filonenko V., Rego E.M., Zago M.A. // Leukemia Res. 2006. V. 30. P. 1333–1339. https://doi.org/10.1016/j.leukres.2006.02.031
Pellat-Deceunynck C., Mellerin M.P., Labarrière N., Jego G., Moreau-Aubry A., Harousseau J.L., Jotereau F., Bataille R. // Eur. J. Immunol. 2000 V. 30. P. 803–809. https://doi.org/10.1002/1521-4141(200003)30:3<803: :AID-IMMU803>3.0.CO;2-P
Roszik J., Wang W.-L., Livingston J.A., Roland C.L., Ravi V., Yee C., Hwu P., Futreal A., Lazar A.J., Patel S.R., Conley A.P. // Clin. Sarcoma Res. 2017. V. 7. P. 1–7. https://doi.org/10.1186/s13569-017-0077-3
Al-Khadairi G., Decock J. // Cancers. 2019. V. 11. P. 984. https://doi.org/10.3390/cancers11070984
Xu Y., Zou R., Wang J., Wang Z.W., Zhu X. // Cell Proliferation. 2020. V. 53. P. e12770. https://doi.org/10.1111/cpr.12770
Ikeda H., Lethe B., Lehmann F., van Baren N., Baurain J.F., de Smet C., Chambost H., Vitale M., Moretta A., Boon T., Coulie P.G. // Immunity. 1997. V. 6. P. 199–208. https://doi.org/10.1016/s1074-7613(00)80426-4
Pankov D., Sjöström L., Kalidindi T., Lee S.G., Sjöström K., Gardner R., McDevitt M.R., O’Reilly R., Thorek D.L., Larson S.M., Veach D. // Oncotarget. 2017. V. 8. P. 65917. https://doi.org/10.1016/s1074-7613(00)80426-4
Fagnani R. // Immunol. Series. 1994. V. 61. P. 3–22.
Khazaeli M.B., Conry R.M., LoBuglio A.F. // J. Immunother. Emphasis Tumor Immunol. 1994. V. 15. P. 42–52. https://doi.org/10.1097/00002371-199401000-00006
Kuus-Reichel K., Grauer L.S., Karavodin L.M., Knott C., Krusemeier M., Kay N.E. // Clin. Diagn. Lab. Immunol. 1994. V. 4. P. 365–372. https://doi.org/10.1128/cdli.1.4.365-372.1994
Mateo C., Moreno E., Amour K., Lombardero J., Harris W., Perez R. // Immunotechnology. 1997. V. 3. P. 71–81. https://doi.org/10.1016/s1380-2933(97)00065-1
Stephens S., Emtage S., Vetterlein O., Chaplin L., Bebbington C., Nesbitt A., Sopwith M., Athwal D., Novak C., Bodmer M. // Immunology. 1995. V. 85. P. 668–674.
Мисюрин В.А., Финашутина Ю.П., Турба А.А., Ларина М.В., Солопова О.Н., Лыжко Н.А., Кесаева Л.А., Касаткина Н.Н., Алиев Т.К., Мисюрин А.В., Кирпичников М.П. // Доклады РАН. Науки о жизни. 2020. Т. 492. № 1. С. 293–296. https://doi.org/10.31857/S2686738920030166
Wedemayer G.J., Patten P.A., Wang L.H., Schultz P.G., Stevens R.C. // Science. 1997. V. 276. P. 1665–1669. https://doi.org/10.1126/science.276.5319.1665
Zimmermann J., Oakman E.L., Thorpe I.F., Shi X., Abbyad P., Brooks C.L., Boxer S.G., Romesberg F.E. // PNAS. 2006. V. 103. P. 13722–13727. https://doi.org/10.1073/pnas.0603282103
Kabat E.A. // Sequences of Immunological Interest. 5th edn. Public Health Service, NIH, Bethesda, Md, USA, 1991.
Foote J., Winter G. // J. Mol. Biol. 1992. V. 224. P. 487–499. https://doi.org/10.1016/0022-2836(92)91010-m
Queen C., Schneider W.P., Selick H.E., Payne P.W., Landolfi N.F., Duncan J.F., Avdalovic N.M., Levitt M., Junghans R.P., Waldmann T.A. // Proc. Natl. Acad. Sci. USA. 1989. V. 86. P. 10029–10033. https://doi.org/10.1073/pnas.86.24.10029
Makabe K., Nakanishi T., Tsumoto K., Tanaka Y., Kondo H., Umetsu M., Sone Y., Asano R., Kumagai I. // J. Biol. Chem. 2008. V. 283. P. 1156–1166. https://doi.org/10.1074/jbc.M706190200
Weitzner B.D., Jeliazkov J.R., Lyskov S., Marze N., Kuroda D., Frick R., Adolf-Bryfogle A., Biswas N., Gray J.J. // Nat. Protoc. 2017. V. 12. P. 401–416. https://doi.org/10.1038/nprot.2016.180
Abraham M.J., Murtola T., Schulz R., Páll S., Smith J.C., Hess B., Lindahl E. // SoftwareX. 2015. V. 1–2. P. 19–25. https://doi.org/10.1016/j.softx.2015.06.001
Финашутина Ю.П., Мисюрин А.В., Ахлынина Т.В., Лыжко Н.А., Крутов А.А., Аксенова Е.В., Мисюрин В.А., Барышников А.Ю. // Рос. биотерапевтич. журнал. 2015. Т. 14. № 3. С. 29–36.
Ларина М.В., Алиев Т.К., Солопова О.Н., Позднякова Л.П., Коробова С.В., Якимов С.А., Свешников П.Г., Долгих Д.А., Кирпичников М.П. // Биоорг. химия. 2015. Т. 41. С. 316–326. [Larina M.V., Yakimov S.A., Dolgikh D.A., Kirpichnikov M.P., Aliev T.K., Solopova O.N., Pozdnyakova L.P., Sveshnikov P.G., Korobova S.V. // J. Bioorg. Chem. 2015. V. 41. P. 280–288.] https://doi.org/10.1134/S106816201503005X
Laemmli U.K. // Nature. 1970. V. 227. P. 680–685. https://doi.org/10.1038/227680a0
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


