Биоорганическая химия, 2022, T. 48, № 2, стр. 232-239
Распределение жирных кислот в запасных и структурных липидах голотурии Eupentacta fraudatrix
Е. В. Ермоленко 1, *, Т. В. Сикорская 1, И. Ю. Долматов 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского Дальневосточного отделения РАН
690041 Владивосток, ул. Пальчевского, 17, Россия
* E-mail: ecrire_711@mail.ru
Поступила в редакцию 01.06.2021
После доработки 09.10.2021
Принята к публикации 13.10.2021
- EDN: ZMGPKM
- DOI: 10.31857/S0132342322020087
Аннотация
Голотурия Eupentacta fraudatrix широко используется для изучения механизмов регенерации и выделения биологически активных веществ. Данные о содержании липидов и составе E. fraudatrix ограничиваются описанием состава жирных кислот (ЖК). Впервые были идентифицированы молекулярные виды запасных и структурных липидов кишечника E. fraudatrix различными методами хроматографии и масс-спектрометрии. Триацилглицерины как запасные липиды характеризуются высокой концентрацией трофических маркеров ЖК. Среди структурных липидов фосфатидилэтаноламины и фосфатидилхолины характеризуются высоким уровнем молекулярных видов с простой эфирной связью. Фосфатидилсерины (ФС) и фосфатидилинозитолы (ФИ) отличаются от других липидов преобладанием длинноцепочечных ЖК в составе, среди которых обнаружена кислота 23:1n-9, характерная для голотурий. Изучение липидома морских организмов может способствовать пониманию путей биосинтеза и распределения маркерных жирных кислот в липидах.
ВВЕДЕНИЕ
Голотурии (Holothuroidea) – один из наиболее широко распространенных классов низших беспозвоночных. Они играют важную роль в экосистеме океана, расщепляя детрит и органические вещества для бактерий и, таким образом, возвращая питательные вещества обратно в Мировой океан [1]. Голотурии традиционно используются в пищу в Юго-Восточной Азии.
Некоторые виды голотурий обладают защитным механизмом, называемым эвисцерация: животные могут выбрасывать свои внутренние органы (например, кишечник и дыхательные пути) из своего тела при воздействии стресса (например, химического стресса или физических манипуляций), при этом потерянные органы могут быть быстро регенерированы [2, 3]. Голотурия Eupentacta fraudatrix – один из уникальных организмов, используемых для изучения процесса регенерации. Недавно анализ динамики экспрессии генов во время регенерации кишечника у E. fraudatrix позволил идентифицировать ряд факторов транскрипции, которые могут участвовать в трансдифференцировке целомических эпителиальных клеток в энтероциты голотурий [4].
Голотурия E. fraudatrix известна как богатый источник тритерпеновых гликозидов. Всего из голотурии выделено и идентифицировано 37 гликозидов [5–7]. Большинство гликозидов E. fraudatrix характеризуются наличием остатка 3-O-метилксилозы в качестве конечного звена в углеводной цепи вместо 3-O-метилглюкозы, обнаруженной в большинстве гликозидов трепангов. Это различие считается хемотаксономическим маркером рода Eupentacta [7].
В многочисленных исследованиях голотурии E. fraudatrix почти не учитывается состав липидов, за исключением описанного ранее состава жирных кислот (ЖК) E. fraudatrix [8]. Липиды обладают важными для организма функциями. Нейтральные липиды (триацилглицерины (ТГ) и эфиры восков) служат резервом энергии. Полярные липиды (глицерофосфолипиды, сфинголипиды и гликолипиды) – структурные компоненты клеточных мембран, участвующие в передаче сигналов. Состав липидов и ЖК описан у голотурий, обитающих в водах Вьетнама [8], Apostichopus japonicas [9], абиссальных голотурий [10] и глубоководных голотурий Охотского моря [11].
Каждый класс липидов представляет собой смесь сотен молекулярных видов липидов, в состав которых входят различные ЖК. Количественное описание молекулярного состава липидов – одна из задач, решаемых липидомикой. Увеличение данных о липидоме способствует изучению морской экологии и биохимии липидов.
Цель настоящей работы – определение состава молекулярных видов в запасных (триацилглицерины) и структурных (фосфолипиды) липидах кишечника E. fraudatrix. Химическая структура и состав молекул липидов фосфолипидов (ФЛ) были впервые идентифицированы с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с тандемной масс-спектрометрией высокого разрешения (МС/МС). ТГ анализировали с помощью сверхкритической флюидной хроматографии с использованием масс-спектрометра низкого разрешения и светорассеивающего детектора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для определения состава ЖК и молекулярных видов липидов использовали взрослых особей голотурии E. fraudatrix, собранных в заливе Петра Великого Японского моря. Липиды, выделенные из кишечников пяти особей голотурии, анализировали методами жидкостной и газо-жидкостной хроматографии с масс-спектрометрическим, пламенно-ионизационным и светорассеивающим детектированием.
Общие липиды составляли 4.6% от сырого веса кишечника голотурии. Содержание ТГ и стеринов определяли с помощью сверхкритической флюидной хроматографии со светорассеивающим детектором. Общее количество фосфолипидов и некоторых классов этих липидов определяли по количеству неорганического фосфора при окислении в HClO4 [12]. Содержание основных классов липидов голотурии представлено в табл. 1. ФЛ включали шесть основных классов: фосфатидилэтаноламины (ФЭ), фосфатидилхолины (ФХ), фосфатидилсерины (ФС), фосфатидилинозитолы (ФИ), лизофосфатидилхолины (ЛФХ) и дифосфатидилглицерины (ДФГ).
Таблица 1.
Состав липидов кишечника Eupentacta fraudatrix
| Класс липидов | Содержание, % от липидного экстракта |
|---|---|
| Триацилглицерины | 16.66 ± 7.03 |
| Стерины | 16.51 ± 8.12 |
| Фосфолипиды | 25.44 ± 6.82 |
| Фосфатидилхолины | 15.46 ± 1.71 |
| Фосфатидилэтаноламины | 5.08 ± 0.33 |
| Фосфатидилсерины | 2.15 ± 1.02 |
| Фосфатидилинозитолы | 1.39 ± 0.01 |
| Лизофосфатитидилхолины | 0.42 ± 0.02 |
| Дифосфатидилглицерины | 0.93 ± 0.36 |
Содержание липидов в кишечнике E. fraudatrix было сопоставимо с голотуриями из вод Вьетнама, исследованных ранее [8]. Кишечник E. fraudatrix содержал липиды (ТГ, стерины и ФЛ), которые составляли значительную часть липидного экстракта (58.6%) кишечника голотурии. ФХ, ФЭ, ФС, ФИ, лизофосфолипиды и ДФГ были обнаружены у широко распространенных видов голотурий, таких как Holothuria leucospilota, H. atra, Cucumaria frondosa, Isostichopus fuscus и др. [8, 13]. Таким образом, состав полярных липидов E. fraudatrix (табл. 1) был типичным для голотурий. Основным классом фосфолипидов у E. fraudatrix был ФХ, содержание которого составляло 60.8% от общего количества ФЛ. О преобладании ФХ в фосфолипидах сообщалось и для других голотурий [8, 13].
Содержание и состав жирных кислот в кишечнике E. fraudatrix определяли газо-жидкостной хроматографией с пламенно-ионизационным детектором. Профиль ЖК голотурий отличался высокой концентрацией полиненасыщенных жирных кислот (ПНЖК), при этом основной ПНЖК была эйкозапентаеновая кислота (20:5n-3) (табл. 2). n-3 ПНЖК преобладали в липидах кишечника (39.9% от суммы жирных кислот), в то время как содержание n-6 ПНЖК составляло всего 1.9%. Содержание ЖК с нечетным количеством атомов углерода составляло 9.7%. Обнаружена ЖК 23:1n-9 – маркерная ЖК голотурий.
Таблица 2.
Состав жирных кислот липидов кишечника Eupentacta fraudatrix
| Жирная кислота | Содержание, % от общих ЖК и ДМА |
|---|---|
| 14:0 | 3.17 ± 0.25 |
| ai-15:0 | 6.17 ± 0.89 |
| 16:0 | 1.77 ± 0.96 |
| 16:1n-7 | 8.30 ± 1.25 |
| ai-17:0 | 3.47 ± 0.74 |
| 16:4n-1 | 3.51 ± 0.51 |
| 18:0 | 6.80 ± 0.44 |
| 18:1n-7 | 3.71 ± 0.56 |
| 18:4n-3 | 2.06 ± 0.25 |
| 20:0 | 1.60 ± 0.36 |
| 20:1n-9 | 1.58 ± 0.21 |
| 20:2(5,11) | 0.46 ± 0.09 |
| 20:4n-6 | 0.92 ± 0.13 |
| 20:4n-3 | 3.42 ± 0.88 |
| 20:5n-3 | 20.32 ± 2.21 |
| 22:1n-9 | 1.31 ± 0.27 |
| 21:5n-3 | 1.54 ± 0.14 |
| 23:1n-9 | 1.50 ± 0.66 |
| 22:5n-3 | 1.67 ± 0.74 |
| 22:6n-3 | 6.76 ± 0.87 |
| Другие | 23.47 ± 2.14 |
| Разветвленные + нечетные | 18.79 ± 2.01 |
| НЖК | 29.09 ± 3.12 |
| МНЖК | 21.90 ± 3.21 |
| ПНЖК | 47.98 ± 2.85 |
| 18:0-ДМА | 1.03 ± 0.08 |
При кислотном метанолизе из фосфолипидов с алкенильной группой в положении sn-1 образуются длинноцепочечные диметилацетали альдегидов (ДМА). Диметилацеталь октадеканаля (18:0-ДМА) был единственным ДМА, который составлял 1.03% от смеси МЭЖК и ДМА, полученной из общих липидов голотурии.
Состав ЖК кишечника E. fraudatrix был схожим с ранее полученными данными [8]. В нашей работе было показано, что кишечник E. fraudatrix содержал более высокую концентрацию 22:6n-3 (6.76% от общего количества ЖК и ДМА) по сравнению с таковым во всем организме ранее исследованной E. fraudatrix (2.3% от общего количества ЖК) [8]. Особенностью состава ЖК кишечника изученной нами E. fraudatrix был высокий уровень ЖК с разветвленной структурой и нечетным количеством атомов углерода, что согласуется с ранее полученными данными для E. fraudatrix [8]. Считается, что разветвленные ЖК синтезируются грамположительными и сульфатредуцирующими бактериями [14]. Кишечник голотурии, возможно, содержит большое количество подобных бактерий.
Высокое содержание кислот 16:4n-1 (3.51%) и 20:5n-3, а также соотношение 16:1n-7/16:0, превышавшее 1, были обнаружены в кишечнике голотурии. Эти параметры указывают на преобладание диатомовых водорослей в рационе E. fraudatrix [11]. Ранее было показано, что голотурия C. frondosa также питается преимущественно диатомовыми водорослями в период их активного цветения [15].
ТГ – основная форма хранения энергии как у наземных, так и у морских животных [16]. Состав ТГ липидов кишечника E. fraudatrix представлен 53 молекулярными видами. Данные по основным молекулярным видам, расположенным в порядке увеличения времени удерживания, приведены в табл. 3. Основные ТГ содержали ацильные фрагменты 20:5, 16:0, 14:0, 16:1 и 22:6.
Таблица 3.
Состав молекулярных видов триацилглицеринов (ТГ) кишечника Eupentacta fraudatrix
| № | Время удерживания, мин | Молекулярный вид триацилглицерина | Содержание липидов | |
|---|---|---|---|---|
| % от суммы ТГ | % от липидного экстракта | |||
| 1 | 9.23 | 20:5/16:4/20:5 | 2.68 ± 0.84 | 0.45 ± 0.29 |
| 2 | 9.38 | 20:5/16:0/16:4; 18:3/14:0/16:4 | 2.07 ± 0.57 | 0.37 ± 0.23 |
| 3 | 10.00 | 20:5/16:1/16:4 | 3.23 ± 1.68 | 0.61 ± 0.48 |
| 4 | 11.07 | 20:5/16:3/20:5; 18:4/14:1/18:3 | 1.57 ± 0.54 | 0.24 ± 0.08 |
| 5 | 13.35 | 16:1/16:2/16:3; 20:5/16:3/16:1; 20:5/18:4/20:5 | 4.50 ± 0.29 | 0.74 ± 0.29 |
| 6 | 12.30 | 20:5/16:1/16:3 | 1.92 ± 0.92 | 0.35 ± 0.28 |
| 7 | 13.62 | 20:5/20:5/20:5; 14:0/20:5/20:5 | 4.62 ± 1.89 | 0.86 ± 0.57 |
| 8 | 14.38 | 20:5/16:0/20:5; 16:1/16:1/16:3 | 3.01 ± 0.75 | 0.49 ± 0.23 |
| 9 | 14.97 | 20:5/16:2/16:1 | 1.81 ± 1.50 | 0.36 ± 0.37 |
| 10 | 15.18 | 20:5/14:0/22:6; 20:5/20:4/20:5; 20:5/15:0/20:5 | 8.28 ± 1.63 | 1.41 ± 0.69 |
| 11 | 16.37 | 20:5/16:0/16:1; 20:5/15:0/16:0 | 4.79 ± 1.56 | 0.86 ± 0.57 |
| 12 | 16.88 | 16:1/16:2/16:1; 22:6/16:2/16:1; 18:3/16:2/16:1 | 3.72 ± 0.77 | 0.59 ± 0.17 |
| 13 | 17.27 | 20:5/16:1/16:1; 20:5/15:0/16:1; 20:4/16:1/16:1 | 8.14 ± 1.97 | 1.43 ± 0.79 |
| 14 | 17.69 | 18:4/16:0/20:5 | 4.22 ± 0.58 | 0.68 ± 0.22 |
| 15 | 20.23 | 16:1/16:1/16:1; 16:1/15:0/16:1; 20:5/16:1/20:5 | 9.61 ± 4.86 | 1.39 ± 0.46 |
| 16 | 21.20 | 20:5/18:1/20:5; 18:3/16:0/20:5 | 2.87 ± 0.57 | 0.45 ± 0.14 |
| 17 | 21.96 | 20:5/18:1/16:0; 20:5/18:0/16:3 | 1.25 ± 0.22 | 0.22 ± 0.12 |
| 18 | 22.26 | 20:5/16:0/16:1; 20:5/16:0/15:0; 16:1/16:0/16:1; 16:1/15:0/16:0 | 1.90 ± 0.36 | 0.30 ± 0.10 |
| 19 | 22.86 | 20:5/18:1/16:1; 22:6/16:0/16:1; 20:5/18:1/15:0 | 2.00 ± 1.40 | 0.33 ± 0.30 |
| 20 | 23.49 | 20:5/18:0/18:4 | 2.95 ± 1.07 | 0.50 ± 0.34 |
| 21 | 24.64 | 22:6/16:0/16:1; 16:1/15:0/16:0 | 1.42 ± 0.32 | 0.25 ± 0.13 |
| 22 | 25.76 | 16:1/18:1/16:1 | 1.60 ± 0.39 | 0.27 ± 0.16 |
| 23 | 26.97 | 20:5/18:0/20:5 | 5.15 ± 3.42 | 0.71 ± 0.38 |
| 24 | 28.12 | 20:5/18:0/16:0; 18:3/18:0/20:5 | 0.96 ± 0.19 | 0.17 ± 0.09 |
| 25 | 30.17 | 20:5/18:0/16:1; 20:5/18:0/15:0 | 4.61 ± 1.55 | 0.79 ± 0.46 |
| 26 | 34.86 | 16:1/18:0/16:1; 22:6/18:0/16:1 | 1.14 ± 0.75 | 0.16 ± 0.04 |
| 27 | 38.14 | 20:5/18:0/16:0 | 1.12 ± 0.66 | 0.19 ± 0.15 |
| Другие | 8.85 ± 4.57 | 1.50 ± 1.16 | ||
В составе ТГ были обнаружены одинаковые по составу молекулярные виды с разным временем удерживания, полученным на колонке с обращенной фазой. Например, ТГ 22:6/16:0/16:1 имел меньшее время удерживания (№ 19, 22.86 мин), чем аналогичный молекулярный вид (№ 21, 24.64 мин). Схожее хроматографическое поведение наблюдалось для пиков № 11 и 18, 24 и 27. Некоторые из молекулярных видов ТГ имели необычное время удерживания для их структуры (количество атомов углерода и число двойных связей в остатках ЖК). Таким образом, ТГ 20:5/18:1/16:0 (пик № 17) имел меньшее время удерживания, чем ТГ 20:5/18:1/15:0 (пик № 19). Различия во временах удерживания аналогичных молекулярных видов ТГ позволяют предположить, что в составе ТГ содержатся разветвленные ЖК. 28 молекулярных видов ТГ содержали маркеры диатомовых водорослей (16:4n-1 и 16:1n-7). Более того, ряд ТГ (16:1/16:1/16:1, 16:1/16:2/16:1, 20:5/16:1/16:1 и 20:5/16:0/16:1) полностью повторяет состав ТГ диатомовых водорослей [17]. Мы обнаружили, что трофические маркерные ЖК присутствуют преимущественно в ТГ.
Структурные липиды в кишечнике E. fraudatrix представлены в основном стеринами и фосфолипидами. Гликолипиды также обнаружены у голотурий [9], но мы не определяли содержание и состав этих классов липидов. В липидах кишечника голотурии было идентифицировано 63 молекулярных вида ФЭ, ФХ, ФС, ФИ и ЛФХ. Основными молекулярными видами были 18:1алк/20:5 ФЭ, 18:1алк/20:5 ФХ, 18:1/20:5 ФХ, 18:0/20:5 ФХ, 22:0/20:5 ФС, 22:1/24:1 ФС, 23:1/20:1 ФС, 20:0/20:5 ФИ, 22:1/20:5 ФИ и 22:0/20:5 ФИ (рис. 1). Основной ЖК в составе фосфолипидов E. fraudatrix была кислота 20:5n-3 (рис. 1а). Высокая концентрация длинноцепочечных ацильных фрагментов (до 42 атомов углерода) характерна для ФС (77.4% от суммы ФС) и ФИ (61.2% от суммы ФИ).
Рис. 1.
(а) – Cодержание основных молекулярных видов (% от класса фосфолипидов) фосфатидилэтаноламинов (ФЭ), фосфатидилхолинов (ФХ), фосфатидилсеринов (ФС) и фосфатидилинозитолов (ФИ) в кишечнике Eupentacta fraudatrix. На осях sn-1 и sn-2 расположены алкильные и ацильные группы в положениях sn-1 и sn-2 соответственно молекулы соответствующего класса фосфолипидов. Алкильные (X:Yалк) и ацильные группы (X:Y) содержат X атомов углерода и Y двойных связей; (б) – распределение алкил/ацильных и диацильных молекулярных видов в каждом классе фосфолипидов; (в) – распределение нечетных и четных ацильных фрагментов в каждом классе фосфолипидов.
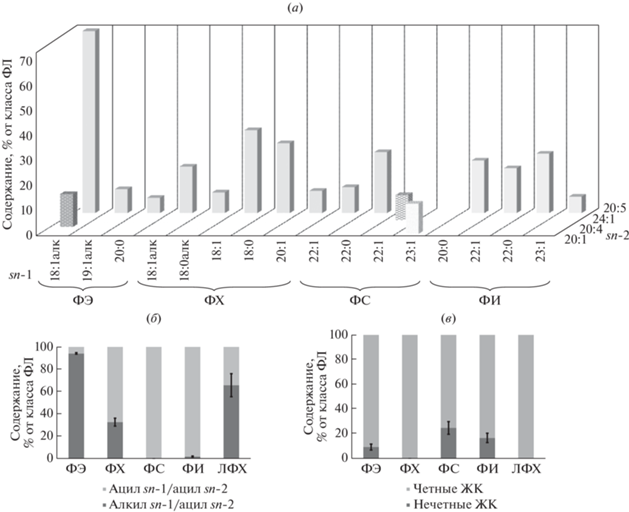
Алкил/ацильные молекулярные виды ФЛ были характерны для ФЭ (94.1% от суммы всех ФЭ), ФХ (32.5% ФХ) и ЛФХ (65.7% ЛФХ) (рис. 1б). Единственным алкил/ацильным молекулярным видом ФИ с концентрацией менее 2% был 18:0алк/20:5 ФИ. ФС не содержал алкил/ацильные молекулярные виды.
Высокое содержание алкил/ацильных молекулярных видов было обнаружено в ФЭ, ФХ и ЛФХ, что согласуется с ранее полученными данными для голотурий [13]. Молекулярные виды с алкильной связью в положении sn-1 встречались преимущественно в ФХ ряда голотурий, в то время как алкенильная связь характерна для ФЭ [13]. Липиды с простой эфирной связью – основные структурные компоненты клеточных мембран. Простая эфирная связь в фосфолипидах изменяет их физические свойства и влияет на динамику мембран [18]. Отсутствие карбонильного кислорода в положении sn-1 способствует образованию более прочных межмолекулярных водородных связей между головными группами [19]. Алкенильная группа плазмалогенов в положении sn-1 способствует более плотной упаковке фосфолипидов в мембране, что приводит к снижению текучести мембраны и увеличению жесткости [18].
ЖК с нечетным количеством атомов углерода были характерны для ФЭ (9.2% от суммы ФЭ), ФС (24.6% от суммы ФС) и ФИ (16.5% от суммы ФИ) (рис. 1в). ЖК 19:1 присутствовала в ФЭ, более длинноцепочечные кислоты 23:0 и 23:1 встречались только в ФС и ФИ.
Наибольшая концентрация нечетных ЖК была обнаружена в ФС (рис. 1в). Наличие остатков 21:0 и 23:0 указывает на возможное удлинение ЖК бактериального происхождения (15:0, 17:0 и 19:0) в тканях морских организмов для дальнейшего биосинтеза собственных липидов [20]. Кислота 23:1n-9, характерная для голотурий, обнаружена только в ФС и ФИ. Предполагается, что эта ЖК образуется в результате α-окисления 24:1n-9 [21]. Ранее маркерные для мягких кораллов тетракозаполиненасыщенные ЖК (24:5n-6 и 24:6n-3) также были обнаружены в основном в ФИ и ФС [22, 23]. Взаимосвязь биосинтетических путей ФС и ФИ с маркерными ЖК нуждается в дополнительных исследованиях.
Состав и содержание основных классов липидов голотурии E. fraudatrix значительно не отличается от липидов других видов голотурий [8, 13]. Молекулярные виды ФЭ и ФХ содержат в основном эйкозапентаеновую кислоту (20:5n-3), что согласуется с ранее полученным данным для шести съедобных голутурий [13]. Длинноцепочечныe ЖК (>21 атома углерода) как с четным, так и с нечетным количеством атомов углерода были обнаружены преимущественно в ФС и ФИ, что подтверждено ранее [13]. Особенность липидов кишечника голотурии E. fraudatrix – высокое содержание ПНЖК в составе ФЭ и ФХ (97.2% от суммы ФЭ и 99.6% от суммы ФХ).
Голотурия E. fraudatrix используется для изучения механизмов регенерации [4] и в качестве источника биологически активных соединений [7]. Запасные и структурные липиды кишечника E. fraudatrix впервые были проанализированы различными методами хроматографии и масс-спектрометрии. Ранее было высказано предположение, что фосфолипиды – относительно консервативная часть липидома, в гораздо меньшей степени подверженная влиянию источников питания, чем неполярные резервные классы липидов [24]. Мы показали, что жирные кислоты, поступающие из пищи и бактерий, живущих в кишечнике, входят в состав резервного класса липидов – триацилглицеринов. Биосинтез ФЛ включал элонгацию жирных кислот, поступающих из пищи. Изучение липидома морских организмов может помочь в установлении биосинтетических путей и распределении трофических маркеров в липидах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Для экстракции липидов и тонкослойной хроматографии (ТСХ) использовали гексан, бензол, хлороформ, метанол и 28%-ный раствор NH4OH аналитической чистоты; для ВЭЖХ – гексан, 2-пропанол, HCOOH и триэтиламин (Sigma-Aldrich, США). Стандарты триацилглицеринов и фосфолипидов были приобретены у Avanti Polar Lipids Inc. (США), тридецилпальмитат (ч.д.а.) – у КНПО “Диагностикум” (Россия).
Животные. Взрослые особи голотурии E. fraudatrix были собраны в заливе Петра Великого Японского моря и содержались в резервуарах объемом 3 м3 с проточной аэрированной морской водой при 16°C в течение одной недели. Ткани кишечника были взяты из пяти особей (через разрез стенки тела голотурии). Кишечник промывали стерильной морской водой для удаления остатков пищи.
Анализ липидов. Экстракты общих липидов получали по методу Фолча [25] с некоторыми модификациями. Содержание фосфорсодержащих общих липидов измеряли на спектрофотометре UV-1800 (Shimadzu, Япония), исходя из количества неорганического фосфора при окислении в HClO4, как опубликовано ранее [12].
Метиловые эфиры жирных кислот (МЭЖК) из липидов кишечника E. fraudatrix получали в соответствии с методом Carreau и Dubacq [26]. МЭЖК анализировали методом газовой хроматографии на хроматографе GC-2010 (Shimadzu, Япония) с пламенно-ионизационным детектором и капиллярной колонкой 30 м × 0.25 мм (i.d.) Supelcowax 10 (США). Анализ проводили при следующих условиях: температура колонки 205°С, температура инжектора и детектора 250°C. В качестве газа-носителя использовали гелий. Пики МЭЖК были идентифицированы путем сравнения времен удерживания индивидуальных эфиров жирных кислот и значений эквивалентной длины цепи со стандартами (смесь PUFA-3 из масла менхадена, Supelco, Bellefonte, США). Концентрацию МЭЖК (% от суммы ЖК) определяли по площадям хроматографических пиков соответствующих соединений, при этом общую площадь пиков МЭЖК принимали за 100% и вычисляли процентную концентрацию отдельных ЖК по отношению к их общему содержанию.
Содержание и структуру молекулярных видов ФЛ определяли на хроматографе LC-20A Prominence (Shimadzu, Япония) с тандемным масс-спектрометром высокого разрешения LCMS-IT-TOF (Shimadzu, Япония) согласно ранее описанным условиям [23]. Определение содержания и идентификацию молекулярных видов проводили, как описано ранее [27, 28].
Состав и количество ТГ в общих липидах были определены с использованием сверхкритической флюидной хроматографии Nexera UC (Shimadzu, Япония) со светорассеивающим детектором ELSD LT II (Shimadzu, Япония) и масс-спектрометром низкого разрешения LCMS-8060 (Shimadzu, Япония) в режиме химической ионизации при атмосферном давлении и регистрации положительных ионов [23]. Для количественного определения ТГ использовали внутренний стандарт 16:0/16:0/18:1 ТГ (Avanti Polar Lipids Inc., США).
Данные представлены как средние значения ± ± стандартное отклонение, повторность пятикратная. Данные обрабатывали в программе MS Excel.
ЗАКЛЮЧЕНИЕ
Впервые были идентифицированы молекулярные виды запасных и структурных липидов кишечника E. fraudatrix методами газо-жидкостной и жидкостной хроматографии с использованием масс-спектрометрического, пламенно-ионизационного и светорассеивающего детекторов. Показано, что жирные кислоты, поступающие из пищи и бактерий, живущих в кишечнике, входят в состав резервного класса липидов – триацилглицеринов. Для биосинтеза фосфолипидов использовались диетические жирные кислоты, подвергшиеся элонгации. Изучение липидома морских организмов может помочь в установлении биосинтетических путей и распределения маркерных жирных кислот в липидах.
Список литературы
Du H.X., Bao Z.M., Hou R., Wang S., Su H.L., Yan J.J., Tian M.L., Li Y., Wei W., Lu W., Hu X.L., Wang S., Hu J.J. // PLoS One. 2012. V. 7. P. 10. https://doi.org/10.1371/journal.pone.0033311
Dolmatov I.Y., Ginanova T.T. // Cell Tissue Res. 2009. V. 336. P. 41–58. https://doi.org/10.1007/s00441-009-0761-6
Mashanov V.S., Dolmatov I.Y., Heinzeller T. // Biol. Bull. 2005. V. 209. P. 184–193. https://doi.org/10.2307/3593108
Boyko A.V., Girich A.S., Tkacheva E.S., Dolmatov I.Y. // Sci. Rep. 2020. V. 10. P. 11. https://doi.org/10.1038/s41598-020-58470-0
Kalinin V.I., Avilov S.A., Kalinovskii A.I., Stonik V.A. // Chem. Nat. Compd. 1992. V. 28. P. 635–636. https://doi.org/10.1007/BF00630455
Silchenko A.S., Kalinovsky A.I., Avilov S.A., Andryjaschenko P.V., Dmitrenok P.S., Martyyas E.A., Kalinin V.I. // Nat. Prod. Commun. 2012. V. 7. P. 1157–1162.
Silchenko A.S., Kalinovsky A.I., Avilov S.A., Popov R.S., Kalinin V.I., Andrijaschenko P.V., Dmitrenok P.S., Yurchenko E.A. // Nat. Prod. Commun. 2018. V. 13. P. 137–140.
Svetashev V.I., Levin V.S., Lam C.N., Nga D.T. // Comp. Biochem. Physiol. B Biochem. Mol. Biol. 1991. V. 98. P. 489–494. https://doi.org/10.1016/0305-0491(91)90242-6
Lou Q.M., Wang Y.M., Liu X.F., Xue C.H. // J. Food Biochem. 2012. V. 36. P. 317–321. https://doi.org/10.1111/j.1745-4514.2011.00544.x
Drazen J.C., Phleger C.F., Guest M.A., Nichols P.D. // Comp. Biochem. Physiol. B Biochem. Mol. Biol. 2008. V. 151. P. 79–87. https://doi.org/10.1016/j.cbpb.2008.05.013
Kharlamenko V.I., Stepanov V.G., Borisovets E.E., Kiyashko S.I., Svetashev V.I. // Russ. J. Mar. Biol. 2015. V. 41. P. 448–455. https://doi.org/10.1134/s106307401506005x
Vaskovsky V.E., Kostetsky E.Y., Vasendin I.M. // J. Chromatogr. 1975. V. 114. P. 129–141.
Wang X.C., Cong P.X., Chen Q.S., Li Z.J., Xu J., Xue C.H. // J. Food Compos. Anal. 2020. V. 94. P. 9. https://doi.org/10.1016/j.jfca.2020.103626
de Carvalho C., Caramujo M.J. // Molecules. 2018. V. 23. P. 36. https://doi.org/10.3390/molecules23102583
Hamel J.F., Mercier A. // Can. J. Zool. Rev. Can. Zool. 1998. V. 76. P. 1194–1198. https://doi.org/10.1139/cjz-76-6-1194
Parrish C., Abrajano T., Budge S., Helleur R., Hudson E., Pulchan K., Ramos C. // Lipid and Phenolic Biomarkers in Marine Ecosystems: Analysis and Applications / Ed. Wangersky P. Berlin: Springer-Verlag, 2000. P. 193–223.
Li S., Xu J.L., Chen J., Chen J.J., Zhou C.X., Yan X.J. // J. Appl. Phycol. 2014. V. 26. P. 1389–1398. https://doi.org/10.1007/s10811-013-0159-4
Dean J.M., Lodhi I.J. // Protein & Cell. 2018. V. 9. P. 196–206. https://doi.org/10.1007/s13238-017-0423-5
Lohner K. // Chem. Phys. Lipids. 1996. V. 81. P. 167–184. https://doi.org/10.1016/0009-3084(96)02580-7
Bosh T.V., Long P.Q. // Russ. J. Mar. Biol. 2017. V. 43. P. 471–478. https://doi.org/10.1134/s1063074017060049
Kaneniwa M., Itabashi Y., Endo S., Takagi T. // Comp. Biochem. Physiol. B Biochem. Mol. Biol. 1986. V. 84. P. 451–455. https://doi.org/10.1016/0305-0491(86)90105-7
Imbs A.B., Dang L.P.T., Rybin V.G., Nguyen N.T., Pham L.Q. // Biochem. Anal. Biochem. 2015. V. 4. P. 205. https://doi.org/10.4172/2161-1009.1000205
Sikorskaya T.V., Imbs A.B. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 712–723. https://doi.org/10.1134/s1068162019010151
Chen H.K., Song S.N., Wang L.H., Mayfield A.B., Chen Y.J., Chen W.N.U., Chen C.S. // PLoS One. 2015. V.10. P. e0132519. https://doi.org/10.1371/journal.pone.0132519
Folch J., Lees M., Sloane-Stanley G.A. // J. Biol. Chem. 1957. V. 226. P. 497–509.
Carreau J.P., Dubacq J.P. // J. Chromatogr. 1978. V. 151. P. 384–390. https://doi.org/10.1016/s0021-9673(00)88356-9
Imbs A.B., Dang L.P.T., Nguyen K.B. // PLoS One. 2019. V. 14. P. 22. https://doi.org/10.1371/journal.pone.0215759
Imbs A.B., Dang L.P.T., Rybin V.G., Svetashev V.I. // Lipids. 2015. V. 50. P. 575–589. https://doi.org/10.1007/s11745-015-4021-0
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


