Электрохимия, 2019, T. 55, № 11, стр. 1307-1317
Теоретический анализ изменения состава раствора при анодном электролизе бромида
М. М. Петров a, b, *, Д. В. Конев a, b, А. Е. Антипов a, b, c, Н. В. Карташова b, c, В. В. Кузнецов a, М. А. Воротынцев a, b, c, d, **
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
b Институт проблем химической физики РАН
Черноголовка, Россия
c Московский государственный университет им. М.В. Ломоносова
Москва, Россия
d Институт молекулярной химии университета Бургундии
Дижон, Франция
* E-mail: mikepetrovm@gmail.com
** E-mail: mivo2010@yandex.com
Поступила в редакцию 17.02.2019
После доработки 04.05.2019
Принята к публикации 20.05.2019
Аннотация
Выполнен расчет изменения потенциала индикаторного электрода и (квази)равновесного состава раствора в анодной камере модельного электролизера, исходно содержащего водный электролит с концентрацией бромид-анионов 0.5 М, при условии поддержания постоянного рН раствора, равного 2. Теоретический анализ проведен для трех различных гипотез относительно возможной глубины электролиза и природы протекающих процессов: 1) не происходит образования соединений брома с положительными степенями окисления; 2) происходит образование соединений брома до степени окисления +1 включительно; 3) процесс проходит с образованием как бромат-иона $\left( {{\text{BrO}}_{{\text{3}}}^{ - }} \right),$ так и соединений брома с более низкими степенями окисления в растворе (${\text{Br}}_{{\text{3}}}^{ - },$ ${\text{Br}}_{{\text{5}}}^{ - },$ Br2, BrO–, HBrO), а также фазы жидкого брома $\left( {{\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}} \right).$ Все электрохимические и химические реакции с участием бромсодержащих частиц, учтенных в рамках гипотезы об эволюции системы 1, 2 или 3, предполагаются находящимися в (квази)равновесном состоянии, а протекание электрического тока через сепаратор ячейки во всех трех случаях обеспечивается за счет ионов фонового электролита. Предложены способы экспериментального определения варианта эволюции состава Br-содержащего анолита в ходе электролиза.
ВВЕДЕНИЕ
Процесс электрохимического окисления бромид-иона Br– активно исследовался экспериментально как в водных растворах [1–14], так и неводных средах [15–17]. Наибольшее внимание уделялось начальному этапу этого процесса, приводящему в разбавленных водных растворах к образованию растворенного молекулярного брома [2, 3, 9, 10, 13–17]:
(1)
$2{\text{B}}{{{\text{r}}}^{ - }} - 2{\text{e}} \rightleftarrows {\text{B}}{{{\text{r}}}_{{\text{2}}}}.$Увеличение концентрации Br–-ионов в исходном растворе приводит к увеличению числа возможных продуктов этого процесса за счет образования как соединений с промежуточными степенями окисления (в частноcти, трибромид-анион ${\text{Br}}_{{\text{3}}}^{ - }$ и пентабромид-анион ${\text{Br}}_{{\text{5}}}^{ - }$), так и фазы жидкого молекулярного брома ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ [18, 19]:
(2)
${\text{B}}{{{\text{r}}}_{{\text{2}}}} + {\text{B}}{{{\text{r}}}^{ - }} \rightleftarrows {\text{Br}}_{{\text{3}}}^{ - },$(3)
${\text{B}}{{{\text{r}}}_{{\text{2}}}} + {\text{Br}}_{{\text{3}}}^{ - } \rightleftarrows {\text{Br}}_{{\text{5}}}^{ - },$(4)
${\text{B}}{{{\text{r}}}_{{\text{2}}}} \rightleftarrows {\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}.$В то же время имеются и публикации, в которых показана возможность электрохимического окисления бромида до более высоких степеней окисления, в частности до бромата $\left( {{\text{BrO}}_{{\text{3}}}^{ - }} \right)$ [4–8, 12] и даже до пербромата $\left( {{\text{BrO}}_{{\text{4}}}^{ - }} \right)$ [4]. Так как из общих принципов электрохимии можно ожидать, что электродный процесс с одновременным переносом нескольких электронов – при этом сопровождающимся разрывом и образованием прочных химических связей – вряд ли может протекать с заметной скоростью, то образование соединений брома с положительными степенями окисления инициируется, по-видимому, реакцией диспропорционирования молекулярного брома, схема которой зависит от рН раствора:
(5)
$\begin{gathered} {\text{B}}{{{\text{r}}}_{2}} + {\text{ }}{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \rightleftarrows {\text{HBrO}} + {\text{B}}{{{\text{r}}}^{--}} + {{{\text{H}}}^{ + }} \\ \left( {{\text{кислые и нейтральные среды}}} \right), \\ \end{gathered} $(6)
$\begin{gathered} {\text{B}}{{{\text{r}}}_{2}} + 2{\text{О}}{{{\text{Н}}}^{--}} \rightleftarrows {\text{Br}}{{{\text{O}}}^{--}} + {\text{B}}{{{\text{r}}}^{--}} + {{{\text{Н}}}_{{\text{2}}}}{\text{О}} \\ \left( {{\text{щелочные среды}}} \right). \\ \end{gathered} $В свою очередь соединения со степенью окисления +1 могут подвергаться серии этапов диспропорционирования с образованием короткоживущих соединений с более высокими степенями окисления, вплоть до накопления более устойчивых веществ – броматов и даже перброматов [20–22], в частности, по брутто-реакциям:
(7)
${\text{3HBrO}} \rightleftarrows {\text{BrО}}_{{\text{3}}}^{ - } + {\text{2B}}{{{\text{r}}}^{ - }} + {\text{3}}{{{\text{H}}}^{ + }},$(8)
${\text{3Br}}{{{\text{O}}}^{ - }} \rightleftarrows {\text{BrО}}_{{\text{3}}}^{ - } + {\text{2B}}{{{\text{r}}}^{ - }}.$При написании этих реакционных схем принято во внимание, что HBr и HBrO3 являются сильными кислотами, т.е. практически полностью диссоциируют, а ${\text{Br}}_{{\text{3}}}^{ - }$ и ${\text{Br}}_{{\text{5}}}^{ - }$ не протонируются – по крайней мере при рН ≥ 0 [23].
В данном исследовании не рассматриваются соединения со степенью окисления +7 (перброматы), поскольку они не образуются в заметных количествах в рассматриваемом интервале потенциалов (ниже +1.6 В относительно с. в. э.) в кислых и нейтральных средах.
Закономерности процесса образования соединений с положительными степенями окисления брома зависят как от параметров электрохимического процесса (выбор его режима, потенциала или тока), так и от устройства ячейки (в частности, от использованных материала электрода и разделительной мембраны). Кроме того, электроокисление в целом часто проходит выше равновесного потенциала выделения кислорода для данного значения рН, что приводит к наложению этого побочного процесса на электродные реакции соединений брома, а также к участию его интермедиатов в гомогенных реакциях бромсодержащих частиц.
По этим причинам пропускание анодного тока через раствор, исходно содержащий бромид-анионы, сопровождается образованием и взаимными превращениями многочисленных соединений брома, прохождение которых определяется как термодинамическими факторами, так и скоростями проходящих процессов. Последние, в свою очередь, сложным образом зависят от рН раствора и суммарной концентрации атомов Br во всех бромсодержащих соединениях ctot (которая при отсутствии потерь совпадает с исходной концентрацией бромида). Поэтому из общих соображений невозможно достоверно предсказывать, какие процессы в экспериментальных условиях будут протекать достаточно быстро (на масштабе времени электролиза), т.е. будут находиться в своем квазиравновесном состоянии, а какие практически не будут проходить вообще.
Поэтому в данной работе были проведены расчеты эволюции потенциала индикаторного электрода Е и состава раствора для трех различных предположений относительно того, какие из стадий проходят достаточно быстро, чтобы по ним достигалось термодинамическое равновесие, тогда как остальные превращения можно вообще не учитывать:
Вариант 1: во время электролиза происходят только реакции (1)–(4), приводящие к соединениям брома с отрицательными и нулевой степенью окисления, т.е. кислородсодержащих соединений брома практически не образуется.
Вариант 2: успевают проходить как реакции (1)–(4), так и последующие химические превращения (5) и/или (6) с образованием соединений брома со степенью окисления +1, тогда как последующие процессы (7) и/или (8) во время электролиза не происходят.
Вариант 3: все реакции (1)–(8) происходят достаточно быстро, так что при электролизе образуются все указанные выше соединения брома вплоть до степени окисления +5.
Предполагается при последующем анализе, что по всем реакциям, которые учитываются в рамках данного варианта, успевает устанавливаться термодинамическое равновесие.
МЕТОД РАСЧЕТА ХАРАКТЕРИСТИК СИСТЕМЫ
Используемый метод представляет развитие подхода нашей работы [18], в которой для варианта 3 (см. выше) были проведены расчеты равновесных характеристик данной системы (суммарного редокс-заряда бромсодержащих соединений Q и состава системы, т.е. количеств каждого из бромсодержащих соединений Ni) в зависимости от суммарного количества атомов Br (в молях) в системе Ntot и рН раствора. В отличие от работы [18] ниже не учитывается переход молекул Br2 в газовую фазу над раствором, поскольку для герметично закрытых ячеек с соизмеримыми объемами жидкой и газовой фаз количество брома в последней пренебрежимо мало по сравнению с Ntot.
По аналогии с работой [18] предполагается, что бромсодержащие соединения не пересекают границ анодной камеры электролизера (т.е., исключаются, в частности, их потери за счет переноса через сепаратор или за счет испарения Br2 из раствора), так что суммарное количество атомов Br во всех компонентах системы (Ntot) не изменяется в ходе электролиза и, следовательно, равно числу молей ионов Br– в начальном растворе, т.е. известно.
При анализе в рамках варианта 3 принимаются в расчет 8 бромсодержащих соединений со степенями окисления от –1 до +5 (табл. 1). Для каждого из них в таблице указано число атомов брома ni в этом соединении. Для этих соединений даются также величины параметра xi, названного [18] суммарной степенью окисления атомов Br в соединении типа i, которая определяется, как число электронов, которое надо забрать у нужного числа (одного или нескольких) нейтральных атомов Br, чтобы получить соединение Ai типа i: ni Br(0) – хie → Ai, например, ${{n}_{{{\text{BrO}}_{3}^{ - }}}}$ = 1, ${{x}_{{{\text{BrO}}_{3}^{ - }}}}$ = +5, или ${{n}_{{{\text{Br}}_{{{\kern 1pt} 3}}^{ - }}}}$ = 3, ${{x}_{{{\text{Br}}{\kern 1pt} _{{3}}^{ - }}}}$ = 1, или ${{n}_{{{\text{Br}}_{{{\kern 1pt} 5}}^{ - }}}}$ = 5, ${{x}_{{{\text{Br}}_{{{\kern 1pt} 5}}^{ - }}}}$ = –1 (см. табл. 1) ввиду превращений: Br(0) – 5e → ${\text{BrO}}_{{\text{3}}}^{ - },$ 3 Br(0) + e → ${\text{Br}}_{{\text{3}}}^{ - },$ 5 Br(0) + e → ${\text{Br}}_{{\text{5}}}^{ - }.$
Таблица 1.
Число атомов брома и суммарная степень окисления атомов брома внутри различных бромсодержащих соединений
| i | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|---|---|---|---|---|---|---|---|---|
| Br– | ${\text{Br}}_{{\text{3}}}^{ - }$ | ${\text{Br}}_{{\text{5}}}^{ - }$ | Br2 | HBrO | BrO– | ${\text{BrO}}_{{\text{3}}}^{ - }$ | ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ | |
| ni | 1 | 3 | 5 | 2 | 1 | 1 | 1 | 2 |
| xi | –1 | –1 | –1 | 0 | +1 | +1 | +5 | 0 |
Тогда суммарное число молей атомов Br в системе Ntot и ее суммарный редокс-заряд Q удовлетворяют балансовым условиям:
где суммирование проводится по всем соединениям (табл. 1), Ni – число молей соединения типа i, величины параметров ni и xi даны в таблице, F – постоянная Фарадея.Предполагается известным заряд Qelchem, затраченный на изменение степени окисления атомов Br внутри всех бромсодержащих компонентов системы от начала электролиза до какого-либо его момента t. Это означает, что либо выход по току соответствующих электрохимических этапов равен 100% (тогда Qelchem совпадает с зарядом электролиза до этого момента), либо (если он ниже 100%) выход по току указанного процесса известен, так что заряд Qelchem может быть вычислен по известному заряду электролиза.
Изменение суммарного редокс-заряда системы от его начального значения Qini до его значения Q в момент времени t за счет изменения степени окисления атомов Br в бромсодержащих соединениях непосредственно связано с пропусканием указанного заряда электролиза Qelchem:
где Qini = –FNtot, поскольку Br– был единственным бромсодержащим соединением в начальном состоянии.Таким образом, величина суммарного редокс-заряда системы Q может быть найдена из измерений Qelchem в любой момент времени электролиза.
Вместо суммарного редокс-заряда системы Q для графических иллюстраций ниже используется соответствующая удельная характеристика – средняя степень окисления x в этом состоянии системы:
(12)
$x = {Q \mathord{\left/ {\vphantom {Q {F{{N}_{{{\text{tot}}}}}{{ = \sum {{{x}_{i}}{{N}_{i}}} } \mathord{\left/ {\vphantom {{ = \sum {{{x}_{i}}{{N}_{i}}} } {\sum {{{n}_{i}}{{N}_{i}}} }}} \right. \kern-0em} {\sum {{{n}_{i}}{{N}_{i}}} }}.}}} \right. \kern-0em} {F{{N}_{{{\text{tot}}}}}{{ = \sum {{{x}_{i}}{{N}_{i}}} } \mathord{\left/ {\vphantom {{ = \sum {{{x}_{i}}{{N}_{i}}} } {\sum {{{n}_{i}}{{N}_{i}}} }}} \right. \kern-0em} {\sum {{{n}_{i}}{{N}_{i}}} }}.}}$Согласно уравнению (11), эта величина xini = –1 в начальном состоянии системы.
Условия термодинамических равновесий (см. ниже) содержат не количества веществ Ni, а их концентрации ci, определяемые соотношениями:
(13)
${{c}_{i}} = {{{{N}_{i}}} \mathord{\left/ {\vphantom {{{{N}_{i}}} {{{V}^{{{\text{sol}}}}}}}} \right. \kern-0em} {{{V}^{{{\text{sol}}}}}}},$Для концентраций балансовое условие (9) принимает вид:
где формально введенная суммарная молярная концентрация атомов Br в системе дается соотношением: ctot = Ntot/Vsol. Ее величина рассматривается в работе как известный параметр системы.В работе [18] сформулирован набор независимых термодинамических соотношений для электрохимических и химических превращений в этой системе для варианта 3, т.е. в предположении о равновесиях во всех реакциях (1)–(8), а также решение соответствующей системы уравнений для концентраций ci всех компонентов в табл. 1 как в случае, когда фаза жидкого брома отсутствует, так и когда она образуется.
При этом считались известными три управляющих параметра системы: суммарная концентрация атомов Br в системе ctot, рН раствора и его равновесный потенциал Е, тогда как в результате расчетов находились суммарный редокс-заряд Q и концентрации всех бромсодержащих соединений ci.
Так как при электролизе стандартным контролируемым параметром является заряд Q, а не потенциал Е (хотя он так может быть измерен с помощью индикаторного электрода, потенциал которого определяется редокс-переходами между соединениями с различными степенями окисления Br), то представляет интерес предсказание зависимостей потенциала Е и концентраций ci от Q, которые получаются из предыдущих расчетов с использованием зависимости Q(Е).
Расчеты для вариантов 1 и 2 проводятся в точности по той же принципиальной методике, но с уменьшением числа рассматриваемых бромсодержащих соединений и удалением того же числа определяющих их условий термодинамического равновесия. А именно, для варианта 2, когда реакции образования (7) и (8) не происходит во время проведения электролиза, достаточно исключить ${\text{BrO}}_{{\text{3}}}^{ - }$ из списка в табл. 1 и из соотношений (9), (10), (12), (14), а также исключить из расчетов термодинамическое соотношение (15) работы [18] для его концентрации. Для варианта 1 исключаются также HBrO и BrO–, а также соотношения (16) и (22) работы [18] для их концентраций.
Целью таких расчетов является рассмотрение трех различных сценариев изменения состава раствора в зависимости от скоростей процессов, приводящих к изменению степеней окислению атомов брома в его соединениях. Эти сценарии отвечают двум предельным случаям для определенных процессов, когда их скорости настолько быстрые, что для их концентраций строго выполняются термодинамические соотношения или настолько медленные, что процессы вообще не происходят. Представляется очевидным, что реальная ситуация является промежуточной, причем зависящей от многочисленных параметров системы. Выполненный нами анализ предельных случаев даст в будущем возможность сравнивать измеренные характеристики во время электролиза с вычисленными, что позволит сделать качественные выводы о том, какие процессы успевают происходить в этой системе.
ОБСУЖДЕНИЕ
Результаты для вариантов 1, 2 и 3 сопоставляются ниже в графической форме. Расчеты выполнены для водного раствора при исходной 0.5 М концентрации бромида, так что суммарная концентрация атомов Br в ходе электролиза сохраняется равной этой величине: ctot = 0.5 М. Предполагается, что рН 2 раствора поддерживается постоянным, несмотря на протекание процессов с участием протонов.
Соотношение между потенциалом Е и редокс-зарядом Q
На рис. 1 показаны зависимости потенциала Е, который может быть измерен индикаторным электродом, от средней степени окисления атомов Br системы х, т.е. от нормированного суммарного редокс-заряда системы Q (который изменяется за счет заряда электролиза Qelchem) для вариантов 1, 2 и 3 ее эволюции.
Рис. 1.
Зависимость равновесного потенциала системы Е (шкала с. в. э.) от изменения (за счет заряда электролиза Qelchem) ее средней степени окисления х, т.е. от ее суммарного редокс-заряда Q, отнесенного к числу атомов Br в системе Ntot = ctotVsol (см. соотношение (12)). Кривые: 1 – расчет 1, 2 – расчет 2, 3 – расчет 3.
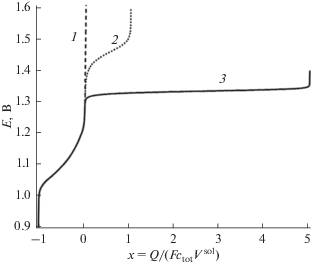
Отметим, что ввиду соотношения (11) началу процесса электролиза (раствор бромида) отвечает х = –1, а максимальная степень окисления зависит от предположения о пути эволюции системы: х = 0 (Br2 в растворенном и, возможно, жидком состояниях) для варианта 1, х = +1 (HBrO и BrO–) для варианта 2, х = +5 $\left( {{\text{BrO}}_{{\text{3}}}^{ - }} \right)$ для варианта 3. При приближении редокс-заряда к соответствующему максимальному значению рассчитанный потенциал индикаторного электрода начинает неограниченно возрастать (рис. 1) в соответствии с уравнением Нернста из-за убывания концентраций соединений с более низкими степенями окисления.
Могло бы показаться, что наличие такого роста потенциала при соответствующем значении нормированного редокс-заряда представляет удобный диагностический критерий для установления того, какой из вариантов реализуется в системе, изучаемой экспериментально.
Такой вывод представляется обоснованным для варианта 2, где величина потенциала должна оставаться в ожидаемом интервале вплоть до значений х, близких к +1 (что позволяет исключить вариант 1), тогда как вблизи значения +1 начинается резкий рост потенциала (что не соответствует предсказаниям варианта 3).
Возможность достигнуть значений х, превышающих +1, представляет явное свидетельство в пользу варианта 3 – при условии, что исключен вклад в заряд электролиза Qelchem за счет процессов, не связанных с изменением степеней окисления атомов Br. Проверка выполнения последнего условия состоит в наличии (или отсутствии) быстрого роста потенциала при подходе к величине х, близкой +5 (рис. 1).
Наиболее сложной является проверка принадлежности системы к варианту 1. Как видно из рис. 1, при приближении заряда к значению, отвечающему х = 0, участок практически вертикального роста потенциала наблюдается на всех кривых 1, 2 и 3, так что различие между ними состоит в величине потенциала Е, при котором этот быстрый рост прекращается. При обнаружении на экспериментальной кривой отклонения от вертикального участка в области потенциалов, отвечающих предсказаниям кривой 2 или кривой 3, можно сделать предварительный вывод о достаточно быстром протекании соответствующих процессов образования оксосоединений брома (см. реакции (5)–(8)). В то же время отклонение от вертикальной прямой х = 0 при более высоких потенциалах нельзя рассматривать как свидетельство в пользу исключения вариантов 2 и 3, поскольку кривые 2 и 3 на рис. 1 рассчитаны для равновесного состояния указанных реакций образования соединений брома с положительными степенями окисления. В реальной системе электродные реакции могут проходить со значительными перенапряжениями, приводящими к сдвигу соответствующей кривой 2 или 3 вверх.
Поэтому не следует делать окончательного вывода о выборе между вариантами 1, 2 и 3 на основе кривых потенциал-заряд (рис. 1), а следует использовать данные о составе раствора для них (см. ниже).
Заметим, что при потенциалах образования атомов брома в положительных степенях окисления (выше 1.3 В относительно с. в. э. на рис. 1) становится термодинамически возможной реакция выделения кислорода. Однако на всех известных электродных материалах кислородная реакция протекает со значительным перенапряжением [24, 25]. В частности, даже на платине существенные токи выделения кислорода наблюдаются лишь при потенциалах выше 1.6 В относительно о. в. э. Это позволяет предположить, что выход по току реакции анодного выделения кислорода в условиях, рассматриваемых в работе, будет достаточно низким, так что по крайней мере качественный вид кривых на рис. 1 не изменится. При заметном вкладе кислородной реакции в суммарный заряд электролиза необходимо оценить величину этого вклада при расчете экспериментальных величин заряда Qelchem в соотношении (11), связанного с изменением степени окисления атомов брома.
Другим побочным процессом, который может наблюдаться при столь высоких потенциалах (до 1.6 В относительно с. в. э.), является коррозия материала электрода. Для минимизации ее эффектов следует использовать для проведения электролиза такие коррозионно-устойчивые материалы, как платина, электропроводные оксиды (RuO2, IrO2, PbO2) или допированный бором алмаз (BDD). В этом случае можно считать, что величина Qelchem будет близка к измеряемому заряду электролиза.
Соотношение между распределениями концентраций ci и суммарным редокс-зарядом Q
На рис. 2 показано изменение состава раствора в зависимости от заряда электролиза Qelchem, т.е. изменения суммарного редокс-заряда системы Q, пересчитанного на среднюю степень окисления атомов Br х (рис. 1). Результаты расчетов для вариантов 1, 2 и 3 приведены, соответственно, на рис. 2а, 2б и 2в. Интервал изменения значений х на каждом из них выбран в соответствии с показываемым вариантом, как и на рис. 1. При этом масштаб вдоль оси х выбран одинаковым для всех этих рисунков для наглядности их сопоставления.
Рис. 2.
Изменение состава раствора (концентрации nici в соотношении (14)) в зависимости от средней степени окисления атомов Br х в ходе электролиза (см. подпись к рис. 1) для вариантов 1 (а), 2 (б) и 3 (в). Линии на всех рисунках (а)–(в) отвечают соединениям: Br– (1), ${\text{Br}}_{{\text{3}}}^{ - }$ (2a), ${\text{Br}}_{{\text{5}}}^{ - }$ (2б), Br2 (3а), ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ (3б), HBrO (4а), ${\text{BrO}}_{{\text{3}}}^{ - }$ (5). Для каждого соединения i дается молярная концентрация атомов Br в нем, т.е. nici (см. табл. 1).

Вместо концентрации каждого соединения ci на рис. 2 дается концентрация атомов в нем, т.е. величины ni ci, где числа ni даны в табл. 1. Преимущество такого выбора в том, что именно такая величина отражает относительный вклад данного соединения в суммарную концентрацию атомов Br системы ctot ввиду соотношения (14), т.е. при каждом значении х сумма концентраций на рис. 2 равна ctot.
Сравнение рис. 2а, 2б и 2в показывает совпадение эволюции состава раствора на них в интервале значений х между –1 и 0. Эта область показана также на рис. 3a наложением результатов для вариантов 1 и 2. Сначала происходит постепенное уменьшение концентрации Br– (линия 1) за счет роста в основном ${\text{Br}}_{{\text{3}}}^{ - }$ (с учетом 3 атомов Br в каждом ионе), а также Br2 и ${\text{Br}}_{{\text{5}}}^{ - }.$ Во второй половине этого интервала следует убывание сначала трибромида, а потом и пентабромида, тогда как концентрация растворенного молекулярного брома быстро растет.
Рис. 3.
Сопоставление эволюций состава раствора (концентрации nici в соотношении (14)) для начального этапа электролиза для вариантов 1 (3б ') и 2 (1, 2a, 2б, 3а, 3б. Линии на всех рисунках (а)–(в) отвечают соединениям: Br– (1), ${\text{Br}}_{{\text{3}}}^{ - }$ (2a), ${\text{Br}}_{{\text{5}}}^{ - }$ (2б), Br2 (3a), ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ (3б), HBrO (4a), ${\text{BrO}}_{{\text{3}}}^{ - }$ (5) – расчет 1; ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ (3б′) – расчет 2. (а) Область –1 < x < 0, где соответствующие сплошные и пунктирные графики сливаются. (б) Область вблизи х = 0, где видно слабое различие графиков ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ (линии 3б′ и 3б) для вариантов 1 и 2.

Незадолго до достижения значения х = 0 эта концентрация (Br2) достигает своего максимального значения 0.185 М, отвечающего насыщенному раствору Br2 в воде. При дальнейшем увеличении х концентрация Br2 остается постоянной, тогда как оставшаяся часть атомов Br (0.5 М – 2 × × 0.185 М = 0.13 М) переходит в фазу жидкого брома ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ (рис. 3a).
Эволюция в окрестности х ≅ 0 показана более детально на рис. 3б, где можно видеть очень небольшое различие между графиками для количества жидкого брома для вариантов 1 (пунктир, чуть выше, заканчивается при х = 0) и для варианта 2 (сплошная кривая, продолжается при х > 0). Это различие между предсказаниями для ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ связано с началом образования HBrO при малых отрицательных значениях х для варианта 2.
Таким образом, внутри интервала –1 < x < 0 электролиз приводит лишь к переходу между исходным соединением со степенью окисления –1 (бромид-ион) и нейтральными молекулами брома в растворенном и жидком состояниях (степень окисления 0) через соединения с промежуточными степенями окисления (трибромид- и пентабромид-анионы), тогда как возможность образования оксосоединений брома с положительными степенями окисления практически не реализуется из-за более высоких стандартных потенциалов соответствующих реакций.
Прогноз равновесного состава анолита при положительных значениях х можно реализовать только для вариантов 2 (рис. 2б) и 3 (рис. 2в). Сравнение расчетных концентраций соединений в этом интервале показывает полное различие для этих вариантов.
Возможность образования только соединений со степенью окисления +1 (вариант 2, рис. 2б) показывает, что превышение величиной х значения 0 приводит к быстрому росту концентрации HBrO (линия 4а) по линейному закону (концентрация BrO– очень мала ввиду низкого рН раствора), сначала за счет исчезновения фазы жидкого брома (линия 3б), а потом и его растворенной части (линия 3a), так что при х = +1 в системе остается практически только HBrO.
Совершенно другой характер эволюции предсказывает вариант 3 (рис. 2в). В этом случае окисление молекулярного брома (сначала за счет его жидкой фазы, а потом и за счет его раствора: линии 3б и 3а) приводит к линейному росту концентрации бромата (линия 5), тогда как HBrO и BrO– с промежуточной степенью окисления +1 практически отсутствуют. Электролиз завершается при х = +5, где бромат представляет единственный компонент системы.
Таким образом, проведение измерений состава раствора (например, по измерениям спектров раствора в УФ-видимом диапазоне длин волн света [13]) при электролизе в интервале x > 1 позволяет однозначно различить варианты эволюции 1, 2 и 3. В варианте 1 атомы брома остаются в их нулевой степени окисления (молекулярный бром); в варианте 2 происходит переход между молекулярным бромом и HBrO; наконец, в варианте 3 убыль молекулярного брома сопровождается ростом концентрации бромат-аниона.
Соотношение между распределением концентраций ci и потенциалом Е
Для полноты картины на рис. 4 даются иллюстрации эволюции состава раствора во время электролиза в зависимости от потенциала индикаторного электрода.
Рис. 4.
Изменение состава раствора в ходе электролиза (концентрации nici в соотношении (14)) в зависимости от потенциала Е (шкала с. в. э.) для вариантов 1 (а), 2 (б) и 3 (в). Линии на всех рисунках (а)–(в) отвечают соединениям: Br– (1), ${\text{Br}}_{{\text{3}}}^{ - }$ (2a), ${\text{Br}}_{{\text{5}}}^{ - }$ (2б), Br2 (3a), ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ (3б), HBrO (4a), ${\text{BrO}}_{{\text{3}}}^{ - }$ (5).

Практическое совпадение линий на рис. 1 для вариантов 1, 2 и 3 в интервале –1 < x < 0 означает, что выводы, сделанные при анализе эволюции состава раствора в зависимости от редокс-заряда системы (рис. 2 и 3), непосредственно переносятся и на зависимости состава от потенциала электрода в соответствующем интервале ниже 1.3 В, что, естественно, подтверждается при анализе данных на рис. 4.
В то же время существенно различаются формы изменения концентраций на рис. 2 и 4, что обусловлено большой протяженностью интервала потенциалов на рис. 1 для этого диапазона зарядов. A именно, переход бромида в молекулярный бром (растворенный и жидкий) оказывается широко растянутым по сравнению с нернстовским интервалом за счет того, что он фактически состоит из двух последовательных переходов: 1) Br– в ${\text{Br}}_{{\text{3}}}^{ - }$ + ${\text{Br}}_{{\text{5}}}^{ - };$ 2) ${\text{Br}}_{{\text{3}}}^{ - }$ + ${\text{Br}}_{{\text{5}}}^{ - }$ в Br2 + ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}.$ Для значения суммарной концентрации ctot, равной 0.5 М, доля пентабромида в промежуточной области потенциалов в несколько раз меньше доли трибромида, несмотря на большее число атомов Br в этом ионе. Накопление молекулярного брома начинается с его растворенной формы, тогда как после достижения ее насыщенной концентрации (${{c}_{{{\text{B}}{{{\text{r}}}_{{\text{2}}}}}}}$ = 0.185 М) рост ее концентрации останавливается, и появляется нарастающий вклад жидкой фазы ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}.$
После окончания этих переходов концентрации Br2 и ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ в рамках варианта 1 прекращают меняться из-за отсутствия процессов с образованием оксобромных соединений (рис. 4a). Напротив, эволюция состава системы продолжается в вариантах 2 и 3, однако совершенно различными способами.
В варианте 2 (рис. 2б) выше потенциала 1.35 В начинается переход молекулярного брома (сначала из его жидкой фазы, потом из раствора) в HBrO с шириной порядка 200 мВ, после чего эволюция заканчивается. Напротив, в варианте 3 соединений со степенью окисления +1 вообще по существу не образуется, а в очень узкой области потенциалов (порядка 50 мВ) молекулярный бром переходит в ${\text{BrO}}_{{\text{3}}}^{ - }.$ Следует еще раз подчеркнуть, что эти предсказания сделаны в предположении о достаточно быстром протекании соответствующих стадий (5)–(8), так что они находятся в квазиравновесном состоянии в ходе электролиза.
Эволюция состава раствора в зависимости от потенциала Е для вариантов 1, 2 и 3 (рис. 4) показана также в полулогарифмических координатах (рис. 5). Уравнение Нернста (в логарифмической форме) для любого равновесия между соединениями брома в различных степенях окисления представляет линейное соотношение между потенциалом E и логарифмами их равновесных концентраций. Поэтому при наличии доминирующего вклада в суммарную концентрацию сtot за счет единственного бромсодержащего соединения (или нескольких соединений с одинаковыми степенями окисления брома) для логарифмов концентраций остальных соединений получаются линейные зависимости от потенциала, наклон которых определяется величинами отношений xi/ni для доминирующего и “примесного” соединений (рис. 5).
Рис. 5.
Изменение состава раствора в ходе электролиза (логарифмическая шкала: lg nici) в зависимости от потенциала Е (шкала с. в. э.) для вариантов 1 (а), 2 (б) и 3 (в). Линии на всех рисунках (а)–(в) отвечают соединениям: Br– (1), ${\text{Br}}_{{\text{3}}}^{ - }$ (2a), ${\text{Br}}_{{\text{5}}}^{ - }$ (2б), Br2 (3a), ${\text{Br}}_{{\text{2}}}^{{{\text{liq}}}}$ (3б), HBrO (4a), ${\text{BrO}}_{{\text{3}}}^{ - }$ (5).

Характерной чертой графиков на рис. 5 является также наглядность областей перехода от одного доминирующего соединения к другому, а также поведение концентраций соединений, которые дают относительно малый вклад в суммарную концентрацию.
ЗАКЛЮЧЕНИЕ
Выполненные теоретические исследования имели целью предсказать изменение характеристик системы в ходе окислительного электролиза бромидсодержащего раствора для трех различных предположений относительно проходящих в ней процессов: варианта 1, когда за время электролиза не образуются оксобромные соединения; варианта 2, когда успевает проходить образование соединений со степенью окисления +1; варианта 3, когда, кроме того, проходят достаточно быстро и процессы образования бромат-аниона. При условии квазиравновесного состояния всех проходящих процессов для трех вариантов эволюции системы было проанализировано изменение концентраций всех бромсодержащих соединений и потенциала индикаторного электрода в зависимости от заряда электролиза, истраченного на редокс-превращения атомов Br внутри этих соединений, а также зависимость этих концентраций от потенциала. Предложено использовать спектроскопический метод для контроля состояния системы и выбора варианта ее эволюции.
Список литературы
Ferro, S. and De Battisti, A., The bromine electrode. Part I: Adsorption phenomena at polycrystalline platinum electrodes, J. Appl. Electrochem., 2004, vol. 34, no. 10, p. 981.
Ferro, S., Orsan, C., and De Battisti, A., The bromine electrode. Part II: reaction kinetics at polycrystalline Pt, J. Appl. Electrochem., 2005, vol. 35, no. 3, p. 273.
Ferro, S., The bromine electrode Part III: reaction kinetics at highly boron-doped diamond electrodes, J. Appl. Electrochem., 2005, vol. 35, no. 3, p. 279.
Bergman, ME.H., Iourtchouk, T., and Rollin, J., The occurrence of bromate and perbromate on BDD anodes during electrolysis of aqueous systems containing bromide: first systematic experimental studies, J. Appl. Electrochem., 2011, vol. 41, no. 9, p. 1109.
Osuga, T. and Sugino, K., Electrolytic production of bromates, J. Electrochem. Soc., 1957, vol. 104, no. 7, p. 448.
Vacca, A., Mascia, M., Palmas, S., Mais, L., and Rizzardini, S., On the formation of bromate and chlorate ions during electrolysis with boron doped diamond anode for seawater treatment, J. Chem. Technology & Biotechnology, 2013, vol. 88, no. 12, p. 2244.
Cettou, P., Robertson, P.M., and Ibl, N., On the electrolysis of aqueous bromide solutions to bromate, Electrochim. Acta, 1984, vol. 29, no. 7, p. 875.
Pavlovic, O.Z., Krstajić, N.V., and Spasojević, M.D., Formation of bromates at a RuO2/TiO2 titanium anode, Surface and Coatings Technology, 1988, vol. 34, no. 2, p. 177.
Conway, B.E., Phillips, Y., and Qian, S.Y., Surface electrochemistry and kinetics of anodic bromine formation at platinum, J. Chem. Soc., Faraday Transactions, 1995, vol. 91, no. 2, p. 283.
Xu, J., Georgescu, N.S., and Scherson, D.A., The Oxidation of Bromide on Platinum Electrodes in Aqueous Acidic Solutions: Electrochemical and In Situ Spectroscopic Studies, J. Electrochem. Soc., 2014, vol. 161, no. 6, p. 392.
Johnson, D.C. and Bruckenstein, S., A Ring-Disk Study of HOBr Formation at Platinum Electrodes in 1.0 M H2SO4, J. Electrochem. Soc., 1970, vol. 117, no. 4, p. 460.
Grgur, B.N., Electrochemical Oxidation of Bromides on DSA/RuO2 Anode in the Semi-Industrial Batch Reactor for On-Site Water Disinfection, J. Electrochem. Soc., 2019, vol. 166, no. 2, p. 50.
Петров, М.М., Локтионов, П.А., Конев, Д.В., Антипов, А.E., Астафьев, Е.А., Воротынцев, М.А. Эволюция состава анолита при окислительном электролизе сернокислого раствора бромида натрия. Электрохимия. 2019. Т. 55. № 1. С. 95. [Petrov, M.M., Loktionov, P.A., Konev, D.V, and Antipov, A.E., Evolution of Anolyte Composition in the Oxidative Electrolysis of Sodium Bromide in a Sulfuric Acid Medium, Russ. J. Electrochem., 2019, vol. 54, no. 12, p. 1233.]
Mastragostino, M. and Gramellini, C., Kinetic study of the electrochemical processes of the bromine/bromine aqueous system on vitreous carbon electrodes, Electrochim. Acta, 1985, vol. 30, no. 3, p. 373.
Chang, J., Bennett, B., and Bard, A.J., Detection of an Unstable Intermediate in Br− Electro-oxidation to ${\text{Br}}_{{\text{3}}}^{ - }$ on a Platinum Electrode in Nitrobenzene by Scanning Electrochemical Microscopy, Electrochim. Acta, 2017, vol. 238, no. 238, p. 74.
Allen, G.D., Buzzeo, M.C., Villagran, C., Hardacre, C., and Compton, R.G., A mechanistic study of the electro-oxidation of bromide in acetonitrile and the room temperature ionic liquid, 1-butyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide at platinum electrodes, J. Electroanal. Chem., 2005, vol. 575, no. 2, p. 311.
Bennett, B., Chang, J., and Bard, A.J., Mechanism of the Br–/Br2 Redox Reaction on Platinum and Glassy Carbon Electrodes in Nitrobenzene by Cyclic Voltammetry, Electrochim. Acta, 2016, vol. 219, p. 1.
Petrov, M.M., Konev, D.V., Kuznetsov, V.V., Antipov, A.E., Electrochemically driven evolution of Br-containing aqueous solution composition, J. Electroanal. Chem., 2019, vol. 836, p. 125.
Kelsall, G.H., Welham, N.J., and Diaz, M.A., Thermodynamics of Cl–H2O, Br–H2O, I–H2O, Au–Cl–H2O, Au–Br–H2O and Au–I–H2O systems at 298 K, J. Electroanal. Chem., 1993, vol. 361, no. 1–2, p. 13.
Field, R.J. and Forsterling, H.-D., On the Oxybromine Chemistry Rate Constants with Cerium Ions in the Field-Koros-Noyes Mechanism of the Belousov-Zhabotinskii Reaction: The Equilibrium HBrO2 + ${\text{BrO}}_{{\text{3}}}^{ - }$ + H+ – ${\text{2BrO}}_{{\text{2}}}^{*}$ + H2O, J. Phys. Chem., 1986, vol. 90, no. 21, p. 5400.
Kshirsagar, G. and Field, R.J., A kinetic and thermodynamic study of component processes in the equilibrium 5 HOBr = 2Br2+ ${\text{BrO}}_{{\text{3}}}^{ - }$ + 2H2O + H+, J. Phys. Chem., 1988, vol. 92., no. 25, p. 7074.
Gyorgyi, L., Turanyi, T., and Field, R.J., Mechanistic details of the oscillatory Belousov-Zhabotinskii reaction, J. Phys. Chem., 1990, vol. 94, no. 18, p. 7162.
Alves, W.A., Téllez, C.A., Sala, S.O., Santos, P.S., and Faria, R.B., Dissociation and rate of proton transfer of HXO3 (X = Cl, Br) in aqueous solution determined by Raman spectroscopy, J. Raman Spectroscopy, 2001, vol. 32, p. 1032.
Tarasevich, M.R., Sadkowsky, A., and Yeager, E., Oxygen Electrochemistry / In Comprehensive Treatise of Electrochemistry. 1983, London: Plenum Press, N.-Y., p. 301-391.
Reier, T., Oezaslan, M., and Strasser, P., Electrocatalytic Oxygen Evolution Reaction (OER) on Ru, Ir, and Pt Catalysts: A Comparative Study of Nanoparticles and Bulk Materials, ACS Catal., 2012, vol. 2, p. 1765.
Дополнительные материалы отсутствуют.


