Электрохимия, 2019, T. 55, № 11, стр. 1318-1326
Аккумуляторная водная литий-ионная батарея, рассчитанная на высокие токи разряда, на основе металлического кадмия и LiCoO2
Ю Лю a, b, Санин Гао a, Рудольф Хольце a, c, d, *
a Хемницкий технологический университет, Институт химии, Отделение электрохимии
D-09107 Хемниц, Германия
b Новый адрес: Отделение химической технологии, Университет Ватерлоо
N2L3G1 Онтарио, Ватерлоо, 200 Университет авеню Вест, Канада
c Государственная главная лаборатория материаловедческого химического машиностроения,
Колледж энергетических наук и технологий и Институт перспективных материалов,
Нанкинский технический университет
211816 провинция Цзянсу, Нанкин, Китай
d Санкт-Петербургский государственный университет, Институт химии
199034 Санкт-Петербург, Россия
* E-mail: rudolf.holze@chemie.tu-chemnitz.de
Поступила в редакцию 14.01.2019
После доработки 28.03.2019
Принята к публикации 20.05.2019
Аннотация
Сообщается о водной перезаряжаемой литий-ионной батарее с металлическим кадмием в качестве отрицательного электрода, наночастицами Li–CoO2 в качестве положительного электрода и водно-нейтральным раствором электролита с 0.5 М Li2SO4 и 10 мМ Cd(Ac)2. Она обладает хорошими электрохимическими характеристиками. Расчетная удельная энергия на основе практически доступной мощности двух электродов составляет 72 Вт ч кг–1; это сопоставимо с никель-кадмиевыми батареями. Положительный ртутный электрод нормального элемента Вестона заменен электродом LiCoO2, отрицательный электрод на основе амальгамы кадмия заменен простым электродом из металлического кадмия. Ртуть полностью исключена. По сравнению с никель-кадмиевыми батареями раствор щелочного электролита не требуется, что делает систему более экологически чистой.
1. ВВЕДЕНИЕ
В настоящее время аккумуляторные технологии обеспечивают выбор систем для хранения прерывистой возобновляемой энергии, поддерживая или даже позволяя использовать энергию ветра и солнца. Среди перезаряжаемых батарей литиевые батареи обладают высокой удельной энергией, но следует учитывать недостатки как для стационарных, так и для мобильных и портативных приложений, включая высокую стоимость и риски, связанные с безопасностью [1, 2]. Кроме того, ионы лития имеют низкую проводимость в растворах органических электролитов, что приводит к недостаточной плотности мощности литий-ионных аккумуляторов [3]. Следовательно, в последние годы широко исследовались водные перезаряжаемые батареи, которые по своей сути безопасны, поскольку позволяют избежать воспламеняющихся растворов органических электролитов. Кроме того, водные растворы электролитов недороги и просты в обращении при сборке. Также ионная проводимость водных растворов электролитов примерно на два порядка выше, чем у органических [4], что обеспечивает работу при высоких токах водных аккумуляторных батарей [5, 6], что также рекомендует их применение для накопления и преобразования энергии.
Нормальный элемент Вестона представляет собой классическую электрохимическую систему, изобретенную Эдвардом Вестоном в 1893 г. [7]. В типичной конфигурации (см. рис. S1 ) элемент Вестона [8] представляет собой стеклянный сосуд Н-образной формы с амальгамой кадмия в качестве отрицательного электрода и простой ртути в качестве положительного. Электрические соединения с ртутью и амальгамой кадмия выполнены с помощью платиновых проводов, впаянных в дно стеклянного сосуда. Используется насыщенный раствор электролита сульфата кадмия. Связанные электродные и суммарная реакции представляют собой:
(1)
$\begin{gathered} {\text{Отрицательный электрод: }} \\ {\text{C}}{{{\text{d}}}^{{2 + }}} + {\text{ }}2{\text{e}} \rightleftarrows {\text{Cd }}\left( {{{E}_{{{\text{SHE}}}}} = {\text{ --}}0.403{\text{ В}}} \right). \\ \end{gathered} $(2)
$\begin{gathered} {\text{Положительный}}\,\,\,\,{\text{электрод:}}\,\,{\text{HgS}}{{{\text{O}}}_{{\text{4}}}}{\text{ + }} \\ {\text{ + }}\,\,{\text{2}}{{{\text{e}}}^{--}} \rightleftarrows {\text{Hg}} + {\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}\,\,\,\,\left( {{{E}_{{{\text{SHE}}}}} = + 0.{\text{613}}\,\,{\text{В}}} \right). \\ \end{gathered} $(3)
$\begin{gathered} {\text{Суммарная}}\,\,{\text{реакция:}}\,\,{\text{2Hg}} + {\text{C}}{{{\text{d}}}^{{{\text{2}} + }}} + {\text{SO}}_{{\text{4}}}^{{{\text{2}} - }} \rightleftarrows \\ \rightleftarrows {\text{H}}{{{\text{g}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}} + {\text{Cd}}\,\,\,\,\left( {U = + {\text{1}}.0{\text{16}}\,\,{\text{В}}} \right). \\ \end{gathered} $Насколько нам известно, нормальный элемент Вестона используется только для калибровки вольтметров в лаборатории из-за его низкого температурного коэффициента, который приводит к очень стабильному напряжению. Тем не менее, он никогда не использовался в коммерческих приложениях, таких как свинцово-кислотные аккумуляторные батареи [9], вероятно, из-за низкого рабочего напряжения и высокотоксичных запасов тяжелых металлов (ртуть и кадмий). В последние десятилетия большинство исследований, связанных с кадмием, было сосредоточено на Ni‒Cd-перезаряжаемых батареях [10, 11] и окислительно-восстановительных батареях (RFB) [12, 13], хотя использование кадмия считалось крайне нежелательным. В ЕС (Директива об ограничении содержания опасных веществ (RoHS), Директива о батареях) продажа никель-кадмиевых батарей и устройств, содержащих такие батареи, подвергалась строгим ограничениям, начиная с 2006 г. Тем не менее, более 1.5 миллиарда никель-кадмиевых батарей все еще выпускается ежегодно (2000 г.) [14], см. также [10, 11]. Очевидно, что никель-кадмиевые батареи по-прежнему занимают огромную долю рынка, что можно объяснить их преимуществами, включая низкую стоимость, высокий ток разряда и простоту конструкции. Кроме того, использованное сырье может быть переработано практически полностью, технические показатели извлечения никеля (96%) и кадмия (99%) очень высоки [15]. Использование кадмия в тщательно контролируемых условиях (т.е., не отмеченных популярным потребителем), безусловно, является жизнеспособным решением, также рекомендуемым высокой стабильностью кадмиевого электрода и его способностью разряжаться высокими токами [16]. Однако растворы щелочных или кислотных электролитов, которые используются в качестве электролитов для никель-кадмиевых батарей или однопоточных аккумуляторов Cd–PbO2, соответственно, вызывают серьезную коррозию оборудования. Кроме того, удельная энергия Ni–Cd аккумуляторов существенно ниже по сравнению с литий-ионными аккумуляторами [10]. Этот недостаток предполагает исследования возможных улучшений.
Чтобы уменьшить количество ртути и щелочи (или кислоты), а также увеличить удельную емкость, здесь мы сообщаем о водной литий-ионной батарее на основе металлического Cd в качестве отрицательного электрода и LiCoO2 в качестве положительного электрода в нейтральном водном электролите 0.5 М Li2SO4 и 10 мМ Cd(Ac)2. Cd(Ac)2 использовали вместо CdSO4, чтобы поддерживать значение pH раствора электролита как можно ближе к нейтральному. Он обладает хорошими характеристиками с кулоновской эффективностью около 100% и способен выдерживать большие токи.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Нитрат лития (LiNO3), нитрат кобальта (Co(NO3)2 ⋅ 6H2O), крахмал ((C6H10O5)n), уксусная кислота (99% CH3COOH), ацетат кадмия (Cd(Ac)2 ⋅ 2H2O) и сульфат лития (Li2SO4) были использованы без дополнительной очистки. Водные растворы готовили с деионизованной сверхчистой водой (Seralpur Pro 90 C).
2.1. Подготовка материалов
Наночастицы LiCoO2 были получены золь-гель методом с использованием крахмала [17]. Сначала, 0.4 г крахмала помещали в круглодонную колбу и в колбу добавляли 25 мл деионизованной сверхчистой воды. Затем смесь нагревали при 110°С при перемешивании до тех пор, пока раствор не стал прозрачным (раствор A). После этого, 5 ммоль нитрата лития и 5 ммоль нитрата кобальта растворяли в 5 мл сверхчистой воды, чтобы получить гомогенный раствор (раствор B). Затем раствор B по каплям добавляли в раствор A при перемешивании, эту смесь выдерживали при 110°C в течение 2 ч. Смесь высушивали при 110°С для получения пенообразного прекурсора. Наконец, осуществляли прокаливание прекурсора при 700°С в течение 36 ч со скоростью нагревания 2°С мин–1, чтобы получить наночастицы LiCoO2.
2.2. Характеристика готовых материалов
Кристаллическая структура полученных наночастиц LiCoO2 была охарактеризована методом порошковой дифракции рентгеновских лучей (XRD) с использованием дифрактометра Rigaku Rotalflex RU-200B с CuKα-излучением, отфильтрованным тонкой никелевой пластиной при 40 кВ и 40 мА при скорости сканирования 0.02 с–1. Сканирующие электронные микрофотографии (SEM) были получены на сканирующем электронном микроскопе JEOL JSM-7500F.
Электрохимические исследования проводили в двухэлектродной ячейке с обоими электродами, погруженными в раствор электролита на расстоянии нескольких миллиметров или в трехэлектродной ячейке с использованием провода из металлического кадмия в качестве электрода сравнения, платиновой пластинки в качестве противоэлектрода и нейтрального водного раствора электролита 0.5 М Li2SO4 и 10 мМ Cd(Ac)2. Положительный электрод готовили прессованием порошкообразной смеси полученных наночастиц LiCoO2, ацетиленовой сажи и поли (тетрафторэтилена) (ПТФЭ) в массовом соотношении 8 : 1 : 1. Полученную пленку перфорировали в небольшой диск массой около 2 мг, площадью 0.25 см2 и толщиной 0.3 мм. Наконец, эти диски были напрессованы на сетки из нержавеющей стали под давлением 10 МПа, а затем высушены при 120°С в течение 12 ч. В качестве отрицательного электрода использовали пластину кадмия (ширина 1.5 см, длина 2.5 см, толщина 0.1 см). Чтобы удалить оксидную пленку с поверхности, перед испытанием ее травили в 50%-ной уксусной кислоте с использованием ультразвуковой ванны в течение 2 мин. Уксусную кислоту использовали в качестве химического полирующего агента, чтобы избежать введения других ионов, таких как ионы нитрата и фосфата. Серную кислоту нельзя использовать в качестве травителя, так как кадмиевая пластина быстро корродирует в сильной кислоте [18].
Для измерения электрохимического импеданса (EIM) использовался потенциостат Solartron SI 1287, подключенный к анализатору частотной характеристики SI 1255, подключенному к ПК. Измерения проводились при самопроизвольно установленном напряжении разомкнутой цепи (OCV) с амплитудой модуляции 5 мВ в диапазоне частот от 0.1 до 105 Гц. Оценка данных импеданса проводилась с использованием программного обеспечения Boukamp версии 2.4. Гальваностатический заряд и разряд между 0.4 и 1.8 В (в сравнении с Cd2+/Cd) выполнялись в двухэлектродной электрохимической ячейке на многоканальном тестере батарей ATLAS 0961 и потенциостате-гальваностате. Циклическая вольтамперометрия (ЦВ) была выполнена на электрохимическом интерфейсе IVIUMSTAT в двухэлектродной, а также трехэлектродной электрохимической ячейке. Все электрохимические измерения проводились при температуре окружающей среды.
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
СЭМ-микрофотография и рентгенограмма полученного LiCoO2 при 700°C представлены на рис. 1. Наночастицы LiCoO2 на рис. 1а имеют размер около 50–100 нм, они агломерированы, образуя объемную структуру с частицами субмикронного размера. На рис. 1б все пики дифракции могут быть проиндексированы на LiCoO2 в соответствии с литературными значениями (JCPDS 50-0653) [19]. Пики при 19.0°, 37.4° и 45.0° можно отнести к плоскостям (003), (101) и (104) LiCoO2, соответственно, которые показывают, что он имеет ромбоэдрическую решетку (пространственная группа R3m) и гексагональную слоистую кристаллическую структуру α-NaFeO2. Эта слоистая структура обеспечивает легкую интеркаляцию/деинтеркаляцию ионов лития во внутреннее пространство, что, в свою очередь, определяет скорость заряда и разряда и, наконец, эффективность батарей [20].
На рис. 2a–2г показаны кривые ЦВ двухэлектродной системы (два кадмиевых электрода) и обычной трехэлектродной системы при различных скоростях сканирования 2, 5, 10 и 20 мВ с–1 соответственно. В случае трехэлектродной ячейки кривые ЦВ показывают только один пик восстановления, который можно отнести к осаждению ионов кадмия. При анодном сканировании происходит растворение металла. В двухэлектродной ячейке Cd//Cd может наблюдаться одна пара симметричных пиков тока. Они связаны с растворением/осаждением металла соответственно. Пиковые потенциалы соответствующих ЦВ согласуются (за исключением незначительного различия из-за небольшой разницы в площади поверхности кадмиевых электродов в двухэлектродной установке), поскольку электрод сравнения в трехэлектродной ячейке находится в состоянии покоя (E0) и напряжение ячейки в двухэлектродной установке можно разделить, поскольку используются симметричные кадмиевые электроды. Различные отклики катодного тока могут быть объяснены применением закона Ома в соответствии с упрощенной электрической схемой, показанной на рис. 2д. Соответствующие уравнения можно выразить следующим образом22:
(4)
$\begin{gathered} {\text{Трехэлектродная система: }} \\ {{I}_{3}}\left( {{{R}_{{{\text{sol}}}}} + {\text{ }}{{R}_{{{\text{Cd}}}}}} \right){\text{ }} = {\text{ }}U_{3}^{2}. \\ \end{gathered} $(5)
$\begin{gathered} {\text{Двухэлектродная система: }} \\ {{I}_{2}}\left( {{{R}_{{{\text{Cd}}}}} + {\text{ }}{{R}_{{{\text{sol}}}}} + {\text{ }}{{R}_{{{\text{Cd}}}}}} \right){\text{ }} = {\text{ }}{{U}_{2}}, \\ \end{gathered} $(6)
${{{{I}_{3}}} \mathord{\left/ {\vphantom {{{{I}_{3}}} {{{I}_{2}}}}} \right. \kern-0em} {{{I}_{2}}}} = {{{{U}_{3}}\left( {2{{R}_{{{\text{Cd}}}}} + {{R}_{{{\text{sol}}}}}} \right)} \mathord{\left/ {\vphantom {{{{U}_{3}}\left( {2{{R}_{{{\text{Cd}}}}} + {{R}_{{{\text{sol}}}}}} \right)} {\left( {{{U}_{2}}\left( {{{R}_{{{\text{Cd}}}}} + {{R}_{{{\text{sol}}}}}} \right)} \right)}}} \right. \kern-0em} {\left( {{{U}_{2}}\left( {{{R}_{{{\text{Cd}}}}} + {{R}_{{{\text{sol}}}}}} \right)} \right)}}.$Рис. 2.
ЦВ трехэлектродной системы и двухэлектродной системы при различных скоростях сканирования: 2 (а), 5 (б), 10 (в) и 20 мВ/с (г); упрощенная модель электрической эквивалентной схемы и (д) гистограмма отношения тока I3/I2 в зависимости от различных скоростей сканирования (е).

Если U3 = U2, с учетом Rsol ≠ 0, уравнение (6) можно упростить:
(7)
${{{{I}_{3}}} \mathord{\left/ {\vphantom {{{{I}_{3}}} {{{I}_{2}}}}} \right. \kern-0em} {{{I}_{2}}}} = {{\left( {2{{R}_{{{\text{Cd}}}}} + {{R}_{{{\text{sol}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {2{{R}_{{{\text{Cd}}}}} + {{R}_{{{\text{sol}}}}}} \right)} {\left( {{{R}_{{{\text{Cd}}}}} + {{R}_{{{\text{sol}}}}}} \right)}}} \right. \kern-0em} {\left( {{{R}_{{{\text{Cd}}}}} + {{R}_{{{\text{sol}}}}}} \right)}} = {\text{const}}.$Следовательно, уравнение Рэндлса–Шевчика (см. ниже) также применимо в двухэлектродной ячейке с учетом соотношения тока (см. уравнение (7)). Для дальнейшего понимания, когда U1 = U2 и Rsol не учитывается (учитывая только поляризационные сопротивления электрода), уравнение (6) может быть далее преобразовано:
(8)
${{{{I}_{3}}} \mathord{\left/ {\vphantom {{{{I}_{3}}} {{{I}_{2}}}}} \right. \kern-0em} {{{I}_{2}}}} = {{2{{R}_{{{\text{Cd}}}}}} \mathord{\left/ {\vphantom {{2{{R}_{{{\text{Cd}}}}}} {{{R}_{{{\text{Cd}}}}}}}} \right. \kern-0em} {{{R}_{{{\text{Cd}}}}}}} = 2.$Расчеты и экспериментальные данные хорошо согласуются, как показано на рис. 2д. CV металлического Cd-электрода при различных скоростях сканирования от 1 до 100 мВ с–1 в 0.5 М водном растворе Li2SO4 и 10 мМ Cd(Ac)2 в диапазоне –0.5 < E (в сравнении с Cd2+/Cd) < 0.5 В показаны на рис. S2 а. Кривые ЦВ отражают хорошую обратимость окислительно-восстановительной реакции Cd2+/Cd благодаря наличию высокосимметричных окислительно-восстановительных пиков даже при высокой скорости сканирования 100 мВ с–1. Это подразумевает, что металлический кадмиевый электрод обладает высокой емкостью. Пиковый потенциал восстановления несколько уменьшается, а пиковый ток восстановления увеличивается с ростом скорости сканирования от 1 до 100 мВ с–1, что указывает на быструю кинетику Cd2+/Cd. Это также может быть доказано путем анализа данных ЦВ с использованием уравнения Рэндлса–Шевчика [21]:
(9)
$\begin{gathered} {{I}_{{\text{p}}}} = 0.4463{{\left( {{{{{F}^{3}}} \mathord{\left/ {\vphantom {{{{F}^{3}}} {RT}}} \right. \kern-0em} {RT}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{n}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}A{{D}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}c{{v}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} = \\ = 2.69 \times {{10}^{5}}{{n}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}A{{D}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}c{{v}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}, \\ \end{gathered} $Циклические вольтамперограммы двухэлектродных аккумуляторов установки Cd//Cd и полных батарей Cd//LiCoO2 с 0.5 М водного электролита Li2SO4 и 10 мМ Cd(Ac)2 при скорости сканирования 5 мВ с–1 показаны на рис. 3. В случае Cd//Cd существует одна пара высокосимметричных окислительно-восстановительных пиков, расположенных при –0.13/0.12 В (по сравнению с Cd2+/Cd), как обсуждалось выше, что связано с уменьшением Cd2+ → Cd. Симметрия говорит о том, что металлический кадмиевый электрод обладает хорошей обратимостью в этом нейтральном водном растворе электролита. Один набор окислительно-восстановительных пиков, связанных с полной батареей Cd//LiCoO2, расположен при напряжении 1.15/1.61 В (по сравнению с Cd2+/Cd), что соответствует интеркаляции/деинтеркаляции ионов Li+ в/из LiCoO2 в водном растворе электролита. Ионный радиус иона Cd2+ составляет 97 пм (радиус Полинга), что больше, чем у Li+ (60 пм, радиус Полинга). Кроме того, ион имеет двойной заряд, по этим причинам он не может легко войти в узлы литий-ионной решетки в LiCoO2. Результирующие напряжения ниже, чем у батареи Cd/PbO2 [12] и кадмиево-железного RFB [13] из-за различных положительных электродов.
Рис. 3.
Кривые ЦВ двухэлектродной системы Cd//Cd и полной батареи Cd/LiCoO2 в водном электролите 0.5 М Li2SO4 и 10 мМ Cd(Ac)2 при скорости сканирования 5 мВ с–1.

Комбинация из кадмиевого и LiCoO2-электрода представляет собой аккумуляторную батарею со следующими электродом и реакционными ячейками, как показано на схеме 1 .
Схема 1 . Схематическое изображение окислительно-восстановительных реакций для водной аккумуляторной батареи Cd//LiCoO2 во время процессов заряда/разряда.
(10)
${\text{Отрицательный электрод: C}}{{{\text{d}}}^{{2 + }}}{\text{ }} + {\text{ }}2{\text{e}} \rightleftarrows {\text{Cd}},$(11)
$\begin{gathered} {\text{Положительный электрод: }} \\ {\text{LiCo}}{{{\text{O}}}_{2}} \rightleftarrows {\text{L}}{{{\text{i}}}_{{1{\text{ }}--x}}}{\text{Co}}{{{\text{O}}}_{2}} + x{\text{L}}{{{\text{i}}}^{ + }} + x{\text{e}}{\text{.}} \\ \end{gathered} $(12)
$\begin{gathered} {\text{Суммарная}}\,\,{\text{реакция:}} \\ x{\text{/}}2{\text{C}}{{{\text{d}}}^{{2 + }}} + {\text{LiCo}}{{{\text{O}}}_{2}} \rightleftarrows x{\text{/}}2{\text{Cd}} + {\text{ L}}{{{\text{i}}}_{{1{\text{ }}--x}}}{\text{Co}}{{{\text{O}}}_{2}} + x{\text{L}}{{{\text{i}}}^{ + }}. \\ \end{gathered} $Во время заряда Cd2+ осаждается из нейтрального водного раствора электролита на электрод Cd путем получения двух электронов. В то же время LiCoO2 превращается в Li1 –xLiCoO2 путем высвобождения ионов Li+ в раствор электролита. Следовательно, удаленные ионы Cd2+ и высвобожденные ионы Li+ сохраняют заряд всегда сбалансированным. В процессе разряда электрод Cd теряет электроны и высвобождает катионы Cd2+ в нейтральный электролит, тогда как Li1 –xLiCoO2 получает ионы Li+ из электролита, превращаясь в LiCoO2. Это означает, что этой батарее не требуется раствор щелочного электролита и ртутный тяжелый металл по сравнению с никель-кадмиевой батареей и элементом Вестона соответственно. Основной причиной этого является то, что положительный электрод заменен на LiCoO2. В зависимости от определения водных перезаряжаемых литий-ионных батарей (ARLIB) его можно классифицировать как тип ARLIB первого поколения [9, 24]. Относительно низкая концентрация ионов Cd2+ не вызывает чрезмерного перенапряжения электрода во время заряда; он поддерживает низкий уровень запасов мобильных ионов Cd2+. О высокой обратимости кадмиевого электрода сообщалось в других работах [16].
График импеданса батареи Cd//LiCoO2, измеренной до и после нескольких циклов ЦВ при напряжении холостого хода, показан на рис. 4. Данные импеданса были дополнительно проанализированы методом нелинейного наименьшего квадрата (NLLSF) [25–29] в соответствии с эквивалентной схемой, приведенной на рис. 4в. Смоделированные и экспериментальные данные импеданса показаны на рис. 4а и 4б. Формы до и после циклирования схожи с дугой в высокочастотном диапазоне и линией в низкочастотном диапазоне. Результаты расчета элементов в эквивалентной схеме приведены в табл. 1. Перехват на самой высокой частоте на оси действительной части (Z ') представляет омическое сопротивление ячейки (ESR, электрическое последовательное сопротивление), в основном состоящее из сопротивления раствора (Rsol). Очевидно, что Rsol почти одинаково до и после нескольких циклов. Однако наблюдается различие в полукруге в высокочастотной области, соответствующее емкости двойного слоя (Cdl), образованной на электрохимических границах, и сопротивлению переноса заряда (Rct), вызванному реакциями Фарадея положительного и отрицательного электродов. После циклирования Rct = 62.23 Ом больше, чем до (Rct = = 11.27 Ом), что может быть вызвано низкой проводимостью побочного продукта Cd(OH)2, образующегося при перезаряде с выделением водорода, или Cd-дендритами, осажденными во время заряда (см. рис. S3 ). На низких частотах линейная часть приписывается диффузии/переносу ионов в растворе электролита, так называемой диффузии Варбурга [26]. Элемент с постоянной фазой (QCPE), предполагаемый вместо идеального конденсатора для представления двухслойной емкости, был выбран для учета неидеального поведения границы раздела металл/раствор. Это отклонение объясняется неоднородностями поверхности/границы раздела [30], в частности энергетическими [31], включая неравномерное распределение заряда на границах зерен, распределение удельного сопротивления в пленках на поверхностях электродов [32, 33], и приводит к искаженным полукругам в комплексной плоскости диаграммы Найквиста. Это выражается следующим образом [34]:
(13)
${{Q}_{{{\text{(CPE)}}}}} = {{\left( {{{Y}_{{\text{o}}}}{{{\left( {j\omega } \right)}}^{n}}} \right)}^{{ - 1}}},$Рис. 4.
Диаграммы Найквиста экспериментальных данных и смоделированных данных для батареи Cd//LiCoO2 до (а) и после (б) 50 циклов, эквивалентная схема, используемая для аппроксимации спектров импеданса (в).
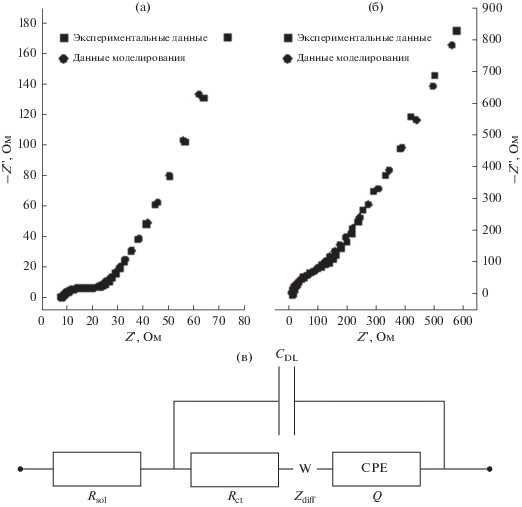
Таблица 1.
Результаты оценки импеданса
| Период | Rsol, Ом | Rct, Ом | CDL, Ф | Yo (=1/Q, n = 1)/S | Yo (=1/Zdiff)/S |
|---|---|---|---|---|---|
| До циклирования | 8.15 | 11.27 | 1.34 × 10–5 | 1.33 × 10–3 | 5.60 × 10–3 |
| После циклирования | 8.55 | 62.23 | 4.88 × 10–5 | 4.99 × 10–3 | 1.58 × 10–3 |
Электрохимические характеристики батареи Cd//LiCoO2 при различных плотностях тока от 0.4 до 1.8 В представлены на рис. 5. Обратимая емкость батареи составляет 122.3 мА ч г–1 при 0.2 А г–1 на основе положительного электрода LiCoO2, что аналогично ранее сообщенным значениям для водных растворов электролитов [35, 36]. В этом случае среднее напряжение разряда/заряда составляет 1.2 и 1.6 В, соответственно, что соответствует результатам ЦВ. При увеличении плотности тока заряда/разряда от 0.4, 0.6, 0.8, 1.0, 1.5, 2.0 до 3.0 А г–1 разрядная емкость уменьшается с 118.5, 111.5, 103.6, 100.1, 92.9, 823 до 69.4 мА ч г–1 соответственно. Это означает, что аккумулятор Cd//LiCoO2 можно быстро заряжать и разряжать, а также он может удовлетворить требования к быстрому заряду, предъявляемые к источнику питания и потребностям портативных и мобильных устройств. Кроме того, эта высокоскоростная способность сравнима с возможностями батарей Zn//LiNi1/3Co1/3Mn1/3O2 и Zn//Na0.95MnO2 [5, 37]. Основной причиной этого является быстрая окислительно-восстановительная кинетика Cd2+/Cd (см. Также кинетические данные, представленные ранее [25]), что согласуется с результатами ЦВ (см. рис. S2a ). Что касается отрицательного Cd-электрода, теоретическая емкость составляет 477 мА ч г–1. Используя примерно четверть этого в нынешней системе батарей, практическая емкость металлического Cd составит около 119 мА ч г–1. Учитывая, что емкость LiCoO2 (122 мА ч г–1) и среднее напряжение разряда (1.2 В), дальнейшая расчетная удельная энергия составит 72 Вт ч кг–1 на основе двух электродов. Это значение конкурирует с никель-кадмиевыми батареями.
Рис. 5.
Кривые заряда–разряда батареи Cd//LiCoO2 при различных плотностях тока на основе положительного электрода LiCoO2 (a) и циклическое поведение батареи при 700 мА г–1 на основе LiCoO2 (б).

Циклическая характеристика полностью заряженной батареи Cd//LiCoO2 на основе емкости LiCoO2 107 мА ч г–1 при плотности тока 700 мА г–1 (рис. 5б) показывает кулоновскую эффективность около 100% за исключением начальных циклов, такое поведение также наблюдается с литий-ионными батареями. Ячейка показывает отличную обратимость заряда/разряда. После 100 полных циклов сохранение емкости составляет 75.8% по сравнению с первыми циклами. Возможные причины этого: в случае положительного электрода LiCoO2 на устойчивость к циклированию и высокую скорость влияет размер наночастиц. В частности, нанокристаллический LiCoO2 обладает превосходной скоростью по сравнению с объемным LiCoO2. С другой стороны, небольшой размер нанокристаллов LiCoO2 приводит к более низкой стабильности циклирования по сравнению с объемным LiCoO2 [38]. Тем не менее, наблюдаемая стабильность, очевидно, обусловлена устойчивой комбинацией объемного и нанокристаллического материала в LiCoO2 положительном электроде (см. рис. 1а). Что касается отрицательного Cd-электрода, образование кадмиевых дендритов было продемонстрировано на рис. S3 . Другая причина – расщепление воды, которое уже начинается вокруг потенциала осаждения кадмия согласно диаграмме Пурбе [36, 39]. Во время расщепления воды образуется Cd(OH)2, истощающий запас ионов кадмия, что приводит к низким числам циклов.
4. ВЫВОДЫ
В заключение, водная перезаряжаемая литий-ионная батарея была собрана с использованием металлического Cd в качестве отрицательного электрода, наночастиц LiCoO2 в качестве положительного электрода и водного раствора нейтрального электролита с 0.5 М Li2SO4 и 10 мМ Cd(Ac)2. Среднее напряжение разряда составляет 1.2 В, а удельная емкость разряда составляет 107 мА ч г–1 на основе LiCoO2 при плотности тока 700 мА г–1.
После 100 циклов сохранение емкости составляет 75.8% по сравнению с первыми циклами между 0.4 и 1.8 В. Расчетная удельная энергия составляет 72 Вт ч кг–1, исходя из практической мощности двух электродов. Результаты показывают, что положительный ртутный электрод нормального элемента Вестона может быть заменен электродом LiCoO2. Щелочной электролит не нужен по сравнению с никель-кадмиевыми батареями. Следовательно, эта система батарей может быть хорошим кандидатом в качестве источника питания для портативных устройств и для крупномасштабного накопления энергии.
Список литературы
Wang, X.W., Wang, F.X., Wang, L., Li, M., Wang, Y., Chen, B., Zhu, Y., Fu, L., Zha, L., Zhang, L., Wu, Y.P., and Huang, W., Adv. Mater., 2016, vol. 28, p. 4904.
Choi, N.S., Chen, Z., Freunberger, S.A., Ji, X., Sun, Y.K., Amine, K., Yushin, G., Nazar, L.F., Cho, J., and Bruce, P.G., Angew. Chem. Int. Ed., 2012, vol. 51, p. 9994.
Wang, X.W., Li, M.X., Wang, Y.F., Chen, B.W., Zhu, Y.S., and Wu, Y.P., J. Mater. Chem., 2015, vol. A 3, p. 8280.
Holze, R., Landolt-Börnstein: Numerical Data and Functional Relationships in Science and Technology, New Series, Group IV: Physical Chemistry, Volume 9: Electrochemistry, Subvolume B: Ionic Conductivities of Liquid Systems, Part 2: Deep Eutectic Solvents and Electrolyte Solutions, W. Martienssen, M.D. Lechner, Eds., Springer-Verlag, Berlin, 2016.
Wang, F.X., Liu, Y., Wang, X.W., Chang, Z., Wu, Y.P., and Holze, R., ChemElectroChem., 2015, vol. 2, p. 1024.
Wang, F.X., Yu, F., Wang, X., Chang, Z., Fu, L.J., Zhu, Y.S., Wen, Z.B., Wu, Y.P., and Huang, W., ACS Appl. Mater. Interfaces., 2016, vol. 8, p. 9022.
E. Weston, Voltaic cell, US Patent 494827, April 4th, 1893.
Bard, A.J., Inzelt, G., and Scholz, F., Electrochemical Dictionary, 2nd ed., Heidelberg: Springer-Verlag, 2012.
Liu, Y., Wen, Z.B., Wu, X.W., Wang, X.W., Wu, Y.P., and Holze, R., Chem. Commun., 2014, vol. 50, p. 13714.
Gao, P., Wang, Y., Zhang, Q., Chen, Y., Bao, D., Wang, L.Q., Sun, Y.Z., Li, G.B., and Zhang, M.L., J. Mater. Chem., 2012 vol. 22, p. 13922.
Zhang, J.X., Yu, J.X., and Cha, C., Int. J. Electrochem. Sci., 2012, vol. 7, p. 10233.
Pan, J.Q., Yang, M., Jia, X., and Sun, Y.Z., J. Electrochem. Soc., 2013, vol. 160, p. A1146.
Zeng, Y.K., Zhao, T.S., Zhou, X.L., Wei, L., and Jiang, H.R., J. Power Sources, 2016, vol. 330, p. 55.
Solucorp Industries Ltd., as published in: Business Wire 2006-10-19
Randhawa, N.S., Gharami, K., and Kumar, M., Hydrometallurgy, 2016, vol. 16, p. 191.
Liu, Y., Gao, S., Holze, R., and Shukla, A.K., J. Electrochem. Soc., 2017, vol. 164, p. A3858.
Tang, W., Tian, S., Liu, L.L., Li, L., Zhang, H.P., Yue, Y.B., Bai, Y., Wu, Y.P., and Zhu, K., Electrochem. Commun., 2011, vol. 13, p. 205.
Tegart, W.J.M.G., The Electrolytic and Chemical Polishing of Metals in Research and Industry, London: Pergamon Press, 1959.
Xiao, X.L., Yang, L.M., Zhao, H., Hu, Z.B., and Li, Y.D., Nano Res., 2012, vol. 5, p. 27.
Wang, G.J., Qu, Q.T., Wang, B., Shi, Y., Tian, S., Wu, Y.P., and Holze, R., Electrochim. Acta, 2009, vol. 54, p. 1199.
Chang, Z., Wang, X.J., Yang, Y.Q., Gao, J., Li, M.X., Liu, L.L., and Wu, Y.P., J. Mater. Chem., 2014, vol. A 2, p. 19444.
Andrei, P., Zheng, J.P., Hendrickson, M., and Plichtac, E.J., J. Electrochem. Soc., 2012, vol. 159, p. A770.
Trahan, M.J., Mukerjee, S., Plichta, E.J., Hendrickson, M.A., and Abrahama, K.M., J. Electrochem. Soc., 2013, vol. 160, p. A259.
Chang, Z., Yang, Y.Q., Li, M.X., Wang, X.W., and Wu, Y.P., J. Mater. Chem., 2014, vol. A 2, p. 10739.
Liu, Y., Wiek, A., Dzhagan, V., and Holze, R., J. Electrochem. Soc., 2016, vol. 163, p. A1247.
Yan, J., Fan, Z.J., Wei, T., Qian, W.Z., Zhang, M.L., and Wei, F., Carbon, 2010, vol. 48, p. 3825.
Lasia A., Electrochemical Impedance Spectroscopy and its Applications, New York: Springer, 2014.
Holze, R., Bull. Electrochem., 1994, vol. 10, p. 56.
Barsoukov, E. and Macdonald, J.R., Impedance Spectroscopy, Hoboken: WILEY INTERSCIENCE, 2005.
Shi, J. and Sun, W., Corr. Sci. Prot. Technol., 2011, vol. 23, p. 387.
Córdoba-Torres, P., Mesquita, T.J., and Nogueira, R.P., J. Phys. Chem., 2015, vol. C 119, p. 4135.
Hirschorn, B., Orazem, M.E., Tribollet, B., Vivier, V., Frateur, I., and Musiani, M., J. Electrochem. Soc., 2010, vol. 157, p. C452.
Musiani, M., Orazem, M.E., Pébère, N., Tribollet, B., and Vivier, V., J. Electrochem. Soc., 2011, vol. 158, p. C424.
Burashnikova, M.M., Kazarinov, I.A., and Zotova, I.V., J. Power Sources, 2012, vol. 207, p. 19.
Wang, X.J., Qu, Q.T., Hou, Y.Y., Wang, F.X., and Wu, Y.P., Chem. Commun., 2013, vol. 49, p. 6179.
Ruffo, R., Wessells, C., Huggins, R.A., and Cui, Y., Electrochem. Commun., 2009, vol. 11, p. 247.
Zhang, B.H., Liu, Y., Wu, X.W., Yang, Y.Q., Chang, Z., Wen, Z.B., Wu, Y.P., Chem. Commun., 2014, vol. 50, p. 1209.
Okubo, M., Hosono, E., Kim, J., Enomoto, M., Kojima, N., Kudo, T., Zhou, H.S., and Honma, I., Am. J. Chem. Soc., 2007, vol. 129, p. 7444.
Pourbaix, M., Atlas of electrochemical equilibria in aqueous solutions, Houston: National Association of Corrosion Engineers, TX 1974.
Дополнительные материалы отсутствуют.




