Электрохимия, 2020, T. 56, № 12, стр. 1073-1082
Вторичное восстановление тугоплавкого металла у гладкого катода при электролизе солевого расплава. 3. Численное воспроизведение натурного эксперимента при катодном восстановлении Nb в расплаве KNaCl2–NaF–K3NbF7
А. П. Храмов a, *, А. А. Чернышёв a, b, **, А. В. Исаков a, А. В. Суздальцев a, Ю. П. Зайков a, b
a Институт высокотемпературной электрохимии УрО РАН
620137 Екатеринбург, ул. Академическая, 20, Россия
b Уральский федеральный университет им. первого Президента России Б.Н. Ельцина,
Химико-технологический институт
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: a.khramov@ihte.uran.ru
** E-mail: aac-vp@yandex.ru
Поступила в редакцию 17.07.2019
После доработки 13.12.2019
Принята к публикации 06.03.2020
Аннотация
В рамках модели стационарного процесса вторичного восстановления ионов тугоплавкого металла щелочным металлом (или щелочноземельным), образующимся на гладком катоде в ходе электролиза солевого расплава, проведено численное воспроизведение натурного эксперимента. Модельные расчеты сделаны на основе поляризации, измеренной при катодном восстановлении Nb в хлоридно-фторидном расплаве, [Nb] = 2.4 мол. %, 800°C, плотность тока i − до 5.4 А/см2. Показано, что на гладком катоде в интервале перенапряжения 0.21−0.41 В (i = 0.75−1.17) должна происходить полная смена механизма восстановления с первичного на вторичное. Зона вторичного восстановления находится внутри диффузионного слоя и отодвигается от катода при увеличении i. Даже при максимальной в данном случае i, эта зона остается внутри δ (δ − толщина диффузионного слоя): при i = = 0.96, координата максимума скорости вторичного восстановления xm = 0; при i = 5.4, xm = 0.93δ (в эксперименте не достигнута i, когда xm ≥ δ). При i = 5.4 доля вторичного восстановления в объеме незначительна, ≈10–5 А/см2. Рассчитана кривая δ–E: при смещении E от равновесного значения в отрицательную сторону, |i| увеличивается от нуля и выше, а δ сначала уменьшается на порядок, а затем увеличивается. Соответственно величина предельного диффузионного тока не является константой при неизменной концентрации [Nb] в объеме. Это является причиной нечеткого предельного тока на стационарных катодных поляризационных кривых при электролизе металлов в расплавах. Предложена гипотеза о зависимости толщины диффузионного слоя Нернста у катода от плотности тока выше предельной диффузионной в условиях вторичного восстановления.
ВВЕДЕНИЕ
В работе [1] представлена модель стационарного процесса вторичного восстановления тугоплавкого металла у гладкого катода, в работе [2] даны результаты расчетов по этой модели для гипотетических экспериментов. В случае натурного эксперимента модель можно использовать для оценки коэффициента диффузии в том случае, если удастся определить или задать точное значение толщины диффузионного слоя δ. Модель позволяет рассчитать ток i2V вторичного восстановления в объеме при разных условиях электролиза. Однако представляется наиболее естественное использование модели – для объяснения поляризационных кривых и для извлечения информации из них. При этом результаты расчетов – это продукт переработки стационарных поляризационных кривых в предположении чисто диффузионной кинетики. Во всех случаях полезны и наглядны простые расчеты токов первичного восстановления на поверхности (i1), вторичного в объеме (i2V) и у катода (i2Cat) по уравнениям (53), (55), (42) в [1] для точек на оси расстояний от катода x = 0 и x = δ, при различных потенциалах. В итоге при численном воспроизведении натурных экспериментов получаются зависимости E–i1, E–i2, E–i2V, а также кривая изменения толщины диффузионного слоя в зависимости от потенциала δ–E (или от i). Предлагаемый метод не требует громоздких вычислений разных зависимостей от x/δ, однако после дополнительных расчетов можно получить также профили скорости VAM–x/δ и тока вторичного восстановления i2x–x/δ.
В настоящей работе нам важно проследить, к каким следствиям для понимания вторичного восстановления тугоплавкого металла у катода приводят расчеты по данной модели для соответствующего натурного эксперимента по измерению стационарной поляризации на гладком катоде в первоначальный период электролиза (до момента разрастания поверхности за счет осажденного металла). Мы взяли случай катодного восстановления ниобия в хлоридно-фторидном расплаве при плотностях тока, соответствующих вторичному восстановлению:
здесь B – щелочной металл. Фоновый электролит – эквимольная смесь хлоридов KCl–NaCl.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Концентрация была задана добавкой пятивалентного ниобия в виде K2NbF7 с последующим растворением присутствующего в электролите металлического Nb в ходе перезаряда с образованием группировок четырехвалентного ниобия ${\text{NbF}}_{{\text{7}}}^{{{\text{3}}--}},$ [Nb] = 2.4 мол. % по катионной подрешетке. Концентрация фтора – добавкой NaF из расчета 30 мол. % общего фтора по анионной подрешетке, или 14.3 мол. % избыток свободного фтора после образования комплексов ${\text{NbF}}_{{\text{7}}}^{{{\text{3}}--}}.$ Итоговый состав в предположении полного перезаряда ниобия со степени окисления Nb5+ до Nb4+, мол. %, по молекулам KCl–NaCl–NaF–K3NbF7: 40.43–40.43–16.55–2.59. Электролит находился в молибденовом стакане, помещенном в стальную реторту, в атмосфере гелия, Т = 800°С. Катод – Nb‑стержень диаметром 3 мм, электрод сравнения – Nb-проволока. На дно поместили Nb-пластину, служившую анодом. Поляризационную кривую строили по точкам. Для каждой плотности тока измерение поляризации проводили методом записи кривой включения тока. Длительность кривой включения до 14–24 с. После регистрации каждой экспериментальной точки поверхность катода заново полировали, для этого ячейка имела шлюзовое устройство. Глубину погружения примерно 10 мм уточняли после регистрации кривой включения и удаления катода из расплава. Для поляризации использовали импульсный гальваностат ВЭЛК-1. Паузы тока были значительно короче импульсов тока, – частота пауз 150 Гц, длительность пауз 40 мкс. Регистратор – запоминающий осциллограф С8-13. Длительность развертки осциллографа на 3–4 порядка больше периода следования пауз тока (период = = 150–1 с). При этом наблюдались две кривые включения. Первая состояла из точек в моменты импульсов тока, вторая в моменты пауз. Во второй кривой отсутствовала IR-составляющая поляризации. Наблюдение двух четких линий возможно только при быстродействующем импульсном гальваностате, когда переходные процессы коммутации тока заканчиваются за время не более 1–5 мкс.
Равновесные потенциалы ниобия относительно хлорного электрода сравнения исследованы в работе [3], и у нас была возможность установить точку отсчета на оси потенциалов при i = 0 относительно этого электрода. На рис. 1 поляризационная кривая представлена в виде экспериментальных точек. Сплошная линия, проведенная по точкам, – это полином пятого порядка, полученный средствами Excel. Эта линия использовалась далее как экспериментальная E, i-кривая.
Рис. 1.
Экспериментальная катодная поляризационная E,i-кривая ниобия в расплаве KCl–NaCl–NaF–K3NbF7, измеренная относительно потенциала Nb и пересчитанная относительно хлорного электрода сравнения. Приведены результаты расчетов, когда в качестве исходных данных взята экспериментальная поляризационная кривая.

ЧИСЛЕННОЕ ВОСПРОИЗВЕДЕНИЕ НАТУРНОГО ЭКСПЕРИМЕНТА
Значения величин, взятые для расчета
Для расчета условной константы равновесия $K_{C}^{{*{\text{*}}}}$ [1] реакции вторичного восстановления (1) сначала надо выбрать, какой именно щелочной металл примет участие в этой реакции. Сравним напряжения разложения хлоридов ε. Для этого воспользуемся данными работы [4], В:
(2)
${{\varepsilon }_{{{\text{NaCl}}}}} = 3.896 - 5.94 \times {{10}^{{ - 4}}}T\,\,\,(T = 1073{\text{--}}1400\,\,{\text{K}}),$(3)
${{\varepsilon }_{{{\text{KCl}}}}} = 4.189 - 6.66 \times {{10}^{{ - 4}}}T\,\,\,(T = 1043{\text{--}}1400\,\,{\text{K}}).$В работе [3] исследованы равновесные потенциалы Nb в хлоридно-фторидных расплавах относительно Cl2-электрода. Приведены первичные экспериментальные результаты в виде таблицы равновесных потенциалов: 12 сочетаний концентраций, 4 температуры, 46 вариантов условий, 3 эксперимента для каждого варианта – всего 137 значений. Приведена эмпирическая зависимость потенциала от концентраций в виде (9) в [1] при n = 4, k = 7 (const – в виде эмпирической политермы). Из этой зависимости определяются величины для наших условий (T = 1073 К, NNb = = 0.024, NFсвоб = 0.143 моль/моль): равновесный потенциал E = –1.80 В, const = –2.03 В. Однако, если выбрать близкие к нашим условиям табличные данные [3] и непосредственно экстраполировать их на нужные нам концентрации, то получается значение E = –(1.72–1.73) В. При рассмотрении результатов [3] становится ясно, что в данных условиях электрод ${{{\text{N}}{{{\text{b}}}^{{n + }}}} \mathord{\left/ {\vphantom {{{\text{N}}{{{\text{b}}}^{{n + }}}} {{\text{Nb}}}}} \right. \kern-0em} {{\text{Nb}}}}$ безусловно ведет себя подобно электродам второго рода, – его потенциал становится электроотрицательнее при неизменной концентрации катионов ниобия по мере увеличения концентрации анионов фтора, которые в среде хлоридных расплавов дают с катионами ниобия комплексные ионы. Таким образом, понятна попытка в работе [3] аппроксимировать результаты в виде упомянутого выражения, введенного Смирновым [5] для описания именно таких электродных систем. Однако применение его ограничено случаями, в которых уже достигнуто насыщение фторидного комплекса анионами фтора, и дальнейшее увеличение концентрации фтора не приводит к изменению комплексов и увеличению концентрации связанного фтора, а приводит только к увеличению концентрации свободного фтора. После подробного изучения первичных экспериментальных данных [3] с применением собственных расчетов нам стало ясно, что это выражение очень нечетко аппроксимирует полученные результаты. Достоверность аппроксимации резко возрастает, если взять величины “const” и “k” не как константы, а как корреляционные коэффициенты, которые меняются в зависимости от концентраций, а величина k принимает не только целые, но и дробные значения. Не исключено, что в данном случае имеется несколько комплексов. Это требует отдельного рассмотрения. В данной работе мы приняли вариант: n = 4, k = 7 и сдвиг на +0.04 В значения E за счет значения const, рассчитанных по эмпирической политерме [3]. Таким образом взяли для дальнейших расчетов E = –1.76 В, const = –1.99 В. В том случае, если более правильным значением E считать минус 1.72–1.73 В, то здесь уместно заметить, что в дальнейших расчетах такое смещение равновесного потенциала в положительную сторону несколько усилит эффект изменения толщины диффузионного слоя при изменении плотности тока по сравнению с эффектом, представленным ниже.
Мольный объем фонового электролита рассчитали через мольные объемы KCl, NaCl, NaF по правилу аддитивности, $V = 39.55$ см3/моль. Значение условной константы равновесия, рассчитанное по выражению (11) в [1] при ${{N}_{{{{{\text{B}}}^{{m + }}}}}}$ = = ${{N}_{{{\text{N}}{{{\text{a}}}^{ + }}}}}$ = 0.5288, $K_{C}^{{{\text{**}}}}$ = 6.3 × 1021. Другие исходные данные, которые взяли для численного воспроизведения эксперимента, обозначения как в [1]: T = = 1073 К, cA0 = ${{C}_{{{\text{NbF}}_{7}^{{3 - }}}}}$ = 6.07 × 10–4 моль/см3, cL0 = = ${{c}_{{{{{\text{F}}}^{ - }}}}}$ = 3.62 × 10−3, DA = ${{D}_{{{\text{NbF}}_{7}^{{3 - }}}}}$ = 2 × 10−5 см2/с, DB = ${{D}_{{{\text{N}}{{{\text{a}}}^{0}}}}}$ = 3.5 × 10−3, DL = ${{D}_{{{{{\text{F}}}^{ - }}}}}$ = 5 × 10−5, ${{a}_{{{\text{N}}{{{\text{a}}}^{ + }}}}}$ = ${{N}_{{{\text{N}}{{{\text{a}}}^{ + }}}}}$ = 0.5288, γ∞ = 70. Коэффициент диффузии восстановленного натрия взят из исследования Ковалевского [6]. Коэффициент активности натрия при бесконечном разбавлении γ∞ взят из работы Чебыкина [4].
Для того чтобы получить кривые зависимостей δ−E, id−E (рис. 1), нужно только согласование каждой экспериментальной пары значений E−i со значением δ с помощью уравнения согласования постоянных величин. Для этого проводятся вычисления условно постоянных (не зависящих от расстояния) величин по уравнениям (30), (31), (32), (33) в [1], далее полученные величины согласовываются по уравнению (24) в [1]. Чтобы получить кривые E−i1 и E−i2 (рис. 2) достаточно для каждой пары значений E−i cделать расчеты по уравнениям (53), (55) (и (42)) в [1] для точек x = 0 и x = δ соответственно.
Рис. 2.
Поляризационная кривая ниобия с указанием токов первичного и вторичного восстановления, – результаты расчетов, когда в качестве исходных данных взята экспериментальная поляризационная кривая, рис. 1.

Условия при вторичном восстановлении, при которых сохраняется общий вид диффузионной модели Нернста
На рис. 1 приведены результаты расчетов, когда в качестве исходных данных взята экспериментальная поляризационная кривая: δ – толщина диффузионного слоя; xm – координата на оси расстояний от катода внутри диффузионного слоя, – точка максимума скорости VAM вторичного восстановления Nb по реакции (1) (Nb – металл A в терминах работы [1]). Видно, что δ сильно уменьшается при включении и увеличении тока электролиза. В работе [2] мы говорили, что такое поведение δ представляется естественным, – градиент концентрации тяжелого металла в растворе у границы катода приводит к градиенту плотности жидкой фазы. Это усиливает конвекцию и уменьшает δ. Однако δ увеличивается при дальнейшем увеличении плотности тока i, рис. 1. Это требует отдельного рассмотрения, ниже мы остановились на этом моменте. В итоге δ ведет себя сложным образом при изменении i (или E). Это означает, что величина предельного диффузионного тока id не является константой при неизменной концентрации CA0 ионов металла A в объеме, – см. выражение (4) для id в рамках диффузионной модели Нернста:
Кроме того, при вторичном восстановлении градиент концентрации ионов металла A на границе диффузионного слоя не совпадает с градиентом по модели Нернста. Приведем здесь упрощенное выражение (4) в [2] для тока вторичного восстановления при достаточно большой константе равновесия $K_{C}^{{{\text{**}}}}$ реакции вторичного восстановления:
Сравним градиенты для двух последних выражений:
(6)
$\tfrac{{{{c}_{{{\text{A}}0}}}}}{{\delta - {{x}_{{\text{m}}}}}} > \tfrac{{{{c}_{{{\text{A}}0}}}}}{\delta }.$Видно, что градиент концентрации при вторичном восстановлении и градиент по модели Нернста совпадают только тогда, когда xm$ \ll $ δ, при этом i ≈ id (4), (5). Когда величина xm сравнима с δ, плотность тока превышает формальный параметр (4), i > id.
Тем не менее, алгебраическое выражение (4) сохраняет некоторый смысл. Данное текущее значение параметра id показывает, какая плотность тока i установилась бы при данном текущем значении δ, если бы одновременно выполнялись два условия: концентрация ионов металла A на границе катода много меньше, чем в объеме, а зона вторичного восстановления (если вторичное восстановление уже возникло) незначительно удалилась от границы катода. В эксперименте такая ситуация возникает при относительно небольших i, запишем условия этого равенства:
(7)
$i \approx {{i}_{{\text{d}}}}\,\,\,{\text{при}}\,\,\,{{c}_{{{\text{A}}S{\text{Cat}}}}} \ll {{c}_{{{\text{A}}0}}},\,\,\,{{x}_{{\text{m}}}} \ll \delta .$При соблюдении условий (7) профили концентраций имеют приблизительно вид обычных зависимостей c−x/δ для диффузионной модели Нернста, отличие только на очень малых расстояниях x от катода, см. ниже.
В нашем случае условия (7) одновременно выполняются в широкой области потенциалов 1.9 ≤ ≤ –E ≤ 2.75 В (рис. 1), при этом i ≈ id. На этом интервале потенциалов, при смещении E в отрицательную сторону, i и id одновременно увеличиваются за счет уменьшения δ.
При дальнейшем смещении в отрицательную сторону, при –E ≥ 2.75 В, вид концентрационных зависимостей сильно изменяется (например, рис. 1.6 в [2]). Зона вторичного восстановления заметно отодвигается от границы катода (xm увеличивается), и градиент концентрации при вторичном восстановлении больше градиента по модели Нернста (6). Таким образом, изменяющиеся значения плотности тока i становятся больше соответствующих изменяющихся значений формального параметра id по формуле для модели Нернста (4), i > id, рис. 1. Более того, при смещении E в отрицательную сторону в этой области потенциалов i увеличивается за счет уменьшения [δ – xm] (5), а формальный параметр id уменьшается за счет увеличения δ (4).
Результаты расчета
На рис. 2 представлено распределение парциальных токов первичного (i1) и вторичного (i2) восстановления вдоль оси потенциалов. Здесь i2 = = i2Cat + i2V, где i2Cat – суммарный ток вторичного восстановления, израсходованный в пределах диффузионного слоя у катода, i2V – ток вторичного восстановления, израсходованный в объеме (определение тока вторичного восстановления дано в [1] после выражения (45)).
Видно, что на интервале −E = 1.99–2.19 В (этот интервал в единицах перенапряжения −η = 210–410 мВ, i = 0.75–1.17 А/см2), судя по расчетам, должна происходить почти полная смена механизма восстановления с первичного на вторичное. Было интересно провести численные эксперименты в этом интервале потенциалов, а также при более значительных перенапряжениях. В табл. 1 и на рис. 3.1–3.8 представлены результаты расчетов для семи численных экспериментов, воспроизводящих натурные эксперименты при разных потенциалах. На рисунках величина i2x – это ток вторичного восстановления ниобия (металл A), суммарно израсходованный в объеме диффузионного слоя на участке толщиной от 0 до x и площадью 1 см2 (i2x = i2Cat при x = δ).
Таблица 1.
Результаты численного воспроизведения натурных экспериментов
| № | Выбор точки на E–i-кривой и согласование граничных условий | Результат | Рис. | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| E, В | i, А/см2 | δ, см | ${{i}_{1}}$ | ${{i}_{{2{\kern 1pt} {\text{Cat}}}}}$ | ${{i}_{{2{\kern 1pt} V}}}$ | xm/δ | xm, нм | Δx/δ | Δx, нм | ||
| 1 | –2.09 | 0.960 | 4.88 × 10−3 | 0.426 | 0.534 | 1.3 × 10−6 | 0 | 0 | 3 × 10−4 | 15 | 3.1 |
| 2 | –2.16 | 1.109 | 4.23 × 10−3 | 0.020 | 1.089 | 1.6 × 10−6 | 5.6 × 10−5 | 2.4 | 2 × 10−4 | 8.5 | 3.2 |
| 3 | –2.24 | 1.290 | 3.63 × 10−3 | 3.1 × 10−4 | 1.290 | 1.7 × 10−6 | 1.9 × 10−4 | 6.9 | 2.4 × 10−4 | 8.7 | 3.3 |
| 4 | –2.49 | 1.891 | 2.48 × 10−3 | 6.1 × 10−10 | 1.891 | 2.5 × 10−6 | 3.3 × 10−3 | 82 | 2.3 × 10−4 | 5.6 | 3.4 |
| 5 | –2.74 | 2.325 | 2.12 × 10−3 | 0 | 2.325 | 3.1 × 10−6 | 4.8 × 10−2 | 1.0 × 103 | 2.4 × 10−4 | 5.1 | 3.5 |
| 6 | –2.99 | 2.781 | 2.95 × 10−3 | 0 | 2.781 | 3.7 × 10−6 | 0.4298 | 1.3 × 104 | 1.3 × 10−4 | 3.9 | 3.6 |
| 7 | –3.26 | 5.358 | 1.31 × 10−2 | 0 | 5.358 | 7.1 × 10−6 | 0.93322 | 1.2 × 105 | 1.9 × 10−5 | 2.5 | 3.7 3.8 |
Рис. 3.
Результаты численного воспроизведения натурных экспериментов. Условия и числовые значения результатов приведены в табл. 1. Здесь cA = ${{c}_{{{\text{NbF}}_{7}^{{3 - }}}}},$ cB = ${{c}_{{{\text{N}}{{{\text{a}}}^{{\text{0}}}}}}},$ cL = ${{c}_{{{{{\text{F}}}^{ - }}}}}.$
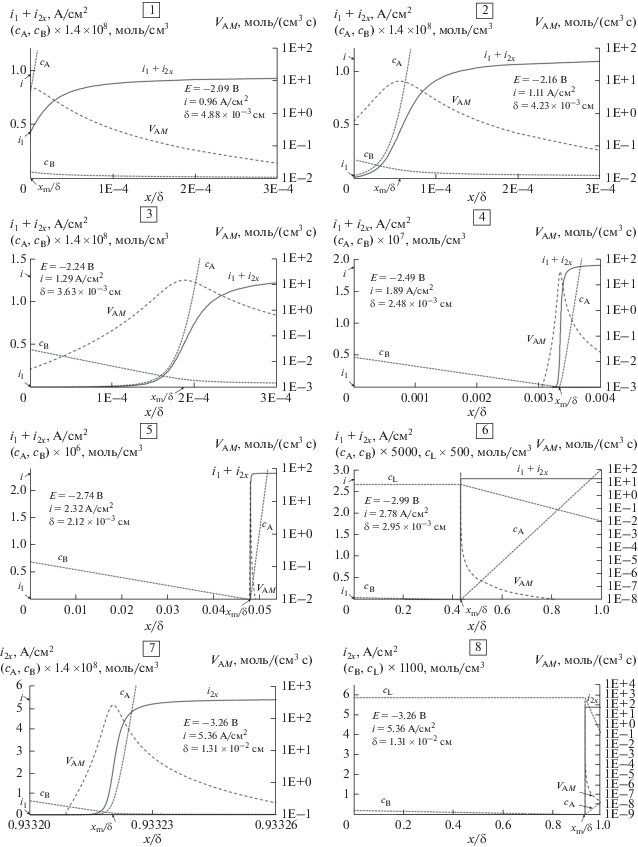
Оказалось, что на первой половине упомянутого интервала потенциалов, на котором происходит смена механизма восстановления, максимум скорости вторичного восстановления VAM приходится на границу катода, xm/δ = 0, рис. 3.1 . На второй половине интервала этот максимум отрывается от границы катода, рис. 3.2 .
При незначительном удалении зоны вторичного восстановления от границы катода относительная ширина Δx/δ, в которой расходуется 95% тока i2Cat, не изменяется, при 0 ≤ xm/δ ≤ 0.05 (в условиях нашего эксперимента, в абсолютных единицах 0 ≤ xm ≤ 1000 нм), Δx/δ ≈ (2−3) × 10−4, табл. 1, численные эксперименты 1–5. При этом такое незначительное удаление зоны вторичного восстановления от границы катода происходит при значительном сдвиге потенциала в отрицательную сторону. Это тот интервал потенциалов, где каждое текущее значение i приблизительно равно соответствующему текущему значению id, рис. 1. Поскольку δ на этом интервале потенциалов уменьшается (а Δx/δ ≈ const), то Δx в абсолютных единицах также значительно уменьшается, – от 15 до 5 нм. При дальнейшем смещении потенциала и увеличении плотности тока до наибольшего значения на поляризационной кривой Δx уменьшается до 2.5 нм, табл. 1.
Судя по результатам расчетов, плотность тока вторичного восстановления за пределами диффузионного слоя катода i2V постепенно увеличивалась по мере увеличения i, но при этом не превышала 10–5 А/см2, табл. 1.
В работе [2] приведено выражение для упрощенных расчетов, указывающее приблизительное положение максимума скорости вторичного восстановления xm:
Полученные результаты численного воспроизведения натурных экспериментов с ниобием позволяют оценить погрешность, которую дает расчет по выражению (8). В табл. 2 приведены значения xm/δ, полученные по формуле (8) и по цифровым Excel-таблицам профилей VAM−x/δ, представленных здесь в виде рис. 3. Из табл. 2 видно, что погрешность результата, полученного по формуле, всегда в сторону завышения. Погрешность становится приемлемой, когда xm/δ ≥ 0.05. Ниже показано, что при увеличении плотности тока, начиная именно с этой области значений xm, есть необходимость учитывать значение xm в расчетах.
Таблица 2.
Значения координаты максимума скорости вторичного восстановления, xm/δ
| № эксперимента в табл. 1 | Точное значение xm/δ по профилю VAM | Оценка xm/δ по формуле (8) | Погрешность xm/δ по формуле (8), % |
|---|---|---|---|
| 1 | 0 | 0.0000345 | − |
| 2 | 0.0000562 | 0.0000935 | +66 |
| 3 | 0.0001876 | 0.0002249 | +20 |
| 4 | 0.0033288 | 0.0033660 | +1.1 |
| 5 | 0.0480015 | 0.0480370 | +0.07 |
| 6 | 0.4297522 | 0.4297734 | +0.005 |
| 7 | 0.9332203 | 0.9332228 | +0.0003 |
Относительно границы диффузионного слоя при вторичном восстановлении на катоде
Остановимся на другой особенности вторичного восстановления – плотность потока реагирующих ионов металла A из объема через границу диффузионного слоя превышает формальный параметр (4) плотности предельного диффузионного тока id (${{j}_{{\text{d}}}}$ в неэлектрических единицах плотности потока массы). Конечно, зона вторичного восстановления отодвигается от границы катода, и градиент концентрации ионов металла A на границе диффузионного слоя увеличивается, обеспечивая соответствующий диффузионный поток вглубь диффузионного слоя от его границы, даже при постоянной толщине диффузионного слоя (см. рис. 3.6, 3.8 ). Однако мы предполагаем, что дело не ограничивается только этим. При увеличении плотности потока массы jA на электроде выше формального параметра jd граница диффузионного слоя должна отодвигаться вглубь объема, ближе к границе слоя Прандтля.
Местоположение границы диффузионного слоя Нернста (толщина слоя δN) определяется из условия: поток частиц из объема к границе δN, осуществляемый конвективным переносом, равен потоку от границы δN к подложке электрода путем молекулярной диффузии. Конечно, такое рассмотрение является грубым. Оно возможно только в рамках упрощенной модели Нернста. Реально существуют не две четко разграниченные области конвективной и молекулярной диффузии, а области преобладающего переноса путем конвекции и путем диффузии, соединенные переходной областью. Взаимное расположение этих областей подчиняется сложным законам [7]. Тем не менее, практика расчетов показывает, что подход на основе упрощенной модели часто бывает уместным.
Рассуждение 1: При увеличении плотности тока на электроде (при неизменном D), особенно при i > id, плотность потока массы ионов металла A увеличивается, и, для обеспечения возросшего диффузионного потока соответствующим подводом из объема путем конвекции, граница δN должна омываться более интенсивным потоком жидкости. Для этого граница δN должна отодвинуться в сторону объема, поскольку диффузионный слой находится внутри пограничного гидродинамического слоя Прандтля, в рамках которого скорость движения жидкости изменяется от нуля на подложке до скорости конвективных потоков в объеме (слой Прандтля гораздо толще диффузионного слоя).
Модельные расчеты для натурного эксперимента на катоде подтверждают такое предположение (кривая δ−E на рис. 1). Сделаем предположение о законе изменения δN от плотности потока j при i > id. Для грубой оценки можно воспользоваться уже имеющимися зависимостями между δN, ${{j}_{{\text{d}}}}$ и D для случая, когда i ≤ id. Далее соответствующий формальный вывод, следующий из этих зависимостей, можно попробовать распространить на случай, когда i > id. В самом деле, упомянутое выше условие приводит к зависимости δN от коэффициента диффузии D.
Рассуждение 2: При увеличении подвижности частиц (при увеличении D) при тех же концентрации в объеме и режиме перемешивания увеличивается предельная плотность потока массы разряжающихся частиц внутри диффузионного слоя Нернста. При сохранении плотности тока на пределе i = idграница δN должна омываться более интенсивным потоком жидкости, результатом чего является ее смещение в сторону объема, как и в случае рассуждения 1.
Здесь уместно напомнить соотношения:
(9)
${{j}_{{\text{d}}}} = D\tfrac{c}{\delta }\,\,\,{\text{или}}\,\,\,{{i}_{{\text{d}}}} = n{\kern 1pt} F{\kern 1pt} D\tfrac{c}{\delta },$Согласно рассуждению 2, по сути, задача заключается в следующем: показать закон увеличения δ при увеличении id. При этом причиной увеличения и той и другой величины является увеличение D. Для этого воспользуемся выражениями (9) и (10). Для приведенных ниже соотношений принимаем условия: (i) не изменяется гидродинамическая обстановка вблизи электрода, то есть не изменяется интенсивность перемешивания в объеме; (ii) не изменяется концентрация в объеме.
Итак, δ увеличивается при увеличении D (10). Не приступая к преобразованиям, глядя на выражения (9) и (10) и имея в виду, что 0 < m < 1, можно убедиться, что id тоже увеличивается при увеличении D. Удалим из системы (9), (10) величину D за счет сокращения системы до одного уравнения:
(11)
${{{\delta }}^{{1\, - \,m}}} = \tfrac{l}{{{{{\left( {{\kern 1pt} nFc} \right)}}^{m}}}}i_{{\text{d}}}^{m}.$Таким образом, если при i = id увеличиваем D, поддерживая ток предельным (при этом предельный ток увеличивается), то можно записать, учитывая (11):
(12)
$\delta _{{\text{d}}}^{{1 - m}} \propto {{i}^{m}}\,\,{\text{при}}\,\,i \approx {{i}_{{\text{d}}}},$Запишем выражение, вытекающее из (12), для двух конкретных значений D1 и D2:
(13)
${{\left( {\tfrac{{{{\delta }_{{{\text{d}}(1)}}}}}{{{{\delta }_{{{\text{d}}(2)}}}}}} \right)}^{{1{\kern 1pt} - {\kern 1pt} m}}}{\kern 1pt} = {{\left( {\tfrac{{{{i}_{{(1)}}}}}{{{{i}_{{(2)}}}}}} \right)}^{m}}\,\,\,{\text{при}}\,\,i \approx {{i}_{{\text{d}}}}.$Далее предполагаем, что при увеличении плотности тока больше некоторой предельной точки на поляризационной кривой, когда перестаёт выполняться условие xm$ \ll $ δ и текущее значение i становится заметно больше текущего значения параметра id, закон (12) изменения δ при изменении i сохранится. Тогда можно записать аналогично выражению (13) и получить окончательно:
(14)
${{\left( {\tfrac{{{{\delta }_{{{\text{SEC}}}}}}}{{{{\delta }_{{{\text{pt}}}}}}}} \right)}^{{1 - m}}} = {{\left( {\tfrac{i}{{{{i}_{{{\text{pt}}}}}}}} \right)}^{m}}\,\,\,\,{\text{при}}\,\,\,\,i > {{i}_{{\text{d}}}},$(15)
${{\delta }_{{{\text{SEC}}}}} = {{\delta }_{{{\text{pt}}}}}{{\left( {\tfrac{i}{{{{i}_{{{\text{pt}}}}}}}} \right)}^{{{m \mathord{\left/ {\vphantom {m {(1 - m)}}} \right. \kern-0em} {(1 - m)}}}}}\,\,\,\,{\text{при}}\,\,\,\,i > {{i}_{{\text{d}}}}.$Выражения (14), (15) – это зависимость толщины диффузионного слоя катода от плотности тока i выше текущего значения параметра id в условиях вторичного восстановления внутри диффузионного слоя (гипотеза). Они пригодны для участия в описании вторичного восстановления на катоде при любом значении константы $K_{C}^{{{\text{**}}}}.$
Здесь надо подчеркнуть, что при выводе (14) мы учли тенденцию увеличения δ по мере увеличения плотности тока, но не могли учесть тенденцию уменьшения δ. Вероятно в области точки отсчета реальная интенсивность перемешивания продолжает увеличиваться при смещении потенциала в отрицательную сторону за счет ускорения вторичного восстановления. Это означает, что встречаются две тенденции – уменьшение δ и увеличение δ. При выводе (14) мы пренебрегли тенденцией уменьшения δ и в качестве точки отсчёта взяли минимум кривой δ–E, когда тенденция увеличения начинает превосходить тенденцию уменьшения.
Найдем значение m в нашем эксперименте с восстановлением ниобия, – прологарифмируем (14):
(16)
$\lg \left( {\tfrac{{{{\delta }_{{{\text{SEC}}}}}}}{{{{\delta }_{{{\text{pt}}}}}}}} \right) = \tfrac{m}{{1 - m}}\lg \left( {\tfrac{i}{{{{i}_{{{\text{pt}}}}}}}} \right)\,\,\,\,{\text{при}}\,\,\,\,i > {{i}_{{\text{d}}}}.$Возьмем для расчета в качестве ipt и δpt значения, соответствующие потенциалу –2.75 В, рис. 1. При смещении потенциала в отрицательную сторону, начиная примерно с этого значения потенциала, толщина диффузионного слоя увеличивается, а зона вторичного восстановления не только возникла, но уже заметно отодвинулась от границы катода (xm > 0). На рис. 4 приведена зависимость логарифма левой части (16) от логарифма в правой части (16) для интервала потенциалов −2.75…−3.26 В. По наклону прямой линии тренда, средствами Excel принудительно проведенной через ноль, с помощью уравнения (16) определено значение m = 0.688.
Рис. 4.
Линия зависимости (16) для поляризационной кривой, рис. 1, на участке −2.75…−3.26 В. Пунктир – это прямая линия тренда.

Перепишем выражение (8), указывающее положение максимума скорости вторичного восстановления xm, через величину δSEC . Также уточним рассуждения в работе [2], связанные с этим выражением, с учетом полученных результатов:
(17)
$\tfrac{{{{x}_{{\text{m}}}}}}{{{{\delta }_{{{\text{SEC}}}}}}} = 1 - \tfrac{{{{i}_{{\text{d}}}}}}{i}\,\,\,\,{\text{при}}\,\,\,\,i > {{i}_{{\text{d}}}}.$Подчеркнем, что здесь все величины переменные. Все они изменяются при изменении потенциала, включая параметр id. Выражение (17) пригодно в условиях, когда в расчетах уже нельзя пренебречь величиной xm, – в нашем случае точку отсчета пришлось взять при потенциале –2.75 В, когда xm/δSEC≈ 0.05, см. выше. При этом текущие значения плотности тока i становятся заметно больше соответствующих текущих значений параметра id. Запишем комбинацию выражений (15) и (17):
(18)
${{x}_{{\text{m}}}} = {{\delta }_{{{\text{pt}}}}}{{\left( {\tfrac{i}{{{{i}_{{{\text{pt}}}}}}}} \right)}^{{{m \mathord{\left/ {\vphantom {m {(1 - m)}}} \right. \kern-0em} {(1 - m)}}}}}\left( {1 - \tfrac{{{{i}_{{\text{d}}}}}}{i}} \right)\,\,\,\,{\text{при}}\,\,\,\,i > {{i}_{{\text{d}}}}.$Выражения (17), (18) указывают местоположение зоны вторичного восстановления xm в рамках упрощенной методики расчета профилей концентраций, когда $K_{C}^{{{\text{**}}}}$ настолько велика, что можно пренебречь шириной зоны вторичного восстановления Δx. Однако точку максимума скорости вторичного восстановления можно рассчитывать с помощью (17) и при относительно малых значениях $K_{C}^{{{\text{**}}}}.$ Важно только, чтобы соблюдалось обозначенное условие (xm заметно отодвинулась от нуля), табл. 2. Выражение (18) учитывает гипотезу (14) о зависимости толщины диффузионного слоя катода от плотности тока, когда в этом слое происходит вторичное восстановление, δSEC.
Выражение (14) вместе с рис. 4 косвенно подтверждают приведенное объяснение увеличения толщины диффузионного слоя δSEC при увеличении плотности тока. Однако это выражение в настоящий момент бесполезно для расчетов (а вслед за ним и (18)). Эмпирические коэффициенты в этом уравнении могут быть получены только после точных расчетов по модели, когда уже построены кривые δ−E и id−E. Не исключено, что эти выражения окажутся полезными для быстрых оценок после того, как накопится некоторое количество подобных расчетов и будут определены эмпирические коэффициенты δpt, ipt, m в разных случаях электролиза. Кроме того, возможно, что после этого удастся связать эти коэффициенты с величинами $K_{C}^{{{\text{**}}}}$ и $E_{{{{{\text{ox}}} \mathord{\left/ {\vphantom {{{\text{ox}}} {{\text{red}}}}} \right. \kern-0em} {{\text{red}}}}}}^{{\text{0}}}.$
Об учете концентрационной зависимости коэффициента активности металла B
В заключение отметим, что в расчетах не учитывалась концентрационная зависимость коэффициента активности раствора натрия γNa в фоновом электролите при больших отрицательных значениях E. Если взять систему Na–NaCl, то при более отрицательных значениях E, начиная с ‒3.02 В, γNa заметно отклоняется от γ∞ (в работе [1] мы представили соответствующий расчет на основе данных работы [4]). При E = −3.26 В (как на рис. 3.7, 3.8 ) γNa≈ 60. Мы оценили, насколько расчетная толщина диффузионного слоя δ изменится, если для расчета cBSCat использовать такое значение коэффициента активности (вместо γNa = 70). Оказалось, что значение для последней точки на кривой δ−E (рис. 1) увеличилось с 0.0131 см до 0.0150 (+15%).
ЗАКЛЮЧЕНИЕ
Обсуждены возможные расчеты по модели вторичного восстановления тугоплавкого металла для натурного эксперимента, в котором получена стационарная поляризационная кривая в условиях вторичного восстановления на гладком катоде.
Расчеты по модели были сделаны на основе поляризации, измеренной при катодном восстановлении Nb в хлоридно-фторидном расплаве. Показано, что на гладкой подложке катода в интервале перенапряжения −η = 210−410 мВ должна происходить полная смена механизма восстановления с первичного на вторичное.
Показано, что толщина катодного диффузионного слоя δ изменяется при изменении плотности тока i − при увеличении i от нуля и выше, δ сначала уменьшается на порядок, а затем увеличивается. Соответственно величина предельного диффузионного тока id не является константой при неизменной концентрации ионов восстанавливаемого металла в объеме.
Показано, что причиной нечеткого предельного тока на стационарных катодных поляризационных кривых при электролизе металлов в расплавах является уменьшение δ более чем на порядок по мере увеличения i в области относительно малых i. При этом вторичное восстановление сосредоточено на расстоянии от катода ≤0.05δ.
Показано, что δ увеличивается по мере увеличения i в области относительно больших i. При этом вторичное восстановление сосредоточено на расстоянии от катода ≥0.05δ.
Предложена гипотеза о зависимости толщины диффузионного слоя Нернста у катода от плотности тока i > id в условиях вторичного восстановления на гладком катоде.
Список литературы
Храмов, А.П., Чернышёв, А.А., Исаков, А.В., Зайков, Ю.П. Вторичное восстановление тугоплавкого металла у гладкого катода при электролизе солевого расплава. 1. Вывод базовых уравнений для модели процесса. Электрохимия. 2020.Т. 56. С. 771. [Khramov, A.P., Chernyshev, A.A., Isakov, A.V., and Zaykov, Yu.P., Secondary reduction of a refractory metal near a smooth cathode during electrolysis of molten salt. 1. Derivation of basic equations for the process model, Russ. J. Electrochem., 2020, vol. 56, no. 9.]
Храмов, А.П., Чернышёв, А.А., Исаков, А.В., Зайков, Ю.П. Вторичное восстановление тугоплавкого металла у гладкого катода при электролизе солевого расплава. 2. Расчеты для некоторых гипотетических экспериментов. Электрохимия. 2020. Т. 56. С. 782. [Khramov, A.P., Chernyshev, A.A., Isakov, A.V., and Zaykov, Yu.P., Secondary reduction of a refractory metal near a smooth cathode during electrolysis of molten salt. 2. Calculations for some hypothetical experiments, Russ. J. Electrochem., 2020, vol. 56, no. 9.]
Лукинских, А.В. Электродные процессы при электролизе тантала и ниобия из хлоридно-фторидных расплавов. Диссертация на соискание ученой степени кандидата химических наук. Свердловск: Институт электрохимии УНЦ АН СССР, 1986. 127 с. [Lukinskikh, A.V., Electrode processes during the electrolysis of tantalum and niobium from chloride-fluoride melts. The dissertation for the degree of Candidate of Chemical Sciences (in Russian), Ekaterinburg: Institute of Electrochemistry, Ural Scientific Center, Academy of Sciences, USSR, 1986, 127 p.]
Smirnov, M.V., Chebykin, V.V., and Tsiovkina, L.A., The thermodynamic properties of sodium and potassium dissolved in their molten chlorides, bromides, and iodides, Electrochim. Acta, 1981, vol. 26, no. 9, p. 1275. https://doi.org/10.1016/0013-4686(81)85111-0
Смирнов, М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука, 1973. С. 212. [Smirnov, M.V., Electrode potentials in molten chlorides (in Russian), M.: Nauka, 1973, p. 212.]
Ковалевский, P.A., Чебыкин, В.В. Транспортные характеристики восстановленных форм катионов растворителя в расплавах хлоридов щелочных металлов. Расплавы. 1992. № 3. С. 36. [Kovalevsky, P.A. and Chebykin, V.V., Transport characteristics of reduced forms of solvent cations in melts of alkali metal chlorides, Rasplavy (in Russian), 1992, no. 3, p. 36.]
Левич, В.Г. Физико-химическая гидродинамика. М.: Из-во АН СССР, 1952. 538 с. [Levich, V.G., Physico-chemical hydrodynamics (in Russian), M.: Academy of Sciences USSR Publishing, 1952, 538 p.]
Плесков, Ю.В., Филиновский, В.Ю. Вращающийся дисковый электрод. М.: Наука, 1972. 344 с. [Pleskov, Yu.V. and Filinovsky, V.Yu., Rotating disc electrode (in Russian), M.: Nauka, 1972, 344 p.]
Храмов, А.П., Некрасов, В.Н., Ивановский, Л.Е. Экспериментальное изучение массопереноса к вибрирующему вдоль своей оси цилиндрическому электроду. Измерения интенсивности массопереноса. Электрохимия. 1990. Т. 26. С. 1287. [Khramov, A.P., Nekrasov, V.N., and Ivanovskii, L.E., Experimental Study of Mass Transport to an Axially Vibrated Cylindrical Electrode. Measurements on of the Intensity of Mass Transport, Soviet Electrochem., 1990, vol. 26, p. 1151.]
Дополнительные материалы отсутствуют.


