Электрохимия, 2020, T. 56, № 12, стр. 1083-1099
Устойчивость к деградации и активность катализаторов с различным содержанием платины, синтезированных на углеродных нанотрубках
В. А. Богдановская a, *, А. В. Кузов a, **, М. В. Радина a, В. Я. Филимонов a, Г. М. Сударев a, М. А. Осина b
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
b Национальный исследовательский университет “МЭИ”
111250 Москва, ул. Красноказарменная, 14, Россия
* E-mail: bogd@elchem.ac.ru
** E-mail: scourge@mail.ru
Поступила в редакцию 28.12.2017
После доработки 24.01.2020
Принята к публикации 15.05.2020
Аннотация
Платиновые катализаторы, синтезированные на углеродных нанотрубках (УНТ), с содержанием драгоценного металла 20 и 40 мас. % исследованы в модельных условиях и в составе катодов мембранно-электродных блоков (МЭБ) водородо-воздушных топливных элементов (ТЭ) с протонпроводящим полимерным электролитом (ППЭ). Показано влияние состава активных слоев (АС) катодов и мембранно-электродных блоков (МЭБ) в целом на активность и стабильность работы синтезированных каталитических систем. Устойчивость к деградации изучена методом ускоренного стресс-тестирования (УСТ) путем многократного циклического изменения потенциала катода в диапазоне 0.6–1.3 В. Показано, что синтезированные катализаторы характеризуются более высокой устойчивостью к деградации, по сравнению с коммерческим 60Pt/C (HiSPEC). Вклад в суммарные потери электрохимических, омических и транспортных составляющих зависит от общей величины поверхности платины в АС, определяющей плотность тока поляризации, и массы Pt на носителе. Более высокие омические и транспортные потери у катализатора с содержанием Pt 40 мас. %, по сравнению с катализатором, содержащим 20 мас. % платины, обусловлены структурными характеристиками – уменьшением объема и размера пор УНТ при нанесении большей массы металла.
ВВЕДЕНИЕ
Создание электрокатализаторов для катодов топливных элементов является одной из наиболее сложных задач, что связано с необходимостью обеспечения целого ряда требований к ним. С одной стороны, для изготовления АС катода, которые должны быть достаточно тонкими, массовая доля платины должна составлять 60–70%, как это имеет место в наиболее активных коммерческих моноплатиновых катализаторах. С другой стороны, необходимость снижения расхода платины и повышение ее устойчивости к растворению потребовали поиска путей решения этих задач. Наибольшее внимание к настоящему моменту было уделено разработке би- и триметаллических систем (PtM1 и PtM1M2), где M1 и M2 – переходные металлы (Fe, Ni, Co, Cr и другие). Показано [1–8], что образование сплавов со структурой ядро–оболочка обеспечивает существенное увеличение активности платины, и таким образом может быть снижен ее расход. Синтезированный катализатор PtCoCr/C, при использовании в качестве носителя сажи ХС72 [9] и содержании платины до 50 мас. % показывает высокую активность и более высокую стабильность по сравнению с коммерческими моноплатиновыми катализаторами. Свойства платины в составе оболочки отличаются от свойств моноплатины, благодаря лигандному влиянию ядра, в результате которого хемосорбция на поверхности платины кислородсодержащих частиц из воды затруднена. Меньшее заполнение поверхности хемосорбированным кислородом обеспечивает благоприятную для разрыва О–О-связи адсорбцию молекулярного кислорода и тем самым повышается селективность реакции электровосстановления О2 до воды. Кроме того, чем меньше кислородсодержащих частиц, а также сульфат-анионов (в ТЭ с протонпроводящим полимерным электролитом) адсорбируется на поверхности Pt, и которые являются начальной стадией растворения металла, тем выше устойчивость катализатора к деградации. Однако, наряду с деградацией собственно металлической фазы, разрушению в жестких условиях функционирования катода ТЭ подвергается также носитель, в качестве которого чаще всего используют турбостратный углерод (сажу). Поиски устойчивого к окислению и разрушению носителя показывают, что наиболее перспективными для этих целей являются углеродные нанотрубки (УНТ). УНТ представляют собой графеноподобный материал, величина удельной поверхности и пористая структура которого могут быть изменены в широких пределах. Следует отметить также, что к настоящему времени УНТ (одностенные и мультистенные) выпускаются как за рубежом, так и в России. По стабильности в атмосфере кислорода при повышенных температурах и низких рН (условия на катоде ТЭ) УНТ [10–13] значительно превосходят сажи, а их пористая структура характеризуется обширным набором пор, включая мезопоры. Использованию УНТ в качестве носителей при синтезе катализаторов для ТЭ посвящено много работ [10–17], которые включают исследования в модельных условиях и в составе МЭБ ТЭ. Наиболее общий вывод, который может быть сделан на основании этих исследований, заключается в том, что УНТ имеют более высокую устойчивость к деградации, что в свою очередь обеспечивает повышение стабильности катализатора в целом. Значительное внимание уделяют изучению влияния функционализации или допирования на стабильность и активность катализаторов, синтезированных на них [16–22]. Модифицирование поверхности направлено на дальнейшее повышение устойчивости углеродного материала к окислению. Кроме того, на поверхности УНТ увеличивается количество кислород- и/или азотсодержащих групп, которые служат центрами связывания платины в процессе синтеза катализатора и обеспечивают образование наноразмерных частиц и равномерное распределение их по поверхности носителя [19–23]. Кроме того, УНТ имеют высокую электропроводность, а в их структуру входят мезопоры, необходимые для транспорта реагентов, например, в источниках тока. Эти свойства нанотрубок [15] свидетельствуют о перспективности их применения при создании электрокатализаторов для ТЭ. Однако, сделать вывод о том, какой именно тип УНТ следует выбрать в качестве носителя, в настоящее время не представляется возможным, поскольку до недавнего времени коммерческое производство УНТ отсутствовало, а синтезированные в лабораторных условиях образцы отличались по характеристикам. Наряду с положительными свойствами следует отметить, что необходимой стадией при использовании УНТ в качестве носителя является проведение предварительной функционализации поверхности с целью синтеза на ней различных групп, необходимых для закрепления наночастиц металла [20, 21].
Целью данной работы является исследование влияния содержания платины в каталитических системах, синтезированных на УНТ, на электрокаталитическую активность в реакции восстановления кислорода и устойчивость к деградации при исследованиях в модельных условиях и в составе МЭБ низкотемпературного топливного элемента с протонпроводящим полимерным электролитом. Новизна настоящей работы заключается в использовании УНТ отечественного производства, а также в комплексном подходе к оценке характеристик катализаторов. Всестороннее исследование, начиная от стадии функционализации УНТ, синтеза катализаторов, изучения их свойств в модельных условиях и заканчивая испытаниями активности и стабильности в составе МЭБ водородо-воздушных ТЭ, а также в выяснении влияния массы катализатора и содержания Pt, на активность и устойчивость к деградации синтезированных каталитических систем.
МЕТОДИКА ЭКСПЕРИМЕНТА
В качестве носителя для синтеза катализаторов использовали нанотрубки Таунит М, производства ООО “НаноТехЦентр” РФ (УНТТ) и для сравнения нанотрубки фирмы Bayer (УНТВ). Характеристики синтезированных катализаторов сравнивали с коммерческим катализатором фирмы HiSPEC 9000 с содержанием платины 60 мас. % (в дальнейшем – 60Pt/C) и синтезированным катализатором 20Pt/XC72.
Полиольный метод синтеза катализаторов. Метод заключается в восстановлении ионов платины многоосновным спиртом (этиленгликолем) при температуре, близкой к его температуре кипения. Навеску нанотрубок, подвергнутых обработке в щелочи, помещали в стакан, добавляли этиленгликоль (ос. ч. ЗАО “ЭКОС-1”, Россия) (на 1 мг УНТ 1 мл спирта) и подвергали ультразвуковому диспергированию в течение 1 ч. Для сравнения 20% платиновый катализатор был синтезирован на саже ХС72 при тех же условиях. Суспензию углеродного материала переносили в трехгорлую круглодонную колбу, снабженную капельной воронкой, обратным холодильником и капилляром для барботирования аргона. Колбу устанавливали в лабораторную баню, заполненную глицерином, и размещенную на магнитной мешалке. В капельную воронку помещали водный раствор H2PtCl6 ∙ 6H2O (фирма “Аурат”), баню нагревали до 130–150°С и по каплям вводили раствор хлорплатината в суспензию нанотрубок. Температурную обработку, барботирование аргоном и перемешивание магнитной мешалкой продолжали в течение всего времени синтеза. Полученную смесь отстаивали, промывали водой, твердый осадок отделяли на центрифуге и помещали в сушильный шкаф (80°С). При синтезе катализатора с массовым содержанием платины 40% продолжительность введения платины была увеличена в два раза.
Предварительная подготовка УНТТ, которая в данном случае заключалась в их обработке в щелочи или кислоте, обеспечивала образование на поверхности кислородсодержащих групп. При этом пористая структура и величина удельной поверхности нанотрубок не должны существенно изменяться, поскольку эти характеристики необходимы носителям, используемым при синтезе катализаторов для ТЭ, так же как наличие кислородсодержащих групп, обеспечивающих связывание катиона платины и более равномерное распределение наночастиц металла по поверхности.
Обработка в 1 М NaOH. Навеску (400 мг) УНТТ помещали в термостойкий стакан и приливали 200 мл 1 М NaOH. При постоянном перемешивании магнитной мешалкой стакан нагревали до 100°С. Нагрев и перемешивание вели в течение 1 ч. Затем смесь охлаждали до комнатной температуры, отмывали водой до нейтрального значения рН и сушили при 80°С в сушильном шкафу. Нанотрубки, обработанные в 1 М NaOH, в дальнейшем обозначали – УНТТNaOH.
Обработка в 1 М HNO3. Обработку нанотрубок проводили в тех же условиях, что и в щелочи, но навеску УНТT (400 мг) помещали в 200 мл 1 М HNO3. Сухие функциализованные нанотрубки взвешивали и помещали в бюкс и для их обозначения использовали ${\mathbf{УНТ}}{{{\mathbf{T}}}_{{{\mathbf{HN}}{{{\mathbf{O}}}_{{\mathbf{3}}}}}}}.$
Определение массовой доли платины в составе катазизатора проводили спектрофотометрическим методом. Массовое содержание платины в катализаторах изменялось в пределах ±5%. Методика определения количества платины основана на измерении оптической плотности раствора комплекса платины с хлоридом двухвалентного олова (SnCl2) [24], оптимизированная применительно к катализаторам, нанесенным на дисперсный углеродный материал. Образование комплексов платины с хлоридом олова характерно для всех металлов платиновой группы, в связи с чем, эта методика не является специфической при анализе смеси платиновых металлов. В то же время при наличии единственного металла платиновой группы методика вполне специфична и чувствительна. По спектрам раствора регистрировали изменение оптической плотности при длине волны 403 нм. Предварительно строили калибровочную кривую по зависимости оптической плотности от известной массы платины в образце, по которой определяли содержание Pt в пробе. Среднюю величину оптической плотности определяли по четырем параллельным измерениям.
Модельные исследования синтезированных катализаторов и сопоставление их характеристик с результатами, полученными при исследовании коммерческой 60Pt/C-системы, − необходимая начальная стадия для выбора катализатора, перспективного для изготовления активных слоев катодов ТЭ. Перед проведением измерений катализаторы из разных партий смешивали для получения каталитической системы, содержащей 20 или 40% платины.
Подготовка электродов для модельных измерений. Измерения по определению электрохимически активной поверхности (ЭАП) и активности катализаторов проводили в трехэлектродной электрохимической ячейке на дисковом электроде из стеклоуглерода в 0.5 М Н2SO4 в инертной атмосфере или в атмосфере кислорода, соответственно, с нанесенным тонким слоем дисперсного катализатора [23]. Для формирования тонкого слоя катализатора готовили каталитические “чернила”, путем диспергирования катализатора (2 мг) в 500 мкл изопропилового спирта, в который добавляли 2.5 мкл раствора Nafion® (Aldrich), предварительно разбавленного изопропиловым спиртом до содержания 1%. Суспензию наносили на дисковый электрод из стеклоуглерода из расчета 100–150 мкг катализатора на см2 геометрической поверхности электрода, что, как показано в [23], закрывало диск и обеспечивало равнодоступность поверхности нанесенной дисперсной системы для электролита и кислорода. Электродом сравнения служил насыщенный Ag/AgCl электрод. Все потенциалы в работе приведены относительно обратимого водородного электрода в растворе электролита. Величину удельной поверхности платины в составе катализатора рассчитывали из циклических вольтамперограмм (ЦВА) по количеству электричества, пошедшего на десорбцию водорода, за вычетом заряда двойнослойной области, при использовании удельной величины 0.21 мКл/см2, как описано в работе [9]. Расчет проводили по ЦВА, полученной после пропускания не менее 10 циклов при скорости наложения потенциала 0.10 В/с в области потенциалов 0.05–1.4 В при комнатной температуре.
Поляризационные кривые получали при скорости развертки потенциала 0.005 В/с и записи кривой в катодном и анодном направлении при температуре 60°С, близкой к температуре работы низкотемпературного водородо-воздушного ТЭ. Величину активности определяли по току восстановления кислорода при потенциале 0.9 В на поляризационной кривой, записанной в анодном направлении. Это обеспечивало получение наиболее высоких значений тока, поскольку поверхность платины была восстановлена при достижении потенциалов менее 0.30 В на катодной ветви кривой, и на ее поверхности отсутствовали адсорбированные из воды кислородсодержащие частицы, препятствующие адсорбции молекулярного кислорода [9, 25, 26]. Расчет значений электрокаталитической активности различных катализаторов из поляризационных кривых, измеренных в анодном направлении, и сопоставление ее с результатами измерений в ТЭ, является в значительной степени условным, поскольку в реальных условиях работы ТЭ значения потенциалов, при которых кислородсодержащие частицы восстанавливаются (менее 0.30 В), не достигаются. При сравнении так же следует принимать во внимание, что в модельных условиях катализатор находится в свободном электролите большого объема, в то время как в ТЭ – это малый объем полимерного электролита.
Определение устойчивости катализаторов к деградации в модельных условиях осуществляли методом циклирования потенциала в области 0.6–1.3 В при скорости наложения потенциала 0.10 В/с в атмосфере аргона. Через определенные промежутки времени (количество циклов) записывали ЦВА и поляризационную кривую для оценки изменения поверхности и активности исследуемой системы. Для этого заменяли электролит, продували аргоном и при комнатной температуре записывали ЦВА, а затем раствор насыщали кислородом, устанавливали температуру 60°С и записывали поляризационную кривую при вращении электрода. Характеристики определяли, как описано выше.
Методика формирования мембранно-электродных блоков. Основной задачей настоящей работы являлось исследование катализаторов в составе катодов МЭБ, поэтому в качестве мембраны была выбрана коммерческая протонпроводящая мембрана Nafion 212 (толщина 50 мкм), обладающая высокими показателями стабильности и проводимости. В качестве иономера использовали 5%‑ный раствор Nafion в смеси низкомолекулярных алифатических спиртов (Aldrich). Количество иономера в активном слое катода было выбрано в соответствие с соотношением (Nafion/углеродный материал (Nf/C)), равным 0.6 от массы носителя, в данном случае УНТ, по аналогии с работой [27], где было проведено исследование влияния соотношения Nf/C на характеристики МЭБ. Показано, что оптимальным является отношение 0.6 на катоде и 1.0 на аноде. Для нанесения АС электродов готовили суспензию из катализатора и Nafion (отдельно для катода и анода), количество компонентов, в зависимости от нагрузки по платине, рассчитывали на величину поверхности электродов (25 см2). С помощью аэрографа напыляли суспензии для катода и анода на мембрану Nafion 212 с противоположных сторон. Газодиффузионные слои (ГДС) совмещали с АС катода и анода и прессовали при температуре 135°С и давлении прессования 60 кг/см2 в течение 1 мин. В качестве ГДС использовали графитизированные материалы Sigraset марки 10ВС. Продолжительность прессования составляла 30 с. В качестве катализатора АС анода использовали 60Pt/С при соотношении Nf/С = 1.0, нагрузка по платине составляла 0.32–0.35 мгPt/см2. При этом исходили из того, что анодная реакция не лимитирует эффективность работы МЭБ. Количество платины в АС катода составляло 0.41−0.46 или 0.61–0.63 мгPt/см2, если не указано особо в каждом конкретном случае, при соотношении Nf/С = 0.6.
Проведение ускоренного стресс-тестирования (УСТ). Собранный МЭБ устанавливали в испытательную ячейку (Arbin, 25 см2), моделирующую одиночный топливный элемент. Ячейку подсоединяли к испытательным стендам (ElectroChem или Arbin) и выводили на рабочие условия (температура, давление, расходы газов, увлажнение). Экспресс-тестирование МЭБ проводили путем многократного циклического изменения напряжения в интервале потенциалов 0.6–1.3 В со скоростью развертки 0.10 В/с. В ходе УСТ проводили наложение 2000 циклов. Циклирование осуществляли в инертной атмосфере. Через катодное пространство пропускали инертный газ (аргон) при 100% увлажнении и расходе газа 50 мл/мин. В анодное пространство подавали чистый водород при 100% увлажнении и расходе 50 мл/мин. Периодически (через 500 циклов) проводили измерение величины электрохимически активной поверхности платины в составе АС катода по ЦВА, записанным при скорости развертки потенциала 0.05 В/с. При записи ЦВА, в этих условиях, анод служил вспомогательным электродом и электродом сравнения, относительно которого записывали циклическую вольтамперограмму на катоде. Разрядные U,I-кривые в атмосфере кислорода получали перед началом УСТ, для фиксации исходных характеристик МЭБ, а также после наложения необходимого количества циклов. U,I-кривые с исследуемыми МЭБ записывали в потенциодинамических условиях: от величины устанавливающегося НРЦ до значения 0.20–0.50 В со скоростью наложения потенциала 0.002 В/с. Измерения проводили на чистом водороде (анод) и воздухе либо кислороде (катод), при избыточном давлении газов 1 атм, либо без избыточного давления, 100% увлажнении и расходе подаваемых газов 200 мл/мин при температуре ячейки 65°С.
Степень деградации катодного катализатора оценивали по изменению величины ЭАП катодного катализатора в АС. Величину активности определяли по разрядным кривым (величина U при i = 0.5 А/см2). В ходе экспресс-тестирования на промежуточных стадиях проводили измерение омического сопротивления МЭБ и величины кроссовера водорода через мембрану. Омическое сопротивление МЭБ и сопротивление полимерного электролита в АС определяли методом спектроскопии электрохимического импеданса c использованием PARSTAT 2273 (Princeton Applied Research). Подробнее методика измерения и расчетов описана в [27].
Структурные исследования. Структурные исследования каталитических систем осуществляли в процессе их изготовления, в ходе испытаний в модельных условиях, до и после испытаний в составе МЭБ ТЭ.
Параметры пористой структуры образцов были определены из изотермы адсорбции паров азота при температуре 77 К, измеренной на объемной высоковакуумной адсорбционной установке ASAP-2020 MP Micromeritics USA в интервале относительных давлений от 10–6 до 0.99 объемным методом. Удельную поверхность определяли методом БЭТ [28]. Для расчета поверхности мезопор и соотношения поверхностей мезо- и микропор применяли BJH ((Barrett–Joyner–Halenda) и t-plot методы [28–30].
РФЭ спектры поверхности были получены на Оже-микроскопе (Вакуум Дженерейторз, Великобритания) с приставкой CLAM2. Источником немонохроматического излучения служил Al-анод (200 Вт). Калибровку шкалы прибора проводили по пикам Сu2p3/2 = 932.6 эВ и Au4f7/2 = 84.0 эВ металлических образцов, предварительно очищенных ионным травлением. Положение наблюдаемых пиков стандартизовали по положению пика углерода C1s. Воспроизводимость положения наблюдаемых пиков составляла ±0.2 эВ. Для обзорного спектра энергию пропускания анализатора устанавливали равной 100 эВ, а для определения количественного состава (С1s и O1s) использовали энергию анализатора 50 эВ. При получении количественных соотношений использовали коэффициенты чувствительности, приведенные в программе обработки спектров VG1000. Глубина определения состава поверхностного слоя составляла 10 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В предварительных экспериментах при синтезе моноплатинового катализатора были использованы УНТТ без обработки. Величина активности этой каталитической системы (20Pt/УНТТ) составила при 0.90 В ~55 А/гPt, поверхность платины не превышала 30 м2/г. С целью повышения активности моноплатинового катализатора была проведена предварительная обработка носителя (УНТТ) с целью увеличения его электрохимически активной поверхности и активности в реакции восстановления кислорода.
На рис. 1 и в табл. 1 представлены данные, полученные методом РФЭС на УНТТ, после различной обработки. Из представленных данных следует, что доля кислорода на поверхности увеличивается, а также изменяется состав кислородсодержащих групп при энергии связи электронов кислорода (табл. 1). При этом суммарное количество кислорода на поверхности увеличивается в ряду: УНТТисх < УНТТNaOH < $УНТ{{T}_{{HN{{O}_{3}}}}}.$ Такой же ряд зависимости суммарной доли кислорода на поверхности стеклоуглерода наблюдали в работах [31–34] в зависимости от обработки углеродных материалов (УМ) в кислоте или в щелочи. При этом функционализация приводит к значительному (более чем в два раза) увеличению кислорода на поверхности по сравнению с УМ без обработки. В то же время суммарное количество кислорода на функционализованных УНТ отличается незначительно, что также согласуется с результатами работы [33]. Наблюдаемые различия в РФЭ спектрах на рис. 1 связаны преимущественно с изменением соотношения различных групп. Однако выделить ту или иную группу на поверхности при использовании результатов только РФЭС измерений затруднительно и требуется проведение исследований с использованием других методов. Можно говорить только о вероятности присутствия кислорода в связи (С=О) на поверхности в составе карбонильных, лактонных и карбоксильных групп при Eсв = 531.37 эВ; в хинонных и карбонильных групп при Есв = 532.9 эВ, и кислорода (–С–О) в составе лактонных, гидроксильных или фенольных групп при Есв = 533.3 эВ. Карбоксильные группы характеризуются энергией связи электронов 533.9 эВ, по данным, опубликованным в работах [32–34], посвященных исследованию функциональных групп на поверхности углеродного материала, полученных при использовании нескольких различных методов их идентификации.
Рис. 1.
РФЭ-спектры кислорода на УНТТ: (а) без обработки; (б) после обработки в щелочи; (в) после обработки в кислоте.
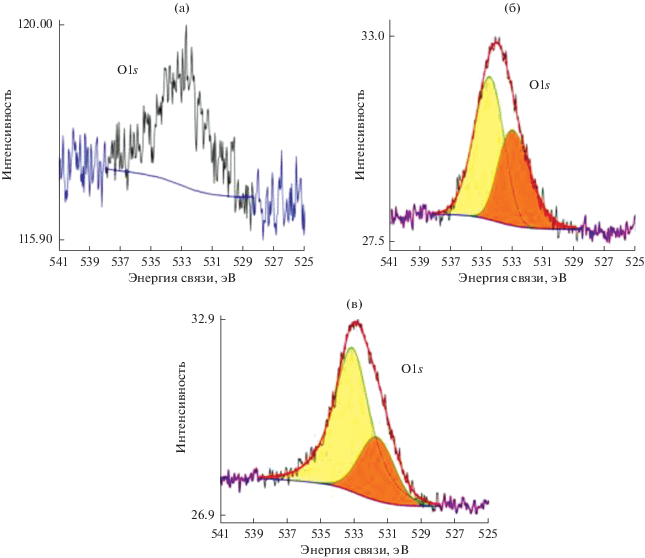
Таблица 1.
Состав поверхности исходных (УНТВ и УНТТ) и УНТТ после обработки в кислоте или щелочи по данным РФЭС (величины энергии связи электронов элемента в максимуме// и доля элемента на поверхности в ат. %). Приведены значения максимумов для кислорода (по отношению к пику С1s графита, Есв которого равна 284.5 эВ)
| Энергия связи элемента // содержание, ат. % | УНТВ | УНТТ | УНТТNaOH | ${\text{УНT}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ |
|---|---|---|---|---|
| С1s, эВ*//ат. % | 284.5*//98.89 | 284.6*//99.66 | 284.7*//97.33 | 284.6//77.12;
284.9//10.85; 286.7//2.73; 287.8//1.69; 288.9//1.47; 290.7//3.13 |
| Суммарное количество углерода, ат. % | 98.89 | 99.66 | 97.33 | 96.99 |
| O1s, эВ* // ат. % в кислородсодержащих группах | 532.4*//1.11 | 532.8*//0.34 | 532.9*//1.11 | 531.5*//0.82 |
| – | – | 534.4*//1.56 | 533.1*//2.19 | |
| Суммарное количество кислорода, ат. % | 1.11 | 0.34 | 2.67 | 3.01 |
В спектре углерода С1s основная энергия связи электронов 284.5 соответствует связи С=С (в исследованных образцах доля углерода с таким типом связи составляет около 90%, следовательно вклад других групп незначителен). В табл. 1 представлена суммарная величина углерода, включающая углерод с другими типами связи, их доля составляет около 10%.
На УНТ, подвергнутых функционализации, атомы кислорода являются активными центрами для связывания катионов платины, и увеличение количества активных центров обеспечивает образование мелких частиц металла, как показано в работе [33] и ссылках в ней. Кроме того, после функционализации величина поляризационной емкости нанотрубок (которая характеризует величину электрохимически активной поверхности) увеличивается (рис. 2а, кривые 3, 4), как после обработки в щелочи, так и в кислоте. По активности в реакции восстановления кислорода карбоксильные кислородсодержащие группы по данным [31–35], проявляют большую активность в реакции восстановления кислорода. Однако, как следует из рис. 2б, исследуемые УНТ по активности при потенциале 0.20 В располагаются в ряд, совпадающий с рядом величин количества кислорода на поверхности: ${\text{УНТ}}{{{\text{Т}}}_{{{\text{НN}}{{{\text{O}}}_{{\text{3}}}}}}}$ ≥ УНТТNaOH > УНТВисх > > УНТТисх (рис. 2б).
Рис. 2.
(а) ЦВА на дисковом электроде с нанесенным УМ. Скорость развертки потенциала – 0.10 В/с; комнатная температура, атмосфера – аргон. (б) Поляризационные кривые электровосстановления кислорода на дисковом электроде с нанесенным УМ. Скорость развертки потенциала 0.005 В/с, скорость вращения электрода – 1500 об/мин, 60°С, атмосфера – кислород. 0.5 М H2SO4; на электроде 150 мкгУМ/см2: 1 – УНТТисх; 2 – УНТВисх; 3 – УНТTNaOH; 4 – ${\text{УНT}}{{{\text{T}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}.$

Таким образом, УНТТ, подвергнутые функционализации, имеют более высокую ЭАП и активность в реакции восстановления кислорода, по сравнению с УНТ без обработки. При выборе метода функционализации в данной работе руководствовались задачей, связанной с подготовкой поверхности носителя для синтеза моноплатинового катализатора. В связи с этим был выбран простой метод мягкой обработки. Мягкая обработка в щелочи обеспечивает удаление примесей (остатки каталитических систем, используемых при синтезе УНТ) и функционализацию поверхности без жесткого окисления и разрушения пористой структуры. Для сравнения использовали обработку в азотной кислоте, которая приводит к сильному окислению поверхности, и разрушению структуры. Как показано на рис. 2б, характеристики УНТ, определенные для нанотрубок после обработки в кислоте или в щелочи, в отношении активности в реакции восстановления кислорода близки между собой (рис. 2б), а величина удельной поверхности больше в случае УНТ, обработанных в щелочи (табл. 2).
Таблица 2.
Структурные и электрохимические (SЭАП, j0.9 В) характеристики УНТТ и платины, нанесенной на них, массовая активность приведена при Е = 0.9 В; 60°C; 0.5 M H2SO4
| Материал | Параметр | ||||
|---|---|---|---|---|---|
| суммарный объем пор, см3/г | S(БЭТ), м2/г | S(наружн.), м2/г | SЭАП, м2/гPt | j, мА/мгPt | |
| УНТТисх | 3.92 | 211 | 211 | – | – |
| ${\text{УНT}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ | 2.908 | 227 | 204 | – | – |
| 40Pt/${\text{УНT}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ | 0.35 | 147 | 116 | 43 | 56 |
| УНТТNaOH | 4.76 | 297 | 273 | – | – |
| 20Pt/УНТТNaOH | 4.30 | 228 | 210 | 40 | 63 |
| 40Pt/УНТТNaOH | 1.83 | 158 | 149 | 55 | 82 |
| 60Pt/C (HiSPEC) | 1.15 | 286 | 226 | 60 | 70 |
На рис. 3 представлены ЦВА, полученные на катализаторах с содержанием платины 20 и 40 мас. % и использовании в качестве носителя УНТNaOH. При равном количестве катализатора на электроде (100 мкг/см2), масса платины в два раза меньше в 20% катализаторе. ЦВА в представленном виде практически совпадают, однако поляризационная емкость в области потенциалов, где отсутствуют максимумы, характеризующие процессы на частицах платины, больше в случае системы 20Pt/УНТТNaOH. Как показано в работах [23, 36], величина поверхности УНТТ при нанесении 20 мас. % платины, определенная по методу БЭТ, и их пористая структура изменяются незначительно (табл. 2). Величины площади поверхности платины, рассчитанные по водородной области ЦВА (м2/гPt) для каталитических систем с содержанием платины 20 и 40 мас. %, составляют 40 ± 2 и 55 ± 3 м2/гPt соответственно. Необходимо также отметить, что положение потенциалов максимумов десорбции кислорода, при записи ЦВА в одинаковых условиях, несколько отличаются и составляют 0.755 и 0.764 для 20 и 40%-го катализатора, соответственно. Это указывает на более прочное связывание кислорода, хемосорбированного из воды, на наночастицах платины при ее содержании 20 мас. %.
Рис. 3.
ЦВА, полученные на УНТТNaOH с нанесенной Pt, мас. %: 20 – 1 и 40 – 2. На электроде 100 мкгкат/см2; 0.5 М H2SO4, атмосфера – аргон, скорость наложения потенциала 0.10 В/с, комнатная температура.

Для определения устойчивости катализатора в процессе функционирования ТЭ осуществляли циклирование потенциала при амплитуде циклирования 0.6–1.3 В. Выбранные жесткие условия тестирования вызывают деградацию наночастиц платины и углеродного носителя [23].
Электрохимические свойства материалов (ЭАП (Sэап) и активность в реакции восстановления кислорода) оценивали до циклирования и после определенного количества циклов изменения потенциала. На рис. 4 представлены данные в относительных единицах по изменению величины поверхности Pt в процессе циклирования в модельных условиях. До циклирования величины поверхности платины составляют, м2/г: 40, 36, 55, 58, а после циклирования поверхность платины уменьшилась до 34, 29, 43 и 36 для 20Pt/УНТТNaOH, 20Pt/ХС72, 40Pt/УНТTNaOH и 60Pt/С, соответственно. Рассматривая системы с 20% Pt на ХС72 и УНТTNaOH можно видеть, что снижение величины поверхности платины в первом случае составляет 20%, а на УНТТNaOH только 15%. Вероятно более высокая устойчивость УНТТNaOH к окислительному разрушению обеспечивает стабильность катализатора в целом. Увеличение массы платины, как на нанотрубках, так и на ХС72 ускоряет процессы деградации и снижение величины поверхности катализатора, что наиболее отчетливо видно для 60Pt/С, величина снижения площади поверхности составляет 38% от начальной. Для синтезированных на УНТTNaOH катализаторов: 20 и 40 мас. % Pt относительное снижение величины поверхности Pt (рис. 4, кривые 1–3) меньше после первых 500 циклов, по сравнению с Pt в коммерческом катализаторе (кривая 4), где уменьшение поверхности Pt достигает 45–50%. Для катализатора 20Pt/УНТТNaOH (рис. 4, кривая 2) величина поверхности Pt уменьшается при пропускании 500 циклов, а затем практически не изменяется. Вероятно, это связано с растворением в свободном электролите в первую очередь наночастиц Pt малых размеров, которые растворяются и переходят в объем раствора. Это приводит к уменьшению величины площади поверхности платины [37–39]. Следует также отметить, что не всегда наблюдается прямая корреляция между размером наночастиц, активностью и величиной поверхности, что показано, например, в работах [38–40], где механизм деградации платиновых катализаторов рассмотрен с учетом ряда путей этого процесса. Поверхность Pt в катализаторе 20Pt/ХС72 по мере циклирования продолжает уменьшаться, что может быть связано со свойствами носителя (сажи) и прочностью связи наночастиц платины с его поверхностью. Следует также отметить, что наибольшую (3.1–3.4 ${{{\text{мА}}} \mathord{\left/ {\vphantom {{{\text{мА}}} {{\text{см}}_{{{\text{геом}}}}^{{\text{2}}}}}} \right. \kern-0em} {{\text{см}}_{{{\text{геом}}}}^{{\text{2}}}}}$ и 75–80 мА/мгPt) удельную и массовую активность в реакции восстановления кислорода имеет катализатор с 40 мас. % Pt/УНТТNaOH. Это обусловлено большим количеством активных центров (наночастиц Pt) на единицу поверхности каталитической системы.
Рис. 4.
Относительное изменение поверхности платины в составе катализаторов при циклировании потенциала электрода в области ΔЕ = 0.6–1.3 В в зависимости от числа циклов. Дисковый электрод c нанесенным катализатором – 0.10 мгкат/см2, 0.5 М Н2SO4, атмосфера – аргон, скорость развертки потенциала 0.10 В/с, комнатная температура.

Таким образом, результаты модельных исследований свидетельствуют о более высокой устойчивости к разрушению в жестких условиях функционирования ТЭ синтезированных Pt/УНТТNaOH катализаторов. После 1000 циклов в интервале 0.6–1.3 В по стабильности исследованные системы могут быть расположены в ряд: 20Pt/УНТТNaOH > > 20Pt/ХС72 > 40Pt/УНТТNaOH > 60Pt/C. При одинаковой массовой доле платины большую стабильность имеет катализатор, нанесенный на УНТТNaOH. При этом величина потенциала полуволны в реакции восстановления кислорода достигает 0.89–0.90 В для всех синтезированных каталитических систем. Селективность в отношении восстановления кислорода до воды (n – число переносимых электронов на молекулу кислорода, которое при восстановлении кислорода до воды составляет 4) высокая, и величина n составляет 3.9–4.0.
В табл. 2 представлены структурные и электрохимические характеристики УНТТ, до и после нанесения на них платины. Как видно, обработка в кислоте и в щелочи приводит к изменению структурных параметров УНТ. В большей степени структура изменяется при обработке в щелочи, что выражается в увеличении поверхности по БЭТ, а также величины поверхности и удельного объема мезопор (табл. 2). После синтеза на УНТTNaOH моноплатиновых катализаторов величины поверхности и удельного объема пор снижаются, однако в случае 20Pt/УНТТNaOH этот эффект выражен в меньшей степени, по сравнению с ${{{\text{40Pt}}} \mathord{\left/ {\vphantom {{{\text{40Pt}}} {{\text{УНТ}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}}}} \right. \kern-0em} {{\text{УНТ}}{{{\text{Т}}}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}}}{\text{.}}$ При синтезе 20%-ного катализатора, как было показано ранее [23, 36], изменение структурных характеристик после нанесения платины обусловлено только незначительным смещением максимального размера пор в сторону меньших значений (от интервала радиуса пор: 10–30 нм до 10–20 нм).
Результаты исследований, проведенных в модельных условиях, показывают, что монометаллические катализаторы, синтезированные на нанотрубках марки Таунит М, подвергнутых предварительной обработке в щелочи, по активности в реакции восстановления кислорода сопоставимы или превосходят коммерческий катализатор 60Pt/C, а по стабильности значительно превышают его (рис. 4). Можно выделить ряд факторов, влияющих на активность и устойчивость моноплатиновых катализаторов, синтезированных полиольным методом на УНТТ, подвергнутых функцианализации. В зависимости от использованного метода обработки на поверхности образуется различное количество кислородсодержащих групп, таких как карбоксильные, карбонильные, гидроксильные и др. В свою очередь в зависимости от состояния поверхности носителя (количества и природы кислородсодержащих групп) распределение и размеры наночастиц платины отличаются, кроме того изменяется пористая структура. Структура каталитической системы, содержащей 40% платины, заметно отличается от пористой структуры исходного носителя (табл. 2) и структуры нанотрубок, обработанных щелочью или кислотой. Вероятно, это связано с уменьшением размеров пор при закреплении на их поверхности наночастиц платины.
С использованием синтезированных катализаторов были изготовлены МЭБ и проведены их испытания в водородо-воздушных (кислородных) ТЭ с протонпроводящим полимерным электролитом.
Предварительно для оптимизации архитектуры электродов МЭБ были проведены исследования по влиянию на их характеристики состава активного слоя, загрузки катода по платине, давления кислорода и давления прессования МЭБ. На рис. 5 представлена зависимость напряжения при плотности тока 0.5 А/см2 от загрузки платины в АС катода. На воздухе без избыточного давления зависимость выражена в большей степени (рис. 5, кривая 1). При увеличении массы платины от 0.2 до 1.0 мг/см2 при испытаниях без избыточного давления газов напряжение изменяется от 0.62 до 0.71 В. Это связано с увеличением суммарной площади электрохимически активной поверхности платины (числа активных центров платины), доступных для кислорода воздуха (рис. 6, кривая 1). На это указывает также тот факт, что с увеличением загрузки по платине транзиент (снижение) напряжения уменьшается от 0.15 до 0.07 В при поляризации током 7.5 А (0.30 А/см2) в атмосфере воздуха (рис. 6, кривая 2). При большой загрузке по платине за счет увеличения общей ЭАП снижается удельная плотность тока. Чем меньше плотность тока поляризации, тем меньше снижение напряжения (транзиент) во времени при условии эффективной подачи кислорода в зону реакции. Использование в качестве носителя углеродных нанотрубок, имеющих большой объем мезопор, приводит к тому, что толщина активного слоя катода увеличивается по сравнению с катализатором на основе сажи. Это может приводить к росту транспортных потерь и снижению величины предельного тока. Однако, при изготовлении АС из катализатора 20Pt/УНТТ с близкими величинами нагрузки по платине (0.40–0.60 мг/см2) толщина слоя практически не изменялась при использовании давления прессования до 80 кг/см2. На рис. 7 и 8 представлены характеристики МЭБ, изготовленных с использованием 20%- и 40%-ных катализаторов Pt/УНТТNaOH. Как видно, при приблизительно равной загрузке по платине и прочих равных условиях характеристики МЭБ не слишком сильно отличаются между собой за исключением величины удельной поверхности платины в составе активного слоя. В катализаторе 20Pt/УНТ величина электрохимически активной площади поверхности платины равна 23 м2/г, а в случае 40Pt/УНТ – 43 м2/г, что составляет около ~57 и ~80% по отношению к результатам, полученным в модельных условиях. Это свидетельствует о более высокой эффективности использования Pt в АС катода МЭБ в случае его формировании на основе 40Pt/УНТТNaOH. Несмотря на низкий коэффициент использования Pt в АС катода на основе катализатора 20Pt/УНТТNaOH величина напряжения при плотности тока 0.50 А/см2 в атмосфере кислорода составляет 0.745 В (±5 мВ) для катализаторов с 20 и 40 мас. % Pt. При этом транзиент при работе ТЭ на постоянной заданной плотности тока (0.3 А/см2) рис. 7 и 8, значительно меньше при использовании катализатора 40Pt/УНТТNaOH, благодаря большей суммарной величине ЭАП этого катализатора. Более высокие величины транзиента, при использовании в АС катализатора 20Pt/УНТТ, связаны с тем, что величина суммарной ЭАП меньше, и следовательно реальная плотность тока выше. При увеличении загрузки этого катализатора до 0.63 мгPt/см2 транзиент, при прочих равных условиях, уменьшается. Толщина слоя (загрузка платины от 0.4 до 0.6 мгPt/см2) не оказывает заметного влияния на характеристики катода, как следует из рис. 5 и 6. При этом суммарная поверхность платины при загрузке 0.63 мгPt/см2 равна поверхности платины в АС на основе катализатора 40Pt/УНТТ при его массе на электроде 0.43 мгPt/см2 (табл. 3).
Рис. 5.
Зависимость напряжения при плотности тока 0.5 А/см2 от загрузки АС катода по платине на основе 40Pt/УНТTNaOH, Nf/C = 0.6. Анод во всех случаях 60Pt/C, 0.35 мгPt/см2, Nf/C = 1.0. Давление прессования МЭБ 60 кг/см2, 135°C, 1 мин.

Рис. 6.
Зависимость величины площади электрохимически активной поверхности платины в составе активного слоя катода (1) и транзиента (падение) напряжения ТЭ (2) при Iconst = 7.5 А (0.30 А/см2) от загрузки по платине (40Pt/УНТТNaOH).

Рис. 7.
(а) Разрядные кривые; (б) ЦВА катода, 50 мВ/с; (в) транзиент напряжения: 0.3 А/см2. МЭБ 25 см2, мембрана Nafion 212, 65°C, ГДС 10BC. Катод: 20Pt/УНТТNaOH – 0.63 мгPt/см2; Nf/C = 0.6. Анод: 60Pt/C– 0.32 мгPt/см2; Nf/C = 1.0.
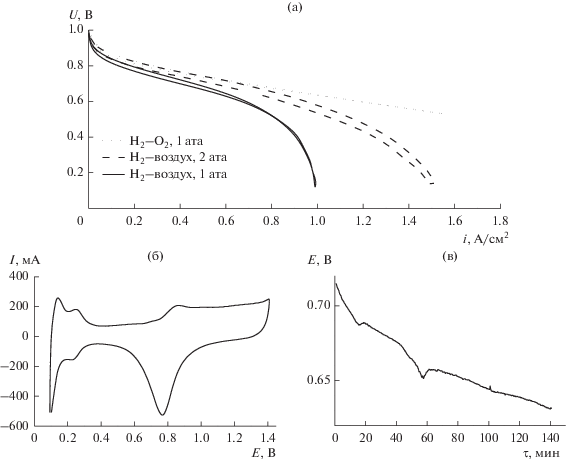
Рис. 8.
(а) Разрядные кривые; (б) ЦВА катода, 50 мВ/с; (в) транзиент напряжения: 0.3 А/см2. МЭБ 25 см2, мембрана Nafion 212, 65°C, ГДС 10BC. Катод: 40Pt/УНТТNaOH – 0.61 мгPt/см2; Nf/C = 0.6. Анод: 60Pt/C– 0.32 мгPt/см2; Nf/C = 1.0.

Таблица 3.
Омические, электрохимические и транспортные потери ТЭ с катодами на основе 20 и 40% Pt/УНТТ и 60% Pt/С (HiSPEC 9000), в ходе УСТ ТЭ на воздухе
| Катализатор | Загрузка, мгPt/см2* | Измерение | U, В при I = 0.5 А/см2 | Доля потерь при I = 0.5 А/см2, мВ // % | |||
|---|---|---|---|---|---|---|---|
| ΣΔU, мВ | ΔUэл-хим | ΔUомич | ΔUтрансп | ||||
| 20% Pt/УНТТNaOH | 0.63 (25.2) | До УСТ | 0.667 | 519 | 424 // 80 | 65//12 | 30 // 8 |
| 2000 циклов | 0.657 | 539 | 417 // 77 | 65//12 | 57 // 11 | ||
| 40% Pt/УНТТNaOН | 0.46 (25.3) | До УСТ | 0.677 | 519 | 366 // 71 | 74//14 | 79 // 15 |
| 2000 циклов | 0.655 | 540 | 358 // 66 | 76//14 | 106 // 20 | ||
| 60% Pt/С (HiSPEC 9000) | 0.44 (26.4) | До УСТ | 0.720 | 538 | 418 // 81 | 70//7 | 50 // 12 |
| 2000 циклов | 0.620 | 636 | 567 // 68 | 21//22 | 48 // 10 | ||
Как известно, причиной снижения токовых характеристик в ходе длительной работы ТЭ являются деградационные процессы различного происхождения. Результирующие потери напряжения могут быть оценены методом разделения потерь по методике, описанной в работе [27]. На рис. 9 представлена схема расчета составляющих поляризационных потерь: электрохимической, омической и транспортной на примере вольтамперной кривой водородо-воздушного ТЭ, снятой перед началом УСТ.
Рис. 9.
Схема расчета составляющих потерь напряжения для МЭБ, Н2–воздух ТЭ, МЭБ 25 см2, мембрана Nafion 212, 65°C, ГДС 10BC, без избыточного давления. Катод: 60 Pt/С, 0.44 мгPt/см2; Nf/C = 0.6. Анод: 60Pt/C – 0.32 мгPt/см2; Nf/C = 1.0.

Отклонение потенциала реакции восстановления кислорода от равновесного значения на катоде МЭБ $\Delta U$ определяется по формуле:
где ${{E}_{{{\text{равн}}}}}$ – равновесный потенциал реакции, В; $U$ – экспериментальное значение напряжения, В.Для расчета омических потерь использовали величину высокочастотного омического сопротивления $\left( {R_{{{\text{ом}}}}^{{{\text{ВЧ}}}}} \right),$ определенного методом импедансных измерений. $R_{{{\text{ом}}}}^{{{\text{ВЧ}}}}$ соответствует сопротивлению мембраны и контактов в ТЭ и не изменяется при использовании различных катализаторов по данным работы [27], и составляет:
Активационные потери обусловлены кинетикой реакции. Анализ разрядных кривых в полулогарифмических координатах показывает, что для разрядных кривых в области напряжений 0.8–0.9 В наблюдается участок с наклоном ~2.3RT/F, который соответствует кинетическому режиму генерации тока [27], отсутствию транспортных потерь, и наблюдаемые токовые характеристики соответствуют массовой активности катализатора. Экстраполяция этого наклона на обратимое значение потенциала кислородной реакции (рассчитанное с учетом температуры измерений в ТЭ) позволяет определить ток обмена i0 кислородной реакции.
Зная коэффициент $b,$ экспериментальное значение плотности тока на разрядной кривой $i,$ и значение тока обмена i0, можно определить активационные потери ${{\eta }_{{\text{а}}}}$ по формуле:
Транспортные потери обусловлены подводом реагентов к поверхности АС. При известной величине $\Delta U,$ омических ${{\eta }_{{{\text{ом}}}}}$ и активационных ${{\eta }_{{\text{а}}}}$ потерях, можно определить транспортные потери ${{\eta }_{{{\text{тр}}}}}$ по формуле:
Потери на аноде считали пренебрежимо малыми. Каждый эксперимент УСТ воспроизведен не менее 3 раз, точность определения величины U составляет ±5 мВ. Результаты расчетов отдельных составляющих потерь представлены в табл. 3.
Из представленных данных следует, что суммарные и активационные потери до УСТ практически совпадают для катализаторов Pt/УНТ и несколько больше на 60Pt/C. Близость величин суммарных потерь до УСТ на 20%- и 40%-ных катализаторах обусловлена тем, что реальная плотность тока в них, благодаря равной суммарной величине ЭАП Pt за счет несколько большей нагрузки в случае 20Pt/УНТ, одинакова (табл. 3). При равной величине плотности поляризующего тока могут быть выявлены транспортные и омические составляющие потерь, которые увеличиваются в процессе УСТ в катализаторах 40Pt/УНТTNaOH и 60Pt/С. Это, вероятно, связано с деградацией носителя в присутствии более высокого содержания Pt. Кроме того, при нанесении на УНТT Pt в количестве 40% структура материала изменилась и, как показано в табл. 2, уменьшились объем, размеры пор и величина наружной поверхности. В катализаторе 20Pt/УНТTNaOH нанесение платины не приводит к заметным изменениям пористой структуры (табл. 2). Стадией, определяющей характеристики при проведении УСТ, является суммарная величина ЭАП, и реальная (по сравнению с заданной) плотность тока поляризации. При близких величинах суммарной ЭАП платины, как показано в табл. 3, на первый план выступают транспортные ограничения, которые больше в катализаторах высокого содержания платины. На рис. 10 представлено снижение, в относительных единицах, ЭАП платины, определенной из ЦВА, записанных на катодах ТЭ. Как видно, в ходе УСТ в случае 60Pt/С катализатора происходит снижение ЭАП платины в 3 раза. В случае катализаторов Pt/УНТТNaOH, эта величина (уменьшение ЭАП платины) не превышает 15%.
Рис. 10.
Снижение площади активной поверхности платины в ходе УСТ для катализаторов: 1 – 20Pt/УНТTNaOH, 0.63 мгPt/см2, Nf/С = 0.6; 2 – 40Pt/УНТTNaOH, 0.43 мгPt/см2, Nf/С = 0.6; 3 – 60Pt/С, 0.44 мгPt/см2, Nf/С = 0.6. Анод 60Pt/С, 0.35 мгPt/см2, Nf/С = 1.0.
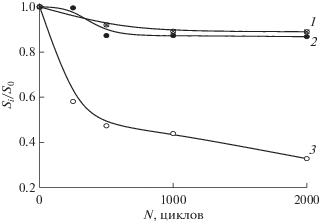
Характер происходящих деградационных процессов позволяет выявить различия в характеристических параметрах для МЭБ, выведенных на рабочий режим и МЭБ, прошедших УСТ. Активационные потери для всех катализаторов вносят наибольший вклад в суммарные потери напряжения, однако их величина после УСТ изменяется незначительно для катализаторов, синтезированных на УНТТ, и заметно возрастает на коммерческом катализаторе. Значительное снижение ЭАП платины и рост омической составляющей потерь, вероятно, указывают на разрушение носителя и осыпание платины, вызывающие снижение напряжения при плотности тока 0.5 А/см2 (до 0.620 В). Для катализаторов, синтезированных на УНТТNaOH, величина напряжения после УСТ составляет 0.655–0.657 В (табл. 3). Таким образом, по мере циклирования проявляются в большей степени преимущества каталитических систем, синтезированных на УНТTNaOH, обладающих более высокой стабильностью. Увеличение транспортных потерь в каталитической системе 40Pt/УНТTNaOH может быть связано со структурой катализатора в целом, поскольку объем и размеры пор уменьшились после нанесения 40% металла и поверхность по БЭТ в этой системе составляет около 150 м2/г (SУНТT = 270 м2/г), суммарный объем пор также значительно уменьшился (от 24.48 до 11.09 и от 4.76 до 1.83 см3/г), соответственно, что приводит к увеличению транспортных потерь по доставке кислорода (воздуха) к активным центрам восстановления кислорода. Влияние загрузки по платине в пределах 0.40–0.60 мг/см2 не приводит к существенному изменению характеристик катода МЭБ (рис. 5, 6). Кроме того, разную загрузку платины выбрали для того, чтобы получить близкие величины суммарной ЭАП для разных катализаторов. Аналогичное влияние углеродной подложки на характеристики МЭБ установлено в работе [40]. Показано, что максимальная мощность достигается при использовании в активном слое электродов мультистенных нанотрубок с нанесенным катализатором, которые, благодаря пористой структуре активного слоя, обеспечивают лучшие транспортные свойства по кислороду и протону. Влияние транспорта реагентов особенно заметно при повышении разрядной плотности тока и наблюдается для катализаторов с 20 и 40 мас. % Pt (рис. 11), поскольку транспортные потери возрастают при высоких плотностях тока. Это указывает на необходимость оптимизации активного слоя катода при использовании катализаторов, отличающихся по структурным характеристикам.
ЗАКЛЮЧЕНИЕ
Показано, что массовое содержание платины в катализаторах Pt/УНТТNaOH оказывает различное влияние на величину составляющих деградационных потерь. Суммарные и активационные потери практически совпадает (табл. 3) у катализаторов с массовым содержанием платины 40% и 20%, при условии, что величины ЭАП Pt, при выбранных нагрузках по платине совпадают. При этом в процессе УСТ увеличивается доля транспортных потерь в системе 40Pt/УНТТNaOH, и структурные параметры каталитической системы изменяются (уменьшилась величина поверхности Pt, объем и размер пор), что приводит к транспортным затруднениям по доставке реагентов к активным центрам.
В катоде с АС на основе 60Pt/C, несмотря на более тонкий слой (за счет высокого массового содержания Pt), транспортные потери обусловлены отсутствием мезопор в катализаторе, синтезированном на микропористом углеродном носителе. В этом случае характеристикой, определяющей эффективность процесса, становится структура активного слоя катода, обеспечивающая транспорт кислорода. После УСТ в результате деградации углеродного материала омические и транспортные потери увеличиваются, чему способствует и значительное содержание платины. При этом омические и транспортные потери выше, чем у 20%-ной платины на УНТTNaOH, что связано со структурными различиями. Основные изменения (увеличение) транспортных потерь обусловлены структурными параметрами катализаторов – уменьшением размера и объема пор преимущественно в катализаторе с содержанием платины 40 мас. %, которое происходит непосредственно после нанесения такого количества платины. Уменьшение размера пор приводит к затруднениям по доставке кислорода в зону реакции, что требует оптимизации архитектуры активного слоя каталитической системы.
Катализаторы, синтезированные на УНТТ, подвергнутых функционализации в NaOH, превосходят по стабильности коммерческий моноплатиновый катализатор (60Pt/C), благодаря более высокой устойчивости УНТТNaOH. Характеристики каталитических систем (активность и стабильность) c 20 и 40% Pt, нанесенными на УНТTNaOH превышают таковые, полученные на коммерческом катализаторе, после 2000 циклов электрохимического тестирования методом циклирования напряжения. Следует также отметить, что увеличение массовой доли платины на одном и том же носителе ускоряет деградацию.
Список литературы
Тарасевич, М.Р., Богдановская, В.А., Гаврилов, Ю.Г., Жутаева, Г.В., Казанский, Л.П., Кольцова, Э.М., Кузов, А.В., Лозовая, О.В., Модестов, А.Д., Радина, М.В., Филимонов, В.Я. PtCoCr катализаторы для катодов ТЭ: электрохимическая активность, содержание платины, тип носителя, структура и свойства. Физикохимия поверхности и защита материалов. 2013. Т. 49. С. 127. [Tarasevich, M.R., Bogdanovskaya, V.A., Gavrilov, Yu.G., Zhutaeva, G.V., Kazanskii, L.P., Kol’tsova, E.M., Kuzov, A.B., Lozovaya, O.V., Modestov, A.D., Radina, M.V., and Filimonov, V.Ya., PtCoCr Catalysts for Fuel Cell Cathodes: Electrochemical Activity, Pt Content, Substrate Nature, Structure and Corrosion Properties, Protection of Metals and Physical Chemistry of Surface, 2013, vol. 49, p. 125.]
Тарасевич, М.Р., Богдановская, В.А., Андреев, В.Н. Современные электрокатализаторы для топливных элементов c протонпроводящим полимерным электролитом. Катализ в промышленности. 2014. № 2. С. 16. [Tarasevich, M.R., Bogdanovskaya, V.A., and Andreev, V.N., Modern electrocatalysts for fuel cells with a proton-conductive polymeric electrolyte, Kataliz v promyshlennosti ((in Russian), 2014, no. 2, p. 16.]
Maniwan, W., Poochinda, K., and Hunsom, M., Activity and stability of PtxCr/C catalyst for oxygen reduction reaction: Effect of the Pt : Cr ratio and heat treatment atmosphere, International J. Hydrogen Energy, 2016, vol. 41, p. 21404.
Groger, O., Gasteiger, H.A., and Suchsland, J.-P., Review—Electromobility: Batteries or Fuel Cells?, J. Electrochem. Soc., 2015, vol. 162, p. A2605.
Sorsa, O., Romar, H., Lassi, U., and Kallio, T., Co-electrodeposited Mesoporous PtM (M = Co, Ni, Cu) as an Active Catalyst for Oxygen Reduction Reaction in a Polymer Electrolyte Membrane Fuel Cell, Electrochim. Acta, 2017, vol. 230, p. 49.
Long, N.V., Yang, Y., Thi, C.M., Minh, N.V., Cao, Y., and Nogami, M., The development of mixture, alloy, and core-shell nanocatalysts with nanomaterial supports for energy conversion in low-temperature fuel cells, Nano Energy, 2013, vol. 2, p. 636.
Stassi, A., Gatto, I., Monforte, G., Baglio, V., Passalacqua, E., Antonucci, V., and Arico, A.S., The effect of thermal treatment on structure and surface composition of PtCo electro-catalysts for application in PEMFCs operating under automotive conditions, J. Power Source, 2012, vol. 208, p. 35.
Wang, K.-C., Huang, H.-C., and Wang C.-H., Synthesis of Pd@Pt3Co/C core–shell structure as catalyst for oxygen reduction reaction in proton exchange membrane fuel cell, Internat. J. Hydrogen Energy, 2017, vol. 42, p. 11771.
Богдановская, В.А., Красильникова, О.К., Кузов, А.В., Радина, М.В., Тарасевич, М.Р., Аваков, В.Б., Капустин, А.В., Ландграф, И.К. Электрохимические и структурные характеристики PtCoCr/C катализатора с содержанием платины 50 мас. % и катод на его основе для топливного элемента. Электрохимия. 2015. Т. 51. С. 685. [Bogdanovskaya, V.A., Krasilnikova, O.K., Kuzov, A.V., Radina, M.V., Tarasevich, M.R., Avakov, V.B., Kapustin, A.V., and Landgraf, I.K., Electrochemical and structure characteristics of PtCoCr/C—catalyst with platinum content 50 wt % and cathode on its basis for fuel cell with proton-conducting polymer electrolyte, Russ. J. Electrochem., 2015, vol. 51, p. 602.]
Тарасевич, М.Р., Богдановская, В.А., Лозовая, О.В., Малеева, Е.А., Кольцова, Э.М. Новые носители: углеродные нанотрубки, оксиды титана и графеноподобные материалы и катализаторы для топливных элементов на их основе. Альтернативная энергетика и экология. 2012. № 01(105). С. 82. [Tarasevich, M.R., Bogdanovskaya, V.A., Lozovaya, O.V., Maleeva, E.A., and Kol’tsova, E.M., New carriers: carbon nanotubes, titanium oxide, graphene like materials and catalysts for fuel cells on their basis, Al’ternativnaya Energetika i Ekologiya (in Russian), 2012, no. 01(105), p. 82.]
Богдановская, В.А., Радина, М.В., Лозовая, О.В., Углеродные нанотрубки – перспективные носители для синтеза катодных катализаторов PtCoCr, Альтернативная энергетика и экология, 2012, № 2(106), с. 91. [Bogdanovskaya, V.A., Radina, M.V., and Lozovaya, O.V., Carbon nanotubes—perspectiv carrier for a synthesis of cathodic catalysts PtCoCr, Al’ternativnaya Energetika i Ekologiya (in Russian), 2012, no. 2(106), p. 91.]
Stamatin, S.N., Borghei, M., Dhiman, R., Andersen, S.M., Ruiz, V., Kauppinen, E., and Skou, E.M., Activity and stability studies of platinized multi-walled carbon nanotubes as fuel cell electrocatalysts, Appl. Catal. B: Environmental, 2015, vol. 162, p. 289.
Antolini, E., Carbon supports for low-temperature fuel cell catalysts, Appl. Catal. B: Environmental, 2009, vol. 88, p. 1.
Martínez-Huerta, M.V. and Lázaro, M.J., Electrocatalysts for low temperature fuel cells, Catalysis Today, 2017, vol. 285, p. 3.
Zhang, Wei and Silva, Ravi P., Application of carbon nanotubes in polymer electrolyte based fuel cells, Rev. Adv. Mater. Sci., 2011, vol. 29, p. 1.
Иваньшина, О.Ю., Тамм, М.Е., Герасимова, Е.В., Кочугаева, М.П., Кирикова М.Н., Савилов, С.В., Яшина, Л.В. Синтез и электрокаталитическая активность композитов наночастицы платины/углеродные нанотрубки. Неорган. материалы. 2011. Т. 47(6). С. 694. [Ivan’shin, O.Yu., Tamm, M.E., Gerasimova, E.V., Kochugaeva, M.P., Kirikova, M.N., Savilov, S.V., and Yashina, L.V., Synthesis and electrocatalytical activity of composites platinum nanoparticals/carbon nanotubes. Neorganicheskie materials (in Russian), 2011, vol. 47, no. 6, p. 694.]
Mezalira, D.Z. and Bron, M., High stability of low Pt loading high surface area electrocatalysts supported on functionalized carbon nanotubes, J. Power Sources, 2013, vol. 231, p. 113.
Bharti, A. and Cheruvally, G., Influence of various carbon nano-forms as supports for Pt catalyst on proton exchange membrane fuel cell performance, J. Power Sources, 2017, vol. 360, p. 196.
Yaragalla, S., Anilkumar, G., Kalarikkal, N., and Thomas, S., Structural and optical properties of functionalized multi-walled carbon nanotubes, Materials Science in Semiconductor Processing, 2016, vol. 41, p. 491.
Melchionna, M., Marchesan, S., Prato, M., and Fornasiero, P., Carbon nanotubes and catalysis: the many facets of a successful marriage, Catalysis Science & Technology, 2015, vol. 5, p. 3859.
Sahoo, M., Scott, K., and Ramaprabhu, S., Platinum decorated on partially exfoliated multiwalled carbon nanotubes as high performance cathode catalyst for PEMFC, Int. J. Hydrog. Energy, 2015, vol. 40, p. 9435.
Punetha, V.D., Rana, S., Yoo, H. J., Chaurasia, A., McLeskey, J.T., Jr., Ramasamy, M.S., Sahoo, N.G., and Choc, J.W., Functionalization of carbon nanomaterials for advanced polymer nanocomposites: A comparison study between CNT and graphene Vinay, Progress in Polymer Science, 2017, vol. 67, p. 1.
Богдановская, В.А., Кольцова, Е.М., Тарасевич, М.Р., Радина, М.В., Жутаева, Г.В., Кузов, А.В., Гаврилова, Н.Н. Высокоактивные и стабильные катализаторы, основанные на нанотрубках, модифицированных платиной для топливных элементов. Электрохимия. 2016. Т. 52. С.810. [ Bogdanovskaya, V.A., Kol’tsova, E.M., Tarasevich, M.R., Radina, M.V., Zhutaeva, G.V., Kuzov, A.V., and Gavrilova, N.N., Highly active and stable catalysts based on nanotubes and modified platinum for fuel cells, Russ. J. Electrochem., 2016, vol. 52, p. 723.]
Гинзбург, С.И., Езерская, Н.А., Прокофьева, И.В., Федоренко, Н.В., Шленская, В.И., Бельский, Н.К. Аналитическая химия платиновых металлов. М.: Издательство “Наука, 1972. 309 c. [Ginzburg, S.I., Ezerskaya, N.A., Prokof’eva, I.V., Fedorenko, N.V., Shlenskaya, V.I., and Bel’skii, N.K., Analytical chemistry of platinum metals (in Russian), Moscow, Nauka, 1972, 309 p.]
Gasteiger, H.A., Kocha, S.S., Sompalli, B., and Wagner, F.T., Activity Benchmarks and Requirements for Pt, Pt-Alloy, and Non-Pt Oxygen Reduction Catalysts for PEMFCs, Appl. Catal. B: Environmental, 2005, vol. 56, no. 1, p. 9.
Богдановская, В.А., Tарасевич, М.Р., Лозовая, О.В. Кинетика и механизм электровосстановления О2 на PtCoCr/C-катализаторе с содержанием Pt 20 и 40 мас. %. Электрохимия. 2011, Т. 47. С. 902. [Bogdanovskaya, V.A., Tarasevich, M.R., and Lozovaya, O.V., Кinetics and mechanism of oxygen electroreduction on catalyst containing 20–40 wt % platinum PtCoCr/C, Russ. J. Electrochem., 2011, vol. 47, p. 845.]
Аваков, В.Б., Алиев, А.Д., Бекетаева, Л.А., Богдановская, В.А., Бурковский, Е.В., Дацкевич, А.А., Иваницкий, Б.А., Казанский, Л.П., Капустин, А.В., Корчагин, О.В., Кузов, А.В., Ландграф, И.К., Лозовая, О.В., Модестов, А.Д., Станкевич, М.М., Тарасевич, М.Р., Чалых, А.Е. Исследование деградации мембранно-электродных блоков водородо-кислородного (воздушного) топливного элемента в условиях ресурсных испытаний и циклирования напряжения. Электрохимия. 2014. Т. 50. С. 858. [Avakov, V.B., Aliev, A.D., Beketaeva, L.A., Bogdanovskaya, V.A., Burkovskii, E.V., Datskevich, A.A., Ivanitskii, B.A., Kazanskii, L.P., Kapustin, A.V., Korchagin, O.V., Kuzov, A.V., Landgraf, I.K., Lozovaya, O.V., Modestov, A.D., Stankevich, M.M., Tarasevich, M.R., and Chalykh, A.E., Study of degradation of membrane-electrode assemblies of hydrogen–oxygen (air) fuel cell under the conditions of life tests and voltage cycling, Russ. J. Electrochem., 2014, vol. 50, p.773.]
Грегг, С., Синг, К., Адсорбция, удельная поверхность, пористость. М.: Мир, 1084, 306 с. [Gregg, S. and Sing, K., Adsorption, specific surface, porosity (in Russian), M.: Mir, 1972, 306 p.]
Dubinin, M.M., Chemistry and Physics of Carbon. N.Y.: Marcel Dekker. 1966. V. 2, p. 51.
Voloshchuk, A.M., Dubinin, M.M., Moskovskaya, T.A., Ivakhnyuk, G.K., and Fedorov, N.F., Pore structure and chemical state of the surface of carbon adsorbents communication 1.Selection of the comparative isotherm of adsorption of nitrogen vapors on the surface of carbon adsorbents, Bull. Acad. Sci. USSR, Division Chem. Sci., 1988, vol. 37, p. 204.
Huang, Z., Liao,Z., Yang, W., Zhou, H., Fu, Ch., Gong, Yi., Chen, L., and Kuang, Ya., Different types of nitrogen species in nitrogen-doped carbon material: the formation mechanism and catalytic role on oxygen reduction reaction, Electrochim. Acta, 2017, vol. 245, p. 957.
Sang, Y., Fu, A., Li, H., Zhang, J., Li, Z., Li, H., Zhao, X.S., and Guo, P., Experimental and theoretical studies on the effect of functional groups on carbon nanotubes to its oxygen reduction reaction activity, Colloids and Surfaces A: Physicochem. Eng. Aspects, 2016, vol. 506, p. 476.
Youngmi, Yi, Weingberg, G., Prenzel, M., Greiner, M., Heumann, S., Becker, S., and Schlogl, R., Electrochemical corrosion of glassy carbon electrode, Catalysis Today, 2017, vol. 295, p. 32.
Полянская, Е.М., Таран, О.П. Исследование функциональных групп на поверхности окисленного углеродного материала Сибунит методами кислотно-основного титрования и РФЭС. Вестник Томского государственного университета. Химия. 2017. № 10. С. 6. [Polyanskaya, E.M. and Taran, O.P., Research of functional groups on a surface of oxidated carbon material Sibunit methods of acid-base titration and XPS. Vestnik Tomskogo university. Chemistry. 2017, no. 10, p. 6.]
Gonzalez, E.R. and Antolini, E., Innovative Support Materials for Low-Temperature Fuel Cell Catalysts, Chapter 7, P. 341–400, in Book Polymer Electrolyte Fuel Cells. Science, Applications, and Challenges. Ed. by Franco, A.A. Pan Stanford Pablishing. 2013.
Soboleva, T., Zhao, X., Malek, K., Xie, Z., Navessin, T., and HoldcrofT, S., On the micro-, meso- and macroporous structures of polymer electrolyte membrane fuel cell catalyst layers, ACS Appl. Mater. Interfaces, 2010, vol. 2, p. 375.
Кольцова, Э.М., Богдановская, В.А., Тарасевич, М.Р., Василенко, В.А., Станкевич, М.М., Филиппова, М.М., Хорошавина, Е.Б. Компьютерное моделирование водородо-кислородного(воздушного) топливного элемента с учетом деградационных механизмов платинового катализатора на катоде. Электрохимия. 2016. Т. 52. С. 63. [Kol’tsova, E.M., Bogdanovskaya, V.A., Tarasevich, M.R., Vasilenko, V.A., Stankevich, M.M., Filippova, E.B., and Khoroshavina, A.A. Computer aided simulation of hydrogen-oxygen (air) fuel cell with regard to the degradation mechanism of platinum catalyst on the cathode, Russ. J. Electrochem., 2016, vol. 52, p. 53.]
Jomori, S., Nonoyama, N., and Yoshiba, T., Analysis and modeling of PEMFC degradation: effect on oxygen transport, J. Power Sources, 2012, vol. 215, p. 18.
Guterman, V.E., Pakharev, A.Y., and Tabachkova, N.Y., Microstructure and Size Effects in Pt/C and Pt3Ni/C Electrocatalysts Synthesised in Solutions Based on Binary Organic Solvents, Appl. Catal. A: General, 2013, vol. 453, p. 113.
Смирнова, Н.В, Куриганова, А.Б., Новикова, К.С., Герасимова, Е.В. Роль морфологии углеродного носителя в структуре каталитического слоя твердо-полимерного топливного элемента. Электрохимия. 2014. Т. 50. С. 999. [Smirnova, N.V., Kuriganova, A.B., Novikova, K.S., and Gerasimova, E.V., The role of carbon support morphology in the formation of catalytic layer of solid-polymer fuel cell, Russ. J. Electrochem., 2014, vol. 50, p. 899.]
Дополнительные материалы отсутствуют.



