Электрохимия, 2020, T. 56, № 12, стр. 1100-1105
Вольтамперометрическое исследование электрокаталитического окисления L-лактата натрия с помощью 4-ацетамид-TEMPO
Ж. Сион a, Д. Уян a, В. Жан a, *
a Ичуньский Университет
336000 Ичунь, КНР
* E-mail: zhangwbycu@163.com
Поступила в редакцию 20.12.2019
После доработки 22.05.2020
Принята к публикации 11.06.2020
Аннотация
Проведено сравнительное исследование использования 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO) и 4-ацетамид-TEMPO в качестве медиатора электрохимического окисления L-лактата натрия методом циклической вольтамперометрии. Показано, что в этих электрокаталитических реакциях 4-ацетамид-TEMPO более эффективен в качестве медиатора. Подробное исследование характеристик электроокисления L-лактата натрия с помощью 4-ацетамид-TEMPO путем варьирования pH и концентрации L-лактата натрия позволило измерить методом хроноамперометрии чувствительность электроаналитического определения L-лактата натрия: 2.78 мкA cм–2/мМ, и константу скорости каталитического процесса: 51.7 л/(моль с).
ВВЕДЕНИЕ
Лактат натрия используют в медицине для реанимации, гемодинамического улучшения или бустирования сердечной деятельности при острой сердечной недостаточности [1–3]. Было показано, что лактат натрия – это очень ценная добавка в пищевой промышленности [4–8]; он также применяется, как антимикробное, увлажняющее и пищевкусовое вещество. Отметим также, что лактат натрия тесно связан с молочной кислотой, важным полупродуктом в химической промышленности [9]. Недавно лактат натрия успешно применили в качестве экологичного и устойчивого адсорбента для десульфирования топочных газов [10, 11]. В свете будущих применений, исследование химии и электрохимии лактата натрия заслуживает неотложной интенсификации.
Электрохимическое исследование лактата было сосредоточено главным образом на методах его электрохимического определения [12–14]; в основном это амперометрические биосенсоры для определения лактата в мышцах и крови, главным образом с применением ферментных электродов различного типа, в которых лактат может быть определен непрямым способом с помощью ферментов лактатоксидазы или лактатдегидрогеназы, которые катализируют электрохимические реакции. Насколько нам известно, электрохимические исследования лактата, помимо изготовления электрохимических биосенсоров, все еще находятся в стадии предварительного развития.
Реакции электроокисления спиртов, аминов или функционализацию группами C–H с участием 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO) и соответствующих циклических аминоксильных радикалов исследуют уже в течение многих десятилетий [15]. При создании электрохимических сенсоров и в органическом электросинтезе было исследовано много полезных соединений, таких как L-тирозин [16], 5-гидроксиметилфурфурал [17], витамин B6 [18]. В настоящей работе методом циклической вольтамперометрии проведено сравнительное исследование использования 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO) и 4-ацетамид-TEMPO (ACT) для электрохимического окисления L-лактата натрия. 4-Ацетамид-TEMPO – более эффективный медиатор – был изучен более подробно, с перспективой его последующего применения в электрохимических сенсорах на лактат натрия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все реактивы использовались без дополнительной очистки: TEMPO (98%, Aladdin), L-лактат натрия (60%-ный водный раствор, Aladdin), 4‑ацетамид-TEMPO (98%, J&K, Пекин), карбонат натрия (≥99.8%, Yongda, Тяньцзинь) и бикарбонат натрия (≥99.5%, Yongda, Тяньцзинь). Стеклоуглеродные дисковые электроды, электроды-пластинки Pt и электрод сравнения Ag/AgCl (нас. KCl) были приобретены у компании GaossUnion, Inc. Все растворы готовили на ультрачистой воде (удельное сопротивление >18 MОм). Эксперименты по циклической вольтамперометрии и хроноамперометрии проводили в обычной трехэлектродной ячейке с неразделенными пространствами с помощью электрохимического комплекса CHI650E. Рабочим служил стеклоуглеродный электрод (диаметром 3 мм), электродом сравнения – Ag/AgCl (нас. KCl), противоэлектродом – Pt. Скорость развертки потенциала равнялась 5 мВ/с. Электролитом служил 0.1 М буферный раствор карбоната натрия (pH 9–11).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как показано на рис. 1, потенциал полуволны окислительно–восстановительной пары ACT/ACT+ приблизительно на 100 мВ выше, чем у пары TEMPO/TEMPO+. Это указывает на то, что для окисления ACT требуется более высокая энергия, чем для окисления TEMPO. Согласно объяснению, данному в предшествующей работе [19], эффект электронной индукции амидной группы, содержащей электроотрицательные атомы азота и кислорода, дестабилизирует оксоаммониевый катион, поэтому для генерирования ACT+ требуется более положительный потенциал, чем для генерирования TEMPO+.
Рис. 1.
Циклические вольтамперограммы (a) 3 мМ TEMPO в отсутствие (1) и в присутствии (2) 19 мМ L-лактата натрия; (б) 3 мМ ACT в отсутствие (3) и в присутствии (4) 19 мМ L-лактата натрия при pH 9.8. Потенциал сканируется от отрицательных значений к положительным.

Известно, что соответствующие соединения-кетоны можно получать из вторичных спиртов по реакциям электроокисления с нитроксильными радикалами в качестве медиаторов в водных щелочных растворах [20]. Вольтамперограммы, наблюдаемые в карбонатном буферном растворе (pH 9.8), содержащем TEMPO или ACT в присутствии L-лактата натрия, хорошо согласуются с представлениями о типичном ЭХ'-механизме (т.е., классическом электрокаталитическом механизме). Это может указывать на то, что лактат натрия в щелочной среде может реагировать с электрогенерированным TEMPO+ или ACT+. После распада промежуточного продукта и образования окончательного продукта, TEMPO или ACT в конце концов регенерируются, как показано в предшествующих исследованиях [21]; предлагаемый механизм приведен на схеме 1.
Сравнение электрокаталитических токов на рис. 1 показывает, что ACT демонстрирует более сильную каталитическую активность по отношению к реакции окисления L-лактата натрия, чем TEMPO, хотя и при более высоком формальном потенциале окисления, и это находится в хорошем согласии с наблюдениями, сделанными в работе [20]. Это улучшенное электрокаталитическое поведение ACT можно связать с более легким образованием алкоксидного аддукта между оксоаммониевыми остатками и L-лактатом натрия, с учетом того, что электрофильность ACT+ выше, чем у TEMPO+. Далее, ACT будет использован как наилучший медиатор электроокисления L-лактата натрия. Обратимся к его потенциальному применению при конструировании электрохимического сенсора на лактат натрия.
Схема 1. Предлагаемый механизм окисления L-лактата натрия в щелочной среде с медиатором – нитроксильными радикалами.
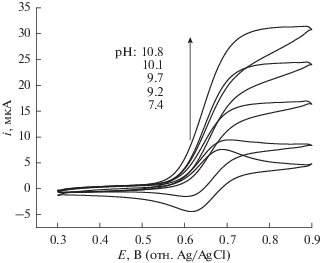
Согласно исследованию механизма реакции, проведенному в работе [22], в щелочной среде регенерирование нитроксильных радикалов не может быть скоростьопределяющей стадией, и поэтому зависимость pH от каталитического тока следует приписать образованию алкоксидного аддукта, чему способствует присутствие ионов OH–. Скорее всего, как видно из рис. 2, с ростом концентрации ионов OH– растет электроокислительная сила ACT по отношению к L-лактату натрия. Можно заключить, что с ростом pH возрастает концентрация алкоксидного аддукта с депротонированной реакционноспособной формой L‑лактата натрия; поэтому увеличивается каталитическая активность этой реакции – электроокисления L-лактата натрия с медиатором ACT. К тому же сравнение значений анодного и катодного пиковых токов не выявило никакого явного каталитического поведения в фосфатном буферном растворе при pH 7.4. Для сравнительного исследования ускоренного щелочью разложения ACT+ и образования некаталитического гидроксидного аддукта-цвиттериона мы снимали циклические вольтамперограммы 2.0 мМ раствора ACT в присутствии различных концентраций L‑лактата натрия при pH 10.8. Потенциал начала окисления L-лактата натрия близок к 0.57 В относительно Ag/AgCl(нас. KCl)-электрода сравнения (рис. 2).
Рис. 2.
Циклические вольтамперограммы 3.0 мМ ACT в присутствии 19.0 мМ L-лактата натрия при различных рН.
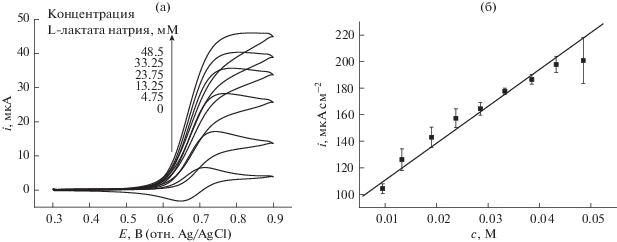
На рис. 3б показана линейная зависимость плотности анодного пикового тока от концентрации L-лактата натрия в области от 4.75 до 48.5 мМ. Она показывает, что эта электрокаталитическая реакция имеет кинетику первого порядка по отношению к L-лактату натрия в растворе. Чувствительность ACT к L-лактату натрия, определенная по этой линейной зависимости, равняется 2.78 мA cм–2/М). Дополнительно, линейная зависимость анодных пиковых токов от корня квадратного из скорости развертки потенциала показывает, что эта реакция электроокисления контролируется диффузией.
Рис. 3.
(a) Циклические вольтамперограммы 3.0 мМ ACT в присутствии различных концентраций L-лактата натрия при pH 10.8; (б) зависимость каталитического пикового тока от концентрации L-лактата натрия.
Для получения количественной информации об электроокислении с медиатором ACT, эту реакцию исследовали методом хроноамперометрии. На рис. 4 приведены типичные хроноамперограммы, полученные с ACT в отсутствие и в присутствии L-лактата натрия. Потенциал меняли ступенчатым образом от 400 до 900 мВ. Видно, что после добавления субстрата хроноамперометрический ток увеличивается. Каталитическая константа скорости k этой реакции электроокисления может быть найдена с помощью следующего уравнения [23]:
где c0 – это начальная концентрация L-лактата натрия, ib и ic – каталитический ток, соответственно, в отсутствие и в присутствии L-лактата натрия. Вычисленная каталитическая константа скорости k равняется 51.7 л/(моль с); для вторичного спирта это – достаточно большая величина.ЗАКЛЮЧЕНИЕ
Результаты циклической вольтамперометрии показывают, что ACT – более эффективный катализатор реакции электроокисления вторичного спирта – L-лактата натрия по сравнению с TEMPO. Например, отношение каталитических пиковых токов электроокисления L-лактата натрия (ic/ib) при pH 9.8 при прочих равных условиях в случае ACT почти вдвое выше, чем в случае TEMPO. Это повышение электрокаталитической активности можно связать с электронодонорной способностью ацетамидной группы. Точнее, при реакции электроокисления L-лактата натрия, катализируемой ACT, рост концентрации ионов OH- способствует образованию алкоксидного аддукта, и поэтому электрокаталитическая активность возрастает с ростом величины pH в области от pH 9 до pH 11. Дополнительно, продемонстрирована линейная зависимость электрокаталитических пиковых токов от концентрации L-лактата натрия, которая показывает, что это электроокисление – реакция первого порядка по L-лактату натрия; из этой зависимости определена чувствительность потенциального электрохимического сенсора на L-лактат натрия на основе реакции электроокисления с медиатором ACT: 2.78 мкA cм–2/мМ. Вычисленная из хроноамперометрических кривых каталитическая константа скорости равняется 51.7 л/(моль с). В настоящей работе расширен круг электрокаталитических реакций с использованием ACT в качестве медиатора. Более того, показана возможность изготовления не ферментного электрохимического сенсора для определения лактата натрия.
Список литературы
Ichai, C., Orban, J.C., and Fontaine, E., Sodium lactate for fluid resuscitation: the preferred solution for the coming decades? Crit. Care, 2014, vol. 18, p. 163.
Nalos, M., Leverve, X., Huang, S., Weisbrodt, L., Parkin, R., Seppelt, I., Ting, I., and Mclean, A., Half-molar sodium lactae infusion improves caradiac performance in acute heart failure: a pilot randomised controlled clinical trial. Crit. Care, 2014, vol. 18, p. R48.
Duburcq, T., Durand, A., Dessein, A.F., Vamecq, J., Vienne, J.C., et al., Comparison of fluid balance and hemodynamic and metabolic effects of лактат натрия versus sodium bicarbonate versus 0.9% NaCl in porcine endotoxic shock: a randomized, open-label, controlled study. Crit. Care, 2017, vol. 19, p. 113.
Martinez, L., Cilla, I., Beltran, J.A., and Roncales, P., Combined effect of modified atmosphere packaging and addition of rosemary (rosmarinus officinalis), ascorbic acid, red beet root (beta vulgaris), and sodium lactate and their mixtures on the stability of fresh pork sausages. J. Agr. Food Chem., 2006, vol. 54, p. 4674.
IIhak, O.I. and Guran, H., Combined antimicrobial effect of thymol and sodium lactate against listeria monocytogenes and salmonella typhimurium in fish patty. J. Food Safety, 2014, vol. 34, p. 211.
Mohan, C.O., Ravishankar, C.N., Kumar, K.A., and Gopal, T.K., Biogenic amines and nucleotide breakdown products of sodium acetate, sodium lactate, and sodium citrate treated seer fish (Scomberomorus commerson) during iced storage. J. Food Safety, 2019, vol. 39, p. 12633.
Zhang, L., Wang, H., Jin, C., Zhang, R., Li, L., Li, X., and Jiang, S., Sodium lactate loaded chitosan-polyvinyl alcohol/monotmorillonite composite film towards active food packaging. Innov. Food Sci. Emerg., 2017, vol. 42, p. 101.
Juneja, V.K., Delayed Clostridium perfringens growth from a spore inocula by лактат натрия in sous-vide chicken products. Food Microbio, 2006, vol. 23, p. 105.
Dusselier, M., Wouwe, P.V., Dewaele, A., Makshina, E., and Sels, B.F., Lactic acid as a platform chemical in the biobased economy: the role of chemocatalysis. Energy Environ. Sci., 2013, vol. 6, p. 1415.
Zhang, K., Ren, S., Hou, Y., Wu, W., and Bao, Y., Sodium lactate aqueous solution, a green and stable absorbent for desulfurization of flue gas. Industrial & Engineering Chem. Res., 2017, vol. 56, p. 13844.
Wu, Z., Hou, Y., Wu, W., Ren, S., and Zhang, K., Efficient removal of sulfuric acid from sodium lactate aqueous solution based on the common-ion effect for the absorption of SO2 of flue gas. Energ. Fuels, 2019, vol. 33, p. 4395.
Rathee, K., Dhull, V., Duhll, R., and Singh, S., Biosensors based on electrochemical lactate detection: A comprehensive review. Biochem. Biophys. Rep., 2016, vol. 5, p. 35.
Kucherenko, I.S., Topolnikova, Y.V., and Soldatkin, O.O., Advances in the biosensors for lactate and pyruvate detection for medical applications: a review. TrAC Trends in Anal. Chem., 2019, vol. 110, p. 160.
Cunhua-Silva, H., Pires, F., Dias-Cabral, A.C., and Arcos-Martinez, M.J., Inhibited enzymatic reaction of crosslinked lactate oxidase through a pH-dependent mechanism. Colloids surface B: Biointerfaces, 2019, vol. 184, p. 110490.
Nutting, J.E., Rafiee, M., and Stahl, S.S., Tetramethylpiperidine N-Oxyl (TEMPO), Phthalimide N-Oxyl (PINO), and related N-oxyl species: electrochemical properties and their use in electrocatalytic reactions. Chem. Rev., 2018, vol. 118, p. 4834.
Li, Y., Wen, X.L., and Liu Z.L., Electrocatalytic oxidation of Vitamin B6 by 4-Hydroxy-2,2,6,6-tetramethyl piperidine-N-oxy. Chin. J. Chem., 2004, vol. 22, p. 1356.
Wen, X.L., Jia, Y.H., Yang, L., and Liu, Z.L., Electrocatalytic oxidation of L-tyrosine by a nitroxide. Talanta, 2001, vol. 53, p. 1031.
Cardiel, A.C., Taitt, B.J., and Choi, K., Stabilities, regeneration pathways, and electrocatalytic properties of nitroxyl radicals for the electrochemical oxidation of 5‑hydroxymethylfurfural. ACS Substainable Chem. Eng., 2019, vol. 7, p. 11138.
Manda, S. Nakanishi, I., Ohkubo, K., Yakumaru, H., Matsumoto, K., Ozawa, T., Ikota, N., Fukuzumi, S., and Anzai, K., Nitroxyl radicals: electrochemical redox behaviour and structure–activity relationships. Org. Biomol. Chem., 2007, vol. 5, p. 3951.
Rafiee, M., Miles, K.C., and Stahl, S.S., Electrocatalytic alcohol oxidation with TEMPO and bicyclic nitroxyl derivatives: driving force trumps steric effects. J. Am. Chem. Soc., 2015, vol. 137, p. 14751.
Hill-Cousins, J.T., Kuleshova, J., Green, R.A., Birkin, P.R., Pletcher, D., Underwood, T.J., Leach, S.G., and Brown, R.C.D., TEMPO-Mediated Electrooxidation of Primary and Secondary Alcohols in a Microfluidic Electrolytic Cell. ChemSusChem., 2012, vol. 5, p. 326.
Green, R.A., Hill-Cousins, J.T., Brown, R.C.D., Pletcher, D., and Leach, S.G., A Voltammetric Study of the 2,2,6,6-Tetramethylpiperidin-1-oxyl (TEMPO) Mediated Oxidation of Benzyl Alcohol in tertButanol/Water. Electrochim. Acta, 2013, vol. 113, p. 550.
Galus, Z., Fundamentals of Electrochemical Analysis, N.Y.: Ellis Horwood Press, 1994, p. 388.
Дополнительные материалы отсутствуют.




