Электрохимия, 2023, T. 59, № 2, стр. 81-91
Электрофоретическое осаждение наноразмерных частиц кобальтата лития на поверхности металлов и электропроводящей оксидной керамики
В. А. Хохлов a, *, Д. В. Моденов a, В. Н. Докутович a, Э. Г. Вовкотруб a, В. А. Кочедыков a, Л. А. Акашев b, В. Б. Малков a, А. А. Панкратов a, А. В. Фетисов c
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Институт химии твердого тела УрО РАН
Екатеринбург, Россия
c Институт металлургии УрО РАН
Екатеринбург, Россия
* E-mail: vladkhokh@mail.ru
Поступила в редакцию 11.02.2022
После доработки 29.08.2022
Принята к публикации 29.08.2022
- EDN: NEWGOY
- DOI: 10.31857/S0424857023020056
Аннотация
В статье представлены результаты исследования электрофоретического осаждения наноразмерных частиц LiCoO2, синтезированных в расплавах LiCl–CoCl2, на поверхностях никелевой фольги, меди, хром-кобальтового сплава и платиновой сетки в водных растворах хлорида лития при комнатной температуре и на поверхности электронопроводящей оксидной керамики La0.6Sr0.4MnO3 в хлоридном расплаве при температуре около 700°C. Методами колебательной спектроскопии, рентгеновской фотоэлектронной спектроскопии, эллипсометрии и сканирующей электронной микроскопии выявлены особенности химического состава, структуры и морфологии полученных осадков.
ВВЕДЕНИЕ
Кобальтат лития LiCoO2 является одним из широко используемых катодных материалов литий-ионных аккумуляторов благодаря высокой электрохимической емкости и скорости разряда [1–3]. Особый интерес представляет формирование тонкопленочных катодов из кобальтата лития для миниатюрных источников тока, которые могут использоваться в компьютерных микросхемах и микроэлектронных медицинских устройствах [4, 5]. Сообщается о перспективности твердотельных литий-ионных аккумуляторов и использования в них катодных узлов – “сэндвичей”, содержащих тонкий слой малоразмерных частиц LiCoO2, существенно повышающих рабочие характеристики и безопасность источников тока [6]. Большой интерес вызывает использование эпитаксиальных тонких пленок кобальтата лития для изготовления синаптических транзисторов, которые способны “самообучаться” и менять свои электрические и электронные характеристики в процессе работы [7], а также катодов с особой ориентацией нанокристаллов для литиевых источников тока, которые обеспечивают очень большой высокоскоростной разряд без потери емкости [8]. Рассматриваются различные способы модифицирования тонкопленочных электродов на основе кобальтата лития другими оксидными материалами для стабилизации их слоистой структуры и повышения долговечности пленок [9–11]. В этих и десятках других публикаций подробно описаны не только уникальные свойства компонентов литий-ионных аккумуляторов и микроустройств на основе тонких пленок LiCoO2, но и способы их получения. Чаще всего используются физические методы осаждения кобальтата лития, в том числе при формировании многослойных электродов. Методы импульсного лазерного осаждения [12–14], высокочастотного магнетронного распыления [15‒17], электростатического напыления [18, 19] позволили получить высококачественные тонкие пленки LiCoO2 без примесных фаз с контролируемой морфологией и заданной ориентацией кристаллической оси. Так, в работе японских исследователей [14] методами циклической вольтамперометрии и импедансной спектроскопии подробно изучены и сопоставлены электрохимические свойства пленок хаотически ориентированных (порошкообразных) и ориентированных по кристаллической оси с наноразмерных частиц гексагонального кобальтата лития. Результаты исследования показали, что ориентированные нанокристаллические осадки LiCoO2, образующиеся на металлических подложках в начальный период их получения методом импульсного лазерного осаждения, увеличивают сопротивление переносу заряда и снижают реакционную способность тонкопленочного электрода Li-ионных аккумуляторов.
Следует отметить комплексные методы, сочетающие вышеупомянутые физические способы с предварительным синтезом кобальтата лития из прекурсоров, обычно карбоната лития и оксидов кобальта, непосредственно на подложках [20‒22].
Эффективным методом формирования пленок для Li-ионных источников тока и тонкослойных конденсаторов и транзисторов является электрофоретическое осаждение малоразмерных частиц кобальтата лития на металлы и электронопроводящие керамики.
Описанные в научной литературе способы его реализации [23–31] сложны, энергозатратны и трудоемки. Кроме синтеза и измельчения исходного кобальтата лития или прекурсоров до субмикронного состояния, для осуществления электрофореза требуется применение вспомогательных веществ (органических растворителей с различными добавками для получения взвесей оксидных частиц, поверхностно-активных диспергирующих агентов, сажи) и специальных методов стабилизации суспензий. В большинстве случаев после электрофореза необходима термообработка (отжиг) полученной пленки LiCoO2. Осаждение проводится обычно в импульсном режиме при межэлектродном напряжении постоянного тока до 100 В/см в течение десятков минут [23–26].
Одним из главных требований к электрофоретическому способу получения осадков наноразмерных оксидных частиц на поверхности металлов или керамик является создание их устойчивых взвесей в жидких средах. Синтез наноразмерных порошков LiCoO2 можно осуществить в среде расплавленных солей [32–40]. Часто в состав реакционной среды, кроме прекурсоров (обычно, термически неустойчивых солей лития и кобальта), взятых в количествах, обеспечивающих стехиометрический состав конечного продукта, добавляют формально не участвующие в синтезе расплавленные хлориды щелочных металлов, играющие роль жидкостей, обеспечивающих равномерное распределение малоразмерных частиц оксидов лития и кобальта, что облегчает синтез LiCoO2. После отделения оксидных продуктов реакции от солей, как правило, проводят их длительный отжиг при температурах выше 1200°C для завершения реакции образования свободных от примесей субмикронных кристаллических частиц кобальтата лития с высокотемпературной ромбоэдрической структурой.
В данной статье сообщается об электрофоретическом осаждении наноразмерных частиц LiCoO2, синтезированных в расплавах LiCl–CoCl2, и формировании из них тонких пленок на гладких поверхностях никелевой фольги, меди, хром-кобальтового сплава и платиновой сетки в водных растворах хлорида лития при комнатной температуре, а также на поверхности электронопроводящей оксидной керамики La0.6Sr0.4MnO3 в суспендированных системах оксид-хлоридный расплав при температуре около 700°C.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез порошка кобальтата лития
Для синтеза наноразмерных частиц LiCoO2 был использован разработанный нами способ, основанный на окислении кислородом воздуха термически устойчивых хлоридов лития (LiCl) и кобальта (CoCl2) и взаимодействии промежуточных продуктов (оксидов Li2O и Co2O3) в солевом расплаве с образованием не растворимого в нем кобальтата лития. Он термодинамически обоснован и подробно описан ранее в нашей статье [41]. Синтез проводили при температурах от 650 до 700°C без последующего высокотемпературного отжига. Этот способ позволяет тонко регулировать размеры и морфологию продуктов реакции при изменении концентрации компонентов галогенидных расплавов, парциального давления О2 в рабочей газовой смеси, температуры и других условий получения тонких порошков кобальтата лития. Сольватация синтезированных наноразмерных частиц ионами реакционной среды существенно тормозит их агрегацию и обеспечивает устойчивость взвесей частиц в солевом расплаве или водном растворе электролита, что позволяет осуществить их осаждение на поверхностях металлов, полупроводников и электронопроводящих керамик методом электрофореза.
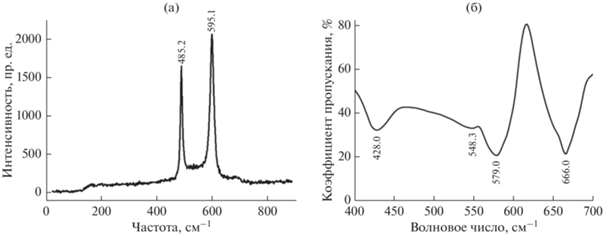
Идентификацию химического и фазового состава отмытого от соли и высушенного при температуре 80°C порошка проводили методами рентгенофазового анализа (РФА), спектроскопии комбинационного рассеяния света (КРС) и инфракрасной (ИК) спектроскопии. Показанные в качестве типичного примера рентгенограмма (рис. 1) и колебательные спектры (рис. 2) продукта реакции, полученного в расплавленной смеси 0.80LiCl–0.20CoCl2 при 700°C, свидетельствуют о том, что образовавшийся однофазный порошок состоит из малоразмерных кристаллов высокотемпературной модификации кобальтата лития (HT-LiCoO) с ромбоэдрической структурой, принадлежащей тригональной пространственной группе $R\bar {3}m$ [42, 43].
Рис. 1.
Рентгенограмма порошка кобальтата лития (LiCoO2), синтезированного в расплавленной смеси LiCl–CoCl2 при 700°C.

Рис. 2.
Колебательные спектры КРС (а) и ИК (б) порошка кобальтата лития (LiCoO2), синтезированного в расплавленной смеси LiCl–CoCl2 при 700°C.
Анализ рентгенограмм свидетельствует о малом размере синтезированных частиц кобальтата лития (40–50 нм).
Групповой факторный анализ показал [44], что два пика в спектре КРС и три ИК-активные моды располагаются в диапазоне от 400 до 700 см–1. По литературным данным, положение конкретных колебательных полос зависит от метода синтеза высокотемпературной модификации LiCoO2 [45, 46].
В нашем случае, как видно из колебательных спектров наноразмерного порошка LiCoO2, спектральные пики КРС при 485.2 и 595.1 см–1 отвечают активным модам Eg и A1g пространственной группы $R\bar {3}m,$ полосы ИК-спектров при 660.0 и 579.0 см–1 относятся к колебаниям связей Co–O и O–Co–O, а пики 548.3 и 428.0 см–1 отражают колебания связи Li–O.
Методика электрофоретического осаждения наноразмерных частиц
Электрофоретическое осаждение наноразмерных частиц LiCoO2 осуществляли при комнатной температуре из их суспензий в достаточно концентрированном водном растворе хлорида лития, которые были устойчивы и не расслаивались в течение нескольких часов. Ячейка для проведения электрофореза представляла собой плексигласовую кювету прямоугольного сечения (10 × 4 см) высотой 4 см, наполовину заполненную суспензией. В качестве электродов использовали никелевую фольгу, плазменно-напыленные на керамические пластинки медь и кобальт-хромовый сплав, а также платиновую сетку.
В случае выделения продуктов реакции на поверхности электронопроводящей оксидной керамики электрофорез проводили непосредственно в реакторе для синтеза кобальтата лития в расплаве LiCl–CoCl2 (рис. 3) при 700°C сразу же после накопления в реакционной смеси наноразмерных частиц LiCoO2. Для этого прикрепленные к платиновым проводникам электроды из оксидной керамики были опущены в расплав на половину своей высоты. Платиновые токоподводы во время эксперимента не касались солевого расплава. Электроды в виде прямоугольных параллелепипедов были спрессованы из порошка манганита лантана–стронция (La0.6Sr0.4MnO3) с последующим их спеканием (отжигом) при температуре 1450°С.
Рис. 3.
Схема реактора для синтеза и электрофоретического осаждения кобальтата лития в хлоридном расплаве.

Исходная эффективная плотность электродов была равна 5.31 г/см3 (85% от теоретической), а электропроводность – около 200 × 102 См/м в обычных условиях (20°С, воздушная атмосфера, давление около 1 атм).
Предварительно в расплаве LiCl–CoCl2 при 700°С в течение 11 ч был проведен синтез наноразмерных частиц кобальтата лития согласно упомянутой выше методике, чтобы осуществить их электрофоретическое осаждение после погружения электродов в образовавшуюся взвесь частиц LiCoO2 в хлоридном расплаве.
Как в случае водно-солевых, так и расплавленных хлоридных электролитов электрофоретическое осаждение суспендированных наноразмерных частиц кобальтата лития проводили 5–6 ч при электродном напряжении, не превышающем 0.5 В, чтобы исключить фарадеевский процесс (электролитическое разложение водного раствора или расплава солей). Ионная сольватация наноразмерных оксидных частиц (диэлектриков) обеспечивала их смещение к катоду или аноду в зависимости от знака суммарного заряда сольватной оболочки и осаждение частиц в виде тонкой пленки на поверхность металла или оксидной керамики. Осажденную пленку вместе с подложкой тщательно промывали дистиллированной водой и сушили при температуре ниже 100°С. Приготовленные таким образом образцы пленки были подвергнуты тщательному изучению различными инструментальными методами.
Методы исследования пленок кобальтата лития
Структура, химический состав и морфология осадков были изучены методами фурье – инфракрасной спектроскопии (ИК-фурье), спектроскопии комбинационного рассеяния света (КРС), спектроскопии нарушенного полного внутреннего отражения (НПВО), рентгеновской фотоэлектронной спектроскопии (РФЭС), эллипсометрии и сканирующей электронной микроскопии (СЭМ) вкупе с энергодисперсионной рентгеновской спектроскопией (ЭДС).
ИК-фурье-спектры регистрировали, используя спектрометр Bruker Tensor 27 (Bruker Optik GmbH, Германия) в интервале волновых чисел от 375 до 4000 см–1. НПВО-спектры пленок записывали на спектрометре Nicolet 6700 FT-IR (Thermo Fisher Scientific, США) в той же спектральной области. Структуру пленок LiCoO2 изучали на раман-спектрометре Jobin Yvon U 1000 (Renishaw, Англия) с аргон-ионным лазером (514.5 нм) в интервале частот 50–1000 см–1. Рентгеновские фотоэлектронные спектры пленки кобальтата лития на металлической поверхности получали, используя электронный спектрометр Multiprobe (Omicron, Германия) с источником излучения MgKα мощностью 170 Вт. Пленки LiCoO2, нанесенные на металлические поверхности, исследовали методом эллипсометрии на лазерном эллипсометре ЛЭФ-3М (Феодосийский приборостроительный завод, Украина). Морфологию частиц, осажденных на поверхность металлов и оксидной керамики, изучали с помощью растрового электронного микроскопа X-Act ADD + JSM-5900LV (Jeol, Япония), оснащенного системой волнодисперсионного микроанализатора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пленки LiCoO2 на металлических поверхностях
Электрофоретическое формирование на поверхности металлов пленок наноразмерных частиц LiCoO2 проводили из их устойчивых суспензий в достаточно концентрированных водных растворах хлорида лития. Как правило, использовались первые порции фильтрата, получаемого после растворения охлажденного оксидно-солевого плава. Никелевая фольга, зеркальные поверхности осажденных на керамических пластинках меди и хром-кобальтового сплава, платиновая сетка – материалы, использованные для изготовления электродов, не подвергались никакой механической обработке, а только обезжиривались и промывались дистиллированной водой. Во всех случаях катод и анод, сделанные из одного и того же материала, имели одинаковую форму и размер, а после опытов отмытые от соли и высушенные электроды были первоначально исследованы методом комбинационного рассеяния света на присутствие в поверхностном слое продуктов электрофоретического осаждения. Последние были обнаружены только на поверхности катодов, что свидетельствовало о преимущественном сольватировании взвешенных в электролите наноразмерных оксидных частиц его катионами. Интересно, что подобные примеры сольватации наночастиц заряженными кластерами ионных жидкостей приведены в работе [47].
Схематически процесс электрофоретического формирования пленок LiCoO2 на поверхности катода представлен на рис 4.
Ниже рассмотрены результаты исследования осадков LiCoO2 на поверхностях различных металлических катодов. Все они изучены методами колебательной спектроскопии. Более основательно исследованы ультратонкие пленки LiCoO2 на никелевой фольге, поскольку такие оксидно-металлические системы представляют интерес для создания сверхъемких конденсаторов [48] и катодных слоев миниатюрных твердотельных литиевых аккумуляторов [15, 20]. Для их диагностики дополнительно использованы методы НПВО, РФЭС и эллипсометрии.
КРС- и ИК-спектроскопия. При анализе спектров КРС и НПВО ультратонкой (235 нм) пленки LiCoO2, нанесенной на никелевую фольгу (рис. 5), наблюдался небольшой сдвиг характеристических колебательных частот, свойственных исходному порошку (рис. 2). В ИК-спектре обнаружены новые слабо выраженные полосы (405.0, 453.2 и 532.2 см–1), очевидно связанные с особенностями формирования слоя наноразмерных частиц LiCoO2 на поверхности никеля.
Рис. 5.
Колебательные спектры КРС (а) и НПВО (б) электрофоретических осадков LiCoO2 на никелевой подложке, нанесенных из устойчивых суспензий исходного порошка в водных растворах хлорида лития.

Аналогичное явление наблюдалось в колебательных спектрах оксидных покрытий на других металлических поверхностях. На рис. 6 и 7 показаны спектры КРС электрофоретических осадков наноразмерных частиц LiCoO2 на гладких (зеркальных) поверхностях меди и хром-кобальтового сплава, а также поверхности платиновой сетки.
Рис. 6.
Спектры КРС электрофоретических осадков LiCoO2 на гладких поверхностях меди (а) и хром-кобальтового сплава (б), нанесенных из устойчивых суспензий исходного порошка в водных растворах хлорида лития.

Рис. 7.
Спектр КРС электрофоретического осадка LiCoO2 на платиновой сетке, нанесенного из устойчивой суспензии исходного порошка в водном растворе хлорида лития.

В дополнение к активным модам Eg и A1g, наблюдаемым в спектре КРС нанопорошка кобальтата лития (485.2 и 595.1 см–1), которым в осадках на металлических подложках соответствуют пики при 498.4 и 593.4 см–1 (Ni), 476.1 и 587.7 см–1 (Cu), 476.3 и 599.0 см–1 (Cr–Co сплав) и 495.2 см–1 и 595.0 (Pt), были обнаружены новые полосы, вероятно связанные с оксидными соединениями электродных материалов [49–52]. Полосы валентных колебаний связи Co–O около 680 см–1 [53] присущи колебательным спектрам пленок, образованных на поверхности всех изученных металлов.
Рентгеновская фотоэлектронная спектроскопия. Спектры РФЭС наноразмерной пленки LiCoO2 толщиной 235 нм, нанесенной на никелевую фольгу, регистрировали, используя источник возбуждающего излучения MgKα (hν = 1253.6 эВ) мощностью 170 Вт. Энергоанализатор был откалиброван по стандартным образцам Au, Ag и Cu. С целью учета смещения фотоэлектронных пиков диэлектрических образцов в сторону более высоких энергий связи. В ходе экспериментов проводилась коррекция спектров по линии углерода C 1s (285.0 эВ). Погрешность определения энергии связи не превышала 0.1 эВ.
Спектр Co 2p кобальтата лития, показанный на рис. 8, описывает состояние Co3+ в окружении октаэдрического иона кислорода. Положение и специфическая форма основных пиков фотоэмиссии 2p3/2 и 2p1/2, а также малая интенсивность сателлитных пиков по отношению к интенсивности основных – все это свидетельствует о высокой стабильности диамагнитного иона Co3+ (табл. 1). Энергии электронов уровней O 1s и Li 1s, полученные из рентгеновских фотоэлектронных спектров, также приведены в этой таблице.
Рис. 8.
Pентгеновский фотоэлектронный спектр Co 2p наноразмерных частиц LiCoO2, осажденных на никелевой фольге электрофорезом.

Таблица 1.
Характеристические энергии связи (эВ) в LiCoO2 (обзорный спектр РФЭС)
| Li 1s | O 1s | Co 2p3/2 основная/сателлит |
Co 2p1/2 основная/сателлит |
|---|---|---|---|
| 56.8 | 529.7 | 782.4/788.1 | 797.7/803.2 |
Анализ рентгеновского фотоэлектронного спектра пленки LiCoO2 подтвердил зарядовое равновесие между ионами O2−, Co3+ и Li+ в кристаллической решетке LiCoO2.
Эллипсометрия. Пленки LiCoO2, нанесенные на никелевую фольгу, исследовали на эллипсометре с гелий-неоновым лазером (длина волны λ = 632.8 нм), удерживая фиксированный угол падения светового луча на образец (θ = 55°). Измеряемые поляризационные параметры зависят от толщины (d) многослойной отражающей поверхности [54]. Сложная отражающая система, схематически показанная на рис. 9, состоит из внутренней подложки Ni, промежуточного слоя NiO и внешнего покрытия LiCoO2, полученного электрофорезом в водном растворе хлорида лития.
При компьютерном решении основного уравнения эллипсометрии для этого случая по справочным данным по показателям преломления (n) и коэффициентам поглощения (k) Ni и NiO были определены параметры (n и d) верхней пленки LiCoO2. Из расчета следует, что показатель преломления LiCoO2 равен 1.55. В большинстве экспериментов толщина промежуточного слоя NiO была близка к 4 нм, а толщина осадка LiCoO2 изменялась от 100 до 250 нм в зависимости от продолжительности электрофореза. Теоретическое значение показателя преломления LiCoO2 (ntheor), рассчитанное с использованием молярных рефракций Li2O, CoO и Co3O4, равно 1.613. Из экспериментального и теоретического значений показателей преломления (nex и ntheor) легко оценить пористость (1 – q) полученной пленки LiCoO2, используя уравнение
Расчеты показали, что в рассмотренном случае пористость пленки (1 – q) = 8%. Видимо поэтому, из-за малой толщины осадка LiCoO2 в наблюдаемых КРС- и ИК-спектрах заметно проявляются колебательные полосы, присущие соединениям материалов подложек.
Сканирующая электронная микроскопия. Морфологию частиц, осажденных на металлические поверхности, изучали с помощью сканирующего электронного микроскопа на примере пленок LiCoO2, сформированных на никелевой и медной подложках. Различное исходное состояние поверхности холоднокатанной никелевой фольги и гладкой (зеркальной) поверхности меди, полученной ее плазменным напылением на керамическую пластинку, оказало заметное влияние на свойства электрофоретических покрытий LiCoO2. Подобную зависимость морфологии электродных пленок литий-ионных аккумуляторов от природы металлических подложек наблюдали недавно немецкие исследователи [25]. На рис. 10, где представлены СЭМ-фотографии осадков, видно, что пленка LiCoO2, нанесенная на никелевую подложку в водном растворе хлорида лития при комнатной температуре, полностью однородна и состоит из расположенных хаотично игольчатых частиц диаметром 20–50 нм и длиной более 1 мкм, в то время как покрытие, образованное на зеркальной поверхности меди, представляет собой рыхлый осадок, состоящий в основном из ультрамелких кристаллов разного размера с нечеткими границами зерен. Средний размер глобул составляет около 250 нм. Приведенные фотографии пленки кобальтата лития на никелевой фольге подтверждают вывод о ее малой пористости, сделанный по результатам эллипсометрических исследований.
Электрофоретическое осаждение наночастиц LiCoO2 на электропроводную керамику в солевом расплаве
В суспензиях наноразмерных частиц LiCoO2, образованных в хлоридном расплаве LiCl–CoCl2, их сольватация ионами должна проявляться в большей степени, чем в водных электролитах, из-за отсутствия гидратных оболочек. Это указывает на возможность с большой эффективностью проводить осаждение наноразмерных частиц функциональных оксидных материалов – изоляторов (в нашем случае LiCoO2) на электронопроводящие керамики непосредственно в расплавленной солевой реакционной среде, в которой взвешены частицы продукта реакции. Результаты исследования электрофоретического осаждения наночастиц LiCoO2 на электропроводную керамику La0.6Sr0.4MnO3 показали, что так же, как и в водных электролитах, из-за преимущественной сольватации наночастиц кобальтата лития катионами солевого расплава они выделялись на отрицательно заряженном электроде.
На рис. 11 показано изменение во времени межэлектродного электросопротивления для конкретного случая электрофоретического осаждения кобальтата лития после его 11-часового синтеза в расплаве 0.80LiCl–0.20CoCl2 при 720°С. Видно, что выделение LiCoO2, накопленного в расплаве, завершилось приблизительно через 4 ч. В водном растворе электролита из-за его более низкой по сравнению с солевым расплавом электропроводности и более слабым сольватирующим эффектом ионов водного электролита, окруженных молекулами H2O, на осаждение такого же количества взвешенных в электролите наноразмерных частиц кобальтата лития было затрачено времени почти на 2 ч больше.
Рис. 11.
Зависимость межэлектродного сопротивления от времени электрофоретического осаждении LiCoO2 на электропроводную оксидную подложку в солевом расплаве.

Спектры комбинационного рассеяния света полученного осадка (рис. 12) указывают на появление полос, свойственных оксидам кобальта (516.4 и 665.9 см–1), который в условиях проведения электрофореза (барботаже воздуха) осаждается в небольшом количестве вместе с кобальтатом лития. Спектр был аналогичен найденным при электрофоретическом осаждении наноразмерных частиц кобальтата лития из их взвесей в водном растворе LiCl–CoCl2 на металлических поверхностях при комнатной температуре (рис. 5–7).
Рис. 12.
Спектры КРС поверхности исходной электропроводной оксидной керамики La0.6Sr0.4MnO3 (а) и осадка LiCoO2 (б), полученного методом электрофореза в расплаве LiCl–CoCl2 при 700°С.

Входящие в состав электропроводной оксидной подложки оксиды марганца провоцируют образование на ее поверхности сложных соединений LiMnxCoyO2 [1] со структурой шпинели $\left[ {Fd\bar {3}m} \right],$ что подтверждается данными сканирующей электронной микроскопии и энергодисперсионного анализа, показанными на рис. 13 и в табл. 2. Видно, что в отличие от металлических электродов из-за пористости (15%) электропроводной оксидной подложки и неоднородности ее поверхности не удалось получить в указанных экспериментальных условиях сплошного электрофоретического покрытия кобальтата лития (темные частицы), элементный состав которого соответствует данным в точках 1, 2, 3. Светлые “пятна” на микрофотографии поверхности относятся к участкам оксидного электрода, не покрытым осадком кобальтата лития.
Рис. 13.
Микрофотография СЭМ поверхности оксидного электрода (La0.6Sr0.4MnO3) после электрофоретического осаждения кобальтата лития в расплаве LiCl–CoCl2 при 700°С.

Таблица 2.
Элементный состав поверхностного слоя оксидного электрода (La0.6Sr0.4MnO3) с осадком кобальтата лития (в атомных %) согласно энергодисперсионому анализу
| Элемент | O | Mg | Si | Cl | Mn | Fe | Co | Sr | La |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 46.70 | 0.51 | 0.00 | 0.00 | 15.62 | 0.48 | 36.41 | 0.00 | 0.27 |
| 2 | 56.39 | 0.86 | 0.00 | 0.00 | 11.64 | 0.00 | 30.78 | 0.00 | 0.32 |
| 3 | 53.46 | 0.67 | 0.00 | 0.00 | 11.29 | 0.46 | 33.80 | 0.00 | 0.33 |
ЗАКЛЮЧЕНИЕ
Результаты выполненных исследований продемонстрировали возможность осаждения кобальтата лития на электропроводящие материалы в водных и расплавленных солевых электролитах методом электрофореза. Она реализована благодаря сольватации синтезированных в расплавленных солях оксидных наночастиц LiCoO2 либо ионами самой реакционной среды, либо ионами водных растворов солей. Выявлено, что ионная сольватная оболочка наноразмерных частиц в обоих случаях заряжена положительно. Это обеспечивало электрофоретическое осаждение LiCoO2 на поверхности отрицательно заряженных металлов (никеля, меди, хром-кобальтового сплава, платины) и электронопроводящей оксидной керамики (La0.6Sr0.4MnO3). Описанный в статье и реализованный в лабораторном масштабе простой способ осаждения наноразмерных частиц кобальтата лития на подложках из разных материалов может быть использован для электрофоретического формирования ультратонких пленок других функциональных материалов.
Список литературы
Махонина, Е.В., Первов, В.С., Дубасова, В.С. Оксидные материалы положительного электрода литий-ионных аккумуляторов. Успехи химии. 2004. Т. 73. С. 1075. [Makhonina, E.V., Pervov, V.S., and Dubasova, V.S., Oxide materials as positive electrodes of lithium-ion batteries, Russ. Chem. Rev., 2004, vol. 73, p. 991.]
Bensalah, N. and Dawood, H., Review on Synthesis, Characterizations, and Electrochemical Properties of Cathode Materials for Lithium-Ion Batteries, J. Material Sci. Eng., 2016, vol. 5, p. 258.
Pang, H., Cao, X., Zhu, L., and Zheng, M., Synthesis of Functional Nanomaterials for Electrochemical Energy Storage, Singapore: Springer Nature Singapore Pte Ltd., 2020. 222 p.
Lithium-ion Batteries – Thin Film for Energy Materials and Devices, Eds. Mitsunobu Sato, Li Lu, and Hiroki Nagai, London: InTechOpen Limited, 2020. 132 p.
Wu, J., Yang, S., Cai, W., Bi, Z., Syang, G., and Yao, J., Multi-characterization of LiCoO2 cathode films using advanced AFM-based techniques with high resolution, Scientific Reports, 2017, vol. 7, 11164.
Ohta, N., Takada, K., Sakaguchi, I., Zhang, L., Ma, R., Fukuda, K., Osada, M., and Sasaki, T., LiNbO3-coated LiCoO2 as cathode material for all solid-state lithium secondary batteries, Electrochem. Comm., 2007, vol. 9, p. 1486.
Yu, H., Holtz, M.E., Gong, Y., Pearson, J., Ren, Y., Herzing, A.A., Zhang, X., and Takeuchi, I., Nonvolatile multilevel switching in artificial synaptic transistors based on epitaxial LiCoO2 thin films, Phys. Rev. Materials, 2021, vol. 5, 115401.
Kawashima, K., Ohnishi, T., and Takada, K., High-Rate Capability of LiCoO2 Cathodes, ACS Appl. Energy Mater., 2020, vol. 3, no. 12, p. 11803.
Orikasa, Y., Takamatsu, D., Yamamoto, K., Koyama, Y., Mori, S., Masese, T., Mori, T., Minato, T., Tanida, H., Uruga, T., Ogumi, Z., and Uchimoto, Y., Origin of the Surface Coating Effect of MgO on LiCoO2 to Improve the Interfacial Reaction between Electrode and Electrolyte, Adv. Mat. Interfaces, 2014, vol. 1, no. 9, 00195.
Inamoto, J., Fukutsuka, T., Miyazaki, K., and Abe, T., Insight into the state of the ZrO2 coating on a LiCoO2 thin-film electrode using the ferrocene redox reaction, J. Appl. Electrochem., 2017, vol. 47, no. 11, p. 1.
Oh, Y., Ahn, D., Nam, S., and Park, B., The effect of Al2O3-coating coverage on the electrochemical properties in LiCoO2 thin films, J. Solid State Electrochem., 2009, vol. 14, no. 7, p. 1235.
Yan, B., Liu, J., Song, B., Xiao, P., and Lu, L., Li-rich Thin Film Cathode Prepared by Pulsed Laser Deposition, Scientific Reports, 2013, vol. 3, 3332.
Ohnishi, T., Hang, B.T., Xu, X., Osada, M., and Takada, K., Quality control of epitaxial LiCoO2 thin films grown by pulsed laser deposition, J. Mater. Res., 2010, vol. 25, no. 10, p. 1886.
Iriyama, Y., Inaba, M., Abe, T., and Ogumi Z., Preparation of c-axis oriented thin films of LiCoO2 by pulsed laser deposition and their electrochemical properties, J. Power Sources, 2001, vol. 94, p. 175.
Kosuri, Y.R., Penki, T.R., Nookala, M., Morgen, P., and Gowravaram, M.R., Investigations on Sputter Deposited LiCoO2 Thin Films from Powder Target, Adv. Mat. Lett., 2013, vol. 4, no. 8, p. 615.
Yoon, M., Lee, S., Lee, D., Kim, J., and Moon, J., All-solid-state thin film battery based on well-aligned slanted LiCoO2 nanowires fabricated by glancing angle deposition, Appl. Surf. Sci., 2017, vol. 412, p. 537.
Julien, C.M., Mauger, A., and Hussain, O.M., Sputtered LiCoO2 Cathode Materials for All-Solid-State Thin-Film Lithium Microbatteries, Materials, 2019, vol. 12, no. 17, 2687.
Chen, C., Kelder, E.M., van der Put, P.J.J.M., and Schoonman, J., Morphology control of thin LiCoO2 films fabricated using the electrostatic spray deposition (ESD) technique, J. Mater. Chem., 1996, vol. 6, p. 765.
Taniguchi, I. and Nishino, T., Surface Morphology and Electrochemical Properties of LiCoO2 Thin Films Synthesized by Electrostatic Spray Deposition Method, Kagaku Kogaku Ronbunshu, 2003, vol. 29, no. 2, p. 226.
Donders, M.E., ArnoldBik, W.M., Knoops, H.C.M., Kessels, W.M.M., and Notten, P.H.L., Atomic layer deposition of LiCoO2 thin film electrodes for all-solid-state Li-ion micro-batteries. J. Electrochem. Soc., 2013, vol. 160, no. 5, p. A3066.
Yuji, H.Y. and Goto, T., Orientation and Morphology of LiCoO2 Prepared by Chemical Vapor Deposition on Al2O3 Single Crystal, Key Eng. Mater., 2012, vol. 508, p. 300.
Maruyama, S., Kubokawa, O., Nanbu, K., Fujimoto, K., and Matsumoto, Y., Combinatorial Synthesis of Epitaxial LiCoO2 Thin Films on SrTiO3(001) via On-Substrate Sintering of Li2CO3 and CoO by Pulsed Laser Deposition, ACS Comb. Sci., 2016, vol. 18, no. 6, p. 343.
Goto, A., Hamagami, J.I., Kanamura, K., and Umegaki, T., Electrophoretic Deposition (EPD), LiCoO2, Lithium-Ion Battery, Key Eng. Mater., 2000, vols. 181–182, p. 159.
Kanamura, K., Goto, A., Rho, Y.H., and Umegaki, T., Electrophoretic fabrication of LiCoO2 positive electrodes for rechargeable lithium batteries, J. Power Sources, 2001, vol. 97, p. 294.
Esper, J.D., Helmer, A., Wu, Y., Bachmann, J., and Klupp Taylor, R.N., Electrophoretic Deposition of Out-of-Plane Oriented Active Material for Lithium-Ion Batteries, Energy Technol., 2021, vol. 9, no. 4, 2000936.
Miyazaki, H., Mimaru, Y., Makinose, Y., Tsuji, T., Yamada, H., and Mutai, T., Improvement of the Cycle Property of Binder-Free LiCoO2 Positive Electrode Film Deposited via the Pulsed Electrophoretic Deposition, Mater. Trans., 2019, vol. 60, no. 12, p. 2576.
Caballero, A., Herna’n, L., Melero, M., Morales, J., Moreno, R., and Ferrari B., LiNi0.5Mn1.5O4 thick-film electrodes prepared by electrophoretic deposition for use in high voltage lithium-ion batteries, J. Power Sources, 2006, vol. 158, p. 583.
Sarkar, P. and Nicholson, P.S., Electrophoretic Deposition (EPD): Mechanisms, Kinetics, and Application to Ceramics, J. Amer. Ceram. Soc., 1996, vol. 79, no. 8, p. 1987.
Van der Biest, O. and Vandeperre, L., Electrophoretic Deposition of Materials, Ann. Rev. Mater. Sci., 1999, vol. 29, p. 327.
Besra, L. and Liu, M., A review on fundamentals and applications of electrophoretic deposition (EPD), Prog. Mater. Sci., 2007, vol. 52, p. 1.
Corni, I., Ryan, M.P., and Boccaccin, A.R., Electrophoretic deposition: From traditional ceramics to nanotechnology, J. Eur. Ceram. Soc., 2008, vol. 28, p. 1353.
Hong, Y.S., Han, C.H., and Kim, K., Preparation of polycrystalline HT-LiCoO2 using molten salt synthesis method at 280°C, Chem. Lett., 2000, vol. 29, no. 12, p. 1384.
Liang, H., Qiu, X., Zhang, S., He, Z., Zhu, W., and Chen, L., High performance lithium cobalt oxides prepared in molten KCl for rechargeable lithium-ion batteries, Electrochem. Commun., 2004, vol. 6, no. 5, p. 505.
Liang, H., Qiu, X., Chen, H., He, Z., Zhu, W., and Chen, L., Analysis of high rate performance of nanoparticled lithium cobalt oxides prepared in molten KNO3 for rechargeable lithium-ion batteries, Electrochem. Commun. 2004, vol. 6, p. 789.
Tan, K.S., Reddy, M.V., Subba Rao, G.V., and Chowdari, B.V.R., High-performance LiCoO2 by molten salt (LiNO3:LiCl) synthesis for Li-ion batteries, J. Power Sources, 2005, vol. 147, nos. 1–2, p. 241.
Fu, J., Bai, Y., Liu, C., Yu, H., and Mo, Y., Physical characteristic study of LiCoO2 prepared by molten salt synthesis method in 550–800°C, Mater. Chem. Phys., 2009, vol. 115, no. 1, p. 105.
Kim, J.H., Myung, S.T., and Sun, Y.K., Molten salt synthesis of LiNi0.5Mn1.5O4 spinel for 5 V class cathode material of Li-ion secondary battery, Electrochim. Acta, 2004, vol. 49, no. 2, p. 219.
Kumagai, N., Oshitari, S., Komaba, S., and Kadoma, Y., Synthesis of hollandite-type LiyMn1 –xCoxO2 (x = 0–0.15) by Li+ ion-exchange in molten salt and the electrochemical property for rechargeable lithium battery electrodes, J. Power Sources, 2007, vol. 174, no 2, p. 932.
Han, C.-H., Hong, Y.-S., Park, C.M., and Kim, K., Synthesis and electrochemical properties of lithium cobalt oxides prepared by molten-salt synthesis using the eutectic mixture of LiCl–Li2CO3, J. Power Sources, 2001, vol. 192, p. 95.
Han, C.-H., Hong, Y.-S., Kang, E.-J., Shin, J.-S., and Kim, K., Synthesis and Electrochemical Properties of HT-LiCo0.8Ni0.2O2 Prepared by Molten Salt Synthesis Method using 0.59LiNO3–0.41LiOH System, Korean J. Chem. Eng., 2001, vol. 18, no. 5, p. 765.
Khokhlov, V., Modenov, D., Dokutovich, V., Kochedykov, V., Zakir’yanova, I., Vovkotrub, E., and Beketov, I., Lithium oxide solution in chloride melts as a medium to prepare LiCoO2 nanoparticles, MRS Commun., 2014, vol. 4, p. 15.
Hara, K., Yano, T., Suzuki, K., Hirayama, M., Haya-shi, T., Kanno, R., and Hara, M., Raman Imaging Analysis of Local Crystal Structures in LiCoO2 Thin Films Calcined at Different Temperatures, Anal. Sci., 2017, vol. 33, p. 853.
Freitas, B.G.A., Siqueira, Jr. J.M., da Costa, L.M., Ferreira, G.B., and Resende, J.A.L.C., Synthesis and Characterization of LiCoO2 from Different Precursors by Sol–Gel Method, J. Brazil. Chem. Soc., 2017, vol. 28, no. 11, p. 2254.
Julien, C., Local cationic environment in lithium nickel–cobalt oxides used as cathode materials for lithium batteries, Solid State Ionics, 2000, vol. 136–137, p. 887.
Rao, M.C. and Hussain, O.M., Spectroscopic investigations on tetravalent doped LiCoO2 thin film cathodes, Eur. Phys. J.- Appl. Phys., 2009, vol. 48, 20503.
Yang, W.-D., Hsieh, C.-Y., Chuang, H.-Jan., and Chen, Y.-S., Preparation and characterization of nanometric-sized LiCoO2 cathode materials for lithium batteries by a novel sol–gel method, Ceram. Int., 2010, vol. 36, p. 135.
He, Z. and Alexandridis, P., Nanoparticles in ionic liquids: interactions and organization, Phys. Chem. Chem. Phys., 2015, vol. 17, 18238.
Xu, Y., Ding, L., Zhong, T., Han, X., Jiao, L., Yuan, H., and Wang, Y., Novel application of LiCoO2 as a high-performance candidate material for supercapacitor, J. Energy Chem., 2015, vol. 24, p. 193.
Mironova-Ulmane, N., Kuzmin, A., Sildos, I., Puust, L., and Grabis, J., Magnon and Phonon Excitations in Nanosized NiO, Latvian J. Phys. Tech. Sci., 2019, vol. 56, no. 2, p. 61.
Debbichi, L., Marco de Lucas, M.C., Pierson, J.F., and Krüger, P., Vibrational Properties of CuO and Cu4O3 from First-Principles Calculations, and Raman and Infrared Spectroscopy, J. Phys. Chem. C, 2012, vol. 116, p. 10232
Zoolfakar, A.S., Rani, R.A., Morfa, A.J., O’Mullane, A.P., and Kalantar-Zadeh, K., Nanostructured copper oxide semiconductors: A perspective on materials, synthesis methods and applications, J. Mat. Chem. C, 2014, vol. 2, p. 27.
Graham, G.W., Weber, W.H., McBride, J.R., and Peters, C.R., Raman Investigation of Simple and Complex Oxides of Platinum, J. Raman Spectrosc., 1991, vol. 22, p. 1
Hadjiev, V.G., Iliev, M.N., and Vergilov, I.V., The Raman spectra of Co3O4, J. Phys. C: Solid State, 1988, vol. 21, p. L199.
Azzam, R.M.A. and Bashara, N.M., Ellipsometry and Polarized Light, Amsterdam; N.Y.: North-Holland, 1987. 539 p.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия





