Электрохимия, 2023, T. 59, № 2, стр. 92-100
Сравнительное изучение биокаталитического окисления некоторых органических субстратов с помощью микроорганизмов Shewanella xiamenensis и Escherichia coli на медиаторных и безмедиаторных биоанодах
И. А. Казаринов a, *, М. О. Мещерякова a
a ФГБОУ ВО “Саратовский национальный исследовательский государственный университет
им. Н.Г. Чернышевского”
410012 Саратов, ул. Астраханская, 83, Россия
* E-mail: kazarinovia@mail.ru
Поступила в редакцию 28.01.2022
После доработки 11.07.2022
Принята к публикации 22.07.2022
- EDN: NEKTJN
- DOI: 10.31857/S0424857023020044
Аннотация
В работе проведена сравнительная оценка эффективности микроорганизмов Shewanella xiamenensis и Escherichia coli, используемых в качестве биокатализатора в процессе биоэлектрохимического окисления различных субстратов в нейтральных средах на безмедиаторном и медиаторном биоанодах. Показано, что скорость биоэлектрохимического окисления исследуемых органических субстратов (лимонная кислота, глюкоза, сахароза) с помощью клеток S. xiamenensis не зависит от концентрации введенного в систему медиатора (метиленового синего) – перенос электронов от клеток на электрод осуществляется в результате прямого контакта клеток с поверхностью электрода. Сравнительный кинетический анализ показал, что клетки S. xiamenensis являются менее эффективным биологическим катализатором процесса окисления глюкозы по сравнению с микроорганизмом E. coli (в присутствии медиатора). Определены кинетические характеристики реакции окисления глюкозы в системе “медиатор–субстрат–клетки E. coli”. Установлено, что порядок реакции окисления по глюкозе на аноде равен единице, величина константы скорости этой реакции составляет 0.0214 мин–1, время полупревращения глюкозы – 33 мин. Показано, что исследуемая модельная система позволяет понизить концентрацию глюкозы в рабочем растворе до значения фонового тока, что свидетельствует о почти полной очистке раствора от органического субстрата. Показано, что при решении практических задач для повышения эффективности очистки стоков от органических веществ с помощью безмедиаторных биоанодов необходимо вести поиск новых клеток, в том числе и других клеток рода Shewanella, с обязательной иммобилизацией клеток на поверхности электрода с целью повышения электрического контакта.
ВВЕДЕНИЕ
Сокращение зависимости от ископаемого топлива и снижение загрязнений окружающей среды – это основные тенденции, заставляющие человечество искать новые источники энергии. Обработка сточных вод – область, в которой две эти цели могут быть совмещены.
Проблема очистки сточных вод, начиная со второй половины 20-го века, является актуальной для всех стран мира. В США на обработку богатых органикой сточных вод затрачивается около 15 гВт мощности электроэнергии (3% всей электроэнергии, производимой в стране), сами же сточные воды содержат 17 гВт мощности электроэнергии [1]. Поэтому промышленные сточные воды, например от отраслей пищевой промышленности и пивоваренных заводов, сахарных производств, сельскохозяйственные сточные воды от животноводческих ферм, сточные воды целлюлозно-бумажных отраслей производства являются идеальным сырьем для биообработки, так как они содержат высокие уровни легко деградируемого органического материала, что приводит к экономической выгоде даже когда требуется подогрев жидкости.
Кроме того, они уже имеют высокое содержание воды, что исключает необходимость ее добавления. Такие сточные воды – потенциальные объекты переработки, из которых можно получать биоэнергию и биохимикаты. Получение энергии и ценных продуктов могло бы частично скомпенсировать стоимость обработки сточных вод и несколько уменьшить нашу зависимость от ископаемого топлива.
Есть несколько биологических стратегий обработки промышленных и сельскохозяйственных сточных вод [2]:
1. Очистка сточных вод с помощью микробных топливных элементов (МТЭ).
2. Метаногенное анаэробное ферментативное расщепление органических веществ в сточных водах.
3. Ферментативное производство водорода из сточных вод.
4. Биологическое химическое производство.
Три из этих стратегий приводят к выработке биоэнергии (электричество, метан, водород), а четвертая – к ферментативному получению биохимикатов. Однако для внедрения каждой из этих технологий существуют научно-технические проблемы, важнейшей из которых является подбор соответствующих микробиологических систем.
Микробные топливные элементы представляют собой устройства, которые используют определенного типа микроорганизмы в качестве катализаторов для генерации электричества [3–5]. Одним из важнейших достоинств биотопливных элементов является то, что они представляют собой экологически чистые источники электрической энергии. Они работают в нормальных условиях – при температуре и давлении окружающей среды.
Такие технологии, использующие микробные топливные элементы для конвертирования энергии, запасенной в химических связях органических соединений, вызывают в последнее время огромный интерес [6]. Поэтому целью данной работы является сравнительная оценка эффективности микроорганизмов E. coli и S. xiamenensis, используемых в качестве биокатализатора в процессе биоэлектрохимического окисления различных субстратов в нейтральных средах в присутствии медиатора или без медиатора соответственно.
МЕТОДИКА ЭКСПЕРИМЕНТА
Микроорганизмы
Клетки E. coli штамма К-12 и S. xiamenensis IBPPM 628 выращивали на твердой питательной среде LB с последующим пересевом на жидкую питательную среду LB. Состав питательной среды LB (на 1 л воды): пептон – 10 г; дрожжевой экстракт – 5 г; NaCl – 10 г; агар-агар – 30 г. Культивирование E. coli проводили в конической колбе на круговой качалке при температуре 37°С в аэробных условиях, а S. xiamenensis – при 28–30°С. После 16-часового культивирования биомасса трижды отмывалась центрифугированием (5000 об./мин, 5 мин) с последующим ресуспензированием в фосфатном буферном растворе (pH 7.0). В 1 мл такой суспензии содержалось 109 клеток. (Микроорганизмы предоставлены коллекцией ризосферных микроорганизмов ИБФРМ РАН, г. Саратов.)
Реактивы
В качестве рабочего электролита использовали раствор хлорида натрия, приготовленный растворением кристаллической соли в фосфатном буферном растворе (pH 7.0). Рабочий электролит готовили следующим образом: к 0.067 М раствору Na2HPO4·12H2O (23.876 г в 1 л воды) (“ч. д. а.”) приливали 0.067 М раствор KH2PO4 (9.072 г в 1 л воды) (“ч. д. а.”) в соотношении 1 : 2 соответственно. Растворы фосфатов готовили растворением навесок кристаллических солей в бидистиллированной воде. Навеску кристаллической соли NaCl (“х. ч.”) растворяли в буферном растворе из расчета 10 г/л.
В качестве медиатора использовали растворы окислительно-восстановительного индикатора – метиленового синего (“ч. д. а.”).
В качестве субстратов были выбраны растворы лимонной кислоты C6H8O7 (“х. ч.”), глюкозы C6H12O6 (“х. ч.”) и сахарозы C12H22O11 (“х. ч.”), моделирующие отходы пищевой промышленности.
При проведении экспериментов использовали различные концентрации растворов медиатора и субстратов.
Электрохимические измерения
Для проведения электрохимического эксперимента использовали стеклянную герметичную трехэлектродную ячейку, снабженную наружной стеклянной рубашкой для термостатирования. Эксперименты проводили в термостатических условиях при температуре 37°С с применением водяного термостата VT-10. Ячейка была снабжена специальным отверстием со стеклянной трубкой для пропускания через рабочий электролит аргона (марки А) с целью удаления из ячейки кислорода и создания анаэробных условий. Перед опытом ячейку тщательно обрабатывали концентрированной серной кислотой (d = 1.393 г/см3) и промывали бидистиллированной водой.
В качестве электрода сравнения использовали насыщенный хлоридсеребряный электрод сравнения (ЭВЛ-1М1), потенциал которого составлял +0.201 В относительно нормального водородного электрода. Электрод сравнения соединялся с ячейкой через последовательно собранные агар-агаровый мостик, сифон с краном и капилляр Луггина.
Катодное пространство (отсек вспомогательного электрода) отделялось от анодного пространства стеклянной мембраной (фильтром Шотта). Вспомогательный электрод (катод) представляет собой платиновую проволоку в виде спирали.
В стационарных измерениях рабочими электродами являлись цилиндрические углеграфитовые стержни, укрепленные на вертикальных осях, которые одновременно служили токоподводами. Рабочей поверхностью электродов являлся торец электрода. Нерабочие поверхности электродов (боковые поверхности) изолировали. В качестве материалов для изоляции электрода был выбран фторопласт-4 (тефлон). Электрохимические измерения проводили при постоянном перемешивании электролита.
В методе вращающегося дискового электрода использовали электроды, которые представляли собой диски из стеклоуглерода и графита. Диаметры дисков составляли 3 мм (S = 0.071 см2) и 7 мм (S = 0.39 cм2) соответственно.
Непосредственно перед экспериментом проводили обработку поверхностей электродов, которая выражалась в зачистке их наждачной бумагой разной зернистости и промывании горячей концентрированной серной кислотой и бидистиллированной водой. Целью такой обработки являлось удаление с поверхности загрязнений (в том числе и биомассы), оставшихся на ней после предыдущего эксперимента.
Изучение поляризационных характеристик проводили в электрохимической ячейке с помощью потенциостата IPC-2000, интегрированного с персональным компьютером. Обработку полученных результатов проводили с помощью программы Microsoft Excel.
Собранную ячейку с якорем (состоящим из магнитного сердечника, защищенного полимерной оболочкой) помещали на магнитную мешалку и заполняли электролитом. Платиновую спираль (вспомогательный электрод) погружали в электролит. Затем отсек рабочего электрода герметизировали и деаэрировали аргоном. Термостатирование ячейки осуществлялось в течение всего эксперимента.
После создания в отсеке рабочего электрода нужных физиологических условий: отсутствие кислорода, температура 37°С, постоянное перемешивание – в этот отсек с помощью шприца вводили растворы медиатора, субстрата и бактериальную суспензию.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Биоэлектрокаталитическое окисление органических субстратов с помощью бактериальных клеток S. xiamenensis
Некоторые виды микроорганизмов в МТЭ способны прямо передавать электроны на анод. К ним можно отнести металловосстанавливающие бактерии, такие как Geobacter sulfurredusens [7, 8], Rhodoferax ferrireducens [9] и Shewanella putrefaciens [10–14], которые найдены в донных осадках, где они используют нерастворимые электронные акцепторы, например оксид железа(III) или оксид марганца(IV). Прямой перенос электронов осуществляется благодаря наличию в их наружной мембране цитохромов или благодаря способности развивать электронно-проводящие молекулярные пили (нанопровода).
S. xiamenensis – грамотрицательная, подвижная палочковидная бактерия, которая была впервые выделена из прибрежного осадка, собранного в Китае. Ее свойства сравнительно мало изучены, поэтому цель нашей работы была определить, в каких системах она работает лучше: в медиаторных или безмедиаторных микробных топливных элементах.
На рис. 1 приведены циклические вольт-амперные кривые, снятые на стационарном углеграфитовом электроде в рабочем электролите (pH 7.0), содержащем 1 × 10–2 М сахарозы, 2 мл клеток S. xiamenensis с добавлением (3, 4) и без добавления медиатора (2) метиленового синего.
Рис. 1.
Циклические вольт-амперные кривые, снятые на стационарном углеграфитовом электроде в рабочем электролите (pH 7.0), содержащем 1 × 10–2 М сахарозы; 1 – фоновый раствор; 2 – с добавлением 2 мл клеток S. xiamenensis; 3 – с добавлением 2 мл клеток S. xiamenensis и 7.5 × 10–4 М медиатора метиленового синего; 4 – с добавлением 2 мл клеток S. xiamenensis и 1.0 × 10–3 М медиатора метиленового синего. Скорость развертки потенциала 10 мВ/с.

В табл. 1 приведены значения плотности тока максимума процесса окисления разных субстратов в присутствии клеток S. xiamenensis с добавлением и без добавления медиатора метиленового синего.
Таблица 1.
Значения плотностей токов максимумов процессов окисления различных субстратов в присутствии клеток S. xiamenensis с добавлением 7.5 × 10–4 М метиленового синего и без добавления медиатора
| Субстрат | imax, мА/см2 | |
|---|---|---|
| без медиатора | с медиатором | |
| Лимонная кислота | 2.60 ± 0.10 | 3.02 ± 0.12 |
| Глюкоза | 3.90 ± 0.16 | 3.98 ± 0.16 |
| Сахароза | 4.34 ± 0.17 | 4.45 ± 0.18 |
Из данной таблицы видно, что значения плотностей токов максимумов для различных субстратов с добавлением и без добавления медиатора практически совпадают между собой. Это говорит о том, что введение медиатора метиленового синего в систему “субстрат–клетки S. xiamenensis” практически не влияет на скорость процесса.
Данный вывод подтверждается и потенциостатическими исследованиями на вращающемся дисковом электроде. На рис. 2 и 3 представлены потенциостатические кривые анодного окисления исследуемых субстратов при E = +0.400 В в присутствии клеток S. xiamenensis на вращающемся дисковом электроде при добавлении медиатора метиленового синего и без его добавления.
Рис. 2.
Потенциостатические кривые процесса анодного окисления субстрата на вращающемся углеграфитовом дисковом электроде в рабочем электролите, содержащем 1 × 10–2 М субстрата, 7.5 × 10–4 М раствора метиленового синего и 2 мл клеток S. xiamenensis (ω = 1000 об./мин; Е = +0.400 В). Субстраты: 1 – сахароза, 2 – глюкоза, 3 – лимонная кислота (стрелкой показан момент введения клеток в систему).

Рис. 3.
Потенциостатические кривые процесса анодного окисления субстратов на вращающемся углеграфитовом дисковом электроде в рабочем электролите, содержащем 1 × 10–2 М субстрата и 2 мл клеток S. xiamenensis (ω = 1000 об./мин; Е = +0.400 В). 1 – сахароза, 2 – глюкоза, 3 – лимонная кислота (стрелкой показан момент введения клеток в систему).

Представленные на рисунках потенциостатические кривые имеют одинаковую форму независимо от используемого субстрата. Их особенность состоит в том, что наблюдается резкое ускорение процесса окисления субстрата после введения в систему катализатора (бактериальных клеток).
Результаты интегрирования потенциостатических кривых анодного окисления различных субстратов на вращающемся дисковом электроде в рабочем электролите, содержащем 1 × 10–2 М субстрата и 2 мл клеток S. xiamenensis (рис. 2 и 3), представлены в табл. 2.
Таблица 2.
Количества электричества, полученные при анодном окислении различных субстратов на вращающемся дисковом электроде в рабочем электролите, содержащем 1 × 10–2 М субстрата и 2 мл клеток S. xiamenensis (ω = 1000 об./мин; Е = +0.400 В) с медиатором метиленовым синим (7.5 × 10–4 М) и без медиатора
| Субстрат | Q, мКл/см2 | |
|---|---|---|
| без медиатора | с медиатором | |
| Лимонная кислота | 0.88 ± 0.04 | 1.03 ± 0.04 |
| Глюкоза | 1.88 ± 0.08 | 2.00 ± 0.08 |
| Сахароза | 2.53 ± 0.10 | 2.40 ± 0.10 |
Таким образом, изучение биоэлектрокаталитического окисления разных органических субстратов (лимонной кислоты, глюкозы и сахарозы) с помощью бактериальных клеток S. xiamenensis показало, что скорость биоэлектрохимического окисления исследуемых органических субстратов не зависит от концентрации введенного в систему медиатора (метиленового синего) – перенос электронов от клеток на электрод осуществляется в результате прямого контакта клеток с поверхностью электрода.
Наибольшую электрохимическую активность в исследуемой биоэлектрохимической системе проявляла сахароза. По-видимому, в анаэробных условиях гликолитический распад глюкозы и сахарозы с помощью клеток протекает до молочной кислоты [3], а поскольку атомов углерода в молекуле сахарозы больше, чем в молекуле глюкозы, то и зависимость анодной емкости, получаемой при окислении сахарозы, от ее молярной концентрации в растворе должна быть выше, чем для глюкозы. Эффективность же окисления лимонной кислоты низкая. Это лишний раз показывает, что подбор биоэлектрохимических систем для решения практических задач носит специфический характер.
2. Влияние концентрации глюкозы на ее биоэлектрокаталитическое окисление с помощью клеток E. coli и S. xiamenensis
В связи с тем, что биоэлектрокаталитические свойства клеток E. coli ранее нами широко исследованы на примере глюкозы [15–18], то и сравнение каталитических свойств E. coli и S. xiamenensis проведены на этом же субстрате.
В табл. 3 представлены анодные электрохимические емкости, полученные при биоэлектрохимическом окислении растворов глюкозы различной концентрации на вращающемся дисковом электроде для безмедиаторных (S. xiamenensis) и медиаторных (E. coli) систем. Анализ данных таблицы в координатах Q, lgC представлен на рис. 4.
Таблица 3.
Значения анодных емкостей в зависимости от концентрации глюкозы, полученных при окислении глюкозы на вращающемся дисковом электроде с помощью клеток S. xiamenensis и E. coli – метиленовый синий (7.5 × 10–4 М) (ω = 1000 об./мин; Е = +0.400 В)
| S. xiamenensis | E. coli + медиатор | ||
|---|---|---|---|
| концентрация глюкозы, М | Q, мКл/см2 | концентрация глюкозы, М | Q, мКл/см2 |
| 1 × 10–4 | 2.85 ± 0.11 | 3 × 10–3 | 4.05 ± 0.16 |
| 1 × 10–3 | 3.18 ± 0.13 | 6 × 10–3 | 5.80 ± 0.23 |
| 1 × 10–2 | 3.43 ± 0.14 | 9 × 10–3 | 7.88 ± 0.32 |
| 1 × 10–1 | 3.75 ± 0.15 | 1.2 × 10–2 | 9.90 ± 0.40 |
Рис. 4.
Зависимость количества электричества, полученного при окислении глюкозы на вращающемся дисковом электроде в рабочем электролите (pH 7.0), содержащем 2 мл клеток S. xiamenensis (а) и 2 мл клеток E. coli с метиленовым синим (7.5 × 10–4 М) (б), от логарифма концентрации субстрата (ω = 1000 об./мин; Е = +0.400 В).

Из рисунка следует прямо пропорциональная зависимость полученного количества электричества от логарифма концентрации субстрата, которая может быть аппроксимирована следующим уравнением в случае использования клеток S. xiamenensis:
а при использовании бактериальной суспензии E. coli – уравнением:
Анализ полученных уравнений (1) и (2) показывает, что процесс биоэлектрохимического окисления глюкозы с помощью клеток E. coli на медиаторном аноде протекает значительно эффективнее, чем на безмедиаторном электроде в присутствии клеток S. xiamenensis.
Для решения практических и кинетических задач более важной является зависимость скорости биоэлектрохимической реакции от концентрации субстрата. В табл. 4 приведены значения среднего тока, полученные при биоэлектрохимическом окислении глюкозы с помощью клеток S. xiamenensis и E. coli на вращающемся дисковом электроде в потенциостатических условиях при различной исходной концентрации субстрата.
Таблица 4 .
Значения средних анодных токов в зависимости от концентрации глюкозы, полученные при окислении глюкозы на вращающемся дисковом электроде с помощью клеток S. xiamenensis и E. coli с метиленовым синим (7.5 × 10–4 М) (ω = 1000 об./мин; Е = +0.400В)
| S. xiamenensis | E. coli + медиатор | ||
|---|---|---|---|
| концентрация глюкозы, М | iср, мА/см2 | концентрация глюкозы, М | iср, мА/см2 |
| 1 × 10–4 | 0.024 ± 0.001 | 3 × 10–3 | 0.034 ± 0.001 |
| 1 × 10–3 | 0.027 ± 0.001 | 6 × 10–3 | 0.048 ± 0.002 |
| 1 × 10–2 | 0.029 ± 0.001 | 9 × 10–3 | 0.066 ± 0.003 |
| 1 × 10–1 | 0.031 ± 0.001 | 1.2 × 10–2 | 0.083 ± 0.003 |
Обработка полученных результатов в координатах “средняя плотность тока окисления субстрата (iср)–концентрация субстрата (lg C)” представлена на рис. 5. Из рисунка также следует прямо пропорциональная зависимость полученных значений средних токов биоэлектрохимического окисления глюкозы от концентрации субстрата, которая может быть аппроксимирована уравнением (3) в случае использования клеток S. xiamenensis:
а при использовании бактериальной суспензии E. coli – уравнением (4):Рис. 5.
Зависимость среднего анодного тока, полученного при окислении глюкозы на вращающемся дисковом электроде в рабочем электролите (pH 7.0), содержащем 2 мл клеток S. xiamenensis (а) и 2 мл клеток E. coli с метиленовым синим (7.5 × 10–4 М) (б), от логарифма концентрации субстрата (ω = 1000 об./мин; Е = +0.400 В).
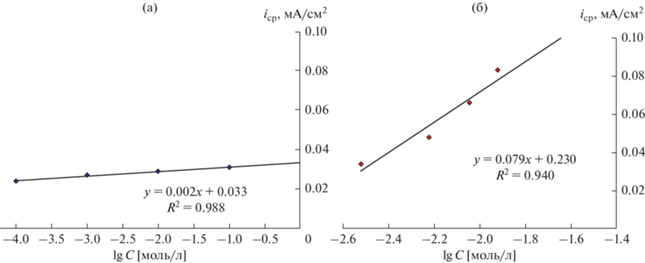
Полученные результаты действительно показали, что средняя скорость процесса биоэлектрохимического окисления глюкозы на медиаторном аноде с помощью клеток E. coli значительно превышает скорость окисления глюкозы на безмедиаторном электроде с помощью клеток S. xiamenensis. Для повышения скорости окисления органических субстратов с помощью безмедиаторных анодов необходима дальнейшая оптимизация биоэлектрохимической системы по концентрации клеток либо нужно вести поиск новых клеток, в том числе и других клеток рода Shewanella.
3. Кинетика утилизации глюкозы с помощью клеток E. coli на медиаторном биоаноде
Анализируя кинетику явлений, протекающих в биологических системах, важно подобрать такую модель процесса, которая отражает основные свойства системы и может допускать аналитическое рассмотрение.
В табл. 5 приведены кинетические данные об изменении концентрации глюкозы в биоэлектрохимической системе “медиатор–глюкоза–клетки E. coli” в процессе очистки рабочего раствора от органического субстрата на стационарном углеграфитовом электроде. Концентрация глюкозы в рабочем растворе определялась методом вращающегося дискового электрода по току максимума вольт-амперной кривой процесса окисления глюкозы.
Таблица 5.
Зависимость концентрации глюкозы от времени процесса очистки раствора от органического субстрата в системе “медиатор–глюкоза–клетки E. coli”, содержащем 7.5 × 10–4 М медиатора и 2 мл бактериальной суспензии на стационарном углеграфитовом электроде при потенциале +0.400 В в условиях интенсивного перемешивания
| Время, с | iср, мкА/см2 | С, М |
|---|---|---|
| 0 | 53.3 | 0.024 |
| 60 | 33.3 | 0.012 |
| 900 | 13.7 | 0.006 |
| 1800 | 9.3 | 0.0045 |
| 2700 | 9.0 | 0.004 |
| 3600 | 6.7 | 0.003 |
| 4500 | 4.3 | 0.002 |
На рис. 6 представлена зависимость скорости реакции анодного окисления глюкозы на стационарном углеграфитовом электроде в рабочем электролите, содержащем клетки E. сoli и 7.5 × 10–4 М медиатора метиленового синего. Видно, что скорость реакции возрастает пропорционально концентрации субстрата, т.е. по субстрату реакция имеет первый порядок.
Рис. 6.
Зависимость скорости процесса анодного окисления глюкозы от ее концентрации в растворе, содержащем 2 мл бактериальной суспензии клеток E. coli и 7.5 × 10–4 М медиатора метиленового синего, на стационарном углеграфитовом электроде в условиях интенсивного перемешивания при Е = +0.400 В.

На рис. 7 представлена зависимость концентрации глюкозы от времени в ходе процесса анодного окисления глюкозы на стационарном углеграфитовом электроде в рабочем электролите, содержащем 1 × 10–2 М глюкозы и 2 мл клеток E. coli и 7.5 × 10–4 М медиатора, при потенциале +0.400 В в условиях интенсивного перемешивания.
Рис. 7.
Зависимость концентрации глюкозы от времени в ходе процесса биоэлектрохимического окисления глюкозы на стационарном углеграфитовом электроде в рабочем электролите, содержащем 1 × 10–2 М глюкозы, 2 мл клеток E. coli и 7.5 × 10–4 М медиатора, при потенциале +0.400 В в условиях интенсивного перемешивания.

Обработка представленной кинетической кривой в соответствии с уравнением для реакции первого порядка в координатах lnC, t (рис. 8) позволила определить значение константы скорости процесса утилизации глюкозы на медиаторном аноде с помощью клеток E. coli. Величина константы скорости составила 0.0214 мин–1.
Рис. 8.
Обработка кинетической кривой процесса анодного окисления глюкозы на стационарном углеграфитовом электроде в рабочем электролите, содержащем 1 × 10–2 М глюкозы, 2 мл клеток E. coli и 7.5 × 10–4 М медиатора, при потенциале +0.400 В в условиях интенсивного перемешивания в координатах lnC, t.
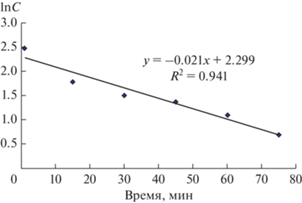
Время полупревращения для реакции первого порядка не зависит от начальной концентрации исходного вещества и обратно пропорционально константе скорости реакции. Зная порядок реакции и константу скорости реакции, мы можем рассчитать время полупревращения по уравнению (5):
(5)
${{t}_{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} = \ln {2 \mathord{\left/ {\vphantom {2 k}} \right. \kern-0em} k}.$В нашем случае время полупревращения глюкозы на медиаторном биоаноде с помощью клеток E. coli составило 33 мин.
Таким образом, проведенные исследования показали, что модельная система “медиатор–глюкоза–клетки E. coli” работоспособна, позволяет понизить концентрацию глюкозы в рабочем растворе до значения фонового тока, что свидетельствует о почти полной очистке раствора от органического субстрата. Однако использование медиаторных систем при решении практических задач для очистки стоков от органических субстратов не рационально, так как в этом случае биоанод работает, как правило, в проточном режиме, что увеличивает расход медиаторов и, следовательно, удорожает технологию. Поэтому для повышения эффективности очистки стоков от органических веществ с помощью безмедиаторных биоанодов стоит вести поиск новых клеток, в том числе и других клеток рода Shewanella, с обязательной иммобилизацией клеток на поверхности электрода с целью повышения электрического контакта.
ЗАКЛЮЧЕНИЕ
1. Изучено биоэлектрокаталитическое окисление разных органических субстратов (глюкозы, лимонной кислоты и сахарозы) с помощью бактериальных клеток S. xiamenensis. Показано, что скорость биоэлектрохимического окисления исследуемых органических субстратов не зависит от концентрации введенного в систему медиатора (метиленового синего) – перенос электронов от клеток на электрод осуществляется в результате прямого контакта клеток с поверхностью электрода. Наибольшую электрохимическую активность исследуемая биоэлектрохимическая система проявляла в присутствии в качестве органического субстрата сахарозы.
2. На примере модельной системы глюкоза–клетки S. xiamenensis показана зависимость скорости процесса и количества отданного электричества от концентрации субстрата – глюкозы. Экспериментально получены уравнения, показывающие зависимость скорости биоэлектрохимического окисления глюкозы в отсутствие медиатора с помощью клеток S. xiamenensis от концентрации субстрата.
3. Сравнительный кинетический анализ показал, что клетки S. xiamenensis являются менее эффективным биологическим катализатором процесса окисления глюкозы по сравнению с микроорганизмом E. coli в присутствии медиатора.
4. Определены кинетические характеристики реакции окисления глюкозы на стационарном углеграфитовом электроде в условиях интенсивного перемешивания, содержащем 7.5 × 10–4 М медиатора и бактериальной суспензии 5 мг вл. веса/клеток E. coli. Установлено, что порядок реакции окисления по глюкозе на биоаноде равен единице, величина константы скорости этой реакции составляет 0.0214 мин–1, время полупревращения глюкозы – 33 мин.
5. При решении практических задач для повышения эффективности очистки стоков от органических веществ необходима оптимизация биоэлектрохимической системы по концентрации бактериальных клеток S. xiamenensis, либо нужно вести поиск новых штаммов, в том числе и других клеток рода Shewanella, с обязательной иммобилизацией клеток на поверхности электрода с целью повышения их электрического контакта с электродом.
Список литературы
Logan, E. and Rabaey, K., Conversion of Wastes into Bioelectricity and Chemicals by Using Microbial Electrochemical Technologies, Science, 2012, vol. 337, p. 686.
Angenent, L.T., Karim, K., Al-Dahhan, M.H., Wrenn, B.A., and Domiguez-Espinosa, R. Production of bioenergy and biochemicals from industrial and agricultural wastewater, TRENDS in Biotechnology, 2004, vol. 22, no. 9, p. 478.
Казаринов, И.А. Введение в биологическую электрохимию. Саратов: Изд-во Сарат. ун-та, 2012. 216 с. [Kazarinov, I.A., Introduction to biological electrochemistry (in Russian), Saratov: Izd-vo Sarat. un-ta, 2011. 216 p.]
Katz, E., Shipway, A.N., and Willner, I., Handbook of fuel cells – Fundamentals, Technology and Application, Vielstich, W., Gasteiger, H.A., and Lamm, A., Eds, London: John Wiley&Sons. Ltd., 2003, vol. 1, p. 2–27.
Shukla, A.K., Suresh, P., Berchmans, S., and Rajendran, A., Biological fuel cells and their applications, Current Science, 2004, vol. 87, no. 4, p. 455.
Davila, D., Esquivel, J., and Vigues, N., Development and Optimization of Microbial Fuel Cells, J. New Mater. Electroch. Systems, 2008, vol. 11, p. 99.
Bulter, J.I., A diheme c-type cytochrome involved in Fe(III) reduction by Geobacter sulfurreducens, J. Bacteriol, 2004, vol. 186, p. 4042.
Methe, B.A., Genome of Geobacter sulfurreducens: metal reduction in subsurface environments, Science, 2003, vol. 302, p. 1967.
Rabaey, K., Microbial ecology meets electrochemistry: electricity driven and driving communities, ISME J., 2007, vol. 1, p. 9.
Lovley, D.R., Microbial energizers: fuel cells that keep on going, Microbe, 2006, vol. 1, p. 323.
Myers, C.R., Localization of cytochromes to the outer membrane of anaerobically grown Shewanella putrefaciens MR-1, J. Bacteriol, 1992, vol. 194, p. 3429.
Myers, C.R., Role of outer membrane cytochromes OmcA and OmcB of Shewanella putrefaciens MR-1 in reduction of manganese dioxide, Appl. Environ. Biotechnol., 2001, vol. 67, p. 260.
Kim, H.J., A mediator-less microbial fuel cell using a metal reducing bacterium Shewanella putrefaciens, Enzyme Microb. Technol., 2002, vol. 30, p. 145.
Kim, B.H., Direct electrode reaction of Fe(III)-reducing bacterium Shewanella putrefaciens, J. Microbiol. Biotechnol., 1999, vol. 9, p. 127.
Градсков, Д.А., Игнатов, В.В., Казаринов, И.А. Биоэлектрохимическое окисление глюкозы с помощью бактерии Escherichia coli. Электрохимия. 2001. Т. 37. С.1397. [Gradskov, D.A., Ignatov, V.V., and Kazarinov, I.A., Bioelectrochemical oxidation of glucose using the bacterium Escherichia coli, Russ. J. Electrochem., 2001, vol. 37, p. 1216.]
Кузьмичева, Е.В., Степанов, А.Н., Казаринов, И.А., Игнатов, О.В. Изучение кинетики окисления глюкозы бактериальными клетками Escherichia coli с помощью метода вращающегося дискового электрода. Электрохим. энергетика. 2007. Т. 7. С. 200. [Kuzmicheva, E.V., Stepanov, A.N., Kazarinov, I.A., and Ignatov, O.V., Study of the kinetics of glucose oxidation by Escherichia coli bacterial cells using the rotating disk electrode method, Elektrokhimicheskaya energetika (in Russian), 2007, vol. 7, p. 200.]
Казаринов, И.А., Кузьмичева, Е.В., Игнатова, А.А. Оценка эффективности работы экзогенных редокс медиаторов в биоэлектрохимической системе глюкоза-клетки Esherichia coli-медиатор. Электрохим. энергетика. 2011. Т. 11. С. 60. [Kazarinov, I.A., Kuzmicheva, E.V., and Ignatova, A.A., Evaluation of the efficiency of exogenous redox mediators in the bioelectrochemical system glucose-cells Escherichia coli-mediator, Elektrokhimicheskaya energetika (in Russian), 2011, vol. 11, p. 60.]
Казаринов, И.А., Игнатова, А.А., Наумова, М.Н. Кинетика электрокаталитического окисления глюкозы клетками бактерий Escherichia coli в присутствии экзогенных медиаторов. Электрохимия. 2014. Т. 50. С. 97. [Kazarinov, I.A., Ignatova, A.A., and Naumova, M.N., Kinetics of the electrocatalytic oxidation of glucose by Escherichia coli bacterial cells in the presence of exogenous mediators, Russ. J. Electrochem., 2014, vol. 50, p. 87.]
Дополнительные материалы отсутствуют.


