Электрохимия, 2023, T. 59, № 3, стр. 158-166
Влияние природы ионов d0 на электрохимическую активность редокс-пары O2–/O– в оксифторидах с разупорядоченной структурой каменной соли
К. В. Мищенко a, О. А. Подгорнова a, Н. В. Косова a, *
a Институт химии твердого тела и механохимии СО РАН
Новосибирск, ул. Кутателадзе, 18, Россия
* E-mail: kosova@solid.nsc.ru
Поступила в редакцию 29.07.2022
После доработки 07.09.2022
Принята к публикации 30.09.2022
- EDN: HWVZRN
- DOI: 10.31857/S0424857023030088
Аннотация
В настоящей работе исследовано влияние природы ионов переходных металлов (электронная конфигурация 3d0 и 4d0) на локальную структуру и электрохимические свойства литий-избыточных оксифторидов с разупорядоченной структурой каменной соли (fluorinated disordered rock-salt – F-DRX) Li1 +x(MеMn3+)1 –xO2 –yFy, где Mе = Ti4+, Nb5+, 0.2 ≤ x ≤ 0.288 и 0.05 ≤ y ≤ 0.15. Проведено всестороннее исследование данных соединений с использованием рентгенофазового анализа, сканирующей электронной микроскопии, гранулометрии, спектроскопии электронного парамагнитного резонанса и гальваностатического циклирования. На кривых циклирования F-DRX наблюдается два плато в области напряжений 3.3–3.4 и 4.1–4.3 В, отнесенные к редокс-процессам с участием двух пар Mn3+/Mn4+ и O2–/O–. Однако в случае Ti-содержащих F-DRX с увеличением содержания фтора вклад пары O2–/O– в ходе электрохимического процесса уменьшается. Для обеих систем F-DRX установлено образование парамагнитных кластеров Mn3+–O–Mn4+, количество которых возрастает с повышением содержания Mn. Наибольшая степень кластеризации наблюдается для образца Li1.266Nb0.217Mn0.55O1.85F0.15. В то же время коэффициент диффузии для Nb-содержащих F-DRX на порядок ниже, чем для Ti-содержащих F-DRX, что, вероятно, связано с большей кластеризацией ионов Mn3+, затрудняющей макродиффузию ионов Li+ и, как следствие, ухудшающей кинетику процесса.
ВВЕДЕНИЕ
В последние годы катодные материалы на основе литий-избыточных смешанно-катионных оксидов переходных металлов с общей формулой Li1 +x(M1M2)1 –xO2 и с разупорядоченной структурой каменной соли (disordered rock-salt – DRX) стали рассматривать как новый перспективный класс катодных материалов для литий-ионных аккумуляторов с повышенной удельной энергией [1–5]. Высокая удельная емкость достигается путем введения в структуру избытка лития и при условии активации двух редокс-пар: катионной Mеn+/Mе(n+ 1)+ и анионной O2–/O–. Стабилизация структуры данных соединений при обратимой интеркаляции ионов лития осуществляется благодаря присутствию электрохимически неактивных (d0) высоковалентных ионов переходных металлов (transition metal – TM) [2]. Ранее считалось, что соединения DRX с кубической плотнейшей упаковкой, в которой ионы Li+ и переходных металлов произвольно занимают одни и те же октаэдрические позиции, не могут быть использованы в качестве электродных материалов из-за отсутствия каналов для диффузии ионов лития в структуре [1]. Позже было установлено, что диффузия Li+ в DRX происходит по прыжковому механизму путем перескока из одной октаэдрической позиции в другую через промежуточную тетраэдрическую пустоту (o-t-o-диффузия). Промежуточные тетраэдрические пустоты имеют общие грани с четырьмя октаэдрами, которые могут быть заняты Li или ТМ. Катионное разупорядочение в структуре оксида приводит к образованию различных окружений тетраэдрических пустот: Li4, Li3ТМ, Li2ТM2, LiТM3 и ТM4 (эквивалентно обозначению 0ТM, 1ТM, 2ТM, 3ТM и 4ТM). Ab initio расчеты показали, что только тетраэдрические пустоты, не содержащие в окружении ионов ТМ (0ТМ) или содержащие только 1ТM, обеспечивают наименьшую энергию активации для прыжков ионов Li+. В свою очередь, для макроскопической диффузии ионов Li+, тетрапустоты 0ТM и/или 1ТМ должны быть непрерывно соединены между собой, образуя тем самым перколяционную сеть. При этом, чем больше избыток лития, тем выше вероятность, что такая сеть будет непрерывной.
Известно, что окисленные анионы кислорода по своей природе нестабильны, и по мере электрохимического окисления кислорода происходит его необратимое выделение из решетки в виде O2. Потеря кислорода приводит к модификации анионной подрешетки и, как следствие, к миграции ионов ТМ и уплотнению решетки [6]. Эти изменения сопровождаются значительными затруднениями для диффузии ионов лития. Поэтому эффективной стратегией повышения устойчивости электродных материалов стало включение в кристаллическую решетку DRX-оксидов анионов с высокой электроотрицательностью, таких как фтор, с образованием F-DRX с общей формулой Li1 +x(M1M2)1– xO2– yFy. Ранее предпринимались попытки по фторированию термодинамически стабильных хорошо упорядоченных оксидов лития [7]. Помимо чрезвычайно малой растворимости фтора в них, оказалось, что большинство введенных ионов F– находится на поверхности, образуя слой LiF. Включение анионов фтора в кислородную подрешетку на уровне, намного превышающем степень замещения для упорядоченных оксидов, было достигнуто в DRX-соединениях благодаря их локальной химической неоднородности с участками, обогащенными ионами лития [6, 8–14]. Было показано, что частичное замещение кислорода фтором в анионной подрешетке приводит к повышению доли марганца и удельной емкости, приходящейся на электрохимически активный ТМ (Mn3+), и к стабилизации редокс-пары кислорода при циклировании [6, 8–10]. Экспериментально показано, что для F-DRX с общей формулой ${\text{L}}{{{\text{i}}}_{{{\text{1}}{\text{.2}}}}}{\text{Mn}}_{{0.6\, + \,0.5x}}^{{3 + }}{\text{N}}{{{\text{b}}}^{{5 + }}}_{{0.2\, - \,0.5x}}{{{\text{O}}}_{{2\, - \,x}}}{{{\text{F}}}_{x}}$ (далее LMNОF) наблюдается снижение количества выделяемого кислорода из решетки в процессе заряда по сравнению с соответствующими DRX-оксидами [8, 10]. Путем комбинации теоретических и экспериментальных методов исследования установлено, что частичное замещение ионов кислорода на фтор способствует уменьшению искажения октаэдров Mn3+O6, вызванного эффектом Яна–Теллера, что также может способствовать снижению окислительно-восстановительной (ОВ) активности кислорода [8, 13]. Сильное притяжение между Li+ и F– в F-DRX должно повышать образование диамагнитных кластеров, богатых литием, что необходимо для создания перколяционной сети для диффузии ионов лития [14, 15].
Несмотря на то, что электрохимически неактивные ТМ (d0) играют важную роль в образовании F-DRX, их влияние на обратимые катионные и анионные ОВ-процессы и стабильность при циклировании изучено недостаточно. Ранее, на примере Ti-содержащих (LTMO) и Nb-содержащих (LNMO) DRX c одинаковым содержанием Mn, было показано, что вклад редокс пары O2–/O– в удельную емкость LNMO значительно выше, в то время как циклическая стабильность лучше у LТМО [3, 4]. Описанная разница в характеристиках двух типов DRX-оксидов ясно демонстрирует критическую роль ТМ (d0) в регулировании их электрохимического поведения [5].
В настоящей работе механохимически стимулированным твердофазным методом синтеза получены литий-избыточные (20–30 мол. %) F-DRX с общей формулой Li1 +x(MeMn3+)1 –xO2 –yFy, где Me = Ti4+, Nb5+, 0.2 ≤ x ≤ 0.288 и 0.05 ≤ y ≤ 0.15. Проведены исследования структурных характеристик и электрохимических свойств полученных F-DRX с целью изучения влияния ТМ (d0) на ОВ активность пары O2–/O– и на диффузию ионов лития.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы исследуемых Ti- и Nb-содержащих F-DRX с общей формулой Li1 +x(MeMn3+)1 –xO2 –yFy, где Me = Ti4+, Nb5+, 0.2 ≤ x ≤ 0.288 и 0.05 ≤ y ≤ 0.15, и составами, представленными в табл. 1, получали из смеси следующих реагентов: LiOH (98%, Реахим), LiF (98%, ООО “Завод редких металлов”), TiO2 (анатаз, 99.8%, Sigma Aldrich), Nb2O5 (99.5%, Реахим) и Mn2O3 (98%, Alfa Aesar). Стоит отметить, что из-за разницы в степенях окисления TM (d0) отсутствует возможность подобрать для двух систем составы с одинаковым количеством лития при условии сохранения электронейтральности. Синтез катодных материалов осуществляли механохимически стимулированным твердофазным способом. Предварительную механическую активацию (МА) проводили в планетарной мельнице АГО-2 (600 об./мин) в стальных барабанах с шарами из ZrO2, стабилизированного иттрием, в течение 5 мин. Массовое соотношение порошка к шарам составляло 1 : 40. Отжиг активированных смесей осуществляли в токе аргона при температуре 950°С в течение 2 ч. Композиционные материалы с углеродом были получены путем МА синтезированных материалов с 5 мас. % сажи П-277 (Центр новых химических технологий ИК СО РАН, Омский филиал) в мельнице SPEX-800 в течение 10 мин.
Таблица 1.
Параметры решетки образцов F-DRX, уточненные методом Ритвельда; средний размер частиц (D50) по данным гранулометрии
| Состав | Образец | a, Å | V, Å3 | Rwp, % | χ2 | D50, мкм* |
|---|---|---|---|---|---|---|
| Li1.2Ti0.35Mn0.45O1.95F0.05 | LTMOF5 | 4.1487(1) | 71.41 | 4.90 | 1.33 | 6.26/1.87 |
| Li1.2Ti0.30Mn0.50O1.90F0.10 | LTMOF10 | 4.1502(1) | 71.48 | 4.39 | 1.21 | 6.42/2.24 |
| Li1.2Ti0.25Mn0.55O1.85F0.15 | LTMOF15 | 4.1534(1) | 71.65 | 3.96 | 1.17 | 6.89/2.42 |
| Li1.288Nb0.272Mn0.45O1.95F0.05 | LNMOF5 | 4.1836(2) | 73.22 | 4.23 | 1.28 | 6.66/1.29 |
| Li1.275Nb0.245Mn0.50O1.9F0.10 | LNMOF10 | 4.1840(1) | 73.25 | 4.73 | 1.42 | 6.12/1.24 |
| Li1.266Nb0.217Mn0.55O1.85F0.15 | LNMOF15 | 4.1759(5) | 72.82 | 4.12 | 1.29 | 5.03/1.33 |
Рентгенофазовый анализ (РФА) полученных образцов проводили с помощью дифрактометра D8 Advance (Bruker, Германия) с использованием CuKα-излучения (λ1 = 1.5406 Å, λ2 = 1.5445 Å). Уточнение параметров решетки осуществляли методом Ритвельда с использованием пакета программного обеспечения TOPAS 4.2. Размер и морфологию частиц исследовали методом сканирующей электронной микроскопии (СЭМ) с помощью электронного микроскопа Hitachi TM-1000 (Hitachi, Япония). Спектры электронного парамагнитного резонанса (ЭПР) образцов регистрировали на спектрометре Adani Spinscan X (ADANI, Беларусь) при комнатной температуре (25°С) и при температуре жидкого азота (–196°С). Гранулометрический анализ порошков проводили с помощью лазерного анализатора размеров частиц Микросайзер 201А (ООО “ВА Инсталт”, Россия). Перед проведением анализа образцы подвергали ультразвуковой обработке (200 Вт) в течение 30 с.
Для электрохимического тестирования готовили катодные смеси, состоящие из 75 мас. % активной составляющей, 20 мас. % проводящего углерода Super P и 5 мас. % связующего PVDF/NMP. Рабочие электроды получали путем нанесения суспензии на алюминиевую фольгу с помощью doctor blade, высушивания при 90°C в вакууме и прокатки. Плотность приготовленных образцов составляла 2–3 мг см–2, диаметр электрода 10 мм. В качестве анода использовали литиевую фольгу, в качестве электролита – раствор 1 М LiPF6 в смеси этиленкарбоната и диметилкарбоната (1 : 1) (Alfa Aesar, 99%), а в качестве сепаратора – стекловолоконный фильтр Whatman, Grade GF/C. Электрохимические ячейки собирали в аргоновом боксе VBOX-SS 950, Vilitek, Россия. Циклирование образцов проводили на установке Biologic BCS 805 (Франция) в гальваностатическом режиме при комнатной температуре и скорости С/40. Гальваностатическое прерывистое титрование (galvanostatic intermittent titration technique – GITT) проводили при комнатной температуре со скоростью С/20. Время наложения тока составляло 20 мин, а время релаксации – 40 мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фазовый состав, кристаллическая структура и морфология
Дифрактограммы синтезированных образцов F-DRX приведены на рис. 1. На всех дифрактограммах наблюдаются рефлексы хорошо окристаллизованных фаз, относящиеся к кубической сингонии с пр. гр. Fm-3m. Слева на рисунке приведена выделенная область отражений от плоскости (111). Для Nb-содержащих F-DRX с ростом содержания фтора видно значительное изменение положения рефлекса (111) в сторону больших значений 2θ по сравнению с Ti-содержащими образцами. Значения параметра решетки a исследуемых Ti- и Nb-содержащих F-DRX, уточненные методом Ритвельда, представлены в табл. 1. Видно, что параметр a для Ti-содержащих F-DRX при повышении содержания фтора возрастает. С увеличением содержания фтора увеличивается содержание ионов Mn3+ и уменьшается содержание ионов Ti4+. Поскольку ионный радиус Mn3+ (0.645 Å) больше ионного радиуса Ti4+ (0.605 Å), то соответственно увеличивается и среднее расстояние между ионами металла и кислорода. Напротив, для Nb-содержащих F-DRX с увеличением мольной доли фтора параметр a уменьшается вследствие уменьшения содержания лития (${{r}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ = = 0.76 Å).
Согласно микрофотографиям СЭМ, образцы Ti-содержащих F-DRX: LTMOF5, LTMOF10, LTMOF15 – состоят из частиц полигональной формы размером 4–7, 6–10 мкм и 7–15 мкм соответственно (рис. 2а). Увеличение размера частиц, вероятно, связано с плавлением LiF (Tпл = = 850°C), что приводит к спеканию частиц F-DRX. Для Nb-содержащих F-DRX наблюдается неоднородное распределение частиц со средним размером мелких частиц 1–3 мкм и крупных частиц 10–20 мкм (рис. 2б). По данным гранулометрии средний размер частиц лежит в диапазоне 5–7 мкм (табл. 1).
Для получения электропроводящих композитов с углеродом, образцы подвергали МА с 5% углерода П-277 с применением мельницы SPEX‑800. На снимках СЭМ для всех композитов наблюдаются первичные частицы субмикронного размера (рис. 2в, 2г). Средний размер ОКР, определенный из данных РФА с использованием формулы Шеррера, несколько меньше для Ti-содержащих F-DRX и лежит в диапазоне (20.9–24.0) ± 0.9 нм, в то время как для Nb-содержащих размер ОКР составляет (22.8–24.1) ± 0.8 нм.
Локальная структура
Ранее методом спектроскопии ЭПР нами были проведены исследования локальной структуры DRX оксидов Li1.2Mn0.4Ti0.4O2 и Li1.3Mn0.4Nb0.3O2 [16, 17]. Установлено, что в них существуют не только диамагнитные кластеры лития (0ТМ или 1ТМ), но и парамагнитные кластеры марганца, присутствие которых ухудшает условия транспорта ионов лития. В данной работе также были проведены исследования, направленные на выявление в структуре F-DRX возможной кластеризации парамагнитных ионов марганца методом ЭПР.
На рис. 3 приведены спектры ЭПР образцов LTMOF5 и LNMOF5, записанные при двух температурах. На спектрах ЭПР, полученных при комнатной температуре (25°С), для всех образцов наблюдаются широкие линии Лоренца с g ~ 2 (рис. 3а).
Рис. 3.
ЭПР-спектры образцов LTMOF5 (а) и LNMOF5 (б), записанные при комнатной температуре (25°С) и при температуре жидкого азота (–196°С).
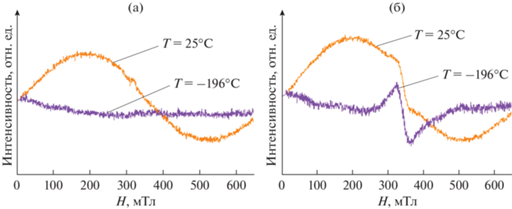
Причина появления широкого сигнала, как и в случае DRX-оксидов, по-видимому, связана с появлением ионов Mn4+ и возникновением непрямого обменного взаимодействия между ионами Mn3+ и Mn4+ [18]. Для Ti-содержащих LTMOF10, LTMOF15 и Nb-содержащих LNMOF5, LNMOF10, LNMOF15 образцов сигнал представляет собой суперпозицию широкой и узкой линий Лоренца, связанных с релаксацией спиновой системы Mn3+–O–Mn4+ и сигналом от Mn4+ в диамагнитном (Li+/Nb5+ или Li+/Ti4+) окружении (рис. 3б), соответственно. Суммарное количество парамагнитных центров для обеих систем F-DRX увеличивается с ростом содержания Mn и составляет 0.12, 0.21, 0.21 ат. % для LTMOF5, LTMOF10, LTMOF15 и 0.13, 0.19, 0.25 ат. % для LNMOF5, LNMOF10, LNMOF15 соответственно. С увеличением содержания Mn в Ti-содержащих F-DRX наблюдается также рост интенсивности узкого сигнала от Mn4+ в диамагнитном окружении ионами Li+ и/или Li+/Ti4+ [16], что косвенно свидетельствует об уменьшении степени кластеризации ионов Mn4+. Поскольку в Nb-содержащих образцах количество ионов Li+ больше, чем в Ti-содержащих образцах (табл. 1), поэтому и магнитуда узкого сигнала от Mn4+ в диамагнитном окружении в этих образцах выше (рис. 3). С другой стороны, поскольку концентрация парамагнитных кластеров Mn3+–O2––Mn4+ остается практически одинаковой (0.12 и 0.13 ат. % для LTMOF5 и LNMOF5 соответственно), то широкие компоненты на ЭПР-спектрах LTMOF и LNMOF образцов близки.
Для доказательства присутствия кластеров Mn3+–O–Mn4+, а не возможных ферромагнитных взаимодействий в образцах, спектры ЭПР были записаны при температуре жидкого азота (‒196°С). При низкой температуре магнитуда широкого сигнала падает, что свидетельствует об отсутствии ферромагнетизма в образцах, однако остается заметным слабоинтенсивный узкий сигнал (рис. 3б) с шириной линии между точками максимального наклона ∆Hmax ~ 30 мТл, характерный для Mn4+ в диамагнитном окружении [19, 20].
Электрохимические свойства
На рис. 4 представлены зарядно-разрядные кривые первого и второго циклов F-DRX, а также кривые дифференциальной емкости (dQ/dU) в зависимости от приложенного напряжения для двух серий образцов Ti- и Nb-содержащих F-DRX с одинаковым содержанием Mn. Согласно анализу данных циклирования, ступенчатый характер кривых при деинтеркаляции ионов лития указывает на реализацию многоэлектронных процессов с участием двух редокс-пар Mn3+/Mn4+ и O2–/O–. В табл. 2 приведены значения разрядной емкости первого и десятого циклов для всех синтезированных F-DRX. Практические значения разрядной емкости превышают теоретические значения, рассчитанные, исходя из содержания Mn3+ на формульную единицу. При дальнейшем повышении напряжения до 4.8 В в ОВ процесс включается и анионная подрешетка. Стоит отметить, что вклад редокс-пары O2–/O– в разрядную емкость для Ti- и Nb-содержащих F-DRX различен.
Рис. 4.
Зарядно-разрядные кривые первых двух циклов образцов Li1 +x(MеMn3+)1 –xO2– yFy, где Mе = Ti4+ (а) и Nb5+ (б), а также зависимости dQ/dU от напряжения (в) и (г) соответственно. Вертикальной пунктирной линией указано теоретическое значение удельной емкости, приходящееся на пару Mn3+/Mn4+.
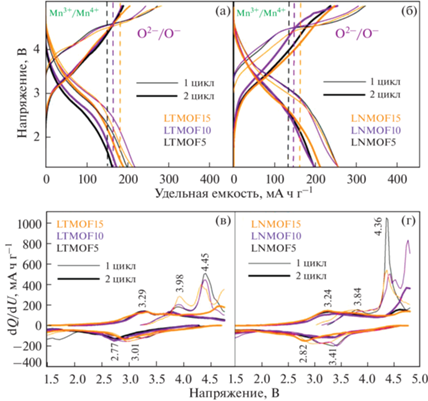
Таблица 2.
Значения теоретической и практической емкости (Q) для Ti- и Nb-содержащих F-DRX с участием двух редокс-пар Mn3+/Mn4+ и O2–/O–
| Qтеор(Mn3+/Mn4+), мА ч г–1 | Qтеор (O2–/O–), мА ч г–1 | Qтеор.общ, мА ч г–1 | Qпракт, мА ч г–1* | |
|---|---|---|---|---|
| LTMOF5 | 147 | 245 | 392 | 197/70 |
| LTMOF10 | 163 | 228 | 390 | 215/73 |
| LTMOF15 | 178 | 210 | 388 | 212/122 |
| LNMOF5 | 132 | 245 | 377 | 255/72 |
| LNMOF10 | 145 | 225 | 370 | 256/96 |
| LNMOF15 | 158 | 206 | 364 | 250/140 |
Проведенные нами ранее сравнительные исследования DRX-оксидов показали, что более выраженным вкладом редокс-пары O2–/O– в удельную емкость обладают Nb-содержащие соединения [4], однако при их циклировании происходит падение емкости из-за выделения газообразного кислорода из решетки [21], поскольку окисленные ионы кислорода по своей природе нестабильны. Присутствие в структуре ионов F– оказывает стабилизирующий эффект, уменьшая количество выделяющегося из решетки кислорода [8]. С другой стороны, расчетными методами было показано, что при небольшом избытке лития (x < 0.2) введение фтора необходимо для преодоления порога перколяции в Li1 +x(MеM')1 –xO2 –yFy и извлечения 1 Li [14, 15]. Чем больше ионов F– в структуре, тем больше образуется соединенных между собой диамагнитных кластеров Li, которые состоят из тетрапустот 0ТМ и 1ТМ, создающих непрерывную перколяционную сеть [22].
Для всех Nb-содержащих образцов, вне зависимости от содержания Mn, наблюдаются близкие значения электрохимической емкости. Максимальный вклад редокс-пары O2–/O– (123 мА ч г–1) в удельную разрядную емкость на первом цикле наблюдается для образца LNMOF5 (рис. 4б). Отметим, что для Ti-содержащих составов вклад редокс-пары O2–/O– на первом цикле менее выражен и имеет максимальное значение 52 мА ч г–1 для образца LTMOF10 (рис. 4а). Падение удельной емкости после первого цикла может свидетельствовать об образовании CEI (cathode electrolyte interphase), окислении электролита или о частичном удалении кислорода из структуры при напряжении около 4.8 В. При продолжительном циклировании наибольшей разрядной емкостью на 10-м цикле обладают образцы с максимальным содержанием фтора LTMOF15 и LNMOF15, что свидетельствует о стабилизации кислорода в анионной подрешетке.
На дифференциальных кривых заряда наблюдаются пики в области напряжений 3.3–4.0 В и 4.1–4.5 В, отвечающие окислению Mn3+/Mn4+ и активации анионной подрешетки O2–/O– соответственно (рис. 4в, 4г). Для Ti-содержащих образцов интенсивность пика Mn3+/Mn4+ на первом заряде выше по сравнению с Nb-содержащими образцами, что указывает на больший вклад пары Mn3+/Mn4+. Для Nb-содержащих образцов, наоборот, наблюдается значительный вклад пары O2–/O– в ОВ реакцию (~4.4 В).
Подвижность ионов лития
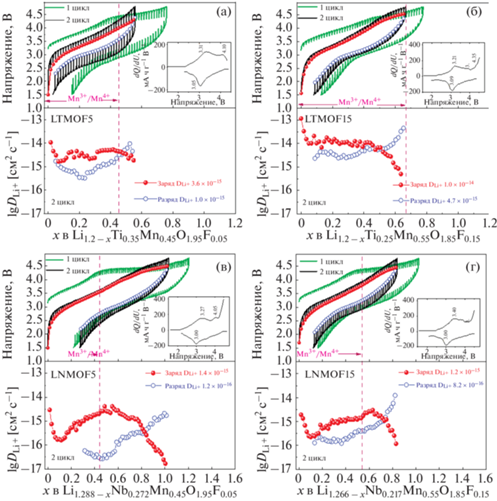
Для того чтобы оценить коэффициент диффузии $\left( {{{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}} \right)$ ионов Li+ в процессе циклирования, использовали метод гальваностатического прерывистого титрования (GITT). На рис. 5 представлены зарядно-разрядные кривые для образцов LTMOF5, LTMOF15, LNMOF5 и LNMOF15 в ходе первого и второго циклов, иллюстрирующие зависимость напряжения от содержания Li+ при нагрузке и релаксации. На кривых НРЦ на первом цикле для обеих систем F-DRX наблюдаются два плато, что согласуется с данными гальваностатического циклирования.
Рис. 5.
Кривые GITT и НРЦ Ti-содержащих LTMOF5, LTMOF15 (а, б) и Nb-содержащих LNMOF5, LNMOF15 (в, г) F-DRX и зависимости коэффициента диффузии ${{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ от хLi для второго цикла. Во вставке представлены дифференциальные кривые НРЦ второго цикла. Пунктирной линией отмечено теоретическое значение удельной емкости (xLi), приходящееся на пару Mn3+/Mn4+.
Коэффициенты диффузии $\left( {{{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}} \right)$ ионов Li рассчитаны из данных GITT по уравнению [23]:
На рис. 5 приведены кривые GITT и НРЦ для Ti- и Nb-содержащих образцов и зависимости коэффициента диффузии ${{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ от хLi. Форма кривых зависимости ${{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ от состава F-DRX аналогична форме кривых DRX-оксидов [16, 24]. Напротив, наблюдается явное различие в значениях ${{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ на заряде и разряде для обеих систем F-DRX. Рассчитанные коэффициенты диффузии находятся в диапазоне 10–14–10–17 см2 с–1. Для Ti-содержащих F-DRX значения ${{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ на втором заряде меняются в узком диапазоне xLi (область псевдоплато) от 0.05 до 0.5 xLi и равны 3.6 × 10–15 и 1.0 × 10–14 см2 с–1 для LTMOF5 и LTMOF15 соответственно (рис. 5а, 5б). Для Nb-содержащих образцов область псевдоплато является более протяженной 0.1–0.7 xLi, а значения ${{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ равны 1.4 × 10–15 и 1.2 × 10–15 см2 с–1 для LNMOF5 и LNMOF15 соответственно (рис. 5в, 5г). Видно, что для Ti-содержащих F‑DRX значения ${{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ на порядок выше, чем для Nb-содержащих F-DRX, что, вероятно, обусловлено более сильными необратимыми изменениями в решетке Nb-содержащих образцов после извлечения лития, как например, уплотнение решетки с поверхности в случае миграции ионов ТМ [6]. Наблюдаемая разница в значениях ${{D}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}$ для Nb- и Ti-содержащих F-DRX согласуется с результатами ЭПР спектроскопии, согласно которым кластеризация ионов марганца более выражена для Nb-содержащих образцов, что отрицательно влияет на макродиффузию ионов лития. Кроме того, релаксационные пики на кривых GITT более интенсивны для образца LTMOF5, что свидетельствует о более медленной кинетике процесса интеркаляции ионов лития по сравнению с остальными образцами. Причиной может быть низкая степень замещения кислорода на фтор в этом образце или недостаточное количество диамагнитных кластеров для образования непрерывной перколяционной сети.
ЗАКЛЮЧЕНИЕ
С помощью механохимически стимулированного твердофазного синтеза получены образцы оксифторидов Li1 +x(MеMn3+)1 –xO2 –yFy (где Mе = Ti4+, Nb5+) с 0.2 ≤ x ≤ 0.288 и 0.05 ≤ y ≤ 0.15 с разупорядоченной структурой каменной соли, содержащие ионы Mn3+ в качестве электрохимически активного катиона и высокозарядные ионы 3d0 Ti4+ или 4d0 Nb5+, стабилизирующие кристаллическую структуру. Механическая активация оксифторидов с углеродом позволяет снизить размер частиц до субмикронного уровня и приводит к образованию электронопроводящих композитов. Показано, что электрохимически активной парой в Ti-содержащих оксифторидах является, преимущественно, пара Mn3+/Mn4+. Напротив, для Nb-содержащих оксифторидов реализуется работа двух пар: Mn3+/Mn4+ при 3.3–3.4 В и O2–/O– при 4.1–4.3 В. Показано, что как для Ti-, так и для Nb-содержащих образцов с ростом содержания F– степень необратимого анионного окисления кислорода уменьшается. Высказано предположение, что кинетика диффузионных процессов в Ti-содержащих оксифторидах определяется количеством в них диамагнитных кластеров лития, число которых возрастает с увеличением содержания фтора, в то время как в Nb-содержащих оксифторидах значительный рост числа парамагнитных кластеров Mn3+–O2––Mn4+ затрудняет диффузию ионов Li+.
Установлено, что наименьшее падение емкости при циклировании наблюдается для Ti-содержащих F-DRX с y = 0.10 и x = 0.2 и для Nb-содержащих F-DRX с y = 0.15 и x = 0.266. Для оптимизации электрохимических свойств Ti-содержащих F‑DRX требуется увеличить количество диамагнитных кластеров лития путем введения его избытка (x > 0.2). Для Nb-содержащих F-DRX существует необходимость в уменьшении количества парамагнитных кластеров марганца, препятствующих диффузии лития, путем варьирования условий синтеза.
Список литературы
Lee, J., Urban, A., Li, X., Dong, S., Hautier, G., and Ceder, G., Unlocking the potential of cation disordered oxides for rechargeable lithium batteries, Science, 2014, vol. 343, p. 519.
Yabuuchi, N., Material design concept of lithium-excess electrode materials with rocksalt-related structures for rechargeable non-aqueous batteries, Chem. Rec., 2019, vol. 19, p. 690.
Chen, D., Wu, J., Papp, J. K., McCloskey, B., and Chen, G., Role of redox-inactive transition-metals in the behavior of cation-disordered rocksalt cathodes, Small, 2020, vol. 16, p. 173.
Kosova, N.V., Mishchenko, K.V., Podgornova, O.A., Semykina, D.O., and Shindrov, A.A., High-energy density electrode materials with disordered rock-salt structure, Russ. J. Electrochem., 2022, vol. 58(7), p. 567.
Ji, H., Urban, A., Kitchaev, D.A., Kwon, D.H., Artrith, N., Ophus, C., Huang, W.H., Cai, Z., Shi, T., Kim, J.C., Kim, H., and Ceder, G., Hidden structural and chemical order controls lithium transport in cation-disordered oxides for rechargeable batteries, Nat. Commun., 2019, vol. 10, p. 592.
Li, L., Lun, Zh., Chen, D., Yue, Y., Tong, W., Chen, G., Ceder, G., and Wang, C., Fluorination-enhanced surface stability of cation disordered rocksalt cathodes for Li-ion batteries, Adv. Funct. Mater., 2021, vol. 31, no. 2101888.
Croguennec, L., Bains, J., Ménétrier, M., Flambard, A., Bekaert, E., Jordy, C., Biensan, P., and Delmas, C., Synthesis of “Li1.1 (Ni0.425Mn0.425Co0.15)0.9O1.8F0.2” materials by different routes: is there fluorine substitution for oxygen? J. Electrochem. Soc., 2009, vol. 156, p. A349.
Lun, Z., Ouyang, B., Kitchaev, D., Clément, R., Papp, J., Balasubramanian, M., Tian, Y., Lei, T., Shi, T., McCloskey, B., Lee, J., and Ceder, G., Improved cycling performance of Li-excess cation-disordered cathode materials upon fluorine substitution, Adv. Energy Mater., 2019, vol. 9, p. 1802959.
Ahn, J., Chen, D., and Chen, G., A fluorination method for improving cation-disordered rocksalt cathode performance, Adv. Energy Mater., 2020, vol. 10, No. 2001671.
Crafton, M., Yue, Y., Huang, T., Tong, W., and McCloskey, B.D., Anion reactivity in cation-disordered rocksalt cathode materials: the influence of fluorine substitution, Adv. Energy Mater., 2020, vol. 10, no. 2001500.
Lun, Z., Ouyang, B., Kwon, D.H., Ha, Y., Foley, E.E., Huang, T.Y., Cai, Z., Kim, H., Balasubramanian, M., Sun, Y., Huang, J., Tian, Y., Kim, H., McCloskey, B.D., Yang, W., Clément, R.J., Ji, H., and Ceder, G., Cation-disordered rocksalt-type high-entropy cathodes for Li-ion batteries, Nat. Mater., 2021, vol. 20, p. 214.
Zhou, K., Zheng, S., Ren, F., Wu, J., Liu, H., Luo, M., Liu, X., Xiang, Y., Zhang, C., Yang, W., He, L., and Yang, Y., Fluorination effect for stabilizing cationic and anionic redox activities in cation-disordered cathode materials, Energy Storage Mater., 2020, vol. 32, p. 234.
Lee, J., Kitchaev, D.A., Kwon, D.H., Lee, C.W., Papp, J.K., Liu, Y.S., Lun, Z., Clément, R.J., Shi, T., McCloskey, B.D., Guo, J., Balasubramanian, M., and Ceder, G., Reversible Mn2+/Mn4+ double redox in lithium-excess cathode materials, Nat. Mater., 2018, vol. 556, p. 185.
Ouyang, B., Artrith, N., Lun, Z., Jadidi, Z., Kitchaev, D.A., Ji, H., Urban, A., and Ceder, G., Effect of fluorination on lithium transport and short-range order in disordered-rocksalt-type lithium-ion battery cathodes, Adv. Energy Mater., 2020, vol. 10, no. 1903240.
Lun, Z., Ouyang, B., Cai, Z., Clément, R.J., Kwon, D.H., Huang, J., Papp, J.K., Balasubramanian, M., Tian, Y., McCloskey, B.D., Ji, H., Kim, H., Kitchaev, D.A., and Ceder, G., Design principles for high-capacity Mn-based cation-disordered rocksalt cathodes, Chem., 2020, vol. 6, p. 153.
Semykina, D.O., Morkhova, Ye.A., Kabanov, A.A., Mishchenko, K.V., Slobodyuk, A.B., Kirsanova, M.A., Podgornova, O.A., Shindrov, A.A., Okhotnikov, K.S., and Kosova, N.V., Effect of transition metal cations on the local structure and lithium transport in disordered rock-salt oxides, Phys. Chem. Chem. Phys., 2022, vol. 24, p. 5823.
Mishchenko, K.V., Kirsanova, M.A., Slobodyuk, A.B., Krinitsyna, A.A., and Kosova, N.V., Effect of cooling rate on the structure and electrochemical properties of Mn-based oxyfluorides with cation-disordered rock-salt structure, Chim. Techno Acta, 2022, vol. 9(3), no. 20229310.
Stoyanova, R., Gorova, M., and Zhecheva, E., EPR of Mn4+ in spinels Li1 +xMn2 –xO4 with 0 ≤ x ≤ 0.1, J. Phys. Chem. Solids, 2000, vol. 61(4), p. 609.
Julien, C., Gendron, F., Ziolkiewicz, S., and Nazri, G.A., Electrical and ESR studies of lithium manganese oxide spinels, Mat. Res. Soc. Symp., 1998, vol. 548, p.187.
Geng, F., Hu, B., Li, C., Zhao, C., Lafon, O., Trébosc, J., Amoureux, J.P., Shen, M., and Hu, B., Anionic redox reactions and structural degradation in a cation-disordered rock-salt Li1.2Ti0.4Mn0.4O2 cathode material revealed by solid-state NMR and EPR, J. Mater. Chem. A, 2020, vol. 8(32), p. 16515.
Chen, D., Ahn, J., and Chen, G., An overview of cation-disordered lithium excess rocksalt cathode, ACS Energy Lett., 2021, vol. 6, p. 1358.
Clément, R.J., Lun, Z., and Ceder, G., Cation-disordered rocksalt transition metal oxides and oxyfluorides for high energy lithium-ion cathodes, Energy Environ. Sci., 2020, vol. 13, p. 345.
Weppner, W. and Huggins, R.A., Determination of the kinetic parameters of mixed-conducting electrodes and application to the system Li3Sb, J. Electrochem. Soc., 1977, vol. 124, p. 1569.
Wang, R., Huang, B., Qu, Z., Gong, Y., He, B., and Wang, H., Research on the kinetic properties of the cation disordered rock-salt Li-excess Li1.25Nb0.25Mn0.5O2 material, Solid State Ionics, 2019, vol. 339, No. 114999.
Дополнительные материалы отсутствуют.




