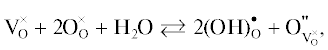Электрохимия, 2023, T. 59, № 3, стр. 143-157
Транспортные свойства In3+- и Y3+-допированного гексагонального перовскита Ba5In2Al2ZrO13
Р. Д. Андреев a, b, И. А. Анохина a, b, Д. В. Корона a, b, А. Р. Гилев a, И. Е. Анимица a, *
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
b Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: Irina.animitsa@urfu.ru
Поступила в редакцию 21.07.2022
После доработки 31.08.2022
Принята к публикации 30.09.2022
- EDN: HWGJUV
- DOI: 10.31857/S0424857023030039
Аннотация
В работе впервые получен сложный оксид Ba5In1.9Y0.1Al2ZrO13, характеризующийся структурой гексагонального перовскита (a = 5.971(4) Å, с = 24.012(1) Å). Установлено, что фаза способна к диссоциативному поглощению воды из газовой фазы, степень гидратации достигала 0.39 моль Н2О. Методом ИК-спектроскопии установлено, что протоны присутствуют в виде энергетически неэквивалентных ОН–-групп, участвующих в разных по силе водородных связях. Показано, что изовалентное допирование иттрием фазы Ba5In2Al2ZrO13 не приводит к значимому изменению величины кислород-ионной проводимости, по сравнению с акцепторным допированием Ba5In2.1Al2Zr0.9O12.95, которое позволяет увеличить кислород-ионную проводимость в 1.3 раза. Оба типа допирования приводят к увеличению величины протонной проводимости как результат увеличения концентрации протонов. Для данных фаз степень гидратации зависит от величины параметров ячейки и, соответственно, определяется наличием свободного места для участия ОН–-групп в координации бария. Фазы Ba5In2Al2ZrO13, Ba5In2.1Al2Zr0.9O12.95 и Ba5In1.9Y0.1Al2ZrO13 ниже 600оС во влажной атмосфере (pH2О = 1.92 × 10–2 атм) проявляют доминирующий протонный транспорт.
ВВЕДЕНИЕ
Исследования высокотемпературного протонного транспорта в сложных оксидах продолжаются уже на протяжении нескольких десятилетий, начиная с работ Х. Ивахары (H. Iwahara) [1–4], и это обусловлено в первую очередь высокой практической значимостью таких систем [5–7]. Особый интерес к высокотемпературным протонным электролитам обусловлен возможностью создания на их основе среднетемпературных твердооксидных топливных элементов ТОТЭ (500–700°C) [8–10]; снижение рабочих температур ТОТЭ позволяет значительно уменьшить коррозию металлических и деградацию керамических компонентов, существенно повысить срок службы топливного элемента, и в конечном итоге добиться удешевления стоимости производимой электроэнергии. Предлагаемые в настоящее время протонные электролиты для ТОТЭ подвержены значительной деградации, поэтому малоэффективны, т.к. не могут обеспечить стабильность характеристик устройства. Все это стимулирует поиск новых материалов с высокой протонной проводимостью и химической устойчивостью.
В настоящее время класс высокотемпературных протонных электролитов представлен, в основном, допированными перовскитами [11, 12]. Они всесторонне изучены, установлены основные закономерности формирования высокотемпературной протонной проводимости. Возможность возникновения протонных дефектов в этих соединениях обусловлена наличием вакансий кислорода, которые задаются введением акцепторного допанта [13, 14]. Наличие вакантных позиций в кислородной подрешетке способствует обратимому диссоциативному поглощению воды из газовой фазы и появлению протонного вклада проводимости.
Существуют различные стратегии материаловедческого поиска сложно-оксидных систем, способных к проявлению протонного переноса. С целью повышения химической устойчивости осуществляются разработки сложных оксидов с пониженной концентрацией щелочноземельных элементов или даже без их наличия в структуре (alkaline earth elements free strategy). К таким соединениям могут быть отнесены как сложные оксиды со структурой перовскита А3+В3+О3 [15–19], так и неперовскитные системы, например допированные LaNbO4 [20–22], ${\text{L}}{{{\text{a}}}_{{\text{2}}}}{\text{M}}_{{\text{2}}}^{{{\text{4 + }}}}{{{\text{O}}}_{7}}$ (M = Zr, Ce, Hf) [23–28], Ln6WO12 [29–31]. Для нового класса протонных проводников со структурой Раддлесдена–Поппера, например BaNdInO4 [32], BaLaInO4 [33, 34] и их допированных аналогов, характерны высокие концентрации протонов. В таких системах действуют иные закономерности формирования протонных дефектов, отличающиеся от классических перовскитов. Так, степень гидратации может достигать значимых величин, поскольку определяется не концентрацией вакансий кислорода, а размером блока каменной соли. Кроме того, такие структуры отличаются значительной кристаллохимической гибкостью, так как октаэдры не соединяются через апикальные атомы кислорода, а разделены блоком каменной соли, поэтому введение небольших концентраций допантов позволяет на порядки увеличивать величину протонной проводимости. Для таких структур процесс инкорпорирования протонов (т.е., ОН–-групп) обеспечивается присутствием координационно-ненасыщенных Ba- и La-полиэдров. Подобные механизмы гидратации также реализуется для структур срастания, например, в протон-проводящих электролитах – гексагональных перовскитах Ba7Nb4MoO20, Ba5Er2Al2ZrO13 [35–38]. Такие фазы характеризуются высокими значениями протонной проводимости, превышающей величины для известных протон-проводящих фаз (~10–3 Ом–1 см–1, 300°С). Пока круг таких систем остается достаточно малочисленным. Еще остаются непонятными механизмы миграции протонов, закономерности процессов гидратации, факторы, определяющие подвижность протонов.
Строение другого соединения Ba5In2Al2ZrO13 со структурой гексагонального перовскита описано Шпанченко Р.В. и др. в 1994 г. [39]. Показано, что эту структуру можно рассматривать как результат срастания блоков Ba2InAlO5 и BaZrO3 вдоль оси с. Особенностью структуры является совместное заполнение двух позиций 4f атомами In и Al и разупорядочение атомов кислорода и вакансий в слоях BaO◻2 (где слои BaO3 и BaO◻2 с неупорядоченным размещением атомов кислорода и вакансии чередуются вдоль оси с, кислородные вакансии локализованы в слоях h-типа BaO◻2). Недавно было показано [40], что для этой фазы и In3+-допированного структурного аналога Ba5In2.1Al2Zr0.9O12.95 также возможна реализация протонного переноса. В продолжение этих исследований в настоящей работе нами были предприняты попытки проведения различных типов замещений в In3+-подрешетке на Ca2+ (акцепторное допирование), Y3+ (изовалентное допирование) и Zr4+ (донорное допирование). Впервые для фазы Ba5In1.9Y0.1Al2ZrO13 проведены исследования гидратации, природы кислородно-водородных групп и проводимости в зависимости от температуры в атмосферах различной влажности. Проведено сравнение полученных данных с In3+-допированной фазой Ba5In2.1Al2Zr0.9O12.95.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Матричная фаза состава Ba5In2Al2ZrO13 и допированные образцы номинальных составов Ba5In1.9Y0.1Al2ZrO13, Ba5In2.1Al2Zr0.9O12.95, Ba5In1.9Ca0.1Al2ZrO12.95 и Ba5In1.9Zr0.1Al2ZrO13.05 были получены твердофазным методом. В качестве исходных веществ были использованы BaCO3 (Вектон, 99.9999%), In2O3 (Реахим, 99.99%), Al2O3 (Реахим, 99.99%), ZrO2 (Реахим, 99.99%), CaCO3 (Реахим, 99.99%), Y2O3 (Вектон, 99.998%). Предварительно прокаленные исходные вещества, взятые в стехиометрических количествах, смешивались в агатовой ступке, перетирались в течение одного часа, после чего подвергались отжигу. Синтез производили на воздухе при ступенчатом повышении температуры в диапазоне 800–1200°C с шагом 100°C; время отжига составляло 24 ч на каждой стадии. После каждого этапа термообработки образцы тщательно перетирались в агатовой ступке в среде гексана. Гексан был использован в качестве дисперсионной среды, поскольку является индифферентной жидкостью к оксидам (карбонатам) и образующимся в процессе синтеза промежуточным фазам, а также не содержит следов воды, присутствие которой могло бы приводить к гидролизному разложению фаз и нарушению стехиометрии при синтезе.
Для контроля фазового состава и уточнения параметров элементарных ячеек исследуемых образцов был использован рентгеновский анализ. Съемка проводилась на дифрактометре ARL EQUINOX 3000 (Thermo Fisher Scientific, США). Рентгенограммы были получены при комнатной температуре в CuKα-излучении в интервале углов 10°–90° с шагом 0.024°. Для расчетов параметров элементарных ячеек использовался пакет программ FullProf.
Исследование морфологии поверхности и катионного состава полученных образцов производилось на сканирующем электронном микроскопе (СЭМ) VEGA3 (Tescan, Чехия), оснащенным системой для энергодисперсионной рентгеновской спектроскопии (ЭДС) AztecLive Standard Ultim Max 40 (Oxford Instruments, Великобритания).
Для термогравиметрических (ТГ) измерений и инфракрасной (ИК) спектроскопии были подготовлены гидратированные образцы исследуемых соединений. Предварительно образцы прокаливались при температуре 1100°C в атмосфере сухого азота с целью удаления молекул воды и диоксида углерода, которые образцы могли инкорпорировать из воздуха. Прокаленные образцы затем медленно охлаждались в атмосфере влажного азота (pH2О = 1.92 × 10–2 атм) до 200°C. Таким образом, нижняя температура гидратации обеспечивала условия, исключающие появление адсорбционной влаги в образце.
Термогравиметрический анализ гидратированных образцов проводился на термовесах TG STA 409 PC (Netzsch, Германия), совмещенных с квадрупольным масс-спектрометром (МС) QMS 403C Aëolos (Netzsch, Германия). Таким образом, одновременно с термогравиметрическими измерениями проводился анализ отходящих газов. Измерения проводились в температурном интервале 25–1000°C со скоростью нагрева 10°C/мин в атмосфере аргона.
Для идентификации кислородно-водородных групп в исследуемых соединениях использовался метод ИК-спектроскопии. Гидратированные образцы исследовали на ИК-фурье-спектрометре Nicolet 6700 (Thermo Fisher Scientific, США) методом диффузного отражения с использованием приставки Smart Diffuse Reflectance (Thermo Fisher Scientific, США). Съемка проходила при комнатной температуре в диапазоне частот 500–4000 см–1.
Для изучения электрических свойств были получены керамические образцы. Порошкообразные образцы компактировали в виде таблеток на ручном прессе при давлении 10 МПа и подвергали спеканию при температуре 1425°C в течение 24 ч. В качестве пластификатора использовали раствор натурального каучука в толуоле. Затем на торцевые поверхности керамических образцов наносились палладий-серебряные электроды и припекались в течение 4 ч при температуре 900°C.
Электрические свойства образцов исследовали методом импедансной спектроскопии. Измерения проводили с использованием измерителя параметров импеданса Z-3000X (Elins, Россия) в частотном диапазоне 100 Гц–3 МГц; обработка данных производилась с помощью программного обеспечения ZView. Измерения проводились в сухом и во влажном воздухе (pO2 = 0.21 атм) и азоте (pO2 = 2.02 × 10–4 атм) в интервале температур 250–900°C при охлаждении со скоростью 1°С/мин. Сухая атмосфера (pH2О = 3.5 × 10–5 атм) задавалась циркуляцией воздуха через порошкообразный пентаоксид фосфора. Влажная атмосфера (pH2О = 1.92 × 10–2 атм) задавалась барботированием воздуха последовательно через 30%‑ный раствор гидроксида натрия, дистиллированную воду и насыщенный раствор бромида калия. Влажность газов контролировали измерителем влажности газов ИВГ-1 МК-С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фазовый анализ и морфологическая аттестация
По данным рентгенофазового анализа, матричное соединение Ba5In2Al2ZrO13 и допированные фазы Ba5In1.9Y0.1Al2ZrO13, Ba5In2.1Al2Zr0.9O12.95 получены однофазными и характеризовались гексагональной структурой (пространственная группа P63/mmc). Таким образом, оксиды иттрия Y2O3 и индия In2O3 растворяются в исходной матрице с образованием твердых растворов Ba5In1.9Y0.1Al2ZrO13 и Ba5In2.1Al2Zr0.9O12.95. Реакции изовалентного замещения индия иттрием и гетеровалентного замещения циркония на индий можно представить с помощью следующих квазихимических уравнений:
(1)
${{{\text{Y}}}_{{\text{2}}}}{{{\text{O}}}_{3}}\xrightarrow{{{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}2{\text{Y}}_{{{\text{In}}}}^{ \times } + 3{\text{O}}_{{\text{O}}}^{ \times },$(2)
${\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{3}}\xrightarrow{{{\text{Zr}}{{{\text{O}}}_{{\text{2}}}}}}2{\text{In}}_{{{\text{Zr}}}}^{'} + 3{\text{O}}_{{\text{O}}}^{ \times } + {\text{V}}_{{\text{O}}}^{{ \bullet \bullet }},$Рис. 1.
Рентгенограммы образцов Ba5In2Al2ZrO13 (1) [40], Ba5In1.9Y0.1Al2ZrO13 (2), Ba5In1.9Ca0.1Al2ZrO12.95 (3), Ba5In1.9Zr0.1Al2ZrO13.05 (4). Символами указаны пики, соответствующие фазе BaAl2O4.

Образцы составов Ba5In1.9Ca0.1Al2ZrO12.95 и Ba5In1.9Zr0.1Al2ZrO13.05 не были получены однофазными как после проведенных термообработок в интервале 800–1200°C, так и после последующей термообработки на 1425°С. На рентгенограммах наблюдались пики, соответствующие алюминату бария BaAl2O4, а также карбонату кальция CaCO3 для образца Ba5In1.9Ca0.1Al2ZrO12.95 и диоксиду циркония ZrO2 для состава Ba5In1.9Zr0.1Al2ZrO13.05. Таким образом, замещение In3+ на ионы Ca2+ и Zr4+ не реализовалось в условиях проведенного эксперимента. Возможная причина – это значимое различие размеров атомов (${{r}_{{{\text{I}}{{{\text{n}}}^{{3 + }}}}}}$ = 0.80 Å, КЧ = 6, ${{r}_{{{\text{C}}{{{\text{a}}}^{{2 + }}}}}}$ = 1.00 Å, КЧ = 6, ${{r}_{{{\text{Z}}{{{\text{r}}}^{{4 + }}}}}}$ = 0.72 Å, КЧ = 6) [41]. Кроме того, можно предположить, что при допировании матричного соединения цирконием, в соответствии со следующим квазихимическим уравнением:
где ${\text{Zr}}_{{{\text{In}}}}^{ \bullet }$ – катион Zr4+ в позиции трехвалентного индия, – анион кислорода в междоузлии, образование междоузельного кислорода не может быть
реализовано.
– анион кислорода в междоузлии, образование междоузельного кислорода не может быть
реализовано.
Допирование соединения Ba5In2Al2ZrO13 иттрием сопровождалось ростом параметров элементарной ячейки, что коррелирует с соотношением радиусов индия (${{r}_{{{\text{I}}{{{\text{n}}}^{{{\text{3 + }}}}}}}}$ = 0.80 Å, КЧ = 6 [41]) и иттрия (${{r}_{{{{{\text{Y}}}^{{{\text{3 + }}}}}}}}$ = 0.90 Å, КЧ = 6 [41]), параметры элементарной ячейки представлены в табл. 1 в сравнении с In3+-допированной фазой. Пример полнопрофильной обработки рентгенограммы соединения Ba5In1.9Y0.1Al2ZrO13 показан на рис. 2, координаты атомов для фазы Ba5In1.9Y0.1Al2ZrO13 представлены в табл. 2.
Рис. 2.
Экспериментальная, расчетная, а также разностная рентгенограммы и угловые положения рефлексов образца состава Ba5In1.9Y0.1Al2ZrO13.

Таблица 2.
Значения координат атомов и изотропного термического параметра для фазы Ba5In1.9Y0.1Al2ZrO13 (Rp = 3.8, RwP = 4.1, RF = 2.9, χ2 = 2.3)
| Атом | Позиция | x | y | z | B |
|---|---|---|---|---|---|
| Ba(1) | 4e | 0 | 0 | 0.357(8) | 1.03(4) |
| Ba(2) | 2d | 2/3 | 1/3 | 1/4 | 2.87(2) |
| Ba(3) | 4f | 2/3 | 1/3 | 0.545(3) | 0.98(7) |
| In/Al/Y | 4f | 2/3 | 1/3 | 0.398(5) | 0.62(5) |
| Al/In | 4f | 2/3 | 1/3 | 0.809(8) | 1.53(8) |
| Zr | 2a | 0 | 0 | 0 | 0.44(3) |
| O(1) | 12k | 0.491(1) | 0.976(3) | 0.651(6) | 1.96(5) |
| O(2) | 12k | 0.169(7) | 0.342(9) | 0.584(4) | 2.05(9) |
| O(3) | 6h | 0.296(4) | 0.593(7) | 1/4 | 1(1) |
На рис. 3 представлены результаты исследования морфологии поверхности образцов по данным СЭМ. У керамического образца Ba5In1.9Y0.1Al2ZrO13 наблюдались сросшиеся округлые зерна размером 3–5 мкм; зерен иного цвета, формы или размеров не выявлено. У неоднофазных образцов Ba5In1.9Ca0.1Al2ZrO12.95 и Ba5In1.9Zr0.1Al2ZrO13.05 кроме зерен основной фазы наблюдались более светлые кристаллиты иной формы и размером порядка 1 мкм, относящиеся к примесной фазе. Результаты ЭДС показали, что данные кристаллиты характеризуются большим содержанием бария и алюминия и не содержат циркония, из чего можно предположить, что они относятся к алюминату бария, что согласуется с данными рентгенофазового анализа.
Рис. 3.
СЭМ-изображения поверхности керамических образцов Ba5In1.9Y0.1Al2ZrO13 (а), Ba5In1.9Zr0.1Al2ZrO13.05 (б), Ba5In1.9Ca0.1Al2ZrO12.95 (в), а также данные анализа ЭДС для фазы Ba5In1.9Y0.1Al2ZrO13 (г) и примесных фаз образцов Ba5In1.9Zr0.1Al2ZrO13.05 (д) и Ba5In1.9Ca0.1Al2ZrO12.95 (е). Области детектирования показаны крестиком.

Как показано в табл. 3 для однофазного образца Ba5In1.9Y0.1Al2ZrO13, результаты элементного анализа по данным СЭМ достаточно хорошо согласуются с теоретическими.
Природа кислородно-водородных групп
ИК-спектр гидратированного образца Ba5In1.9Y0.1Al2ZrO13 в сравнении с Ba5In2Al2ZrO13 представлен на рис. 4. Спектры соединений имеют схожий вид. В области частот 2500–3700 см–1 на спектрах присутствует широкая несимметричная полоса, что подтверждает присутствие кислородно-водородных групп – данная область частот соответствует валентным колебаниям (υOH) гидроксо-групп. Также на спектрах наблюдается полоса в области частот ~1400 см–1, соответствующая деформационным колебаниям кислородно-водородных групп. По положению полос поглощения в диапазоне деформационных колебаний можно сделать вывод о формах кислородно-водородных группировок в гидратированных соединениях. Полосы поглощения ~1430 см–1 указывают на присутствие в образцах групп M–OH; отсутствие полос в частотах 1600 и 1700 см–1 свидетельствует об отсутствии в образцах молекул воды и ионов H3O+ соответственно. Таким образом, во всех исследуемых соединениях при их гидратации протоны присутствуют в единственной форме – в виде гидроксо-групп OH–.
Следует отметить, что широкая полоса поглощения в области валентных колебаний имеет сложную форму, что связано с присутствием различных энергетически неэквивалентных гидроксо-групп. В общем случае, в области ν(OH) можно выделить три компоненты, как результат присутствия ОН–-групп с различным набором силовых постоянных. Основному максимуму этой полосы соответствует частота ~3360 см–1. Нечетко выраженный максимум ~3550 см–1, проявляющийся как высокочастотное плечо основной полосы, указывает на то, что присутствует некоторое количество ОН–-групп с более короткой длиной связи O–H, образующих слабые водородные связи (относительно свободные или, другими словами, изолированные группы). Также можно выделить максимум с частотой ~2809 см–1, указывающий на наличие OH–-групп с более высокими значениями длины связи O–H, данные гидроксогруппы принимают участие в образовании более сильных водородных связей. На спектрах присутствуют полосы ~1900 см–1, соответствующие смешанным колебаниям, которые для идентификации кислородно-водородных групп не используются. Можно сделать вывод, что замещение индия иттрием не приводит к изменению природы кислородно-водородных групп в гидратированных формах соединений и единственной формой существования протонов в соединениях являются OH–-группы.
Процессы гидратации
ТГ-кривая гидратированного образца Ba5In1.9Y0.1Al2ZrO13 совместно с данными масс-спектроскопии показана на рис. 5. Экспериментальные данные представлены в виде температурной зависимости степени гидратации x(H2O) – количества моль воды на моль исследуемого соединения. По данным масс-спектрометрического анализа доказано, что изменения массы связаны с выделением воды; пиков, соответствующих выделению иных возможных веществ (CO2, O2), не наблюдалось. Таким образом, изменения массы обусловлены процессом дегидратации предварительно гидратированного образца.
Изменение массы наблюдалось в широком температурном диапазоне 25–950°C, при этом наиболее значительное изменение массы происходило в температурном интервале 200–400°C, далее в интервале температур 400–950оC наблюдалось незначительное изменение массы, а при температуре выше 950°C происходила стабилизация массы.
Наличие на кривой ионного тока (H2O) нескольких сигналов, а также на ТГ-кривой нескольких ступеней дегидратации связано с присутствием в структуре гидратированного образца энергетически неэквивалентных ОН–-групп, как результат их различного кристаллографического положения. В целом, можно видеть наличие низкотемпературных (2 эффекта) и высокотемпературных ОН–-групп. Присутствие ОН–-групп в сложном оксиде до столь высоких температур (~900°С) является общим свойством гексагональных перовскитов, что также ранее отмечалось для гидратированного соединения Ba5Er2Al2ZrO13·хН2О [37]. Таким образом, данные термогравиметрического и масс-спектроскопического анализа достаточно хорошо согласуются с данными ИК-спектроскопии.
Как известно, способность к инкорпорированию ОН–-групп в структуру сложного оксида обеспечивается либо присутствием вакансий кислорода, задаваемых акцепторным допированием (примесное разупорядочение), либо наличием незанятых кислородных позиций, т.е., структурных вакансий кислорода (структурное разупорядочение). В обоих случаях происходит увеличение координационного числа полиэдра с участием ОН–-групп в координации катиона. Кроме того, ранее было показано, что для блочно-слоевых структур способность к гидратации (т.е., увеличение координационного числа катиона) обусловлена геометрическими размерами свободного пространства для размещения ОН–-групп в блоке каменной соли [34]. Структуру исследуемого соединения Ba5In2Al2ZrO13 можно представить, как срастание двух блоков кислородно-дефицитной фазы Ba2InAlO5 и одного блока комплектного по кислороду перовскита BaZrO3 [39]. Таким образом, как соединение Ba5In2Al2ZrO13, так и допированная фаза Ba5In1.9Y0.1Al2ZrO13 в виду присутствия в их структуре кислородно-дефицитных блоков потенциально способны к инкорпорированию молекул воды из газовой фазы. Данный процесс можно представить с помощью уравнения:
где ${\text{V}}_{{\text{O}}}^{ \times }$ – структурная вакансия кислорода, $({\text{OH}})_{{\text{O}}}^{ \bullet }$ – гидроксогруппа в позиции кислорода, – атом кислорода в структурной вакансии кислорода.
– атом кислорода в структурной вакансии кислорода.
Экспериментально полученные значения степеней гидратации для Ba5In2Al2ZrO13 составили x(H2O) = 0.30 моль [40] и для допированной фазы Ba5In1.9Y0.1Al2ZrO13 0.39 моль. Как было сказано выше, структуру Ba5In2Al2ZrO13 можно рассматривать как кислород-дефицитную, в которой чередуются слои BaO3 и BaO◻2. Локализация вакансий кислорода в слоях BaO◻2 приводит к тому, что часть атомов бария реализуют полиэдр, состоящий из половины кубооктаэдра, т. е., имеют координационное число 9 [39]. Такой полиэдр легко может быть дополнен атомами кислорода до десятивершинника [39]. Соответственно, можно предполагать, что такая трансформация Ba-полиэдров может реализоваться также и при участии в координации ОН–-групп. Вероятно, эти структурные особенности соединения Ba5In2Al2ZrO13 обуславливают его поведение при гидратации. Для допированной фазы Ba5In1.9Y0.1Al2ZrO13 с бόльшим объемом элементарной ячейки реализуются бόльшие значения степеней гидратации (по сравнению с недопированной фазой). Аналогичные закономерности были ранее описаны для блочно-слоевых фаз Раддлесдена–Поппера BaLaInO4, для которых степень гидратации также зависит от геометрических размеров элементарной ячейки [34]. Для In3+-допированного структурного аналога Ba5In2.1Al2Zr0.9O12.95 присутствие дополнительного количества вакансий кислорода, как результат допирования, обеспечивает несколько более высокие степени гидратации x(H2O) = 0.41 [40].
Таким образом, исходя из полученных данных, можно заключить, что методы изо- и гетеровалентного допирования структур срастания, позволяющие увеличить объем элементарной ячейки, являются перспективной стратегией увеличения степени гидратации, соответственно, концентрации протонов.
Электрические свойства
На рис. 6 представлены типичные годографы импеданса для фазы Ba5In1.9Y0.1Al2ZrO13 в сухом воздухе при различных температурах (а) и при 550°C в сухом и влажном воздухе (б). В целом, вид спектров импеданса при варьировании температуры и парциальных давлений паров воды остается схожим – на годографах в основной области изученных частот наблюдалось два релаксационных процесса, проявляющихся в виде двух перекрывающихся окружностей, также на годографах в области низких частот наблюдался небольшой вклад от третьей полуокружности. На рис. 1а в Дополнительных материалах представлен пример обработки годографа импеданса, а также на рис. 1б представлена зависимость мнимой части Im Z от логарифма частоты переменного тока для доказательства присутствия нескольких релаксационных процессов. Вывод о природе тех или иных релаксационных процессов можно сделать по значениям электрической емкости [42]. Значения емкости, полученные для первой полуокружности, составили ~10–11 Ф, что соответствует объемному вкладу, второй – ~10–10 Ф, что соответствует вкладу границ зерен; значения емкости, соответствующие третьей полуокружности, составили ~10–6 Ф, что характерно для электродных процессов. Как видно, вклад границ зерен небольшой в сравнении с объемным вкладом. Стоит отметить, что для других перовскитов с гексагональной структурой также наблюдались небольшие или сопоставимые с объемом сопротивления границ зерен [43, 44]. Далее при расчетах значений электропроводности использовались значения объемного сопротивления, полученные при экстраполяции соответствующей полуокружности на ось абсцисс (обработка в программе ZView).
Рис. 6.
Годографы импеданса образца Ba5In1.9Y0.1Al2ZrO13 в сухом воздухе при разных температурах (а) и при температуре 550°С в сухом (pH2О = 3.5 × 10–5 атм) и влажном (pH2О = 1.92 × 10–2 атм) воздухе (б) в сравнении.

Значения удельной электропроводности σ были рассчитаны по известной формуле:
где l – это толщина образца, S – площадь поперечного сечения образца и Rоб – величина объемного сопротивления образца. Температурные зависимости электропроводности недопированной фазы Ba5In2Al2ZrO13 [40] и Y3+-допированного образца Ba5In1.9Y0.1Al2ZrO13 в атмосферах с различным содержанием паров воды представлены на рис. 7. Во всем исследуемом температурном интервале значения электропроводности, полученные в атмосфере влажного воздуха, были выше, чем в атмосфере сухого. Разница в значениях проводимости, полученных в разных по влажности атмосферах, увеличивалась с уменьшением температуры. При температуре 400°C различия достигают порядка величины и увеличиваются до 1.7 порядка при 250°С, энергия активации электропроводности уменьшалась с 0.65 до 0.30 эВ.Рис. 7.
Температурные зависимости общей электропроводности фаз Ba5In2Al2ZrO13 [40] (а) и Ba5In1.9Y0.1Al2ZrO13 (б) в сухом (pH2О = 3.5 × 10–5 атм) и влажном (pH2О = 1.92 × 10–2 атм) воздухе.

В табл. 4 приведены значения энергии активации в различных атмосферах, рассчитанные по уравнению Френкеля:
где A – это предэкспоненциальный множитель, k – постоянная Больцмана, T – абсолютная температура.Таблица 4.
Значения энергии активации общей электропроводности для фаз Ba5In2Al2ZrO13 и Ba5In1.9Y0.1Al2ZrO13
| Соединение | Eа, эВ | Eа, эВ | ||
|---|---|---|---|---|
| сухой воздух | влажный воздух | |||
| 250–500°C | 700–900°C | 250–500°C | 700–900°C | |
| Ba5In2Al2ZrO13 | 0.67 | 0.92 | 0.33 | 0.68 |
| Ba5In1.9Y0.1Al2ZrO13 | 0.63 | 0.87 | 0.37 | 0.66 |
При температуре выше 850°C разница в значениях электропроводности в сухом и влажном воздухе становится незначительной. Такое поведение проводимости во влажной атмосфере является типичным при появлении протонных носителей заряда, вклад которых в величину общей электропроводности возрастает с понижением температуры.
На рис. 8 представлено сравнение температурных зависимостей электропроводностей в сухом (а) и во влажном (б) воздухе для соединений Ba5In2Al2ZrO13 [40], Ba5In2.1Al2Zr0.9O12.95 [40] и Ba5In1.9Y0.1Al2ZrO13. Как видно, допированный иттрием образец в сухом воздухе демонстрирует более низкие значения проводимости, чем матричное соединение и допированная индием фаза. При температуре выше 700°C значения проводимости для Ba5In1.9Y0.1Al2ZrO13 и недопированной фазы становятся сопоставимыми, однако они не превосходили значения проводимости для акцепторно-допированного состава Ba5In2.1Al2Zr0.9O12.95. Во влажном воздухе ниже 500°C значения проводимости увеличивались в ряду Ba5In1.9Y0.1Al2ZrO13–Ba5In2Al2ZrO13–Ba5In2.1Al2Zr0.9O12.95. Стоит, однако, отметить, что разница в значениях проводимости в сухом и влажном воздухе для фаз Ba5In1.9Y0.1Al2ZrO13 и Ba5In2.1Al2Zr0.9O12.95 была примерно одинаковой и была выше, чем для недопированного соединения.
Поскольку известно, что для блочных структур на воздухе может реализоваться вклад дырочной проводимости [40], то для разделения общей проводимости на парциальные вклады были проведены измерения проводимости в широком интервале парциальных давлений кислорода. На рис. 9 представлены изотермы проводимости фазы Ba5In1.9Y0.1Al2ZrO13 в сухой (рис. 9а) и влажной (рис. 9б) атмосферах, а также их эволюция при смене влажности (рис. 9в).
Рис. 9.
Зависимости электропроводности от парциального давления кислорода фазы Ba5In1.9Y0.1Al2ZrO13 в сухой (pH2О = 3.5 × 10–5 атм) (а) и влажной (pH2О = 1.92 × 10–2 атм) (б) атмосферах, а также сравнение изотерм в сухой и влажной атмосферах при 500оС (в).

Из рис. 9 видно, что в интервале парциальных давлений кислорода 10–4–0.21 атм с увеличением рО2 происходит увеличение значений электропроводности. Это подтверждает наличие вклада дырочной проводимости σh. Образование дырок связано с процессом инкорпорирования кислорода из газовой фазы в структурные вакансии кислорода, присутствующие в Ba5In1.9Y0.1Al2ZrO13; данный процесс можно представить уравнением:
(7)
${\text{V}}_{{\text{O}}}^{ \times } + \frac{1}{2}{{{\text{O}}}_{2}} \leftrightarrow 2{{h}^{\centerdot }} + {\text{O}}_{{{{{\text{V}}}_{{\text{O}}}}}}^{{''}},$С изменением температуры общий вид зависимостей остается схожим, небольшие изменения происходят в области высоких парциальных давлений кислорода. С понижением температуры наклон зависимости в интервале парциальных давлений кислорода 0.21–10–4 атм уменьшается, и зависимость приобретает более пологий вид, из чего можно сделать вывод о росте вклада ионной проводимости. Во влажной атмосфере значения проводимостей значительно превышают проводимость в сухих условиях (рис. 9в), наибольшие различия реализуются в области плато, что связано с появлением дополнительного вклада протонной проводимости.
На основании полученных экспериментальных данных были определены значения кислород-ионной проводимости ${{\sigma }_{{{{{\text{O}}}^{{2--}}}}}}$ (${{\sigma }_{{{{{\text{O}}}^{{2--}}}}}} = \sigma _{{{\text{плато}}}}^{{{\text{сух}}}}$). Значения кислород-ионной проводимости исследуемой фазы в сравнении с Ba5In2Al2ZrO13 и Ba5In2.1Al2Zr0.9O12.95 представлены на рис. 10.
В целом, можно видеть, что значимого различия кислород-ионной проводимости исследованных фаз не наблюдается, в низких температурах различия составляют 0.2 порядка величины. Небольшое увеличение проводимости In3+-допированного образца (~ в 1.3 раза) может быть результатом увеличения концентрации вакансий кислорода. Таким образом, на воздухе (рО2 = 0.21 атм) значимое различие общих проводимостей исследованных фаз (рис. 8а) обусловлено разным вкладом дырочной проводимости.
На рис. 11 представлены в сравнении температурные зависимости протонных проводимостей недопированной фазы Ba5In2Al2ZrO13 и Y3+, In3+-допированных структурных аналогов. Значения протонной проводимости для соединения Ba5In1.9Y0.1Al2ZrO13 были получены как разность величин электропроводности во влажной и сухой атмосферах в области плато на зависимостях электропроводности от парциальных давлений кислорода (${{\sigma }_{{\text{Н}}}} = \sigma _{{{\text{плато}}}}^{{{\text{влажн}}}} - \sigma _{{{\text{плато}}}}^{{{\text{сух}}}}$). Как видно, значения протонной проводимости для всех фаз близки, для допированных фаз Ba5In1.9Y0.1Al2ZrO13 и Ba5In2.1Al2Zr0.9O12.95 значения σH выше, чем для матричной фазы в 1.5 раза (рис. 11). В процессе исследования гидратации образцов было установлено, что степень гидратации и, следовательно, концентрация протонов для допированных фаз Ba5In1.9Y0.1Al2ZrO13 и Ba5In2.1Al2Zr0.9O12.95 выше, чем у Ba5In2Al2ZrO13. Соответственно, бόльшие значения протонной проводимости допированных фаз могут быть обусловлены более высокими концентрациями протонов.
Рис. 11.
Температурные зависимости протонной проводимости для фаз Ba5In2Al2ZrO13, Ba5In2.1Al2Zr0.9O12.95 и Ba5In1.9Y0.1Al2ZrO13 (pH2О = = 1.92 × 10–2 атм).

Значения подвижности протонов были рассчитаны из уравнения:
где σH – протонная проводимость, Ze – абсолютная величина эффективного заряда носителя (Z = 1), CH – объемная концентрация протонов, μH – подвижность протонов. Как следует из уравнения (8), значение проводимости прямо пропорционально концентрации носителей заряда и их подвижности. Расчеты показали, что подвижности протонов допированных фаз и матричной фазы сопоставимы. Иначе говоря, действительно, основное изменение протонной проводимости исследованных фаз обусловлено бόльшими концентрациями протонов в допированных фазах. Таким образом, установленные закономерности ионного транспорта согласуются с полученными ранее для классических допированных перовскитов АВО3 – δ. Как известно [45, 46], протоны в сложных оксидах локализируются на атомах кислорода, и их миграция происходит посредством перескокового, термически активированного процесса от одного атома кислорода к другому. Поэтому динамика кислородной подрешетки определяет подвижность протонов. Как было показано, кислород-ионная проводимость исследованных фаз сопоставима (рис. 10), соответственно, подвижности протонов в этих фазах тоже близки.На рис. 12 представлено сравнение подвижности протонов для исследованной фазы Ba5In1.9Y0.1Al2ZrO13 и разных классов сложных оксидов. Как видно, различия протонной подвижностей разных материалов достигают нескольких порядков, в то время как концентрации протонов для этих соединений являются однопорядковыми величинами. Столь значимые различия подвижностей протонов, как известно [12], определяются многочисленными факторами, но в общем случае – как структурными особенностями сложных оксидов (тип структуры, симметрия ячейки), так и самой природой элементов.
Наибольшие подвижности протонов реализуются в допированных перовскитах на основе цератов и цирконатов бария, несколько меньшие значения – для фаз на основе перовскитов LaВ3+О3. Небольшие значения подвижности протонов типичны для фаз со структурой Раддлесдена–Поппера (BaLaInO4 и структурные аналоги). Для исследуемых гексагональных перовскитов (представлено на примере Ba5In1.9Y0.1Al2ZrO13) реализуются средние значения подвижности протонов относительно представленных материалов. Можно предполагать, что поиск оптимальной допирующей добавки и ее концентрации позволит значимо увеличить величину протонной проводимости гексагональных перовскитов. Эти результаты показывают необходимость в расширении знаний о протонной подвижности, как параметра, определяющего величину протонной проводимости.
Для исследуемых гексагональных перовскитов был произведен расчет кислород-ионных чисел переноса ${{t}_{{{{{\text{O}}}^{{2 - }}}}}}$ по формуле:
(9)
${{t}_{{{{{\text{O}}}^{{2--}}}}}} = \frac{{{{\sigma }_{{{{{\text{O}}}^{{2--}}}}}}}}{{{{\sigma }_{{{\text{общ}}}}}}},$(10)
${\text{V}}_{{\text{O}}}^{{ \bullet \bullet }} + \frac{1}{2}{{{\text{O}}}_{2}} \leftrightarrow 2{{h}^{ \bullet }} + {\text{O}}_{{\text{O}}}^{ \times },$Расчет протонных чисел переноса проводили по формуле:
(11)
${{t}_{{{{{\text{H}}}^{ + }}}}} = \frac{{{{\sigma }_{{{{{\text{H}}}^{ + }}}}}}}{{{{\sigma }_{{{\text{общ}}}}}}},$В заключение можно отметить, что системы на основе гексагонального перовскита Ba5In2Al2ZrO13 являются перспективными протонными проводниками. Соответствующее допирование позволяет увеличить протонную проводимость. Дальнейшее изучение процессов влияния гомо- и гетеровалентного допирования на транспортные свойства, а также изучение концентрационных зависимостей может способствовать оптимизации протонного транспорта.
ЗАКЛЮЧЕНИЕ
Твердофазным методом получен гексагональный перовскит Ba5In1.9Y0.1Al2ZrO13, введение иттрия в индиевую подрешетку приводило к увеличению параметров элементарной ячейки (a = = 5.971(4) Å, с = 24.012(1) Å) по сравнению с недопированной фазой Ba5In2Al2ZrO13 (a = 5.967(2) Å, с = 24.006(8) Å). Образцы при замещении In3+ на Ca2+ или Zr4+, соответственно, Ba5In1.9Ca0.1Al2ZrO12.95 и Ba5In1.9Zr0.1Al2ZrO13.05, не удалось получить однофазными. Было установлено, что исследуемая фаза Ba5In1.9Y0.1Al2ZrO13 способна к диссоциативному поглощению молекул воды из газовой фазы; степень гидратации составила x(H2O) = 0.39 моль. Методом ИК-спектроскопии было установлено, что протоны существуют в виде OH–-групп. Фаза Ba5In1.9Y0.1Al2ZrO13 способна к проявлению протонной проводимости в атмосферах с высокими парциальными давлениями паров воды (pH2О = = 1.92 × 10–2 атм), ниже 600°С протонный перенос становится доминирующим. Таким образом, при замещении индия на иттрий, по сравнению с недопированным соединением, значимого изменения кислород-ионной проводимости не происходило, но уменьшалась доля дырочной проводимости, наблюдалось увеличение степени гидратации и, как следствие, увеличение протонной проводимости.
Список литературы
Takahashi, T. and Iwahara, H., Solid-state ionics: Protonic conduction in perovskite-type oxide solid solution, Rev. Chem. Mineral, 1980, vol. 17, no. 4, p. 243.
Iwahara, H., Esaka, T., Uchida, H., and Maeda, N., Proton conduction in sintered oxides and its application to steam electrolysis for hydrogen production, Solid State Ionics, 1981, vol. 3, no. 4, p. 359.
Uchida, H., Maeda, N., and Iwahara H., Relation between proton and hole conduction in SrCeO3-based solid electrolytes under water containing atmospheres at high temperatures, Solid State Ionics, 1983, vol. 11, no. 2, p. 117.
Iwahara, H., Proton-conducting ceramics, Ceram. Jap., 1983, vol. 18, no. 10, p. 855.
Norby, T., Advances in proton ceramic fuel cells, steam electrolyzers, and dehydrogenation reactors based on materials and process optimizations, ECS Transactions, 2017, vol. 80, no. 9, p. 23.
Medvedev, D., Lyagaeva, J., Gorbova, E., Demin, A., and Tsiakaras, P., Advanced materials for SOFC application: Strategies for the development of highly conductive and stable solid oxide proton electrolytes, B: Progress in Mater. Sci., 2016, vol. 75, p. 38.
Medvedev, D. and Ricote, S., Electrochemistry of proton-conducting ceramic materials and cells, B: J. Solid State Electrochem., 2020, vol. 24, no. 7, p. 1445.
Xi, X. and Lei, B., Intermediate Temperature Solid Oxide Fuel Cells, Elsevier, 2020. p. 81.
Tarancón, A., Strategies for Lowering Solid Oxide Fuel Cells Operating Temperature, Energies, 2009, vol. 2, p. 1130.
Medvedev, D., Trends in research and development of protonic ceramic electrolysis cells, Intern. J. Hydrogen Energy, 2019, vol. 44, no. 49, p. 26711.
Стенина, И.А., Ярославцев, А.Б. Высокотемпературные и композиционные протонпроводящие электролиты. Неорган. материалы. 2017. № 53(4). С. 335. [Stenina, I.A. and Yaroslavtsev, A.B., High-temperature and composite proton conducting electrolytes, Neorgan. mater. (in Russian), 2017, no. 53(4), p. 335.]
Haugsrud, R., High Temperature Proton Conductors – Fundamentals and Functionalities, Diffusion Foundations, 2016, vol. 8, p. 31.
Kim, J., Sengodan, S., Kim, S., Kwon, O., Bud, Y., and Kim, G., Proton conducting oxides: A review of materials and applications for renewable energy conversion and storage. Renewable and Sustainable Energy Rev., 2019, vol. 109, p. 606.
Kochetova, N., Animitsa, I., Medvedev, D., Demin, A., and Tsiakaras, P., Recent activity in the development of proton-conducting oxides for high-temperature applications, RSC Advances, 2016, vol. 6, p. 73222.
Nomura, K., Takeuchi, T., Kamo, Sh., Kageyama H., and Miyazaki, Y., Proton conduction in doped LaScO3 perovskites, Solid State Ionics, 2004, vol. 175, p. 553.
Zhao, G., Suzuki, K., Hirayama, M., and Kanno, R., Syntheses and characterization of novel perovskite-type LaScO3-based lithium ionic conductors, Molecules, 2021, vol. 26, p. 299.
Kuzmin, A.V., Stroeva, A.Yu., Gorelov, V.P., Novikova, Yu.V., Lesnichyova, A.S., Farlenkov, A.S., and Khodimchuk, A.V., Synthesis and characterization of dense proton-conducting La1 –xSrxScO3 – α ceramics, Intern. J. Hydrogen Energy, 2019, vol. 44, p. 1130.
Kuzmin, A.V., Lesnichyova, A.S., Tropin, E.S., Stroeva, A.Yu., Vorotnikov, V.A., Solodyankina, D.M., Belyakov, S.A., Plekhanov, M.S., Farlenkov, A.S., Osinkin, D.A., Beresnev, S.M., and Ananyev, M.V., LaScO3-based electrolyte for protonic ceramic fuel cells: Influence of sintering additives on the transport properties and electrochemical performance, J. Power Sources, 2020, vol. 466, p. 228255.
Касьянова, А.В., Руденко, А.О., Лягаева, Ю.Г., Медведев, Д.А. Лантансодержащие протонные электролиты со структурой перовскита. В: Мембраны и мембр. технологии. 2021. № 11 (2). С. 83. [Kasyanova, A.V., Rudenko, A.O., Lyagaeva, Y.G., and Medvedev, D.A., Lanthanum-containing proton electrolytes with perovskite structure, V: Membrani i membr. technologii (in Russian), 2021, no. 11(2), p. 83.]
Magrasó, A., Polfus, J., Frontera, C., Canales-Vázquez, J., Kalland, L., Hervoches, C., Erdal, S., Hancke, R., Islam, M., Norby, T., and Haugsrud, R., Complete structural model for lanthanum tungstate: a chemically stable high temperature proton conductor by means of intrinsic defects, J. Mater. Chem., 2012, vol. 22, no. 5, p. 1762.
Haugsrud, R. and Norby, T., High-temperature proton conductivity in acceptor-doped LaNbO4, Solid State Ionics, 2006, vol. 177, no. 13–14, p. 1129.
Huse, M., Norby, T., and Haugsrud, R., Effects of A and B site acceptor doping on hydration and proton mobility of LaNbO4, Intern. J. Hydrogen Energy, 2012, vol. 37, no. 9, p. 8004.
Besikiotis, V., Knee, C. S., Ahmed, I., Haugsrud, R., and Norby, T., Crystal structure, hydration and ionic conductivity of the inherently oxygen-deficient La2Ce2O7, Solid State Ionics, 2012, vol. 228, p. 1.
Tu, T., Zhang, B., Liu, J., Wu, K., and Peng, K., Synthesis and conductivity behavior of Mo-doped La2Ce2O7 proton conductors, Electrochim. Acta, 2018, vol. 283, p. 1366.
Zhu, Z., Liu, B., Shen, J., Lou, Y., and Ji, Y., La2Ce2O7: A promising proton ceramic conductor in hydrogen economy, J. Alloys and Compounds, 2016, vol. 659, p. 232.
Omata, T., Okuda, K., Tsugimoto, S., and Otsuka-Matsuo-Yao, S., Water and hydrogen evolution properties and protonic conducting behaviors of Ca2+-doped La2Zr2O7 with a pyrochlore structure, Solid State Ionics, 1997, vol. 104, p. 249.
Eurenius, K., Proton conductivity in acceptor-doped lanthanide based pyrochlore oxides, Thesis for the degree of doctor of philosophy, University of Gothenburg Gothenburg, Sweden, 2009.
Shlyakhtina, A., Lyskov, N., Nikiforova, G., Kasyanova, A., Vorobieva, G., Kolbanev, I., Stolbov, D., and Medvedev, D., Proton Conductivity of La2(Hf2 –xLax)O7 –x/2 “Stuffed” Pyrochlores, B: Appl. Sci., 2022, vol. 12, no. 9, p. 4342.
Haugsrud, R., Defects and transport properties in Ln6WO12 (Ln = La, Nd, Gd, Er), Solid State Ionics, 2007, vol. 178, p. 555.
Haugsrud, R. and Norby, T., Proton conduction in rare-earth ortho-niobates and ortho-tantalates, Nature Mater., 2006, vol. 5, no. 3, p. 193.
Solís, C., Navarrete, L., Roitsch, S., and Serra, J., Electrochemical properties of composite fuel cell cathodes for La5.5WO12 – δ proton conducting electrolytes, J. Mater. Chem., 2012, vol. 22, no. 31, p. 16051.
Zhou, Y., Shiraiwa, M., Nagao, M., Fujii, K., Tanaka, I., Yashima, M., Baque, L., Basbus, J., Mogni, L., and Skinner, S., Protonic Conduction in the BaNdInO4 Structure Achieved by Acceptor Doping, Chem. Mater., 2021, vol. 33, p. 2139.
Tarasova, N., Animitsa, I., Galisheva, A., and Korona, D., Incorporation and Conduction of Protons in Ca, Sr, Ba-Doped BaLaInO4 with Ruddlesden–Popper Structure, Materials, 2019, vol. 12, no. 10, p. 1668.
Tarasova, N. and Animitsa, I., Materials AIILnInO4 with Ruddlesden-Popper Structure for Electrochemical Applications: Relationship between Ion (Oxygen-Ion, Proton) Conductivity, Water Uptake, and Structural changes, Materials, 2022, vol. 15, no. 1, p. 114.
Yashima, M., Tsujiguchi, T., Sakuda, Y., Yasui, Y., Zhou, Y., Fujii, K., Torii, S., Kamiyama, T., and Skinner, S., High oxide-ion conductivity through the interstitial oxygen site in Ba7Nb4MoO20-based hexagonal perovskite related oxides, Nature Commun., 2021, vol. 12, no. 1, p. 1.
Fop, S., McCombie, K., Wildman, E., Skakle, J., Irvine, J., Connor, P., Savaniu, C., Ritter, C., and Mclaughlin, A., High oxide ion and proton conductivity in a disordered hexagonal perovskite, Nature Mater, 2020, vol. 19, p. 752.
Murakami, T., Hester, J., and Yashima, M., High Proton Conductivity in Ba5Er2Al2ZrO13, a Hexagonal Perovskite-Related Oxide with intrinsically Oxygen-Deficient Layers, J. Amer. Chem. Soc., 2020, vol. 142, p. 11653.
Fop, S., Solid oxide proton conductors beyond perovskites, J. Mater. Chem. A, 2021, vol. 9, p. 18836.
Shpanchenko, R., Abakumov, A., Antipov, E., and Kovba, L., Crystal structure of Ba5In2Al2ZrO13, J. Alloy. Compd., 1994, vol. 206, p. 185.
Andreev, R., Korona, D., Anokhina, I., and Animitsa, I., Proton and Oxygen-Ion Conductivities of Hexagonal Perovskite Ba5In2Al2ZrO13, Materials, 2022, vol. 15, no. 11, p. 3944.
Shannon, R., Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides, Acta Crystallogr. Sect. A Cryst. Phys. Diffr. Theor. Gen. Crystallogr., 1976, vol. 32, p. 751.
Irvine, J., Sinclair, D., and West, A., Electroceramics: Characterization by Impedance Spectroscopy, Adv. Mater., 1990, vol. 2, p. 132.
Huang, W., Ding, Y., Li, Y., and Wang, Z., Proton conductivity and transport number of complex perovskite barium strontium tantalite, Ceram. Intern., 2021, vol. 47, no. 2, p. 2517.
Fop, S., McCombie, K., Smith, R., and Mclaughlin, A., Enhanced Oxygen Ion Conductivity and Mechanistic Understanding in Ba3Nb1 –xVxMoO8.5, Chem. Mater., 2020, vol. 32, no. 11, p. 4724.
Iwahara, H., High temperature protonic conduction based on perovsike-type oxides, ISSI Letters, 1992, vol. 2, no. 3, p. 11.
Munch, W., Seifert, G., Kreuer, K.D., and Maier, J., A quantum molecular dynamics study of proton conduction phenomena in BaCeO3, Solid State Ionics, 1996, vol. 86, p. 647.
Kreuer, K., Dippel, Th., Baikov, Yu., and Maier, J., Water solubility, proton and oxygen diffusion in acceptor doped BaCeO3: A single crystal analysis, Solid State Ionics, 1996, vol. 86, p. 613.
Kreuer, K., Adams, S., Fuchs, W., Klock, U., and Maier, J., Proton conducting alkaline earth zirconates and titanates for high drain electrochemical applications, Solid State Ionics, 2001, vol. 145, p. 295.
Tarasova, N., Galisheva, A., Animitsa, I., Korona, D., and Davletbaev, K., Novel proton-conducting layered perovskite based on BaLaInO4 with two different cations in B-sublattice: Synthesis, hydration, ionic (O2–, H+) conductivity, Intern. J. Hydrogen Energy, 2022, vol. 47, no. 44, p. 18972.
Okuyama, Y., Kozai, T., Ikeda, Sh., Matsuka, M., Sakai, T., and Matsumoto, H., Incorporation and conduction of proton in Sr-doped LaMO3 (M = Al, Sc, In, Yb, Y), Electrochim. Acta, 2014, vol. 125, p. 443.
Дополнительные материалы
- скачать ESM.doc
- Приложение 1.
Рис. 1. Пример обработки экспериментальных данных соединения Ba5In1.9Y0.1Al2ZrO13 при температуре 385°С в сухом воздухе, полученных импедансной спектроскопией, и соответствующая эквивалентная схема