Координационная химия, 2023, T. 49, № 3, стр. 163-173
Синтез, строение и свойства комплексов Cu(II), Ni(II), Co(II), Zn(II), Pd(II) с (4Z)-4-[(2-фурилметиламино)метилен]-5-метил-2-фенилпиразол-3-оном
В. Г. Власенко 1, *, А. С. Бурлов 2, М. С. Милутка 2, Ю. В. Кощиенко 2, А. И. Ураев 2, В. А. Лазаренко 3, Н. И. Макарова 2, А. В. Метелица 2, А. А. Зубенко 4, Д. А. Гарновский 5
1 НИИ физики Южного федерального университета
Ростов-на-Дону, Россия
2 НИИ физической и органической химии Южного федерального университета
Ростов-на-Дону, Россия
3 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
4 Северо-Кавказский зональный научно-исследовательский ветеринарный институт
Новочеркасск, Россия
5 Южный научный центр РАН
Ростов-на-Дону, Россия
* E-mail: v_vlasenko@rambler.ru
Поступила в редакцию 10.06.2022
После доработки 25.08.2022
Принята к публикации 31.08.2022
- EDN: BNPJEG
- DOI: 10.31857/S0132344X22600217
Аннотация
Синтезированы (4Z)-4-[(2-фурилметиламино)метилен]-5-метил-2-фенилпиразол-3-он (HL) и его комплексы Cu(II), Ni(II), Co(II), Zn(II), Pd(II) состава ML2. Строение комплексов изучено методами C,H,N-элементного анализа, ИК-спектроскопии, магнетохимических измерений и квантовой химии. Кристаллическая структура комплексов меди(II) и кобальта(II) определена методом РСА (CCDC № 2177619, 2177622 соответственно). Показано, что два депротонированных лиганда хелатно координированы к ионам металла атомом азота иминогруппы и кислорода гидроксильной группы лиганда. Геометрия окружения иона меди(II) соответствует искаженному плоскому квадрату, тогда как ион кобальта(II) находится в искаженном тетраэдрическом окружении. В ряду изученных соединений в случае комплекса Zn(II) в растворе CH2Cl2 наблюдалась флуоресценция с максимумом при 431 нм и квантовым выходом 0.29. Полученные енамин и комплексы металлов были исследованы на антибактериальную, протистоцидную и фунгистатическую активности. Показано, что все соединения не обладали фунгистатической и антибактериальной активностью, и только слабая процистоидная активность фиксировалась для комплексов меди и цинка.
Производные пиразола представляют собой огромный класс соединений, которые до настоящего времени являются предметом обширных исследований [1–10]. Большое внимание к этим соединениям обусловлено, прежде всего, их практической значимостью для медицины, ветеринарии и сельского хозяйства, так как они проявляют разнообразную биологическую активность. Производные пиразола обладают жаропонижающими и болеутоляющими свойствами [11–13], противораковыми [14, 15], антибактериальными [16], антимикробными [17] свойствами и входят в состав хорошо апробированных лекарственных препаратов (например, Целебрекс®, Виагра®).
Кроме биологических и фармацевтических приложений известно применение комплексов металлов на основе производных пиразола в качестве люминесцентных материалов. Получение новых соединений, излучающих в синей области спектра и обладающих набором характеристик (монохроматичность, высокая фотостабильность, высокая яркость и др.) для их использования в качестве активных излучающих слоев в OLED, остается важной насущной проблемой. С этой целью были получены комплексы цинка с пиразолсодержащими лигандами, которые продемонстрировали в качестве эмиттеров в OLED высокую яркость и эффективность люминесценции [18–23]. Также в последнее время появились примеры создания OLED-устройств, излучающих в инфракрасной области спектра, на основе комплексов редкоземельных элементов с пиразолсодержащими лигандами [24].
Синтетическое манипулирование и функционализация пиразольного каркаса способствует получению большого числа разнообразных типов координационных узлов [25–27], что позволяет проследить изменения многих физико-химических свойств указанных соединений в зависимости от их состава и структуры.
С этой целью, в продолжение наших предыдущих исследований структуры, спектральных и биологических свойств комплексов переходных металлов [1–10, 28–31], в настоящей работе мы сообщаем о синтезе, кристаллическом строении, спектральных свойствах нового пиразолсодержащего основания Шиффа (4Z)-4-[(2-фурилметиламино)метилен]-5-метил-2-фенилпиразол-3-она (HL), комплексов Cu (Ia), Ni (Iб), Co (Iв), Zn (Iг), Pd (Iд) на его основе. Полученные соединения были исследованы также на антибактериальную, протистоцидную и фунгистатическую активности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали коммерчески доступные растворители (бензол, метанол, хлористый метилен), 2-(аминометил)фуран (≥99%), моногидрат ацетата меди (≥98%), тетрагидрат ацетата никеля (98%), тетрагидрат ацетата кобальта (≥98%), дигидрат ацетата цинка (≥98%), ацетат палладия (98%) (Alfa Aesar) без предварительной очистки. 5-Гидрокси-3-метил-1-фенилпиразол-4-карбальдегид получали по методикам [32, 33].
Синтез HL. К раствору 2.02 г (10 ммоль) 5-гидрокси-3-метил-1-фенилпиразол-4-карбальдегида в 10 мл бензола прибавляли раствор 0.97 г (10 ммоль) 2-(аминометил)фурана в 10 мл бензола. Смесь кипятили с насадкой Дина-Старка в течение 2 ч до полного отделения воды, охлаждали, добавляли 5 мл метанола. Выпавший осадок HL отфильтровывали и перекристаллизовывали из смеси метанол : хлористый метилен (2 : 1). Белый порошок. Выход 2.40 г (87%).
ИК-спектр (ν, см–1): 3219 (NH), 3160 (CH2 метилфуран), 1681, 1667 (C=O), 1633, 1621, 1595, 1538, 1500, 1486, 1462, 1432, 1366, 1353, 1338, 1305, 1279, 1264, 1202, 1158, 1117, 1082, 1009, 991, 920, 820, 791, 757, 744, 694, 665, 625, 597, 567. Спектр ЯМР 1Н (DMSO-d6; δ, м.д.): 2.17 (c., 3H, CH3), 4.67 (д., J = 5.1 Гц, 2H, CH2), 6.42 (д., J = 3.0 Гц, 1H, ${\text{H}}_{{{\text{фурил}}}}^{{\text{3}}}$), 6.46 (т., J = 2.4 Гц, 1H, ${\text{H}}_{{{\text{фурил}}}}^{{\text{4}}}$), 7.08 (т., J = = 7.4 Гц, 1H, ${\text{H}}_{{{\text{фенил}}}}^{{\text{4}}}$), 7.35 (т., J = 7.8 Гц, 2H, H3 и ${\text{H}}_{{{\text{фенил}}}}^{{\text{5}}}$), 7.68 (с., 1H, ${\text{H}}_{{{\text{фурил}}}}^{{\text{5}}}$), 7.97 (д., J = 7.8 Гц, 2H, H2 и ${\text{H}}_{{{\text{фенил}}}}^{6}$), 8.10 (д., J = 13.8 Гц, 1H, CH–NH), 9.74–9.78 (м., 1H, CH–NH),
Синтез комплексов Iа–Iд. К раствору 0.56 г (2 ммоль) лиганда HL в смеси 10 мл метанола и 5 мл хлористого метилена прибавляли растворы: 0.20 г (1 ммоль) моногидрата ацетата меди, 0.25 г (1 ммоль) тетрагидрата ацетата никеля, 0.25 г (1 ммоль) тетрагидрата ацетата кобальта, 0.22 г (1 ммоль) дигидрата ацетата цинка, 0.25 г (1 ммоль) ацетата палладия, соответственно, в 10 мл метанола. Смесь кипятили в течение 2 ч. Выпавшие по охлаждении осадки комплексов отфильтровывали, промывали метанолом, перекристаллизовывали из смеси метанол–хлористый метилен (2 : 1) и высушивали в вакуумном сушильном шкафу при 100°С.
Кристаллы комплексов, пригодные для РСА, выращивали из смеси метанол : хлористый метилен (2 : 1).
Бис{[4-[(E)-2-фурилметилиминометил]-5-метил-2-фенилпиразол-3-ил]окси}медь(II) (Iа). Коричневые кристаллы, выход 0.50 г (81%), Тпл = 225–226°С.
| Найдено, %: | С 61.62; | H 4.59; | N 13.51; | Cu 10.25. |
| Для С32H28N6O4Cu | ||||
| вычислено, %: | С 61.58; | H 4.52; | N 13.47; | Cu 10.18. |
ИК-спектр (ν, см–1): 3140 (CH2 метилфуран), 1626 (CH=N), 1596, 1543, 1525, 1502, 1491, 1458, 1441, 1399, 1374, 1333, 1256, 1219, 1188, 1147, 1120, 1091, 1031, 1012, 905, 883, 816, 758, 734, 696, 650, 613, 597. µэфф = 2.10 µB (294 K).
Бис{[4-[(E)-2-фурилметилиминометил]-5-метил-2-фенилпиразол-3-ил]окси}никель(II) (Iб). Зеленые кристаллы, выход 0.47 г (76%), Тпл = 155–156°С.
| Найдено, %: | С 61.11; | H 4.62; | N 13.69; | Ni 9.54. |
| Для С32H28N6O4Ni | ||||
| вычислено, %: | С 61.06; | H 4.56; | N 13.57; | Ni 9.48. |
ИК-спектр (ν, см–1): 3145 (CH2 метилфуран), 1633 (CH=N), 1598, 1549, 1531, 1504, 1465, 1374, 1315, 1183, 1148, 1087, 1013, 900, 821, 757, 731, 693, 623. µэфф = 3.12 µB (294 K).
Бис{[4-[(E)-2-фурилметилиминометил]-5-метил-2-фенилпиразол-3-ил]окси}кобальт(II) (Iв). Красно-коричневые кристаллы, выход 0.50 г (81%), Тпл = 201–202°С.
| Найдено %: | С 62.17; | H 4.61; | N 13.50; | Co 9.60. |
| Для С32H28N6O4Co | ||||
| вычислено, %: | С 62.04; | H 4.56; | N 13.57; | Co 9.51. |
ИК-спектр (ν, см–1): 3144 (CH2 метилфуран), 1621 (CH=N), 1596, 1586, 1531, 1501, 1456, 1372, 1260, 1190, 1145, 1120, 1034, 1011, 1003, 908, 885, 812, 753, 738, 693, 649, 612, 600, 567. µэфф = 4.26 µB (294 K).
Бис{[4-[(E)-2-фурилметилиминометил]-5-метил-2-фенилпиразол-3-ил]окси}цинк(II) (Iг). Белые кристаллы, выход 0.54 г (86%), Тпл > 300°С.
| Найдено, %: | С 61.48; | H 4.59; | N 13.50; | Zn 10.52. |
| Для С32H28N6O4Zn | ||||
| вычислено, %: | С 61.40; | H 4.51; | N 13.43; | Zn 10.44. |
ИК-спектр (ν, см–1): 3111 (CH2 метилфуран), 1633 (CH=N), 1620, 1597, 1584, 1500, 1489, 1456, 1388, 1371, 1329, 1264, 1178, 1170, 1147, 1115, 1095, 1018, 974, 957, 901, 813, 756, 736, 721, 694, 611, 597. Спектр ЯМР 1Н (DMSO-d6; δ, м.д.): 2.24 (c., 3H, CH3), 4.50 (c., 2H, CH2), 6.10 (д., J = 3.3 Гц, 1H, ${\text{H}}_{{{\text{фурил}}}}^{{\text{3}}}$), 6.17 (т., J = 2.6 Гц, 1H, ${\text{H}}_{{{\text{фурил}}}}^{{\text{4}}}$), 7.13 (т., J = = 7.4 Гц, 1H, ${\text{H}}_{{{\text{фенил}}}}^{{\text{4}}}$), 7.33–7.38 (м., 3H, H3 и ${\text{H}}_{{{\text{фенил}}}}^{{\text{5}}},$ ${\text{H}}_{{{\text{фурил}}}}^{{\text{5}}}$), 7.78 (д., J = 7.5 Гц, 2H, H2 и ${\text{H}}_{{{\text{фенил}}}}^{{\text{6}}}$), 8.36 (c., 1H, CH=N).
Бис{[4-[(E)-2-фурилметилиминометил]-5-метил-2-фенилпиразол-3-ил]окси}палладий(II) (Iд). Светло-коричневый порошок, выход 0.55 г (82%), Тпл > 300°С.
ИК-спектр (ν, см–1): 1627 (CH=N), 1597, 1538, 1520, 1497, 1462, 1443, 1377, 1333, 1186, 1146, 1120, 1088, 1013, 915, 889, 820, 752, 695, 662, 600. Спектр ЯМР 1Н (DMSO-d6; δ, м.д.): 2.21 (c., 3H, CH3), 4.59 (c., 2H, CH2), 6.10 (д., J = 3.0 Гц, 1H, ${\text{H}}_{{{\text{фурил}}}}^{{\text{3}}}$), 6.17 (т., J = 2.6 Гц, 1H, ${\text{H}}_{{{\text{фурил}}}}^{{\text{4}}}$), 7.25 (т., J = 7.2 Гц, 1H, ${\text{H}}_{{{\text{фенил}}}}^{{\text{4}}}$), 7.41 (т., J = 7.8 Гц, 2H, H3 и ${\text{H}}_{{{\text{фенил}}}}^{{\text{5}}}$), 7.57–7.60 (м., 3H, H2 и ${\text{H}}_{{{\text{фенил}}}}^{{\text{6}}},$ ${\text{H}}_{{{\text{фурил}}}}^{{\text{5}}}$), 7.80 (c., 1H, CH=N).
Элементный анализ на С, H, N выполняли на приборе Carlo Erba Instruments TCM 480. Анализ на металл проведен весовым методом. Температуру плавления измеряли на столике Кофлера. ИК-спектры образцов регистрировали на приборе Varian 3100-FTIR Excalibur в области 4000–400 см–1 методом нарушенного полного внутреннего отражения. Спектры ЯМР 1Н регистрировали на приборе Varian Unity-300 (300 МГц) в ДМСО-d6. Химические сдвиги ядер 1H приведены относительно остаточных сигналов дейтерорастворителя. ИК-спектры образцов регистрировали на приборе Varian 3100-FTIR Excalibur в области 4000–400 см–1 методом нарушенного полного внутреннего отражения.
Удельную магнитную восприимчивость определяли относительным методом Фарадея при комнатной температуре. В качестве эталона для калибровки использовали Hg[Co(CNS)4].
Электронные спектры поглощения (ЭСП) записывали в растворе 2.0 × 10–5 M на спектрофотометре Agilent 8453, фотолюминесцентные (ФЛ) спектры записывали в растворе 5.0 × 10–6 M на флуоресцентном спектрофотометре Varian Cary Eclipse. Все спектры получали для растворов в дихлорметане (CH2Cl2, “хч” для спектроскопии, Acros Organics) при комнатной температуре. Квантовый выход флуоресценции определяли относительно стандарта 3-метокси-7H-бенз[де]антрацен-7-она в толуоле (ФFl = 0.1 при возбуждении 365 нм) [34].
Квантово-химические расчеты проводили в рамках теории функционала плотности с использованием обменно-корреляционного функционала Пердью, Бурке и Эрнцерхофа PBE0 [35, 36] и корреляционно-согласованного поляризационного валентно-расщепленного базиса Даннинга cc-pVDZ [37]. Использовали программу Gaussian’03 [38]. Геометрию молекул оптимизировали без ограничения по симметрии, минимумы поверхности потенциальной энергии характеризовали отсутствием мнимых частот рассчитанных нормальных колебаний. Влияние среды учитывали в рамках модели непрерывной поляризуемой среды [39] с использованием параметров для растворителя (CH2Cl2).
РСА. Интенсивности дифракционных отражений для Iа и Iв измерены на синхротронной станции “Белок/РСА” НИЦ “Курчатовский институт”, используя двухкоординатный CCD детектор Rayonix Sx165 (T = 100 K, φ-сканирование с шагом 1.0°) [40, 41]. Обработка экспериментальных данных проведена с помощью программы XDS, а учет поглощения рентгеновского излучения по программе XSCALE [42]. Основные кристаллографические данные и параметры уточнения представлены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структур Iа и Iв
| Параметр | Значение | |
|---|---|---|
| Iа | Iв | |
| Брутто-формула | C32H28N6O4Cu | C32H28N6O4Co |
| М | 624.14 | 619.53 |
| Температура, K | 100(2) | 100(2) |
| Сингония | Моноклинная | Триклинная |
| Пр. группа | C2/c | $P\bar {1}$ |
| a, Å | 17.207(3) | 8.8100(18) |
| b, Å | 16.484(3) | 11.480(2) |
| c, Å | 21.443(4) | 14.480(3) |
| α, град | 90 | 105.28(3) |
| β, град | 104.24(3) | 97.16(3) |
| γ, град | 90 | 91.62(3) |
| Объем, Å3 | 5895(2) | 1398.8(5) |
| Z | 8 | 2 |
| ρ(выч.), г/cм3 | 1.411 | 1.476 |
| µ, мм–1 | 0.888 | 0.895 |
| F(000) | 2600.0 | 646.0 |
| Размер кристалла, мм | 0.15 × 0.1 × 0.1 | 0.1 × 0.05 × 0.05 |
| Длина волны | λ = 0.7454 | λ = 0.79312 |
| Диапазон по 2θ, град | 5 до 62.002 | 5.768 до 76.97 |
| Диапазон индексов | –23 ≤ h ≤ 23, –22 ≤ k ≤ 22, –28 ≤ l ≤ 29 | –13 ≤ h ≤ 13, –14 ≤ k ≤ 14, –22 ≤ l ≤ 18 |
| Собранные рефлексы | 32 246 | 19 362 |
| Независимые рефлексы (Rint, Rsigma) | 7998 (0.0355, 0.0291) | 8764 (0.0522, 0.0641) |
| Данные/ограничения/параметры | 7998/0/390 | 8764/0/390 |
| GООF | 1.050 | 1.099 |
| R факторы (I > 2σ(I)) | R1 = 0.040, wR2 = 0.113 |
R1 = 0.044, wR2 = 0.127 |
| R факторы (все данные) | R1 = 0.0511, wR2 = 0.1205 |
R1 = 0.0560, wR2 = 0.1317 |
| Электронная плотность (max/min), e Å–3 | 0.95/–0.99 | 0.55/–0.81 |
Модели структур определены прямыми методами и уточнены полноматричным методом наименьших квадратов по F 2 в анизотропном приближении для неводородных атомов. Положения остальных атомов водорода в соединениях Iа и Iв рассчитаны геометрически и включены в уточнение с фиксированными позиционными параметрами (модель “наездника”) и изотропными параметрами смещения (Uизо(H) = 1.5Uэкв(C) для CH3-групп и Uизо(H) = 1.2Uэкв(C) для остальных групп). Все расчеты проведены с использованием комплекса программ SHELXTL [43].
Структуры Iа и Iв депонированы в Кембриджском банке структурных данных (CCDC № 2177619, 2177622 соответственно; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
Антибактериальную активность оценивали с использованием штаммов Staphylococcus aureus 6538 P и Escherichia coli F 50 (полевые изоляты из коллекции Ростовской областной ветеринарной лаборатории) методом диффузии в агар, описанным в [44, 45]. Фуразолидон использовали в качестве эталонного продукта. Уровень антибактериальной активности определяли по размеру зон ингибирования роста.
Изучение фунгистатической активности новых веществ проводили на культуре грибов рода Penicillium, вида Penicillium italicum Wehmer (1894) (полевой изолят) из коллекции микромицетов лаборатории микотоксикологии ФГБНУ Северо-Кавказского зонального научно-исследовательского ветеринарного института по методике [44]. Препаратом сравнения служил фундазол.
Протистоцидную активность изучали на простейших вида Colpoda steinii (полевой изолят), коллекция лаборатории паразитологии СКЗНИВИ. Протистоцидную активность изучали методом серийных разведений по методике [44–46] на культуре простейших вида Colpoda steinii. Препаратом сравнения служил хлорохин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В продолжение работ [1–10, 28–31] по исследованию структуры и свойств новых хелатных комплексов, содержащих пиразольный фрагмент, осуществлен синтез HL и комплексов металлов ML2 (М = Cu, Ni, Co, Zn, Pd) на его основе (схема 1 ).
Схема 1 .
Строение HL установлено согласно данным элементного анализа, спектроскопии ИК, ЯМР 1H и квантово-химических расчетов. Соединения данного типа могут существовать в различных таутомерных формах и Е,Z-изомерах [25, 27, 47]. Аминопроизводные альдегидов и кетонов пиразол-5-она в растворе могут существовать как в виде кето-аминной (A), так и енол-иминной форм (Б) с возможностью реализации таутомерных переходов. Проведенные квантово-химические расчеты HL методом DFT показали, что наиболее предпочтительной является кето-аминная форма A как в газовой фазе, так и в растворе CH2Cl2 (схема 2 ). Рассчитанная энергия таутомерного перехода для HL в газовой фазе оказалась очень близкой к значению Δ = 6.99 ккал/моль (B3LYP/6-31G(d,p)), полученному для аналогичного N,N,O-тридентатного тозиламинофункционализованного пиразолсодержащего основания Шиффа [3].
Схема 2 .
Кето-аминная форма HL подтверждается также данными спектроскопии ИК и ЯМР 1H этого соединения. В ИК-спектре HL наблюдаются интенсивные полосы поглощения при 3219 см–1 ν(NH) и 1681 и 1667 см–1 ν(С=O), соответствующие колебаниям винилогической амидной группировки С(=О)–СН=NR [9]. В спектре ЯМР 1H HL проявляются сигналы протонов при 8.10 м.д. (CH–NH) и при 9.74–9.78 м.д. (CH–NH).
Комплексы металлов Iа–Iд имеют, согласно данным элементного анализа, состав ML2. В их ИК спектрах исчезают полосы поглощения νNH и νС=O HL и появляются интенсивные полосы поглощения ν(CH=N) в области 1626 см–1 (M = Cu, Iа), 1633 см–1 (M = Ni, Iб), 1621 см–1 (M = Co, Iв), 1620 см–1 (M = Zn, Iг), 1627 см–1 (M = Pd, Iд), свидетельствующие об образовании хелатных структур I с HL [4, 9, 25–27, 48] и указывая о переходе кето-аминной формы лиганда А в депротонированную енолят-иминную форму при координации с ионами металла. Подтверждением этому являются спектры ЯМР 1H комплексов Zn (Iг) и Pd (Iд), в которых исчезают сигналы CH–NH и NH–CH протонов HL, а появляются сигналы группы CH=N при 8.36 и 7.80 м.д. соответственно.
Комплексы Iа–Iв парамагнитны. Значения µэфф = 2.10 µB (M = Cu), 3.12 µB (M = Ni), 4.26 µB (M = Co) при 294 К и не меняются с понижением температуры, что свидетельствует об их моноядерном строении.
Окончательный вывод о строении комплексов Iа и Iв сделан на основании данных РСА, их молекулярные структуры показаны на рис. 1, 2, основные геометрические параметры для них приведены в табл. 2.
Рис. 1.
Молекулярная структура комплекса Iа в представлении атомов эллипсоидами атомных смещений на уровне вероятности 50%.

Рис. 2.
Молекулярная структура комплекса Iв в представлении атомов эллипсоидами атомных смещений на уровне вероятности 50%.

Таблица 2.
Длины связей и валентные углы между ними для комплексов Iа и Iв
| M = Cu, Co | Iа | Iв |
|---|---|---|
| Длина связи, Å | ||
| М–O(3) | 1.9312(14) | 1.9538(13) |
| М–O(4) | 1.9459(13) | 1.9389(13) |
| М–N(5) | 1.9762(16) | 1.9900(14) |
| М–N(6) | 1.9706(16) | 1.9898(15) |
| Угол, град | ||
| O(3)MO(4) | 150.113(57) | 107.368(55) |
| N(5)MN(6) | 151.173(66) | 120.396(55) |
| N(5)MO(4) | 91.181(59) | 117.748(57) |
| O(4)MN(6) | 96.621(61) | 98.673(57) |
| N(5)MO(3) | 95.726(60) | 100.269(54) |
| O(3)MN(6) | 91.203(59) | 112.309(52) |
Комплекс Iа (рис. 1) кристаллизуется в моноклинной пространственной группе С2/c. Два депротонированных лиганда HL хелатно координированы к иону меди(II) атомами N азометиновой связи и O альдегидной компоненты лиганда с образованием шестичленных хелатных циклов. Геометрия окружения иона меди(II) соответствует искаженному плоскому квадрату. Оба шестичленных хелатных кольца практически компланарны пятичленным пиразольным циклам (углы между плоскостями 1.138(5)° и 1.740(5)°). В пиразольных фрагментах лигандов фенильные кольца повернуты разнонаправлено относительно пятичленных пиразольных гетероциклов на 19.152(7)° и 20.152(7)°. Пятичленные фурильные фрагменты образуют с шестичленными хелатными циклами существенно разные углы 75.508(5)° и 85.316(5)°. Полученные расстояния Cu…O 1.9312(14), 1.9459(13) Å и Cu…N 1.9762(16) 1.9706(16) Å близки к значениям аналогичных длин связей в структурно подобном комплексе меди(II) с 4-[(бензиламино)фенилметилен]-5-метил-2-фенилпиразол-3-оновыми лигандами Cu…O 1.916(1), 1.922(1) Å и Cu…N 1.973(2), 1.984(2) Å соответственно [49]. Существенных водородных связей или π-взаимодействий между соседними молекулами комплекса не обнаружено.
Комплекс Iв (рис. 2) кристаллизуется в триклинной пространственной группе $P\bar {1}$ и имеет близкое к Iа строение координационного узла. Как и для Iа в комплексе Iв осуществляется координация хелатно двух депротонированных лигандов HL через атомы N и O аминного и альдегидного фрагментов лиганда с образованием шестичленных хелатных циклов. Исходя из значений углов между связями (табл. 2) для комплекса Iв характерно образование искаженного тетраэдрического координационного окружения вокруг иона кобальта(II). Углы между плоскостями шестичленных хелатных колец и пиразольного гетероцикла близки и составляют 4.745(5)° и 4.648(5)°, тогда как углы поворота фенильных заместителей относительно пятичленных пиразольных колец меньше, чем в Iа, и составляют 6.845(5)° и 11.048(6)° соответственно. Пятичленные фурильные гетероциклы образуют с шестичленными хелатными кольцами углы 87.504(5)° и 82.16(5)°, не сильно отличаясь от значений в Iа. Как углы между связями, так и длины связей в Iв близки к полученным значениям в аналогичном комплексе кобальта(II) с 4-[(бензиламино)фенилметилен]-5-метил-2-фенилпиразол-3-оновыми лигандами (Cо…O 1.925(2), 1.931(2) Å и Cо…N 1.993(2), 1.996(2) Å) [50]. Так же как и для Iа, водородных связей или π-взаимодействий между соседними молекулами комплекса Iв не обнаружено.
ЭСП соединений HL и Iа–Iд в CH2Cl2 при комнатной температуре приведены на рис. 3. В спектральном диапазоне 240–500 нм ЭСП лиганда HL характеризуется тремя полосами поглощения с максимумами при 261, 300 и 357 нм соответственно (рис. 3). Отнесение полос ЭСП HL проведено на основе расчетов TD-DFT для оптимизированной структуры соединения с учетом эффектов сольватации. Для HL рассчитаны характеристики синглет-синглетных электронных переходов и проведено их отнесение для наблюдаемых полос в экспериментальном ЭСП. Расчетные значения максимумов ЭСП (λтеор), обусловленных основными электронными синглет-синглетными переходами между граничными МО, соответствующие силы осцилляторов для данных переходов и экспериментальные значения максимумов полос ЭСП (λэксп) для HL приведены в табл. 3. На рис. 4 показаны энергетическая диаграмма, вид изоповерхностей граничных МО и указаны основные электронные переходы для HL.
Рис. 3.
ЭСП растворов HL и комплексов Iа (1), Iб (2), Iв (3), Iг (4), Iд (5) в CH2Cl2 (с = 2 × 10–5 М, l = 1 см, T = 293 K).

Таблица 3.
Рассчитанные λтеор и экспериментальные λэксп максимумы ЭСП, вклады отдельных электронных переходов и силы осцилляторов f для HL, полученные из TD-DFT расчетов
| λэксп, нм | λтеор, нм | Электронные переходы (вклады, %) |
f |
|---|---|---|---|
| 357 | 343.19 | ВЗМО → НСМО (94%) | 0.02 |
| 300 | 293.78 | ВЗМО-1→ НСМО (77%) | 0.35 |
| 284.00 | ВЗМО-4 → НСМО (92%) | 0.04 | |
| 261 | 268.97 | ВЗМО-2 → НСМО (76%) | 0.33 |
| 260.12 | ВЗМО → НСМО+1 (50%) ВЗМО → НСМО+2 (22%) |
0.17 | |
| 254.74 | ВЗМО → НСМО+2 (44%) ВЗМО → НСМО+1 (42%) |
0.25 |
Рис. 4.
Энергетическая диаграмма, вид изоповерхностей граничных МО и основные электронные переходы для HL.
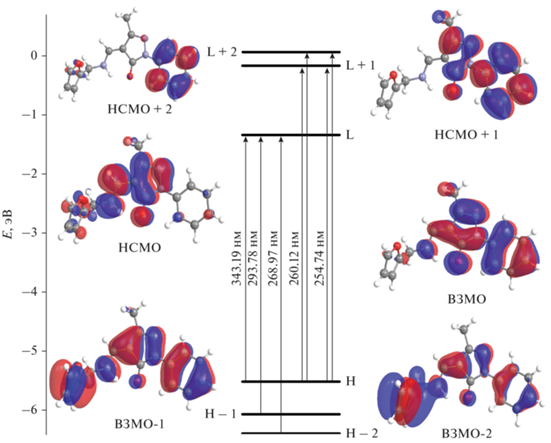
Согласно расчетам, длинноволновая полоса поглощения HL с низкой интенсивностью при 357 нм может быть отнесена за счет электронного перехода ВЗМО → НСМО, имеющего низкую силу осциллятора f = 0.02. Этот переход имеет характер π–π*-внутрилигандного переноса заряда с фенильного кольца на пиразольный фрагмент молекулы. Основной максимум ЭСП HL при 300 нм определяется одним очень сильным переходом ВЗМО-1→ НСМО и более слабым ВЗМО-4 → → НСМО. Первый из них имеет характер π–π*-внутрилигандного переноса заряда с фенильного кольца на фурановый фрагмент молекулы. Полоса поглощения при 261 нм в ЭСП HL определяется несколькими электронными переходами между ВЗМО и НСМО + 1, НСМО + 2, имеющие характер π–π*-внутрилигандного переноса заряда с пиразольного фрагмента молекулы на фенильное кольцо.
Природа металла оказывает существенное влияние на абсорбционные свойства исследуемых комплексных соединений Iа–Iд. ЭСП координационных соединений Iа–Iв на основе меди(II), никеля(II) и кобальта(II) характеризуются двумя полосами поглощения с максимумами при 253–260 нм (ε = 36 820–40 730 л/моль см) и при 291–296 нм (ε = 36 750–44 320 л/моль см), которые по интенсивности в ~2 раза выше в сравнении с лигандом HL (рис. 3). Для комплекса цинка Iг, в отличие от лиганда HL, наблюдаются две полосы поглощения с максимумами при 275 нм (ε = 17 240 л/моль см) и 357 нм (ε = 9250 л/моль см). Удвоенная интенсивность длинноволновой полосы поглощения комплекса цинка Iг в сравнении с соответствующим поглощением лиганда соотносится с его строением ZnL2. Максимум длинноволновой полосы поглощения комплекса палладия Iд смещен гипсохромно на 25 нм в сравнении с цинковым комплексом (рис. 3).
Комплекс цинка Iг проявляет ФЛ свойства в растворах CH2Cl2 при комнатной температуре, демонстрируя синее свечение с максимумом полосы испускания при 431 нм (рис. 5). Квантовый выход флуоресценции составляет 0.29. Сравнительный анализ спектра поглощения соединения Iг со спектром возбуждения наблюдаемой флуоресценции демонстрирует их хорошее совпадение, свидетельствующее о принадлежности наблюдаемой ФЛ к координационному соединению. В аналогичных условиях для лиганда HL и координационных соединений Iа–Iв и Iд ФЛ не зафиксирована. Таким образом, природа металла оказывает существенное влияние и на флуоресцентные свойства полученных комплексных соединений.
Рис. 5.
ЭСП комплекса Iг (1), его спектры возбуждения ФЛ (2, λпогл = 450 нм) и эмиссии ФЛ (3, λвозб = = 365 нм) в CH2Cl2 при комнатной температуре.

Полученный енамин HL и комплексы d-металлов Iа–Iд были исследованы на антибактериальную, протистоцидную и фунгистатическую активности. Найдено, что енамин HL и все комплексы Iа–Iд не обладали фунгистатической активностью в отношении Penicillium italicum и антибактериальной активностью в отношении Staphylococcus aureus и Escherichia coli.
При изучении протистоцидных свойств обнаружено, что енамин HL и комплексы никеля (Iб) и кобальта (Iв) не проявили протистоцидную активность, а активность комплексов меди (Iа) и цинка (Iг) в отношении Colpoda steinii была в 32 раза слабее активности хлорохина.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Uraev A.I., Nefedov S.E., Lyssenko K.A. et al. // Polyhedron. 2020. V. 188. P. 114623. https://doi.org/10.1016/j.poly.2020.114623
Garnovskii D.A., Vlasenko V.G., Lyssenko K.A. et al. // Polyhedron. 2020. V. 190. P. 114763. https://doi.org/10.1016/j.poly.2020.114763
Гарновский Д.А., Власенко В.Г., Александров Г.Г. и др. // Коорд. химия. 2018. Т. 44. № 5. С. 295 (Garnovskii D.A., Vlasenko V.G., Aleksandrov G.G. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 596). https://doi.org/10.1134/S0132344X18050031
Uraev A.I., Lyssenko K.A., Vlasenko V.G. et al // Polyhedron. 2018. V. 146. P. 1. https://doi.org/10.1016/j.poly.2018.02.018
Ураев А.И., Коробов М.С., Попов Л.Д. и др. // Журн. общ. химии. 2017. Т. 87. № 2. С. 277 (Uraev A.I., Korobov M.S., Popov L.D. et al // Russ. J. Gen. Chem. 2017. V. 87. P. 252). https://doi.org/10.1134/S1070363217020165
Гарновский Д.А., Александров Г.Г., Макарова Н.И. и др. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1078 (Garnovskii D.A., Aleksandrov G.G., Makarova N.I. et al. // Russ. J. Inorg. Chem. 2017. V. 62. P. 1077). https://doi.org/10.1134/S0036023617080071
Гарновский Д.А., Анцышкина А.С., Макарова Н.И. и др. // Журн. неорган. химии. 2015. Т. 60. № 12. С. 1670 (Garnovskii D.A., Antsyshkina A.S., Makarova N.I. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 12. P. 1528). https://doi.org/10.1134/S0036023615120116
Бурлов А.С., Кощиенко Ю.В., Власенко В.Г. и др. // Журн. общ. химии. 2016. Т. 86. № 10. С. 1732 (Burlov A.S., Koshchienko Y.V., Vlasenko V.G. et al. // Russ. J. Gen. Chem. 2016. V. 86. P. 2379). https://doi.org/10.1134/S1070363216100224
Бурлов А.С., Власенко В.Г., Лифинцева Т.В. и др. // Коорд. химия. 2020. Т. 46. № 7. С. 429 (Burlov A.S., Vlasenko V.G., Lifintseva T.V. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 485). https://doi.org/10.1134/S1070328420070015
Vlasenko V.G., Garnovskii D.A., Aleksandrov G.G. et al. // Polyhedron. 2019. V. 157. P. 6. https://doi.org/10.1016/j.poly.2018.09.065
Ying-Xin Zou, Xu Feng, Zhi-Yong Chu et al. // Regul. Toxic. Pharm. 2019. V. 103. P. 34. https://doi.org/10.1016/j.yrtph.2019.01.018
Micieli G., Manzoni G.C., Granella F. et al. // Drug-Induced Headache. Advances in Applied Neurological Sciences / Eds Diene H.C., Wilkinson M. Berlin, Heidelberg: Springer, 1988. V. 5. P. 20. https://doi.org/10.1007/978-3-642-73327-7_5
Ribeiro N., Roy S., Butenko N. et al. // J. Inorg. Biochem. 2017. V. 174. P. 63. https://doi.org/10.1016/j.jinorgbio.2017.05.011
Parvarinezhad S., Salehi M., Malekshah R.E. et al. // Appl. Organomet. Chem. 2022. V. 36. Iss. 3. P. e6563. https://doi.org/10.1002/aoc.6563
Venkateswarlu K., Ganji N., Daravath S. et al. // Polyhedron. 2019. V. 171. P. 86. https://doi.org/10.1016/j.poly.2019.06.048
Poormohammadi E.B., Behzad M., Abbasi Z. et al. // J. Mol. Struct. 2020. V. 1205. P. 127603, https://doi.org/10.1016/j.molstruc.2019.127603
Jayarajan R., Vasuki G., Rao P.S. // Org. Chem. Int. 2010. V. 2010. Art. 648589. https://doi.org/10.1155/2010/648589
Burlov A.S., Vlasenko V.G., Dmitriev A.V. et al. // Synth. Metals. 2015. V. 203. P. 156. https://doi.org/10.1016/j.synthmet.2015.02.028
Burlov A.S., Koshchienko Y.V., Makarova N.I. et al. // Synth. Metals. 2016. V. 220. P. 543. https://doi.org/10.1016/j.synthmet.2016.06.025
Минкин В.И., Цивадзе А.Ю., Бурлов А.С. и др. Патент РФ № 2470025 // Б.И. № 35. 20.12.2012.
Gusev A.N., Kiskin M.A., Braga E.V. et al. // ACS Appl. Electron. Mater. 2021. V. 3. № 8. P. 3436. https://doi.org/10.1021/acsaelm.1c00402
Гусев А.Н., Брага Е.В., Крюкова М.А. и др. // Коорд. химия. 2020. Т. 46. № 4. С. 232 (Gusev A.N., Braga E.V., Kryukova M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 251). https://doi.org/10.1134/S107032842004003X
Gusev A.N., Kiskin M.A., Braga E.V. et al. // J. Phys. Chem. C. 2019. V. 123. № 18. P. 11850. https://doi.org/10.1021/acs.jpcc.9b02171
Barkanov A., Zakharova A., Vlasova T. et al. // J. Mater. Sci. 2022. V. 57. P. 8393. https://doi.org/10.1007/s10853-021-06721-4
Marchetti F., Pettinari C., Di Nicola C. et al. // Coord. Chem. Rev. 2019. V. 401. P. 213069. https://doi.org/10.1016/j.ccr.2019.213069
Marchetti F., Pettinari C., Pettinari R. // Coord. Chem. Rev. 2005. V. 249. P. 2909. https://doi.org/10.1016/j.ccr.2005.03.013
Marchetti F., Pettinari C., Pettinari R. // Coord. Chem. Rev. 2015. V. 303. P. 1. https://doi.org/10.1016/j.ccr.2015.05.003
Ураев А.И., Ниворожкин А.В., Бондаренко Г.И. и др. // Изв. АН. Сер. хим. 2000. № 11. С. 1892 (Uraev A., Nivorozhkin A., Bondarenko G. et al. // Russ. Chem. Bull. Int. Ed. 2000. V. 49. P. 1863). https://doi.org/10.1007/BF02494925
Ураев А.И., Коршунов О.Ю., Ниворожкин А.Л. и др. // Журн. неорган. химии. 2009. Т. 54. № 4. С. 575 (Uraev A.I., Korshunov O.Y., Nivorozhkin A.L. et al. // Russ. J. Inorg. Chem. 2009. V. 54. № 4. P. 521). https://doi.org/10.1134/S0036023609040068
Nivorozhkin A.L., Uraev A.I., Bondarenko G.I. et al. // Chem. Commun. 1997. № 18. P. 1711. https://doi.org/10.1039/a704879c
Ураев А.И., Ниворожкин А.Л., Курбатов В.П. и др. // Изв. АН. Сер. хим. 2003. № 11. С. 2386 (Uraev A.I., Nivorozhkin A.L., Divaeva L.N. et al. // Russ. Chem. Bull. 2003. V. 52. № 11. P. 2523).
Порай-Кошиц Б.А., Квитко И.Я. // Журн. общ. химии. 1962. Т. 32. № 12. С. 4050 (Porai-Koshits B.A., Kvitko I.Ya. // Zh. Obshch. Khim. 1962. V. 32. P. 4050).
Квитко И.Я., Порай-Кошиц Б.А. // Журн. орган. химии. 1964. Т. 34. № 9. С. 3005 (Kvitko I.Ya., Porai-Koshits B.A. // Zh. Org. Khim. 1964. V. 34. P. 3005).
Красовицкий Б.М., Болотин Б.М. Органические люминофоры. М.: Химия, 1984. С. 336.
Perdew J.P., Burke K., Ernzerhof M. // Phys. Rev. Lett. 1997. V. 78. P. 1396. https://doi.org/10.1103/physrevlett.78.1396
Perdew J.P., Ernzerhof M., Burke K. // J. Chem. Phys. 1996. V. 105. P. 9982. https://doi.org/10.1063/1.472933
Woon D.E., Dunning T.H., Jr. // J. Chem. Phys. 1993. V. 98. P. 1358. https://doi.org/10.1063/1.464303
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 03. Revision A.1. Pittsburgh (PA, USA): Gaussian, Inc., 2003.
Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005. V. 105. P. 2999. https://doi.org/10.1021/cr9904009
Lazarenko V.A., Dorovatovskii P.V., Zubavichus Y.V. et al. // Crystals. 2017. V. 7. № 11. P. 325. https://doi.org/10.3390/cryst7110325
Svetogorov R.D., Dorovatovskii P.V., Lazarenko V.A. // Cryst. Res. Tech. 2020. V. 55. № 5. P. 1900184. https://doi.org/10.1002/crat.201900184
Kabsch W. // Acta Crystallogr. D. 2010. V. 66. № 2. P. 125. https://doi.org/10.1107/S0907444909047337
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Burlov A.S., Vlasenko V.G., Koshchienko Yu.V et al. // Polyhedron. 2018. V. 154. P. 65. https://doi.org/10.1016/j.poly.2018.07.034
Burlov A.S., Vlasenko V.G., Koshchienko Yu.V. et al. // Polyhedron. 2018. V. 144. P. 249. https://doi.org/10.1016/j.poly.2018.01.020
Фетисов Л.Н., Зубенко А.А., Бодряков А.Н., Бодрякова М.А. // Междунар. паразитологический симп. “Современные проблемы общей и частной паразитологии”. 2012. С. 70.
Minkin V.I., Garnovskii A.D., Elguero J. et al. // Adv. Heterocycl. Chem. 2000. V. 76. P. 157.
Chatziefthimiou S.D., Lazarou Y.G., Hadjoudis E. et al. // J. Phys. Chem. B 2006. V. 110. P. 23701. https://doi.org/10.1021/jp064110p
Feng Bao, Juan Feng, Seik Weng Ng // Acta Crystallogr. E. 2005. V. 61. P. m2393. https://doi.org/10.1107/S1600536805033805
Rong-Ming Ma, Shao-Fa Sun, Seik Weng Ng // Acta Crystallogr. E. 2006. V. 62. P. m2711. https://doi.org/10.1107/S1600536806038049
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия




