Микология и фитопатология, 2023, T. 57, № 1, стр. 33-41
Потенциал почвенных аскомицетов к биодеградации длинноцепочечных алкилфенолов
И. Л. Кузикова 1, *, Н. Г. Медведева 1, **
1 “Санкт-Петербургский Федеральный исследовательский центр Российской академии наук” (СПб ФИЦ РАН),
Санкт-Петербургский научно-исследовательский центр экологической безопасности Российской академии наук
197110 Санкт-Петербург, Россия
* E-mail: ilkuzikova@ya.ru
** E-mail: ngmedvedeva@gmail.com
Поступила в редакцию 17.04.2022
После доработки 05.10.2022
Принята к публикации 07.11.2022
- EDN: HRHLUT
- DOI: 10.31857/S0026364823010087
Аннотация
Из дерново-подзолистой суглинистой почвы (Ленинградская обл., Россия), контаминированной нонилфенолом, выделены 11 штаммов аскомицетов – деструкторов технического нонилфенола (НФ) и 4-трет-октилфенола (4-т-ОФ). Изоляты грибов способны осуществлять деструкцию НФ и 4-т-ОФ при высокой нагрузке (300 мг/л). Наиболее активный штамм Fusarium solani 8F обладает способностью деструктировать алкилфенолы (АФ) как в условиях кометаболизма, так и без дополнительных источников углерода и энергии. Убыль АФ осуществляется за счет процессов биодеструкции и/или биотрансформации исследуемым штаммом и в малой степени за счет сорбции клетками грибов. Период полураспада НФ и 4-т-ОФ в условиях кометаболизма составляет 3.5 и 6.4 ч, соответственно, а без дополнительных источников углерода и энергии 9 и 19.7 ч соответственно. Количество продукта перекисного окисления липидов – малонового диальдегида, равно как и содержание восстановленного глутатиона в процессе биодеструкции НФ и 4-т-ОФ в условиях кометаболизма возрастает в 1.7 и 2 раза, соответственно, по сравнению с контролем. Высокий уровень восстановленного глутатиона в клетках F. solani 8F может свидетельствовать об участии этого метаболита как в процессах биодеструкции АФ, так и в обеспечении устойчивости штамма к окислительному стрессу. Способность аскомицетного гриба Fusarium solani к биодеструкции НФ и 4-т-ОФ как в условиях кометаболизма, так и без дополнительных источников углерода и энергии показана впервые. Выявленный высокий потенциал почвенных аскомицетов к деструкции алкилфенолов может быть основой новых экологически безопасных биоремедиационных технологий очистки почв, природных и сточных вод, загрязненных гормоноподобными ксенобиотиками.
ВВЕДЕНИЕ
Длинноцепочечные алкилфенолы, такие как октил- и нонилфенолы, относятся к наиболее распространенным персистентным эндокринным деструкторам, обладающим эстрогенной активностью (Gingrich et al., 2020). Алкилфенолы образуются вследствие неполной биологической и абиотической трансформации соответствующих полиэтоксилатов – неионогенных поверхностно-активных веществ, широко применяемых в различных отраслях деятельности человека (Graca et al., 2016). Основным источником загрязнения окружающей среды алкилфенолами являются недостаточно очищенные промышленные и муниципальные сточные воды (Barber et al., 2015). Кроме того, использование сточных вод, регенерированных для вторичного использования в системах орошения сельскохозяйственных угодий, а также применение осадков сточных вод в качестве нетрадиционных органоминеральных удобрений для сельского хозяйства (FAO, 2012; Jiang et al., 2019) усугубляют эту проблему. Благодаря высокой биоаккумуляционной способности, алкилфенолы накапливаются в живых организмах, оказывая негативное влияние, в первую очередь, на их эндокринную систему, вызывая канцерогенные, тератогенные, и мутагенные эффекты (Tabassum et al., 2017; Wang et al., 2018). Для устранения негативных последствий от загрязнения алкилфенолами чрезвычайно важна разработка высокоэффективных методов очистки окружающей среды от токсичных ксенобиотиков. Микробная деградация алкилфенолов как чистыми культурами бактерий (Watanabe et al., 2012; Kolvenbach, Corvini, 2012; Ma et al., 2018; Bhandari et al., 2021) и грибов (Moon, Song, 2012; Сatapane et al., 2013; Rajendran et al., 2016, 2017a, 2017b, 2020), так и микробными консорциумами донных осадков (Wang et al., 2014) и почвы (Liu et al., 2014) является наиболее эффективным, экологически безопасным подходом по их удалению по сравнению с известными физико-химическими методами утилизации алкилфенолов (фильтры с активированным углем, нанофильтрация, фотокаталитическое окисление, озонирование, обратный осмос) (Priac et al., 2017), которые обладают рядом недостатков, связанных в большинстве случаев с их высокой себестоимостью, низкой эффективностью удаления ксенобиотиков, а также с образованием более стойких и токсичных продуктов их распада. Большинство известных микроорганизмов-деструкторов алкилфенолов относится к бактериям (Watanabe et al., 2012; Kolvenbach, Corvini, 2012; Ma et al., 2018) и базидиальным грибам, продуцирующим лакказу и лигнин-пероксидазу, которые играют ключевую роль в биотрансформации ароматических ксенобиотиков (Wang et al., 2012; Catapane et al., 2013).
В последнее время наблюдается все возрастающий интерес к деградации алкилфенолов аскомицетными грибами (Ascomycota) в силу их доминирования в загрязненных объектах окружающей среды, высокой устойчивости к токсикантам и эффективности процессов их утилизации. Известные аскомицеты – деструкторы алкилфенолов родов Aspergillus, Candida, Fusarium, Рenicilium, Thielavia и др. способны деструктировать нонил- и октилфенолы в концентрациях, не превышающих 100 мг/л (Krupiński et al., 2014; Rajendran et al., 2016, 2017a, 2017b, 2020; Kuzikova et al., 2018, 2020; Mtibaà et al., 2020). Большая часть изученных штаммов грибов осуществляет биодеструкцию в условиях кометаболизма и только для ограниченной части продемонстрирована способность утилизировать нонил- и октилфенолы как единственные источники углерода и энергии (Krupinski et al., 2014; Rajendran et al., 2016, 2017a, 2017b). Объем научных данных о возможности аскомицетных грибов, выделенных из загрязненных объектов окружающей среды, деструктировать нонил- и октилфенолы при высоких нагрузках как в условиях кометаболизма, так и без дополнительных источников углерода и энергии в настоящее время все еще остается фрагментарным.
Цель настоящего исследования состояла в выделении из контаминированной нонилфенолом дерново-подзолистой почвы (Ленинградская обл.), аскомицетов, способных к биодеструкции нонил- и 4-трет-октилфенола, а также в оценке эффективности биодеградации алкилфенолов штаммом Fusarium solani 8F.
МАТЕРИАЛЫ И МЕТОДЫ
Микромицеты выделяли из дерново-подзолистой суглинистой почвы [Eutric Albic Retisol (Abruptic, Loamic, Aric, Ochric)], отобранной с опытного поля Санкт-Петербургского государственного аграрного университета (СПбГАУ). В лабораторных условиях почву контаминировали нонилфенолом в дозе 300 мг/кг а.с.п. и инкубировали в течение трех месяцев при температуре 22 ± 2°С. Выделение культур грибов из почвы осуществляли традиционным методом почвенных разведений с высевом на плотную питательную среду Чапека с 2% глюкозы, содержащую стрептомицин в дозе 100 мкг/мл для подавления роста бактериальных культур.
Идентификацию микромицетов проводили по культурально-морфологическим признакам c применением стандартных методов и определителей (Domsch, Gams, 1980; Samson, Reenen-Hoekstra, 1988) и с использованием молекулярных методов по секвенированию ITS региона ДНК. Выделение, амплификацию и секвенирование геномной ДНК грибов осуществляли в соответствии с ранее описанной процедурой (Kuzikova et al., 2017). Для амплификации ITS-региона грибов использовали праймеры: ITS1 – 5′TCCGTAGGTGAACCTGCGG и ITS4 – 5′TCCTCCGCTTATTGATATGC. Определение нуклеотидной последовательности ПЦР-продуктов проводили на генетическом анализаторе ABI 3500xl (Applied Biosystems, США) в Ведомственной коллекции полезных микроорганизмов сельскохозяйственного назначения (ВКСМ, Санкт-Петербург). Поиск гомологичных последовательностей и идентификацию проводили с помощью базы данных GenBank (программа BLAST) (http://www.ncbi.nlm.nih.gov).
В работе использовали технический нонилфенол (НФ) CAS: 84852-15-3 и 4-трет-октилфенол (4-т-ОФ) CAS: 140-66-9 производства Sigma-Aldrich, США.
Для получения посевного материала споровые суспензии с титром 1–2 × 107 кл./мл вносили в колбы объемом 250 мл с 50 мл жидкой среды Чапека с 2% глюкозы и инкубировали на инкубационном шейкере Certomat BS-1 при 230 об./мин при температуре 25 ± 1°С в течение двух суток. Для оценки способности штаммов к утилизации алкилфенолов посевной материал грибов в соотношении 1:9 вносили в колбы объемом 250 мл с 50 мл жидкой среды Чапека с 2% глюкозы (условия кометаболизма) и в колбы объемом 250 мл с 50 мл жидкой минеральной среды Чапека (без дополнительных источников углерода). Алкилфенолы вносили в питательную среду в виде растворов в этиловом спирте в концентрации 300 мг/л. Содержание этанола в контрольных вариантах (без содержания алкилфенолов) также, как и в опытных составляло 0.02% об. Абиотический контроль (без внесения культур) использовали для оценки убыли алкилфенолов в абиотических условиях. Культивирование штаммов осуществляли на инкубационном шейкере Certomat BS-1 в темноте при 230 об./мин и температуре 25 ± 1°С. Время культивирования в зависимости от цели эксперимента составляло до 96 ч. Прирост биомассы грибов определяли весовым методом.
Экстракцию НФ и 4-т-ОФ из культуральных жидкостей и биомассы грибов и количественный анализ АФ проводили в соответствии с ранее описанной методикой (Kuzikova et al., 2017, 2018). АФ определяли методом ВЭЖХ на приборе “Hewlett-Packard” H 1090 с диодно-матричным детектором при длине волны 278 нм с разрешением 1.2 нм. Степень извлечения АФ составляла 98 ± 1%, лимит детекции – 5 мкг/л.
Биодеградацию (БД) алкилфенолов рассчитывали как: БДАФ = 100 × (Сисх. – Сt)/Сt, где Сисх. – исходное содержание АФ в культуральной жидкости, Сt – содержание АФ в культуральной жидкости через определенный промежуток времени.
Для оценки эффективности удаления АФ использовали кинетическую модель первого порядка (Rajendran et al., 2017а), которая представлена уравнением: ln(Сисх/Сt) = kt, где Сt – концентрация алкилфенола в момент времени t; Сисх – исходная концентрация алкилфенола, мг/л; t – период деградации, сутки; k – константа скорости деградации, сут–1. Период полураспада (t1/2) АФ вычисляли в соответствии с уравнением: t1/2 = 0.693/k.
Общую активность супероксиддисмутазы (СОД) определяли по способности фермента ингибировать фотохимическое восстановление нитросинего тетразолия по методу Beyer, Fridovich (1987) с небольшой модификацией, как описано ранее (Kuzikova et al., 2017). Поглощение измеряли при 560 нм на УФ сканирующем спектрофотометре Genesys 10 (Thermo Spectronic, США). Результаты выражали в Е/г а.с.б.
Для определения содержания восстановленного глутатиона (ГЛУ) использовали модифицированный метод Gao и Tam (2011). Влажную биомассу грибов в количестве 200 мг растирали в 2 мл сульфосалициловой кислоты (5%) на ледяной бане, центрифугировали 10 мин при 6000 об./мин. К 0.5 мл супернатанта добавляли 0.6 мл реакционного буфера [2 мл Na-фосфатного буфера (0.1 М, рН 7.0), 0.1 мл ЭДТА (1 мМ), 0.04 мл 0.15%-й 5.5-дитиобис-2 нитробензойной кислоты]. Продолжительность реакции – 2 мин, далее измеряли оптическую плотность при 412 нм на спектрофотометре Genesys 10 uv scanning (Thermo Spectronic, США). Концентрацию глутатиона определяли по калибровочной кривой и выражали в нмоль/г а.с.б.
При определении содержания малонового диальдегида (МДА) использовали метод, представленный Dhindsa et al. (1981), с небольшими модификациями (Kuzikova et al., 2017).
Статистическую обработку результатов проводили с использованием пакета компьютерных программ Statistica 10.0 (Stat Soft) и Past 4.x software (http://folk.vio.no/ohammer/past). Статистическую значимость различий между вариантами оценивали с помощью one-way Anova и Tukey’s post hoc тест для данных с нормальным распределением, в противном случае с помощью U-критерия Манна–Уитни, различия считались значимыми при р < 0.05. Для оценки нормальности данных и равенства дисперсий использовали Shapiro-Wilk и Levene-тесты. В таблицах и на графиках полученные данные представлены как среднее значение (± стандартное отклонение) (M ± SD) трех независимых повторов каждого варианта с тремя параллельными повторностями в каждом (n = 3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Контаминация дерново-подзолистой почвы гормоноподобным ксенобиотиком нонилфенолом приводит к изменению численности основных физиологических групп почвенных микроорганизмов и снижению видового разнообразия почвенного микробиома (Kuzikova et al., 2019). Кроме того, при загрязнении почвы нонилфенолом наблюдаются сдвиги в активности пула ферментов азотного, углеводного циклов и окислительно-восстановительных ферментов. Так, целлюлазная активность почвы повышалась более чем на 30% по сравнению с неконтаминированной почвой, что коррелировало с увеличением численности целлюлозоразрушающих бактерий и микромицетов (Zaytseva et al., 2020). В контаминированных нонилфенолом почвенных образцах зафиксирована убыль ксенобиотика, главным образом, за счет его биодеградации почвенной микробиотой (Kuzikova et al., 2019).
С целью оценки потенциала деструкции алкилфенолов мицелиальными грибами из образцов дерново-подзолистой суглинистой почвы, контаминированной в лабораторных условиях нонилфенолом в дозе 300 мг/г а.с.п., выделены 11 изолятов микромицетов. В ходе предварительной идентификации культур по морфологическим признакам среди выделенных штаммов были выявлены грибы рода Fusarium (штаммы – 1F, 3F, 7F, 8F, 9F, 10F), Penicillium (штаммы 2F, 4-2F, 5-2F) и Trichoderma (штаммы 4-1F, 5-1F). Аскомицеты выделенных родов являются типичными представителями почвенных местообитаний, распространены повсеместно. Скрининг активности выделенных штаммов в отношении биодеструкции АФ показал, что все штаммы в условиях кометаболизма проявили способность к деструкции как НФ, так и 4-т-ОФ. Через 72 ч культивирования степень биодеградации нонилфенола составила от 69 до 95.1%, а 4-т-ОФ – от 52.3 до 88.1% в зависимости от штаммовой принадлежности грибов (табл. 1).
Таблица 1.
Биодеструкция нонил- и 4-трет-октилфенола (300 мг/л) выделенными штаммами грибов
| Тест-штаммы грибов | БДНФ (на 72 ч культивирования), % | БД4-т-ОФ (на 72 ч культивирования), % |
|---|---|---|
| 1F | 76.5 | 62.5 |
| 2F | 73.2 | 60.3 |
| 3F | 80.3 | 57.4 |
| 4-1F | 88.0 | 77.4 |
| 4-2F | 89.1 | 68.2 |
| 5-1F | 69.4 | 52.3 |
| 5-2F | 79.9 | 59.8 |
| 7F | 72.1 | 63.2 |
| 8F | 95.1 | 88.1 |
| 9F | 77.2 | 54.5 |
| 10F | 69.0 | 61.2 |
Из 11 изолятов-деструкторов АФ для последующих исследований был отобран штамм 8F с наибольшей степенью биодеградации НФ на 72 часа – 95.1% и 4-т-ОФ – 88.1% (табл. 1). Идентификация штамма методом cеквенирования фрагмента последовательности 18S–5.8S–28SрДНК показала, что генный кластер 18S–5.8S–28S рДНК штамма 8F проявляет высокую степень идентичности со штаммами Fusarium solani (Mart.) Sacc. strain PSC(R)T (96.68%), F. solani strain YIMPH300045 (99.76%), F. solani isolate F41(100%) и F. solani isolate F61 (100%). На основании морфологических исследований и данных, полученных при секвенировании фрагмента последовательности кластера 18S–5.8S–28S рДНК, штамм 8F идентифицирован как F. solani.
Изучение кинетики деструкции алкилфенолов штамом F. solani 8F проводили как в условиях кометаболизма, так и без дополнительных источников углерода и энергии при содержании токсикантов в среде 300 мг/л. Установлено, что в условиях кометаболизма при использовании глюкозы как ростового субстрата, наблюдается эффективная убыль ксенобиотиков из среды, несмотря на то, что АФ оказывают ингибирующее действие на рост исследуемого штамма. Наряду со способностью деструктировать НФ и 4-т-ОФ в условиях кометаболизма штамм F. solani 8F обладает метаболитическим свойством деградировать алкилфенолы и без дополнительных источников углерода и энергии (рис. 1, а, б).
Рис. 1.
Удаление алкилфенолов (АФ) – нонилфенола (а) и 4-трет-октилфенола (б) штаммом Fusarium solani 8F: 1 – убыль АФ (300 мг/л) в условиях кометаболизма; 2 – убыль АФ (300 мг/л) без дополнительных источников углерода и энергии; 3 – абсолютно сухая биомасса в контроле на среде Чапека с 2% глюкозы (без АФ); 4 – абсолютно сухая биомасса на среде Чапека с 2% глюкозы + 300 мг/л АФ; 5 – абсолютно сухая биомасса на среде Чапека без глюкозы + 300 мг/л АФ.

Анализ данных по удалению алкилфенолов из культуральной жидкости гриба показал, что убыль НФ, равно как и 4-т-ОФ как в условиях кометаболизма, так и без дополнительных источников углерода и энергии происходит, главным образом, за счет процессов биодеструкции и/или биотрансформации исследуемым штаммом и в малой степени за счет клеточной сорбции. Количество связанного с клетками гриба нонилфенола на протяжении всего процесса культивирования составляет от 2.5 до 6.5%. Степень сорбции октилфенола исследуемым штаммом несколько выше – от 3.4 до 18.2%.
Следует отметить, что в абиотическом контроле (без содержания культуры) убыли алкилфенолов не наблюдается, что согласуется с данными других исследователей (Rozalska et al., 2015; Janicki et al., 2016). Так в течение всего периода культивирования штамма – 96 ч – содержание нонил- и октилфенола в абиотическом контроле составляло от 95 до 98% от исходного значения.
Для оценки эффективности удаления алкилфенолов из среды использовали кинетическую модель первого порядка (Rajendran et al., 2017a). Полученные данные по кинетике деградации НФ и 4-т-ОФ штаммом F. solani 8F показали, что процесс деградации соответствует этой модели, значения коэффициентов корреляции (R2) находятся в диапазоне от 0.943 до 0.995 (табл. 2).
Таблица 2.
Кинетические параметры убыли нонил- и 4-трет-октилфенола штаммом Fusarium solani 8F
| Концентрации алкилфенолов, мг/л | Кинетическое уравнение | Константа скорости убыли, К (ч–1) | Период полураспада, t1/2 (ч) | Коэффициент корреляции R2 |
|---|---|---|---|---|
| 1НФ 300 | lnC = –0.077t + 4.605 | 0.077 | 9.0 ± 0.6 | 0.943 |
| 2НФ 300 | lnC = –0.201t + 4.605 | 0.201 | 3.5 ± 0.4 | 0.989 |
| 14-т-ОФ 300 | lnC = –0.035t + 4.605 | 0.035 | 19.7 ± 1.0 | 0.995 |
| 24-т-ОФ 300 | lnC = –0.109t + 4.605 | 0.109 | 6.4 ± 0.7 | 0.979 |
При сравнительном анализе эффективности убыли АФ в культуральной жидкости гриба в условиях кометаболизма и без дополнительных источников углерода и энергии выявлено, что в условиях кометаболизма процесс убыли АФ протекает быстрее – периоды полураспада для НФ и 4-т-ОФ сокращаются в 2.6 и 3.1 раза (р < 0.05) и составляют 3.5 и 6.4 ч при соответствующих возрастающих скоростях убыли АФ (табл. 2). При этом в условиях кометаболизма наблюдается практически полная утилизация – до 95% НФ и до 89% 4-т-ОФ, в то время как максимальное удаление НФ и 4-т-ОФ из культуральной среды без дополнительных источников углерода, составляет 70 и 52%, соответственно (рис. 1). Полученные данные о более быстрой утилизации нонил- и октилфенолов в условиях кометаболизма согласуются с опубликованными результатами зарубежных исследователей (Krupinski et al., 2014; Rajendran et al., 2020).
Анализ кинетики деструкции НФ и 4-т-OФ выделенными штаммами почвенных аскомицетов, в том числе наиболее эффективным деструктором F. solani 8F показал, что исследуемые штаммы по эффективности утилизации ксенобиотиков превосходят ранее известные грибы-деструкторы. Ранее сообщалось, что грибы Candida aquaetextoris и Aspergillus versicolor в отсутствии иных источников углерода и энергии полностью деградировали линейный 4-n-НФ, менее токсичный, чем технический НФ, в концентрации 100 мг/л в течение 14- и 3-суточного инкубирования, соответственно (Vallini et al., 2001; Krupinski et al., 2014). Candida rugopelliculosa RRKY5 и Galactomyces candidum RRK17 и RRK22, выделенные из сточных вод, способны в течение 24 сут разлагать 4-т-OФ как единственный источник углерода и энергии в концентрации 10 мг/л, при этом эффективность утилизации 4-т-OФ была сопоставима с условиями кометаболизма (Rajendran et al., 2016, 2017a). Эффективность деградации 4-т-OФ как единственного источника углерода в концентрации 30 мг/л изолятами мицелиальных аскомицетов родов Fusarium falciforme, F. oxysporum, Aspergillus fumigatus, Trichoderma longibrachiatum, T. asperellum, выделенными из сточных вод, составила от 52 до 73% через 15 сут культивирования (Rajendran et al., 2017b).
Известно, что биодеструкция АФ мицелиальными грибами осуществляется непосредственно при участии различных ферментативных систем – медьсодержащих лакказ, цитохром Р450 монооксигеназ, супероксиддисмутаз и др. (Krupinski et al., 2013; Szewczyk et al., 2014; Cajthaml, 2015; Mtibaà et al., 2020). Из числа неферментативных метаболитов особый интерес вызывают небелковые пептиды, а именно восстановленный глутатион. Наряду с ферментативными метаболитами, восстановленный глутатион является важным внутриклеточным антиоксидантом, играет особую роль в поддержании клеточного редокс-статуса за счет участия в тиол/дисульфидном обмене, что обеспечивает регуляцию целого ряда функций клетки, в том числе регуляцию генной экспрессии, активности отдельных ферментов и ферментных систем. Одной из главных функций внутриклеточного глутатиона является детоксикация загрязняющих веществ и/или их метаболитов, как при непосредственном участии, так и в качестве субстрата для целого ряда ферментов биотрансформации (Smirnov, Sukhovskaya, 2014; Esterhuizen-Londt et al., 2017). При изучении биодеструктирующего потенциала штамма Fusarium solani 8F был проведен анализ изменения протекторных метаболитов – активности супероксиддисмутазы и содержания восстановленного глутатиона. Установлено, что активность СОД в процессе деструкции НФ и 4-т-OФ у штамма F. solani 8F статистически значимо (р > 0.05) не отличается от контрольного уровня (рис. 2, а), в то время как содержание внутриклеточного ГЛУ значимо возрастает в 1.7 и 2 раза (р < 0.05) (рис. 2, б) в зависимости от вида АФ.
Рис. 2.
Активность супероксиддисмутазы (а), содержание восстановленного глутатиона (б) и малонового диальдегида (в) в клетках Fusarium solani 8F в условиях биодеструкции НФ и 4-т-ОФ: 1 – контроль (без содержания АФ); 2 – 300 мг/л НФ; 3 – 300 мг/л 4-т-ОФ.
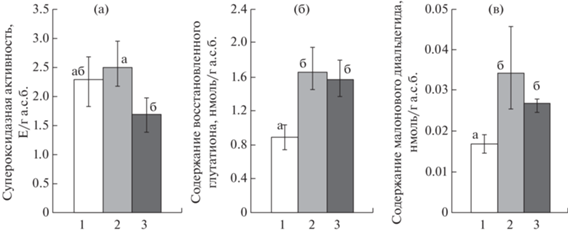
Повышенный уровень содержания ГЛУ у F. solani 8F может свидетельствовать об участии этого метаболита в процессах деструкции НФ и 4-т-OФ, равно как и в обеспечении толерантности штамма к высоким концентрациям алкилфенолов. Известно, что НФ и 4-т-ОФ индуцируют оксидативный стресс у эукариотных клеток посредством накопления в них активных форм кислорода (Chen et al., 2013; Cahyanurani 2017). Одним из возможных компонентов быстрой реакции на стресс является активация перекисного окисления липидов (ПОЛ). Малоновый диальдегид является основным продуктом ПОЛ и часто используется как биологический индикатор развития окислительного стресса различных организмов (Gu et al. 2015). В процессе биодеструкции НФ и 4-т-OФ штаммом F. solani 8F содержание малонового диальдегида в клетках гриба значимо возрастает в 1.7 и 2 раза (р < 0.05), соответственно по сравнению с контролем (рис. 2, в). В этом случае глутатион, обладая антиоксидантными свойствами, может обеспечивать устойчивость штамма к окислительному стрессу, вызванному алкилфенолами.
ЗАКЛЮЧЕНИЕ
Из дерново-подзолистой суглинистой почвы, контаминированной НФ, выделены штаммы грибов – деструкторов технического нонилфенола и 4-трет-октилфенола родов Fusarium, Penicillium и Trichoderma. Изоляты грибов способны осуществлять деструкцию НФ и 4-т-ОФ при высокой нагрузке (300 мг/л). Наиболее активный штамм F. solani 8F обладает способностью к деградации АФ как в условиях кометаболизма, так и без дополнительных источников углерода и энергии. Убыль АФ осуществляется за счет процессов биодеструкции и/или биотрансформации исследуемым штаммом и в малой степени за счет сорбции клетками грибов. Повышенное содержание восстановленного глутатиона в клетках гриба-деструктора может свидетельствовать об участии этого метаболита в процессах детоксикации ксенобиотиков и обеспечении устойчивости штамма к окислительному стрессу. Выявленный высокий потенциал почвенных аскомицетов к деградации алкилфенолов может быть основой новых экологически безопасных биоремедиационных технологий очистки почв, природных и сточных вод, загрязненных гормоноподобными ксенобиотиками.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (№ 122041100086-5).
Список литературы
Barber L.B., Loyo-Rosales J.E., Rice C.P. et al. Endocrine disrupting alkylphenolic chemicals and other contaminants in wastewater treatment plant effluents, urban streams, and fish in the Great Lakes and Upper Mississippi River Regions. Science of the Total Environment. 2015. V. 517. P. 195–206. https://doi.org/10.1016/j.scitotenv.2015.02.035
Beyer W.F., Fridovich I. Assaying for superoxide dismutase activity: some large consequences of minor changes in conditions. Anal. Biochem. 1987. V. 161 (2). P. 559–566. https://doi.org/10.1016/0003-2697(87)90489-1
Bhandari G., Bagheri A.R., Bhatt P. et al. Occurrence, potential ecological risks, and degradation of endocrine disrupter, nonylphenol, from the aqueous environment. Chemosphere. 2021. V. 275. 130013. https://doi.org/10.1016/j.chemosphere.2021.130013
Cahyanurani A.B., Chiu K.H., Wu T.M. Glutathione biosynthesis plays an important role against 4-tert-octylphenol-induced oxidative stress in Ceratophyllum demersum. Chemosphere. 2017. V. 183. P. 56–573. https://doi.org/10.1016/j.chemosphere.2017.05.150
Cajthaml T. Biodegradation of endocrine-disrupting compounds by ligninolytic fungi: mechanisms involved in the degradation. Envir. Microbiol. 2015. V. 17. P. 4822–4834. https://doi.org/10.1111/1462-2920.12460
Catapane M., Nicolucci C., Menale C. et al. Enzymatic removal of estrogenic activity of nonylphenol and octylphenol aqueous solutions by immobilized laccase from Trametes versicolor. J. Hazardous Materials. 2013. V. 248–249. P. 337–346. https://doi.org/10.1016/j.jhazmat.2013.01.031
Chen B.S., Hsiao Y.L., Yen J.H. Effect of octylphenol on physiologic features during growth in Arabidopsis thaliana. Chemosphere. 2013. V. 93. P. 2264–2268. https://doi.org/10.1016/j.chemosphere.2013.08.002
Dhindsa R.S., Plumb-Dhindsa P., Thorpe T.A. Leaf senescence: correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase. J. Experim. Bot. 1981. V. 32 (1). P. 93–101. https://doi.org/10.1093/jxb/32.1.93
Domsch K., Gams W. Compendium of soil fungi. Academic Press, London, 1980.
Esterhuizen-Londt M., Hertel S., Pflugmacher S. Uptake and biotransformation of pure commercial microcystin-LR versus microcystin-LR from a natural cyanobacterial bloom extract in the aquatic fungus Mucor hiemalis. Biotechnol. Lett. 2017. V. 39. P. 1537–1545. https://doi.org/10.1007/s10529-017-2378-2
FAO Water Reports 38, Coping with water scarcity: an action framework for agriculture and food security. Rome, 2012.
Gao Q.T., Tam N.F.Y. Growth, photosynthesis and antioxidant responses of two microalgal species, Chlorella vulgaris and Selenastrum capricornutum, to nonylphenol stress. Chemosphere. 2011. V. 82 (3). P. 346–354. https://doi.org/10.1016/j.chemosphere.2010.10.010
Gingrich J., Ticiani E., Veiga-Lopez A. Placenta disrupted: endocrine disrupting chemicals and pregnancy. Trends Endocrinol. Metabol. 2020. V. 31 (7). P. 508–524. https://doi.org/10.1016/j.tem.2020.03.003
Graca B., Staniszewska M., Zakrzewska D. et al. Reconstruction of the pollution history of alkylphenols (4-tert-octylphenol, 4-nonylphenol) in the Baltic Sea. Environ. Sci. Pollut. Res. 2016. V. 23. P. 11598–11610. https://doi.org/10.1007/s11356-016-6262-8
Gu Y.L., Xu W.H., Liu Y.G. et al. Mechanism of Cr(VI) reduction by Aspergillus niger: enzymatic characteristic, oxidative stress response, and reduction product. Environ. Sci. Pollut. Res. 2015. V. 22. P. 6271–6279. https://doi.org/10.1007/s11356-014-3856-x
Janicki T., Krupinski M., Dlugonski J. Degradation and toxicity reduction of the endocrine disruptors nonylphenol, 4-tert-octylphenol and 4-cumylphenol by the non-ligninolytic fungus Umbelopsis isabellina. Bioresource Technol. 2016. V. 200. P. 223–229. https://doi.org/10.1016/j.biortech.2015.10.034
Jiang L., Yang Y., Zhang Y. et al. Accumulation and toxicological effects of nonylphenol in tomato (Solanum lycopersicum L.) plants. Scientific Reports. 2019. V. 9 (1). https://doi.org/10.1038/s41598-019-43550-7
Kolvenbach B.A., Corvini P.F.X. The degradation of alkylphenols by Sphingomonas sp. TTNP3 – a review on seven years of research. New Biotechnology. 2012. V. 30 (1). P. 88–95. https://doi.org/10.1016/j.nbt.2012.07.008
Krupinski M., Janicki T., Palecz B. et al. Biodegradation and utilization of 4-n-nonylphenol by Aspergillus versicolor as a sole carbon and energy source. J. Hazardous Materials. 2014. V. 280. P. 678–684. https://doi.org/10.1016/j.jhazmat.2014.08.060
Krupinski M., Szewczyk R., Dlugonski J. Detoxification of xenoestrogen nonylphenol by the filamentous fungus Aspergillus versicolor. Int. Biodeterior. Biodegrad. 2013. V. 82. P. 59–66. https://doi.org/10.1016/j.ibiod.2013.03.011
Kuzikova I., Rybalchenko O., Kurashov E. et al. Defense responses of the marine-derived fungus Aspergillus tubingensis to alkylphenols stress. Water, Air, and Soil Pollution. 2020. P. 231. https://doi.org/10.1007/s11270-020-04639-2
Kuzikova I., Safronova V., Zaytseva T. et al. Fate and effects of nonylphenol in the filamentous fungus Penicillium expansum isolated from the bottom sediments of the Gulf of Finland. J. Marine Systems. 2017. V. 171. P. 111–119. https://doi.org/10.1016/j.jmarsys.2016.06.003
Kuzikova I.L., Russu A.D., Medvedeva N.G. Biodegradation of nonylphenol and 4-tert-octylphenol by fungi of genera Penicillium derived from bottom sediments of Gulf of Finland. Mikologiya i fitopatologiya. 2018. V. 52 (2). P. 134–143 (in Russ.).
Kuzikova I.L., Zaytseva T.B., Kichko A.A. et al. Effect of nonylphenols on the abundance and taxonomic structure of the soil microbial community. Eurasian Soil Science. 2019. V. 52 (6). P. 671–681. https://doi.org/10.1134/S1064229319060073
Liu J., Shan J., Jiang B. et al. Degradation and bound-residue formation of nonylphenol in red soil and effects of ammonium. Envir. Pollution. 2014. V. 186. P. 83–89. https://doi.org/10.1016/j.envpol.2013.11.017
Ma J., Chen F., Tang Y. et al. Research on degradation characteristics of nonylphenol in water by highly effective complex microorganisms. E3S Web of Conferences. 2018. V. 53. P. 1–7. https://doi.org/10.1051/e3sconf/20185304016
Moon D.S., Song H.G. Degradation of alkylphenols by white rot fungus Irpex lacteus and its manganese peroxidase. Appl. Biochem. Biotechnol. 2012. V. 168 (3). P. 542–549. https://doi.org/10.1007/s12010-012-9795-4
Mtibaà R., Ezzanad A., Aranda E. et al. Biodegradation and toxicity reduction of nonylphenol, 4-tert-octylphenol and 2,4-dichlorophenol by the ascomycetous fungus Thielavia sp. HJ22: Identification of fungal metabolites and proposal of a putative pathway. Science of the Total Environment. 2020. V. 708. P. 135129. https://doi.org/10.1016/j.scitotenv.2019.135129
Priac A., Morin-Crini N., Druart C. et al. Alkylphenol and alkylphenol polyethoxylates in water and wastewater: A review of options for their elimination. Arabian J. Chemistry. 2017. V. 10. P. 3749–3773. https://doi.org/10.1016/j.arabjc.2014.05.011
Rajendran R.K., Huang S.L., Lin C.C. et al. Aerobic degradation of estrogenic alkylphenols by yeasts isolated from a sewage treatment plant. RSC Adv. 2016. V. 6. P. 82862–82871. https://doi.org/10.1039/C6RA08839B
Rajendran R.K., Huang S.L., Lin C.C. et al. Biodegradation of the endocrine disrupter 4-tert-octylphenol by the yeast strain Candida rugopelliculosa RRKY5 via phenolic ring hydroxylation and alkyl chain oxidation pathways. Bioresource Technol. 2017a. V. 226. P. 55–64. https://doi.org/10.1016/j.biortech.2016.11.129
Rajendran R.K., Lin C.C., Huang S.L. et al. Enrichment, isolation, and biodegradation potential of long-branched chain alkylphenol degrading non-ligninolytic fungi from wastewater. Marine Pollut. Bull. 2017b. V. 125 (1–2). P. 416–425. https://doi.org/10.1016/j.marpolbul.2017.09.04
Rajendran R.K., Lee Y.W., Chou P.H. et al. Biodegradation of the endocrine disrupter 4-t-octylphenol by the non-ligninolytic fungus Fusarium falciforme RRK20: Process optimization, estrogenicity assessment, metabolite identification and proposed pathways. Chemosphere. 2020. V. 240. 124876. https://doi.org/10.1016/j.chemosphere.2019.124876
Rozalska S., Sobon A., Pawlowska J. et al. Biodegradation of nonylphenol by a novel entomopathogenic Metarhizium robertsii strain. Bioresource Technol. 2015. V. 191. P. 166–172. https://doi.org/10.1016/j.biortech.2015.05.011
Samson R.A., Reenen-Hoekstra E.S. Introduction to food-borne fungi. 3rd ed. Baarn, 1988.
Smirnov L.P., Suhovskaya I.V. The role of glutathione in the functioning of antioxidant defense systems and biotransformation (Review). Uchenye zapiski Petrozavodskogo gosudarstvennogo universiteta. 2014. V. 6. P. 34–40 (in Russ.).
Szewczyk R., Sobon A., Rozalska S. et al. Intracellular proteome expression during 4-n-nonylphenol biodegradation by the filamentous fungus Metarhizium robertsii. Int. Biodeterior. Biodegrad. 2014. V. 93. P. 44–53. https://doi.org/10.1016/J.IBIOD.2014.04.026
Tabassum H., Ashafaq M., Parvez S. et al. Role of melatonin in mitigating nonylphenol-induced toxicity in frontal cortex and hippocampus of rat brain. Neurochem. Int. 2017. V. 104. P. 11–26. https://doi.org/10.1016/j.neuint.2016.12.010
Vallini G., Frassinetti S., Andrea F. et al. Biodegradation of 4-(1-nonyl) phenol by axenic cultures of the yeast Candida aquaetextoris: identification of microbial breakdown products and proposal of a possible metabolic pathway. Int. Biodeterior. Biodegrad. 2001. V. 47. P. 133–140. https://doi.org/10.1016/S0964-8305(01)00040-3
Wang J., Majima N., Hirai H. et al. Effective removal of endocrine disrupting compounds by lignin peroxidase from the white-rot fungus Phanerochaete sordida YK-624. Current Microbiol. 2012. V. 64. P. 300–303. https://doi.org/10.1007/s00284-011-0067-2
Wang S., Liu F., Wu W. et al. Migration and health risks of nonylphenol and bisphenol a in soil-winter wheat systems with long-term reclaimed water irrigation. Ecotoxicology and Environmental Safety. 2018. V. 158. P. 28–36. https://doi.org/10.1016/j.ecoenv.2018.03.082
Wang Z., Yang Y., Sun W. et al. Nonylphenol biodegradation in river sediment and associated shifts in community structures of bacteria and ammonia-oxidizing microorganisms. Ecotoxicol. Environ. Saf. 2014. V. 106. P. 1–5. https://doi.org/10.1016/j.ecoenv.2014.04.019
Watanabe W., Hori Y., Nishimura S., Takagi A., Kikuchi M., Sawai J. Bacterial degradation and reduction in the estrogen activity of 4-nonylphenol. Biocontrol Sci. 2012. V. 17 (3). P. 143–147. https://doi.org/10.4265/bio.17.143
Zaytseva T.B., Zinoveva S.V., Kuzikova I.L. et al. Impact of nonylphenols on biological activity of loamy soddy-podzolic soil. Eurasian Soil Science. 2020. V. 53. P. 661–667. https://doi.org/10.1134/S1064229320050178
Кузикова И.Л., Руссу А.Д., Медведева Н.Г. (Kuzikova et al.) Биодеградация нонилфенола и 4-трет-октилфенола грибами родов Penicillium, выделенными из донных осадков Финского залива // Микология и фитопатология. 2018. Т. 52. № 2. С. 134–143.
Смирнов Л.П., Суховская И.В. (Smirnov, Sukhovskaya) Роль глутатиона в функционировании систем антиоксидантной защиты и биотрансформации (обзор) // Ученые записки Петрозаводского государственного университета. 2014. Т. 6. С. 34–40.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


