Нефтехимия, 2020, T. 60, № 6, стр. 854-862
Синтез стерически затрудненных сложных эфиров на основе жирных спиртов ДЛЯ ИСПОЛЬЗОВАНИЯ в качестве потенциальных антиоксидантов для смазочных материалов
Venkateshwarlu Kontham 1, 2, Korlipara V. Padmaja 1, 2, Devarapaga Madhu 1, 3, *
1 Centre for Lipid Science & Technology, CSIR−Indian Institute of Chemical Technology
500007 Telangana, Hyderabad, India
2 Academy of Scientific and Innovative Research
New Delhi, India
3 Department of Chemistry, Indian Institute of Technology (BHU) Varanasi
221005 Varanasi, India
* E-mail: deverapaga.rs.chy14@itbhu.ac.in
Поступила в редакцию 03.03.2020
После доработки 30.06.2020
Принята к публикации 10.07.2020
Аннотация
Путем этерификации были синтезированы четыре затрудненных фенольных эфира, реакция протекала между 3-(3,5-ди-трет-бутилгидроксифенил)пропионовой кислотой и жирными спиртами. Методами ЯМР, ИК и масс-спектрометрией с индуктивно-связанной плазмой (ИСП-МС ESI-MS) изучали характеристики синтезированных сложных эфиров, a также анализировали их антиоксидантные свойства и термическую стабильность. Влияние синтезированных соединений на устойчивость к окислению базового масла оценивали дифференциальной сканирующей калориметрией (DSC) и методом Rancimat. Результаты обоих исследований хорошо коррелировали друг с другом. Термогравиметрический анализ показал, что все эфиры обладают высокой термостабильностью. Среди всех полученных соединений в присутствии сложного эфира миристилового спирта улучшаются антиоксидантные свойства базового масла, тогда как в присутствии сложного эфира стеарилового спирта увеличивается термостабильность. Синтезированные антиоксиданты могут быть потенциальными биодобавками для смазочных материалов.
Смазочные масла широко применяются в промышленности и автомобилестроении для повышения срока службы двигателей, обеспечивая их защиту от износа и трения [1, 2]. Несмотря на очевидные преимущества, смазочные масла обладают плохой окислительной и термической стабильностью. Воздействие высоких температур и постоянный контакт с кислородом из окружающей среды приводят к образованию свободных радикалов [3, 4]. Для улучшения смазочных характеристик и увеличения срока службы в масла вводятся добавки, которые улучшают антикоррозионные, антиоксидантные, трибологические (противоизносные и антифрикционные) свойства [5, 6]. По экологическим нормам, в смазочных материалах должен быть низкий уровень содержания серы, фосфатной золы и присадок, содержащих металлы [7–9]. В связи с этим был синтезирован ряд добавок к маслам, не включающих металлы, и охарактеризованы их трибологические свойства и поведение в сравнении с традиционными многофункциональными добавками – диалкилдитиофосфатами цинка (ZDDP). Окислительное разложение смазочных материалов обычно приводит к образованию первичных и вторичных продуктов окисления (пероксидов, карбоновых кислот, спиртов, альдегидов и кетонов), которые изменяют физические и химические свойства базовой основы [10]. Таким образом, антиоксиданты необходимы для замедления или предотвращения процесса окисления смазочных материалов путем ингибирования образования свободных радикалов [11–13].
Экранированные фенолы и ариламины являются хорошо известными антиоксидантными присадками к смазочным маслам [10, 14]. Экранированные фенольные соединения выступают донорами водорода и, тем самым, нейтрализуют алкокси- и алкилперокси-радикалы [10, 15]. Некоторые из этих соединений (стерически затрудненные фенольные соединения, SHP) являются хорошо известными на рынке антиоксидантами, к примеру, BHT (бутилированный гидрокситолуол), BHA (бутилированный гидроксианизол) и TBHQ (трет-бутилгидрохинон) [16, 17]. Амидирование и этерификация фенольных кислот и алкилфенолов представляют собой практические методы для повышения их растворимости и эмульгирующих свойств, а также эффективности ингибирования при окислении [18, 19]. Yu и др. синтезировали антиоксиданты фенольного дифениламина на основе оснований Шиффа с мостиковыми связями. В результате, авторы обнаружили, что соединения имеют лучшую термостабильность и антиоксидантную эффективность в базовом масле 150SN [20]. Однако, из-за опасений ввиду негативного воздействия присадок на основе минеральных масел на окружающую среду, растет интерес к использованию биологических масел [21, 22]. Олеохимические добавки имеют лучшую способность к биологическому разложению по сравнению с традиционными добавками, полученными из нефти, благодаря наличию природных компонентов и отсутствию ионов металлов [14]. Биоорганические добавки также в значительной степени улучшают окислительную стабильность и трибологические характеристики базового масла. В данной работе представлен синтез экранированных сложных эфиров с длинноцепочечными жирными спиртами (C14, C11:1, C18 и C18:1), изучены характеристики синтезированных соединений методами NMR, IR и ESI-MS, а также представлен анализ антиокислительных свойств и термостабильности экологически чистого базового масла.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
3-(3,5-Ди-трет-бутил-4-гидроксифенил) пропионовая кислота, миристиловый спирт, стеариловый спирт, 10-ундеценол, олеиловый спирт, 1‑этил-3 (3-диметиламинопропил)карбодимид гидрохлорид (EDC ⋅ HCl) и 4-диметиламинопиридин (DMAP) были приобретены в компании Sigma-Aldrich (Сент-Луис, США). Силикагель (60–120 меш) для колоночной хроматографии был приобретен в компании M/s AcmeSynthetic Chemicals (Мумбаи, Индия), платы TLS с предварительно нанесенным покрытием (силикагель 60 F254) были приобретены в компании M/s Merck (Дармштадт, Германия). Все растворители были приобретены в компании M/s SD Fine Chemicals (Мумбаи, Индия) и имели наивысшую степень чистоты.
Характеристика
Спектры 1Н ЯМР и 13С ЯМР регистрировали на Varian 300 при 75 МГц, в качестве внутреннего стандарта использовали TMS. Масс-спектры регистрировали с использованием ионизационного распыления электронов на сепараторном модуле Waters e2695 (Waters, Milford, MA, USA). ИК-спектры регистрировали в дихлорметане на приборе Perkin-Elmer с инфракрасным спектром BX и преобразованием Фурье (FT-IR) (модель: Spectrum BX; Коннектикут, США).
Общая процедура синтеза сложных эфиров (2a–2d)
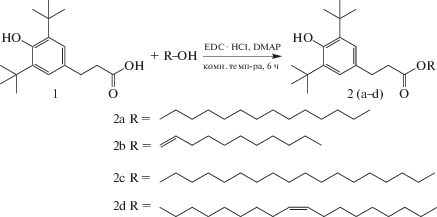
Смесь 3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионовой кислоты (1.0 г, 3.6 ммоль), жирного спирта (5.4 ммоль) и EDC ⋅ HCl (0.67 г, 4.3 ммоль) растворяли в сухой DCM (20 мл), перемешивали при комнатной температуре в течение 20 мин и добавляли DMAP (0.43 г, 3.6 ммоль), далее перемешивание продолжали в течение 6 ч. Образование продукта контролировали с помощью ТСХ (гексан/этилацетат 90 : 10, об./об.). После завершения реакции реакционную смесь экстрагировали в этилацетат, промывали водой и сушили над сульфатом натрия. Полученный неочищенный продукт подвергали колоночной хроматографии с использованием гексана и этилацетата (90 : 10, об./об.). Процедуру повторяли до получения чистого продукта.
Синтез тетрадецил-3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионата (2а). Количество взятых субстратов: 3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионовая кислота (1.0 г, 3.6 ммоль), миристиловый спирт (1.15 г, 5.4 ммоль), EDC ⋅ HCl (0.67 г, 4.3 ммоль) и DMAP (0.43 г, 3.6 ммоль), выход продукта составил 93% (1.6 г) твердого вещества бледно-желтого цвета. Т. пл. 47–48°C; 1H ЯМР (CDCl3, ppm) δ 0.88 (t, 3H, –CH3), 1.25–1.33 (m, 20H, 10x–CH2), 1.42 (s, 18H, 6x–CH3), 1.54–1.64 (m, 2H, –CH2), 2.55–2.64 (t, 2H, –CH2CO), 2.84–2.90 (t, 2H, –CH2–Ar), 4.0–4.11 (t, 2H, –OCH2), 6.99 (s, 1H), 7.25 (s, 2H); 13C ЯМР (CDCl3, ppm) δ 14.1, 22.7, 25, 29.3, 29.6, 31.6, 34.2, 36.5, 64.7, 124.7, 131.1, 135.9, 152.0, 173.4; ИК (cм–1, CHCl3): 3641, 2927, 2860, 1732, 1443, 1232, 1160, 879; ESIMS: m/z 497 [M + Na]+.
Синтез ундец-10-ен-ил3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионата (2b). Количество взятых субстратов: 3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионовая кислота (1.0 г, 3.6 ммоль), 10-ундеценол (0.92 г, 5.4 ммоль) и EDC ⋅ HCl (0.67 г, 4.3 ммоль) DMAP (0. 43 г, 3.6 ммоль), выход продукта составил 95% (1.48 г) твердого вещества бледно-желтого цвета. Т. пл. 32–33°C; 1H ЯМР (CDCl3, ppm) δ 0.88 (t, 3H, –CH3), 1.24–1.34 (m, 14H, 7x–CH2), 1.39–1.45 (s, 18H, 6x3–CH3), 1.56–1.66 (m, 2H, –CH2), 2.57–2.64 (t, 2H–CH2CO), 2.86–2.94 (t, 2H, –CH2–Ar), 4.08–4.12 (t, 2H, –OCH2), 4.95 (m, 2H), 5.80 (m, 1H), 6.84 (s, 1H), 7.26 (s, 2H); 13C ЯМР (CDCl3, ppm) δ 14.1, 22.7, 25, 29.3, 29.6, 32.6, 34.4, 36.2, 64.8, 115.7, 123.4, 131.3, 135.6, 152.7, 173.6; ИК (см–1, CHCl3): 3640, 3068, 2925, 2864, 1730, 1639, 1453, 1261, 1177, 802; ESIMS: m/z 453 [M + Na]+.
Синтез октадецил-3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионата (2с). Количество взятых субстратов: 3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионовая кислота (1.0 г, 3.6 ммоль), стеариловый спирт (1.45 г, 5.4 ммоль) и EDC ⋅ HCl (0.67 г, 4.3 ммоль) DMAP (0.45 г, 3.6 ммоль), выход продукта составил 97% (1.84 г) твердого вещества бледно-желтого цвета. Т. пл. 55–56°C; 1H ЯМР (CDCl3, ppm) δ 0.88 (t, 3H, –CH3), 1.25–1.33 (m, 30H, 15x–CH2), 1.44 (s, 18H, 6x–CH3), 1.56–1.64 (m, 2H, –CH2), 2.56–2.63 (t, 2H,–CH2CO), 2.83–2.90 (t, 2H, –CH2–Ar), 4.0–4.11 (t, 2H, –OCH2), 7.01 (s, 1H), 7.27 (s, 2H); 13C ЯМР (CDCl3, ppm) δ 14.1, 22.6, 25, 29.3, 29.6, 31.7, 34.2, 36.7, 64.6, 124.6, 131.8, 135.7, 152.0, 173.2; ИК (cм–1, CHCl3): 3642, 2924, 2857, 1732, 1444, 1360, 1235, 1160, 874; ESIMS: m/z 553 [M + Na]+.
Синтез (Z) окта-дец-9-ен-ил-3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионата (2d). Количество взятых субстратов: 3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионовая кислота (1.0 г, 3.6 ммоль), олеиловый спирт (1.44 г, 5.4 ммоль) и EDC ⋅ HCl (0.67 г, 4.3 ммоль) DMAP (0.43 г, 3.6 ммоль), выход продукта составил 95% (1.80 г) твердого вещества бледно-желтого цвета. Т. пл. 38–39°C; 1H ЯМР (CDCl3, ppm) δ 0.87 (t, 3H, –CH3), 1.25–1.33 (m, 22H, 11x–CH2), 1.43 (s, 18H, 6x‒CH3), 1.56–1.63 (m, 2H, –CH2), 1.99–2.04 (m, 4H, 2x–CH2), 2.56–2.61 (t, 2H, –CH2CO), 2.84–2.90 (t, 2H, –CH2–Ar), 4.0–4.10 (t, 2H, –OCH2), 5.36 (m, 2H, –HC=CH), 6.99 (s, 1H), 7.27 (s, 2H); 13C ЯМР (CDCl3, ppm) δ 14.1, 22.7, 25, 29.3, 29.6, 32.8, 34.2, 36.8, 64.7, 124.8, 129.3, 131.2, 135.2, 152.2, 173.4; ИК (cм–1, CHCl3): 3644, 2924, 2862, 1736, 1466, 1360, 1233, 1162, 876; ESIMS: m/z 551 [M + Na]+.
Анализ Rancimat
Индукционный период окисления (OIT) исследовали на приборе Metrohm Rancimat, модель 743 (Herisau/Switzerland), в соответствии с официальным методом AOCSCd 12b-92. Проводимость дистиллированной воды (60 мл) измеряли непрерывным потоком воздуха (20 л/ч), барботируемым в базовое масло (5 г) при температурах 110 и 140°С. Полученные летучие компоненты собирали в воде. Время, необходимое для достижения перегиба проводимости, регистрировали как OIT [23]. По данной методике проводили два анализа, конечные значения регистрировали как среднеарифметическое по двум результатам.
Дифференциальный сканирующий калориметрический анализ
Индукционный период окисления (OIT) и температуру начала окисления (OT) измеряли с помощью дифференциального сканирующего калориметра (DSC) в соответствии с методикой ASTME 2009-08. Анализы DSC проводили на тепловом анализаторе Q-100 от компании ТА Instruments при непрерывном потоке кислорода со скоростью 50 мл/мин в изотермическом режиме. Температуру повышали от 40 до 140°С. В соответствии с методикой 5 ± 0.5 мг тестируемого образца взвешивали в герметичной алюминиевой чашке и помещали в камеру оборудования. Аналогичным образом неизотермические испытания проводили в кислородной среде при повышении температуры со скоростью 10°С/мин до появления экзотермического пика. OIT и OT анализировали с использованием универсального программного обеспечения компании TA. Тангенс угла наклона кривых был определен путем экстраполяции базовой линии до максимального экзотермического пика.
Термогравиметрический анализ
Для определения термостабильности в неизотермическом режиме использовали прибор TA Q500 (TA Instruments, Inc., Нью-Касл, Германия, США). Образец 4 ± 0.5 мг отбирали в тигель α-Al2O3, далее исследования проводили в диапазоне температур около 40–400°С со скоростью нагрева 10°С/мин при непрерывном потоке газообразного азота 60 мл/мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез и спектральный анализ. Стерически затрудненные сложные эфиры фенолов были синтезированы с участием различных жирных спиртов с использованием катализаторов EDC, HCl и DMAP, выходы продуктов составили от 93 до 97% (схема 1). Полученные сложные эфиры были охарактеризованы с помощью 1Н ЯМР, 13С ЯМР, ИК- и масс-спектральных исследований. Характерные триплетные пики, появившиеся в 1Н ЯМР при 4.08–4.13 и 2.54–2.64 ppm соответствуют метиленовым протонам алкильной цепи, присоединенным к карбонильному кислороду, и протонам α, присоединенным к карбонильному углероду соответственно. Пики, присутствующие при 1.24–1.32 ppm, обусловлены протонами жирных алкильных цепей, тогда как значения химического сдвига, наблюдаемые при 4.95–5.80 ppm, указывают на присутствие ненасыщенных протонов (для продуктов 2b и 2d). Сигналы, появляющиеся при 7.26 ppm, подтверждают наличие фенильного кольца. В спектрах 13C ЯМР явный пик, появляющийся при 173.2–173.6 ppm, обусловлен карбонильным углеродом, в то время как пик, наблюдаемый при 64.6–64.8 ppm, соответствует углероду алкильной цепи, присоединенному к карбонильной группе. Пики, наблюдаемые при 22.7–34.4 ppm и 123.4–152.9 ppm, соответствуют сигналам атомов углерода алкильной цепи и ароматического углерода соответственно. В спектрах ИК-Фурье явный пик, появившийся при 3640–3644 см–1, указывает на присутствие фенольного ОН, а характерные пики, наблюдаемые при 1732–1736 см–1 и 1160–1177 см–1, относятся к сложноэфирной группе. Пики, появляющиеся при ∼2927 и ∼2864 см–1, обусловлены симметричной и асимметричной полосами растяжения алкильной цепи. Более того, молекулярные ионы m/z при 497, 453, 553, 551 [M + Na]+, полученные с помощью позитивного режима спектров ESI, дополнительно подтверждают образование целевых молекул. Соединение окта-децил-3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионат (2с) коммерчески известно как Irganox 1076 и действует как антиоксидант [24, 25]. В настоящем исследовании аналогичный класс новых соединений Ir-ganox 1076 синтезировали путем варьирования жирной алкильной цепи, а также изучали влияние алкильной цепи на окисление и термическую стабильность соединения.
Схема 1. Синтез сложных эфиров жирных спиртов 3-(3,5-ди-трет-бутил-4-гидроксифенил) пропионовой кислоты.
Антиоксидантная активность по Rancimat
Антиоксидантную активность базового масла, содержащего синтезированные добавки, оценивали посредством измерения периода индукции окисления (OIT) путем проведения анализа по методу Rancimat. Значение OIT получали посредством построения графика зависимости проводимости от времени, где высокое значение OIT указывало на большую устойчивость соединения к окислению [26]. Анализ проводили на базовом масле без добавок и на образцах базового масла с концентрациями добавок 100 и 200 ppm, через образцы базовых масел пропускали поток атмосферного воздуха при температурах 110 и 140°C. Каждый образец тестировали по три раза, конечный результат фиксировали как среднее значение по трем точкам с учетом стандартного отклонения. Для всех тестируемых образцов по методу Rancimat наблюдаются в значительной степени (P < 0.001) более высокие показатели OIT, чем для DSK (односторонний тест ANOVA). Полученные значения OIT приведены в табл. 1 (***P < 0.001; нс: несущественно). Из полученных результатов следует, что уже при концентрации присадок 100 ppm улучшается устойчивость к окислению базового масла. Обычно период индукции для базового масла составляет 25.6 ч при 110°C и 1.55 ч при 140°C. Для образца базового масла с добавкой 2а периоды индукции были увеличены до 43.24 при 110°C и 4.63 ч при 40°C. Дальнейшее увеличение концентрации присадок до 200 ppm приводит к улучшению устойчивости образцов к окислению. Показатели OIT для базового масла с добавкой 2а увеличились до 49.23 ч при 110°C и 12.36 ч при 140°C, что в 1.9 раза выше, чем при концентрации 100 ppm. Все синтезированные добавки в положительной степени повлияли на стабильность базовых масел, это обусловлено природой алкильной цепи. Ненасыщенность в алкильной цепи оказывает существенное влияние на значения ITO для сложных эфиров SHP. Ненасыщенные алкильные цепи, содержащие сложные эфиры, показали более низкую способность к ингибированию окисления, чем насыщенные сложные эфиры. Это связано с тем, что аллильные положения в двойных связях подвержены окислению [27, 28].
Таблица 1.
Периоды индукции окисления базового масла и базового масла, содержащего синтезированные антиоксиданты, оцененное с помощью метода Rancimat и изотермического метода DSC
| Образцы | Значения OIT Rancimat, ч | Значения OITDSC, ч | |||
|---|---|---|---|---|---|
| концентрация | |||||
| 100 ppm | 200 ppm | 200 ppm | |||
| 110°C | 140°C | 110°C | 140°C | 140°C | |
| Базовое масло | 26.96 ± 0.72*** | 1.55 ± 0.21нс | – | – | 2.96 ± 0.34 |
| B + 2a | 43.24 ± 0.79*** | 4.63 ± 0.61нс | 49.23 ± 1.68*** | 12.36 ± 0.36*** | 4.33 ± 0.10 |
| B + 2b | 30.47 ± 0.56*** | 4.16 ± 0.39нс | 32.42 ± 0.88*** | 7.52 ± 0.60*** | 4.10 ± 0.48 |
| B + 2c | 42.52 ± 0.74*** | 4.48 ± 0.19нс | 46.41 ± 0.98*** | 11.45 ± 0.21*** | 4.24 ± 0.32 |
| B + 2d | 29.37 ± 0.38*** | 4.16 ± 0.28нс | 37.46 ± 0.68*** | 8.94 ± 0.11*** | 4.18 ± 0.35 |
| B + BHT | 28.46 ± 0.61*** | 3.26 ± 0.36нс | 30.24 ± 0.85*** | 8.56 ± 0.47*** | 3.96 ± 0.57 |
Антиокислительная активность по DSC (изотермическая)
Изотермическая дифференциальная сканирующая калориметрия использовалась для определения времени индукции окисления [29, 30]. Для определения антиокислительной активности синтезированных соединений готовили образцы на основе базового масла с концентрацией антиоксидантов 200 ppm. Из результатов, представленных в табл. 1, следует, что показатель OIT в образцах с добавкой 2а увеличивался от 2.96 до 4.33 ч. Явное сокращение времени окисления образцов свидетельствует об эффективности добавления синтезированных соединений. Наилучшими характеристиками по антиокислительной активности обладает добавка 2а, далее активность снижается в присутствии добавок 2с и 2d. Наименьший показатель OIT наблюдается в образце с добавкой 2b, это может быть связано с наличием в соединении терминальной ненасыщенности. Все синтезированные соединения показали превосходные характеристики по сравнению с BHT. Каждый образец тестировали по три раза, конечный результат фиксировали как среднее значение по трем точкам с учетом стандартного отклонения.
На рис. 1 представлена сравнительная характеристика результатов OIT Rancimat и OIT DSC. Согласно двухстороннему тесту ANOVA (тест множественного сравнения Тьюки), для всех тестируемых образцов по методу Rancimat наблюдаются в значительной степени (P < 0.001) более высокие показатели OIT, чем для DSK. Однако, показатели OIT, полученные на образцах в присутствии добавок, в значительной степени (P < 0.001) выше по сравнению с показателями, снятыми с образца базового масла без добавок (рис. 1б). Разница в величине показателей OIT по Rancimat и DSK обусловлена количеством синтезированных соединений в образцах: в DSK использовалось исключительно небольшое количество добавок (3–5 мг), тогда как в методе Rancimat количество добавок составляло около 5 г. Другим важным фактором является соотношение объема поверхности между исследуемым образцом и кислородом. Обычно, в методе Rancimat отношение объема поверхности к объему образца, помещенного в пробирку, меньше, чем в методе DSC [31]. От значения объема поверхности или количества добавки зависит эффективность протекания реакции окисления. Также анализ Rancimat проводился с потоком воздуха, в то время как в тестах DSC применялся чистый кислород, в связи с чем показатели OIT, полученные с помощью анализа DSG, фиксируются быстрее, чем при анализе Rancimat [28]. На рис. 2 представлена корреляция между значениями OIT, полученными разными методами. Из результатов следует, что корреляция достаточно хорошая. Она рассчитывалась по коэффициенту корреляции Пирсона [26]. Из расчета следует, что наблюдается положительная линейная корреляция между значениями (R2 = 0.875).
Рис. 1.
(а) Антиокислительная эффективность синтезированных соединений. (б) Сравнение времени индукции по DSC и времени индукции по Rancimat при 140°С и концентрации добавки 200 ppm.

Температура начала окисления по DSC (неизотермическая). Неизотермические DSC-тесты использовались для определения температуры начала окисления (ОТ) и максимальной температуры сигнала (SM) в течение короткого промежутка времени. Значения ОТ регистрировали при появлении экзотермического пика по отношению к тепловому потоку, что свидетельствовало о начале окисления. Каждый образец тестировали по три раза, конечный результат фиксировали как среднее значение по трем точкам с учетом стандартного отклонения. Из рис. 3 видно, что при добавлении присадок к базовому маслу с концентрацией 200 ppm повышается его устойчивость к окислению. Присутствие присадки 2a улучшает начальную стабильность к окислению базового масла с 180 до 241°C, тогда как присутствие присадок 2b, 2c и 2d улучшает стабильность к окислению до 231, 238 и 231°C соответственно. По сравнению с коммерчески доступным антиоксидантом BHТ (229°C) присутствие всех синтезированных присадок улучшает устойчивость к окислению базового масла. В дополнение к значениям OT значения температуры SM также улучшились при испытаниях присадок в диапазоне от 268 до 291°C (табл. 2) по сравнению со значением SM базового масла при 205°C, в то время как коммерческая добавка BHT способна улучшить значение SM базового масла только до 257°C. Средние различия температур устойчивости к окислению (OT и SM) синтезированных добавок (односторонний тест ANOVA) показали, что присутствовали статистически значимые более высокие значения OT и SM по сравнению с BHT (P < 0.001). Улучшение показателей по температурам ОТ и SM базового масла с присадками подтверждают высокую антиокислительную эффективность синтезированных сложных эфиров SHP (***P < 0.001 по сравнению с B + BHT; нс: несущественно).
Таблица 2.
Антиокислительная активность сложных эфиров SHP в базовом масле при концентрации 200 ppm, оцененная неизотермическим методом DSC
| Образцы | OIT, °С | SM, °С |
|---|---|---|
| Базовое масло | 180 ± 0.81*** | 205 ± 0.92*** |
| B + 2a | 241 ± 0.63*** | 291 ± 1.25*** |
| B + 2b | 231 ± 1.13нс | 268 ± 2.28*** |
| B + 2c | 238 ± 1.81*** | 286 ± 1.40*** |
| B + 2d | 231 ± 0.81нс | 285 ± 3.18*** |
| B + BHT | 229 ±1.23 | 257 ± 3.46 |
Термогравиметрический анализ. Для описания диапазона рабочих температур синтезированных добавок была исследована термическая стабильность синтезированных сложных эфиров SHP с помощью термогравиметрического анализа (TGA). Термограммы получали путем построения графика зависимости температуры от потери массы (мас. %) (рис. 4). Каждый образец тестировали по три раза, конечный результат фиксировали как среднее значение по трем точкам с учетом стандартного отклонения. На рис. 4 и в табл. 3 показаны значения начальных температур разложения (Td) и максимальных температур разложения (Td max) для всех синтезированных добавок. Стабильность колеблется от 243 до 290°С, тогда как для 3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионовой кислоты (1) температура составляет 178°С. Средние различия температур термического разложения (Td и Td max) синтезированных добавок (односторонний тест ANOVA) показали, что были статистически значимые более высокие температуры термического разложения по сравнению с 1 образцом (P < 0.001) (***P < 0.001). Изменение термостабильности связано с длиной алкильной цепи и ненасыщенностью соединения [32].
Таблица 3.
Термостойкость сложных эфиров SHP Td и Td max
| Образцы | Td | Td max |
|---|---|---|
| 1 | 178 ± 1.58 | 300 ± 4.21 |
| 2a | 283 ± 2.26*** | 355 ± 4.16*** |
| 2b | 243 ± 2.50*** | 331 ± 2.54*** |
| 2c | 290 ± 3.04*** | 360 ± 3.54*** |
| 2d | 260 ± 0.94*** | 341 ± 2.48*** |
Таким образом, представлен синтез четырех стерически затрудненных фенольных эфиров и оценена их антиоксидантная эффективность в смазочном базовом масле с использованием методов Rancimat и DSC. Результаты, полученные обоими методами, хорошо совпадали друг с другом. Показатели изотермических OIT и неизотермических OT также хорошо коррелировали, и существует почти линейная связь с каждым сложным эфиром SHP. Испытания термостабильности по методу TGA показало, что все синтезированные сложные эфиры разлагаются при высоких температурах. По сравнению с BHT, все синтезированные сложные эфиры демонстрировали превосходные антиокислительные свойства в базовом масле с точки зрения увеличения периода индукции и температуры начала окисления.
Список литературы
Liu X., Shi X., Huang Y.,Deng X.,Yan Z., Xue B. // J. Alloy. Compd. 2018. V. 765. P. 7.
Minami I., Kamimura H., Mori S. // J. Synth. Lubr. 2007. V. 24. P. 135.
Kouame S.D., Liu E. // Tribol. Int. 2014. V. 72. P. 58.
Omrani H., Dudelzak A.E., Hollebone B.P., Loock H.-P. // Anal. Chim. Acta. 2014. V. 811. P. 1.
Borda F.L.G., de Oliveira S.J.R., Lazaro L.M.S.M., Leiróz A J.K. // Tribol. Int. 2018. V. 117. P. 52.
Oulego P., Blanco D., Ramos D., Viesca J.L., Díaz M., Hernández Battez A. // J. Mol. Liq. 2018. V. 272. P. 937.
Migdal C.A. Antioxidants, Lubricant Additives Chemistry and Applications, Ed. by Rudnick L.R. New York: Marcel Dekker, Inc., 2003. P. 1–28.
Jaiswal V., Kalyani, Rastogi R.B., Kumar R. // J. Mater. Chem. A. 2014. V. 2. P. 10 424.
Jaiswal V., Gupta S.R., Rastogi R.B., Kumar R., Singh V.P. // J. Mater. Chem. A. 2015. V. 3. P. 5092.
Wu Y., Li W., Zhang M., Wang X. // Thermochim. Acta. 2013. V. 569. P. 112.
Fox N.J., Stachowiak G.W. // Tribol. Int. 2007. V. 40. P. 1035.
Ohkatsu Y., Nishiyama T. // Polym. Degrad. Stab. 2000. V. 67. P. 313.
Tan K.H., Awala H., Mukti R.R., Wong K.-L., Ling T.C., Mintova S., Ng E.-P. // J. Taiwan. Inst. Chem. Eng. 2016. V. 58. P. 565.
Singh R.K., Kukrety A., Singh A.K. // ACS. Sustain. Chem. Eng. 2014. V. 2. P. 1959.
Nath A.R., Yehye W.A., Zulkifli N.W.M., Johan M.R. // Thermochim. Acta. 2018. V. 670. P. 7.
Huang L., Ma J., Wang X., Zhang P., Yu L., Zhang S. // Tribol. Int. 2018. V. 121. P. 114.
Loh S.K., Chew S.M., Choo Y.M. // J. Am. Oil Chem. Soc. 2006. V. 83. P. 947.
Muniz-Wypych A.S., da Costa M.M., Oliveira A.R., Neu P.M., Schober S., Mittelbach M., Ramos L.P., César-Oliveira M.A.F. // Eur. J. Lipid Sci. Tech. 2017. V. 119. P. 1 700 179.
Nakamura K., Nakajima T., Aoyama T., Okitsu S., Koyama M. // Tetrahedron. 2014. V. 70. P. 8097.
Yu S., Feng J., Cai T., Liu S. // Ind. Eng. Chem. Res. 2017. V. 56. P. 4196.
Chan C.H., Tang S.W., Mohd N.K., Huei Lim W., Yeong S.K., Idris Z. // Renew. Sust. Energ. Rev. 2018. V. 93. P. 145.
Nagendramma P., Khatri P.K., Thakre G.D. // J. Mol. Liq. 2017. V. 244. P. 219.
AOCS, Official methods and recommended practices of the American Oil Chemists’ Society, 5th ed., Champaign, AOCS press, USA, 1997.
Xu A., Roland S., Colin X. // Polym. Degrad. Stabil. 2020. V. 171. P. 109046.
Matisova-Rychla L., Rychly J. // Polym. Degrad. Stabil. 2001. V. 73. P. 393.
Liang Y.C., May C.Y., Foon C.S., Ngan M.A., Hock C.C., Basiron Y. // Fuel. 2006. V. 85. P. 867.
Knothe G. // Fuel. Process. Technol. 2005. V. 86. P. 1059.
Leonardo R.S., Murta Valle M.L., Dweck J. // J. Therm. Anal. Calorim. 2012. V. 108. P. 751.
Pardauil J.J., Souza L.K., Molfetta F.A., Zamian J.R., Filho G.N.R., da Costa C.E.F. // Bioresour. Technol. 2011. V. 102. P. 5873.
Yaakob Z., Narayanan B.N., Padikkaparambil S. // Renew. Sust. Energ. Rev. 2014. V. 35. P. 136.
Tan C.P., Che Man Y.B., Selamat J., Yusoff M.S.A. // Food Chem. 2002. V. 76. P. 385.
Vagvala T.C., Pandey S.S., Krishnamurthy S., Hayase S. // Z. Anorg. Allg. Chem. 2016. V. 642. P. 134.
Дополнительные материалы отсутствуют.