Нефтехимия, 2020, T. 60, № 6, стр. 844-853
Исследование термической стабильности 4-(1-адамантил)фенола
В. А. Шакун 1, *, Т. Н. Нестерова 1, С. В. Таразанов 2, В. С. Саркисова 1
1 Самарский государственный технический университет (СамГТУ)
43100 Самара, Россия
2 Всероссийский научно-исследовательский институт по переработке нефти
111116 Москва, Россия
* E-mail: ShakyH@mail.ru
Поступила в редакцию 06.06.2020
После доработки 03.07.2020
Принята к публикации 10.07.2020
Аннотация
В диапазоне температур 703–753 K изучена термическая стабильность 4-(1-адамантил)фенола, произведена идентификация компонентов реакционной массы термолиза, рассчитаны константы скорости и параметры уравнения Аррениуса для термической деструкции исследуемого соединения. Установлено значительное преобладание термической стабильности 4-(1-адамантил)фенола по сравнению с 4-трет-бутилфенолом.
Известно, что модификация органических соединений и полимеров адамантаном и его производными сообщает материалам дополнительную устойчивость к экстремальным механическим воздействиям и повышает их термоокислительную стабильность.
В настоящее время большое внимание уделяется эфирам карбоновых кислот адамантанового ряда как перспективным компонентам термостойких смазочных масел. Так, в работе [1] Е.И. Багрием и Г.Б. Маравиным произведена оценка вязкостно-температурных свойств и термоокислительной стабильности алкиловых эфиров 5,7-диметиладамантан-1,3-дикарбоновых кислот и показаны их преимущества над штатными высокотемпературными маслами. Авторами рекомендовано использование подобных структур в качестве термостойких синтетических смазочных масел для газотурбинных установок, а также в качестве кабельного масла – благодаря сильным электроизоляционным свойствам. Результаты работ [2–5], в которых выполнены обширные исследования физико-химических характеристик и термоокислительной стабильности сложных эфиров двухосновных карбоновых кислот адамантанового ряда, также показывают серьезные преимущества данного типа соединений в разработке уникальных смазывающих материалов.
В создании перспективных полимеров производные адамантана также представляют большой интерес. Например, в работах [6, 7] показано, что эпоксидные смолы, на основе 1,3-бис-(4-гидроксифенил)адамантана характеризуются повышенной твердостью и термостойкостью, а также улучшенными диэлектрическими свойствами. Согласно данным патента [8] сополимеры диалкиладамантана и ди-трет-бутилбензолов обладают высокой температурой стеклования (182°С), устойчивы к экстремальным температурам и термоокислительной деструкции и находят применение в качестве защитных покрытий.
Результаты исследований, посвященных адамантилфенолам, свидетельствуют о возможности их эффективного применения в качестве ингибиторов и антиоксидантов. Соколенко и др. [9] показано, что 4-(1-адамантил)фенол, 2,4-ди-(1-адамантил)фенол проявляют высокую антиокислительную активность на примере модельной реакции окисления кумола. В работах [10, 11] обсуждаются перспективы применения адамантилзамещенных фенолов, крезолов, пирокатехина и гидрохинона в качестве ингибиторов радикально-цепной полимеризации при переработке жидких продуктов пиролиза.
В целом, учитывая приведенную выше информацию, вопрос термической стабильности производных адамантана, в том числе адамантиларенов, играет серьезную роль в разработке перспективных полимерных и смазывающих материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные вещества
4-(1-Адамантил)фенол (4-(1-Ад)Ф) был синтезирован в результате алкилирования фенола (предоставлен АО “ННК”, 99.9 мас. % по ГЖХ) 1-бромадамантаном в стеклянном реакторе с рубашкой, снабженном перемешивающим устройством и обратным холодильником, при температуре 353 K. Термостатирование обеспечивалось кипящим в рубашке реактора бензолом.
В расплав фенола вносили 30 мас. % сульфокатионита Amberlyst 36 Dry, предварительно высушенного до постоянной массы при 105°С в воздушном термостате, и выдерживали 30 мин при постоянном перемешивании для набухания катализатора. После чего добавляли 1-бромадамантан и продолжали перемешивание в течение еще 30 мин. Мольное соотношение фенол/1-бромадамантан находилось в диапазоне (4–3)/1.
Вакуумным фильтрованием отделяли катализатор от реакционной массы, промывали его на фильтре горячим ацетонитрилом, а полученный раствор объединяли с продуктами реакции. Растворитель отгоняли при атмосферном давлении, избыток фенола – под вакуумом. Остаток перекристаллизовывали из ацетонитрила, выпавшие белые игольчатые кристаллы отфильтровывали и сушили при комнатной температуре. После удаления растворителя концентрация 4-(1-Ад)Ф составила 99.9 мас. % по ГЖХ.
Методика исследования термолиза 4-(1-Ад)Ф
Исследование термической стабильности 4-(1-Ад)Ф в газовой фазе проводили в интервале температур 703–753 K (с шагом в 5 K) путем термостатирования в реакторах закрытого типа – запаянных с двух сторон стеклянных капиллярах. Вещества предварительно осушались от влаги; капилляр после загрузки продувался гелием. Схема печи, на которой осуществлялось термостатирование образцов, представлена в работе [12], посвященной исследованию термической стабильности 4-трет-бутилфенола (4-ТБФ). Точность поддержания температуры в изотермической зоне обеспечивалась в пределах ±1°C. Время достижения изотермического режима после помещения капилляра в печь не превышало 60 с. Процесс пиролиза завершался процедурой закалки в охлажденной пробирке. После чего капилляр надпиливали надфилем, погружали в пробирку с растворителем и надламывали стержнем из нержавеющей стали. В качестве растворителя использовали этанол.
Исследование кинетики термолиза 4-(1-Ад)Ф проводили при величине конверсии в пределах 30%. При этом число молей в процессе росло не более чем на 5% от начального значения, поэтому при оценке изменений состава реакционной массы термолиза было принято допущение о возможности перехода от количества молей продуктов реакции к молярной концентрации.
Анализ и идентификация
В качестве основного метода анализа реакционных смесей использовали ГЖХ. Анализ выполняли на приборе “Кристалл 2000М”, оснащенном ПИД, делителем потока газа-носителя и кварцевой капиллярной колонкой (60 м × 250 мкм × 0.25 мкм) с привитой неподвижной фазой SE-30. В качестве газа-носителя использован гелий с давлением на входе в колонку – 3 атм. Температура испарителя – 250°С, детектора – 280°С.
Количественный анализ состава реакционной массы выполнен методом внутреннего стандарта, в качестве которого использовали н-С24Н50 (99.9 мас. % по ГЖХ), величина калибровочного коэффициента по отношению к 4-(1-Ад)Ф составила 1.1455 ± 0.051.
Качественный анализ компонентов смесей проводили методом ГХ-МС на газовом хроматографе Agilent 6850, оснащенном капиллярной колонкой Agilent 19091S-433E (30 м × 250 мкм × 0.25 мкм) с неподвижной фазой HP-5MS и масс-селективным детектором Agilent 5975C VL MSD при ионизирующем напряжении 70 эВ.
Реакционная масса термолиза 4-(1-Ад)Ф
Типовая хроматограмма продуктов термолиза 4-(1-Ад)Ф представлена на рис. 1.
Рис. 1.
Хроматограмма реакционной массы термолиза 4-(1-Ад)Ф (733 K, 17 мин): 1 – толуол; 2 – о-, м-, п-ксилолы; 3 – триметилбензол (ТМБ); 4 – фенол; 5 – адамантан; 6 – 4-МеФ; 7 – изобутенилбензол (ИБенБ); 8 – 1-метилиндан (1-МеИн); 9 – 4-этилфенол (4-ЭФ); 10 – 4-изопропилфенол (4-ИПФ); 11 – 4-н-пропилфенол (4-НПФ); 12 – 4-гидроксибифенил (4-ГБФ); 13 – (1-адамантил)бензол (1-(Ад)Б); 14 – 4-гидрокси-3'-метил-бифенил (4-Г-3'-МеБФ); 15 – 1-бензил(адамантан) (1-БАд); 16 – 4-(1-адамантил)толуол (4-(1-Ад)Т); 17 – компонент А1; 18 – не идентифицирован (X1); 19 – 2-(1-адамантил)фенол (2-(1-Ад)Ф); 20 – 4-(1-Ад)Ф; 21 – 4-(2-адамантил)фенол (4-(2-Ад)Ф); 22 – компонент А2; 23 – 4-(1-адамантил)-2-метилфенол (4-(1-Ад)-2-МеФ); 24 – 4-(1-адамантил)-2,6-диметилфенол (4-(1-Ад)-2,6-ди-МеФ).

Идентификацию продуктов реакции производили методом ГХ-МС с использованием спектральных данных (ЭИ, 70 эВ) библиотеки NIST2017 [13].
4-МеФ, 4-ЭФ, 4-ИПФ, 4-НПФ были дополнительно идентифицированы в результате сравнения времени удерживания исследуемых компонентов реакционной массы со стандартными образцами соединений. В результате было установлено, что в реакционной массе термолиза 4-(1-Ад)Ф отсутствовали позиционные изомеры указанных алкилфенолов (АФ).
Для идентификации структуры компонентов 14, 16, 17, 19, 21–24 мы использовали данные, правила и подходы, описанные в работах [14–19], устанавливая закономерности между деструкцией адамантиларенов в камере масс-спектрометра при электронной ионизации и термическим распадом. Справедливость данного подхода подтверждается в работах Лободина В.В. и Лебедева А.Т. [20] и Доэрти [21]. Предположение о структуре компонентов A1 и A2 (17 и 22) основано, кроме того, на данных исследования термической стабильности и распада 1,3-диметиладамантана [22], в котором обнаружены схожие продукты раскрытия адамантанового цикла, образованные в результате разрыва одной или двух связей между узловым и мостиковым углеродом. Характеристики масс-спектров компонентов 12–24 приведены в табл. 1, их структуры показаны на рис. 1.
Таблица 1.
Характеристика масс-спектров 4-(1-Ад)Ф и продуктов его термолиза
| Структура | Масс-спектр, 70 эВ: m/z, основные интенсивности (отн. %) |
|---|---|
| 12 | M+•, 170(100); 165(2), 157(2), 152(4), 141(20), 128(1), 115(12), 107(0.2) |
| 13 | M+•, 212(100); 169(13), 155(100), 141(5), 128(7), 115(8), 103(2), 94(8), 91(9) |
| 14 | M+•, 184(100); 167(5), 165(12), 157(1), 155(5), 153(6), 141(4), 128(4), 121(0.2) 115(4), 107(0.3), 91(2) |
| 15 | M+•, 226(50); 207(5), 183(10), 169(10), 153(2), 135(100), 128(1), 115(5), 107(11), 93(12), 91(9), 79(8) |
| 16 | M+•, 226(76); 211(2), 194(1), 183(7), 169(100), 154(11), 141(5), 132(15), 128(6), 115(5), 105(7), 94(3), 91(6) |
| 17 | M+•, 228(28); 213(4), 198(3), 185(100), 172(17), 157(7), 152(2), 144(2), 141(2), 131(1), 128(2), 115(2), 107(5), 94(1), 91(2) |
| 18 | M+•, 226(100); 211(9), 197(6), 183(46), 170(30), 165(8), 157(6) 153(7), 144(4), 141(6), 128(6), 115(7), 103(1), 94(1), 91(1) |
| 19 | M+•, 228(100); 213(2), 200(1), 185(20), 171(88), 165(4), 158(6), 153(23), 145(6), 141(3), 134(14), 131(7), 128(7), 121(5), 115(7), 107(14), 94(7), 91(8) |
| 20 | M+•, 228(80); 213(1), 200(1), 199(1), 185(11), 171(100), 165(1), 157(5), 153(21), 145(4), 141(3), 134(23), 131(4), 128(5), 119(3), 115(5), 107(11), 94(2), 91(6) |
| 21 | M+•, 228(100); 211(6), 200(1), 199(1), 185(3), 171(1), 165(1), 157(1), 152(1), 145(3), 141(1), 133(5), 131(3), 121(6), 115(3), 107(24), 93(6), 91(5) |
| 22 | M+•, 228(61); 213(2), 208(7), 195(1), 181(1), 169(3), 157(6), 152(1), 146(14), 135(12), 131(11), 127(10), 120(100), 107(23), 92(22), 91(6) |
| 23 | M+•, 242(100); 224(2), 213(1), 209(1), 199(12), 185(98), 171(6) 167(13), 157(3), 152(5), 148(22), 141(3), 131(2), 128(3), 121(7), 115(3), 91(3) |
| 24 | M+•, 256(100); 241(3), 213(10), 209(1), 199(75), 183(4), 171(25) 162(21), 157(2), 153(7), 147(5), 141(3), 135(8), 128(4), 121(1), 115(4), 107(1), 91(6) |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ термических превращений 4-(1-Ад)Ф
Состав основных продуктов термолиза 4-(1-Ад)Ф при температуре процесса 733 K, выбранной из середины исследуемого диапазона 703–753 K, показан в табл. 2. Все закономерности, установленные для данной температурной точки, характерны для полного диапазона температур исследования.
Таблица 2.
Состав основных продуктов термолиза 4-(1-Ад)Ф при 733 K, мол. %
| Время, мин | Фенол | Адамантан | $\sum {{\text{АФ}}} $ | 4-ГБФ | 4-Г-3'-МеБФ | А1 | 2-(1-Ад)Ф | 4-(1-Ад)Ф | 4-(2-Ад)Ф | А2 |
|---|---|---|---|---|---|---|---|---|---|---|
| 0.0 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 100.00 | 0.00 | 0.00 |
| 1.0 | 0.11 | 0.01 | 0.00 | 0.00 | 0.00 | 0.04 | 0.42 | 99.15 | 0.18 | 0.04 |
| 1.5 | 0.10 | 0.01 | 0.00 | 0.00 | 0.00 | 0.08 | 0.57 | 98.95 | 0.19 | 0.06 |
| 2.0 | 0.23 | 0.03 | 0.02 | 0.00 | 0.00 | 0.22 | 0.69 | 98.30 | 0.37 | 0.07 |
| 3.0 | 0.60 | 0.14 | 0.02 | 0.00 | 0.00 | 0.58 | 0.94 | 97.23 | 0.21 | 0.13 |
| 5.0 | 0.73 | 0.22 | 0.04 | 0.01 | 0.01 | 0.64 | 1.23 | 96.32 | 0.40 | 0.12 |
| 6.0 | 1.02 | 0.37 | 0.10 | 0.01 | 0.03 | 0.91 | 1.30 | 94.98 | 0.65 | 0.14 |
| 6.5 | 0.82 | 0.23 | 0.09 | 0.02 | 0.02 | 1.14 | 1.46 | 95.11 | 0.58 | 0.15 |
| 7.0 | 0.76 | 0.25 | 0.19 | 0.03 | 0.06 | 1.23 | 1.46 | 93.96 | 0.98 | 0.13 |
| 8.0 | 1.16 | 0.44 | 0.11 | 0.01 | 0.02 | 1.29 | 1.52 | 93.95 | 0.58 | 0.14 |
| 9.0 | 1.53 | 0.69 | 0.15 | 0.04 | 0.09 | 1.67 | 1.37 | 92.60 | 0.89 | 0.16 |
| 10.0 | 1.72 | 0.61 | 0.15 | 0.02 | 0.11 | 1.51 | 1.33 | 92.47 | 0.78 | 0.10 |
| 11.0 | 1.28 | 0.54 | 0.31 | 0.05 | 0.15 | 2.02 | 1.39 | 91.47 | 1.26 | 0.13 |
| 12.0 | 1.90 | 0.79 | 0.32 | 0.06 | 0.19 | 2.25 | 1.39 | 89.91 | 1.36 | 0.11 |
| 14.0 | 2.89 | 1.32 | 0.30 | 0.06 | 0.15 | 1.90 | 1.30 | 88.68 | 1.41 | 0.10 |
| 15.0 | 3.01 | 1.65 | 0.43 | 0.05 | 0.32 | 2.10 | 1.24 | 87.19 | 1.55 | 0.10 |
| 17.0 | 3.58 | 1.91 | 0.53 | 0.09 | 0.42 | 2.41 | 1.01 | 85.13 | 1.96 | 0.09 |
| 20.0 | 4.31 | 2.35 | 0.79 | 0.09 | 0.62 | 2.91 | 0.90 | 82.40 | 1.94 | 0.09 |
| 23.0 | 4.67 | 2.72 | 1.22 | 0.15 | 0.77 | 3.24 | 0.61 | 79.51 | 2.10 | 0.07 |
| 25.0 | 5.71 | 3.24 | 1.32 | 0.16 | 0.72 | 3.33 | 0.56 | 77.01 | 2.09 | 0.08 |
| 27.0 | 5.81 | 3.36 | 1.81 | 0.21 | 0.85 | 3.44 | 0.43 | 75.05 | 2.28 | 0.08 |
Примечание: 4-МеФ, 4-ЭФ, 4-ИПФ и 4-НПФ в представлены в виде группы “сумма алкилфенолов” $\left( {\sum {{\text{АФ}}} } \right).$ Продукты термолиза 4-(1-Ад)Ф, которые достигали заметных концентраций только в развитом процессе при конверсии 4-(1-Ад)Ф более 10%, такие как толуол, ксилолы, ТМБ, ИБенБ, 1-МеИн, X1, (1-Ад)Б, 1-БАд, 4-(1-Ад)Т, 4-(1-Ад)-2-МеФ, 4-(1-Ад)-2,6-ди-МеФ не представлены в табл. 2.
Информация о характере изменения концентраций всех индивидуальных продуктов и групп компонентов в реакционной массе отражена на рис. 2.
Рис. 2.
Концентрационные кривые продуктов термических превращений 4-(1-Ад)Ф при 733 K: 1 – 4-(1-Ад)Ф; 2 – 2‑(1-Ад)Ф; 3 – Фенол; 4 – Адамантан; 5 – компонент A1; 6 – 4-(2-Ад)Ф; 7 – 4-(1-Ад)-2-МеФ; 8 – 4-(1-Ад)-2,6-ди-МеФ; 9 – 4-МеФ; 10 – 4-ЭФ; 11 – 4-ИПФ; 12 – 4-НПФ; 13 – (1-Ад)Б; 14 – Σ(1-БАд, 4-(1-Ад)Т); 15 – Х1; 16 – компонент A2; 17 – 4-ГБФ 18 – 4-Г-3'-МеБФ; 19 – Σ(толуол, ксилолы, ТМБ, ИБенБ, 1-МеИн).

Анализ возможных взаимных превращений установленных компонентов был основан на существующей информации о направлениях и продуктах распада производных адамантана при термолизе и в результате электронной ионизации [14–16, 19, 22], а также учитывал характер кинетических кривых (рис. 2) согласно данным С. Вэйласа для типовых сложных реакций [23].
Таким образом, к продуктам прямого превращения 4-(1-Ад)Ф были отнесены 2-(1-Ад)Ф, 4-(2-Ад)Ф и компоненты А1 и А2 (рис. 2). Начальный этап термолиза 4-(1-Ад)Ф характеризовался высокой скоростью накопления 2-(1-Ад)Ф и 4-(2-Ад)Ф во всем диапазоне температур исследования. Так, например, при 733 K за первую минуту, при степени превращения 4-(1-Ад)Ф 0.85 мол. %, концентрация 2-(1-Ад)Ф составила 0.42 мол. %, а 4-(2-Ад)Ф – 0.18 мол. % (табл. 2). Учитывая исключительно позиционные изменения заместителей в структуре, эти компоненты были определены как продукты изомеризации. Основанием для данного предположения служит существенное влияние изомеризационных процессов, обнаруженных нами, при исследовании термолиза 4-трет-бутилфенола [12] и 4-трет-бутилдифенилоксида [24], при этом механизм изомеризации “4-(1-Ад)Ф → 4-(2-Ад)Ф” аналогично может быть реализован через трехчленный переходный цикл:
Очевидно, что образование компонентов А1 и А2 происходит в результате деструкции 4-(1-Ад)Ф по связи Сузловой–Смостиковый. Предположительно, процесс протекает по следующему механизму:
Состав реакционной массы (табл. 2) свидетельствует о том, что в развивающемся процессе (в пределах 10% конверсии 4-(1-Ад)Ф) деструкция адамантильного заместителя с образованием компонентов А1 и А2 не уступает распаду по связи CAr–CAd с образованием фенола и адамантана. Изомеризация 4-(1-Ад)Ф с образованием 2-(1-Ад)Ф и 4-(2-Ад)Ф в указанных пределах конверсий носит преобладающий характер.
С увеличением глубины превращения 4-(1-Ад)Ф скорость образования фенола и адамантана возрастает, что объясняется ростом интенсивности деструктивных процессов в целом, и в частности, деструкцией 2-(1-Ад)Ф и 4-(2-Ад)Ф. Это также подтверждают данные о составе реакционной массы (табл. 2) и вид кинетических кривых этих компонентов.
В отношении разрыва связи СAr–СAd во всем диапазоне исследования нами было установлено, что в развивающемся процессе концентрация адамантана была существенно ниже концентрации фенола. С увеличением степени превращения 4-(1-Ад)Ф, а также температуры термолиза мольное отношение С(Адамантан)/С(Фенол) возрастает, но не достигает 1.0 моль/моль. Так, при 703 K оно стабилизируется на уровне (0.35–0.40), при 733 K – (0.55–0.60), при 753 K – (0.65–0.75) (рис. 3).
Рис. 3.
Изменение отношения мольной концентрации С(Адмантан)/С(Фенол): 1 – 703 K (He), предельная конверсия 4-(1-Ад)Ф – 7.95%; 2 – 703 K (H2), предельная конверсия 4-(1-Ад)Ф – 10.33%; 3 – 733 K (He), предельная конверсия 4-(1-Ад)Ф – 24.95%; 4 – 753 K (He), предельная конверсия 4-(1-Ад)Ф – 26.38%.
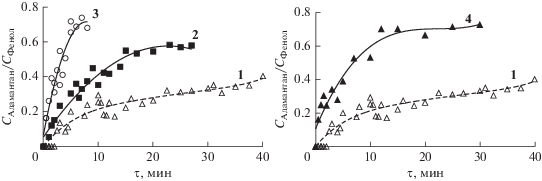
Такой характер процесса, вероятно, указывает на деструкцию адамантильного радикала, образовавшегося вследствие гетеролитического разрыва связи CAr–CAd в 4-(1-Ад)Ф. Стабильность адамантильного радикала, согласно данным Е.И. Багрия [14], в ряде случаев даже ниже стабильности трет-бутильного радикала. Очевидно, что при термолизе 4-(1-Ад)Ф при разрыве связи CAr–CAd образовавшийся адамантильный радикал подвергается деструкции с образованием водорода, легких углеводородов С1–С4 и алкилароматических углеводородов, аналогично деструкции адамантана, метил- и диметиладамантанов [14, 22]. Как видно из данных (рис. 3), с увеличением глубины процесса концентрация адамантана относительно фенола возрастает, что, очевидно, является следствием появления свободного водорода и водородных радикалов, способствующих стабилизации адамантильного радикала и превращению его в адамантан.
Для проверки данной гипотезы мы сопоставили характер термолиза 4-(1-Ад)Ф при 703 K в атмосфере гелия и водорода (рис. 3). Размер капилляров и степень загрузки вещества не изменялись, но вместо гелия, капилляр заполнялся водородом. В результате, соотношение С(Адмантан)/С(Фенол) выросло в каждый момент времени и в пределе достигло уровня 0.7 моль/моль. При этом уровень концентрации фенола не изменился, а адамантана – вырос (рис. 4).
Рис. 4.
Изменение концентрации продуктов термолиза 4-(1-Ад)Ф в среде гелия и водорода при температуре 703 K: 1 – 4-(1-Ад)Ф (He); 2 – 4-(1-Ад)Ф (H2); 3 – 2-(1-Ад)Ф (He); 4 – 2-(1-Ад)Ф (H2); 5 – адамантан (He), 6 – Фенол (He); 7 – адамантан (H2), 8 – фенол (H2)

В атмосфере водорода, в целом, возросла интенсивность процессов деструкции. Константа скорости распада “4-(1-Ад)Ф → продукты” возросла в 1.78 раза: в инертной атмосфере – k703 = = (3.21 ± 0.07) × 10–5 c–1, в атмосфере водорода – ${{k}_{{703\left( {{{{\text{H}}}_{2}}} \right)}}}$ = (5.71 ± 0.36) × 10–5 c–1. Интерес также вызвал тот факт, что характер накопления 2-(1-Ад)Ф практически не изменился.
Относительно направлений образования прочих продуктов термолиза 4-(1-Ад)Ф в инертной среде в диапазоне 703–753 K нами были сделаны следующие предположения:
1. 4-(1-Ад)-2-МеФ и 4-(1-Ад)-2,6-ди-МеФ были отнесены к продуктам последовательного метилирования 4-(1-Ад)Ф;
2. Толуол, ксилолы, ТМБ, ИБенБ, 1-МеИн были отнесены к продуктам деструкции адамантана;
3. 4-ГБФ и 4-Г-3'-МеБФ – продукты деструкции компонента А1;
4. 1-АдБ – продукт деструкции 4-(1-Ад)Ф в результате отщепления гидроксила;
5. Алкилфенолы – 4-МеФ, 4-ЭФ, 4-ИПФ – продукты деструкции компонента А2, а 4-НПФ – продукт изомеризации 4-ИПФ;
6. 1-БАд и 4-(1-Ад)Т – вероятно, результат рекомбинации адамантильного и бензильного радикалов.
Направления превращений, аналогичные приведенным в пунктах 1–3, установлены при термолизе 1,3-диметиладамантана [22]. Реализация направления 4 была показана при изучении термолиза гидрохинона в интервале 623–1123 K [24].
Расчет параметров уравнения Аррениуса реакции “4-(1-Ад)Ф → продукты”
Кинетический анализ экспериментальных данных для реакции термического распада “4-(1-Ад)Ф → продукты” был выполнен в каждой температурной точке в интервале 703–753 K и полном диапазоне конверсии 4-(1-Ад)Ф по уравнению расчета константы скорости реакции первого порядка (1):
Значения рассчитанных констант скорости для реакции приведены в табл. 3.
Таблица 3.
Значения констант скорости термического распада 4-(1-Ад)Ф
| T, K | “4-(1-Ад)Ф → продукты” | |||
|---|---|---|---|---|
| ki × 105, с–1 | n | R2 | предельная конверсия, % | |
| 703 | 3.21 ± 0.07 | 33 | 0.99 | 7.95 |
| 708 | 4.12 ± 0.28 | 24 | 0.94 | 10.08 |
| 713 | 6.88 ± 0.33 | 22 | 0.97 | 15.04 |
| 718 | 9.08 ± 0.54 | 20 | 0.96 | 13.70 |
| 723 | 10.9 ± 0.5 | 21 | 0.98 | 24.63 |
| 728 | 13.8 ± 0.5 | 18 | 0.99 | 21.58 |
| 733 | 17.4 ± 0.5 | 21 | 0.99 | 24.95 |
| 738 | 20.1 ± 0.8 | 18 | 0.98 | 15.90 |
| 743 | 25.6 ± 1.5 | 18 | 0.96 | 14.20 |
| 748 | 49.1 ± 2.3 | 15 | 0.98 | 22.46 |
| 753 | 60.8 ± 15.6 | 17 | 0.93 | 26.38 |
Расчет параметров был произведен по экспериментальным значениям констант скорости путем линеаризации уравнения Аррениуса в координатах “lnki–1000/T”. В результате установлено, что в исследуемом диапазоне температур для реакции распада “4-(1-Ад)Ф → продукты” предэкспоненциальный множитель равен k0= 1013.7 ± 0.8, энергия активации составляет Ea= 244.8 ± 11.7 кДж/моль.
Для сравнения, в диапазоне температур 673–738 K для распада “4-ТБФ → продукты” энергия активации ниже на 14.9 кДж/моль (Ea= 229.9 ± ± 4.1 кДж/моль) при сопоставимой величине предэкспоненциального множителя (k0 = 1013.2 ± 0.3) [12].
Оценка констант скорости, приведенных в табл. 3 , как наиболее чувствительных характеристик, также показывает, что 4-(1-Ад)Ф является более стабильным и способен сохранять свою структуру при более высоких температурах, чем 4-ТБФ. Сравнительный анализ констант скорости распада 4-(1-Ад)Ф и 4-ТБФ в диапазоне температур 703–738 K показал, что деструкция 4-(1-Ад)Ф протекает в среднем в 3−4 раза медленнее.
ЗАКЛЮЧЕНИЕ
В результате исследования было установлено, что в диапазоне 703–753 K термолиз 4-(1-адамантил)фенола протекает по трем направлениям: изомеризация с образованием 4-(2-адамантил)фенола и 2-(1-адамантил)фенола, диссоциация связей Сузловой–Смостиковый в адамантильном заместителе, а также деструкция по связи СAr–CAd, приводящая к образованию фенола и продуктов распада адамантильного заместителя. При этом процессы изомеризации и диссоциация связей Сузловой–Смостиковый с раскрытием адамантанового цикла вносят значительный вклад в термическую деструкцию 4-(1-адамантил)фенола.
Предложен механизм радикальной изомеризации “4-(1-Ад)Ф → 4-(2-Ад)Ф” через трехчленный переходный цикл.
В диапазоне температур 703–753 K для реакции распада “4-(1-Ад)Ф → продукты” становлено, что предэкспоненциальный множитель равен k0= 1013.7 ± 0.8, энергия активации составляет Ea= = 244.8 ± 11.7 кДж/моль, что свидетельствует о значительном преимуществе термической стабильности 4-(1-Ад)Ф по сравнению с 4-ТБФ.
Сведения, полученные в результате данного исследования, призваны расширить теоретическую и информационную базу для разработки термостойких композиционных и смазывающих материалов, высокотемпературных стабилизаторов и антиоксидантов, мономеров для полимеров с улучшенными свойствами.
Список литературы
Багрий Е.И., Маравин Г.Б. // Нефтехимия. 2013. Т. 53. № 6. С. 467.
Ивлева Е.А., Баймуратов М.Р., Журавлева Ю.А., Климочкин Ю.Н., Куликова И.А., Поздняков В.В., Шейкина Н.А., Тыщенко В.А. // Журн. общ. химии. 2014. Т. 84. № 12. С. 2048.
Ивлева Е.А., Баймуратов М.Р., Журавлева Ю.А., Климочкин Ю.Н., Куликова И.А., Поздняков В.В., Шейкина Н.А., Тыщенко В.А., Рудяк К.Б. // Нефтехимия. 2015. Т. 55. № 2. С. 140 [Petrol. Chemistry. 2015. V. 55. № 2. P. 133].
Ивлева Е.А., Баймуратов М.Р., Гаврилова В.С., Журавлева Ю.А., Климочкин Ю.Н., Куликова И.А., Поздняков В.В., Шейкина Н.А., Тыщенко В.А., Рудяк К.Б. // Нефтехимия. 2015. Т. 55. № 6. С. 528 [Petrol. Chemistry. 2015. V. 55. № 8. P. 673].
Ивлева Е.А., Баймуратов М.Р., Журавлева Ю.А., Малиновская Ю.А., Климочкин Ю.Н., Куликова И.А., Поздняков В.В., Шейкина Н.А., Тыщенко В.А. // Нефтехимия. 2016. Т. 56. № 6. С. 655 [Petrol. Chemistry. 2016. V. 56. № 9. P. 873].
Tsai C.W., Wu K.H., Yang C.C., Wang G.P. // Reactive and Functional Polymers. 2015. V. 91. P. 11.
Su X., Jing X. // J. of Applied Polymer Science. 2007. V. 106. № 2. P. 737.
Шнайдер А. // Патент US № 3563919A. 1969.
Sokolenko V.A., Svirskaya N.M., Velikov A.A., Sizova N.V. // Kinetics and Catalysis. 2002. V. 43. № 2. P. 185.
Гоготов А.Ф., До Т.Т., Соколенко В.А., Свирская Н.М., Дам Т.Т.Х., Руденко Д.С., Петерсон И.В., Рубайло А.И., Станкевич В.К. // Нефтепереработка и нефтехимия. Научно-технические достижения и передовой опыт. 2013. № 4. С. 18.
Гоготов А.Ф., До Т.Т., Соколенко В.А., Свирская Н.М., Дам Т.Т.Х., Руденко Д.С., Когай Т.И., Петерсон И.В., Рубайло А.И., Станкевич В.К. // Нефтепереработка и нефтехимия. Научно-технические достижения и передовой опыт. 2013. № 9. С. 24.
Шакун В.А., Нестерова Т.Н., Наумкин П.В. // Нефтехимия. 2019. Т. 59. №. 1. С. 113 [Petrol. Chemistry. 2019. V. 59. № 1. P. 120 ].
Интepнeт-pecypc: http://webbook.nist.gov/
Багрий Е.И. Адамантаны: получение, свойства, применение. М.: Наука, 1989. 264 с.
Шарбатян П.А., Терентьев П.Б., Ковалев В.В., Шокова Э.А. // Журн. орг. химии. 1980. № 16. С. 308.
Ковалев В.В., Шарбатян П.А., Князева И.В., Шморгунов В.А., Шокова Э.А., Терентьев П.Б. // Журн. орг. химии. 1988. № 10. С. 2121.
Olah G.A., Wu An-H., Farooq O. // J. Org. Chem. 1988. V. 53. P. 5142.
Olah G.A., Török B., Shamma T., Török M., Prakash G.S. // Catalysis letters. 1996. V. 42. №. 1. P. 5.
Dolejšek Z., Hala S., Hanuš V., Landa S. // Collection of Czechoslovak Chemical Communications. 1966. V. 31. № 2. P. 435.
Лободин В.В., Лебедев А.Т. // Масс-спектрометрия. 2005. Т. 2. №. 2. С. 91.
Dougherty R.C. // J. of the Am. Chem. Soc. 1968. V. 90. № 21. P. 5780.
Qin X, Yue L., Wu J, Guo Y., Xu L., Fang W. // Energy & Fuels. 2014. V. 28. № 10. P. 6210.
Walas S.M. Reaction Kinetics for Chemical Engineers. Butterworths Series in Chemical Engineering, 2013. 432 p.
Шакун В.А., Нестерова Т.Н., Таразанов С.В., Спиридонов С.А. // Журнал физической химии. 2019. Т. 93. № 11. С. 1644.
Adounkpe J., Khachatryan L., Dellinger B. // Energy & Fuels. 2008. V. 22. № 5. P. 2986.
Дополнительные материалы
- скачать ESM.docx
- Таблица 1. Состав реакционной массы термолиза 4-(1-Ад)Ф, 733 K, % мол.
Масс-спектры некоторых компонентов реакционной массы термолиза 4-(1-Ад)Ф. Рис.1 - Рис.10




