Неорганические материалы, 2023, T. 59, № 3, стр. 306-316
Низкотемпературное фазообразование в системе BaF2–LaF3
А. А. Александров 1, 2, А. Г. Брагина 1, Н. И. Сорокин 3, В. В. Воронов 1, А. А. Лугинина 1, С. В. Кузнецов 1, В. К. Иванов 2, П. П. Федоров 1, *
1 Институт общей физики им. А.М. Прохорова Российской академии наук
119991 Москва,
ул. Вавилова, 38, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова
Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
3 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллографии и фотоники”
Российской академии наук
Москва, Ленинский пр., 59, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 20.09.2022
После доработки 24.11.2022
Принята к публикации 25.11.2022
- EDN: YQIUKH
- DOI: 10.31857/S0002337X23030016
Аннотация
Порошки фторидов бария-лантана синтезированы из нитратов бария и лантана в расплаве нитрата натрия с использованием фторида натрия в качестве фторирующего агента при 350 и 450°C. Пятикратный избыток фторида натрия предотвращает пирогидролиз. Выявлено образование фазы переменного состава флюоритовой структуры Ba1–xLaxF2+x (0.3 < x < 0.5), обладающей высокой ионной проводимостью 2.3 × 10−4 См/см при 500 К и энтальпией активации ионного переноса 0.50 ± 0.01 эВ.
ВВЕДЕНИЕ
Система BaF2–LaF3 привлекает внимание исследователей на протяжении многих лет [1–15]. Гетеровалентные твердые растворы Ba1–xLaxF2+x (x ≤ 0.52) и La1–yBayF3–y (y ≤ 0.13), образующиеся на основе компонентов, являются типичными примерами сильной нестехиометрии [16–18] и характеризуются высокой фтор-ионной электропроводностью [2–4, 8–12]. Эти фазы интересны как с фундаментальной точки зрения [19], так и для разработки различных электрохимических устройств [20–24]. Для выяснения атомного (кластерного) строения твердых растворов в этой системе применяются различные методы исследования [5, 7–11, 13, 15].
Образцы твердых растворов в этой системе могут быть получены различными способами, а именно: выращиванием монокристаллов из расплава [25], твердофазным спеканием [1], соосаждением из водных растворов [26], механохимическим синтезом [8]. Каждый из методов имеет свои ограничения. Нами предварительно [27] показана возможность синтеза твердого раствора Ba1–xLaxF2+x путем химической реакции в расплаве нитрата натрия.
Целью данной работы является систематическое исследование фазообразования в системе BaF2–LaF3 путем проведения синтезов из нитратного расплава, а также изучение электропроводности образцов, синтезированных таким способом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы фторидов получали методом синтеза в солевом расплаве нитрата натрия [28, 29]. Исходные реагенты использовали без дополнительной подготовки: нитрат бария Ba(NO3)2 (ОСЧ 10-2, “Реахим”), гексагидрат нитрата лантана La(NO3)3⋅6H2O (99.99% по катионным примесям, “Ланхит”), фторид натрия NaF (“х. ч.”, “Химмед”), нитрат натрия NaNO3 (“х. ч.”, “Химмед”). Фторид натрия брали в пятикратном мольном избытке, а нитрат натрия – в десятикратном мольном избытке к массе продукта.
Навески фторирующего агента NaF и растворителя NaNO3 сразу переносили в глазурованный фарфоровый тигель, а навески нитрата бария и гексагидрата нитрата лантана смешивали и гомогенизировали в агатовой ступке, после чего добавляли в тигель. Полученную смесь гомогенизировали в фарфоровом тигле и нагревали в муфельной печи со скоростью 10°C/мин. Уравнение реакции синтеза может быть записано в следующем виде:
(1)
$\begin{gathered} \left( {1 - x} \right){\text{Ba}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} + x{\text{La}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{3}}{\kern 1pt} \cdot {\kern 1pt} 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,\left( {2 + x} \right){\text{NaF}} \to {\text{B}}{{{\text{a}}}_{{1 - x}}}{\text{L}}{{{\text{a}}}_{x}}{{{\text{F}}}_{{2 + x}}} + \\ + \,\,\left( {2 + x} \right){\text{NaN}}{{{\text{O}}}_{{\text{3}}}} + 6х{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $После остывания печи спек отделяли от тигля. Часть спека отбирали на рентгенофазовый анализ (РФА). Спек трижды промывали бидистиллированной водой для удаления избытка NaF и NaNO3. Для контроля за удалением нитрат-ионов использовали качественную реакцию: раствор дифениламина (1 мас. %) в концентрированной серной кислоте прикапывали к пробе. Осадок после промывок сушили под ИК-лампой при температуре 45°C.
РФА проводили на дифрактометре Bruker D8 Advance (Германия) с CuKα-излучением. Рентгенограммы были получены в диапазоне углов 2θ = 10°−80° с временем набора сигнала 0.4 с на точку и шагом 0.02° 2θ. Обработку данных проводили в программном обеспечении TOPAS.
Изображения растровой электронной микроскопии (РЭМ) получены на электронном микроскопе Carl Zeiss NVision 40 (Германия) при ускоряющем напряжении 1 кВ. Рентгеноспектральный микроанализ (РСМА) выполнен с использованием приставки Oxford Instruments X-MAX 80 мм2 (Великобритания).
Для проведения химического анализа навеску перетертого в агатовой ступке образца помещали в стеклоуглеродную чашку и трижды обрабатывали концентрированной серной кислотой, упаривая досуха. Затем осадок сульфатов обрабатывали бидистиллированной водой и количественно переносили на беззольный фильтр, раствор переносили в колбу Эрленмейера на 250 мл. Фильтр с осадком помещали в фарфоровый тигель, доведенный до постоянной массы. Осадок анализировали на содержание Ва гравиметрическим методом. Фильтрованный раствор в колбе Эрленмейера анализировали на содержание лантана комплексонометрическим титрованием с использованием трилона Б и индикатора ксиленолового оранжевого при рН 5.5–6.0 в присутствии ацетатного буферного раствора.
Электропроводность σdc керамических образцов измеряли методом импедансной спектроскопии на приборе Tesla BM-507 на частотах 5 Гц–500 кГц. Керамические образцы готовили прессованием при комнатной температуре. Импедансные измерения проводили в вакууме ~1 Па в интервале температур 396–833 К в режиме охлаждения. Погрешность при определении значений σdc составляла 5%. Наличие в спектрах импеданса электрохимических ячеек Ag(C)|керамика|Ag(C) блокирующего эффекта от инертных (Ag, C) электродов на низких частотах указывает на ионную природу электропереноса в исследуемых образцах.
Объемное сопротивление керамики Rcer находили из частотных зависимостей комплексного импеданса электрохимических ячеек по пересечению годографа импеданса с осью активных сопротивлений. Удельную электропроводность σdc керамических образцов рассчитывали по формуле
где h – толщина образца, S – площадь электрода. Величина σdc включает в себя все процессы электропереноса в керамике – внутри кристаллических зерен и на межзеренных границах.Температурные зависимости проводимости обрабатывали в соответствии с уравнением Аррениуса–Френкеля
где A – предэкспоненциальный множитель электропроводности, Ea – энергия активации ионного переноса.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
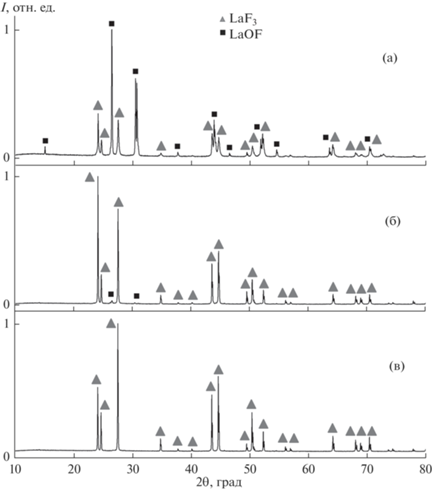
Из-за наличия воды в исходном реактиве возникла необходимость проверки возможности протекания реакции пирогидролиза в процессе синтеза. Для отработки методики мы исследовали влияние количества фторирующего агента на синтез фторида лантана. Фторид лантана гидролизуется существенно легче, чем фторид бария [30]. Были проведены синтезы LaF3 при температуре 450°C и времени 2 ч. Результаты представлены на рис. 1 и в табл. 1. Соотношения исходных компонентов даны в виде отношения La(NO3)3⋅6H2O : NaF.
Таблица 1.
Соотношения исходных компонентов и результаты РФА образцов LaF3
| Образец | La(NO3)3⋅6H2O : NaF | a, Å | c, Å | a, Å | c, Å |
|---|---|---|---|---|---|
| LaF3, пр. гр. P$\bar {3}$c1 | LaOF, пр. гр. P4/nmm | ||||
| 1 | 1 : 0.5 | 7.188(1) | 7.355(1) | 4.104(1) | 5.849(1) |
| 2 | 1 : 1 | 7.188(1) | 7.354(1) | Присутствуют 2 пика LaOF | |
| 3 | 1 : 5 | 7.189(1) | 7.352(1) | – | – |
При недостатке фторирующего агента на рентгенограмме наряду с отражениями гексагональной фазы трифторида лантана LaF3 (PDF-2, card #00-032-0483) видны пики тетрагональной фазы оксифторида LaOF (PDF-2, card #01-089-5168) (рис. 1а). Как видно из рис. 1б, слабый пик 101 при 26.6° относится к фазе LaOF и появляется на рентгенограмме образца со стехиометрическим соотношением реагентов. Использование пятикратного избытка фторирующего агента препятствует протеканию реакции гидролиза и приводит к образованию целевого трифторида лантана. Следует отметить, что дальнейшее увеличение количества фторирующего агента может приводить к образованию тетрафторлантаната натрия NaLaF4 [28]. Температура устойчивости этой фазы при синтезах из раствора в расплаве лежит выше 350°C [31]. Таким образом, пятикратный мольный избыток фторида натрия является оптимальным.
Низкотемпературное фазообразование в системе BaF2–LaF3 было исследовано при 350°C и времени выдержки 2 ч. Проведен синтез образцов номинального состава Ba1–xLaxF2+x, где x варьировали от 0 до 1 с шагом 0.1. Результаты исследования синтезированных образцов приведены на рис. 2–4.
Рис. 2.
Рентгенограммы образцов номинального состава Ba1–xLaxF2+x, синтезированных при температуре 350°C, с x = 0 (а), 0.1 (б), 0.2 (в), 0.3 (г), 0.4 (д), 0.5 (е), 0.6 (ж), 0.7 (з), 0.8 (и), 0.9 (к), 1 (л).

Рис. 3.
РЭМ-изображения образцов номинального состава Ba1–xLaxF2+x, синтезированных при температуре 350°C и времени выдержки 120 мин, с x = 0.2 (а), 0.4 (б), 0.6 (в), 1 (г).

Рис. 4.
Рентгенограммы образцов, синтезированных при температуре 450°C и времени выдержки 10 (а), 20 (б), 40 (в), 60 (г), 120 (д), 360 (е), 7260 мин (ж).

На рентгенограммах образцов с содержанием фторида лантана 0.1, 0.2 и 0.3 есть рефлексы, относящиеся к трем фазам: фториду лантана, фториду бария и твердому раствору со структурой флюорита (фаза F) (рис. 2б–2г). При увеличении содержания лантана до х = 0.4 и выше удалось синтезировать образцы без включения фазы BaF2, но выросла интенсивность линий LaF3, также наблюдались пики фазы F (рис. 2д–2к). Индивидуальные фториды BaF2 и LaF3 получились однофазными, без следов протекания гидролиза (рис. 2а, 2л).
В табл. 2 представлены параметры решетки всех фаз, а также содержание фторида лантана во флюоритовом твердом растворе Ba1–xLaxF2+x, рассчитанное по уравнению
где a0 = 6.200 Å – параметр решетки BaF2 (PDF-2, card #00-004-0452), a – экспериментальный параметр решетки, k = –0.3033 [1].Таблица 2.
Рассчитанные параметры решетки фаз в образцах номинального состава Ba1–xLaxF2+x и содержание фторида лантана в флюоритовом твердом растворе (F) (синтез при 350°C, 2 ч)
| x | a, Å | c, Å | a, Å | a, Å | Содержание LaF3 в фазе F, мол. % |
|---|---|---|---|---|---|
| LaF3 | фаза F | BaF2 | |||
| 0 | – | – | – | 6.1911(7) | – |
| 0.1 | 7.180(2) | 7.3421(3) | 6.104(1) | 6.190(1) | 31.6 |
| 0.2 | 7.177(5) | 7.337(4) | 6.078(1) | 6.181(1) | 40.2 |
| 0.3 | 7.189(3) | 7.331(6) | 6.0843(5) | 6.1966(3) | 38.1 |
| 0.4 | 7.18(1) | 7.32(1) | 6.064(1) | – | 44.8 |
| 0.5 | 7.1917(6) | 7.351(2) | 6.0561(3) | – | 47.4 |
| 0.6 | 7.158(5) | 7.322(2) | 6.033(2) | – | 55.1 |
| 0.7 | 7.165(4) | 7.328(6) | 6.038(2) | – | 53.4 |
| 0.8 | 7.169(5) | 7.333(6) | 6.046(2) | – | 50.8 |
| 0.9 | 7.164(6) | 7.330(8) | 6.051(3) | – | 49.1 |
| 1 | 7.178(1) | 7.345(1) | – | – | – |
На рис. 3 приведены РЭМ-снимки. Из представленных микрофотографий можно сделать вывод о том, что наиболее близок к однофазному образец с x = 0.4 (рис. 3б), однако на его рентгенограмме присутствуют пики LaF3. На рис. 3г представлена микрофотография синтезированного фторида лантана. Видны частицы в форме шестиугольных призм фторида лантана с поперечным размером порядка 200 нм.
Таким образом, в случае синтеза при температуре 350°C можно выделить две концентрационные области. В первой – при содержании фторида лантана от 0.1 до 0.3 – одновременно существуют три фазы: BaF2, LaF3 и Ba1–xLaxF2+x (фаза F). Во второй – при номинальном содержании фторида лантана от 0.4 до 0.9 – существуют две фазы: LaF3 и Ba1–xLaxF2+x. При этом максимальное содержание LaF3 в твердом растворе достигает $х \simeq 0.55.$ Отметим, что одновременное существование трех фаз в двухкомпонентной системе, согласно правилу Гиббса, возможно только в точке нонвариантного равновесия, однако мы наблюдаем три фазы в широком интервале концентраций. Отсюда можно сделать вывод о том, что при 350°C за 2 ч равновесие не достигается.
Нитрат натрия устойчив в присутствии 5 мол. % NaF до температуры 492°C [32], поэтому синтезы можно проводить в широком интервале температур – от плавления (308°C) до 492°C.
В работе исследована кинетика протекания реакции (1) при 450°C. В муфельную печь были загружены 6 образцов с одинаковыми навесками с номинальным содержанием фторида лантана x = 0.33. После нагрева до 450°C образцы поочередно удаляли из горячей зоны – через 10, 20, 40, 60, 120, 360 и 7260 мин. Результаты приведены на рис. 4 и в табл. 3.
Таблица 3.
Параметр решетки и содержание LaF3 в фазе F
| Образец | Время выдержки, мин | a, Å (±0.001) | С, мол. % | ||
|---|---|---|---|---|---|
| расчет по уравнению (4) | по данным РСМА | по данным хим. анализа | |||
| F1768-I | 10 | 6.070 | 42.9 ± 0.5 | 50 ± 2 | – |
| F1768-II | 20 | 6.065 | 44.6 ± 0.5 | 42 ± 2 | – |
| F1768-III | 40 | 6.077 | 40.5 ± 0.5 | 40 ± 2 | 39.3 ± 1.0 |
| F1768-IV | 60 | 6.079 | 39.9 ± 0.5 | 40 ± 2 | – |
| F1768-V | 120 | 6.079 | 39.9 ± 0.5 | 41 ± 2 | 39.7 ± 1.0 |
| F1768-VI | 360 | 6.080 | 39.4 ± 0.5 | 39 ± 2 | – |
| F1768-VII | 7260 | 6.079 | 39.9 ± 0.5 | 38 ± 2 | – |
На рентгенограммах, приведенных на рис. 4а и 4б, видны рефлексы второй фазы – трифторида лантана, а на остальных – только пики флюоритового твердого раствора (фазы F).
На рис. 5 представлены расчеты параметра решетки, области когерентного рассеяния (ОКР), величины микронапряжений и соотношения интенсивностей самых сильных отражений фазы F и трифторида лантана в зависимости от времени синтеза. Видно, что при температуре 450°C зависимости выходят на насыщение при $\tau \simeq 1$ ч. Данные, приведенные в табл. 3, свидетельствуют о хорошей сходимости результатов определения химического состава разными методами. Для синтезированных образцов после достижения равновесия можно принять состав Ba0.6La0.4F2.4.
Рис. 5.
Временны́е зависимости по результатам РФА: а – параметр решетки твердого раствора Ba1–xLaxF2+x (фаза F); б – размеры ОКР; в – величины микронапряжений; г – зависимость отношения интенсивностей самых сильных отражений LaF3 и фазы F (I1 – интенсивность отражения 111 LaF3, I2 – интенсивность отражения 111 фазы F).

На рис. 6 приведены микрофотографии РЭМ. Обращает на себя внимание наличие наряду с мелкими однородными наночастицами Ba0.6La0.4F2.4 крупных ограненных частиц микронных размеров. Судя по данным РСМА, крупная и мелкая фракции имеют одинаковый состав. По-видимому, образование продукта реакции (1) идет по механизму освальдового созревания: крупные частицы растут за счет поглощения мелких.
Рис. 6.
РЭМ-изображения образцов Ba0.6La0.4F2.4, синтезированных при температуре 450°C и времени выдержки 10 (а), 20 (б), 40 (в), 60 (г), 360 (д), 7260 мин (е).

Для измерения электропроводности были спрессованы поликристаллические таблетки диаметром 3 и толщиной 1.2−1.6 мм под давлением 500 МПа, время под нагрузкой 5−10 мин (образцы F1768-IVа, F1768-V, F1768-VI). В качестве электродов для этих образцов использовали серебряную пасту Leitsilber. Образец F1768-IVб диаметром 13 и толщиной 1.5 мм был спрессован под давлением 7 МПа, время под нагрузкой 10 мин. В качестве электродов для этого образца использовали графитовую пасту DAG-580.
На рис. 7, 8 и в табл. 4, 5 приведены результаты измерений электропроводности образцов Ba0.6La0.4F2.4 в сравнении с литературными данными. С целью проверки воспроизводимости результатов для образца F1768-IVа было проведено повторное измерение. Можно видеть, что энергия активации ионного переноса в образцах F1768-IVа и F1768-IVб практически совпадает и равна Ea = 0.50 ± 0.01 эВ. Повторное измерение для образца F1768-IVа приводит к возрастанию величины σdc при 500 К на ~30%, что связано, по-видимому, с уплотнением керамики. Различие в значениях σdc в 2 раза для образцов F1768-IVа и F1768-IVб обусловлено разными режимами прессования. Выяснение причин этого явления требует дополнительных исследований.
Рис. 7.
Температурные зависимости ионной проводимости твердого раствора Ba0.6La0.4F2.4, полученного из нитратного расплава при продолжительности синтеза τ = 60 мин: 1 – образец F1768-IVа , первое измерение; 2 – образец F1768-IVа, второе измерение; 3 – образец F1768-IVб.

Рис. 8.
Температурные зависимости ионной проводимости твердого раствора Ba0.6La0.4F2.4, синтезированного из нитратного расплава (1 – образец F1768-IVб, 2 – образец F1768-V, 3 – образец F1768-VI), механосинтезом (4 – нанокерамика [8], 5 – нанокерамика [22]) и направленной кристаллизацией из расплава (6 – монокристалл [2], 7 – монокристалл [4]).

Таблица 4.
Параметры уравнения Аррениуса–Френкеля для керамических образцов Ba0.6La0.4F2.4, полученных из нитратного расплава
| Образец | A, См К/см | Ea, эВ | σdc, См/см (при 500 К) |
|---|---|---|---|
| F1768-IVа | |||
| Первое измерение | 5.24 × 103 | 0.50 (791–396 К) | 1.1 × 10–4 |
| Второе измерение | 5.86 × 103 | 0.49 (796–621 К) | 1.4 × 10–4 |
| F1768-IVб | 1.37 ×104 | 0.50 (833–503 К) | 2.3 ×10–4 |
| F1768-V | 9.94 × 103 | 0.53 (794–522 К) | 8.9 × 10–5 |
| F1768-VI | 2.19 × 104 | 0.59 (790–397 К) | 5.1 × 10–5 |
Таблица 5.
Вид образца, метод получения и ионная проводимость твердого раствора Ba0.6La0.4F2.4 со структурой флюорита
| Вид образца | Метод получения | σdc × 104, См/см | T, К | Источник |
|---|---|---|---|---|
| Керамика (образец F1768-IVб) |
Раствор-расплавная кристаллизация | 2.3 | 500 | Настоящая работа |
| Керамика | Механосинтез | 2.0 | 500 | [8] |
| Керамика | Механосинтез | 6.9 | 473 | [22] |
| Керамика | Механосинтез | ~5 | 500 | [11] |
| Монокристалл | Метод Бриджмена | 2.5 | 500 | [2] |
| Монокристалл Ba1–xLaxF2–x (x = 0.393) |
Метод Бриджмена | 3.9 | 500 | [4] |
На зависимостях σdc(T) не наблюдаются какие-либо особенности в исследованном интервале температур. Наилучшими электрофизическими характеристиками обладает образец F1768-IVб. Можно сделать вывод, что низкотемпературный синтез из нитратного расплава позволяет получать фазу состава Ba0.6La0.4F2.4 флюоритовой структуры, обладающую высокой ионной проводимостью.
ЗАКЛЮЧЕНИЕ
Результаты исследования фазообразования в системе BaF2–LaF3, согласно данным настоящей работы и [27], свидетельствуют о том, что при в температурном интервале 350–450°C формируется единственная промежуточная фаза F, рентгенограмма которой указывает на флюоритовую структуру, а область существования стягивается к составу Ba0.6La0.4F2.4. Примечательно, что область гомогенности этой фазы не простирается до чистого компонента BaF2, имеющего флюоритовую структуру, а отделена от него двухфазной областью. Эти результаты также соответствуют данным, полученным при осаждении из водных растворов [26].
Можно предположить, что в системе BaF2–LaF3 образуется низкотемпературная упорядоченная флюоритоподобная фаза состава Ba4La3F17. Фазы такой структуры выявлены в системах BaF2–RF3 для всех редкоземельных элементов за исключением лантана [33, 34]. Они характеризуются тригональным искажением кубической решетки с тонким щеплением основных линий на рентгенограммах и появлением слабых сверхструктурных отражений. В данной работе не наблюдается соответствующих искажений на рентгенограмме фазы F. По-видимому, для этого необходимы более тонкие методы исследования (электронная дифракция, использование синхротронного излучения) и/или увеличение продолжительности синтеза. Можно предположить, что фазовая диаграмма системы BaF2–LaF3 в низкотемпературной области аналогична фазовым диаграммам систем BaF2–NdF3 [35] и UO2–UO3 [36] c переходом упорядоченной флюоритоподобный фазы в неупорядоченный твердый раствор при повышении температуры. При этом установлено резкое отличие от низкотемпературной области фазовой диаграммы системы SrF2–LaF3, в которой упорядоченная фаза не образуется [31].
Области гомогенности твердых растворов на основе компонентов в системе BaF2–LaF3 при 450°C, судя по параметрам решетки синтезированных образцов, малы. Однако заметим, что в неравновесных условиях (350°C), по-видимому, удается получить твердый раствор La1–yBayF3–y небольшой концентрации (см. табл. 2).
Измерения методом импедансной спектроскопии показали, что электрофизические характеристики твердого раствора Ba0.6La0.4F2.4, синтезированного из нитратного расплава, соответствуют уровню ионной проводимости аналогичных твердых электролитов, полученных механохимическим синтезом (керамика) и направленной кристаллизацией из расплава (монокристаллы).
Список литературы
Sobolev B.P., Tkachenko N.L. Phase Diagrams of BaF2-(Y,Ln)F3 Systems // J. Less-Common Met. 1982. V. 85. P. 155. https://doi.org/10.1016/0022-5088(82)90067-4
Wapenaar K.E.D., Van Koesveld J.L., Schoonman J. Conductivity Enhancement in Fluorite-Structured Ba1–xLaxF2+x Solid Solutions // Solid State Ionics. 1981. V. 2. P. 145. https://doi.org/10.1016/0167-2738(81)90172-7
Fedorov P.P., Turkina T.M., Sobolev B.P., Mariani E., Svantner M. Ionic Conductivity in the Single Crystals of Non-Stoichiometric Fluorite Phases M1–xRxF2+x (M = Ca, Sr, Ba; R = Y, La-Lu) // Solid State Ionics. 1982. V. 6. P. 331. https://doi.org/10.1016/0167-2738(82)90018-2
Ivanov-Shits A.K., Sorokin N.I., Fedorov P.P., Sobolev B.P. Specific Features of Ion Transport in Nonstoichiometric Fluorite-type Ba1–xRxF2+x (R = La-Lu) Phases // Solid State Ionics. 1989. V. 31. P. 269. https://doi.org/10.1016/0167-2738(89)90466-9
Kolesik M., Tnega D., Sobolev B.P. A Study of the Disorder in Heavily Doped Ba1–xLaxF2+x by Raman Scattering // Phys. Status Solidi B. 1990. V. 160. P. 375–380.
Tu J.J., Sievers A.J. Experimental Study of Raman-Active Two-Level Systems and the Boson Peak in LaF3-Doped Fluorite Mixed Crystals // Phys. Rev. B. 2002. V. 66. № 094206. https://doi.org/10.1103/PhysRevB.66.094206
Аминов Л.К., Куркин И.Н., Курзин С.П., Громов И.А., Мамин Г.В., Рахматуллин Р.М. Обнаружение кубооктаэдрических кластеров в смешанных кристаллах Ba1–xLaxF2+x методом ЭПР // ФТТ. 2007. Т. 49. № 11. С. 1990–1993.
Preishuber-Pflügl F., Bottke P., Pregartner V., Bitschnau B., Wilkening M. Correlated Fluorine Diffusion and Ionic Conduction in the Nanocrystalline F-Solid Electrolyte Ba0.6La0.4F2.4-19FT1(p) NMR Relaxation vs. Conductivity Measurements // Phys. Chem. Chem. Phys. 2014. V. 16. P. 9580–9590. https://doi.org/10.1039/C4CP00422A
Rammutla K.E., Comins J.D., Erasmus R.M., Netshisaulu T.T., Ngoepe P.E., Chadwick A.V. Light Scattering and Computer Simulation Studies of Superionic Pure and La-Doped BaF2 // Chem. Phys. 2016. V. 467. P. 6–12.
Chable J., Martin A.G., Bourdin A., Body M., Legein C., Jouanneaux A., Crosnier-Lopez M.-P., Galven C., Dieudonne B., Leblanc M., Demourgues A., Maisonneuve V. Solid Electrolytes: from Microcrystalline to Nanostructured Tysonite-type La0.95Ba0.05F2.95 // J. Alloys Compd. 2017. V. 692. P. 980. https://doi.org/10.1016/j.jallcom.2016.09.135
Mori K., Mineshige A., Saito T., Sugiura M., Ishikawa Y., Fujisaki F., Namba K., Kamijama T., Otomo T., Abe T., Fukunaga T. Experimental Visualization of Interstitialcy Diffusion Pathways in Fast-fluoride-ion Conductivity Solid Electrolyte Ba0.6La0.4F2.4 // ACS Appl. Energy Mater. 2020. V. 3. P. 2873–1880. https://doi.org/10.21/acsaem.9b02494
Buchinskaya I.I., Karimov D.N., Sorokin N.I. La1–yBayF3–y Solid Solution Crystals as an Effective Solid Electrolyte: Growth and Properties // Crystals. 2021. V. 11. № 6. P. 629. https://doi.org/10.3390/cryst11060629
Sulyanova E., Karimov D.N., Sobolev B.P. Displacements in the Cationic Motif of Nonstoichiometric Fluorite Phases Ba1–xRxF2+x as a Result of the Formation of {Ba8[R6F68-69]} Clusters: III. Defect Cluster Structure of the Nonstoichiometric Ba0.69La0.31F2.31 Phase and its Dependence on Heat Treatment // Crystals. 2021. V. 11. № 4. P. 447. https://doi.org/10.3390/cryst11040447
Сорокин Н.И., Каримов Д.Н. Кристаллофизическая модель ионного переноса в монокристаллах супериоников Ba1–xLaxF2+x и Ca1–xYxF2+x // ФТТ. 2021. Т. 63. № 10. С. 1485–1495.
Nikolaichik V.I., Sobolev B.P., Sorokin N.I., Avilov A.S. Electron Diffraction Study and Ionic Conductivity of Fluorite and Tysonite Phases in the System // Solid State Ionics. 2022. V. 386. P. 116052. https://doi.org/10.1016/j.ssi.2022.116052
Федоров П.П., Соболев Б.П. Об условиях образования максимумов на кривых плавления твердых растворов в солевых системах // Журн. неорган. химии. 1979. Т.24. № 4. С. 1038–1040.
Fedorov P.P. Heterovalent Isomorphism and Solid Solutions with a Variable Number of Ions in the Unit Cell // Russ. J. Inorg. Chem. 2000. V. 45. Suppl. 3. P. S268–S291.
Sobolev B.P. The Rare Earth Trifluorides. Pt. 1. The High-Temperature Chemistry of the Rare Earth Trifluorides. Barcelona, 2000.
Иванов-Шиц А.К., Мурин И.В. Ионика твердого тела. Т. 2. СПб.: Изд-во С.-Петерб. ун-та, 2010. 1000 с.
Потанин А.А. Твердотельный химический источник тока на основе ионного проводника типа трифторида лантана // Рос. хим. журн. 2001. Т. XLV. № 5–6. С. 58.
Сорокин Н.И., Соболев Б.П. Нестехиометрические фториды – твердые электролиты для электрохимических устройств // Кристаллография. 2007. Т. 52. № 5. С. 870–892.
Rongeat C., Anji Reddy M., Witter R., Fichtner M. Nanostructured Fluorite-Type Fluorides as Electrolytes for Fluorides as Electrolytes for Fluoride Ion Batteries // J. Phys. Chem. C. 2013. V. 117. P. 4943–4950. https://doi.org/10.1021/jp3117825
Gschwind F., Rodrigues-Garsia G., Sandbeck D.J.S., Gross A., Weil M., Fichtner M., Hormann N. Fluoride Ion Batteries: Theoretical Performance, Safety, Toxicity, and a Combinatorial Screening of New Electrodes // J. Fluorine Chem. 2016. V. 182. P. 76. https://doi.org/10.1016/j.jfluchem.2015.12.002
Karkera G., Anji Reddy M., Fichtner M. Recent Developments and Perspectives of Anionic Batteries // J. Power Sources. 2021. V. 481. P. 228877. https://doi.org/10.1016/j.jpowsour.2020.228877
Sobolev B.P. The Rare Earth Trifluorides. Pt. 2. Introduction to Materials Science of Multicomponent Metal Fluoride Crystals. Barcelona, 2001.
Кузнецов С.В., Федоров П.П., Воронов В.В., Самарина К.С., Ермаков Р.П., Осико В.В. Синтез порошков Ba4R3F17 (R – редкоземельные элементы) из водных растворов // Журн. неорган. химии. 2010. Т. 55. № 4. С. 536–545.
Федоров П.П., Александров А.А., Воронов В.В., Маякова М.Н., Брагина А.Г., Цыганкова М.В., Лысакова Е.И., Дьяченко А.Н., Иванов В.К. Синтез твердого раствора Ba1–xLaxF2+x из нитратного расплава // Журн. неорган. химии. 2022. Т. 67. № 6. C. 794–801. https://doi.org/10.31857/S0044457X22060071
Fedorov P.P., Mayakova M.N., Alexandrov A.A., Voronov V.V., Kuznetsov S.V., Baranchikov A.E., Ivanov V.K. The Melt of Sodium Nitrate as a Medium for Synthesis of Fluorides // Inorganics. 2018. V. 6. № 2. P. 38–55. https://doi.org/10.3390/inorganics6020038
Fedorov P.P., Alexandrov A.A. Synthesis of Inorganic Fluorides in Molten Salt Fluxes and Ionic Liquid Mediums // J. Fluorine Chem. 2019. V. 227. № 109374. https://doi.org/10.1016/j.jfluchem.2019.109374
Warf J.C., Cline W.C., Tevebaugh R.D. Pyrohydrolysis in the Determination of Fluorides and Other Halides // Anal. Chem. 1954. V. 26. P. 342–346.
Fedorov P.P., Alexandrov A.A., Voronov V.V., Mayakova M.N., Baranchikov A.E., Ivanov V.K. Low-Temperature Phase Formation in the SrF2–LaF3 System // J. Am. Ceram. Soc. 2021. V. 104. № 6. P. 2836–2848. https://doi.org/10.1111/jace.17666
Круглов А.И., Кочергин В.П. Температура начала разложения смесей нитратов натрия и калия с их галогенидами // Изв. вузов. Химия и хим. технология. 1971. Т. 14. С. 1429–1433.
Kieser M., Greis O. Darstettung und Eignschaften der Fluoriruberstrukturphases Ba4SE3F17 mit SE = Ce-Nd, Sm-Lu und Y // Z. Anorg. Allg. Chem. 1980. B. 469. S. 164–171.
Максимов Б.А., Соланс Х., Дудка А.П., Генкина Е.А., Бардиа-Фонт М., Бучинская И.И., Лошманов А.А., Голубев А.М., Симонов В.И., Фонт-Альтаба М., Соболев Б.П. Кристаллическая структура Ba4R3F17 (R = Y, Yb), формирующаяся на основе матрицы флюорита. Упорядочение катионов и особенности анионного мотива // Кристалография. 1996. Т. 41. № 1. С. 51–59.
Федоров П.П. Применение третьего закона термодинамики к фазовым диаграммам // Журн. неорган. химии. 2010. Т. 55. № 11. С. 1825–1844.
Browning P., Hyland G.J., Ralph J. The Origin of the Specific Heat Anomaly in Solid Urania // High Temp. – High Press. 1983. V. 15. P. 169–178.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы