Неорганические материалы, 2023, T. 59, № 3, стр. 281-293
Фотокаталитические свойства пленочных пористых материалов на основе полых микросфер α-Fe2O3
А. П. Демиров 1, *, И. В. Блинков 1, Д. С. Белов 1, Н. С. Козлова 1, Е. В. Забелина 1, В. М. Касимова 1, В. Г. Костишин 1
1 Национальный исследовательский технологический университет “МИСИС”
119049 Москва,
Ленинский пр., 4, стр. 1, Россия
* E-mail: apdemirov@gmail.com
Поступила в редакцию 02.12.2022
После доработки 30.01.2023
Принята к публикации 31.01.2023
- EDN: YQLWSA
- DOI: 10.31857/S0002337X2303003X
Аннотация
В работе исследованы фотоэлектрохимические и фотокаталитические свойства пористых материалов на основе полых микросфер α-Fe2O3, характеризующихся наличием оборванных магнитных связей Fe–O–Fe, обусловленных повышенной концентрацией вакансий на границе стенка/закрытая пора. С использованием данного порошка шликерно-обжиговым методом при температуре изотермической выдержки 400°C были получены две серии пленочных образцов, нанесенных на стекло с токопроводящим слоем из суспензий двух составов: водный раствор Fe(NO3)3 + полые микросферы α-Fe2O3 (серия 1) и водный раствор Fe(NO3)3 + полиэтиленгликоль + полые микросферы α‑Fe2O3 (серия 2). Установлено, что пленки серии 2 имеют структуру с пространственно разделенными частицами различной дисперсности: наночастицы α-Fe2O3/полые микросферы α-Fe2O3, а пленки серии 1 преимущественно состоят из полых микросфер, объединенных “шейками”, формирующимися в процессе термической обработки. Толщина пленок серии 2 составляла порядка 2 мкм, а серии 1 – 4 мкм. Структурные различия пленок двух серий оказывают существенное влияние на оптические свойства материала. Пленка серии 2 (3.50 × 105 м–1) имеет примерно в 2 раза больший коэффициент поглощения света в диапазоне длин волн 350–1500 нм в сравнении с пленкой серии 1 (1.75 × 105 м–1). Исследование фотоэлектрохимических свойств в водном растворе 0.1 M KOH показало, что потенциал начала анодной реакции для пленки серии 2 составил 0.87 В vs. Ag/AgCl, а для серии 1 – 0.97 В vs. Ag/AgCl. Для обеих пленок наблюдалось нетипичное увеличение плотности тока при длительном освещении светом при потенциале 1 В vs. Ag/AgCl, вызванное формированием на поверхности фотоанода Fe(IV). Фотокаталитические свойства материалов оценивались по скорости деградации метиленового синего. Константы скорости реакции (k) составили 0.015 и 0.018 мин–1 для пленок серий 1 и 2 соответственно против k для реакции без фотокатализатора 2.8 × 10–4 мин–1.
ВВЕДЕНИЕ
Материалы, способные превращать энергию солнечного света в химическую (фотокатализаторы), имеют перспективы использования в самых различных областях [1–6].
Протекание фотокаталитической реакции на поверхности материала определяется способностью адсорбировать соответствующий радикал на поверхности фотокатализатора, положениями потолка валентной зоны и дна зоны проводимости полупроводника относительно потенциала окислительно-восстановительной реакции (ОВР). Для реализации фотокаталитической реакции потенциал ОВР должен находиться в запрещенной зоне материала. При фотокаталитических реакциях разложения органических загрязнений в воде и анодной реакции для получения водорода фотоэлектрохимическим методом важное значение имеет реакция выделения кислорода [7–9]. Положения запрещенной зоны наиболее изученных фотокаталитических материалов относительно потенциала этой реакции при pH 7 приведены на рис. 1.
Рис. 1.
Положения валентной зоны и зоны проводимости для наиболее популярных фотокатализаторов относительно потенциала ОВР O2/H2O.

Первые работы в области исследования фотокатализа и фотоэлектрохимических процессов связаны с использованием TiO2 в качестве фотокатализатора [10, 11]. Главным недостатком данного материала является достаточно широкая запрещенная зона (3.2 эВ), что обуславливает низкую адсорбционную способность по отношению к солнечному свету. Данное соединение способно поглощать только 5% от всей энергии солнечного света. Кроме того, такая широкая запрещенная зона приводит к высокой рекомбинации фотогенерированных носителей заряда [12].
Оксид вольфрама (WO3) обладает меньшей в сравнении с TiO2 шириной запрещенной зоны, следовательно, способен поглощать солнечный свет в видимом диапазоне (до 500 нм) и имеет бо́льшую подвижность электронов (12 см2/(В с) для WO3 и 0.3 см2/(В с) для TiO2). К недостаткам данного материала относят быструю рекомбинацию заряда и высокое сопротивление переносу заряда [13].
Гематит (α-Fe2O3) характеризуется рядом существенных преимуществ в сравнении в приведенными выше материалами, использующимися в качестве фотокатализаторов: запрещенная зона (2.1–2.3 эВ) позволяет поглощать солнечный свет в широком диапазоне длин волн (до 600 нм) [14], нетоксичен, его концентрация в земной коре относительно высока. Однако данный материал обладает низкой электропроводностью (10–14 См/см2), короткой длиной диффузии носителей заряда (2–4 нм), низким коэффициентом поглощения солнечного света [15].
Для устранения указанных недостатков используются методы, способствующие изменению структуры и состава. В частности, увеличение электропроводности в α-Fe2O3 достигается за счет легирования переходными металлами [16]. Наряду с легированием одним из путей улучшения проводимости α-Fe2O3, по мнению ряда исследователей, является генерация кислородных вакансий в оксидах, которые создают дополнительные локальные уровни ниже дна зоны проводимости. Вместе с тем вопрос о влиянии кислородных вакансий на эффективность фотокаталитических реакций при разложении органических загрязнений и получении водорода фотоэлектрохимическим методом в настоящее время остается дискуссионным [17]. С одной стороны, донорные примеси увеличивают концентрацию носителей заряда [18], а с другой – являются центрами рекомбинации фотогенерированных дырок [19]. Вероятно, максимально достижимая эффективность оксидных фотокатализаторов путем введения кислородных вакансий в материал определяется их концентрацией и нахождением в объеме или на поверхности материала.
Авторам [20] за счет бомбардировки ионами азота удалось сформировать кислородные вакансии на поверхности пленки, состоящей из массива наностержней α-Fe2O3. Это позволило повысить эффективность разделения заряда с 1.1 до 2.2% и эффективность переноса заряда с 8.7 до 15.2%.
Авторы [21] исследовали фотоэлектрохимические свойства пленок, полученных на основе мезокристаллов α-Fe2O3 (агломератов наночастиц с предпочтительной взаимной ориентацией). В данной структуре на границе двух наночастиц реализуется повышенное содержание кислородных вакансий. Пленка толщиной 1.5 мкм демонстрировала крайне низкий потенциал начала реакции (0.74 B относительно стандартного водородного потенциала) и концентрацию носителей заряда порядка 1020 см–3. Очевидно, что кислородные вакансии в данном случае находились в объеме пленки.
Увеличить коэффициент поглощения пленок можно за счет наноструктурирования. Однако скорость фотокаталитической реакции определяется не только количеством поглощенной энергии, эффективностью разделения фотогенерированных носителей заряда и их временем жизни, но и площадью реакционной поверхности. Площадь границы раздела материал/электролит определяется в т. ч. его смачиваемостью. При этом следует учитывать, что наноструктурные пленки гематита демонстрируют супергидрофобные свойства в результате возникновения состояния Касси [22, 23]. Таким образом, переход к наноструктурным материалам приводит к увеличению коэффициента поглощения солнечного света, но снижению площади реакционной поверхности. Данный недостаток может быть устранен за счет создания микропор в пленочном материале на поверхности, контактирующей с электролитом. Это может быть достигнуто использованием полых микросфер α-Fe2O3 при формировании таких материалов. Так, применение этого порошка в качестве фотокатализатора позволяет увеличить скорость реакции разложения метиленового синего (МС) (по фотореакции Фентона) до значений порядка 8 г–1 мин–1 при воздействии на суспензию видимым светом [24]. Наблюдаемые повышенные фотокаталитические свойства, вероятно, связаны с заключенной внутри микросферы порой, которая обеспечивает увеличенное содержание кислородных вакансий на границе закрытая пора/стенка, описываемое формулой Гиббса–Томпсона [25]. Повышенная концентрация кислородных вакансий может снижать уровень дна зоны проводимости, поэтому градиентное распределение кислородных вакансий в полой стенке микросферы может увеличивать эффективность разделения носителей заряда (электрону энергетически выгодно “стекать” к закрытой поре) (рис. 2). Вместе с тем, к недостаткам полых микросфер α-Fe2O3 можно отнести относительно узкий диапазон длин волн (от 500 до 700 нм), в котором наблюдается высокий коэффициент поглощения [26].
Рис. 2.
Схематическое изображение распределения кислородных вакансий в объеме стенки полой микросферы α-Fe2O3 и влияние концентрации кислородных вакансий на положение дна зоны проводимости (СV(O) – концентрация кислородных вакансий, $C_{{V({\text{O}})}}^{0}$ – равновесная концентрация кислородных вакансий).

На сегодняшний день в научной литературе отсутствуют данные о создании пленочных материалов на основе полых микросфер α-Fe2O3. Расширение диапазона поглощения такой пленки может быть достигнуто введением в структуру материала наночастиц. Причем если создать материал с пространственным распределением частиц по размерам (рис. 3), то удастся обеспечить высокую поглощательную способность, увеличенную площадь поверхности реакции при повышенной электропроводности и эффективность разделения носителей заряда.
Рис. 3.
Схема предлагаемого фотокатализатора на основе полых микросфер α-Fe2O3 (1 – стекло, 2 – токопроводящий слой (FTO), 3 – слой наночастиц α-Fe2O3, 4 – слой полых микросфер α-Fe2O3, 5 – электролит).

Целью данной работы является исследование оптических и фотокаталитических свойств пленок с пространственно разделенными наночастицами и полыми микросферами α-Fe2O3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Полые микросферы α-Fe2O3 были получены методом спрей-пиролиза из 10%-ного водного раствора Fe(NO3)3 при температуре в реакторе 1000°C. Микросферы отжигались в течение 3 ч при температуре 500°C с целью удаления остаточного содержания нитрата.
Пленочные образцы двух серий были получены из суспензий двух составов. Первый состав содержал 20%-ный водный раствор Fe(NO3)3/полые микросферы α-Fe2O3 в соотношении 2/3 по массе, а во второй добавлялся полиэтиленгликоль (ПЭГ-4000), соотношение компонентов в этой суспензии составляло 12/7/1 (20%-ный водный раствор Fe(NO3)3/полые микросферы α-Fe2O3/ПЭГ). Суспензия по поверхности подложки распределялась ракелем. В качестве подложки использовались стекла с токопроводящим слоем FTO (SnO2:F) размером 3 × 3 см. Подложки с распределенной по поверхности суспензией отжигались при температуре 400°C в течение 30 мин, скорость нагрева составляла 2°C/мин, охлаждение образцов осуществлялось в печи.
Поверхность полых частиц, пленок и их изломов исследовали методом сканирующей электронной микроскопии на электронном микроскопе Vega Tescan 3 (Чехия).
Фазовый состав исходных порошков и получаемых образцов определяли методом рентгенофазового анализа на дифрактометре “Дифрей-401” (Россия) (CrKα-излучение).
Мессбауэровские спектры для полых микросфер α-Fe2O3 снимались на спектрометре Ms-1104 Em (Россия), работающем в режиме постоянных ускорений при комнатной температуре. Источником γ-излучения служил Со57 в матрице родия. Изомерный химический сдвиг рассчитывался относительно α-Fe. Использовались порошковые пробы крупностью 0.05−0.07 мм. Обработка спектров проводилась по программе Univem Ms.
Оптические свойства пленок исследовали путем измерений коэффициентов диффузного отражения и пропускания методом фотометрии на спектрофотометре Cary-5000 UV-VIS-NIR (США) с приставкой UMA в диапазоне длин волн от 200 до 2000 нм.
Электрохимическое и фотоэлектрохимическое поведение исследовалось в специально изготовленной трехэлектродной ячейке (рис. 4) с использованием потенциостата-гальваностата PX-45 (Россия). Электродом сравнения служил хлорсеребряный электрод (Ag/AgCl (3 M KCl)), а вспомогательным электродом – графитовый стержень. В качестве электролита использовался водный раствор 0.1 M KOH.
Фотокаталитическую способность образцов определяли по реакции деградации МС. Для этого приготавливался водный раствор с концентрацией МС 20 мг/л, в реактор с образцом помещали 20 мл раствора. После выдержки 30 мин в реактор добавляли 0.1 мл 30%-ного раствора H2O2 и затем реактор освещался. Относительная концентрация МС определялась по отношению интенсивностей пиков в области 650 нм спектров поглощения света растворов МС. Спектры поглощения были получены с использованием спектрофотометра UV mini-1240, Shimadzu (Япония).
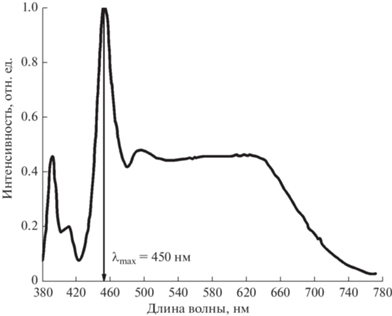
В качестве источника света для определения фотоэлектрохимических и фотокаталитических свойств использовалась LED-лампа мощностью 100 Вт с преобладающей длиной волны 450 нм (рис. 5), расстояние до ячейки-реактора составляло 15 см.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структура и состав полых микросфер α-Fe2O3. Полученные полые микросферы α-Fe2O3 (рис. 6а) имели средний диаметр ~970 нм при толщине стенки ~300 нм (рис. 6б). Пики на дифрактограмме полых микросфер соответствуют фазе α-Fe2O3 (рис. 7).
На рис. 8 приведен месбауэровский спектр полученных микросфер α-Fe2O3, который был разложен на два секстета: С1 и С2. Согласно полученным параметрам (табл. 1), секстет С1 полностью совпадает с параметрами α-Fe2O3 [27, 28]. Секстет С2 также относится к α-Fe2O3, но с меньшим магнитным полем на ядрах Fe57 (490 против 514 кЭ), а также большей шириной резонансных линий (0.58 против 0.29 мм/с). Это может быть объяснено оборванными магнитными связями Fe–O–Fe, возникающими вследствие повышенной концентрации кислородных вакансий на границе закрытая пора/стенка микросферы. Угол Θ, характеризующий ориентацию магнитных моментов и вектор распространения γ-излучения в спектрометре, составил 54.8°, что согласуется со слабым ферромагнетизмом образца с углом Θ, близким к 55°.
Таблица 1.
Мессбауэровские параметры порошка α-Fe2O3, полученного методом спрей-пиролиза
| Компонента спектра | δ, мм/с | Δ, мм/с | Hэф, кЭ | S, отн. % | Г, мм/с |
|---|---|---|---|---|---|
| C1(Fe3+)VI | 0.37 | –0.21 | 514 | 86 | 0.29 |
| С2(Fe3+)VI | 0.37 | –0.18 | 490 | 14 | 0.58 |
Морфология и фазовый состав пленок на основе полых микросфер α-Fe2O3. На рис. 9 приведены СЭМ-изображения поверхностей полученных пленок. Их когезионная прочность обеспечивается за счет формирования “шеек”, образующихся при термической обработке суспензий. В пленке, получаемой из суспензии 1, без ПЭГ, “шейки” явно имеют меньшую площадь поперечного сечения (рис. 9а), чем в пленке, полученной из суспензии 2 (рис. 9б). Средняя толщина получаемых пленок составила 4 мкм (рис. 10а) и 2 мкм (рис. 10б) при использовании суспензий 1 и 2 соответственно.
Образование “шеек” связано с формированием капель водного раствора нитрата железа в области контакта полых микросфер, что обусловлено поверхностным натяжением капли, и последующим термическим разложением Fe(NO3)3 на воздухе, приводящим к образованию α-Fe2O3.
Добавление 5 мас. % ПЭГ (серия 2) в суспензию и увеличение содержания водного раствора Fe(NO3)3 до 60 мас. % позволяет получить на поверхности подложки нанодисперсный слой (рис. 9б). Формирование нанодисперсного слоя обуславливается уменьшением поверхностной энергии на границе раздела за счет добавления поверхностно-активного вещества – ПЭГ [29]. Увеличение диаметра “шейки” в пленках серии 2 может быть связано с большей вязкостью суспензии. Это приводит к росту диаметра капли раствора нитрата железа в области контакта полых микросфер. В пленках, полученных из суспензий без ПЭГ, наночастицы α-Fe2O3 преимущественно располагаются в области контакта подложки и полых субмикронных частиц, обеспечивая адгезию между FTO и пленкой на основе полых субмикросфер. В этих областях наблюдается наибольшая площадь контакта капли раствора нитрата железа с твердой поверхностью. Это снижает энергию, затрачиваемую на образование поверхности зародыша новой фазы.
Таким образом, использование суспензии с ПЭГ позволяет формировать пленки со структурой, подобной приведенной на рис. 2.
Межплоскостные расстояния, рассчитанные из дифрактограмм пленок (рис. 11), соответствуют фазам α-Fe2O3 и SnO2. Оксид олова является основой токопроводящего слоя, нанесенного на стекло.
Оптические свойства пленок. На основании спектров диффузного пропускания и отражения определены зависимости коэффициента поглощения от длины волны (рис. 12). Видно, что поглощение пленки серии 2 (с ПЭГ) в сравнении с пленкой серии 1 примерно в два раза больше в диапазоне длин волн видимого света.
Наблюдаемые на рис. 12 адсорбционные пики соответствуют указанным d–d-переходам (6А1 → 4E(4D); 6A1 → 4E, 4A1(4G); 6А1 → 4T2(4G)) и двойному переходу (6A1 + 6A1 → 4T1(4G) + 4T1(4G)) [26, 30]. Пик, наблюдаемый при 1200 и 1500 нм для пленок серий 1 и 2 соответственно, вероятно, вызван множественными переходами [30]. Для серии 2 адсорбционные пики при 352, 415 и 507 нм заметны более отчетливо, чем для серии 1. Это связано с наличием слоя из наночастиц в пленках серии 2, для которых характерны указанные выше пики [30]. Пик при ~700 нм, наблюдаемый в пленках обеих серий, характерен для полых субмикросфер α-Fe2O3 [30]. Таким образом, представленные спектры поглощения показывают, что структура с пространственным распределением наночастиц и полых микросфер α-Fe2O3 обладает большей поглощательной способностью в видимом диапазоне света, чем пленка на основе полых микросфер.
Фотоэлектрохимическое поведение пленок. На рис. 13 приведены вольтамперограммы пленочных образцов серий 1 и 2. Видно, что потенциал начала анодной реакции для пленок серии 2 (с ПЭГ) на 100 мВ ниже, чем для пленок серии 1. При этом полученные значения потенциала начала анодной реакции на исследуемых образцах (0.97 и 0.87 В vs. Ag/AgCl) в темноте (рис. 13) ниже, чем типичные для пленок α-Fe2O3 (1.1–1.5 В vs. Ag/AgCl [31, 32]).
Рис. 13.
Вольтамперограммы для пленочных образцов серий 1 (а) и 2 (б) при скорости развертки 20 мВ/с в темноте.

На рис. 14 приведено изменение потенциала разомкнутой цепи при освещении пленочных образцов, свидетельствующее о генерации основных (электронов) и неосновных (дырок) носителей заряда и их движении в объем материала и к поверхности соответственно под действием поля обедненного слоя. Увеличение изменения потенциала разомкнутой цепи (ΔVр.ц) увеличивает эффективность фотоэлектрохимического элемента [11, 33]. Для пленок серий 1 и 2 эти значения составили 191 и 239 мВ соответственно при типичных значениях порядка 120–150 мВ [34, 35]. Бо́льшее значение ΔVр.ц для пленок серии 2 объясняется повышенным коэффициентом поглощения в диапазоне длин волн источника солнечного света (от 380 до 740 нм).
Рис. 14.
Изменение потенциала разомкнутой цепи при освещении пленочных образцов серий 1 (а) и 2 (б) (момент включения и выключения источника света обозначен метками вкл. и выкл.).

При потенциостатических фотоэлектрохимических исследованиях в пассивной области (0.5 В vs. Ag/AgCl) пленочные образцы демонстрируют классическое поведение для фотоанода. При освещении пленок при постоянном потенциале наблюдаются резкое увеличение плотности тока, а затем его плавное снижение, вызванное низкой кинетикой анодной реакции, и стабилизация (рис. 15). При выключении источника света значения резко возвращались к исходным.
Рис. 15.
Потенциостатические кривые, снятые в темноте и при освещении пленок серий 1 (а) и 2 (б) при 0.5 В vs. Ag/AgCl (отметка вкл. обозначает момент включения источника света).

При постоянном потенциале 1 В vs. Ag/AgCl и длительном освещении потенциостатические кривые демонстрируют нетипичное фотоэлектрохимическое поведение образцов (рис. 16). В начальный момент включения источника света плотность тока резко увеличивается на 100 60 мкА/см2, что можно связать непосредственно с фотоэффектом. Данное резкое увеличение, как правило, обусловлено переносом заряда лиганд–металл. Дальнейшее увеличение плотности тока после освещения фотоанода не может быть связано с данным переносом заряда, поскольку время жизни фотогенерированных дырок и электронов составляет порядка 10–6–10–7 с. Это явление может быть объяснено генерацией дырок второго типа, обусловленной переносами заряда 6A1 → 4T1 и 6A1 → 4T2, что может приводить к реакции [36]
(1)
${\text{Fe}}\left( {{\text{III}}} \right) - {\text{OH}} + {{{\text{h}}}^{ + }} \to {\text{Fe}}\left( {{\text{IV}}} \right) = {\text{O}} + {{{\text{H}}}^{ + }}.$Рис. 16.
Потенциостатические кривые, снятые в темноте и при освещении пленок серий 1 (а) и 2 (б) при потенциале 1.0 В vs. Ag/AgCl.

О возможности образования Fe(IV) и Fe(V) на поверхности гематита также сообщалось в [37–39 ]. Эффект длительного роста плотности тока был также обнаружен в фотоаноде Fe2TiO5/Fe2O3 [40]. Вместе с тем отмечается, что Fe(IV) является “ловушкой” для фотогенерированных электронов в недопированных фотоанодах α-Fe2O3. Как уже отмечалось, полые субмикросферы имеют большую концентрацию кислородных вакансий на задней стенке (границе закрытая пора/стенка субмикросферы). Эта особенность обуславливает снижение уровня дна зоны проводимости и, следовательно, повышает эффективность разделения заряда. Таким образом, фотогенерированные электроны диффундируют к задней стенке частицы и не попадают в “ловушку”, что повышает вероятность протекания реакции (1).
Части кривой, полученные при освещении и после отключения источника света, могут быть описаны уравнением
где a, b, i0 – “подгоночные” коэффициенты, i – плотность фототока (мА/см2), τ – время (с).Параметры функции приближения приведены в табл. 2 и 3.
Таблица 2.
Параметры функции приближения для части кривой, снятой при освещении
| Серия | i0 | a | b | Сумма квадратов отклонений |
|---|---|---|---|---|
| 1 | 2.04 | – 1.13 | 7230 | 6 × 10–3 |
| 2 | 2.58 | – 2.12 | 12 055 | 8 × 10–3 |
Таблица 3.
Параметры функции приближения для части кривой, снятой после выключения источника света
| Серия | i0 | a | b | Сумма квадратов отклонений |
|---|---|---|---|---|
| 1 | 1.06 | 38.38 | 4214 | 6 × 10–3 |
| 2 | 1.05 | 2.17 | 4359 | 1 × 10–3 |
Основываясь на том, что увеличение плотности тока после 1 мин освещения связано исключительно с образованием Fe(IV), ускоряющим анодную реакцию, и что плотность тока увеличивается линейно с концентрацией Fe(IV) на поверхности, и допуская, что данная реакция первого порядка, т.е. кинетическая кривая инвариантна, можно предположить, что уравнение (2) описывает кинетику реакции Fe(III) ↔ Fe(IV). Тогда параметры имеют следующий физический смысл: (i – i0) – эквивалент начальной концентрации Fe(IV); a – эквивалент конечной концентрации Fe(IV); 1/b – эквивалент константы скорости химической реакции; эквивалент константы скорости прямой химической реакции Fe(III) → Fe(IV) равен 8 × 10–5–1 × 10–4, а обратной – 2 × 10–4. Эта разница может быть связана с бо́льшей энергией активации реакции Fe(IV) → Fe(III) по сравнению с реакцией Fe(III) → Fe(IV).
Фотокаталитическое поведение пленок в процессе разложения МС. Фотокаталитическая активность образцов оценивалась по реакции разложения МС. Спектры поглощения водного раствора МС имеют линейную зависимость с концентрацией МС: при уменьшении концентрации МС интенсивность пика поглощения в области 650 нм уменьшается. Все образцы демонстрируют фотокаталитическую активность (рис. 17а, 17б). После 140 мин реакции степень деградации ((C0 – C)/C0 × 100%) составила более 90% для всех образцов. Кинетика данной реакции подчиняется кинетической модели Ленгмюра–Хиншельвуда и описывается уравнением [41, 42]
где С – концентрация МС в момент времени τ, С0 – начальная концентрация MC, τ – время, k – константа скорости реакции.Рис. 17.
Спектры поглощения водных растворов метиленового синего при различном времени воздействия света на реактор с пленкой серий 1 (а), 2 (б) и кинетическая кривая для пленок серий 1 и 2 в координатах модели первого порядка (в).
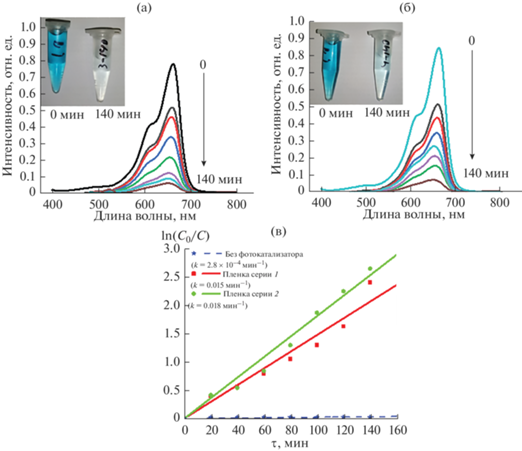
При построении графика в координатах ln(C0/C)–τ может быть оценена константа скорости реакции k (рис. 17в). Из графика видно, что константы скорости реакции составили 0.015 и 0.018 мин–1 для пленок серий 1 и 2 при воздействии источником света на раствор МС без фотокатализатора 2.8 × 10–4 мин–1.
Фотокаталитическая реакция обуславливается генерацией электронно-дырочных пар, которые участвуют в процессе создания высокоактивных радикалов OH– на поверхности фотокатализатора. Радикалы, взаимодействуя с МС, разлагают его на H2O и CO2 [43].
ЗАКЛЮЧЕНИЕ
Исследование методом мессбауэровской спектроскопии полых микросфер α-Fe2O3 показало, что в частице присутствуют оборванные магнитные связи Fe–O–Fe, появление которых можно объяснить повышенной концентрацией кислородных вакансий на границе закрытая пора/стенка.
Шликерно-обжиговым способом получены пленки на основе полых микросфер α-Fe2O3 из суспензий составов: 20%-ный водный раствор Fe(NO3)3/полые микросферы α-Fe2O3 (серия 1) и 20%-ный водный раствор Fe(NO3)3/ПЭГ/полые микросферы α-Fe2O3 (серия 2) на токопроводящем стекле. Состав суспензии оказывает существенное влияние на структуру формируемых пленочных материалов. Так, пленка серии 1 имеет однородную структуру на основе полых микросфер, соединенных “шейками”. Пленка серии 2 характеризуется структурой на основе пространственно разделенных частиц двух уровней дисперсности – слоя наночастиц, прилегающего к субстрату, и слоя микросфер.
Показано, что структурные различия оказывают существенное влияние на оптические свойства материала. Пленка серии 2 имеет адсорбционные пики, которые соответствуют d–d-переходам (6А1 → 4E(4D), 6A1 → 4E4A1(4G), 6А1 → 4T2(4G)) и двойному переходу (6A1 + 6A1 → 4T1(4G) + 4T1(4G)), в то время как пленка серии 1 имеет один ярко выраженный адсорбционный пик 6А1 → 4T2(4G). При этом коэффициент поглощения у пленки серии 2 в два раза выше, чем у пленки серии 1.
Потенциал начала анодной реакции у пленки серии 2 ниже, чем у пленки серии 1 (0.87 против 0.97 В vs. Ag/AgCl), при этом изменение потенциала разомкнутой цепи при освещении у нее больше (239 против 191 мВ). Это говорит о более высоких фотоэлектрохимических свойствах пленок серии 2.
При потенциале 1 В vs. Ag/AgCl исследуемые материалы демонстрируют нетипичное фотоэлектрохимическое поведение, заключающееся в постепенном увеличении плотности тока при длительном освещении светом фотоанода. Данная особенность обусловлена формированием Fe(IV) на поверхности фотоанода и повышенной эффективностью разделения заряда за счет градиентного распределения вакансий кислорода в стенке полой микросферы α-Fe2O3.
Константы скорости реакции разложения водного раствора МС, использующиеся для оценки фотокаталитических свойств материала, составили 0.015 и 0.018 мин–1 для пленок серий 1 и 2 соответственно.
Таким образом, формирование фотокатализаторов с пространственным разделением частиц различной дисперсности может повысить их эффективность вследствие роста коэффициента поглощения солнечного света в широком диапазоне длин волн и увеличения площади реакционной поверхности.
Список литературы
Wang Y., Torres J.A., Shviro M., Carmo M., He T., Ribeiro C. Photocatalytic Materials Applications for Sustainable Agriculture // Prog. Mater. Sci. 2022. V. 130. P. 100965. https://doi.org/10.1016/j.pmatsci.2022.100965
Киселев В.М., Евстропьев С.К., Стародубцев А.М. Фотокаталитическая деградация и сорбция метиленового синего на поверхности оксидов металлов в водном растворе красителя // Опт. спектроскопия. 2017. Т. 123. № 5. С. 798–805. https://doi.org/10.7868/S0030403417090173
Михайлов Д.А., Лелет М.И., Фукина Д.Г., Лелет Ю.Н. Фотокаталитические свойства фосфатов MgHPO4· ·3H2O и MgKPO4·6H2O // Неорган. материалы. 2022. Т. 58. № 6. С. 641–650. https://doi.org/10.31857/S0002337X22060069
Cheng X.-M., Zhao J., Sun W.-Y. Facet-Engineering of Materials for Photocatalytic Application: Status and Future Prospects // EnergyChem. 2022. V. 4. № 5. P. 100084. https://doi.org/10.1016/j.enchem.2022.100084
Беликов М.Л., Сафарян С.А. Адсорбционные и фотокаталитические свойства диоксида титана, модифицированного молибденом // Неорган. материалы. 2022. Т. 58. № 7. С. 742–749. https://doi.org/10.31857/S0002337X2207003X
Bie Ch., Wang L., Yu J. Challenges for Photocatalytic Overall Water Splitting // Chem. 2022. V. 8. № 6. P. 1567–1574. https://doi.org/10.1016/j.chempr.2022.04.013
Wang Q., Tian S., Ning P. Degradation Mechanism of Methylene Blue in a Heterogeneous Fenton-like Reaction Catalyzed by Ferrocene // Ind. Eng. Chem. Res. 2014. V. 53. № 2. P. 643–649. https://doi.org/10.1021/ie403402q
Ameta S.C., Ameta R. Advanced Oxidation Processes for Waste Water Treatment. L.: Academic, 2018. 451 p.
Gopinath M., Marimuthu R. A Review on Solar Energy-based Indirect Water-Splitting Methods for Hydrogen Generation // Int. J. Hydrogen Energy. 2022. V. 47. № 89. P. 37742–37759. https://doi.org/10.1016/j.ijhydene.2022.08.297
Coronado J.M., Fresno F., Hernández-Alonso M.D., Portela R. Design of Advanced Photocatalytic Materials for Energy and Environmental Applications. L.: Springer, 2013. https://doi.org/10.1007/978-1-4471-5061-9
Плесков Ю.В. Фотоэлектрохимическое преобразование солнечной энергии М.: Химия, 1990. 176 с.
Moridon S.N.F., Yunus K.A.R.M., Minggu L.J., Kassim M.B. Photocatalytic Water Splitting Performance of TiO2 Sensitized by Metal Chalcogenides: A Review // Ceram. Int. 2022. V. 48. № 5. P. 5892–5907. https://doi.org/10.1016/j.ceramint.2021.11.199
Costa M.B., Araújo M.A., Lima Tinoco M.V., Brito J.F., Mascaro L.H. Current Trending and Beyond for Solar-Driven Water Splitting Reaction on WO3 Photoanodes // J. Energy Chem. 2022. V. 73. P. 88–113. https://doi.org/10.1016/j.jechem.2022.06.003
Piccinin S. The Band Structure and Optical Absorption of Hematite (α-Fe2O3): a First-Principles GW-BSE Study // Phys. Chem. Chem. Phys. 2019. V. 21. № 6. P. 2957–2967. https://doi.org/10.1039/C8CP07132B
Tamirat A.G., Rick J., Dubale A.A., Su W.-N., Hwang B.-J. Using Hematite for Photoelectrochemical Water Splitting: A Review of Current Progress and Challenges // Nanoscale Horiz. 2016. V. 1. № 4. P. 243–267. https://doi.org/10.1039/C5NH00098J
Malviya K.D., Klotz D., Dotan H., Shlenkevich D., Tsyganok A., Mor H., Rothschild A. Influence of Ti Doping Levels on the Photoelectrochemical Properties of Thin-Film Hematite (α-Fe2O3) Photoanodes // J. Phys. Chem. C. 2017. V. 121. № 8. P. 4206–4213. https://doi.org/10.1021/acs.jpcc.7b00442
Fernández-Climent R., Giménez S., García-Tecedor M. The Role of Oxygen Vacancies in Water Splitting Photoanodes // Sustain. Energy Fuels. 2020. V. 4. № 12. P. 5916–5926. https://doi.org/10.1039/D0SE01305F
Wang Y., Zhang J., Balogun M.-S., Tong Y., Huang Y. Oxygen Vacancy–Based Metal Oxides Photoanodes in Photoelectrochemical Water Splitting // Mater. Today Sustain. 2022. V. 18. P. 100118. https://doi.org/10.1016/j.mtsust.2022.100118
Yang Q., Du J., Li J., Wu Y., Zhou Y., Yang Y., Yang D., He H. Thermodynamic and Kinetic Influence of Oxygen Vacancies on the Solar Water Oxidation Reaction of α-Fe2O3 Photoanodes // ACS Appl. Mater. Interfaces. 2020. V. 12. № 12. P. 11625–11634. https://doi.org/10.1021/acsami.9b21622
Hu J., Zhao X., Chen W., Chen Z. Enhanced Charge Transport and Increased Active Sites on α-Fe2O3 (110) Nanorod Surface Containing Oxygen Vacancies for Improved Solar Water Oxidation Performance // ACS Omega. 2018. V. 3. № 11. P. 14973–14980. https://doi.org/10.1021/acsomega.8b01195
Zhang Z., Karimata I., Nagashima H., Muto S., Ohara K., Sugimoto K., Tachikawa T. Interfacial Oxygen Vacancies Yielding Long-Lived Holes in Hematite Mesocrystal-Based Photoanodes // Nat. Commun. 2019. V. 10. № 1. P. 4832. https://doi.org/10.1038/s41467-019-12581-z
More P.D., Jadhav P.R., Ghanwat A.A., Dhole I.A., Navale Y.H., Patil V.B. Spray Synthesized Hydrophobic α-Fe2O3 Thin Film Electrodes for Supercapacitor Application // J. Mater. Sci.: Mater. Electron. 2017. V. 28. № 23. P. 17839–17848. https://doi.org/10.1007/s10854-017-7725-5
Liang T., Guo X., Yuan B., Kong S., Huang H., Fu D., Zhang F., Xu J., Li X. Design of Functionalized α-Fe2O3 (III) Films with Long-Term Anti-Wetting Properties // Ceram. Int. 2020. V. 45. № 5. P. 6129–6135. https://doi.org/10.1016/j.ceramint.2019.11.077
Zhang Y., Su Y., Wang Y., He J., McPherson G.L., John V.T. Rapid Fabrication of Hollow and Yolk-shell α-Fe2O3 Particles with Applications to Enhanced Photo-Fenton Reactions // RSC Adv. 2017. V. 7. № 62. P. 39049–39056. https://doi.org/10.1039/C7RA06621J
Bokstein B.S., Esin V.A., Rodin A.O., Svetlov I.L. Models for the Porosity Growth and Dissolution in Single-Crystal Nickel-Base Superalloys // Defect Diffus. Forum. 2010. V. 297-301. P. 187–192. doi: 10.4028/www.scientific.net/DDF.297-301.187
Lian J., Duan X., Ma J., Peng P., Kim T., Zheng W. Hematite (α-Fe2O3) with Various Morphologies: Ionic Liquid-Assisted Synthesis, Formation Mechanism, and Properties // ACS Nano. 2009. V. 3. № 11. P. 3749–3761. https://doi.org/10.1021/nn900941e
Van der Wood F. Mossbauer Effect in α-Fe2O3 // Phys. Status Solidi. 1966. V. 17. № 1. P. 417–432. https://doi.org/10.1002/pssb.19660170147
Князев Ю.В., Чумаков А.И., Дубровский А.А., Семенов С.В., Якушкин С.С., Кириллов В.Л., Мартьянов О.Н., Балаев Д.А. Мессбауэровские исследования магнитного перехода в наночастицах α-Fe2O3 на синхротронном и радионуклидном источниках // Письма в ЖЭТФ. 2019. Т. 110. № 9. С. 514–619. https://doi.org/10.1134/S0370274X19210082
Копкова Е.К., Майоров Д.В., Кондратенко Т.В. Получение и исследование структурно-поверхностных и сорбционных свойств слоистых двойных гидроксидов магния и алюминия, модифицированных полиэтиленгликолем // Сорбционные и хроматографические процессы. 2022. Т. 21. № 6. С. 894–904. https://doi.org/10.17308/sorpchrom.2021.21/3836
Mitra S., Das S., Mandal K., Chaudhuri S. Synthesis of a α-Fe2O3 Nanocrystal in Its Different Morphological Attributes: Growth Mechanism, Optical and Magnetic Properties // Nanotechnology. 2007. V. 18. № 27. P. 275608. https://doi.org/10.1088/0957-4484/18/27/275608
Freitas A.L.M., Muche D.N.F., Leite E.R., Souza F.L. Interface Engineering of Nanoceramic Hematite Photoelectrode for Solar Energy Conversion // J. Am. Ceram. Soc. 2020. V. 103. P. 6833– 6846. https://doi.org/10.1111/jace.17390
Zhong D.K., Gamelin D.R. Photoelectrochemical Water Oxidation by Cobalt Catalyst (“Co−Pi”)/α-Fe2O3 Composite Photoanodes: Oxygen Evolution and Resolution of a Kinetic Bottleneck // J. Am. Chem. Soc. 2010. V. 132. № 12. P. 4202–4207. https://doi.org/10.1021/ja908730h
Walter M.G., Warren E.L., McKone J.R., Boettcher S.W., Mi Q., Santori E.A., Lewis N.S. Solar Water Splitting Cells // Chem. Rev. 2010. V. 110. № 11. P. 6446–6473. https://doi.org/10.1021/cr1002326
Krysa J., Zlamal M., Kment S., Brunclikova M., Hubicka Z. TiO2 and Fe2O3 Films for Photoelectrochemical Water Splitting // Molecules. 2015. V. 20. P. 1046–1058. https://doi.org/10.3390/molecules20011046
Xiao C., Zhou Z., Li L., Wu S., Li X. Tin Oxygen-Vacancy Co-Doping into Hematite Photoanode for Improved Photoelectrochemical Performances // Nanoscale Res. Lett. 2020. V. 15. № 1. P. 54. https://doi.org/10.1186/s11671-020-3287-1
Kennedy J.H., Frese K.W. Photooxidation of Water at α-Fe2O3 Electrodes // J. Electrochem. Soc. 1978. V. 125. № 5. P. 709.https://doi.org/10.1149/1.2131532
Upul Wijayantha K.G., Saremi-Yarahmadi S., Peter L.M. Kinetics of Oxygen Evolution at α-Fe2O3 Photoanodes: a Study by Photoelectrochemical Impedance Spectroscopy // Phys. Chem. Chem. Phys. 2011. V. 13. № 12. P. 5264–5270.https://doi.org/10.1039/C0CP02408B
Peter L.M., Upul Wijayantha K.G., Tahir A.A. Kinetics of Light-Driven Oxygen Evolution at α-Fe2O3 Electrodes // Faraday Discuss. 2012. V. 155. P. 309–322. https://doi.org/10.1039/C1FD00079A
Braun A., Sivula K., Bora D.K., Zhu J., Zhang L., Grätzel M., Guo J., Constable E.C. Direct Observation of Two Electron Holes in a Hematite Photoanode During Photoelectrochemical Water Splitting // J. Phys. Chem. C. 2012. V. 116. № 32. P. 16870–16875. https://doi.org/10.1021/jp304254k
Deng J., Lv X., Zhong J. Photocharged Fe2TiO5/Fe2O3 Photoanode for Enhanced Photoelectrochemical Water Oxidation // J. Phys. Chem. C. 2018. V. 122. № 51. P. 29268–29273. https://doi.org/10.1021/acs.jpcc.8b08826
Vasiljevic Z.Z., Dojcinovic M.P., Vujancevic J.D., Jankovic-Castvan I., Ognjanovic M., Tadic N.B., Stojadinovic S., Brankovic G.O., Nikolic M.V. Photocatalytic Degradation of Methylene Blue under Natural Sunlight Using Iron Titanate Nanoparticles Prepared by a Modified Sol–Gel Method // R. Soc. Open Sci. 2020. V. 7. № 9. P. 200708. https://doi.org/10.1098/rsos.200708
Ma M., Yang Y., Chen Y., Ma Y., Lyu P., Cui A., Huang W., Zhang Z., Li Y., Si F. Photocatalytic Degradation of MB Dye by the Magnetically Separable 3D Flower-Like Fe3O4/SiO2/MnO2/BiOBr-Bi Photocatalyst // J. Alloys Compd. 2021. V. 861. P. 158256. https://doi.org/10.1016/j.jallcom.2020.158256
Vu X.H., Phuoc L.H., Dien N.D., Pham T.T.H., Thanh L.D. Photocatalytic Degradation of Methylene Blue (MB) over α-Fe2O3 Nanospindles Prepared by a Hydrothermal Route // J. Electron. Mater. 2019. V. 48. № 5. P. 2978–2985. https://doi.org/10.1007/s11664-019-07056-2
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы