Журнал неорганической химии, 2023, T. 68, № 4, стр. 463-470
Синтез и стабилизация кристаллогидратной модификации SrSO4 ⋅ 0.5H2O
Н. Н. Бушуев a, *, А. А. Сысоев a, Ю. А. Великодный b
a Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, Россия
* E-mail: nbushuev@muctr.ru
Поступила в редакцию 20.09.2022
После доработки 27.10.2022
Принята к публикации 31.10.2022
- EDN: JEAQAX
- DOI: 10.31857/S0044457X22601675
Аннотация
Разработана методика синтеза метастабильной тригональной модификации SrSO4 ⋅ 0.5H2O, изоструктурной известной модификации СаSO4 ⋅ 0.5H2O (пр. гр. P3121). Предложено использовать в качестве прекурсора при кристаллизации SrSO4 ⋅ 0.5H2O замороженные растворы NaCl в воде. Предложен способ стабилизации структуры SrSO4 ⋅ 0.5H2O путем изовалентного замещения ионов стронция на ионы кальция или гетеровалентного замещения ионов стронция на ионы калия и лантана. Получен образец стабилизированной модификации SrSO4 ⋅ 0.5H2O на примере соединения K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O. Определены и уточнены параметры элементарной ячейки. Предложена модель структуры SrSO4 ⋅ 0.5H2O при статистическом размещении атомов калия, лантана и стронция по позициям атомов Са в известной структуре СаSO4 ⋅ 0.5H2O.
ВВЕДЕНИЕ
Полугидрат сульфата стронция SrSO4 ⋅ 0.5H2O, впервые полученный в работе [1], кристаллизуется в тригональной сингонии (пр. гр. Р3121) и, по-видимому, изоструктурен соединению СаSO4 ⋅ ⋅ 0.5H2O, используемому в качестве вяжущего строительного материала. В литературе имеются сведения о получении твердых растворов на основе изовалентного замещения ионов стронция на ионы кальция по схеме: Sr2+ → Ca2+ [2], а также на основе гетеровалентного замещения ионов стронция по схеме: 2Sr2+ → K+ + La3+ [3]. Синтез SrSO4 ⋅ 0.5H2O и исследование его структуры затруднены вследствие короткого времени существования этого соединения (2 ч). Методом электронной микроскопии исследован процесс кристаллизации сульфата стронция из водных растворов SrSO4–NaCl–H2О [4]. Установлено образование SrSO4 ⋅ 0.5H2O и SrSO4. В качестве стабилизатора кристаллизуемых фаз использовали растворы силикагеля. В работе отсутствуют выводы о механизме и влиянии растворов хлористого натрия на кристаллизацию сульфата стронция. Получаемый осадок в первый момент представляет высокодисперсную рентгеноаморфную фазу. В течение 2 ч наблюдается превращение тригональной модификации полугидрата сульфата стронция в безводную ромбическую модификацию сульфата стронция. В литературе практически отсутствуют сведения об особенностях синтеза SrSO4 ⋅ 0.5H2O, поиске исходных прекурсоров, позволяющих в течение длительного времени хранить исходную реакционную смесь, из которой можно быстро и надежно получать кристаллы SrSO4 ⋅ 0.5H2O. Исследование и методы стабилизации кристаллической структуры SrSO4 ⋅ 0.5H2O представляют научный и практический интерес.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучены процессы кристаллизации сульфата стронция из водных 1 М растворов хлорида стронция и соответствующих 1 М растворов сульфатов аммония, натрия и калия. В качестве исходных реактивов для приготовления 1 М растворов использовали SrCl2 ⋅ 2H2O, (NH4)2SO4, Na2SO4 и K2SO4 (все соединения марки “х. ч.”). Осаждение сульфата стронция проводили при комнатной температуре с перемешиванием эквивалентных количеств растворов хлорида стронция и соответствующих количеств сульфатов аммония, натрия и калия в течение 10 мин. Полученные осадки отфильтровывали, промывали спиртом для удаления влаги и подвергали рентгенофазовому анализу на дифрактометре Arl Equinox 100. Регистрацию дифракционной картины осуществляли в течение 5 мин одновременно во всем диапазоне углов 2θ от 5° до 90°.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате проведенных экспериментов установлено, что кристаллизация безводной ромбической модификации SrSO4 наблюдается из растворов хлоридов стронция, сульфатов аммония или калия, в то время как из растворов хлорида стронция и сульфата натрия кристаллизуется тригональная модификация SrSO4 ⋅ 0.5H2O:
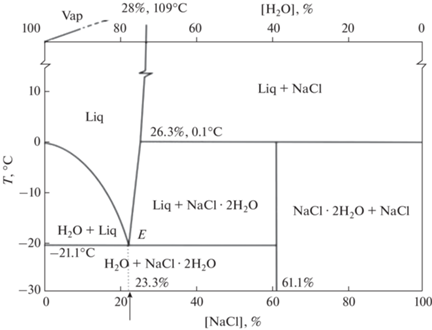
Полученный осадок SrSO4 ⋅ 0.5H2O теряет при комнатной температуре в течение 2 ч кристаллогидратную воду и полностью переходит в ромбическую модификацию SrSO4. Сделан вывод о положительном влиянии растворов хлорида натрия на кристаллизацию SrSO4 ⋅ 0.5H2O. В отличие от хлоридов калия и аммония, хлорид натрия встречается в природе в виде кристаллогидрата NaCl ⋅ ⋅ 2H2O [5]. Описание некоторых физико-химических свойств NaCl ⋅ 2H2O и его влияния на процессы кристаллизации воды в виде льда можно часто встретить в литературе [6–11]. Определенный интерес представляет фазовая диаграмма H2O–NaCl, построенная авторами работы [12].
На рис. 1 приведена диаграмма H2O–NaCl, на которой видно, что указанный кристаллогидрат NaCl ⋅ 2H2O содержит 61.1% NaCl и разлагается при температуре 0.1°C с образованием NaCl и жидкой фазы. Эвтектика между NaCl ⋅ 2H2O и H2O плавится при температуре –21.1°С и содержит 23.3% NaCl, что соответствует составу, содержащему 38.1% H2O в виде льда и 61.9% кристаллической фазы NaCl ⋅ 2H2O. Эвтектика в системе H2O–NaCl содержит 76.7% твердой фазы H2O, значительная доля которой присутствует в виде кристаллогидратной формы NaCl ⋅ 2H2O. На основании этого можно сделать вывод, что NaCl способен удерживать значительное количество воды в виде кристаллогидратной формы при отрицательных температурах, т.е. ниже точки замерзания воды (0°C).
Полученный после осаждения сульфата стронция раствор, содержащий ~6% NaCl, помещали в морозильную камеру до полного замерзания при температуре –20°C и выдерживали в течение 4 ч для полной кристаллизации.
Закристаллизованную в небольшой кювете массу (1–2 мг) извлекали из холодильника и быстро переносили на дифрактометр Arl Equinox 100. В течение первых 15 с при комнатной температуре удалось получить рентгенограмму, свидетельствующую о наличии кристаллической дифракционной решетки исследуемого твердого закристаллизованного образца.
Предварительный анализ дифракционных линий рентгенограммы не обнаруживает возможных фаз SrSO4 ⋅ 0.5H2O, SrSO4, NaCl или NaCl ⋅ 2H2O, что свидетельствует о достаточно сложной структуре полученного комплексного соединения. Более детальный рентгенографический анализ провести не удалось вследствие ограниченного времени съемки. В течение 30 с образец плавится и превращается в рентгеноаморфную фазу. Необходимо отметить, что более детальное исследование следует проводить на низкотемпературном дифрактометре при температуре –20°С.
Важным этапом исследования был поиск и отработка методики выделения и отделения SrSO4 ⋅ 0.5Н2O от закристаллизованной массы. Замерзшую массу образца нагревали до полного плавления кристаллогидрата NaCl ⋅ 2H2O при температуре 0°С. Жидкую фазу быстро удаляли фильтрованием, а оставшуюся кристаллическую часть подвергали рентгенофазовому анализу на рентгеновском дифрактометре Arl Equinox 100. В результате съемки образца в течение 5 мин удалось получить рентгенограмму тригональной модификации SrSO4 ⋅ 0.5Н2O, аналогичную рентгенограмме японских исследователей [1], с параметрами тригональной ячейки SrSO4 ⋅ 0.5Н2O a = 7.178, c = = 6.589 Å.
В табл. 1 представлены рентгенографические характеристики образца SrSO4 ⋅ 0.5Н2O [I], полученного сразу после отделения от жидкой фазы; образца SrSO4 ⋅ 0.5Н2O [II], стоявшего на воздухе в течение 15 мин, и образца SrSO4 ⋅ 0.5Н2O [III], полученного в работе [1]. Видно, что образец SrSO4 ⋅ 0.5Н2O [II] содержит следы безводной ромбической модификации SrSO4. В течение 120 мин SrSO4 ⋅ 0.5Н2O полностью разрушается с потерей кристаллогидратной воды и переходит в безводную модификацию SrSO4. Фазовое превращение практически не сопровождается изменением профилей и интенсивностей дифракционных линий SrSO4 ⋅ 0.5Н2O. Параметры элементарных ячеек, представленные в табл. 1, после их уточнения методом МНК сохраняют свои значения в пределах ошибки определения 2θ = 0.015°–0.020°.
Таблица 1.
Рентгенографические характеристики SrSO4 ⋅ 0.5Н2O
| SrSO4 ⋅ 0.5Н2O [I] | SrSO4 ⋅ 0.5Н2O [II] | SrSO4 ⋅ 0.5Н2O [III] | hkl | |||
|---|---|---|---|---|---|---|
| d, Å | I/I, % | d, Å | I/I, % | d, Å | I/I, % | |
| 6.2173 | 35 | 6.2336 | 37 | 6.2510 | 30 | 100 |
| 4.5310 | 5 | 4.5477 | 5 | 4.5180 | 4 | 101 |
| 3.5929 | 64 | 3.6004 | 62 | 3.5980 | 58 | 110 |
| 3.3108 SrSO4 | 2 | |||||
| 3.1106 | 100 | 3.1168 | 100 | 3.1160 | 100 | 200 |
| 2.9850 SrSO4 | 2 | |||||
| 2.9164 | 36 | 2.9221 | 25 | 2.9160 | 36 | 102 |
| 2.4358 | 6 | 2.4375 | 7 | 2.4290 | 5 | 102 |
| 2.3546 | 11 | 2.3592 | 14 | 2.3510 | 8 | 210 |
| 2.2685 SrSO4 | 3 | |||||
| 2.2175 | 31 | 2.2217 | 36 | 2.2140 | 28 | 211 |
| 1.9795 | 11 | 1.9838 | 17 | 1.9770 | 9 | 301 |
| 1.9170 | 36 | 1.9206 | 38 | 1.9150 | 28 | 212 |
| 1.7987 | 9 | 1.8017 | 12 | 1.7980 | 10 | 220 |
| 1.7578 | 14 | 1.7615 | 16 | 1.7560 | 10 | 302 |
| 1.7269 | 17 | 1.7305 | 24 | 1.7260 | 16 | 310 |
| а = 7.194(7) Å с = 6.615(6) Å V = 296.5(5) Å3 |
а = 7.199(4) Å с = 6.618(5) Å V = 297.0(4) Å3 |
а = 7.178 Å с = 6.589 Å V = 295.0 Å3 |
||||
В связи с ограниченным временем существования SrSO4 ⋅ 0.5H2O и необходимостью поиска методов стабилизации его структуры, а также применения более высокоточного оборудования дальнейшие исследования проводили с помощью камеры-монохроматора G-670 фирмы Huber (CuKα1-излучение, шаг измерения 2θ 0.005°) и программного комплекса WinXPOW (version 2.20 2006 г.) фирмы STOE. Погрешность в определении параметров элементарных ячеек составляла не более 0.002 Å.
В качестве исследуемого образца был выбран образец твердого раствора состава K0.25La0.25Sr0.5(SO4) ⋅ ⋅ 0.5H2O, кристаллизующийся в структурном типе SrSO4 ⋅ 0.5H2O. Он был получен нами ранее при исследовании системы KLa(SO4)2 ⋅ H2O−SrSO4 ⋅ 0.5H2O [3]. В справочной литературе (ICSD) отсутствуют сведения о структуре SrSO4 ⋅ 0.5H2O вследствие ее нестабильности. Учитывая возможную изоструктурность соединений SrSO4 ⋅ 0.5Н2O и СаSO4 ⋅ 0.5Н2O, в качестве исходной модели для построения структуры K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O выбрана структура тригональной модификации СаSO4 ⋅ 0.5Н2O, параметры которой содержатся в ICSD.
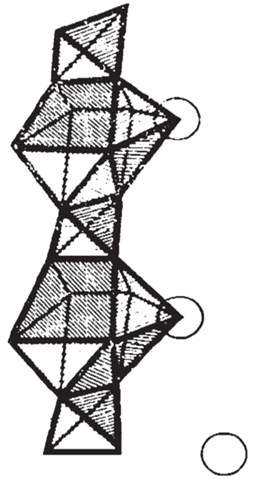
Параметры элементарной ячейки тригональной модификации СаSO4 ⋅ 0.5Н2O и ее структура определены работе [13]: пр. гр. Р3121. Структура СаSO4 ⋅ 0.5Н2O построена из бесконечных цепочек тетраэдров SO4 и девятивершинников CaO9, вытянутых в направлении параметра c элементарной ячейки (рис. 2). Один кислородный атом молекулы H2O входит в девятивершинник CaO9 и обозначен большим кружком. Остальные 8 атомов кислорода одновременно включены в соответствующие тетраэдры SO4 и девятивершинники CaO9. Цепочки полиэдров SO4 и CaO9 координируются вокруг псевдогексагональной оси 61, образуя гексагональные колодцы, в центре которых расположены кислородные атомы молекул воды. На рис. 2 показано расположение девятивершинников CaO9 и тетраэдров SO4 в структуре СаSO4 ⋅ 0.5Н2O.
На рис. 3 приведены кислородные атомы H2O, расположенные внутри псевдогексагонального колодца, отмеченные как O3. Кислородные атомы (малые кружки) O1 и O2 принадлежат тетраэдрам SO4. Тетраэдры SO4, в центре которых находится атом серы (средние по величине кружки), и полиэдр CaO9, в центре которого находится атом кальция (большие кружки), чередуются по оси с.
Рис. 3.
Расположение атомов кислорода O3 воды в структуре СаSO4 ⋅ 0.5Н2O: малые кружки – атомы кислорода, средние кружки – атомы серы, большие кружки – атомы кальция.

Внутри псевдогексагонального колодца, образованного полиэдрами CaO9, теоретически может находиться одна молекула воды, располагаясь по трем возможным позициям вокруг винтовой оси 31, что соответствует химической формуле моногидрата СаSO4 ⋅ Н2O, не существующего в природе. В нем межатомное расстояние между кислородными атомами воды составляло бы 2 Å по сравнению с теоретически возможным межатомным расстоянием О–O 2.8 Å (радиус аниона О2– 1.4 Å). Невозможность соблюдения расстояния 2 Å между атомами кислорода молекул воды приводит к 1/2 заселенности теоретически возможных позиций кислородных атомов воды с образованием полугидрата сульфата кальция СаSO4 ⋅ 0.5Н2O. При 50%-ной статистической заселенности позиций молекулами воды реализуется тригональная структура СаSO4 ⋅ 0.5Н2O. Избыточное содержание кристаллогидратной воды может приводить к удвоению параметра c и моноклинному искажению структуры полугидрата с предельным содержанием 0.67Н2O, что соответствует метастабильной моноклинной модификации СаSO4 ⋅ 0.67Н2O. На практике обычно используется тригональная модификация СаSO4 ⋅ 0.5Н2O без удвоения параметра c. Частичная заселенность позиций кислородными атомами воды в полиэдре CaO9 является причиной неустойчивости структуры СаSO4 ⋅ 0.5Н2O. При нагревании выше 180°С кристаллогидратная вода удаляется с образованием более устойчивой ромбической модификации СаSO4. Структура ромбической безводной модификации СаSO4 построена только из октаэдров CaO8 и тетраэдров SO4, в которой отсутствуют полиэдры CaO9. Наличие влаги приводит к быстрой гидратации СаSO4 ⋅ 0.5Н2O и образованию более устойчивой моноклинной структуры гипса СаSO4 ⋅ 2Н2O, что лежит в основе использования вяжущих строительных материалов.
Структура SrSO4 ⋅ 0.5H2O аналогична структуре полугидрата сульфата кальция СаSO4 ⋅ 0.5Н2O. Связь между атомом кислорода воды и Sr2+ в девятивершиннике слабее аналогичной связи в девятивершиннике CaO9 вследствие большего ионного радиуса Sr2+ (1.20 Å) по сравнению с Сa2+ (1.04 Å) [14]. Молекулы воды в псевдогексагональном колодце, образованном полиэдрами SrO9, имеют меньшую степень свободы внутри колодца. Вследствие этого устойчивость полиэдров SrO9 в структуре SrSO4 ⋅ 0.5H2O значительно ниже устойчивости полиэдров CaO9, что приводит к разрушению структуры SrSO4 ⋅ 0.5H2O с образованием безводной ромбической модификации SrSO4 как на воздухе, так и в водной среде в течение 2 ч. В отличие от фазового превращения в процессе гидратации СаSO4 ⋅ 0.5Н2O → → СаSO4 ⋅ 2Н2O, такой фазовый переход для SrSO4 ⋅ 0.5Н2O → SrSO4 ⋅ 2Н2O неизвестен ввиду отсутствия сведений о существовании SrSO4 ⋅ 2Н2O. Фазовые переходы в процессе гидратации и дегидратации СаSO4 ⋅ 0.5Н2O исследованы в работах [15, 16].
В табл. 2 приведены рентгенографические характеристики K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O и результаты индицирования рентгенограммы с достаточно высоким фактором R30 = 57.2. Уточненные параметры элементарной тригональной ячейки (пр. гр. P3121) составляют: a = 7.2083(18), c = 6.6412(14) Å, V = 298.85(14) Å3.
Таблица 2.
Рентгенографические характеристики K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O
| d, Å | 2θрасч | Δ(2θэксп – 2θрасч) | I, % | hkl |
|---|---|---|---|---|
| 6.243 | 14.176 | 0.0030 | 51.2 | 100 |
| 4.549 | 19.500 | 0.0053 | 16.1 | 101 |
| 3.604 | 24.681 | –0.0034 | 62.0 | 110 |
| 3.168 | 28.147 | 0.0564 | 2.7 | 111 |
| 3.121 | 28.575 | –0.0066 | 98.2 | 200 |
| 2.932 | 30.467 | 0.0001 | 100.0 | 102 |
| 2.825 | 31.648 | –0.0080 | 0.9 | 201 |
| 2.442 | 36.772 | –0.0041 | 15.0 | 112 |
| 2.359 | 38.109 | –0.0004 | 10.4 | 210 |
| 2.274 | 39.595 | 0.0057 | 6.1 | 202 |
| 2.223 | 40.542 | 0.0047 | 0.2 | 211 |
| 2.214 | 40.725 | 0.0251 | 9.8 | 003 |
| 2.086 | 43.332 | 0.0031 | 2.2 | 103 |
| 1.9857 | 45.651 | –0.0060 | 12.9 | 301 |
| 1.9234 | 47.218 | –0.0076 | 55.0 | 212 |
| 1.8863 | 48.203 | –0.0007 | 3.3 | 113 |
| 1.8057 | 50.503 | 0.0454 | 11.6 | 203 |
| 1.7633 | 51.808 | –0.0121 | 20.1 | 302 |
| 1.7392 | 52.579 | –0.0124 | 1.5 | 221 |
| 1.7314 | 52.834 | –0.0124 | 18.4 | 310 |
| 1.6754 | 54.745 | –0.0003 | 2.7 | 311 |
| 1.6144 | 56.997 | –0.0548 | 1.0 | 213 |
| 1.6045 | 57.381 | –0.0154 | 4.9 | 104 |
| 1.5839 | 58.200 | –0.0127 | 4.3 | 222 |
| 1.5606 | 59.152 | –0.0460 | 1.2 | 400 |
| 1.5352 | 60.232 | –0.0156 | 5.3 | 312 |
| 1.5193 | 60.931 | –0.0134 | 1.6 | 401 |
| 1.5080 | 61.436 | 0.0146 | 3.3 | 114 |
| 1.4658 | 63.404 | 0.0235 | 1.6 | 204 |
| 1.4124 | 66.100 | –0.0067 | 4.6 | 402 |
| 1.4000 | 66.765 | 0.0065 | 3.2 | 321 |
| 1.3622 | 68.869 | 0.0307 | 7.1 | 410 |
| 1.3578 | 69.125 | 0.0512 | 7.3 | 214 |
| 1.3345 | 70.513 | –0.0022 | 1.6 | 411 |
| 1.3151 | 71.713 | –0.0159 | 9.1 | 322 |
| 1.2992 | 72.729 | –0.0625 | 2.6 | 105 |
| 1.2978 | 72.817 | 0.0517 | 4.3 | 304 |
| 1.2603 | 75.352 | 0.0014 | 4.6 | 412 |
| 1.2485 | 76.191 | 0.0370 | 1.0 | 500 |
| 1.2270 | 77.773 | –0.0256 | 0.6 | 501 |
| 1.2211 | 78.225 | –0.0042 | 2.4 | 224 |
| 1.2014 | 79.759 | 0.0300 | 4.8 | 330 |
| 1.1797 | 81.527 | –0.0126 | 1.1 | 420 |
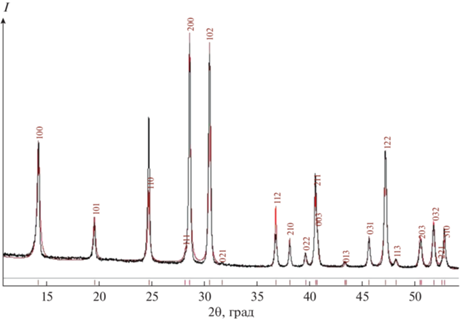
На рис. 4 показанo сравнение профилей дифракционных линий исследуемого образца состава K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O и рассчитанных теоретически по модели структуры CaSO4 ⋅ 0.5H2O (ICSD-73262, пр. гр. P3121) с учетом статистического замещения атомов Са атомами 0.25K + + 0.25La + 0.5Sr, Rp = 10.99%.
Рис. 4.
Профили дифракционных линий исследуемого образца K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O (черные линии) и рассчитанных теоретически (красные линии) по модели CaSO4 ⋅ 0.5H2O (ICSD-73262, пр. гр. P3121).
В табл. 3 приведены координаты атомов в структуре K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O с учетом статистического размещения атомов K, La и Sr по позициям атомов Ca в структуре CaSO4 ⋅ 0.5H2O (Rp = 12.43%).
Таблица 3.
Координаты атомов в структуре K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O
| Aтом | Z | Позиция | x | y | z | SDF |
|---|---|---|---|---|---|---|
| K | 19 | 3b | 0.5424 | 0.0000 | 0.8333 | 0.2500 |
| La | 57 | 0.2500 | ||||
| Sr | 38 | 0.5000 | ||||
| S | 16 | 3a | 0.5481 | 0.0000 | 0.3333 | 1.0000 |
| O1 | 8 | 6c | 0.5952 | 0.8564 | 0.4656 | 1.0000 |
| O2 | 8 | 6c | 0.3693 | 0.8731 | 0.1897 | 1.0000 |
| O3 | 8 | 3b | 0.9143 | 0.0000 | 0.8300 | 1.0000 |
Как уже отмечалось, гетеровалентное замещение атомов Sr с образованием твердых растворов в системе KLa(SO4)2 · H2O–SrSO4 · 0.5H2O [3] приводит к стабилизации их структуры на основе тригональной структуры SrSO4 · 0.5H2O. Аналогичная стабилизация структурного типа SrSO4 · 0.5H2O может иметь место и в других системах, образованных близкими по структуре соединениями. В табл. 4 приведены параметры элементарных ячеек некоторых изоструктурных соединений, которые образуют твердые растворы между собой, что может приводить, в частности, к стабилизации структур СаSO4 ⋅ 0.5H2O или SrSO4 ⋅ 0.5H2O в результате изовалентного или гетеровалентного замещения.
Таблица 4.
Параметры элементарных ячеек некоторых изоструктурных соединений, пр. гр. P3121
| Соединение | а, Å | с, Å |
|---|---|---|
| СаSO4 ⋅ 0.5H2O | 6.946 | 6.346 |
| NaCe(SO4)2 ⋅ H2O | 7.013 | 12.920 |
| KLa(SO4)2 ⋅ H2O | 7.172 | 13.296 |
| SrSO4 ⋅ 0.5H2O | 7.178 | 6.589 |
| CePO4 ⋅ 0.5H2O | 7.101 | 6.490 |
В работах [1, 2] приводятся сведения о существовании широкой области твердых растворов в системе СаSO4 ⋅ 0.5Н2O–SrSO4 ⋅ 0.5Н2O в результате изовалентного замещения ионов Sr на Ca. Такое замещение приводит к увеличению устойчивости структуры SrSO4 ⋅ 0.5Н2O за счет усиления связи молекулы воды с меньшим по размеру ионом Ca2+ по сравнению с ионом Sr2+.
Стабилизация тригональной модификации СаSO4 ⋅ 0.5Н2O может происходить в результате гетеровалентного замещения по схеме: 2Са2+ → → Na+ + Ln3+ при совместной кристаллизации их сульфатов, что объясняется близостью ионных радиусов замещаемых атомов Na+(0.98 Å), La3+(1.04 Å), Ce3+(1.02Å) и Ca2+(1.04 Å) [13]. Образование твердых растворов в бинарных системах СаSO4 ⋅ 0.5Н2O–NaLn(SO4)2 ⋅ H2O (Ln = La, Ce, Nd) отмечено в работах [17, 18] вследствие близости строения соединений СаSO4 ⋅ 0.5Н2O и NaLn(SO4)2 ⋅ H2O. Исходные образцы NaCe(SO4)2 ⋅ H2O или KLa(SO4)2 ⋅ H2O имеют удвоенный параметр элементарной ячейки по оси c по сравнению с элементарной ячейкой СаSO4 ⋅ 0.5H2O вследствие чередования катиона щелочного металла и Ln3+ по оси c. В результате этого чередования появляются сверхструктурные линии на рентгенограммах NaLa(SO4)2 ⋅ H2O и KLa(SO4)2 ⋅ H2O. Статистическое размещение катионов в структуре твердых растворов в системе СаSO4 ⋅ 0.5Н2O–NaLa(SO4)2 ⋅ H2O или в исследуемой системе SrSO4 ⋅ 0.5Н2O–KLa(SO4)2 ⋅ H2O приводит к исчезновению сверхструктурных линий на рентгенограммах. При этом сохраняется величина параметра c без его удвоения, что способствует структурной близости исследуемых твердых растворов к структуре СаSO4 ⋅ 0.5H2O или SrSO4 ⋅ 0.5Н2O.
Стабилизация тригональной модификации СаSO4 ⋅ 0.5Н2O может происходить и в результате гетеровалентного замещения в сложной бинарной системе СаSO4 ⋅ 0.5Н2O–LаPO4 ⋅ 0.5H2O c одновременным замещением по катионному и анионному каркасу изоструктурных соединений СаSO4 ⋅ 0.5Н2O и LaPO4 ⋅ 0.5H2O [19, 20]. Частичное замещение ионов Са2+ на трехзарядный ион La3+ в полиэдре СаО9 приводит к усилению связи с молекулой кристаллогидратной воды, входящей в его координационную сферу, за счет увеличения электростатического взаимодействия. Аналогично происходит усиление связи с молекулой воды и в результате гетеровалентного замещения Sr2+ на La3+.
Полученные результаты могут быть полезны при разработке технологии выделения редкоземельных элементов через образование твердых растворов на основе SrSO4 ⋅ 0.5H2O путем изовалентного и гетеровалентного замещения.
ЗАКЛЮЧЕНИЕ
При совместной кристаллизации NaCl ⋅ 2H2O и кристаллогидрата сульфата стронция SrSO4 ⋅ 0.5H2O при температуре ниже 0°C образуется сложный кристаллический комплекс, имеющий индивидуальную кристаллическую структуру. Удаление дигидрата хлорида натрия в процессе плавления выше 0°C позволяет получить достаточно крупные кристаллы (0.5–1.0 мм) тригональной модификации SrSO4 ⋅ 0.5H2O со структурой, аналогичной структуре СаSO4 ⋅ 0.5Н2O.
Рассмотрена структура тригональной модификации SrSO4 ⋅ 0.5H2O, которая относится к пр. гр. P3121. Кристаллогидратная вода входит в координационную сферу полиэдра SrO9 и слабо удерживается в ней. Полное разрушение структуры чистой фазы SrSO4 ⋅ 0.5H2O завершается через 2 ч.
Предложены способы стабилизации SrSO4 ⋅ ⋅ 0.5H2O на основе изовалентного замещения ионов стронция по схеме: Sr2+ → Ca2+ и гетеровалентного замещения ионов стронция по схеме: 2Sr2+ → K+ + La3+.
В отличие от нестабильной тригональной модификации SrSO4 ⋅ 0.5H2O, время существования которой ограничено 2 ч, стабилизированная модификация в виде K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O устойчива в течение неограниченного времени. Уточнены параметры элементарной ячейки и выполнено индицирование линий рентгенограммы K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O (R30 = 57.2). Предложена модель структуры SrSO4 ⋅ 0.5H2O на примере соединения K0.25La0.25Sr0.5(SO4) ⋅ 0.5H2O (Rp = = 10.52) со статистическим размещением ионов калия, лантана и стронция по позициям атомов кальция в известной тригональной структуре СаSO4 ⋅ 0.5H2O.
Список литературы
Satoshi Takahashi, Masanobu Seki, Katsumi Setoyama // Bull. Chem. Soc. Jpn. 1993. V. 66. P. 2219. https://doi.org/10.1246/bcsj.66.2219
Бушуев Н.Н., Набиев А.Г. // Журн. неорган. химии. 1988. Т. 33. № 11. С. 2962.
Бушуев Н.Н., Тюльбенджян Г.С., Великодный Ю.А. // Журн. неорган. химии. 2021. Т. 66. № 3. С. 382. https://doi.org/10.31857/S0044457X21030041
Carlos M. Pina, Alvaro Tamayo // Geochim. Cosmochim. Acta. 2012. V. 92. Р. 220. Материалы 17-й Всерос. конф. “Современные проблемы дистанционного зондирования Земли из космоса”. М.: ИКИ РАН, С. 248. https://doi.org/10.1016/j.gca.2012.06.018
Akinfiev N.N., Mironenko M.V., Grant S.A. // J. Solution Chem. 2001. V. 30. № 12. P. 1065. https://doi.org/10.1023/A:1014445917207
Craig J.R., Light J.F., Parker B.C. et al. // Antarctic J. 1975. V. 10. № 4. P. 178.
Chen N., Morikawa J., Hashimoto T. // Thermochim. Acta. 2005. V. 431. № 1–2. P. 106. https://doi.org/10.1016/j.tca.2005.01.050
Степанов К.А., Дмитриевский Б.А. // Изв. СПбГТИ(ТУ). 2012. Т. 40. № 14. С. 32.
Бордонский Г.С., Гурулев А.А., Крылов С.Д. // Материалы 17-й Всерос. конф. “Современные проблемы дистанционного зондирования Земли из космоса”. М.: ИКИ РАН, 2010. С. 248.
Шиманов А.А., Комаров И.А. // Инженерная геология. 2019. Т. 14. № 3. С. 68. https://doi.org/10.25296/1993-5056-2019-14-3-68-76
Черкасов Д.Г., Данилина В.В., Ильин К.К. // Журн. неорган. химии. 2021. Т. 66. № 6. С. 785. https://doi.org/10.31857/S0044457X21060076
Yaghoob Farnam, Dale Bentz, Aaron Sakulich et al. // Adv. Eng. Mater. 2014. V. 3. № 1. P. 23. https://doi.org/10.1520/ACEM20130095
Бушуев Н.Н. // Журн. неорган. химии. 1982. Т. 27. № 3. С. 609.
Shannon R.D., Prewitt C.T. // Acta Crystallogr., Sect. B. 1969. V. 25. P. 925. https://doi.org/10.1107/S0567740869003220
Бушуев Н.Н., Борисов В.М. // Журн. неорган. химии. 1982. Т. 27. № 3. С. 604.
Бушуев Н.Н., Масленников Б.М., Борисов В.М. // Журн. неорган. химии. 1983. Т. 28. № 10. С. 2469.
Бушуев Н.Н., Набиев А.Г., Петропавловский И.А. и др. // Журн. прикл. химии. 1988. Т. 61. № 10. С. 2153.
Ove Lindgren // Acta Chem. Scand. 1977. V. 1. P. 591. https://doi.org/10.3891/acta.chem.scand.31a-0591
Зинин Д.С., Бушуев Н.Н. // Журн. прикл. химии. 2017. Т. 90. № 3. С. 266.
Бушуев Н.Н., Колесников В.А. // Хим. технология. 2022. Т. 23. № 3. С. 98. https://doi.org/10.31044/1684-5811-2022-23-3-98-104
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии