Расплавы, 2021, № 5, стр. 502-514
Активность оксидов алюминия и кальция в расплавах CaO–Al2O3 и CaO–SiO2–Al2O3
В. Н. Невидимов a, Ю. М. Дурина a, С. А. Красиков b, *, Е. М. Жилина b, А. С. Быков b
a Уральский федеральный университет им. Первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
b Институт металлургии УрО РАН
Екатеринбург, Россия
* E-mail: sankr@mail.ru
Поступила в редакцию 20.05.2021
После доработки 08.06.2021
Принята к публикации 16.06.2021
Аннотация
Выполнены расчеты термодинамической активности оксидов алюминия и кальция в системах CaO–Al2O3 и CaO–SiO2–Al2O3 с использованием представлений полимерной модели оксидных расплавов, учитывающей переменную функциональность мономера. При проведении расчетов по уравнениям полимерной теории находили константы полимеризации в бинарных оксидных системах “оксид модификатора–оксид комплексообразователя”. Активность оксида алюминия рассматривали как “эффективную”, которая определялась с учетом доли алюминия, расположенного в тетраэдрических полостях между четырьмя ионами кислорода и, соответственно, образующего анионы ${\text{AlO}}_{4}^{{5 - }}$, и в октаэдрических полостях между шестью ионами кислорода с присутствуем в расплаве в виде катиона Al3+, выполняющего функцию модификатора. В расчетах активности оксидов алюминия и кальция в системе CaO–Al2O3 предполагалось, что алюминий при мольной доле X оксида кальция менее 0.7 присутствует в четверной координации и проявляет кислотные свойства. При больших содержаниях CaO алюминий проявляет как кислотные, так и основные свойства. В шлаках CaO–SiO2–Al2O3 согласование расчетных и экспериментальных значений активности компонентов достигалось за счет варьирования доли алюминия в четверной и шестерной координации по отношению к кислороду. Установлено, что зависимость активности оксида алюминия от мольной доли диоксида кремния носит экстремальный характер с максимумом при ${{X}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}$ = 0.3. Выявленная тенденция объясняется тем, что с увеличением доли диоксида кремния до 0.3 растет количество Al3+, обладающего большими степенями свободы и характеризующего проявление основных свойств, и уменьшается присутствие алюминия в четверной координации, что влияет на проявление кислотных свойств. С повышением мольной доли SiO2 более 0.3 алюминий в большей степени получает возможность формировать свои обособленные комплексы ${\text{AlO}}_{4}^{{5 - }}$ и, соответственно, снижается активность алюминия из-за повышения его связанности с атомами кислорода и опять преобладают кислотные свойства Al2O3.
ВВЕДЕНИЕ
Оксидные расплавы играют важную роль шлаков в пирометаллургических процессах производства металлов и сплавов. Качество выплавляемого металла зависит от физико-химических свойств наводимого шлака. Термодинамические свойства оксидного расплава контролируют процессы десульфурации, дефосфорации, рафинирования стали и сплавов. Одним из таких свойств является термодинамическая активность компонентов. Наиболее распространенными металлургическими шлаками являются оксидные системы на основе оксидов кальция, кремния и алюминия.
Физико-химические свойства расплавов системы CaO–SiO2–Al2O3 определяются их составом, а, следовательно, и их композиционно-зависимой структурой. Часто при описании структуры и свойств используются различные термодинамические модели упорядоченных растворов, фазовые диаграммы состояния [1–6]. Однако недостатком этого подхода является большое количество задействованных модельных параметров. Более того, по диаграммам состояния трудно оценить структурные особенности жидкого состояния.
Имеющиеся экспериментальные данные свидетельствуют о наличии в силикатных расплавах устойчивых структурных единиц – кремнекислородных тетраэдров SiO4 [7–10]. Авторы [9] допускают существование либо простых, либо более сложных образований кремний-кислород в пределе блоков SiO2.
Большую информацию о структуре силикатов дают их колебательные спектры. Raman-спектроскопия стеклообразных силикатов обнаруживает присутствие лишь нескольких структурных единиц с 4, 3, 2, 1 и 0 концевыми атомами кислорода на один атом кремния [11].
Применение аналитического метода триметилсилилирования анионов с последующей идентификацией их триметилсилиловых производных методом газовой хроматографии показало [12], что в силикатных стеклах помимо простых кремнекислородных анионов присутствуют трудновыявляемые сложные образования. Их концентрация сильно возрастает с увеличением содержания SiO2. Эти экспериментальные данные подтверждены методом бумажной хроматографии [13].
Таким образом, имеющиеся в настоящее время экспериментальные данные свидетельствуют о наличии в силикатных расплавах наряду со сложными кремнекислородными образованиями простейших силикатных анионов: мономеров, коротких линейных цепочек, плоских колец. В кристаллических, стеклообразных и в жидких силикатах не обнаружено изомерных форм анионов, например, разветвленных цепочек.
Существующие в настоящее время полимерные модели силикатных расплавов позволяют получить уравнения для расчета основных структурных характеристик жидкой фазы. Однако, результирующие уравнения либо применимы в ограниченном интервале составов, либо требуют очень трудоемких вычислений. Это связано со сложностью учета всех возможных форм комплексных анионов [14, 15]. Такие доводы указывают на необходимость дальнейшего развития полимерной модели силикатных расплавов, учитывающей переменную функциональность мономера [16]. Весьма перспективным представляется рассмотрение сравнительно малоизученного поведения оксида алюминия в шлаковых расплавах.
Известно, что Al2O3 является амфотерным оксидом [17, 18] и поэтому в оксидных расплавах алюминий может находиться как в четверной, так и в шестерной координации по кислороду [18–27].
В случае четверной координации катионы алюминия занимают тетраэдрические полости между четырьмя ионами кислорода и образуют алюмокислородные тетраэдры, которые по сравнению с кремнекислородными имеют лишний отрицательный заряд. Этот избыточный заряд равномерно распределен по объему тетраэдра. Алюминий проявляет кислотные свойства, что позволяет рассматривать Al2O3 как кислый оксид.
В случае шестерной координации алюминий занимает октаэдрические полости между шестью ионами кислорода и присутствует в расплаве в виде катиона Al3+, т.е. является модификатором. Здесь Al проявляет основные свойства, а оксид алюминия можно рассматривать как основной оксид.
В настоящей работе предпринята попытка описания термодинамической активности оксидов алюминия и кальция в системах CaO–Al2O3 и CaO–SiO2–Al2O3 с помощью представлений полимерной модели оксидных расплавов, учитывающей переменную функциональность мономера [28–30].
ПОДРОБНОСТИ МОДЕЛИРОВАНИЯ
Вплоть до настоящего времени имеющиеся в литературе данные об активности оксида алюминия в системах CaO–Al2O3 и CaO–SiO2–Al2O3 [21, 30] были ограниченными и не учитывали амфотерность алюминия. В настоящей работе мы предприняли попытку устранить этот недостаток.
В рамках полимерной модели были получены уравнения, позволяющие сравнительно просто рассчитывать основные структурные характеристики алюмосиликатных расплавов и активности компонентов во всем диапазоне составов жидкой фазы. В частности, оказалось возможным рассчитывать активность оксида алюминия, принимая, что алюминий находится только в четверной или шестерной координации по отношению к кислороду. Например, расчет активности оксида алюминия в системе CaO–SiO2–Al2O3 при четверной координации металла можно выполнить по уравнениям [19]:
Для определения активности оксида алюминия в системе CaO–SiO2–Al2O3 при шестерной координации Al можно применить соотношение [20]:
Константу полимеризации ${{\bar {K}}_{p}}$ рассчитывали по уравнению:
(1)
${{\bar {K}}_{p}} = \frac{{\alpha \cdot \left( {1 - 3 \cdot {{X}_{{SA}}} + 2 \cdot \alpha \cdot {{X}_{{SA}}}} \right)}}{{\left( {1 - \sum\limits_{q{\kern 1pt} = {\kern 1pt} 1}^k {{{X}_{q}}} } \right) \cdot {{{\left( {1 - \alpha } \right)}}^{2}}}},$Для определения α уравнение (1) приводили к виду:
где $A = {{X}_{{SA}}} \cdot {{\bar {K}}_{p}} - 2 \cdot {{X}_{{SA}}}$, $B = 3 \cdot {{X}_{{SA}}} - 2 \cdot {{X}_{{SA}}} \cdot {{\bar {K}}_{p}} - 1$, $C = {{X}_{{SA}}} \cdot {{\bar {K}}_{p}}$.Уравнение для нахождения ионной доли “свободного кислорода” ${{X}_{{{{{\text{O}}}^{{2 - }}}}}}$ имеет вид:
Для системы CaO–SiO2–Al2O3 среднелогарифмическую константу полимеризации можно выразить как
Расчет активностей компонентов по уравнениям полимерной модели предполагает использование констант полимеризации в бинарных оксидных системах “оксид–модификатор–оксид-комплексообразователь”. Однако, величины Kp в бинарных системах CaO–Al2O3 и Al2O3–SiO2 неизвестны.
Константу полимеризации в бинарной системе CaO–Al2O3 устанавливали по известным экспериментальным данным об активностях Al2O3 и CaO в данной системе [30].
Экспериментальные данные об активностях в системе Al2O3–SiO2, где алюминий проявляет основные свойства, отсутствуют. Поэтому в работе использован подход, учитывающий взаимосвязь электроотрицательности x и оптической основности λ компонентов. Первая из них количественно характеризует силу притяжения электронов и, соответственно, степень ионности ковалентной связи, а вторая определяет отношение атомов кислорода, находящихся в кремнекислородных тетраэдрах, к атомам кислорода, не входящим в эти образования.
В табл. 1 содержатся данные об электроотрицательностях х [31] и оптических основностях λ, которые связаны между собой уравнением:
Таблица 1.
Исходные данные для расчета констант полимеризации (Me = Ca, Mg, Al, Mn)
| Оксид Me | x [31] | λ | MeO–SiO2 | MeO–Al2O3 | ||
|---|---|---|---|---|---|---|
| Kp | ln Kp | Kp | ln Kp | |||
| CaO | 1.0 | 0.99 | 0.0016 | –6.44 | 0.11 | –4.82 |
| MgO | 1.2 | 0.78 | 0.025 | –3.69 | 0.055 | –2.90 |
| Al2O3 | 1.5 | 0.59 | 0.19 | –1.66 | 0.3 | –1.20 |
| MnO | 1.5 | 0.59 | 0.19 | –1.66 | 0.3 | –1.20 |
Константу полимеризации системы Al2O3–SiO2 определяли по известной оптической основности Mn (табл. 1). Принимая во внимание равенство величин электроотрицательностей алюминия и марганца, допустили возможность равных значений констант полимеризации ${{K}_{{p\left( {{\text{MnO}} - {\text{Si}}{{{\text{O}}}_{2}}} \right)}}}$ = ${{K}_{{p\left( {{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}} - {\text{Si}}{{{\text{O}}}_{2}}} \right)}}}$ = 0.19.
Для определения активности алюминия в системе CaO–SiO2–Al2O3, где алюминий может проявлять как основные, так и кислотные свойства, предложена так называемая “эффективная” активность. Величина “эффективной” активности выражается как сумма двух членов, относящихся соответственно к четверной и шестерной координации алюминия. Каждое слагаемое является произведением двух величин – активности и мольной доли алюминия – взятых для указанных координаций:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Активности оксидов в бинарной системе CaO–Al2O3 (рис. 1) рассчитывали для составов, представленных в табл. 2. Было установлено, что расчетные величины активностей равны их экспериментальным значениям при ${{K}_{{p\left( {{\text{CaO}} - {\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}} \right)}}}$ = 0.11. Для составов № 1–4 допускали, что Al проявляет кислотные свойства. При рассмотрении состава № 5 сделали предположение, что после увеличения содержания оксида кальция до ${{X}_{{{\text{CaO}}}}}$ = 0.7 алюминий начинает проявлять как основные, так и кислотные свойства. Полученные нами данные не входят в существенное противоречие с результатами других авторов [30]. Как видно из табл. 3 и рис. 1, различие значений по активностям оксидов кальция и алюминия составляют 20–70%.
Рис. 1.
Зависимости активности компонентов системы Al2O3–CaO от XCaO при температуре 1550°C. * – Величины одних и тех же параметров, полученные разными авторами и собранные вместе в справочнике [30] в целях сравнения.

Таблица 2.
Составы шлака и мольные доли ионов в системе CaO–Al2O3 при 1550°C
| № состава | ${{X}_{{{\text{CaO}}}}}$ | ${{X}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ | ${{X}_{{{\text{A}}{{{\text{l}}}^{{3 + }}}}}}$ | ${{X}_{{{\text{AlO}}_{4}^{{5 - }}}}}$ |
|---|---|---|---|---|
| 1 | 0.50 | 0.50 | 0.00 | 0.50 |
| 2 | 0.55 | 0.45 | 0.00 | 0.45 |
| 3 | 0.60 | 0.40 | 0.00 | 0.40 |
| 4 | 0.65 | 0.35 | 0.00 | 0.35 |
| 5 | 0.70 | 0.30 | 0.10 | 0.20 |
Таблица 3.
Активности компонентов оксидной системы Al2O3–CaO при 1550°C
| № состава | ${{a}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ | ${{a}_{{{\text{CaO}}}}}$ | ${{a}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ [30]* | ${{a}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ [30]* | ${{a}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}~$ [30]* | ${{a}_{{{\text{CaO}}}}}$ [30]* | ${{a}_{{{\text{CaO}}}}}$ [30]* | ${{a}_{{{\text{CaO}}}}}$ [30]* |
|---|---|---|---|---|---|---|---|---|
| 1 | 0.45 | 0.09 | 0.48 | – | – | 0.08 | – | – |
| 2 | 0.29 | 0.13 | 0.22 | – | 0.78 | 0.15 | 0.10 | – |
| 3 | 0.17 | 0.18 | 0.12 | 0.10 | 0.47 | 0.25 | 0.20 | 0.14 |
| 4 | 0.08 | 0.28 | 0.06 | 0.02 | 0.27 | 0.44 | 0.40 | 0.33 |
| 5 | 0.003 | 0.77 | 0.02 | – | 0.15 | 0.90 | 0.86 | 0.76 |
* Величины одних и тех же параметров, полученные разными авторами и собранные вместе в справочнике [30] в целях сравнения.
По данным [30] выбраны составы расплавов системы CaO–SiO2–Al2O3. Они перечислены в табл. 4 и 5.
Таблица 4.
Составы шлака и активность SiO2 в системе CaO–SiO2–Al2O3 при 1600°C
| № состава | ${{X}_{{{\text{CaO}}}}}$ | ${{X}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}$ | ${{X}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ | ${{X}_{{{\text{A}}{{{\text{l}}}^{{3 + }}}}}}$ | ${{X}_{{{\text{AlO}}_{4}^{{5 - }}}}}$ | ${{X}_{{{{{\text{O}}}^{{2 - }}}}}}$ | ${{a}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}$ | ${{a}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}$ [30] |
|---|---|---|---|---|---|---|---|---|
| 1 | 0.30 | 0.47 | 0.23 | 0.23 | 0.00 | 0.01589 | 0.29 | 0.20 |
| 2 | 0.33 | 0.42 | 0.25 | 0.25 | 0.00 | 0.02612 | 0.14 | 0.10 |
| 3 | 0.36 | 0.37 | 0.27 | 0.26 | 0.01 | 0.04148 | 0.05 | 0.05 |
| 4 | 0.39 | 0.33 | 0.28 | 0.23 | 0.05 | 0.02781 | 0.05 | 0.05 |
| 5 | 0.40 | 0.31 | 0.29 | 0.24 | 0.05 | 0.04382 | 0.02 | 0.02 |
| 6 | 0.43 | 0.27 | 0.30 | 0.22 | 0.08 | 0.04929 | 0.01 | 0.01 |
| 7 | 0.46 | 0.22 | 0.32 | 0.20 | 0.12 | 0.06517 | 0.04 · 10–1 | 0.05 · 10–1 |
| 8 | 0.47 | 0.20 | 0.33 | 0.18 | 0.15 | 0.04316 | 0.07 · 10–1 | 0.05 · 10–1 |
| 9 | 0.50 | 0.16 | 0.34 | 0.16 | 0.18 | 0.06842 | 0.02 · 10–1 | 0.02 · 10–1 |
| 10 | 0.52 | 0.12 | 0.36 | 0.15 | 0.21 | 0.10953 | 0.07 · 10–2 | 0.05 · 10–2 |
| 11 | 0.53 | 0.11 | 0.36 | 0.13 | 0.23 | 0.08245 | 0.01 · 10–2 | 0.01 · 10–1 |
| 12 | 0.55 | 0.08 | 0.37 | 0.12 | 0.25 | 0.12865 | 0.04 · 10–2 | 0.03 · 10–2 |
| 13 | 0.56 | 0.06 | 0.38 | 0.12 | 0.26 | 0.17779 | 0.02 · 10–2 | 0.01 · 10–2 |
Таблица 5.
Составы шлака и активность CaO и Al2O3 в системе CaO–SiO2–Al2O3 с низкой (<0.3) мольной долей Al2O3 при 1600°С
| № состава | ${{X}_{{{\text{CaO}}}}}$ | ${{X}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}$ | ${{X}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ | ${{X}_{{{\text{A}}{{{\text{l}}}^{{3 + }}}}}}$ | ${{X}_{{{\text{AlO}}_{4}^{{5 - }}}}}$ | ${{X}_{{{{{\text{O}}}^{{2 - }}}}}}$ | ${{a}_{{{\text{CaO}}}}}$ | ${{a}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ | ${{a}_{{{\text{CaO}}}}}$ [30] | ${{a}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ [30] |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 0.06 | 0.86 | 0.08 | 0.06 | 0.02 | 0.00115 | 0.04 ⋅ 10–2 | 0.07 ⋅ 10–1 | 0.05 ⋅ 10–2 | 0.01 |
| 2 | 0.21 | 0.72 | 0.07 | 0.06 | 0.01 | 0.00105 | 0.06 ⋅ 10–2 | 0.07 ⋅ 10–1 | 0.01 ⋅ 10–1 | 0.001 |
| 3 | 0.19 | 0.62 | 0.19 | 0.00 | 0.19 | 0.00057 | 0.06 ⋅ 10–2 | 0.30 | 0.05 ⋅ 10–2 | 0.40 |
| 4 | 0.28 | 0.60 | 0.12 | 0.12 | 0.00 | 0.00333 | 0.16 ⋅ 10–2 | 0.02 | 0.02 ⋅ 10–1 | 0.03 |
| 5 | 0.40 | 0.50 | 0.10 | 0.09 | 0.01 | 0.00360 | 0.02 ⋅ 10–1 | 0.02 | 0.01 | 0.01 |
| 6 | 0.35 | 0.43 | 0.22 | 0.19 | 0.03 | 0.01050 | 0.56 ⋅ 10–2 | 0.03 | 0.05 ⋅ 10–1 | 0.40 |
| 7 | 0.45 | 0.39 | 0.16 | 0.14 | 0.02 | 0.01235 | 0.08 ⋅ 10–1 | 0.05 | 0.02 | 0.05 |
| 8 | 0.47 | 0.29 | 0.24 | 0.19 | 0.05 | 0.07314 | 0.54 ⋅ 10–1 | 0.10 | 0.03 | 0.20 |
| 9 | 0.60 | 0.15 | 0.25 | 0.15 | 0.10 | 0.50404 | 0.40 | 0.55 ⋅ 10–1 | 0.30 | 0.05 |
| 10 | 0.60 | 0.14 | 0.26 | 0.00 | 0.26 | 0.06216 | 0.06 | 0.20 | 0.08 | 0.40 |
При рассмотрении активностей в тройной системе CaO–SiO2–Al2O3 изменяли долю Al2O3 с алюминием, находящимся как в четверной, так и в шестерной координации. Как видно из табл. 4 и 5, имеется удовлетворительное согласие полученных нами значений активностей оксидов кремния, кальция и алюминия с данными [30].
Из реакции образования ортоалюминатного аниона
следует, что увеличение содержания ионов свободного кислорода в шлаке должно приводить к смещению равновесия в сторону ортоалюминатного аниона. В то же время, согласно данным табл. 4 и рис. 2, с увеличением ионной доли “свободного” кислорода увеличивается доля алюминия в тетраэдрической координации и уменьшается доля алюминия в октаэдрической координации. Это свидетельствует о допустимости такого предположения и соответствии подобранных долей алюминия равновесию из уравнения (2).Рис. 2.
Зависимости ${{X}_{{{\text{A}}{{{\text{l}}}^{{3 + }}}}}}$ и ${{X}_{{{\text{AlO}}_{4}^{{5 - }}}}}$ от ${{X}_{{{{{\text{O}}}^{{2 - }}}}}}$ в системе CaO–SiO2–Al2O3 при 1600°C. Сплошные линии – аппроксимация светлых и темных точек с помощью логарифмического закона для выявления общих тенденций.
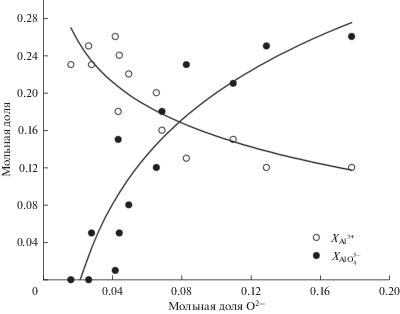
В рассмотренных выше данных при расчете активностей оксидов кальция и алюминия для системы CaO–SiO2–Al2O3 мольная доля оксида алюминия не превышала 0.26 (рис. 2). Для установления применимости предложенного подхода (допускающего сосуществование алюминия в четверной и шестерной координации для оксидной системы с повышенным содержанием оксида алюминия) рассмотрены составы алюмо-кальций-силикатных расплавов с изменением мольной доли оксида алюминия в интервале 0.29–0.48.
Как видно из табл. 6, рис. 3 и 4, результаты расчета активностей оксидов кальция и алюминия для составов системы CaO–SiO2–Al2O3, где ${{X}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}} > 0.3$, удовлетворительно согласуются с данными [21] при допущении о том, что 70–80 мас. % от общего количества алюминия находятся в четверной координации. Этот результат в принципе не противоречит работе [22], авторы которой отмечают, что в шлаках с содержанием Al2O3 более 30 мас. % оксид алюминия ведет себя как кислотный оксид при любой соотношении CaO, SiO2 и Al2O3.
Таблица 6.
Составы шлака и активность CaO и Al2O3 в системе CaO–SiO2–Al2O3 с высокой (≥0.29) мольной долей Al2O3 при 1600°С
| № состава | ${{X}_{{{\text{CaO}}}}}$ | ${{X}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}$ | ${{X}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ | ${{X}_{{{\text{A}}{{{\text{l}}}^{{3 + }}}}}}$ | ${{X}_{{{\text{AlO}}_{4}^{{5 - }}}}}$ | ${{X}_{{{{{\text{O}}}^{{2 - }}}}}}$ | ${{a}_{{{\text{CaO}}}}}$ | ${{a}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ | ${{a}_{{{\text{CaO}}}}}$ [21] | ${{a}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ [21] |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 0.52 | 0.00 | 0.48 | 0.13 | 0.35 | 0.06802 | 0.23 | 0.01 | 0.36 | 0.058 |
| 2 | 0.49 | 0.05 | 0.46 | 0.16 | 0.30 | 0.04459 | 0.15 | 0.06 | 0.25 | 0.08 |
| 3 | 0.46 | 0.10 | 0.44 | 0.11 | 0.33 | 0.01449 | 0.03 | 0.10 | 0.21 | 0.11 |
| 4 | 0.44 | 0.15 | 0.41 | 0.10 | 0.31 | 0.01037 | 0.02 | 0.15 | 0.15 | 0.15 |
| 5 | 0.41 | 0.20 | 0.39 | 0.09 | 0.30 | 0.00706 | 0.01 | 0.22 | 0.08 | 0.23 |
| 6 | 0.39 | 0.25 | 0.36 | 0.07 | 0.29 | 0.00560 | 0.01 | 0.31 | 0.03 | 0.30 |
| 7 | 0.36 | 0.30 | 0.34 | 0.06 | 0.28 | 0.00409 | 0.005 | 0.36 | 0.015 | 0.35 |
| 8 | 0.34 | 0.35 | 0.32 | 0.06 | 0.26 | 0.00265 | 0.003 | 0.35 | 0.012 | 0.33 |
| 9 | 0.31 | 0.40 | 0.29 | 0.06 | 0.23 | 0.00238 | 0.003 | 0.30 | 0.01 | 0.29 |
Рис. 3.
Зависимость активности CaO от мольной доли SiO2 в системе CaO–SiO2–Al2O3 с отношением ${{X}_{{{\text{CaO}}}}}$/${{X}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ = 1.04–1.08 при 1600°C.

Рис. 4.
Зависимость активности Al2O3 от мольной доли SiO2 в системе CaO–SiO2–Al2O3 с отношением ${{X}_{{{\text{CaO}}}}}$/${{X}_{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}}$ = 1.04–1.08 при 1600°C.

Зависимость активности оксида алюминия от мольной доли оксида кремния (рис. 4) является экстремальной с максимумом при ${{X}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}$ = 0.3. Наличие максимума можно объяснить тем фактом, что активность Al2O3, как и любого оксида, определяется одновременно величинами коэффициента активности и мольной доли. По-видимому, при росте мольной доли оксида кремния до 0.3 определяющим факторов является рост коэффициента активности Al2O3 вследствие возможности протекания реакции [32]
ЗАКЛЮЧЕНИЕ
С использованием представлений полимерной модели, учитывающей переменное координационное состояние алюминия, выполнен расчет активностей оксидов алюминия и кальция в системах CaO–Al2O3 и CaO–SiO2–Al2O3. Найденные данные по величинам активности удовлетворительно согласуются с известной литературной информацией. Полученные результаты подтверждают применимость описанной модели для оценки термодинамической активности оксидов алюминия и кальция.
Работа выполнена по государственному заданию для Института металлургии УрО РАН и Уральского федерального университета.
Список литературы
Jak E., Degterov S., Hayes P.C., Pelton A.D. // Fuel. 1998. 77. P. 77–84. https://doi.org/10.1016/S0016-2361(97)00137-3
Kim W.-Y., Yang X., Yan L., Pelton A.D., Decterov S.A. // Calphad. 2011. 35. P. 542–550. https://doi.org/10.1016/j.calphad.2011.09.005
Eriksson G., Wu P., Pelton A.D. // Calphad. 1993. 17. P. 189–205. https://doi.org/10.1016/0364-5916(93)90019-8
Kang Y.-B., Pelton A.D., Lee H.-G. // Calphad. 2015. 51. P. 346–347. https://doi.org/10.1016/j.calphad.2015.01.012
Jung I.-H., Decterov S.A. Pelton A.D. Critical thermodynamic evaluation and optimization of the CaO–MgO–SiO2 system. // J. Eur. Ceram. Soc. 2005. 25. P. 313–333. https://doi.org/10.1016/j.jeurceramsoc.2004.02.012
Blander M., Pelton A.D. // Geochim. Cosmochim. Acta. 1987. 51. P. 85–95. https://doi.org/10.1016/0016-7037(87)90009-3
Ватолин Н.А., Пастухов Э.А. Дифракционные исследования строения высокотемпературных расплавов. М.: Наука, 1980.
Waseda Y. The Structure of Non-Crystalline Materials: Liquids and Amorphous Solids. New-York: McGraw-Hill International book Co., 1980.
Сокольский В.Э., Казимиров В.П., Баталин Г.И. и др. Некоторые закономерности строения расплавов бинарных силикатных систем, составляющих основу сварочных шлаков // Изв. вузов. Черная металлургия. 1986. 3. С. 4–9.
Takagi Y., Ohno H., Igarashi K., Toratani H., Nakamura T., Furukawa K., Mochinaga J., Izumitani T. // Trans. Jpn. Inst. Met. 1985. 26. P. 451–461. https://doi.org/10.2320/matertrans1960.26.451
Mysen B.O., Finger L.W., Virgo D., Seifert F.A. Curve-fitting of Raman spectra of amorphous materials // Am. Mineral. 1982. 67. P. 686–695.
Smart R.M., Glasser F.P. Silicate anion constitution of lead silicate glasses and crystals // Phys. Chem. Glasses. 1978. 19. № 5. P. 95–102.
Wieker W., Hoebbel D., Götz J. Die anionenverteilung in silikatgläsern und ihre bedeutung für die glasbildung // Wiss. Z. Friedrich-Schiller-Univ. Jena, Math.-nat.wiss. Reihe. 1979. 28. P. 277–285.
Заломов Н.И., Бороненков В.Н., Шалимов М.П. Расчет ионного состава и активностей компонентов в расплавах CaO–Al2O3 на основе полимерной теории // Расплавы. 1992. № 1. С. 49–55.
Zalomov N.I., Boronenkov V.N., Zinigrad M.I., Shanchurov S.M. // Glass Phys. Chem., 2007. 33. P. 455–458. https://doi.org/10.1134/S1087659607050033
Новиков В.K. Развитие полимерной модели силикатных расплавов // Расплавы. 1987. № 6. С. 21–33.
Новиков В.К., Невидимов В.Н. Полимерная природа расплавленных шлаков. Екатеринбург: ГОУ ВПО УГТУ–УПИ, 2006.
Истомин С.А., Пастухов Э.А., Денисов В.М. Физико-химические свойства оксидно-фторидных расплавов. Екатеринбург: УрО РАН, 2009.
Невидимов В.Н. Расчет активности оксида алюминия в алюмосиликатных расплавах // В сб.: Инновации в материаловедении и металлургии: материалы I международной интерактивной научно-практической конференции. Екатеринбург. 2012. С. 200–203.
Новиков В.К., Невидимов В.Н., Топорищев Г.А. Сравнение моделей шлаковых расплавов на примере расчета активности оксидов в многокомпонентной алюмосиликатной системе // Расплавы. 1991. № 1. С. 3–9.
Koroušič B. Predicting oxide activities in CaO–Al2O3–SiO2 system by computer model // Kov. Zlit. Tehnol. 1993. 27. P. 313–318.
Некрасов И.В., Шешуков О.Ю., Егиазарьян Д.К., Михеенков М.А. О координации катионов алюминия в оксидных расплавах // В сб.: Строение и свойства металлических и шлаковых расплавов: труды XIV Российской конференции. Екатеринбург: УрО РАН. 2015. С. 200.
Han S.-M., Park J.-G., Sohn I. // J. of Non-Cryst. Solids. 2011. 357. P. 2868–2875. https://doi.org/10.1016/j.jnoncrysol.2011.03.023
Wallenberger F.T., Hicks R.J., Bierhals A.T. // J. Non-Cryst. Solids. 2004. 349. P. 377–387. https://doi.org/10.1016/j.jnoncrysol.2004.08.215
Rajavaram R., Kim H., Park J., Lee C.-H., Cho W.-S., Lee J. // Ceram. Int. 2019. 45. P. 19 409–19 414. https://doi.org/10.1016/j.ceramint.2019.06.194
Wang Z., Wen G., Liu Q., Huang S., Tang P., Yu L. // J. of Non-Cryst. Solids. 2020. 531. P. 119851. https://doi.org/10.1016/j.jnoncrysol.2019.119851
Yu Z.-G., Leng H.-Y., Wang L.-J., Chou K.-C. // Ceram. Int. 2019. 45. P. 7180–7187. https://doi.org/10.1016/j.ceramint.2018.12.225
Zhilina E.M., Krasikov S.A., Agafonov S.N. // Russian Metallurgy. 2016. № 7. P. 752–755. https://doi.org/10.1134/S0036029516080140
Zhilina E.M., Krasikov S.A. // Russian Metallurgy. 2017. № 6. P. 642–643. https://doi.org/10.1134/S0036029517080146
Атлас шлаков. Справочное издание. М.: Металлургия, 1985.
Полинг Л. Общая химия. М.: Мир, 1974.
Roine A. Outokumpu HSC Chemistry for Windows. Chemical Reaction and Equilibrium Software with Extensive Thermochemical Database. Pori: Outokumpu Research OY, 2006.
Дополнительные материалы отсутствуют.


