Успехи современной биологии, 2022, T. 142, № 5, стр. 518-529
Генетическая дифференциация популяций кедрового стланика, Pinus pumila (Pall.) Regel, Тихоокеанского региона
Ю. С. Белоконь 1, *, М. М. Белоконь 1, Е. А. Петрова 2, С. Н. Горошкевич 2, Д. В. Политов 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
Москва, Россия
2 Институт мониторинга климатических и экологических систем
Сибирского отделения Российской академии наук
Томск, Россия
* E-mail: yuri_b@vigg.ru
Поступила в редакцию 04.07.2022
После доработки 24.07.2022
Принята к публикации 25.07.2022
- EDN: XSMCEY
- DOI: 10.31857/S0042132422050040
Аннотация
С помощью 28 аллозимных локусов (Adh-1, Adh-2, Fdh, Fest-2, Gdh, Got-1, Got-2, Got-3, Idh-1, Lap-2, Lap-3, Mdh-1, Mdh-2, Mdh-3, Mdh-4, Mnr-1, Pepca, 6Pgd-2, 6Pgd-3, Pgi-1, Pgi-2, Pgm-1, Pgm-2, Skdh-1, Skdh-2, Sod-2, Sod-3, Sod-4) была изучена генетическая структура и дифференциация двенадцати популяций кедрового стланика Чукотки, п-ва Камчатка, о-ов Сахалин и Кунашир. В целом изменчивыми оказались 26 из изученных локусов (92.9%), среднее число аллелей на локус – 2.3, средняя гетерозиготность составила 0.248. В большинстве популяций уровни внутрипопуляционной изменчивости были близки к средним значениям. В пределах группы популяций Камчатки межпопуляционная дифференциация оказалась довольно высокой (FST = 0.028). Слабая дифференциация наблюдалась между двумя северными чукотскими популяциями (FST = 0.013), а также двумя популяциями о. Сахалин (FST = 0.013). Максимальный уровень генетической дифференциации выявлен между популяциями о. Кунашир, произрастающими в контрастных условиях среды на небольшой по географическим меркам территории (FST = 0.041). Генетические различия кунаширских популяций кедрового стланика сопоставимы с различиями популяций зоны Байкала, где этот вид произрастает в контрастных экологических условиях. В целом дифференциация популяций по Тихоокеанскому региону составила 0.07. Генетические расстояния Нея (DN) находятся в пределах от 0.005 – между двумя популяциями о. Кунашир, до 0.043 между популяциями Камчатки и Кунашира. Факторный анализ выявил кластеры популяций по географическому происхождению, а также показал высокую степень дифференциации между локальностями в пределах о. Кунашир и п-ова Камчатка, что может свидетельствовать о высокой степени приспособленности отдельных популяций к их среде обитания. Таким образом, можно заключить, что высокие показатели межпопуляционной дифференциации кедрового стланика зависят не только от географического происхождения, но и от условий обитания.
ВВЕДЕНИЕ
Кедровый стланик, Pinus pumila (Pall.) Regel, широко распространен в Восточной Сибири и на Дальнем Востоке. Стланик – обычный компонент подгольцового пояса горных лесных экосистем от побережья оз. Байкал до п-ва Камчатка и Курильских о-ов. Высокая экологическая пластичность позволяет ему заселять разнообразные местообитания, часто не приспособленные для роста других деревесных растений. Стланик выступает как пионерный вид-эдификатор при заселени новых мест, таких как гари, вулканические почвы и др. Семена P. pumila – важный кормовой ресурс для птиц и млекопитающих. Распространение семян осуществляется животными, преимущественно кедровкой, Nucifraga caryocatactes (Тихомиров, 1949; Гроссет, 1959; Моложников, 1975; Хоментовский, 1995).
В отличие от других сосен, представляющих собой прямостоячие деревья, стланик обладает уникальной кустовидной или стелящейся формой, его ветви способны к полеганию с наступлением морозов. Многие исследователи отмечают долговечность стланика и практически неограниченную способность к росту за счет укоренения полегающих ветвей и постепенного отмирания старых частей куста (фактически формирование локального сообщества клонов) (Тихомиров, 1949; Гроссет, 1959; Моложников, 1975; Хоментовский, 1995).
Система скрещивания P. pumila включает в себя как перекрестное, так и самоопыление. Отдельные популяции могут отличаться по уровням самоопыления. Как было показано ранее, на систему скрещивания влияет родственная структура популяции, сомкнутость зарослей и климатические факторы (Белоконь и др., 2010). В Тихоокеанском регионе стланик обитает в самых разнообразных условиях климата (от континентального до морского), рельефа (от равнин до высокогорья), почвы (от богатых почв до вулканического пепла и скал) (Хоментовский, 1995).
Как показал ряд сравнительных исследований, вид обладает самыми высокими показателями генетического полиморфизма среди сосен и других хвойных (Крутовский и др., 1990; Гончаренко и др., 1991, 1992; Политов и др., 1992; Гончаренко, Силин, 1997; Малюченко и др., 1998; Малюченко, Алтухов, 2001; Goncharenko et al., 1993; Krutovskii et al., 1994, 1995; Politov, Krutovskii, 1994, 2004; Tani et al., 1996, 1998). Однако имеющиеся генетические данные недостаточно характеризуют разнообразие стланика в Тихоокеанском регионе.
Наше исследование посвящено изучению генетического полиморфизма и уровней межпопуляционной дифференциации в популяциях кедрового стланика Тихоокеанского региона от Чукотки до юга о. Кунашир.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал
Материалом для данного исследования послужили сборы семян кедрового стланика из двенадцати локальностей на территории Чукотского АО, Камчатского края (одна из Корякского округа, три из Камчатской обл.), о. Сахалин и о. Кунашир (Сахалинская обл.). Названия, сокращенные обозначения и расположение выборок приведены в табл. 1 и на рис. 1.
Таблица 1.
Изученные выборки, их численности (число проанализированных семян, N) и географическое положение
| Название выборки |
Сокращенное обозначение | N | Координаты | Регион | Географическое положение | Локальность |
|---|---|---|---|---|---|---|
| Майн | МЙ | 75 | 63°40′ с.ш. 169°52′ в.д. |
Чукотский АО | Чукотка | Северо-восток Пенжинского хребта, долина р. Майн |
| Пенжина | ПЕ | 129 | 62°28′ с.ш. 166°08′ в.д. |
Корякский округ, Камчатский край | Корякия | Правый берег р. Пенжина, 8 км ниже по течению (к западу) от пос. Каменское |
| Вочкажеч | ВЧ | 244 | 53°05′ с.ш. 157°53′ в.д. |
Камчатский край | юг п-ова Камчатка | Подножие г. Вочкажеч, восточный склон |
| Кабан | КБ | 223 | 53°27′ с.ш. 158°44′ в.д. |
Камчатский край | юг п-ова Камчатка | Национальный природный парк “Налычево”, верхнее течение р. Лев. Налычева, г. Кабан |
| Эссо | ЭС | 274 | 55°60′ с.ш. 158°45′ в.д. |
Камчатский край | центральная часть п-ова Камчатка | Срединный хребет, окрестности пос. Эссо |
| Охотское | ОХС | 71 | 46°40′ с.ш. 143°25′ в.д. |
Камчатский край | юг о. Сахалин | Окрестности с. Охотское. 10–15 м над ур. м. Перешеек между Охотским морем и оз. Тунайча. Прибрежные заросли: шикша (Empetrum nigrum) и кедровый стланик |
| Кварциты | КВС | 57 | 46°50′ с.ш. 143°00′ в.д. |
Сахалинская обл. | юг о. Сахалин | Юг Сусунайского хребта, г. Медик. 770–780 м над ур. м. Субальпийские заросли на кварцитовых породах с преобладанием золотистого рододендрона (Rododendron aureum) и кедрового стланика |
| Бамбучник | ББК | 60 | 43°51′ с.ш. 145°28′ в.д. |
Сахалинская обл. | юг о. Кунашир | Заросли курильского бамбучка (Sasa kurilensis) в кальдере вулк. Головнина. 145–150 м над ур. м. и ю.-в. склон вулк. Головнина. 80–90 м над ур. м. около 300 м от тихоокеанского побережья |
| Кипящее | КПК | 60 | 43°45′ с.ш. 145°30′ в.д. |
Сахалинская обл. | юг о. Кунашир | Оз. Кипящее в кальдере вулк. Головнина. 130–135 м над ур. м. Первичная растительность на белом вулканическом пепле |
| Болото | БОК | 55 | 43°54′ с.ш. 145°38′ в.д. |
Сахалинская обл. | юг о. Кунашир | 3–5 м над ур. м. Серноводский перешеек: между oз. Песчаным и тихоокеанским побережьем. Осоково-сфагновое болото с кедровым стлаником |
| Вершина | ВЕК | 60 | 43°58′ с.ш. 145°44′ в.д. |
Сахалинская обл. | юг о. Кунашир | Вершина вулк. Менделеева. 880 м над ур. м. Субальпийская растительность с абсолютным преобладанием кедрового стланика |
| Фумароль-ные поля | ГЗК | 61 | 44°00′ с.ш. 145°44′ в.д. |
Сахалинская обл. | юг о. Кунашир | Фумарольные поля на сев. склоне вулк. Менделеева. 500 м над ур. м. Первичная растительность на белом вулканическом пепле с абсолютным преобладанием кедрового стланика |
Электрофорез
Для электрофореза изоферментов использовались ткани гаплоидных мегагаметофитов (эндоспермов) и диплоидных зародышей семян. От каждого дерева анализировалось по 6–12 семян, или по два семени от дерева в случае популяционных сборов (от 16 до 30 деревьев). Электрофорез проводили по стандартным методикам. Условия электрофоретического разделения, а также генный контроль изоферментных систем описаны нами ранее (Крутовский и др., 1987; Политов, 1989; Белоконь и др., 2005; Politov et al., 1999). Изученные ферментные системы, число кодирующих локусов и использованные буферные системы приведены в табл. 2. Гаплотипы эндоспермов и генотипы зародышей определялись по 28 и 23 изоферментным локусам соответственно.
Таблица 2.
Изученные ферментные системы, число кодирующих локусов и буферные системы, использованные для электрофоретического разделения
| Фермент | Аббревиатура | Номер по К.Ф. | Число локусов1 | Буферная система2 |
|---|---|---|---|---|
| Aлкогольдегидрогеназа | ADH | 1.1.1.1 | 2 | B |
| Формиатдегидрогеназа | FDH | 1.2.1.2 | 1 | B |
| Флюоресцентная эстераза | FEST | 3.1.1.1 | 3 (–2)1 | B |
| Глутаматдегидрогеназа | GDH | 1.4.1.2 | 1 | B, C |
| Глутамат-оксалоацетаттрансаминаза | GOT | 2.6.1.1 | 3 | C, B |
| Изоцитратдегидрогеназа | IDH | 1.1.1.42 | 1 | A |
| Лейцинаминопептидаза | LAP | 3.4.11.1 | 3 (–2, –3)1 | C, B |
| Малатдегидрогеназа | MDH | 1.1.1.37 | 4 | A |
| Менадионредуктаза | MNR | 1.6.99.2 | 3 (–1) 1 | A |
| 6-фосфоглюконатдегидрогеназа | 6PGD | 1.1.1.44 | 3 (–2, –3)1 | A |
| Фосфоглюкоизомераза | PGI | 5.3.1.9 | 2 | B |
| Фосфоглюкомутаза | PGM | 2.7.5.1 | 2 | B, A |
| Фосфоенолпируваткарбоксилаза | PEPCA | 4.1.1.31 | 1 | A |
| Шикиматдегидрогеназа | SKDH | 1.1.1.25 | 2 | A |
| Супероксиддисмутаза | SOD | 1.15.1.1 | 4 (–2, –3, –4)1 | B |
Примечание: 1 – для некоторых ферментов, у которых не для всех зон была возможнa генетическая интерпретация, в скобках курсивом даны номера зон (в порядке от анода к катоду) и соответствующих локусов, взятых в дальнейший анализ; 2 – буферные системы: A – морфолин-цитратная, pH 6.8 (Clayton, Tretiak, 1972); B – трис-ЭДТА-боратная pH 8.6 (Markert, Faulhaber, 1965); C – трис-цитрат/LiOH-боратная (Ridgeway et al., 1970).
Статистические методы
На основании многолокусных генотипов зародышей с помощью компьютерных программ BIOSYS-2 (Swofford, Selander, 1981) и GenAlEx V.6.5 (Peakall, Smouse, 2006, 2012) рассчитывали частоты аллелей и стандартные показатели генетической изменичвости, в т. ч. наблюдаемую и ожидаемую (в предположении равновесия Харди–Вайнберга) гетерозиготность, F-статистики (Wright, 1978), стандартные генетические дистанции Нея DN (Nei, 1972). Для локусов, которые анализировались только в эндоспермах, доля межпопуляционной компоненты изменчивости оценивалась с помощью FDT-статистики Райта. Кластеризацию по методам UPGMA и Neighbor-Joining с оценкой бутстрэп-поддержки узлов ветвления проводили в модулях Neighbor и Consense пакета программ PHYLIP v3.2 (Felsenstein, 1989), факторный анализ дифференциации на основании аллельных частот – в программе STATISTICA (StatSoft, 1998).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Внутрипопуляционная генетическая изменчивость
На основании многолокусных генотипов проведен анализ внутрипопуляционной изменчивости изученных выборок и субрегионов (табл. 3). Из 28 проанализированных локусов два оказались мономорфными во всех популяциях – Pgi-1 и Sod-3. В целом изменчивыми оказались 92.9% изученных локусов, полиморфными – 60.7%. Среднее число аллелей на локус – 2.3, средняя ожидаемая гетерозиготность составила 0.248. В большинстве выборок уровни внутрипопуляционной изменчивости были близки к средним значениям. Также не отмечено значимых отличий в этих показателях между субрегионами. Значения средней ожидаемой гетерозиготности, как меры генетического разнообразия, показывают, что во всех изученных популяциях поддерживается высокий уровень полиморфизма (0.228–0.270). В то же время, во всех популяциях отмечается дефицит гетерозигот среди зародышей семян. Коэффициенты инбридинга находятся в пределах от 0.021 (КПК) до 0.427 (БОК), при среднем значении 0.149.
Таблица 3.
Показатели генетической изменчивости в выборках P. pumila
| Выборка | N1 | A2 | Ae2 | P1002 | P952 | HE2 | HE (23 лок.)3 | HO (23 лок.)3 | F (23 лок.)3 |
|---|---|---|---|---|---|---|---|---|---|
| МЙ | 75 | 2.21 ± 0.214 | 1.45 ± 0.09 | 75.00 | 60.71 | 0.244 ± 0.040 | 0.209 ± 0.043 | 0.175 ± 0.038 | 0.179 |
| ПЕ | 131 | 2.57 ± 0.21 | 1.49 ± 0.10 | 82.14 | 57.14 | 0.253 ± 0.044 | 0.214 ± 0.047 | 0.185 ± 0.040 | 0.080 |
| ВЧ | 244 | 2.11 ± 0.15 | 1.46 ± 0.10 | 82.14 | 57.14 | 0.238 ± 0.042 | 0.202 ± 0.047 | 0.131 ± 0.029 | 0.252 |
| КБ | 223 | 2.14 ± 0.16 | 1.47 ± 0.11 | 78.57 | 50.00 | 0.232 ± 0.045 | 0.208 ± 0.049 | 0.163 ± 0.038 | 0.171 |
| ЭС | 274 | 2.46 ± 0.24 | 1.54 ± 0.13 | 75.00 | 57.14 | 0.251 ± 0.047 | 0.225 ± 0.051 | 0.202 ± 0.046 | 0.077 |
| ОХС | 71 | 2.57 ± 0.24 | 1.50 ± 0.11 | 78.57 | 60.71 | 0.249 ± 0.044 | 0.214 ± 0.044 | 0.194 ± 0.040 | 0.070 |
| КВС | 57 | 2.36 ± 0.25 | 1.50 ± 0.11 | 75.00 | 60.71 | 0.250 ± 0.044 | 0.222 ± 0.047 | 0.189 ± 0.043 | 0.148 |
| ББК | 60 | 2.14 ± 0.21 | 1.48 ± 0.10 | 64.29 | 64.29 | 0.249 ± 0.042 | 0.224 ± 0.045 | 0.188 ± 0.039 | 0.150 |
| КПК | 60 | 2.14 ± 0.22 | 1.45 ± 0.11 | 64.29 | 60.71 | 0.228 ± 0.043 | 0.199 ± 0.043 | 0.197 ± 0.045 | 0.021 |
| БОК | 55 | 2.11 ± 0.19 | 1.55 ± 0.11 | 67.86 | 64.29 | 0.270 ± 0.045 | 0.231 ± 0.048 | 0.124 ± 0.027 | 0.427 |
| ВЕК | 60 | 2.21 ± 0.19 | 1.49 ± 0.10 | 71.43 | 64.29 | 0.253 ± 0.043 | 0.226 ± 0.046 | 0.213 ± 0.045 | 0.091 |
| ГЗК | 61 | 2.36 ± 0.22 | 1.51 ± 0.10 | 71.43 | 64.29 | 0.262 ± 0.043 | 0.228 ± 0.046 | 0.205 ± 0.043 | 0.133 |
| Корякия/Чукотка | 206 | 2.39 ± 0.15 | 1.47 ± 0.07 | 78.57 | 58.93 | 0.248 ± 0.029 | 0.211 ± 0.031 | 0.180 ± 0.027 | 0.126 |
| Камчатка | 741 | 2.24 ± 0.11 | 1.49 ± 0.07 | 78.57 | 54.76 | 0.240 ± 0.026 | 0.212 ± 0.028 | 0.166 ± 0.022 | 0.170 |
| Сахалин | 128 | 2.48 ± 0.18 | 1.50 ± 0.08 | 76.79 | 60.71 | 0.251 ± 0.031 | 0.213 ± 0.031 | 0.181 ± 0.027 | 0.126 |
| Кунашир | 296 | 2.19 ± 0.09 | 1.50 ± 0.05 | 67.86 | 63.57 | 0.252 ± 0.019 | 0.222 ± 0.020 | 0.185 ± 0.018 | 0.162 |
| Среднее | 114.3 | 2.28 ± 0.06 | 1.49 ± 0.03 | 73.81 | 60.12 | 0.248 ± 0.012 | 0.217 ± 0.013 | 0.181 ± 0.011 | 0.149 |
| В целом | 1371 | 3.68 ± 0.35 | 1.53 ± 0.11 | 92.86 | 60.71 | 0.264 ± 0.044 | 0.228 ± 0.047 | 0.175 ± 0.036 | 0.207 |
Примечание: 1 – число проанализированных семян; 2 – значения среднего (A) и среднего эффективного (Ae) числа аллелей на локус, процента полиморфных локусов при 100%-м (P100) и 95%-м (P95) критерии полиморфизма и ожидаемой гетерозиготности (HE) приведены в среднем по 28 локусам, анализ 23 из которых велся в диплоидной ткани зародышей, а пяти (Adh-2, Lap-2, Mdh-3, Mdh-4 и Sod-4) – только в гаплоидной ткани эндоспермов семян; 3 – значения наблюдаемой (HO) и ожидаемой (HE) гетерозиготности, а также коэффициента инбридига (F = (HE–HO)/HE) по 23 локусам, изученным в зародышах; 4 – значения стандартной ошибки среднего.
Для большинства популяций кедрового стланика характерны довольно высокие показатели внутрипопуляционной изменчивости по аллозимным локусам (Гончаренко и др., 1992; Политов и др., 1992; Наконечная и др., 2010; Goncharenko et al., 1993; Tani et al., 1996; Politov, Krutovskii, 1994; Krutovskii et al., 1995). Полученные нами данные подтверждают это для выборок восточной части ареала. В популяциях кедровых сосен дефицит гетерозигот, как результат инбридинга, в выборках зародышей семян наблюдается довольно часто. Он может быть вызван как самоопылением, так и опылением между родственными особями. В репродуктивной части популяции дефицита гетерозигот, как правило, не наблюдается (Политов, 1989; Политов и др., 1992, 2006, 2007; Белоконь, 2007; Белоконь и др., 2010; Politov, Krutovskii, 1994; Krutovskii et al., 1995). В работе японских исследователей, изучивших 18 популяций стланика, отмечено близкое к равновесному соотношение генотипов среди взрослых деревьев (Tani et al., 1996). В исследовании, посвященном изучению динамики аллозимной гетерозиготности в популяциях P. pumila (Политов и др., 2006) было установлено, что коэффициент инбридинга в выборках зародышей семян довольно высок (FIS = 0.124–0.342), но у взрослых деревьев наблюдается равновесное соотношение генотипов или избыток гетерозигот (FIS от –0.167 до 0.053). Только в популяции Пенжина среди взрослых деревьев отмечался дефицит гетерозигот, вызванный небольшим возрастом деревьев (Политов и др., 2006). Нарастание гетерозиготности с возрастом насаждения у хвойных – следствие элиминации инбредного потомства, как менее приспособленного к условиям среды, и действия балансирующего отбора, поддерживающего высокий уровень полиморфизма в популяции (Алтухов и др., 2004).
Генетическая подразделенность и межпопуляционная дифференциация
Тест на гетерогенность аллельных частот показывает, что по всем локусам, за исключением Fdh, наблюдаются достоверные отличия между выборками (табл. 4). Уровни генетической подразделенности (F-статистики) показывают, что по всем локусам, за исключением слабоизменчивых Adh-1, Fdh и Got-1, наблюдался дефицит гетерозигот среди зародышей семян, как относительно выборки FIS = 0.161, так и в целом FIT = 0.207. Значительная часть генетической изменчивости приходится на долю межгрупповой. Средние показатели FST и FDT по Тихоокеанскому региону составили 0.056 и 0.070 соответственно.
Таблица 4.
Значения F-статистик и χ2-теста на гетерогенность аллельных частот
| Локус | FIS | FIT | FST | FDT | χ2 | d.f. | P |
|---|---|---|---|---|---|---|---|
| Adh-1 | –0.019 | –0.003 | 0.016 | 0.009 | 78.564 | 22 | 0.0000 |
| Adh-2 | — | — | — | 0.086 | 1029.859 | 33 | 0.0000 |
| Fdh | –0.007 | –0.002 | 0.005 | 0.000 | 9.735 | 11 | 0.5544 |
| Fe-2 | 0.291 | 0.351 | 0.085 | 0.080 | 694.335 | 44 | 0.0000 |
| Gdh | 0.107 | 0.194 | 0.097 | 0.091 | 173.745 | 11 | 0.0000 |
| Got-1 | –0.014 | –0.001 | 0.013 | 0.006 | 36.421 | 11 | 0.0001 |
| Got-2 | 0.228 | 0.312 | 0.110 | 0.103 | 342.808 | 33 | 0.0000 |
| Got-3 | 0.179 | 0.222 | 0.052 | 0.046 | 615.079 | 88 | 0.0000 |
| Idh | 0.658 | 0.666 | 0.023 | 0.015 | 64.300 | 11 | 0.0000 |
| Lap-2 | – | – | – | 0.065 | 295.178 | 22 | 0.0000 |
| Lap-3 | 0.283 | 0.336 | 0.075 | 0.068 | 504.599 | 44 | 0.0000 |
| Mdh-1 | 0.086 | 0.134 | 0.053 | 0.046 | 140.883 | 22 | 0.0000 |
| Mdh-2 | 0.150 | 0.199 | 0.058 | 0.052 | 913.941 | 55 | 0.0000 |
| Mdh-3 | – | – | – | 0.040 | 233.327 | 22 | 0.0000 |
| Mdh-4 | – | – | – | 0.083 | 1250.668 | 66 | 0.0000 |
| Mnr-1 | 0.176 | 0.194 | 0.022 | 0.016 | 257.885 | 33 | 0.0000 |
| Pepca | 0.119 | 0.198 | 0.090 | 0.085 | 253.728 | 11 | 0.0000 |
| 6Pgd2 | 0.103 | 0.150 | 0.053 | 0.047 | 152.950 | 22 | 0.0000 |
| 6Pgd3 | 0.157 | 0.171 | 0.017 | 0.012 | 92.778 | 44 | 0.0000 |
| Pgi-2 | 0.143 | 0.217 | 0.086 | 0.077 | 252.368 | 33 | 0.0000 |
| Pgm-1 | 0.168 | 0.198 | 0.036 | 0.030 | 361.410 | 44 | 0.0000 |
| Pgm-2 | 0.109 | 0.135 | 0.029 | 0.023 | 368.493 | 44 | 0.0000 |
| Skdh1 | 0.188 | 0.252 | 0.079 | 0.072 | 400.002 | 44 | 0.0000 |
| Skdh2 | 0.226 | 0.285 | 0.076 | 0.069 | 180.527 | 11 | 0.0000 |
| Sod-2 | 0.058 | 0.148 | 0.095 | 0.089 | 218.487 | 22 | 0.0000 |
| Sod-4 | – | – | – | 0.140 | 367.625 | 22 | 0.0000 |
| Среднее | 0.161 | 0.207 | 0.056 | 0.070 | – | – | – |
Межпопуляционная дифференциация оказалась довольно высокой на о. Кунашир (FST = = 0.041; FDT = 0.043), несмотря на близкое расположение выборок (максимальное расстояние менее 40 км). Для трех выборок Камчатки FST = 0.028, FDT = 0.044. Минимальная межпопуляционная дифференциация отмечена для выборок МЙ и ПЕ – FST = 0.013, FDT = 0.016, и для выборок о. Сахалин – FST = 0006, FDT = 0013. В различных публикациях для кедрового стланика приводятся отличающиеся показатели FST. Например, для трех выборок из Чукотки этот показатель равен 0.021 (Политов и др., 1992), для выборок Чукотки и Сахалина – 0.043 (Гончаренко и др., 1992), для прибайкальских популяций – 0.042 (Малюченко и др., 1998; Малюченко, Алтухов, 2001), для трех маргинальных популяций из разных частей ареала (Прибайкалье, Сихотэ-Алинь и Камчатка) FST = 0.05 (Наконечная и др., 2010). Таким образом, выявленная нами общая дифференциация выборок Тихоокеанского региона оказалась максимальной.
Значительно более высокие уровни полиморфизма, как внутрипопуляционного, так и межпопуляционного, были выявлены в исследовании популяций кедрового стланика с применением селективно нейтральных ядерных микросателлитных локусов (Орешкова и др., 2017). По сравнению с другими видами сосен, изученными по тем же микросателлитным локусам, P. pumila демонстрирует самую высокую изменчивость.
Попарные показатели межпопуляционной дифференциации FST и генетические дистанции Нея DN (Nei, 1972) между изученными выборками P. pumila приведены в табл. 5. Минимальные значения генетических дистанций отмечены между выборками о. Кунашир ББК и КПК – 0.009 и ВЕК и ГЗК – 0.005. Максимальные значения – между выборками из разных субрегионов – Чукотка (МЙ) и Кунашир (БОК) – DN = 0.043. Метод невзвешенных парногрупповых средних (UPGMA) (рис. 2) выявляет высокое генетическое сходство некоторых выборок внутри регионов, но не вполне отражает их географическое происхождение, что свидетельствует о значительном генетическом разнообразии в пределах субрегионов. Кластеризация по методу Neighbor-Joining в целом подтверждает региональную приуроченность выборок (рис. 3). Однако, невысокие уровни бутстрэп-поддержки узлов ветвления говорят о высоком межпопуляционном разнообразии в пределах регионов. Так например, выборка Эссо (Центральная Камчатка, Срединный хребет) имеет сходство такого же уровня с северными выборками, что и с выборками юго-востока Камчатки (КБ и ВЧ). Такая кластеризация может быть обусловлена общностью происхождения этих выборок. Существуют мнения, что расселение вида на п-ов Камчатка происходило из северных материковых популяций (Хоментовский, 1995).
Таблица 5.
Попарные показатели межпопуляционной дифференциации FST (над диагональю) и генетические дистанции DN (под диагональю) между изученными выборками P. pumila
| Выборка | МЙ | ПЕ | ВЧ | КБ | ЭС | ОХС | КВС | ББК | КПК | БОК | ВЕК | ГЗК |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| МЙ | – | 0.013 | 0.041 | 0.032 | 0.028 | 0.031 | 0.032 | 0.040 | 0.032 | 0.064 | 0.042 | 0.033 |
| ПЕ | 0.011 | – | 0.029 | 0.023 | 0.014 | 0.021 | 0.023 | 0.034 | 0.029 | 0.054 | 0.040 | 0.030 |
| ВЧ | 0.030 | 0.020 | – | 0.018 | 0.026 | 0.028 | 0.029 | 0.040 | 0.028 | 0.045 | 0.025 | 0.024 |
| КБ | 0.024 | 0.017 | 0.011 | – | 0.017 | 0.030 | 0.033 | 0.039 | 0.035 | 0.051 | 0.032 | 0.033 |
| ЭС | 0.022 | 0.011 | 0.021 | 0.016 | – | 0.027 | 0.033 | 0.051 | 0.040 | 0.063 | 0.040 | 0.037 |
| ОХС | 0.022 | 0.015 | 0.022 | 0.022 | 0.020 | – | 0.006 | 0.037 | 0.035 | 0.054 | 0.024 | 0.020 |
| КВС | 0.024 | 0.015 | 0.020 | 0.023 | 0.023 | 0.011 | – | 0.024 | 0.026 | 0.035 | 0.024 | 0.019 |
| ББК | 0.024 | 0.021 | 0.029 | 0.026 | 0.035 | 0.027 | 0.018 | – | 0.017 | 0.022 | 0.036 | 0.034 |
| КПК | 0.020 | 0.020 | 0.019 | 0.024 | 0.028 | 0.025 | 0.019 | 0.009 | – | 0.012 | 0.018 | 0.014 |
| БОК | 0.043 | 0.039 | 0.032 | 0.035 | 0.042 | 0.041 | 0.026 | 0.016 | 0.023 | – | 0.037 | 0.032 |
| ВЕК | 0.029 | 0.027 | 0.018 | 0.022 | 0.029 | 0.015 | 0.015 | 0.022 | 0.028 | 0.023 | – | 0.008 |
| ГЗК | 0.020 | 0.018 | 0.017 | 0.022 | 0.027 | 0.014 | 0.011 | 0.020 | 0.024 | 0.019 | 0.005 | – |
Рис. 2.
UPGMA-дендрограмма генетического сходства выборок P. pumila на основании генетических расстояний Нея (DN).

Рис. 3.
Кластеризация выборок P. pumila по методу Neighbor-Joining с оценкой бутстрэп-поддержки узлов ветвления.
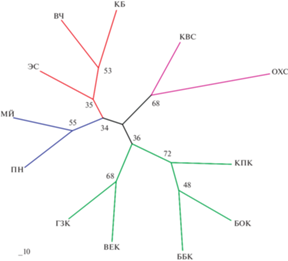
Данная гипотеза подтверждается дифференциацией популяций Тихоокеанского региона, полученной с использованием микросателлитов (Орешкова и др., 2017). В этой работе изученные популяции стланика образуют два крупных кластера. Прослеживается сходство северных популяций Камчатки и Чукотки с одной стороны, и южных популяций Кунашира, Сахалина и Сихотэ-Алиня – с другой. Очевидно, что полученные результаты отражают историю расселения кедрового стланика в Тихоокеанском регионе.
Факторный анализ демонстрирует дифференциацию популяций на основании частот аллелей аллозимных локусов (рис. 4). Первый фактор отражает дифференциацию по географическому происхождению. Популяции образуют группы о. Кунашир, о. Сахалин и совместную группу Камчатка–Чукотка. По нашему мнению, данная картина отражает происхождение и историю расселения стланика в тихоокеанском регионе, а также экологическую подразделенность исследуемых групп популяций.
Рис. 4.
Пространственная ординация выборок P. pumila по результатам факторного анализа частот аллелей аллозимных локусов.

Особого внимания заслуживает дифференциация между выборками о. Кунашир. Минимальная дифференциация наблюдается между двумя парами выборок: ВЕК и ГЗК – вершина вулкана Менделеева и фумарольные поля на северном склоне вулкана; ББК и КПК – бамбучник и оз. Кипящее в кальдере вулкана Головнина. Вероятнее всего, генетическое сходство внутри этих пар выборок вызвано постоянным притоком генетического материала в виде семян, переносимых кедровкой из более “стабильных” в более “экстремальные” места. На белых вулканических почвах видом-первопроходцем является шикша, Empetrum nigrum. Кедровка обычно делает свои запасы в куртинках шикши, которые представляют собой хорошие ориентиры на открытом пространстве. Невостребованные запасы прорастают в виде проростков стланика. Однако выживаемость кустов на первичных вулканических почвах ниже за счет повышенной кислотности и недостатка влаги. Заселение фумарольных полей (ГЗК), экстремальных для обитания вида, идет за счет переноса семян с вершины вулкана Менделеева (ВЕК), где находятся ненарушенные сплошные заросли кедрового стланика, что и объясняет сходство этих двух выборок. Подобная ситуация наблюдается и в кальдере вулкана Головнина, где менее приспособленным местом является берег оз. Кипящее, а источником семян для восстановления – ближайшие кусты стланика из бамбучника. Если рассматривать эти две пары выборок как единые популяции, то интересен тот факт, что генетические различия между ними, а также выборкой из осоково-сфагнового болота (БОК), довольно высоки (достигают уровня региональных). Вероятно, причиной этих различий является изоляция, вызванная рядом факторов, таких как ограниченное распространение пыльцы и семян в условиях сложного рельефа и климатические особенности (высокая влажность воздуха, направление и сила воздушных потоков). Анализ системы скрещивания стланика выявил низкие уровни перекрестного опыления в популяциях Камчатки, обитающих в близости от побережья и представляющих собой сомкнутые заросли (КБ и ВЧ) – tm = 0.73 и 0.57 соответственно. Высокие уровни перекрестного опыления отмечены в более разреженных зарослях популяций Центральной Камчатки (ЭС) и Карякии (ПЕ) – tm = 0.92 и 0.94. У стланика из кальдеры вулкана Головнина (внешний и внутренний склоны) установлен средний уровень перекрестного опыления – tm = 0.87 (Белоконь и др., 2010).
ЗАКЛЮЧЕНИЕ
Полученные данные показывают, что Pinus pumila Тихоокеанского региона обладает высокими уровнями генетической изменчивости, сопоставимыми с оценками, полученными для вида ранее в зоне Байкала, побережья Охотского моря, Чукотки и о. Сахалин. Поддержание высокого уровня аллозимного полиморфизма является адаптивной стратегией, за счет которой популяции кедрового стланика сохраняют возможность приспособиться к изменяющимся условиям среды.
Популяции Чукотки, Камчатки, о. Сахалин и о. Кунашир обладают генетическим своеобразием, которое сформировалось под влиянием истории расселения стланика в регионе и действием естественного отбора в разнообразных эколого-климатических условиях. На примере о. Кунашир отмечен высокий уровень дифференциации между популяциями близкими географически, но различающимися по условиям произрастания и фактически изолированными друг от друга за счет ограничения потока генов.
Список литературы
Белоконь М.М. Генетическая структура популяций сосны корейской и сосны кедровой европейской и родственные связи видов секции Strobus рода Pinus: Дис. …канд. биол. наук. Москва: Институт общей генетики им. Н.И. Вавилова РАН, 2007. 154 с.
Белоконь М.М., Белоконь Ю.С., Политов Д.В. Система скрещивания и динамика аллозимной гетерозиготности в популяциях кедрового стланика, Pinus pumila (Pall.) Regel // Хвойные бореальной зоны. 2010. Т. 27. № 1–2. С. 13–17.
Белоконь М.М., Белоконь Ю.С., Политов Д.В., Алтухов Ю.П. Аллозимный полиморфизм европейской кедровой сосны (Pinus cembra L.) в горных популяциях Альп и Восточных Карпат // Генетика. 2005. Т. 41. № 11. С. 1538–1551.
Гончаренко Г.Г., Силин А.Е. Популяционная и эволюционная генетика сосен Восточной Европы и Сибири. Минск: Тэхналогiя, 1997. 191 с.
Гончаренко Г.Г., Падутов В.Е., Силин А.Е. Степень генетической подразделенности и дифференциации в природных популяциях кедровых сосен // ДАН СССР. 1991. Т. 317. № 6. С. 1477–1483.
Гончаренко Г.Г., Падутов В.Е., Силин А.Е. Генетическая изменчивость и дифференциация у Pinus pumila (Pall.) Regel в популяциях Чукотки и Сахалина // Генетика. 1992. Т. 28. № 7. С. 107–119.
Гроссет Г.Э. Кедровый стланик. М.: Изд-во Моск. общ-ва испыт. природы, 1959. С. 140.
Динамика популяционных генофондов при антропогенных воздействиях / Ред. Ю.П. Алтухов. М.: Наука, 2004. 618 с.
Крутовский К.В., Политов Д.В., Алтухов Ю.П. Генетическая изменчивость сибирской кедровой сосны Pinus sibirica Du Tour. Сообщение I. Механизмы генного контроля изоферментных систем // Генетика. 1987. Т. 23. № 12. С. 2216–2228.
Крутовский К.В., Политов Д.В., Алтухов Ю.П. Межвидовая генетическая дифференциация кедровых сосен Евразии по изоферментным локусам // Генетика. 1990. Т. 26. № 4. С. 694–707.
Малюченко О.П., Алтухов Ю.П. Влияние индивидуальной гетерозиготности на характеристики плодоношения у кедрового стланика Pinus pumila (Pall.) Regel // Докл. РАН. 2001. Т. 384. № 3. С. 418–421.
Малюченко О.П., Политов Д.В., Белоконь Ю.С., Белоконь М.М. Генетическая дифференциация кедрового стланика Pinus pumila (Pall.) Regel в Прибайкалье // Экология и генетика популяций. Йошкар-Ола: Периодика Марий Эл, 1998. С. 38–45.
Моложников В.Н. Кедровый стланик горных ландшафтов Северного Прибайкалья. Ленинград: Наука, 1975. 203 с.
Наконечная О.В., Холина А.Б., Корень О.Г. и др. Характеристика генофондов трех популяций Pinus pumila (Pall.) Regel на границах ареала // Генетика. 2010. Т. 46. № 12. С. 1609–1618.
Орешкова Н.В., Ветрова В.П., Горошкевич С.Н., Петрова Е.А. Изменчивость ядерных микросателлитных локусов в популяциях кедрового стланика (Pinus pumila (Pallas) Regel) из Российской части ареала // Генетика. 2017. Т. 53. № 3. С. 324–333.
Политов Д.В. Аллозимный полиморфизм, генетическая дифференциация и система скрещивания сибирской кедровой сосны Pinus sibirica Du Tour: Дис. … канд. биол. наук. Москва: Институт общей генетики им. Н.И. Вавилова АН СССР, 1989. 190 с.
Политов Д.В., Белоконь М.М., Белоконь Ю.С. Динамика аллозимной гетерозиготности в дальневосточных популяциях кедрового стланика Pinus pumila (Pall.) Regel: сравнение зародышей и материнских растений // Генетика. 2006. Т. 42. № 10. С. 1348–1358.
Политов Д.В., Крутовский К.В., Алтухов Ю.П. Характеристика генофондов популяций кедровых сосен по совокупности изоферментных локусов // Генетика. 1992. Т. 28. № 1. С. 93–114.
Политов Д.В., Пирко Н.Н., Пирко Я.В. и др. Система скрещивания и возрастная динамика уровней инбридинга в популяциях Pinus cembra L. Украинских Карпат // Науковi записки Тернопiльського нацiонального педагогiчного унiверситету iм. Володимира Гнатюка. Серiя: бiологiя. 2007. Т. № 3 (33). С. 80–85.
Тихомиров Б.А. Кедровый стланик. его биология и использование. Москва: Изд-во Моск. общ-ва испыт. природы, 1949. 106 с.
Хоментовский П.А. Экология кедрового стланика Pinus pumila (Pallas) Regel на Камчатке (общий обзор). Владивосток: Дальнаука, 1995. 226 с.
Clayton J.W., Tretiak D.N. Amino-citrate buffers for pH control in starch gel electrophoresis // J. Fish. Res. Board Canada. 1972. V. 29. P. 1169–1172.
Felsenstein J. PHYLIP - Phylogeny Inference Package (Version 3.2) // Cladistics. 1989. V. 5. P. 164–166.
Goncharenko G.G., Padutov V.E., Silin A.E. Allozyme variation in natural populations of Eurasian pines. I. Population structure genetic variation and differentiation in Pinus pumila (Pall.) Regel from Chukotsk and Sakhalin // Silvae Genetica. 1993. V. 42. № 4–5. P. 237–253.
Krutovskii K.V., Politov D.V., Altukhov Y.P. Study of genetic differentiation and phylogeny of stone pine species using isozyme loci // Proc. Internat. workshop on subalpine stone pines and their environment: the status of our knowledge. Ogden. Utah: USDA Forest Service Intermountain Res. Station, 1994. P. 19–30.
Krutovskii K.V., Politov D.V., Altukhov Y.P. Isozyme study of population genetic structure, mating system and phylogenetic relationships of the five stone pine species (subsection Cembrae, section Strobi, subgenus Strobus) // Population genetics and genetic conservation of forest trees / Papers presented at an international symposium organized by IUFRO, held 24–28 August 1992 at Carcans-Maubuisson, France. Amsterdam; Netherlands: SPB Academic Publishing, 1995. P. 279–304.
Markert C.L., Faulhaber I. Lactate dehydrogenase isozyme patterns in fish // J. Exp. Zool. 1965. V. 159. № 2. P. 319–332.
Nei M. Genetic distance between populations // Am. Nat. 1972. V. 106. P. 283–292.
Peakall R., Smouse P.E. GenAIEx V6: genetic analysis in Excel. Population genetic software for teaching and research // Mol. Ecol. Notes. 2006. V. 6. № 1. P. 288–295.
Peakall R., Smouse P.E. GenAlEx 6.5: genetic analysis in Excel. Population genetic software for teaching and research – an update // Bioinformatics. 2012. V. 28. P. 2537–2539.
Politov D.V., Krutovskii K.V. Allozyme polymorphism, heterozygosity, and mating system of stone pines (Pinus, subsection Cembrae) // Proc. Internat. workshop on subalpine stone pines and their environment: the status of our knowledge. Ogden, Utah: USDA Forest Service Intermountain Res. Station, 1994. P. 36–42.
Politov D.V., Krutovskii K.V. Phylogenetics. genogeography and hybridization of 5-needle pines in Russia and neighboring countries / Five-needle pine species: genetic improvement, disease resistance, and conservation. IUFRO Working Party 2.02.15. // Proc. RMRS-P-032 (July 24–25. 2001. Medford. OR). Ogden, Utah, USA: U.S. Department of Agric. Forest Service, Rocky Mountain Res. Station, 2004. P. 85–97.
Politov D.V., Belokon M.M., Maluchenko O.P. et al. Genetic evidence of natural hybridization between Siberian stone pine, Pinus sibirica Du Tour, and dwarf Siberian pine, P. pumila (Pall.) Regel // Forest Genet. 1999. V. 6. № 1. P. 41–48.
Ridgeway Y.J., Sherburne S.W., Lewis R.D. Polymorphisms in the esterases of Atlantic herring // Trans. Am. Fish. Soc. 1970. V. 99. P. 147–151.
StatSoft I. STATISTICA for Windows [Computer program manual]. Tulsa, OK: StatSoft, Inc., 1998.
Swofford D.L., Selander R.B. BIOSYS-1: a FORTRAN program for the comprehensive analysis of electrophoretic data in population genetics and systematics // J. Heredity. 1981. V. 72. P. 281–283.
Tani N., Tomaru N., Araki M., Ohba K. Genetic diversity and differentiation in populations of Japanese stone pine (Pinus pumila) in Japan // Canadian J. Forest Res. 1996. V. 26. № 8. P. 1454–1462.
Tani N., Tomaru N., Tsumura Y. et al. Genetic structure within a Japanese stone pine (Pinus pumila Regel) population on Mt. Aino-Dake in Central Honshu, Japan // J. Plant Res. 1998. V. 111. № 1101. P. 7–15.
Wright S. Evolution and the genetics of population. Variability within and among natural populations. Chicago, Illinois: Univ. of Chicago Press, 1978. 580 p.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии



