Успехи современной биологии, 2023, T. 143, № 1, стр. 52-67
Направленная эволюция кариотипа обыкновенной бурозубки Sorex araneus (Mammalia)
В. Н. Орлов 1, И. А. Крищук 2, Е. В. Черепанова 1, *, Ю. М. Борисов 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
Москва, Россия
2 Научно-практический центр по биоресурсам, Национальная академия наук Беларуси
Минск, Беларусь
* E-mail: elyacherena.16@gmail.com
Поступила в редакцию 19.04.2022
После доработки 17.07.2022
Принята к публикации 22.09.2022
- EDN: HKXBPR
- DOI: 10.31857/S0042132423010064
Аннотация
Предложена модель направленной эволюции кариотипа S. araneus L. в процессах замены десяти пар акроцентрических хромосом пятью парами метацентрических. Направленность эволюции кариотипа возникает из-за неспособности Rb-cоединений с плечами неполной (монобрахиальной) гомологии распространяться в одной популяции. Поэтому Rb-соединение, в силу каких-то случайных событий первым появившееся в популяции, в значительной мере определяет дальнейшую эволюцию кариотипа этой популяции. После третьей замены акроцентрических хромосом метацентрическими, замена оставшихся 6 пар акроцентриков допускает образование не более трех кариотипов с пятью диагностическими метацентриками, которые возможно предсказать, независимо от того, в результате каких перестроек возникают метацентрические хромосомы (Rb-соединения или WART). Направленность кариотипической эволюции значительно повышает вероятность параллельного формирования кариотипов в тех случаях, когда эволюция начинается одинаковыми метацентриками в географически удаленных популяциях. Примером параллельной эволюции, начавшейся с метацентрика gk, могут служить идентичные кариотипы новой расы Могилев из Беларуси и расы Томск из Западной Сибири. В эволюции хромосомных рас Восточной Европы показаны гибридогенные процессы слияния кариотипов рас восточноевропейской (EEKG) и западноевропейской групп (WEKG).
ВВЕДЕНИЕ
Начиная с первых обобщений по хромосомам позвоночных Р. Маттея (R. Matthey) в 1940–50 гг., отмечалось накопление хромосомных перестроек в эволюции родов и семейств млекопитающих, в том числе, предположительно, и Робертсоновских (Rb) центрических соединений акроцентрических хромосом (Воронцов, 1958). С появлением методов дифференциальной окраски хромосом в начале 1970-х гг. стали накапливаться сведения об участии Rb-соединений наряду с другими хромосомными перестройками в эволюции кариотипов млекопитающих (Орлов, 1974; Иваницкая, 1983; Hsu, Benirschke, 1967–1977; Cytotaxonomy…, 1973; Zima, Král, 1984).
В реконструкции эволюции кариотипов обычно выделяют предковый кариотип для рода или семейства и сопоставляют его с кариотипами ныне живущих видов. При этом иногда обнаруживается постепенное накопление одного типа хромосомных перестроек, и достаточно сложно выяснить, имеется ли в таком накоплении определенная эволюционная направленность.
В сравнительной кариологии млекопитающих термин “направленность” (сanalization) накопления хромосомных перестроек использовался только один раз в гипотетической модели эволюции в направлении к оптимальному кариотипу в новой для вида адаптивной зоне под новым селективным давлением (Bickham, Baker, 1979). Но уже в следующей работе авторы указали на отсутствие каких-либо данных, подтверждающих эту интересную гипотезу (Baker, Bickham, 1980).
Особенности хромосомной изменчивости обыкновенной бурозубки S. araneus L. были обобщены в коллективной монографии (Shrews…, 2019), которая подвела итоги более чем 30-летнего периода совместных междисциплинарных исследований хромосомного полиморфизма обыкновенной бурозубки в Евразии, инициированных Международным комитетом по цитогенетике Sorex araneus, ISACC. В настоящее время опубликованы описания 76 хромосомных рас этого вида (Bulatova et al., 2019).
Сравнительный анализ кариотипов видов рода бурозубок Sorex L. давно привел к обоснованному выводу об исходных акроцентрических хромосомах и накоплении Rb-cоединений в кариотипах видов этого рода (Wójcik, Searle, 1988; Volobouev, 1989; Volobouev, Catzeflis, 1989; Biltueva et al., 2000; Wójcik et. al., 2002). Но в хорошо изученной системе хромосомного полиморфизма бурозубок р. Sorex, и обыкновенной бурозубки в частности, направленность процессов замены акроцентрических хромосом на метацентрические ранее не отмечалась.
Вопросы направленной эволюции видов и внутривидовых форм привлекают внимание биологов-эволюционистов с начала ХХ в. (Вавилов, 1920; Берг, 1922). На направленность эволюционного процесса указывает “закон гомологических рядов” Н.И. Вавилова (1920). Развивая эту часть теории направленной эволюции, Р.Л. Берг (1993) объяснила направленность тем, что существуют “ограничения, налагающие запрет на движение по всем остальным направлениям”, “эволюция – движение по разрешенным путям” (с. 223). Если “запрет” означает понижение приспособленности, то он связан с движущим отбором по И.И. Шмальгаузену (1969). Достаточно сложно выявить генетические факторы, ограничивающие направления эволюции и вызывающие параллелизм и конвергенцию в эволюции внутривидовых форм и видов.
В системе хромосомного полиморфизма обыкновенной бурозубки хорошо известно одно важное ограничение в распространении Rb-мутаций в популяциях. В одной популяции не распространяются Rb-соединения с плечами неполной (монобрахиальной) гомологии (например, hi и hn). В мейозе I таких гетерозигот возникают квадриваленты или более сложные мультиваленты. Нерасхождение хромосом приводит к появлению несбалансированных гамет, в результате плодовитость гетерозигот снижается (Fedyk et al., 2019) и одна из кариоморф исчезает из популяции. Изолирующий эффект хромосом монобрахиальной гомологии рассматривается как важная составляющая часть генетической изоляции (White, 1978; Capanna, 1982; Baker, Bickham, 1986; Wójcik et al., 2002; Capanna, Castiglia, 2004; Garagna et al., 2014; Shrews…, 2019). Все предложенные до сих пор модели хромосомного видообразования основаны именно на изолирующем эффекте хромосом монобрахиальной гомологии, но могут ли хромосомы монобрахиальной гомологии не только создавать эффект изоляции, но и вызывать определенную направленность эволюции кариотипа вида?
Следствием направленности кариотипической эволюции может быть возникновение идентичных или сходных хромосомных рас в различных частях ареала вида. Первые удивительно сходные хромосомные расы (Новосибирск в Западной Сибири и Białowieża в бассейне Вислы) были описаны в 1970-х гг. (Král, Radjabli, 1974; Fredga, Nawrin, 1977), но с тех пор не удавалось реконструировать эволюцию кариотипов подобных рас, чтобы доказать их параллельное формирование.
В статье представлено описание новой хромосомной расы из Беларуси с кариотипом, идентичным с расой Томск из Западной Сибири, приводятся доказательства параллельной эволюции этих рас и предложена модель направленной эволюции кариотипов.
МАТЕРИАЛЫ И МЕТОДЫ
Изучены кариотипы 15 бурозубок (9 самок и 6 самцов), отловленных в июле 2014 г. и сентябре 2015 г. в трех пунктах в междуречье Днепра и Сожи восточнее города Могилев (рис. 1). Бурозубки населяют перемежающиеся лесные и луговые биотопы и антропогенные ландшафты.
Рис. 1.
Пункты отлова бурозубок (обозначены звездочками) и ареалы хромосомных рас: Октябрьский (Ok), Светлогорск (Sv), Борисов (Bs), Лепель (Le), Гомель (Gm) (обведены пунктиром из точек) и рас Białowieża (Bi), Kiev (Ki), Нерусса (Ne) и Западная Двина (Wd) (обведены пунктиром из черточек). Распространение хромосомных рас (по Borisov et al., 2017 и Kryshchuk et al., 2021). 1, 2, 3 – локалитеты новой хромосомной расы Могилев (номера соответствуют табл. 1). Тонким светлым пунктиром показаны государственные границы.

Хромосомные препараты были приготовлены из клеток костного мозга и селезенки согласно стандартной методике (Ford, Hamerton, 1956). Митотические хромосомы идентифицировали с помощью обработки трипсином с последующим окрашиванием раствором Гимза (Seabright, 1971; Král, Radjabli, 1974). Кариотип каждого экземпляра определяли в соответствии со стандартной номенклатурой хромосом S. araneus (Searle et al., 2010).
В стандартной номенклатуре хромосом обыкновенной бурозубки каждое плечо в метацентрической хромосоме и (или) гомологичный этому плечу акроцентрик обозначают строчной буквой латинского алфавита в соответствии с размерами (а – самый крупный элемент). К стабильной части кариотипа относят половые хромосомы cамок XX (de, de) и самцов X (de), Y1 (s), Y2(d) и три пары метацентрических аутосом (af, bc и tu). Четвертая пара метацентрических аутосом (jl), встречается во всех популяциях вида и служит диагностическим признаком кариотипа обыкновенной бурозубки, отличающим ее от близких видов. В некоторых популяциях изредка встречаются акроцентрические хромосомы j и l.
Полиморфная часть кариотипа вида представлена акроцентриками (максимально 10 пар: g, h, i, k, m, n, o, p, q, r) и (или) метацентриками, возникшими результате различных Rb-соединений (максимально 5 пар). Акроцентрики и метацентрики полиморфной части кариотипа называют диагностическими для хромосомных рас (race-specific). В настоящее время в популяциях обыкновенной бурозубки известны 37 диагностических метацентриков (Bulatova et al., 2019). В кариотипах популяций число аутосом варьирует от 18 (5 пар диагностических метацентриков) до 28 (10 пар акроцентриков) со всеми возможными промежуточными значениями.
На ареале обыкновенной бурозубки выделяют хромосомные расы – группы географически смежных или недавно изолированных популяций, которые имеют общий по происхождению набор акроцентрических и метацентрических хромосом (Hausser et al., 1994). В тексте статьи для хромосомных рас, включенных в последний обзор хромосомных рас обыкновенной бурозубки (Bulatova et al., 2019), ссылки на первоописания рас не приводятся.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Кариотип новой хромосомной расы Могилев
Все исследованные особи имели кариотипы, типичные для обыкновенной бурозубки, в том числе половые хромосомы самца XY1Y2 (рис. 2). Из аутосом четыре крупных метацентрика af, bc, hi и jl, а также мелкий tu мономорфные. Три диагностических метацентрика g/k, m/n и q/r полиморфные, но в самой северной выборке 3 (Дрибин) все Rb-соединения фиксированы (табл. 1). Имеются также две пары акроцентриков, о и р.
Рис. 2.
G-окрашенный кариотип самца (2n = 23) новой хромосомной расы Могилев (Дрибин, Могилевская обл.).

Таблица 1.
Кариотипические варианты новой хромосомной расы Могилев в междуречье Днепра и Сожи, Могилевская обл., Беларусь (номера пунктов соответствуют карте, рис. 1)
| № | Пункты | Широта; долгота | n | 2n | Диагностические хромосомы |
|---|---|---|---|---|---|
| 1 | Cидоровичи | 53°40′55′′; 30°23′1′′ | 2 | 23 | g/k, hi, mn, o, p, q, r |
| 1 | 24 | g/k, hi, m/n, o, p, q, r | |||
| 1 | 24 | g/k, hi, m, n, o, p, q/r | |||
| 2 | Чаусы | 53°50′42′′; 30°40′1′′ | 1 | 21 | gk, hi, mn, o, p, q/r |
| 1 | 22 | g/k, hi, mn, o, p, q/r | |||
| 1 | 23 | gk, hi, m/n, o, p, q, r | |||
| 1 | 24 | g/k, hi, m/n, o, p, q, r | |||
| 3 | Дрибин (Типовое местонахождение новой расы) |
54°12′00′′; 30°49′00′′ | 1 | 21 | gk, hi, mn, o, p, q/r |
| 1 | 20 | gk, hi, mn, o, p, qr | |||
| 2 | 21 | gk, hi, mn, o, p, q/r | |||
| 1 | 21 | gk, hi, mn, o, p, q/r | |||
| 1 | 22 | gk, hi, mn, o, p, q, r | |||
| 1 | 22 | gk, hi, mn, o, p, q, r |
Ниже приведено описание новой расы в соответствии с правилами ISACC:
Название: Могилев [Mogilev] (Mg).
Кариотип: ХХ/ХY1Y2, af, bc, g/k, hi, jl, m/n, o, p, q/r, tu.
Типовое местонахождение: Дрибин, Могилевская обл., Беларусь.
Ареал: междуречье Днепра и Сожи, Могилевская обл., Беларусь, 54°12′00′′; 30°49′00′′. Расстояния между крайними пунктами отлова 65 км. Кариотип новой расы Могилев (g/k, hi, m/n, q/r, o, p) оказался идентичен расе Томск (gk, hi, mn, qr, o, p). Эта раса населяет обширную территорию междуречья Оби и Енисея и распространена на правом восточном берегу Енисея. Гипотеза происхождения расы Могилев будет рассмотрена в разделе “Происхождение сходных, но географически удаленных хромосомных рас”.
Модель направленной эволюции кариотипов
Во Введении мы отмечали, что сравнительный анализ кариотипов видов рода Sorex давно привел к обоснованному выводу о накоплении метацентрических хромосом в исходно акроцентрических кариотипах видов этого рода. Все многообразие хромосомных рас обыкновенной бурозубки также возникло в результате постепенного накопления в популяциях Rb-соединений.
Кариотип с 10 парами акроцентрических аутосом и четырьмя парами метацентрических (2n = 28) рассматривают в качестве исходного, предкового для всех хромосомных рас обыкновенной бурозубки, в котором акроцентрические хромосомы постепенно замещались метацентрическими (Volobouev, Catzeflis, 1989; Wójcik et al., 2002; Bulatova et al., 2019). На такое направление эволюции кариотипа указывают известные процессы распространения Rb-cоединений в современных популяциях обыкновенной бурозубки с акроцентрическими хромосомами.
Процесс последовательного замещения 10 пар акроцентрических хромосом пятью парами метацентрических в эволюции обыкновенной бурозубки мы называем “Робертсоновской (Rb) цепью”. Эта цепь состоит из пяти последовательных замен акроцентрических хромосом метацентрическими или пяти этапов. В формировании Rb-цепи не имеет значения, в результате каких хромосомных перестроек возникают Rb-соединения, а также появляются ли они в данной популяции или распространяются из соседних популяций.
Направленность эволюции кариотипа возникает из-за неспособности Rb-cоединений с плечами неполной (монобрахиальной) гомологии распространяться в одной популяции. Поэтому Rb-соединение в силу каких-то случайных событий первым появившееся в популяции, в значительной мере определяет дальнейшую эволюцию кариотипа этой популяции. На каждом этапе Rb-цепи сохраняется возможность дивергенции, которая уменьшается в направлении от первой до третьей замены акроцентриков.
После третьей замены акроцентрических хромосом метацентрическими, замена 4 пар оставшихся акроцентриков допускает образование не более трех кариотипов с пятью диагностическими метацентриками, поэтому цепь имеет форму трезубца. Эти конечные кариотипы можно предсказать, независимо от того, в результате каких перестроек возникают метацентрические хромосомы (Rb-соединения или WART).
Ранее, термин “цепь” и “цепные процессы” (сhain processes) замещения акроцентрических хромосом метацентрическими использовал М. Уайт, постулируя роль Rb-соединений в защите от разрушения коадаптированных комплексов генов в модели симпатрического видообразования (White, 1978).
Последовательность случайных событий возникновения и распространения Rb-мутаций в популяциях имеет сходство с “цепью Маркова” (Орлов и др., 2008). В математике цепью Маркова называют последовательности случайных событий, где вероятность наступления каждого события зависит только от состояния, достигнутого в предыдущем событии. Математический аппарат, получивший название цепей Маркова, был разработан математиком А.А. Марковым (старшим) в работе 1906 г. и широко используется в прикладной математике и информатике (Meyn, Tweedie, 1993).
Наша реконструкция эволюции кариотипов основана на сопоставлении хромосомных рас с исходными, промежуточными и конечными кариотипами, как это и принято в кариологии обыкновенной бурозубки (Searle, 1984; Wójcik, 1993). В реконструкции филогенетических связей хромосомных рас мы используем не только сходство, но и общепринятый в эволюционной биологии принцип общности происхождения. Например, общность происхождения хромосомных рас, сходных по двум–трем диагностическим метацентрикам из пяти, можно подтвердить сохранившимися хромосомными расами с двумя–тремя такими метацентриками. “Общность происхождения и есть та скрытая связь, которую бессознательно ищут натуралисты … 〈поэтому〉 … расположение группы внутри каждого класса …должно быть строго генеалогическим” (Дарвин, 1987, с. 304).
Возможность разделения метацентрической хромосомы на две телоцентрические несомненна, но нет каких-либо конкретных данных о влиянии мутации fission на процессы накопления метацентрических хромосом в кариотипах обыкновенной бурозубки. Получены данные, подтверждающие разделения метацентрика jl (Жданова и др., 2009; Searle et al., 2010), следовательно, возможна и роль таких процессов в поддержании полиморфизма jl/j, l в популяциях обыкновенной бурозубки. Возникновения новых акроцентриков из метацентриков (мутация fission), так же как и новых метацентриков (мутация WART), возможны в мейозе I комплексных гетерозигот в гибридных зонах (Searle, 1988; Fedyk et al., 2019). Обнаружена гетерозигота g/m в мономорфной хромосомной расе Москва вблизи узкой гибридной зоны Москва/Селигер (Bulatova et al., 2000), следовательно, мутация fission способна распространяться из гибридных зон.
В настоящее время известны многие популяции обыкновенной бурозубки с 6–10 парами акроцентриков в кариотипах. В то же время отсутствуют данные, позволяющие говорить о вторичном возникновении таких популяций (из популяций с метацентрическими хромосомами). В бассейне Днепра на территории Беларуси описаны популяции обыкновенной бурозубки, возникшие в процессах гибридизации популяций с 10 парами диагностических акроцентриков и рас с метацентрическими хромосомами, расы Bobruysk (h/i), Turov (h/k) (Mishta et al., 2000), Cветлогорск (h/i, k/o), Борисов (g/m, h/k, n/o, q/r), Октябрьский (h/n, i/k), Гомель (hi, k/r, m/n) (Borisov et al., 2010, 2014, 2016, 2017). Метацентрические хромосомы заимствованы в таких гибридных кариотипах из рас Białowieża, Kiev, Нерусса и Западная Двина. На частотах кариотипов приведены доказательства именно гибридного, а не какого-либо иного происхождения таких полиморфных популяций (Kryshchuk et al., 2021). Подобный “реверс” кариотипической эволюции не приводит к равновесию fusion/fission процессов, напротив, такие процессы гибридизации ведут к исчезновению акроцентрических рас.
В обсуждении предложенной модели направленной эволюции кариотипа обыкновенной бурозубки крайне важен вопрос о времени формирования современных хромосомных рас. По вопросу о времени формирования хромосомных рас в литературе встречаются разные мнения. По митохондриальным маркерам не обнаружено значительной молекулярной диверсификации хромосомных рас (Ratkiewicz et al., 2002; Andersson et al., 2005). Поэтому в современной кариологической литературе часто встречается утверждение о “молодости” хромосомных рас обыкновенной бурозубки; их формирование относят к голоцену (последним 10 тыс. л.). Но сходство хромосомных рас по митохондриальным маркерам может быть следствием значительной проницаемости гибридных зон для нейтральных молекулярных мутаций (Horn et al., 2012).
В то же время разными авторами неоднократно отмечалась роль малых популяций ледниковых рефугиумов в эволюции хромосомных рас обыкновенной бурозубки как для европейских (Орлов и др., 2007, 2008; Searle, 1984; Brünner et al., 2002; Orlov et al., 2007), так и сибирских популяций (Поляков и др., 2001). Такой подход значительно увеличивает время формирования хромосомных рас, поскольку последнее оледенение, Валдайское, охватывает значительный интервал времени (приблизительно 100–10 тыс. л. н.).
Оценивая время формирования хромосомных рас, следует помнить о надежно установленном палеонтологическом возрасте обыкновенной бурозубки (как морфологического вида, включая все близкие хромосомные виды), известной в Европе на протяжении всего плейстоцена, последних 2 млн л. Отделение предковой формы S. araneus (sensu lato) от общего ствола с S. daphaenodon Thos. произошло 2.0 (2.97–1.19) млн л. н. по филогеографическим данным, а обособление S. araneus L. и S. granarius Miller от других близких видов (S. coronatus Millet, S. satunini Ogn. и S. antinorii Bon.) – 0.99 (1.46–0.58) млн л. н. Почти одновременно датируется обособление S. araneus и S. granarius – 0.80 (1.19–0.46) (Mackiewicz et al., 2017). В задачи настоящей статьи не входит обсуждение крайне сложных вопросов возникновения близких хромосомных видов в группе S. araneus (sensu lato), важно лишь подчеркнуть, что хромосомная эволюция в этой группе продолжалась на протяжении двух миллионов лет.
Хромосомная эволюция S. araneus несомненно началась одновременно с другими близкими ей видами, формировавшимися в плейстоцене. У обыкновенной бурозубки имеются общие диагностические метацентрики хромосомных рас с S. coronatus – gr, kq, mp, c S. satunini – ik, c S. antinorii – gi, всего пять общих метацентриков, что составляет 14% известных Rb-соединений у обыкновенной бурозубки. Поэтому существует и точка зрения о формировании кариотипической изменчивости обыкновенной бурозубки на протяжении всего плейстоцена (Орлов и др., 2017).
В традиционной классификации хромосомных рас обыкновенной бурозубки используют первые замены в Rb-цепях, общие для определенной группы хромосомных рас, в качестве показателя их филогенетического родства. Западноевропейскую кариотипическую группу (WEKG, western European karyotypic group) выделяют по диагностическим метацентрикам hi и gm (Searle, 1984; Searle, Wójcik, 1998), первым двум заменам акроцентрических хромосом на метацентрические. Хромосомные расы этой группы распространены в континентальной Европе, Великобритании, Скандинавии и даже в Восточной Сибири. Расы североевропейской кариотипической группы (NEKG, northern European karyotypic group) с диагностическими метацентриками ip и hn (Wojcik, 1993; Fredga, 1996), первыми заменившими акроцентрические хромосомы, распространены в Фенноскандии, на востоке Восточно-Европейской равнины и на Урале. Восточноевропейская кариотипическая группа (EEKG, eastern European karyotypic group) (Searle, 1984) была выделена по итогам первого десятилетия изучения хромосомных рас и пересматривалась по мере описания новых хромосомных рас. Для этой явно полифилетической группы невозможно предложить какой-либо общий кариотипический критерий, но первые диагностические метацентрики в этой группе также возникали с участием наиболее крупных акроцентриков – g и h. К группе EEKG можно отнести расы Восточно-Европейской равнины (от Вислы до Урала) и Западной Сибири, не входящие в монофилетические группы WEKG и NEKG.
Направленная эволюция кариотипов в западноевропейской кариотипической группе
Накопление диагностических метацентриков в группе WEKG начиналось с участием Rb-соединений наиболее крупных диагностических акроцентриков, g и h. Два метацентрика, gm и hi, общие для хромосомных рас WEKG, указывают на диверсификацию одной плейстоценовой хромосомной расы. Сохранились две реликтовые хромосомные расы с метацентриками hi, gm – Carlit и Ulm. Эволюция этих рас остановилась в плейстоценовых рефугиумах на этапе двух Rb-соединений (рис. 3). В популяции с 10 парами акроцентрических хромосом способно распространяться Rb-соединение любой пары акроцентриков. Несколько ограничены возможности распространения в популяции второго и особенно третьего Rb-соединений, которые не должны быть соединениями монобрахиальной гомологии, соответственно, с первым или с первыми двумя соединениями. В популяциях с двумя метацентриками gm и hi могут распространяться только 14 определенных Rb-соединений, в том числе четыре соединения с относительно крупным акроцентриком k (ko, kp, kq, kr) и 10 – c мелкими акроцентриками, n, o, p, q, r (no, np, nq, nr, op, oq, or, pq, pr, qr). Таким образом, усиливающая направленность эволюции кариотипа становится заметной на этапе распространения в популяциях третьего Rb-соединения.
Рис. 3.
Rb-цепи и филогенетические линии хромосомных рас WEKG. Конечные Rb-цепи обозначены Rb-соединениями первых трех этапов и римскими цифрами. Рамками выделены филогенетические линии одной цепи. Хромосомные расы приведены по (Bulatova et al., 2019).
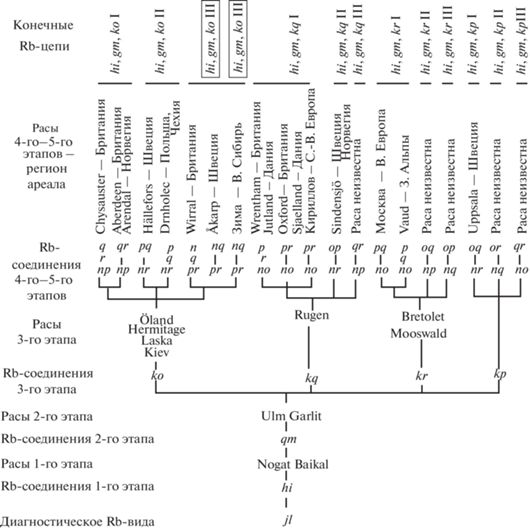
Успешная реконструкция эволюционных преобразований кариотипов в WEKG оказалась возможной благодаря сохранившимся популяциям с тремя метацентриками. Рис. 3 дает представление не только о накоплении хромосомных перестроек в популяциях, но и о вероятной последовательности их включения в кариотип. В современных популяциях Западной Европы сохранились три варианта хромосомных рас с третьим метацентриком (ko, kq и kr) и остановившихся в своей эволюции на этом этапе. Поэтому очень вероятно, что метацентрик kp был третьим в цепи с конечным кариотипом расы Uppsala (рис. 3). Можно лишь предложить, что третьим соединением во всех хромосомных расах группы WEKG оказывалось соединение с акроцентриком k, поскольку это самый крупный акроцентрик среди 6 оставшихся в кариотипе gm, hi (k, n, o, p, q, r). Неоднократно отмечалось участие в Rb-соединениях, в первую очередь, более крупных акроцентрических хромосом, относящихся как к стабильной, так и к изменчивой части кариотипа (Volobouev, 1989; Wójcik et al., 2002).
Дальнейшая эволюция кариотипов, включение четвертого и пятого Rb-соединений, оказывается строго предопределенной и может быть предсказана. Например, в кариотипе с третьим Rb-cоединением ko остаются четыре акроцентрика: n, q, p, r. Следовательно в таких популяциях могут распространяться только 6 Rb-cоединений (nq, np, nr, pq, qr, pr) с образованием всего трех конечных Rb-цепей и трех конечных кариотипов с метацентриками: (np, qr), (nr, pq) и (pr, nq). Любые другие варианты метацентриков оказываются хромосомами непарной гомологии по отношению к первым трем метацентрикам. В современных популяциях сохранились 8 хромосомных рас всех трех возможных конечных Rb-цепей hi, gm, ko (рис. 3).
Аналогично шла эволюция Rb-цепей с метацентриками kq, kr и kp на четвертом–пятом этапах. В популяциях с диагностическими метацентриками hi, gm, kq известны хромосомные расы двух из трех конечных Rb-цепей, а с метацентриками hi, gm, kr и hi, gm, kp – только в одной из трех возможных конечных Rb-цепей, но в плейстоцене могли существовать хромосомные расы и других Rb-цепей, неизвестные в современных популяциях (рис. 3).
Таким образом, исходя из модели направленной эволюции кариотипов в эволюции монофилетической группы WEKG, возможно возникновение только 12 конечных Rb-цепей (кариотипов хромосомных рас) (рис. 3). Кариотипы семи Rb-цепей сохранились в современных популяциях обыкновенной бурозубки, а пять цепей либо оказались нереализованными в эволюции этого вида, либо популяции с такими кариотипами вымерли в плейстоцене.
В системе хромосомного полиморфизма обыкновенной бурозубки часто отмечаются ретикулярные процессы. Например, в хромосомных расах Москва и Кириллов, не связанных общим происхождением, имеются метацентрики no (рис. 3). Общие метацентрики в разных хромосомных расах можно отобразить с использованием “сетевого подхода” (network approach) (White et al., 2010, 2019). Но в этой методике регистрируются только перемещения метацентриков, и возникает впечатление о хаотическом, непредсказуемом их перемещении. В модели направленной эволюции группы WEKG возможность включения общих метацентриков в разные Rb-цепи при четвертой или пятой заменах акроцентрических хромосом на метацентрические (в кариотипах хромосомных рас) оказывается следствием третьей замены – включения Rb-соединений монобрахиальной гомологии с общим плечом k (рис. 4). Но “ниша” для метацентрика – это только потенциальная возможность включения метацентрика, которая хотя и реализуется во многих случаях, но не всегда. Например, в расах Drnholec (цепь gm, hi, ko) и Vaud (цепь gm, hi, kr) метацентрик pq не заменил акроцентрики p и q.
Рис. 4.
Ретикулярная эволюция в группе хромосомных рас WEKG. Рамкой выделены метацентрики, которые входят в конечные кариотипы двух или трех Rb-цепей, отличающихся соединениями монобрахиальной гомологии на третьем этапе (см. рис. 3).

Если предположить, что вся эволюция хромосомных рас происходила в их современных ареалах, то известные ретикулярные процессы в популяциях (White et al., 2010, 2019) окажутся вообще необъяснимыми и невозможными.
Приведенная реконструкция эволюции хромосомных рас группы WEKG основана на дарвиновском принципе родства и полностью отличается от реконструкции филогенетических взаимоотношений видов р. Sorex c использованием методов Байеса (BA) и максимальной парсимонии (Mackiewicz et al., 2017) или сетевого подхода (White et al., 2010, 2019).
В одинаковых кариотипических цепях Rb-соединения могли возникать разными способами, и разные филогенетические линии популяций могут приводить к одинаковым кариотипическим цепям. Было высказано предположение, что среди хромосомных рас Великобритании раса Wirral возникла в гибридной зоне рас Oxford и Aberdeen вследствие реципрокных транслокаций в мейозе гибридов с возникновением метацентрика pr и отбора перестроенных кариотипов, названного Дж. Сирлом “зональным формированием рас” (Searle, 1988). Напротив, метацентрик pr расы Åkarp из Швеции мог возникнуть иным способом, например, в результате центрических соединений акроцентриков и тогда в одной цепи рас hi, gm, ko III возможны разные филогенетические линии (рис. 3).
Гибридное слияние кариотипов хромосомных рас восточноевропейской и западноевропейской кариотипических групп
Из двадцати конечных Rb-цепей группы EEKG по сохранившимся расам возможно реконструировать только одну цепь хромосомных рас: Zuvintas–Goldap–Tallinn (рис. 5) с ареалами в Прибалтике от Гданьского до Финского заливов.
Рис. 5.
Rb-цепи и филогенетические линии хромосомных рас EEKG. Жирным шрифтом выделены метацентрики группы WEKG. Знаком “Х” показан этап Rb-цепи, на котором завершалась кариотипическая эволюция включением Rb-cоединений из 7 определенных Rb-цепей группы WEKG (см. рис. 3).

Реконструкция формирования кариотипов остальных рас возможна только по общим метацентрикам в кариотипах. Так же, как и в расах WEKG, кариотипическая диверсификация восточноевропейских хромосомных рас начиналась с участием Rb-соединений наиболее крупных диагностических акроцентриков g или h. В 14 Rb-цепях среди первых появляются метацентрики монобрахиальной гомологии с участием акроцентрика g (gi, gk, go, gp, gr), что указывает на полифилетическое формирование кариотипов в группе EEKG. В 10 Rb-цепях среди первых отмечены метацентрики hk и hn, а в пяти цепях соединения с акроцентриком g появляются на более поздних этапах формирования цепей или отсутствуют (в расе С.-Петербург) (рис. 5).
Редкая сохранность хромосомных рас на втором–третьем этапах Rb-цепей группы EEKG (в отличие от рас WEKG) связана с одной особенностью эволюции кариотипов, на которую до сих пор кариологи не обращали внимания. В 9 хромосомных расах кариотипическая эволюция начиналась двумя метацентриками, характерными только для группы EEKG, и полностью завершалась тремя метацентриками в каждой расе из какой-то одной расы WEKG (рис. 5 и 6).
Рис. 6.
Гомология диагностических метацентриков 10 восточноевропейских хромосомных рас (группа EEKG) и 7 Rb-цепей западноевропейских рас (группа WEKG) из современных популяций, либо предсказанных, исходя из модели направленной эволюции. Жирным шрифтом выделены хромосомные расы EEKG (см. рис. 3).

Судя по кариотипам современных хромосомных рас EEKG, с ними могли контактировать в плейстоцене хромосомные расы семи кариотипических цепей WEKG, известных в современных популяциях или предсказанных, исходя из модели направленной эволюции (рис. 3). В пяти хромосомных расах группы EEKG (Печора, Мантурово, Молога, Пенза, Нерусса) сохранились метацентрики двух Rb-цепей hi, gm, kq I и hi, gm, kr I группы WEKG, многие хромосомные расы которых известны в Западной и Восточной Европе (рис. 5 и 6). В двух хромосомных расах, Псков и Ягры, сохранились метацентрики Rb-цепей hi, gm, kq II и hi, gm, kp I, современные хромосомные расы которых известны только в Западной Европе (Sidensjö, Uppsala) (рис. 5 и 6). В кариотипах рас Лепель, Западная Двина и Канин остались метацентрики еще трех Rb-цепей WEKG, предсказанных моделью направленной эволюции (hi, gm, kp II, hi, gm, kp III и hi, gm, kq III) (рис. 5 и 6), поэтому не исключено, что расы этих цепей вымерли в плейстоцене.
В этой реконструкции формирования восточноевропейских рас много предположений, как и в любой реконструкции прошлой эволюции популяций и таксонов. Но то, что в кариотипе расы Мантурово обнаруживаются три метацентрика расы Кириллов, а в расах Молога и Нерусса – по три метацентрика расы Москва (рис. 6) невозможно объяснить накоплением случайных Rb-мутаций.
Безусловно, подобные гибридогенные процессы невозможны в современных ареалах хромосомных рас. Но включение в кариотипы шести хромосомных рас Восточной Европы сразу трех метацентриков в каждую из определенных рас WEKG, которых нет в современных популяциях Восточной Европы, не имеет иного объяснения кроме предположения, что в прошлом в Восточной Европе существовали и другие хромосомные расы из группы WEKG, кроме двух сохранившихся в настоящее время.
В эволюции климата Земли за последние 420 тыс. л. отмечено пять глобальных потеплений и четыре глобальных похолодания (оледенений) (Petit et al., 1999), а за последний миллион лет обыкновенная бурозубка пережила не менее десятка подобных изменений климата. Поскольку оледенения различались по охваченной площади и продолжительности, то изменялось и расположение рефугиумов, а, следовательно, и ареалы хромосомных рас в каждое последующее теплое межледниковье.
С высокой вероятностью можно предположить, что хромосомные расы WEKG расселились в Восточной Европе в одно из теплых межледниковий после особенно обширного оледенения, сократившего ареалы популяции местных рас. Ко времени расселения в Восточной Европе расы WEKG завершили кариотипическую эволюцию включением пяти пар диагностических метацентриков, в то время как расы группы EEKG находились на начальном этапе накопления Rb-соединений, сохраняя до шести пар акроцентриков в кариотипе.
Распространение Rb-соединений в популяциях с акроцентрическими хромосомами могло произойти относительно быстро, за время одного теплого межледниковья, и не оставить промежуточных форм. Поэтому начавшаяся самостоятельная кариотипическая эволюция многих популяций EEKG была прервана распространением в популяциях Rb-соединений западноевропейских хромосомных рас.
В современных популяциях обыкновенной бурозубки с акроцентрическими хромосомами известны совершенно аналогичные процессы распространения Rb-соединений в бассейнах Вислы (Wójcik, 1993; Fedyk et al., 2000) и Днепра (Borisov et al., 2017; Kryshchuk et al., 2021) и в Скандинавии (Fredga, 2007).
Направленная эволюция кариотипов cевероевропейской кариотипической группы
По составу диагностических метацентриков эта группа не отличается от рас восточноевропейской группы, поэтому ее можно рассматривать как монофилетическую группу в составе EEKG. Сохранилась только одна островная раса, Lemland, с единственным диагностическим метацентриком ip, выжившая после расширения акватории Балтийского моря в голоцене (рис. 7). Сходство остальных рас этой группы по двум метацентрикам ip и hn указывает на то, что в плейстоцене могла существовать раса с двумя метацентриками, от которой и началась кариотипическая диверсификация популяций.
Рис. 7.
Rb-цепи и филогенетические линии хромосомных рас NEKG (см. рис. 3 и 5). Жирным шрифтом выделены метацентрики группы NEKG.

Реконструировать часть Rb-цепей группы NEKG позволяет сохранившаяся раса с тремя метацентриками Ammarnäs (hn, ip, kq), эволюция которой остановилась в плейстоценовых рефугиумах (рис. 7). Включение в кариотип популяций с метацентриками ip и hn третьего метацентрика kq сужает свободную нишу для метацентриков до четырех акроцентриков g, m, o, r. Эту нишу могут занять хромосомные расы не более чем трех конечных Rb-цепей, из которых в настоящее время известны расы двух цепей. К одной относятся расы Hattsjö и Abisko, ко второй – раса Пояконда (рис. 7). Хромосомные расы Карелии еще недостаточно изучены и не исключено, что существует раса из третьей конечной цепи (ip, hn, kq III). Rb-соединение gm могло быть получено расами Hattsjö и Abisko от современных скандинавских рас группы WEKG (Fredga, 1996, 2007). Судя по тому, что в расе Abisko имеется метацентрик or, все западноевропейские Rb-соединения так же могли быть получены в плейстоцене от вымершей хромосомной расы кариотипической цепи hi, gm, kq III (WEKG) (рис. 3).
Реконструкция Rb-цепей остальных шести хромосомных рас основана на трех общих метацентриках в кариотипах: ip, hn, go. В этой группе рас реализованы все три типа возможных конечных Rb-цепей (рис. 7). Следовательно, в соответствии с предложенной моделью направленной эволюции кариотипов в эволюции монофилетической группы NEKG возможно возникновение только шести конечных Rb-цепей с шестью конечными кариотипами.
Происхождение сходных, но географически удаленных хромосомных рас
Расы группы WEKG. В Западной и Центральной Европе известны географически изолированные хромосомные расы с тремя диагностическими метацентриками gm, hi, ko (расы Öland, Hermitage, Laska и Kiev). Современные изолированные ареалы этих рас могли остаться от обширной хромосомной расы, существовавшей в плейстоцене или в начале голоцена, до возникновения современной акватории Северного и Балтийского морей. Также вероятно, что реликтовые ареалы рас Rügen (hi, gm, kq) и Mooswald, Bretolet (hi, gm, kr) (рис. 3) также могли быть значительно обширнее современных.
Можно предположить независимое, параллельное, формирование кариотипов таких географически удаленных рас, как расы Sjaelland (Дания) и Кириллов (Сев.-Вост. Европа) или Vaud (Зап. Альпы) и Москва (Вост. Европа) (рис. 3). Но именно в Западной Европе обнаруживаются начальные этапы формирования этих рас, популяции с тремя диагностическими метацентриками (gm, hi, kq – раса Rugen; gm, hi, kr – расы Bretolet и Mooswald). Именно в Западной Европе был центр возникновения большой современной группы WEKG. Поэтому более вероятно, что у таких географически удаленных хромосомных рас имелся общий центр происхождения в Западной Европе, и современная географическая изоляция таких идентичных рас оказывается результатом разрыва ареала, а не параллельной эволюции.
Удивительное совпадение кариотипов хромосомных рас Зима из Восточной Сибири и Åkarp из Швеции пока объяснить невозможно. Не исключена возможность независимой эволюции рас группы WEKG в Западной Европе и в Восточной Сибири (Pavlova et al., 2017). Модель направленной эволюции кариотипов повышает вероятность такого предположения, но доказать его удастся, если будут обнаружены другие расы группы WEKG в Восточной Сибири.
Расы группы EEKG. Судя по общим метацентрикам в кариотипах географически удаленных рас Białowieża и Cелигер эти расы дивергировали от одной восточноевропейской популяции с кариотипом из трех пар диагностических метацентриков go, hn, ik и четырех пар акроцентриков, m, p, q, r. В такой популяции возможно распространение только шести Rb-cоединений, mp, mq, mr, pq, pr и qr. Любые другие Rb-соединения окажутся соединениями непарной гомологии, поэтому в дальнейшей кариотипической эволюции возможно образование не более трех конечных кариотипов, go, hn, ik, mq, pr; go, hn, ik, mp, qr и go, hn, ik, mr, pq. В кариотипах хромосомных рас Białowieża и Cелигер реализованы два из трех возможных кариотипов (рис. 5). Следовательно, эти расы родственны между собой в такой же степени, как и любые другие, в эволюции которых обнаруживается предковая хромосомная раса с тремя метацентриками, то есть относящиеся к одной Rb-цепи gm, hi, kq, например, расы WEKG Кириллов (север Европейской России) и Sidensjö (Швеция) (рис. 3).
Сходство рас Новосибирск и Białowieża по трем диагностическим метацентрикам было отмечено еще при описании последней (Fredga, Nawrin, 1977). Формально по числу общих метацентриков эти расы сходны в такой же степени, как и расы Białowieża и Cелигер, но их родство весьма отдаленно. В эволюции этих рас не было общей хромосомной расы с тремя метацентриками, они принадлежат к разным кариотипическим цепям (рис. 5), как, например, расы Arendal (Норвегия) и Кириллов (рис. 3). Общий метацентрик mp рас Białowieża и Новосибирск не связан с филогенетическим родством этих рас, так же как общий метацентрик no в расах Москва и Кириллов (см. выше). Как отмечалось выше, в кариотипах хромосомных рас из разных Rb-цепей могут возникать одинаковые “ниши” для метацентриков, то есть сочетания акроцентриков, поэтому формальное сходство хромосомных рас не всегда правильно отражает их родство.
Ареал расы Могилев образует восточную часть обширного ареала полиморфных популяций (рис. 1). Эти популяции формировались в голоцене в процессах гибридизации популяций с 10 парами акроцентрических хромосом, сохранившихся в рефугиуме бассейна Днепра, и четырех хромосомных рас с метацентрическими хромосомами – Białowieża, Kiev, Западная Двина и Нерусса – расселявшихся каждая из своего рефугиума в Центральной Европе (рис. 1) (Borisov et al., 2017; Kryshchuk et al., 2021).
В последнее оледенение рефугиумы хромосомных рас могли сохраняться по всему современному ареалу вида, а не только в Южной Европе. На максимуме последнего оледенения (24–17 тыс. л. н.) обыкновенная бурозубка отмечена в десятках местонахождений тундро-лесостепного териокомплекса млекопитающих от Франции до Урала, но малая доля костных находок этого вида в местонахождениях (Маркова, Пузаченко, 2008) указывает на мозаичное (рефугиальное) распространение вида.
Так же, как и в других полиморфных расах бассейна Днепра, кариотип расы Могилев формировался в процессах расселения Rb-соединений из окружающих популяций. В непосредственной близости от ареала расы Могилев распространены полиморфные популяции рас Западная Двина (g/m, h/k, i/p, n/o, q/r), Борисов (g/m, h/k, i, n/o, p, q/r), Светлогорск (g, m, h/i, k/o, n, p, q, r), Гомель (g, hi, k/r, m/n, o, p, q) и Нерусса (g/o, hi, k/r, m/n, p/q) (рис. 1) (Bulatova et al., 2000; Borisov et al., 2010, 2016, 2017; Kryshchuk et al., 2021). Cледовательно, ареал расы Могилев окружают полиморфные популяции с 10 Rb-соединениями (gm, go, hi, hk, ip, kr, mn, no, pq, qr), но в предковые популяции этой расы проникли три соединения из окружающих популяций (hi, mn, qr). Именно эти метацентрики проникли в популяции данной расы потому, что остальные метацентрики gm, go, kr и hk оказались соединениями непарной гомологии с gk. Следовательно, соединение gk раньше других появилось в предковых популяциях расы Могилев и в значительной мере предопределило ее дальнейшую кариотипическую эволюцию. Возможно, это соединение имелось в кариотипе популяции из рефугиума.
Метацентрик gk впервые был найден в европейских популяциях обыкновенной бурозубки, а ранее он был известен в пяти хромосомных расах обыкновенной бурозубки Западной и Восточной Сибири (Bulatova et al., 2019). В хромосомных расах Восточной Сибири сохранились возможные этапы формирования расы Томск: Иркутск (gk, hi), Алтай (gk, hi, mn), Томск (gk, hi, mn, qr). Последнее Rb-соединение – qr – раса Томск получила из расы Новосибирск (Polyakov et al., 1996). Идентичные кариотипы рас Могилев и Томск формировались разными путями, но в обоих случаях именно Rb-cоединение gk было первым, и запрет на распространение Rb-соединений непарной с ним гомологии привел к случайному сходству рас Могилев и Томск. Не исключено, что метацентрик gk мог возникать независимо в популяциях Европы и Восточной Сибири.
Расы группы NEKG. Ареал группы рас с хромосомами hn, ip, go разделен на два изолированных участка, с тремя расами в восточной части Фенноскандии и тремя расами на Восточно-Европейской равнине и Урале (рис. 7). Ареалы идентичных по кариотипам рас Kuhmo и Сок, а также Ilomantsi и Юрюзань удалены более чем на тысячу километров, и этот разрыв заполняют современные расы WEKG (Москва, Кириллов) и EEKG (Молога, Мантурово) (карта хромосомных рас (Shchipanov, Pavlova, 2017)).
Разрыв ареалов рас группы NEKG мог возникнуть на одном из этапов плейстоцена после особенно холодного ледниковья. В последующее теплое межледниковье этот разрыв был заселен расами групп WEKG и EEKG. Возможность сохранения популяций обыкновенной бурозубки в рефугиумах ледниковья даже в области ледникового щита Фенноскандии вполне вероятна (Орлов и др., 2007), поскольку критическим фактором для выживания популяций обыкновенной бурозубки оказывается влажность, а не низкие температуры (Shchipanov, Pavlova, 2017), и костные остатки этого вида обнаруживаются во многих местонахождениях максимума последнего ледниковья (Маркова, Пузаченко, 2008).
Rb-соединения западноевропейских рас распространялись не только в популяциях EEKG, но и NEKG (рис. 7). В популяциях североевропейской группы распространялись Rb-cоединения gm, kr, kq и or, которые не были соединениями непарной гомологии с первыми метацентриками в кариотипах NEKG (hn, ip) и которые известны в современных популяциях WEKG. Но соединение qr в расе Серов могло быть получено только из расы конечной цепи hi, gm, kp III (WEKG) (рис. 3). Современные хромосомные расы этой цепи неизвестны, но могли существовать в соответствии с предложенной моделью эволюции кариотипов. Три диагностических Rb-cоединения расы Западная Двина так же могли быть получены только от плейстоценовой расы именно этой цепи (рис. 6). Вполне вероятно, что разрыв ареалов хромосомных рас группы NEKG, расселение в Восточной Европе хромосомных рас группы WEKG и распространение западноевропейских Rb-соединений в популяциях хромосомных рас EEKG и NEKG произошли на одном этапе плейстоценовой эволюции обыкновенной бурозубки. В этом случае завершение кариотипической эволюции идентичных рас Kuhmo – Сок (ip, hn, go, mr, kq) и Ilomantsi – Юрюзань (ip, hn, go, mq, kr) произошло независимо после разрыва ареалов. Поэтому с некоторой вероятностью их можно рассматривать как пример параллельной эволюции в разных филогенетических линиях (рис. 7).
Применима ли модель направленной эволюции к полиморфным популяциям западноевропейской домовой мыши?
Среди европейских млекопитающих накопление Rb-соединений детально изучено также в популяциях западноевропейской домовой мыши. Полагают, что предковым для этой формы был кариотип с диплоидным числом 2n = 40 при 38 телоцентрических аутосомах. Полная Rb-цепь состоит из 9 замен акроцентрических хромосом на метацентрические, например, в расе CD при 2n = = 22 (Capanna et al., 1977).
Домовая мышь расселилась в Западной Европе всего 3000 л. н. (Cucchi et al., 2005). В качестве причин быстрой кариотипической эволюции этого вида указывают структуру популяций, молекулярные особенности перицентромерных районов хромосом и участие не только Rb-соединений, но и транслокаций целых плеч хромосом (WART) (Garagna et al., 2014).
Следует отметить, что организация перицентромерных структур телоцентриков M. m. domesticus и акроцентриков S. araneus неодинакова. В первом случае это минисателлитные последовательности, специфичные для перицентромерных районов (Garagna et al., 2014), а во втором – интерстициальные теломерные повторяющиеся последовательности (ITS) в перицентромерных районах хромосом (Жданова и др., 2009).
Модель направленной эволюции кариотипов применима к любым случаям накопления Rb-соединений в популяциях, но чем длиннее цепь, тем менее выраженным оказывается эффект направленной эволюции. Если у обыкновенной бурозубки все возможные конечные кариотипы в Rb-цепях можно предсказать с третьей замены акроцентрических хромосом на метацентрические, то у домовой мыши – только с седьмой замены. Быстрое накопление Rb-cоединений в малых изолированных популяциях (демах) при большом числе возможных вариантов попарных соединений акроцентриков, достигающем у домовой мыши 171 (Сapanna et al., 1977), ведет к утрате многих промежуточных кариологических форм. В современных популяциях подвида domesticus известны как начальные, так и конечные этапы цепей, но сохранилось слишком мало промежуточных форм для их реконструкции. Поэтому реконструкция Rb-цепей у домовой мыши в настоящее время вряд ли возможна.
ЗАКЛЮЧЕНИЕ
На примерах относительно простых процессов эволюции формы хромосом у обыкновенной бурозубки показано, что запрет распространения в одной популяции Rb-соединений монобрахиальной гомологии формирует направленность эволюции кариотипов популяций в процессах замены 10 пар акроцентрических хромосом на 5 пар метацентрических. Этот запрет вызван пониженной приспособленностью гетерозигот по метацентрическим хромосомам монобрахиальной гомологии, следовательно, направленность эволюции кариотипа обусловлена естественным отбором, именно селектогенез служит причиной ортогенеза. Подтверждается гипотеза Р.Л. Берг (1993) о том, что в эволюции существуют “ограничения, налагающие запрет на движение по всем остальным направлениям”.
Если первые две замены акроцентрических хромосом на метацентрические лишь ограничивают дальнейшую эволюцию кариотипа, то третья замена полностью предопределяет возникновение трех конечных кариотипов, что позволяет предсказывать вероятное существование еще не обнаруженных или вымерших хромосомных рас подобно формам в “гомологических рядах” культурных и дикорастущих злаков по Н.И. Вавилову.
Кариотипические цепи отображают только последовательность включения метацентрических хромосом в кариотип, поэтому в одной кариотипической цепи возможны две и более филогенетических линий, идентичных по кариотипам.
Реконструкция эволюции кариотипа новой хромосомной расы Могилев показала, что формирование идентичных кариотипов этой расы в бассейне Днепра и расы Томск в Западной Сибири происходило параллельно. В процессе направленной эволюции могут независимо возникать сходные или идентичные хромосомные расы. Такие расы аналогичны “градам” (grades) таксонов по Дж. Хаксли (Huxley, 1958), предложенным для обозначения конечных таксонов в родственных, но независимо эволюционировавших линиях, достигших одного адаптивного или структурного уровня.
Постепенная эволюция кариотипических цепей, последовательность замен акроцентрических хромосом на метацентрические, может быть нарушена гибридным слиянием кариотипов двух хромосомных рас с образованием новой хромосомной расы. Такие процессы известны в современных популяциях (Fredga, 2007; Borisov et al., 2017) и прослеживаются в плейстоценовых популяциях обыкновенной бурозубки.
Список литературы
Берг Л.С. Номогенез, или эволюция на основе закономерностей // Теории эволюции, Гл. 5. Петроград: Academia, 1922. С. 82–94.
Берг Р.Л. Генетика и эволюция. Избранные труды. Новосибирск: Наука, 1993. 283 с.
Вавилов Н.И. Закон гомологических рядов изменчивости // Докл. на III Всерос. селекционном съезде в г. Саратове 4 июня 1920. 16 с.
Воронцов Н.Н. Значение изучения хромосомных наборов для систематики млекопитающих // Бюл. МОИП. Отд биол. 1958. Т. 63. № 2. С. 5–86.
Дарвин Ч. Происхождение видов путем естественного отбора. М.: Просвещение, 1987. 383 с.
Жданова Н.С., Рогозина Ю.И., Минина Ю.М. и др. Распределение теломерной ДНК в хромосомах обыкновенной бурозубки (Sorex araneus, Eulipotyphla) // Цитология. 2009. Т. 51. № 7. С. 577–584.
Иваницкая Е.Ю. Хромосомные числа и краткие морфологические характеристики кариотипов млекопитающих / Ред. В.Н. Орлов, Н.Ш. Булатова. Сравнительная цитогенетика и кариосистематика млекопитающих. М.: Наука, 1983. С. 171–403.
Маркова А.К., Пузаченко А.Ю. Комплексы млекопитающих максимальной стадии последнего оледенения (Last Glacial Maximum – LGM) (<=24 – >=17 тыс. л. н.) // Эволюция экосистем Европы при переходе от плейстоцена к голоцену (24–8 тыс. л. н.) / Ред. А.К. Маркова, Т. ван Кольфсхотен. М.: КМК, 2008. С. 91–116.
Орлов В.Н. Кариосистематика млекопитающих. М.: Наука, 1974. 207 с.
Орлов В.Н., Козловский А.И., Балакирев А.Е., Борисов Ю.М. Эндемизм хромосомных рас обыкновенной бурозубки Sorex araneus L. и возможность сохранения рефугиумов в области покровного оледенения Поздневалдайской эпохи // Докл. РАН. 2007. Т. 416. № 6. С. 727–730.
Орлов В.Н., Козловский А.И., Балакирев А.Е., Борисов Ю.М. Процессы фиксации метацентрических хромосом в популяциях обыкновенной бурозубки Sorex araneus L. Восточной Европы // Генетика. 2008. Т. 44. № 5. 581–593.
Орлов В.Н., Черепанова Е.В., Кривоногов Д.М. и др. Зональные и рефугиальные этапы в эволюции видов: пример обыкновенной бурозубки, Sorex araneus L. (Soricidae, Soricomorpha) // Успехи соврем. биол. 2017. Т. 138. № 2. С. 119–134.
Поляков А.В., Панов В.В., Ладыгина Т.Ю. и др. Хромосомная эволюция обыкновенной бурозубки Sorex araneus L. в послеледниковое время на Южном Урале и в Сибири // Генетика. 2001. Т. 37. № 4. С. 448–455.
Шмальгаузен И.И. Проблемы дарвинизма. Л.: Наука, 1969. 493 с.
Andersson A.-C., Alström-Rapaport C., Fredga K. Lack of mitochondrial DNA divergence between chromosome races of the common shrew, Sorex araneus, in Sweden. Implications for interpreting chromosomal evolution and colonization history // Mol. Ecol. 2005. V. 14. P. 2703–2716.
Baker R.J., Bickham J.W. Karyotypic evolution in bats: evidence of extensive and conservative chromosomal evolution in closely related taxa // Syst. Zool. 1980. V. 29 (1). P. 239–254.
Baker R.J., Bickham J.W. Speciation by monobrachial centric fusions // PNAS USA. 1986. V. 83. P. 8245–8248.
Bickham J.W., Baker R.J. Canalization model of chromosomal evolution // Models and methodologies in evolutionary theory / Bull. Carnegie Museum of Natural History. 1979. V. 13. P. 70–84.
Biltueva L.S., Perelman P.L., Polyakov A.V. et al. Comparative chromosome analysis in three Sorex species: S. raddei, S. minutus and S. caecutiens / Acta Theriol. 2000. V. 45. Suppl. 1. P. 119–130.
Borisov Yu.M., Cherepanova E.V., Orlov V.N. A wide hybrid zone of chromosome races of the common shrew, Sorex araneus Linnaeus, 1758 (Mammalia), between the Dnieper and Berezina Rivers (Belarus) // Comp. Cytogen. 2010. V. 3 (2). P. 195–201.
Borisov Yu.M., Kryshchuk I.A., Cherepanova E.V. et al. Chromosomal polymorphism of populations of the common shrew, Sorex araneus L., in Belarus // Acta Theriol. 2014. V. 59 (2). P. 243–249.
Borisov Yu.M., Gaiduchenko H.S., Cherepanova E.V. et al. The clinal variation of metacentric frequency in the populations of the common shrew, Sorex araneus L., in the Dnieper and Pripyat interfluve // Mamm. Res. 2016. V. 61. P. 269–277.
Borisov Yu.M., Kryshchuk I.A., Gaiduchenko H.S. et al. Karyotypic differentiation of populations of the common shrew Sorex araneus L. (Mammalia) in Belarus // Comp. Cytogen. 2017. V. 11 (2). P. 359–373.
Brünner H., Turni H., Kapischke H-J. New Sorex araneus karyotypes from Germany and the postglacial recolonization of central Europe // Acta Theriol. 2002. V. 47 (3). P. 277–293.
Bulatova N.S., Biltueva L.S., Pavlova S.V. Chromosomal differentiation in the common shrew and related species // Shrews, chromosomes and speciation (Cambridge studies in morphology and molecules: new paradigms in evolutionary bio) / Eds. J. Searle, P. Polly, J. Zima. Chapter 5. Cambridge: Cambridge Univ. Press, 2019. P. 134–184.
Bulatova N., Searle J.B., Bystrakova N. et al. The diversity of chromosome races in Sorex araneus from European Russia // Acta Theriol. 2000. V. 45 (Suppl. 1). P. 33–46.
Capanna E. Robertsonian numerical variation in animal speciation: Mus musculus an emblematic model // Mechanism of Speciation / Ed. C. Barigozzi. New York: Alan Liss, 1982. P. 155–177.
Capanna E., Castiglia R. Chromosomes and speciation in Mus musculus domesticus // Cytogen. Gen. Res. 2004. V. 105. P. 375–384.
Capanna E., Civitelli M.V., Cristaldi M. Chromosomal rearrangement, reproductive isolation and speciation in mammals. The case of Mus musculus // Bolletino di Zool. 1977. V. 44. P. 213–246.
Cucchi T., Vigne J.D., Auffray J.-C. First occurrence of the house mouse (Mus musculus domesticus Schwarz et Schwarz, 1943) in the western Mediterranean: a zooarchaeological revision of sub-fossil house mouse occurrences // Biol. J. Linn. Soc. 2005. V. 84. P. 429–445.
Cytotaxonomy and vertebrate evolution / Eds A.B. Chiarelli, E. Capanna. L.: Academic Press, 1973. 783 p.
Fedyk S., Pavlova S.V., Chętnicki W., Searle J.B. Chromosomal hybrid zones // Shrews, chromosomes and speciation // Cambridge studies in morphology and molecules: new paradigms in evolutionary bio / Eds J. Searle, P. Polly, J. Zima. Chapter 8. Cambridge: Cambridge Univ. Press, 2019. P. 271–312.
Fedyk S., Banaszek A., Chętnicki W. et al. Reassessment of the range of the Drnholec race: studies on meiosis in Sorex araneus hybrids // Acta Theriol. 2000. V. 45 (Suppl. 1). P. 59–67.
Ford C.E., Hamerton J.L. A colchicine hypotonic citrate, squash sequence for mammalian chromosomes // Stain Technol. 1956. V. 31. P. 247–251.
Fredga K. The chromosome races of Sorex araneus in Scandinavia // Hereditas. 1996. V. 125. P. 123–135.
Fredga K. Reconstruction of the postglacial colonization of Sorex araneus into northern Scandinavia based on karyotype studies, and the subdivision of the Abisko race into three // Rus. J. Theriol. 2007. V. 6. P. 85–96.
Fredga K., Nawrin J. Karyotype variability in Sorex araneus L. (Insectivora, Mammalia) // Chrom. Today. 1977. V. 6. P. 153–161.
Garagna S., Page J., Fernandez-Donoso R. The Robertsonian phenomenon in the house mouse: mutation, meiosis and speciation // Chromosoma. 2014. V. 123. 529–544.
Hausser J., Fedyk S., Fredga K. et al. Definition and nomenclature of chromosome races of Sorex araneus // Folia Zoologica. 1994. V. 43 (Suppl. 1). P. 1–9.
Horn A., Basset P., Yannic G. et al. Chromosomal rearrangements do not seem to affect the gene flow in hybrid zones between karyotypic races of the common shrew (Sorex araneus) // Evolution. 2012. V. 66. P. 882–889.
Hsu T.C., Benirschke K. An atlas of mammalian chromosomes. V. 1–10. Berlin–Heidelberg–New York: Springer, 1967–1977.
Huxley J.S. Evolutionary process and taxonomy, with special reference to grades // Uppsala Univ. Arsskr. 1958. № 6. P. 21–39.
Král B., Radjabli S.I. Banding patterns and Robertsonian fusion in the western Siberian population of Sorex araneus (Insectivora, Soricidae) // Zoologické Listy. 1974. V. 23. P. 217–227.
Kryshchuk I.A., Orlov V.N., Cherepanova E.V., Borisov Yu.M. Unusual chromosomal polymorphism of the common shrew, Sorex araneus L., in southern Belarus // Comp. Cytogen. 2021. V. 15 (2). P. 159–169.
Mackiewicz P., Moska M., Wierzbicki H. et al. Evolutionary history and phylogeographic relationships of shrews from Sorex araneus group // PLoS One. 2017. V. 12. P. e0179760.
Meyn S.P., Tweedie R.L. Markov chains and stochastic stability. 2nd ed. L.: Springer-Verlag, 1993. 566 p.
Mishta A.V., Searle J.B., Wójcik J.M. Karyotypic variation of the common shrew Sorex araneus in Belarus, Estonia, Latvia, Lithuania and Ukraine // Acta Theriol. 2000. V. 45 (Suppl. 1). P. 47–58.
Orlov V.N., Kozlovsky A.I., Okulova N.M., Balakirev A.E. Postglacial recolonisation of European Russia by the common shrew Sorex araneus // Rus. J. Theriol. 2007. V. 6 (1). P. 97–104.
Pavlova S.V., Borisov S.A., Timoshenko A.F., Sheftel B.I. “European” race-specific metacentrics in East Siberian common shrews (Sorex araneus): a description of two new chromosomal races, Irkutsk and Zima // Comp. Cytogen. 2017. V. 11. P. 797–806.
Petit J.R., Jouzel J., Raunaud D. et al. Climate and atmospheric history of the past 420,000 years from the Vostok ice core, Antarctica // Nature. 1999. V. 399. P. 429–436.
Polyakov A.V., Volobouev V.T., Borodin P.M., Searle J.B. Karyotypic races of the common shrew (Sorex araneus) with exceptionally large ranges: the Novosibirsk and Tomsk races of Siberia // Hereditas. 1996. V. 125. P. 109–115.
Ratkiewicz M., Fedyk S., Banaszek A. et al. The evolutionary history of the two karyotypic groups of the common shrew, Sorex araneus, in Poland // Heredity. 2002. V. 88. P. 235–242.
Seabright M. A rapid banding technique for human chromosomes // Lancet. 1971. V. 11. P. 971–972.
Searle J.B. Three new karyotypic races of the common shrew Sorex araneus (Mammalia: Insectivora) and a phylogeny // Syst. Zool. 1984. V. 33. P. 184–194.
Searle J.B. Karyotypic variation and evolution in the common shrew // Kew chromosome conference III / Ed. P.E. Brandham. L.: HMSO, 1988. P. 97–107.
Searle J.B., Wójcik J.M. Chromosomal evolution: the case of Sorex araneus // Evolution of shrews / Ed. J.M. Wójcik, M. Wolsan, M. Białowieza. Poland: Mammal Research Institute, 1998. P. 219–268.
Searle J.B., Fedyk S., Fredga K. et al. Nomenclature for the chromosomes of the common shrew (Sorex araneus) // Comp. Cytogenet. 2010. V. 4. P. 87–96.
Shchipanov N.A., Pavlova S.V. Density-dependent processes determine the distribution of chromosomal races of the common shrew Sorex araneus (Lipotyphla, Mammalia) // Mamm. Res. 2017. V. 62. P. 267–282.
Shrews, chromosomes and speciation // Cambridge studies in morphology and molecules: new paradigms in evolutionary bio / Eds J. Searle, P. Polly, J. Zima. Cambridge: Cambridge Univ. Press, 2019. 475 p.
Volobouev V.T. Phylogenetic relationships of the Sorex araneus-arcticus species complex (Insectivora, Soricidae) based on high-resolution chromosome analysis // J. Heredity. 1989. V. 80. P. 284–290.
Volobouev V., Catzeflis F. Mechanism of chromosomal evolution in three European species of the Sorex araneus-arcticus group (Insectivora: Soricidae) // Zeitschrift für Zool. Syst. Evol.-Forschung. 1989. V. 27. P. 252–262.
White M.J.D. Chain processes in chromosomal speciation // Syst. Zool. 1978. 27 (3). P. 285–298.
White T.A., Bordewich M., Searle J.B. A network approach to study karyotypic evolution: the chromosomal races of the common shrew (Sorex araneus) and house mouse (Mus musculus) as model systems // Syst. Biol. 2010. V. 59. P. 262–276.
White T.A., Wójcik, J.M., Searle J.B. Phylogenetic relationships of chromosomal races // Shrews, chromosomes and speciation (Cambridge studies in morphology and molecules: new paradigms in evolutionary bio) / Eds. J. Searle, P. Polly, J. Zima. Chapter 6. Cambridge: Cambridge Univ. Press, 2019. P. 186–216.
Wójcik J.M., Searle J.B. The chromosome complement of Sorex granarius – the ancestral karyotype of the common shrew (Sorex araneus)? // Heredity. 1988. V. 61. P. 225–229.
Wójcik J.M. Chromosome races of the common shrew Sorex araneus in Poland: a model of karyotype evolution // Acta Theriol. 1993. V. 38. P. 315–338.
Wójcik J.M., Ratkiewicz M., Searle J.B. Evolution of the common shrew, Sorex araneus: chromosomal and molecular aspects // Acta Theriol. 2002. V. 47 (Suppl. 1). P. 139–167.
Zima J., Kral B. Karyotypes of European mammals I–III // Acta Sci. Nat. Brno. 1984. V. 18 (7). P. 1–51. (8). P. 1–62. (9). P. 1–51.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


