Успехи современной биологии, 2023, T. 143, № 5, стр. 419-429
Солнечный витамин D3 – многоликий, загадочный, необходимый
О. А. Гомазков *
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича
Москва, Россия
* E-mail: oleg-gomazkov@yandex.ru
Поступила в редакцию 20.04.2023
После доработки 22.04.2023
Принята к публикации 27.04.2023
- EDN: SKOQKG
- DOI: 10.31857/S0042132423050046
Аннотация
Рассматривается значение витамина D3 для поддержания уровня здоровья в условиях острой респираторной и сосудистой патологии COVID-19. Физиологический дефицит витамина документируется как негативный прогноз подверженности влиянию вируса и тяжести заболевания. Многие клинические и экспериментальные исследования свидетельствуют, что витамин D3 выполняет функцию контроля гемоваскулярного гомеостаза – эндотелия сосудистой стенки, иммунологических реакций, свертывания и реологических свойств крови, системной гемодинамики и др. Многообразие эффектов определяется транскрипционной ролью рецептора витамина D3, экспрессирующего генные мишени синтеза функциональных белков. Рассматриваются возможности суплементации, поддержания уровня витамина D3 и его химических метаболитов, для профилактической и лечебной стратегии COVID-19.
ВВЕДЕНИЕ
Витамин D: от биоразнообразия к химической структуре
“Солнечный” витамин D3, вероятно, оказывается старейшим гормоном, который описывает почти детективную историю уникального природного синтеза – распространения метаболитов в биологическом мире с нарастающим интересом для здоровья человеческой популяции (Göring, 2018; Holick, 2023).
Ранее исследованный как фактор патофизиологических процессов, связанных с костной тканью и остеопорозом, витамин D ныне привлекает внимание при констатации клинических осложнений, связанных с его дефицитом в организме. Особенно значимым представляется этот аспект в период обострения острых респираторных заболеваний и пандемии COVID-19. При просмотре информационной базы данных PubMed число публикаций по запросу “Vitamin D” в период 2000–2020 гг. вырастает в шесть раз. Ориентиром клинического анализа служат результаты поисковых запросов “Vitamin D insufficiency”, “Vitamin D COVID-19”, “Vitamin D supplementation”.
Экологическая компонента комплекса витамина D3, зависимость от солнечной инсоляции и популяционная генетическая специфичность ассоциируются с клиническими данными пандемии COVID-19. Особенностью заболевания, клинически определяемого как острый респираторный дистресс-синдром (ОРДС), оказывается спектр взаимосвязанных клеточных и молекулярных патологических процессов. В контексте данной статьи рассматриваются свойства метаболитов витамина D3 (холекальциферола) при инфекционном заболевании, вызываемом коронавирусом SARS-CoV-2. Выделяются антибактериальные, иммуномодулирующие и противовоспалительные свойства витамина. В качестве основных компонентов, для контроля которых оказывается важным присутствие витамина D3, рассматриваются факторы гемоваскулярного гомеостаза: функция сосудистого эндотелия, комплекс иммунологических реакций, контроль свертывания и реологических свойств крови, процессы аутофагии для ограничения пермиссивных патогенов и др.
ФАРМАКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ВИТАМИНА D3
Многообразие функциональных мишеней
Исследование витамина D (McCollum, Davis, 1913; Deluca, 2014) открыло группу веществ, которые рассматриваются как система химических соединений, включенных в контроль многих физиологических процессов. Согласно классическому представлению, основная роль витамина D состоит в поддержании уровня кальция и фосфора с влиянием на физиологию костного скелета. Однако экспериментальные и клинические работы последующих десятилетий установили участие витамина D3 и его метаболитов в большом спектре физиологических функций, которые соответствуют его представлению в качестве эндокринного гормона (Геринг, Кожухова, 2015). Эти начальные позиции приобретают масштабную весомость многогранной и необходимой роли компонентов витамина D3 в сложной мозаике патогенеза COVID-19.
Витамин D представляет группу жирорастворимых стероидов, химических метаболитов: эргокальциферол (витамин D2); холекальциферол (витамин D3); кальцифедиол (25-гидроксивитамин D3; 25(OH)D3), кальцитриол (1,25-дигидро-ксивитамин D3; 1,25(OH)2D3). Воздействие ультрафиолетового излучения на кожу стимулирует превращение предшественника 7-дегидрохолестерола в провитамин, который изомеризуется в холекальциферол, витамин D3. Активация витамина происходит у человека преимущественно в печени, а также в проксимальных канальцах почек, в коже, легких, остеоцитах, плаценте, иммунных клетках и др. Витамин D3 связывается особым белком, транспортирующим его в печень, где он метаболизируется в кальцифедиол (25(OH)D3). Эта основная циркулирующая форма используется в исследованиях как тест нормального физиологического уровня: предпочтительный здоровый диапазон составляет 30–60 нг/мл. Такая форма преобразуется в почках в биологически активную форму кальцитриола [1,25(OH)2D3] (рис. 1).
Связь витамина D3 с рецептором, экспрессирующим генные мишени
Отмечается механизм связывания витамина D3 с нуклеарным рецептором, который представляет комплекс транскрипционных молекул, регулирующих экспрессию большого количества генов. У человека рецептор витамина D идентифицирован в сосудистых клетках многих тканей; его распространение отражает большой спектр активности и возможностей регулирующего влияния (Lin et al., 2019). Было установлено, что экспрессия рецептора витамина D регулируется транскрипторными микроРНК, ассоциированными с активностью провоспалительных цитокинов (Ионова и др., 2021). Кальцитриол 1,25(OH)2D3, метаболит витамина D3, взаимодействуя с рецептором, влияет на экспрессию генов с образованием специализированных белков дифференцировки клеток и иммунного ответа, важных в контексте биохимических реакций при патологии. Согласно анализу, представленному (Carlberg, 2017), функциональный профиль генов-мишеней витамина D определяет собственный клеточный фенотип. Следовательно, существует большое разнообразие биологических процессов, регулируемых тканевыми рецепторами для поддержания эндокринных функций витамина D3.
Рецептор витамина D3 рассматривается в качестве особого механизма экспрессии генов. Эти данные подтверждают положение, что при активации рецептора витамина D3 экспрессия гена служит защитой при коронавирусной инфекции. С помощью геномного отслеживания мишеней SARS-CoV-2 было установлено, что витамин D3 при экспрессии определенных генов способствует ограничению негативных реакций ковида, включаясь в коррекцию сопряженных звеньев патогенеза (Glinsky, 2020).
ВИТАМИН D3: ЭНДОКРИННАЯ ПОДДЕРЖКА ГЕМОВАСКУЛЯРНОГО ГОМЕОСТАЗА
Дефицит витамина D3 и/или дисфункция его рецептора в легочном эпителиальном барьере, по-видимому, нарушают защиту, что приводит к усилению повреждений, вызванных цитокиновой агрессией. Роль рецептора витамина была показана в модельных опытах с острой респираторнной патологией, вызываемой липополисахаридом. В экспериментах на мышах с генетическим нокаутом рецептора (то есть нивелированием функции витамина D) отмечались повышенная проницаемость (утечка) легочных сосудов, отек, инфильтрация нейтрофилов, как показателей острого респираторного нарушения. Применение в этих опытах кальцитриола, индуктора рецепторной активности витамина D3, нивелировало картину воспалительного процесса (Kong et al., 2013).
Эндотелий и витамин D3
Функции сосудистого эндотелия придается большое значение, которое оказывается многогранным в патогенезе инфекции SARS-CoV-2 (Гомазков, 2021). Легкие и легочный эндотелий – особое звено, участвующее в первом же цикле кругооборота крови в теле. Здесь синтезируются субстанции, важные для контроля свертывания крови, регуляции тонуса сосудов и артериального давления, трансвазальной функции, метаболического обеспечения мозга, факторы иммунной про- и антивоспалительной систем. Дисрегуляция функций “легочного эндокринного дерева” в легких как первичном звене острой респираторной патологии представляется ключевой в анализе протективной роли витамина D3.
Исследования “доковидного” периода показали, что дефицит витамина D3 ассоциируется с изменениями дилатации сонных артерий – признак, который рассматривается как индикатор эндотелиальной дисфункции и атеросклеротических изменений в сосудах. Этот феномен является типичным для всего ареала сосудистой системы организма (Oz et al., 2013). Доклинические исследования выявили также значение рецепторов витамина D3, активируемых метаболитами 25(OH)D3 и 1,25(OH)2D3. Существенно отметить, что эксперименты продемонстрировали эффекты, которые не зависели от описанного выше геномного механизма, а явились результатом непосредственного влияния витамина D3 на эндотелий.
Таким образом, поскольку витамин D3 и его метаболиты влияют на стабильность эндотелия, негативные корреляции сосудистых заболеваний человека и дефицита витамина D в организме становятся фактом клинической диагностики (Gibson et al., 2015).
Поддержка сердечно-сосудистой функции
Механизмы протективной миссии витамина D охватывают комплекс патофизиологических процессов, которые складываются в единую сеть. Его дефицит связан с различными факторами риска сердечно-сосудистых заболеваний. Рассматривается ряд механизмов, ассоциированных с нарушениями сосудистого эндотелия, аномальная регуляция оксида азота, окислительный стресс. Защитное соучастие витамина D в отношении сердечно-сосудистой системы включает модуляцию иммунной, воспалительной и эндотелиальной функций (Pilz et al., 2016). Такова информационная “подкладка”, которая определяет значимость витамина D3 при нарушении эндотелия и сосудистой системы в целом.
Несколько экспериментальных работ представили доказательства роли витамина D3 в обеспечении нормальной функции сердца. На модели дефицита витамина D3, вызванного нокаутом рецептора витамина или генов 1-α-гидроксилазы, были выявлены структурные изменения миокарда, гипертрофия и снижение сократительной функции. Добавление кальцитриола 1,25(OH)2D3 снижало пролиферацию и гипертрофию кардиомиоцитов (Simpson et al., 2007; Tishkoff et al., 2008).
Витамин D3 и контроль ренин-ангиотензиновой системы
Установлена причастность витамина D3 и его компонентов к контролю комплекса ренин-ангиотензиновой системы (РАС), ответственной за изменения тонуса сосудов, эндотелиального барьера, соотношение свертывающей системы крови и фибринолиза. Витамин D играет важную роль в регуляции целостной системы РАС, влияя на уровень ренина и связанные с ним ферментные комплексы (Han et al., 2022). Длительный недостаток витамина D3 в организме приводит к дисбалансу РАС и основных механизмов контроля артериального давления и трансфузионных процессов (Giménez et al., 2020).
Витамин D3 поддерживает сложную функцию гемоваскулярного гомекинеза за счет влияния на активность ферментов, которые конвертируют ангиотензиноген в активные пептидные блоки различного физиологического назначения (рис. 2). Экспериментально было установлено, что кальцитриол (1,25(OH)2D3) влияет на баланс процессов, ингибируя ренин и далее каскад АСЕ > Ang (1–8) > ATR-1, и, напротив, индуцируя активность позитивной оси ACE2 > Ang-(1–7) > MasR. Следует вывод, что витамин D3 (кальцитриол), влияя на процессы васкулярного гомеостаза, может снизить риск ОРДС (Quesada-Gomez et al., 2022).
Рис. 2.
Влияние метаболитов витамина D3 на функциональные оси ренин-ангиотензиновой системы (по: Quesada-Gomez et al., 2022, адаптировано).
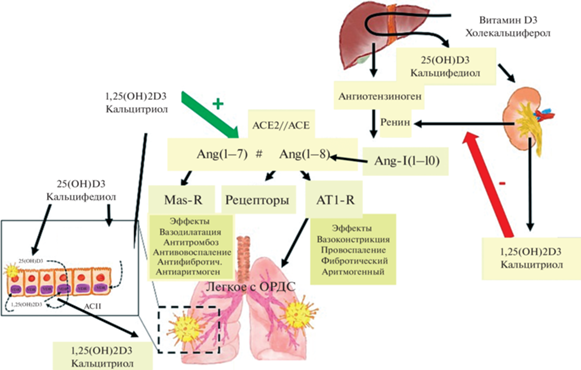
Опыты на мышах с нокаутом рецептора витамина D3 показали, что нивелирование транскрипционного сигнала провоцирует гипертензию и гипертрофию кардиомиоцитов за счет “контрастной” активации ренин-ангиотензиновой системы. Применение ингибитора ангиотензин-превращающего фермента (АПФ) каптоприла или антагониста рецептора ATR-1 снимало эти эффекты (Li et al., 2002).
ИММУНОМОДУЛИРУЮЩАЯ РОЛЬ МОЛЕКУЛЯРНОГО КОМПЛЕКСА ВИТАМИНА D
Витамин D и стратегическая функция иммунной защиты
Значительный список клинических и экспериментальных работ свидетельствует об иммуномодулирующих свойствах витамина D3 и его роли в поддержании системного гомеостаза. Разнообразное влияние витамина D на иммунную систему обозначается как стратегическая функция в защите организма в норме, а также в острой и постковидной формах COVID-19 (Салухов, Ковалевская, 2020; Xu et al., 2020). Новая терапевтическая концепция представляет, в противовес традиционному мнению о примате гиперкальциемии, идею многосторонней миссии витамина D в поддержании иммунной защиты.
Особую роль витамин D3 играет в клеточных и биохимических механизмах защиты врожденного и адаптивного иммунитета. Весомость такой концепции подкрепляется сведениями о присутствии рецепторов витамина D3 в клетках иммунной системы, включающей моноциты и стимулированные макрофаги, естественные клетки-киллеры и активированные В- и Т-клетки клеточной пролиферации и дифференцировки (Lin, White, 2004). Экспрессия рецепторов за счет транскрипционного сигналинга регулирует синтез функционально ориентированных белков, определяющих иммуномодулирующие, дифференцирующие и антипролиферативные функции (Di Rosa et al., 2011).
При анализе роли витамина D3 в защите от инфекции привлекает внимание механизм продуцирования антимикробных и антивирусных белков. Стимулируемый витамином D3 Toll-подобный рецептор за счет кателицидинов и денфенсинов влияет на блокаду трансфекции и репликации инфицирующего агента. Модельные эксперименты на мышах показали, что эти белки могут действовать непосредственно на вирион возбудителя, более того, у инфицированных вирусом мышей установлены более низкие концентрации провоспалительных цитокинов в легких (Liu et al., 2006; Barlow et al., 2011). Последующие исследования описали ген-ассоциированный механизм активированного витамином D синтеза антимикробных и антивирусных белков. Согласно данным (White, 2022), кальцитриол (1,25(OH)2D3) регулирует экспрессию генов за счет их связывания с рецептором витамина D, индуцируя транскрипцию и промотерный синтез β-дефенсина и кателицидина.
Витамин D3 и защитные механизмы при иммунном стрессе
Клинический анализ свидетельствует о влиянии витамина D3 на уровень иммунного стресса при COVID-19. У инфицированных пациентов естественные низкие уровни витамина D ассоциируются с увеличенными рисками вирусных заболеваний и прогрессирующей пневмонией (Jenei et al., 2022). При дефиците витамина D3 фиксируется повышенная активность провоспалительных компонентов патогенеза и, наоборот, снижение защитного иммунного потенциала. Отмечается активация клеточного воспаления, нарушения эндотелиальных и сосудистых барьеров, системное поражение органов (Soltani-Zangbar et al., 2022). Как проявление адаптивного ответа витамин D влияет на баланс субпопуляций Т-хелперов, блокируя эффекторные клетки Th1 и Th17, индуцируя клетки Th2 с усилением клеток Treg (Xu et al., 2020). Этот сценарий иллюстрирует схема влияния витамина D3 на основные звенья врожденного и адаптивного иммунитета (Briceno Noriega, Savelkoul, 2022) (рис. 3).
Рис. 3.
Влияние витамина D3 на основные звенья регуляции иммунной системы (по: Briceno Noriega, 2022, адаптировано).
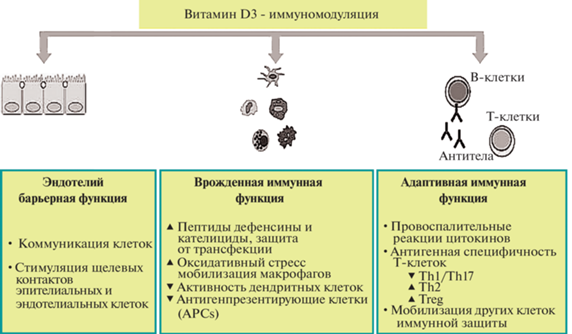
Участие комплекса витамин D3/рецептор служит коррекции иммунного статуса и предупреждению или ограничению острого респираторного заболевания. Благодаря транскрипционным девиациям за счет рецептора витамина D3, включается механизм лабильной регуляции адаптивного иммунитета, который действует как “реостатный переключатель” протективных функций (Adams et al., 2009). Комплекс таких реакций включает: 1) снижение интенсивности цитокинового и хемокинового шторма; 2) влияние на активность нейтрофилов; 3) поддержание целостности легочного эпителиального барьера; 4) коррекцию компонентов ренин-ангиотензиновой системы, влияющих в целом на тонус сосудов и свертывающую систему крови.
Соответствующая демонстрация причастности витамина D3 и его рецептора к различным звеньям патогенеза позволяет предложить идею генного полиморфизма как объяснение универсальности “солнечного” витамина.
Генный полиморфизм как объяснение полифункциональности витамина D3
Констатация данных о том, что большинство структур иммунной системы (включая макрофаги, В- и Т-лимфоциты, нейтрофилы и дендритные клетки) специфически связываются с транскрипционным рецептором, послужила основным аргументом концепции о плейотропном влиянии витамина D3 (Baeke et al., 2010). Новый взгляд на проблему подразумевает генетическую вариабельность влияний витамина D в патогенезе COVID-19. Эта особенность выделяется как генетически обусловленная особенность функционального статуса, значимая для людей с рисками дефицита витамина D. Иммуномодулирующие эффекты рецептора витамина D ограничивают восприимчивость инфекции COVID-19 (Charoenngam et al., 2023).
Принято считать, что факторами, влияющими на содержание в крови витамина D, служат солнечная инсоляция и обогащенная диета, однако, основываясь на клинико-этнографическом материале, следует также учитывать роль генетических факторов, определяющих большую вариабельность фенотипов. Заражение иммунных клеток коронавирусом SARS-CoV-2 может вызывать иммуносупрессию, долговременную персистенцию и распространение вируса на вторичные мишени. В этом смысле витамин D3 служит своеобразным биомаркером здоровья у пациентов острой и пролонгированной стадий COVID-19.
КОВИД-19 И ВИТАМИН D
Патогенез COVID-19: основные черты
Вирусная инфекция SARS-CoV-2 связана с широким спектром клинических нарушений, которые начинаются с верхних дыхательных путей и развиваются как системная полиорганная патология (ОРДС). Одной из основных причин патогенеза служит нарушение защитных функций иммунной системы, представленных как стохастический цито- и хемокиновый стресс. За счет патогенного взаимодействия вирус SARS-CoV-2 нарушает реакции иммунного и гемоваскулярного контроля с расстройством клеточных и органных систем. На фоне ОРДС развиваются поражения сердца, мозга, почек, печени, других органов, осложненные возрастными и коморбидными причинами.
Доказательная база патогенеза COVID-19 строится на изменениях клинических показателей: высокочувствительный С-реактивный белок, отношения нейтрофилов к лимфоцитам, ферритин и D-димер, которые служат принятыми прогностическими биомаркерами. Анализ клинических и патофизиологических данных свидетельствует, что диссонанс множества факторов – регуляторов тонуса сосудов, проницаемости, гемостаза, следует рассматривать как ведущую причину деструктивных процессов в патогенезе СOVID-19. Симптомы, сопутствующие коронавирусной инфекции (высокое артериальная давление, тромбоэмболия, поражения печени, почек, неврологические расстройства и др.), указывают на то, что SARS-CoV-2 индуцирует множество клеточных и биохимических реакций патогенеза. Таким образом, клиническое течение COVID-19 включает фазы последовательно вовлекаемых процессов: а) острая вирусная трансфекция и гиперактивный характер иммунных и провоспалительных реакций; б) локальные или системные нарушения сосудистого эндотелия; в) тромботические осложнения в больших и мелких сосудах; г) тотальный или избирательный тип органных расстройств.
Сравнительный анализ в целом свидетельствует о бόльшей выраженности клинической картины COVID-19 у больных с низким уровнем витамина D3 (Khojah et al., 2022). В этих условиях дефицит витамина D и сниженная активность рецепторной транскрипции генного промоутера подчеркивают восприимчивость вирусной агрессии, тяжесть заболевания и многоплановый характер клеточных и системных дисфункций.
Дефицит витамина D и причастность к некоторым заболеваниям
Дефицит витамина D широко распространен в мире. Анализ публикаций свидетельствует, что около 47% населения в мире имеют показатели умеренного и тяжелого дефицита (Bouillon, 2022). Согласно принятым нормам, нормальный физиологический уровень витамина D определяется как содержание кальцифедиола 25(OH)D3 в крови не ниже 30 нг/мл (75 нмоль/л); недостаточность фиксируется в пределах 20–30 нг/мл (50 нмоль/л); уровень ниже 20 нг/мл рассматривается как выраженный дефицит витамина D3.
Накоплен значительный клинический опыт о корреляции гиповитаминоза D3 и высокой подверженности заболеваниям различной этиологии. Ретроспективные когортные исследования подтверждают связь между дефицитом витамина D3 и клинической историей респираторной патологии: дефицит витамина D служит спутником тяжелой формы ОРДС (Thickett et al., 2015; Dancer et al., 2015). Перечень включает широкий спектр инфекционных заболеваний, аутоиммунные процессы, хроническое клеточное воспаление, сосудистые расстройства, онкологию, пародонтит и др. Низкий уровень витамина D3 часто ассоциируется с патогенезом бактериальных инфекций, гепатитом, расстройствами желудочно-кишечного тракта, другими системными заболеваниями.
Дефицит витамина D как фактор риска при COVID-19
На основании многих данных ставится вопрос о роли витамина D3 как фактора, являющегося причиной острого патогенеза COVID-19. В обзоре клинических наблюдений, включавших более 3600 пациентов среднего возраста, установлено, что дефицит витамина D статистически связан с более высоким риском развития пневмонии. Часть больных с низким уровнем кальцифедиола (≥30 нг/мл) имели бόльшую распространенность гипертонии и сердечно-сосудистых осложнений, аномально высокие уровни тропонина и пиковые уровни D-димера в сыворотке, а также повышенный уровень IL-6 и С-реактивного белка (Chiodini et al., 2021; Ben-Eltriki et al., 2022; Dissanayake et al., 2022). Дефицит/недостаточность витамина D3 рассматривается как сигнал повышенной инфекционной восприимчивости и тяжелой формы патогенеза COVID-19. Это положение имеет определенную закономерность с учетом возрастной категории пациентов (<65 лет) и статуса коморбидности (Jude et al., 2021; Durmuş et al., 2023). Отмечается, что при низком уровне витамина D3 вероятны также неврологические осложнения, особенно выраженные в возрастном контингенте (Gholi et al., 2022).
COVID-19, сосудистая патология и витамин D3
В физиологических исследованиях было установлено, что недостаточность витамина D сопровождается артериальной гипертензией, гипертрофией левого желудочка, повышенной жесткостью артерий. Важным компонентом этого патогенетического комплекса, также связанного с дефицитом витамина D, служит нарушение эндотелия с развитием сосудистого воспаления (Wong et al., 2008; Jablonski et al., 2011). Таким образом, дефицит витамина D на фоне коронавирусной инфекции SARS-CоV-2 становится фактором, усугубляющим преморбидный статус больного. Сообщалось о повышенных уровнях кардиальных биомаркеров и электрокардиографических изменениях как свидетелей кардиомиопатии, аритмий, тромботических осложнений. Следует, однако, констатировать, что за счет суплементации витамин D3 играет существенную роль в поддержании сердечно-сосудистой системы, участвуя в регуляции воспалительных процессов, функции эндотелия, контроле пролиферации и миграции клеток, гомеостаза внеклеточного матрикса и сохранении кардиальной системы в целом (Pál et al., 2023).
Отмечается роль витамина D в контроле компонентов ренин-ангиотензиновой системы в патогенезе COVID-19. В нормальных условиях регуляторную роль выполняет функциональное противостояние родственных ангиотензин-конвертирующих ферментов – АПФ и АПФ2, контролирующих баланс ангиотензиновых пептидных фрагментов. Соотношение активности ферментов определяет контроль вазоконстрикции, цитовоспаления, оксидативного стресса, коагулопатии (рис. 2). Протективный контроль, реализуемый при участии витамина D3, включает ингибирование ренина и, соответственно, реактивацию фермента АПФ2, с “реабилитацией” антивоспалительных, анти-тромботических, вазодилатационных функций, важных для защиты сердечно-сосудистой системы (Malek Mahdavi, 2020; Giménez et al., 2020).
ТЕРАПЕВТИЧЕСКАЯ СТРАТЕГИЯ СУПЛЕМЕНТАЦИИ ВИТАМИНОМ D3
В исследованиях предыдущего периода с осторожностью высказывалась мысль о возможности использования витамина D3 в качестве суплементации или пищевых добавок для защиты от патологических явлений (Göring, 2018). Эта идея оказывается актуальной в нынешнем рассмотрении патогенеза COVID-19 c манифестацией респираторных и системных поражений. Согласно информационному поиску PubMed за два с половиной года (2001–2003 гг.) по запросу “Vitamin D Supplementation. COVID-19”, было опубликовано около 500 клинических, обзорных и аналитических статей. Применение витамина D3 при инфекционной патологии находит немало подтверждений с детализацией положительных примеров и сомнений.
Поддержание уровня витамина D3 в доклинический период жизнедеятельности и/или на ранних стадиях COVID-19 иллюстрируется сокращением времени пребывания в больнице и менее тяжелой формой патогенеза. Добавки витамина D снижают потребность в интенсивной терапии и искусственной вентиляции легких у больных COVID-19 (Castillo et al., 2020; Cicero et al., 2022; Hosseini et al., 2022). Поддержание концентрации витамина D3 в сыворотке на уровне более 40–60 нг/мл в течение года может снизить риск респираторных заболеваний, включая инфекции SARS-CoV-2 (Shah et al., 2022). В отдельной группе исследований терапия холекальциферолом и кальцифедиолом снижала риск смертности и тяжести заболевания у ослабленных пожилых пациентов (Argano et al., 2023). Отмечается также возможность суплементации витамина D3 для предотвращения когнитивных расстройств, ассоциируемых с ковидной патологией (Chakkera et al., 2022).
Суплементация витамином D3 может играть защитную роль, стимулируя на ранней стадии вирусной трансфекции синтез противовоспалительных пептидов. Считается, что применение витамина D3 индуцирует механизм, который, создавая новые белки, ограничивает активность респираторных вирусов (Hansdottir et al., 2010). В последующей фазе COVID-19 (Шторм-2) достаточный уровень витамина D3 препятствует дисрегуляции описанной выше “триады” эндотелиально-сосудистого гомеостаза, иммунных комплексов и органных поражений. Кальцитриол, благодаря взаимодействию с рецептором витамина D3 и включению плейо-тропного транскрипционного механизма, служит реальным обоснованием этой позиции (Renke et al., 2023).
Таким образом, поскольку витамин D обладает множественными иммуномодулирующими свойствами, контроль уровня витамина D3 способствует ограничению заражения и развития тяжелых и осложненных форм COVID-19. Пищевые и лекарственные добавки витамина D могут сбалансировать некоторые негативные последствия COVID-19, такие как дефицит пребывания на солнце и ограничения подвижности, связанные с болезнью (Tang, 2022). Использование в качестве дополнительной терапии витамина Д3 далеко не одномерно и зависит от ряда причин, среди которых на первое место выступают выбор доз и длительность суплементации. Отмечается также использование комплексов биологически активных добавок, включающих взаимодополняющие комбинации (Capozzi et al., 2020).
Априори, несмотря на небольшое число публикаций, можно отметить вероятную пользу суплементации витамином D для пациентов в постковидный период – переболевших или в фазе “Long Covid”. В последнем случае, когда довольно типично мозаичное проявление клинических симптомов, большие возможности компенсаторного действия витамина D3, описанные в настоящей статье, могут служит терапевтической стратегией с учетом персонализированных особенностей пациента (Гомазков, 2023; Barrea et al., 2022).
ЗАКЛЮЧЕНИЕ
Многодесятилетнее знакомство с витамином D3 представляет приключенческую историю интереса, сомнений, медицинской значимости. Экспериментальные исследования установили участие витамина в большом спектре физиологических функций, которые соответствовали его определению как эндокринного гормона. С нынешних позиций витамин D3 – сопроводитель и охранник здорового организма. Взрыв интереса в нынешние годы пандемии COVID-19 выделил аспекты особой миссии, значимой как протективная функция. Ключевой в этом раскладе оказывается связь процессов патогенеза, ассоциированных с вирусом SARS-CoV-2, и выявление мишеней “приложения” витамина D3 как терапевтического подспорья.
Представленный в данном обзоре “солнечный” витамин выступает как профилактический, иммунорегуляторный, нейропротективный и кардиотропный фактор вспомогательной терапии. В этом контексте обсуждается возможная роль витамина D при переходе пандемии COVID-19 в эндемическую стадию за счет мутации коронавируса SARS-CoV-2 и появления других штаммов. По-видимому, вирусные инверсии могут снижать роль адаптивной иммунной системы, однако, в меньшей степени влияют на реакции врожденной иммунной системы. Суплементация витамином D может рассматриваться как потенциальное средство смягчения последствий эндемической стадии COVID-19 (Briceno Noriega, Savelkoul, 2022). Согласно итоговому анализу (Ashique et al., 2023), добавление витамина D в настоящее время стало эффективным вариантом повышения иммунного ответа для всех возрастов и предотвращения распространения инфекции. Подчеркивается важная позиция иммуномодулирующей роли витамина Д3, ключевой в терапевтической стратегии “ковидного” патогенеза. Профилактическое действие добавок витамина D (в определенном режиме) было документировано обсервационными исследованиями и клиническими испытаниями по предотвращению вирусных и острых респираторных дисфункций.
В качестве особой позиции можно акцентировать некоторые ключевые положения, иллюстрирующие принципы молекулярной патофизиологии витамина D3.
Многочисленные данные клинических, аналитических и экспериментальных работ создают целостное впечатление весьма тонкой и паллиативной миссии витамина D3 как фактора защиты. Витамин D3 и его метаболиты (комбинации кальцефедиола/кальцитриола) можно рассматривать как дополнительные протективные средства от заражения SARS-CoV-2 и нивелирования цитокинового шторма в начальной стадии чрезмерного иммунного ответа. Данные о роли витамина D3 в ограничении сосудистого поражения, защите эндотелия, нивелирования диссонанса ренин-ангиотензинового комплекса также свидетельствуют о терапевтической значимости.
Плейотропизм витамина D3 демонстрирует значение иммунной системы как парадигмы гомеостаза, защиты или дисрегуляции, в соответствии с характером патогенеза. Констатация, что большинство структур иммунной системы, включая макрофаги, В- и Т-лимфоциты, нейтрофилы и дендритные клетки, могут связываться с особым рецептором, послужило доказательством влияния витамина D на клеточную иммунную систему. Экспрессия рецептора витамина D3 в иммунных клетках приводит к продукции белков, которые выполняют необходимые в защите от поражений антипролиферативные, дифференцирующие и иммуномодулирующие действия.
Следует выделить особый механизм связывания витамина D3 с рецепторами, которые регулируют экспрессию генов. Транскрипционная рецепция витамина D реализуется в форме корегуляторных комплексов, специфичных как для гена, так и для клетки, которые обеспечивают селективность действия для различных типов клеток. Полиморфизм витамина D демонстрирует сложную систему синтеза протеомных единиц определенного функционального назначения. Универсальность транскрипционного механизма, который использует комплекс витамина D3, и его клеточно-тканевая фенотипичность обеспечиваются за счет экспрессии рецептора витамина D во многих тканях.
Список литературы
Геринг Х., Кожухова С. Витамин D – гормон солнца. А если солнца недостаточно? // Биохимия. 2015. Т. 80 (1). С. 14–28.
Гомазков О.А. Эндотелий – мишень, которую выбирает коронавирус. М.: ИКАР, 2021. 62 с.
Гомазков О.А. Постковидный синдром. Патофизиология системных дисрегуляций // Успехи соврем. биол. 2023. Т. 143 (3). С. 229–238.
Ионова Ж.И., Сергеева Е.Г., Беркович О.А. Генетические и эпигенетические факторы, регулирующие экспрессию и функционирование рецептора витамина D у больных ишемической болезнью сердца // Рос. кардиол. журн. 2021. Т. 26 (1S). С. 425.
Салухов В.В., Ковалевская Е.А. Витамин D – стратегический удар по коронавирусной инфекции // Мед. Совет. 2020. Т. 21. С. 218–228. https://doi.org/10.21518/2079-701X-2020-21-218-228
Adams J.S., Ren S., Liu P.T. et al. Vitamin D-directed rheostatic regulation of monocyte antibacterial responses // J. Immunol. 2009. V. 182. P. 4289–4295. https://doi.org/10.4049/jimmunol.0803736
Ashique S., Gupta K., Gupta G. et al. Vitamin D – a prominent immunomodulator to prevent COVID-19 infection // Int. J. Rheum. Dis. 2023. V. 26 (1). P. 13–30. https://doi.org/10.1111/1756-185X.14477
Argano C., Bocchio R.V., Natoli G. et al. Protective effect of vitamin D supplementation on COVID-19-related intensive care hospitalization and mortality: definitive evidence from meta-analysis and trial sequential analysis // Pharmaceuticals (Basel). 2023. V. 16 (1). P. 130. https://doi.org/10.3390/ph16010130
Baeke F., Korf H., Overbergh L. et al. Human T lymphocytes are direct targets of 1,25-dihydroxyvitamin D3 in the immune system // J. Steroid. Biochem. Mol. Biol. 2010. V. 121 (1–2). P. 221–227.
Barlow P.G., Svoboda P., Mackellar A. et al. Antiviral activity and increased host defense against influenza infection elicited by the human cathelicidin LL-37 // PLoS One. 2011. V. 6. P. e25333. https://doi.org/10.1371/journal.pone.0025333
Barrea L., Verde L., Grant W.B. et al. Vitamin D: a role also in long COVID-19? // Nutrients. 2022. V. 14 (8). P. 1625. https://doi.org/10.3390/nu14081625
Ben-Eltriki M. Hopefl R., Wright J.M. et al. Association between vitamin D status and risk of developing severe COVID-19 infection: a meta-analysis of observational studies // J. Am. Nutr. Assoc. 2022. V. 41 (7). P. 679–689. https://doi.org/10.1080/07315724.2021.1951891
Bouillon R. Vitamin D status in Africa is worse than in other continents // Lancet Glob. Heal. 2020. V. 8. P. e20–e21.
Briceno Noriega D., Savelkoul H.F.J. Vitamin D: a potential mitigation tool for the endemic stage of the COVID-19 pandemic? // Front Publ. Health. 2022. V. 10. P. 888168. https://doi.org/10.3389/fpubh.2022.888168
Capozzi A., Scambia G., Lello S. et al. Calcium, vitamin D, vitamin K2, and magnesium supplementation and skeletal health // Maturitas. 2020. V. 140. P. 55–63. https://doi.org/10.1016/j.maturitas.2020.05.020
Castillo M.E., Costa L.M., Barrios J.M. et al. Effect of calcifediol treatment and best available therapy versus best available therapy patients hospitalized for COVID-19: a pilot randomized clinical study // J. Steroid Biochem. Mol. Biol. 2020. V. 203. P. 105751. https://doi.org/10.1016/j.jsbmb.2020.105751
Carlberg C. Molecular endocrinology of vitamin D on the epigenome level // Mol. Cell. Endocrinol. 2017. V. 453. P. 14–21.
Chakkera M., Ravi N., Ramaraju R. et al. The efficacy of vitamin D supplementation in patients with Alzheimer’s disease in preventing cognitive decline: a systematic review // Cureus. 2022. V. 14 (11). P. e31710. https://doi.org/10.7759/cureus.31710
Charoenngam N., Jaroenlapnopparat A., Mettler S.K. et al. Genetic variations of the vitamin D metabolic pathway and COVID-19 susceptibility and severity: current understanding and existing evidence // Biomedicines. 2023. V. 11 (2). P. 400. https://doi.org/10.3390/biomedicines11020400
Cicero A.F.G., Fogacci F., Borghi C. Vitamin D supplementation and COVID-19 outcomes: mounting evidence and fewer doubts // Nutrients. 2022. V. 14 (17). P. 3584. https://doi.org/10.3390/nu14173584
Chiodini I., Davide Gatti D., Soranna D. et al. Vitamin D status and SARS-CoV-2 infection and COVID-19 clinical outcomes // Front Publ. Health. 2021. V. 9. P. 736665. https://doi.org/10.3389/fpubh.2021.736665
Dancer R.C.A., Parekh D., Lax S. et al. Vitamin D deficiency contributes directly to the acute respiratory distress syndrome // Thorax. 2015. V. 70. P. 617–624.
Deluca H.F. History of the discovery of vitamin D and its active metabolites // Bonekey Rep. 2014. V. 3. P. 479. https://doi.org/10.1038/bonekey.2013.213
Di Rosa M., Malaguarnera M., Nicoletti F. et al. Vitamin D3: a helpful immune-modulator // Immunology. 2011. V. 134 (2). P. 123–139. https://doi.org/10.1111/j.1365-2567.2011.03482.x
Dissanayake H.A., de Silva N.L., Sumanatilleke M. et al. Prognostic and therapeutic role of vitamin D in COVID-19: systematic review and meta-analysis // J. Clin. Endocrinol. Metab. // 2022. V. 107 (5). P. 1484–1502. https://doi.org/10.1210/clinem/dgab892
Durmuş M.E., Kara O., Kara M. et al. The relationship between vitamin D deficiency and mortality in older adults before and during COVID-19 // Heart Lung. 2023. V. 57. P. 117–123. https://doi.org/10.1016/j.hrtlng.2022.09.007
Gholi Z., Yadegarynia D., Eini-Zinab H. et al. Vitamin D deficiency is associated with increased risk of delirium and mortality among critically ill, elderly Covid-19 patients // Complement. Ther. Med. 2022. V. 70. P. 102855. https://doi.org/10.1016/j.ctim.2022.102855
Gibson C., Davis C., Zhu W. et al. Dietary vitamin D and its metabolites non-genomically stabilize the endothelium // PLoS One. 2015. V. 10. P. e0140370. https://doi.org/10.1371/journal.pone.0140370
Giménez V.M., Sanz R.L., Marón F.J.M. et al. Vitamin D: RAAS connection: an integrative standpoint into cardiovascular and neuroinflammatory disorders // Curr. Prot. Pept. Sci. 2020. V. 21. P. 948–954. https://doi.org/10.2174/1389203721666200606220719
Glinsky G.V. Vitamin D, quercetin, and estradiol manifest properties of medicinal agents for targeted mitigation of the COVID-19 pandemic defined by genomics-guided tracing of SARS-CoV-2 targets in human cells // Biomedicines. 2020. V. 8 (5). P. 129. https://doi.org/10.3390/biomedicines8050129
Göring H. Vitamin D in nature: a product of synthesis and/or degradation of cell membrane components // Biochemistry (Mosc.). 2018. V. 83 (11). P. 1350–1357.
Han L., Xu X.J., Zhang J.S., Liu H.M. Association between vitamin D deficiency and levels of renin and angiotensin in essential hypertension // Int. J. Clin. Pract. 2022. Art. 8975396. https://doi.org/10.1155/2022/8975396
Hansdottir S., Monick M.M., Lovanet N. et al. Vitamin D decreases respiratory syncytial virus induction of NF-kappaB-linked chemokines and cytokines in airway epithelium while maintaining the antiviral state // J. Immunol. 2010. V. 184 (2). P. 965–974.
Holick M.F. The one-hundred-year anniversary of the discovery of the sunshine vitamin D3: historical, personal experience and evidence-based perspectives // Nutrients. 2023. V. 15 (3). P. 593. https://doi.org/10.3390/nu15030593
Hosseini B., El Abd A., Ducharme F. Effects of vitamin D supplementation on COVID-19 related outcomes: a systematic review and meta-analysis // Nutrients. 2022. V. 14. P. 2134. https://doi.org/10.3390/nu14102134
Jablonski K.L., Chonchol M., Pierce G.L. et al. 25-Hydroxyvitamin D deficiency is associated with inflammation-linked vascular endothelial dysfunction in middle-aged and older adults // Hypertension. 2011. V. 57. P. 63–69.
Jenei T., Jenei S., T. Tamás L. et al. COVID-19 mortality is associated with low vitamin D levels in patients with risk factors and/or advanced age // Clin. Nutr. ESPEN. 2022. V. 47. P. 410–413. https://doi.org/10.1016/j.clnesp.2021.11.025
Jude E.B., Ling S.F., Allcock R. et al. Vitamin D deficiency is associated with higher hospitalization risk from COVID-19 // J. Clin. Endocrinol. Metab. 2021. V. 106 (11). P. e4708–e4715. /https://doi.org/10.1210/clinem/dgab439
Khojah H.M.J., Ahmed S.A., Al-Thagfan S.S. et al. The impact of serum levels of vitamin D3 and its metabolites on the prognosis and disease severity of COVID-19 // Nutrients. 2022. V. 14 (24). P. 5329. https://doi.org/10.3390/nu14245329
Kong J., Zhu X., Shi Y. et al. VDR attenuates acute lung injury by blocking Ang-2–Tie-2 pathway and rennin-angiotensin system // Mol. Endocrinol. 2013. V. 27. P. 2116–2125.
Li Y.C., Kong J., Wei M. et al. 1,25-Dihydroxyvitamin D3 is a negative endocrine regulator of the renin-angiotensin system // J. Clin. Invest. 2002. V. 110. P. 229–238.
Lin R., White J.H. The pleiotropic actions of vitamin D // BioEssays. 2004. V. 26. P. 21–28.
Lin L., Zhang L., Li Ch. et al. Vitamin D and vitamin D receptor: new insights in the treatment of hypertension // Curr. Prot. Pept. Sci. 2019. V. 20 (10). P. 984–995. https://doi.org/10.2174/1389203720666190807130504
Liu P.T., Stenger S., Li H. et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response // Science. 2006. V. 311. P. 1770–1773. https://doi.org/10.1126/science.1123933
Malek Mahdavi A. A brief review of interplay between vitamin D and angiotensin-converting enzyme 2: implications for a potential treatment for COVID-19 // Rev. Med. Virol. 2020. V. 30 (5). P. e2119.
McCollum E.V., Davis M. The necessity of certain lipins in the diet during growth // J. Biol. Chem. 1913. V. 15. P. 167–175.
Oz F., Cizgici AY., Oflaz H. et al. Impact of vitamin D insufficiency on the epicardial coronary flow velocity and endothelial function // Coron. Artery Dis. 2013. V. 24 (5). P. 392–397. https://doi.org/10.1097/MCA.0b013e328362b2c8
Pál É., Ungvári Z., Benyó Z., Várbíró S. Role of vitamin D deficiency in the pathogenesis of cardiovascular and cerebrovascular diseases // Nutrients. 2023. V. 15 (2). P. 334. https://doi.org/10.3390/nu15020334
Pilz S., Verheyen N., Grübler M.R. et al. Vitamin D and cardiovascular disease prevention // Nat. Rev. Cardiol. 2016. V. 13 (7). P. 404–417. https://doi.org/10.1038/nrcardio.2016.73
Quesada-Gomez J.M., Lopez-Miranda J., Entrenas-Castillo M. et al. Vitamin D endocrine system and COVID-19: treatment with calcifediol // Nutrients. 2022. V. 14 (13). P. 2716. https://doi.org/10.3390/nu14132716
Renke G., Starling-Soares B., Thomaz Baesso T. et al. Effects of vitamin D on cardiovascular risk and oxidative stress // Nutrients. 2023. V. 15 (3). P. 769. https://doi.org/10.3390/nu15030769
Shah K., Varna V.P., Sharma U. et al. Does vitamin D supplementation reduce COVID-19 severity?: a systematic review // QJM. 2022. V. 115 (10). P. 665–672. https://doi.org/10.1093/qjmed/hcac040
Simpson R.U., Hershey S.H., Nibbelink K.A. Characterization of heart size and blood pressure in the vitamin D receptor knockout mouse // J. Steroid. Biochem. 2007. Mol. Biol. V. 103. P. 521–24. https://doi.org/10.1016/j.jsbmb.2006.12.098
Soltani-Zangbar M.S., Mahmoodpoor A., Dolati S. et al. Serum levels of vitamin D and immune system function in patients with COVID-19 admitted to intensive care unit // Gene Rep. 2022. V. 26. P. 101509.https://doi.org/10.1016/j.genrep.2022.101509
Tang J. COVID-19 Pandemic and osteoporosis in elderly patients // Aging Dis. 2022. V. 13. P. 960–969.
Thickett D.R., Moromizato T., Litonjua A.A. et al. Association between prehospital vitamin D status and incident acute respiratory failure in critically ill patients: a retrospective cohort study // BMJ Open Respir. Res. 2015. V. 2. P. 1–8. https://doi.org/10.1136/bmjresp-2014-000074
Tishkoff D.X., Nibbelink K.A., Holmberg K.H. et al. Functional vitamin D receptor (VDR) in the t-tubules of cardiac myocytes: VDR knockout cardiomyocyte contractility // Endocrinology. 2008. V. 149. P. 558–564.
White J.H. Emerging roles of vitamin D-induced antimicrobial peptides in antiviral innate immunity // Nutrients. 2022. V. 14 (2). P. 284. https://doi.org/10.3390/nu14020284
Wong M.S., Delansorne R., Man R.Y. et al. Vitamin D derivatives acutely reduce endothelium-dependent contractions in the aorta of the spontaneously hypertensive rat // Am. J. Physiol. Heart Circ. Physiol. 2008. V. 295. P. H289–H296.
Xu Y., Baylink D.J., Chen C.-S. et al. The importance of vitamin D metabolism as a potential prophylactic, immunoregulatory and neuroprotective treatment for COVID-19 // J. Transl. Med. 2020. V. 18 (1). P. 322. https://doi.org/10.1186/s12967-020-02488-5
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии



