БИОХИМИЯ, 2020, том 85, вып. 4, с. 537 - 546
УДК 577.151
СУБСТРАТНОЕ РАЗНООБРАЗИЕ ГОМОЛОГОВ ДЕГИДРОГЕНАЗЫ
L ТРЕОНОВОЙ КИСЛОТЫ*,**
© 2020
Ч. Чжан1#, Юй Лю1#, С. У1, С. Чжан2***, Х. Хуан1***
1 Guangdong Provincial Key Laboratory of Biotechnology for Plant Development, School of Life Sciences,
South China Normal University, Guangzhou, Guangdong, 510631 China; E mail: hhuang@m.scnu.edu.cn
2 Institute of Ecological Science, School of Life Sciences, South China Normal University,
Guangzhou, Guangdong, 510631 China; E mail: xszhang@scnu.edu.cn
Поступила в редакцию 26.11.2019
После доработки 07.01.2020
Принята к публикации 21.01.2020
Несмотря на физиологическое значение альдоновых сахарных кислот для живых организмов, мало извест
но о метаболических путях этих соединений. В данной работе мы исследовали функциональное разнообра
зие гомологов дегидрогеназы L треоновой кислоты (ThrDH, UniProt ID: Q0KBC7) - фермента, имеющего
два NAD связывающих домена (PF14833 и PF03446). Мы изучили десять гомологов ThrDH с различным ге
номным контекстом и охарактеризовали семь новых ферментативных активностей ((R) пантоатдегидроге
наза, L дегидрогеназа альтроновой кислоты, дегидрогеназа 6 дезокси L талоновой кислоты, дегидрогеназа
L идоновой кислоты, дегидрогеназа D ксилоновой кислоты, дегидрогеназа D глюконовой кислоты и ре
дуктаза 2 гидрокси 3 оксопантоевой кислоты). Кроме того, нами также были идентифицированы два ассо
циированных метаболических пути: было обнаружено, что дегидрогеназа L идоновой кислоты участвует в
деградации L идоновой кислоты посредством ее окисления/декарбоксилирования у Agrobacterium radiobac
ter K84, в то время как 2 гидрокси 3 оксопантоатредуктаза участвует в катаболизме D глукарата посред
ством дегидрирования/расщепления субстрата у Ralstonia metallidurans CH34.
КЛЮЧЕВЫЕ СЛОВА: (R) пантоатдегидрогеназа, катаболизм L идоновой кислоты, катаболизм D глукара
та, дегидрогеназа L альтроновой кислоты, дегидрогеназа D ксилоновой кислоты.
DOI: 10.31857/S0320972520040065
Сахарные кислоты представляют собой саха
тамин C) - жизненно важное соединение для
риды с карбоксильной группой. Их подразделя
живых организмов [2], сиаловые кислоты -
ют на альдоновые, улозоновые, уроновые и аль
важные составляющие структур клеточной по
даровые кислоты. Альдоновые кислоты, у кото
верхности [3]. Согласно Human Metabolome
рых альдегидная функциональная группа альдо
зы окислена с образованием карбоксильной
харные кислоты выявляются в биологических
группы, выполняют важные физиологические
жидкостях и экскрементах человека. Так, D
функции. Например, D глюконовая кислота яв
глицериновая, D глюконовая и L ксилоновая
ляется регулятором кислотности и хелатором
кислоты обнаруживаются в слюне, а L треоно
ионов металлов [1], аскорбиновая кислота (ви
вая кислота и D ксилоновая кислота - в крови и
моче [4]. Поэтому изучение метаболизма альдо
новых кислот может помочь определить их био
Принятые сокращения: EryDH - дегидрогеназа D
логические функции на молекулярном уровне.
эритроновой кислоты; PanDH - (R) пантоатдегидрогена
за; SSN - сеть сходства последовательностей (sequence
Большинство альдоновых кислот катаболизиру
similarity network); ThrDH - дегидрогеназа L треоновой
ется посредством их последовательного дегид
кислоты.
рирования и расщепления, в ходе которых аль
* Первоначально английский вариант рукописи опубли
доновые кислоты или их фосфаты сначала под
вергаются дегидрированию с образованием про
msu.ru/biokhimiya, в рубрике «Papers in Press», BM19 334,
межуточных кетодезоксипроизводных соедине
11.02.2020.
ний, которые затем расщепляются альдолазой
** Приложение к статье на английском языке опубликова
но на сайте журнала «Biochemistry» (Moscow) и на сайте из
на два фрагмента [5-9].
В связи с быстрым увеличением количества
том 85, вып. 4, 2020.
аминокислотных последовательностей в дос
*** Адресат для корреспонденции.
тупных базах данных белков, разнообразие пу
# Авторы внесли равный вклад в работу.
тей катаболизма альдоновых кислот оказалось в
6
537
538
ЧЖАН и др.
значительной степени недооцененным. Ранее
Aldrich» (США), нуклеотиды
- в «General
группа Gerlt et al. охарактеризовала дегидроге
Biosystems» (Анху, Китай), ферменты - в «New
назу L треоновой кислоты (ThrDH) и дегидро
England Biolabs» (США), плазмиды
- в
геназу D эритроновой кислоты (EryDH), кото
«Novagen» (Германия), геномная ДНК была по
рые участвуют в деградации тетроновых кислот
лучена от ATCC (США) и DSMZ (Германия).
в различных катаболических путях [10]. В насто
Эксперименты были проведены с использова
ящей работе с целью изучения новых дегидроге
нием спектрометра Varian
600 MHz NMR,
наз альдоновых кислот и связанных с ними ме
спектрофотометров Nanodrop 2000 и UV visible
таболических путей нами были отобраны четы
(AOE instruments UV 1800).
ре гомолога EryDH (UniProt ID: Q0KBD2) и де
Генерирование сетей сходства последователь
сять гомологов ThrDH (UniProt ID: Q0KBC7) на
ностей (SSN). Сеть сходства последовательнос
основе сходства их аминокислотных последова
тей (SSN - sequence similarity network) позволяет
тельностей, разнообразия геномного контекста
анализировать и визуализировать структурно
(рис. S1 Приложения) и доступности данных по
функциональные взаимосвязи в больших семей
геномной ДНК. В результате проведенной рабо
ствах белков. SSN были построены, как описано
ты мы смогли продемонстрировать большое
ранее [11]. Вкратце, аминокислотная последова
разнообразие субстратов для семи новых дегид
тельность белка, его идентификационный номер
рогеназ альдоновых кислот, а также определили
(ID) в базе данных UniProt или номер семейства
два новых катаболических пути.
в базе данных Pfam (например, PF14833 на
рис. 1) использовали как вводные данные для
МАТЕРИАЛЫ И МЕТОДЫ
efi est/). В сети репрезентативного узла (repre
sentative node network) показатель 50% rep, на
Материалы. Все сахара были приобретены в
пример, означает, что аминокислотные последо
«Carbosynth» (Китай) или синтезированы хими
вательности с идентичностью более 50% будут
ческим путем (Хуайхуа, Китай). Другие хими
представлены в виде одного узла. Как правило,
ческие реактивы были приобретены в «Sigma
первоначально SSN создается на основе вырав
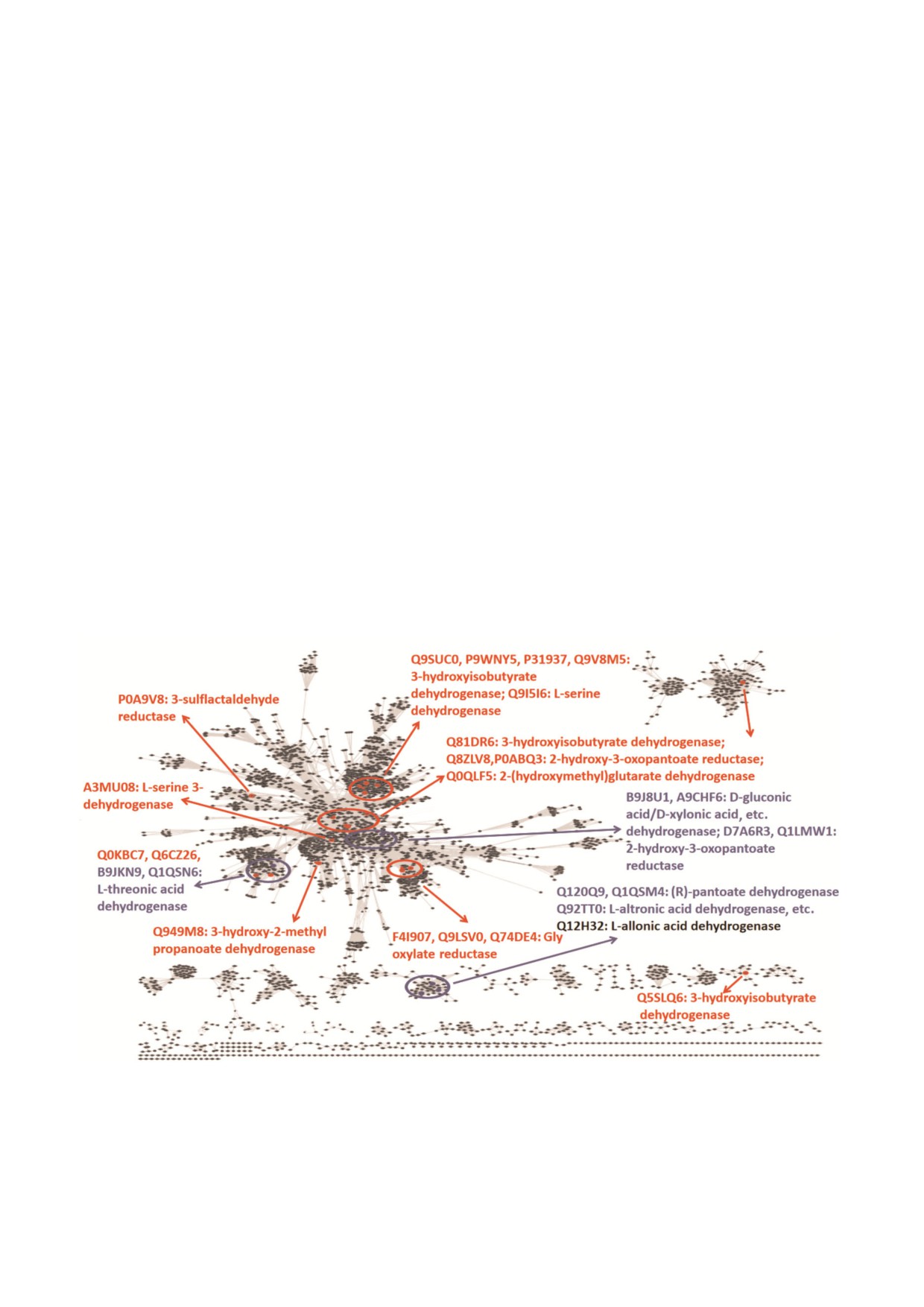
Рис. 1. Структурно функциональное пространство гомологов ThrDH в контексте SSN (PF14833, 61 955 членов, e-67, иден
тичность 40%, 50%rep). Ферменты с известными функциями выделены красным цветом, охарактеризованные в настоя
щей работе ферменты - синим цветом. Q12H32 показан темно серым цветом (фермент с низкой активностью).
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
ФУНКЦИИ ДЕГИДРОГЕНАЗ PF14833 И PF03446
539
Таблица 1. Активные альдоновые кислоты, использованные в настоящей работе в качестве субстратов для тестирования
гомологов ThrDH и EryDH
Ферменты (UniProt ID)
Субстраты
Гомологи EryDH (PF01370)
Q1QSN8/Q1QSM2/B9J8U2/A9CHF5
D эритроновая кислота
Гомологи ThrDH (PF14833 PF02446)
Q1QSN6
L треоновая кислота
B9JKN9
L треоновая кислота, L идоновая кислота, L рибоновая кислота
Q1QSM4/Q120Q9
(R) пантоат
Q12H32
L аллоновая кислота
Q92TT0
6 дезокси L талоновая кислота, L альтроновая кислота, L луксоновая кислота,
L рамноновая кислота, L манноновая кислота
B9J8U1/A9CHF6
L треоновая кислота, L идоновая кислота, D глюконовая кислота, D ксилоновая
кислота, D галактоновая кислота
D7A6R3/Q1LMW1
D глицериновая кислота
Примечание. Полужирным шрифтом выделены субстраты, в отношении которых показана наибольшая ферментативная
активность.
нивания, соответствующего ~30% ной идентич
в буфере A. Белки элюировали 250 мМ имидазо
ности последовательности. Затем критерий
лом в буфере A. Полученные белковые фракции
оценки выравнивания может быть увеличен,
анализировали в SDS PAGE (рис. S3 Приложе
чтобы различить разные функции белка (узлы с
ния). Фракции, содержавшие очищенные бел
одинаковой функцией объединяются в один
ки, объединяли и трижды диализовали против
кластер).
буфера A. Полученные белковые фракции быст
Очистка ферментов. Фрагменты генов, коди
ро замораживали в жидком азоте и хранили при
рующих гомологи ThrDH и EryDH разных ви
-80 °С до их дальнейшего использования.
дов бактерий, амплифицировали по стандарт
Анализ ферментативной активности. Сначала
ному протоколу ПЦР с использованием соответ
была проанализирована дегидрогеназная актив
ствующих геномных ДНК и праймеров (табл. S1
ность полученных ферментов - четырех гомо
Приложения) и лигировали в вектор PET 28a
логов EryDH и десяти гомологов ThrDH - в от
(рис. S2 Приложения). Полученными плазмида
ношении библиотеки альдоновых сахарных
ми с подтвержденными нуклеотидными после
кислот (34 монокарбоновых сахарных кислот,
довательностями трансформировали клетки E.
табл. S2 Приложения) в 96 ячеечном микро
coli BL21 (DE3) для экспрессии белков. Транс
планшете. Дегидрогеназную активность оцени
формированные клетки инокулировали в 1 л
вали путем измерения образующегося NADH
культуральной среды Лурия-Бертани (LB), со
(ε = 6,2 мМ-1 cм-1 при 340 нм). Реакционная
державшей 50 мкM канамицина, и культивиро
смесь (150 мкл, 25 °С) содержала 1 мкM дегидро
вали при 37 °С и 200 об/мин до достижения
геназы, 100 мМ Tris HCl буфер (pH 8,0), 1 мМ
OD600 0,5-0,8. Для индукции экспрессии белка
Mg2+, 0,5 мМ NAD+, 1 мМ субстрата. Значения
добавляли 0,4 мМ IPTG и инкубировали клетки
оптической плотности регистрировали через
в течение ночи (20 °С, 180 об/мин). Далее клет
каждую секунду в течение 5 мин. Субстраты, в
ки собирали и суспендировали в 50 мМ Tris
отношении которых была выявлена наибольшая
HCl буфере (pH 8,0), лизировали с использова
ферментативная активность, отбирали для про
нием французского пресса (French press) и цент
ведения более тщательных кинетических изме
рифугировали. Полученный супернатант нано
рений с использованием описанного выше ме
сили на колонку с Ni NTA агарозой, колонку
тода (табл. 1). Для запуска ферментативной ре
промывали тремя объемами буфера A (25 мМ
акции в 200 мкл реакционной смеси, содержав
Tris, pH 8,0) и двумя объемами 25 мМ имидазола
шей 100 мМ Tris HCl буфер (pH 8,0), 1 м Mg2+,
БИОХИМИЯ том 85 вып. 4 2020
6*
540
ЧЖАН и др.
Таблица 2. Репрезентативные данные кинетики для гомологов ThrDH
Ферменты (UniProt ID) и субстраты
KM, мМ
kcat, с-1
kcat/KM, с-1 · M-1
B9JKN9
L треоновая кислота
1,19 ± 0,16
20,00 ± 0,92
1,68 × 105
L идоновая кислота
1,98 ± 0,42
16,40 ± 1,66
8,3 × 103
B9J8U1
D глюконовая кислота
0,62 ± 0,06
22,40 ± 0,65
3,6 × 104
L идоновая кислота
3,60 ± 0,34
21,10 ± 0,92
5,8 × 103
L треоновая кислота
1,00 ± 0,13
4,20 ± 0,17
4,1 × 103
D ксилоновая кислота
4,45 ± 0,43
15,20 ± 0,91
3,4 × 103
Q92TT0
6 дезокси L талоновая кислота
2,10 ± 0,31
6,30 ± 0,46
3,0 × 103
L альтроновая кислота
3,10 ± 0,32
7,90 ± 0,45
2,5 × 103
D7A6R3
D глицериновая кислота
0,030 ± 0,004
9,30 ± 0,28
3,2 × 105
Q1QSM4
(R) пантоат
0,23 ± 0,03
6,10 ± 0,23
2,7 × 104
B9J8U2
D эритроновая кислота
0,82 ± 0,10
1,09 ± 0,04
1,3 × 103
Q1QSM2
D эритроновая кислота
1,24 ± 0,18
15,80 ± 0,75
1,27 × 104
a
b
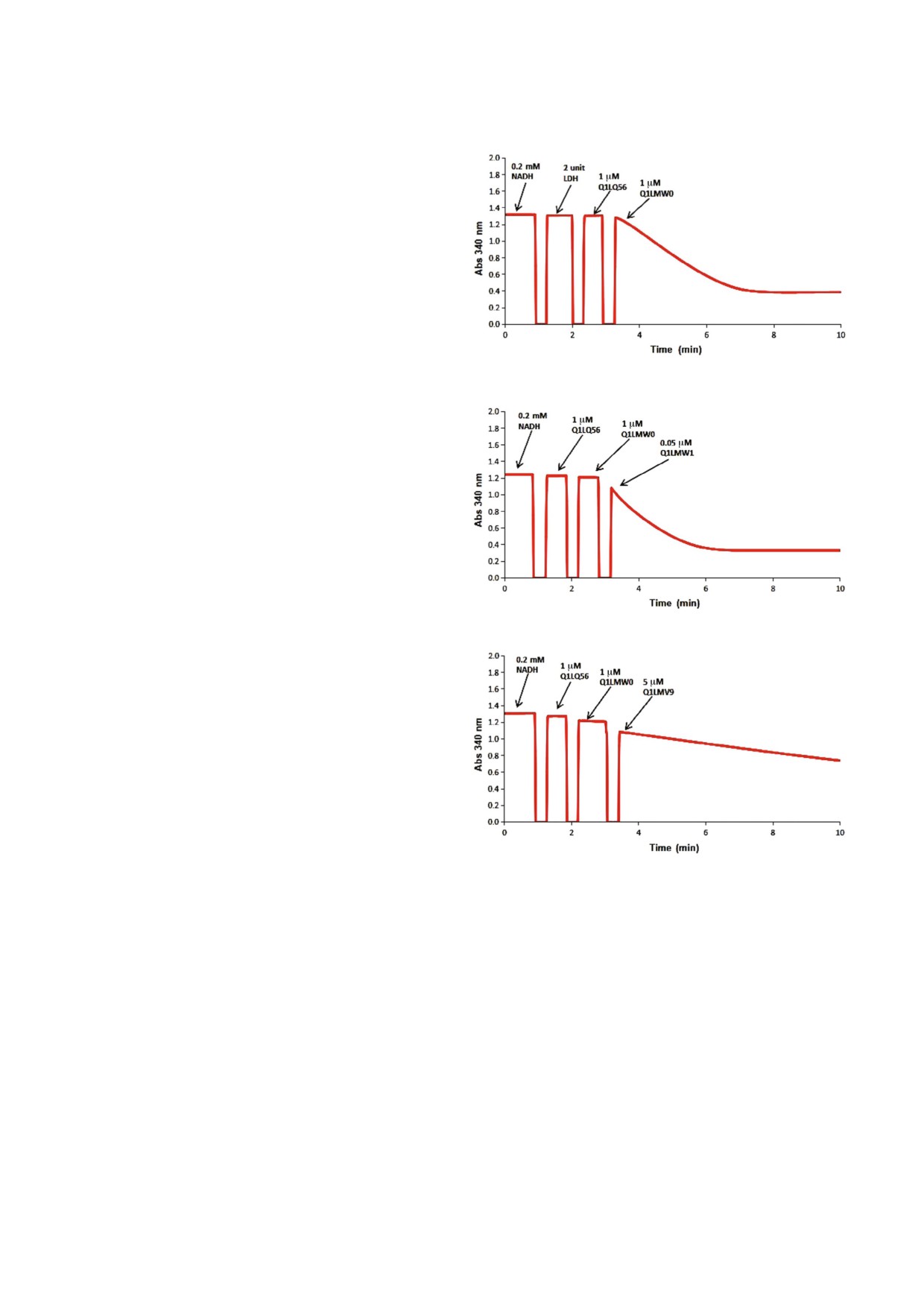
Рис. 2. Спектрофотометрический анализ катаболических путей, ассоциированных с L треоновой и L идоновой кислота
ми. Реакционные смеси содержали 100 мМ Tris HCl буфер (pH 8,0), 1,0 мМ Mg2+, 0,5 мМ NAD+, 0,5 мМ АТP и 1 мМ
субстратов L треоновой (а) или L идоновой кислоты (b). Последовательность добавления в реакционную смесь фермен
тов ThrDH (B9JKN9), AP_endo (B9JKP0) и DUF1537 (B9JKP1) показана на каждой панели.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
ФУНКЦИИ ДЕГИДРОГЕНАЗ PF14833 И PF03446
541
0,5 мМ NAD+ и различные концентрации
a
субстратов альдоновых кислот, добавляли фер
мент в соответствующей концентрации. На
чальные скорости реакции при различных кон
центрациях субстрата соответствовали уравне
нию Михаэлиса-Ментен (табл. 2).
Определение метаболических путей. Последо
вательность реакций катаболических путей для
L треоновой и L идоновой кислот определяли
путем последовательного добавления соответ
ствующих ферментов и последующей регистра
ции изменений значений оптической плотности
при 340 нм. К 200 мкл реакционной смеси
(100 мМ Tris HCl буфер (pH 8,0), 1 мМ Mg2+,
0,5 мМ NAD+, 0,5 мМ АТP, 1 мМ L треоновой
b
кислоты или 1 мМ L идоновой кислоты) добав
ляли 1 мкM дегидрогеназы (B9JKN9) и 1 мкM
изомеразы (B9JKP0). По достижении состояния
равновесия в реакционную смесь вносили
1 мкM киназы DUF1537 (B9JKP1) (рис. 2). В
случае D глукарат ассоциированного катаболи
ческого пути ферментативную активность де
гидратазы D глукаровой кислоты (Q1LQ56) и
альдолазы (Q1LMW0) подтверждали продукци
ей пирувата, которую регистрировали с по
мощью сопряженной с лактатдегидрогеназой
реакции в присутствии NADH. Реакционная
смесь (200 мкл, 25 °С) содержала 100 мМ Tris
c
HCl буфер (pH 8,0), 1 мМ Mg2+, 0,2 мМ NADH
и 1,0 мМ D глукарат. Для инициации реакции в
реакционную смесь добавляли 2 единицы LDH,
1 мкM дегидратазы (Q1LQ56), 1 мкM альдолазы
(Q1LMW0) и регистрировали изменения значе
ний оптической плотности при 340 нМ. Дегидро
геназную активность Q1LMW1 определяли по та
кому же протоколу, но вместо LDH в реакцион
ную смесь добавляли 0,05 мкM Q1LMW1 (рис. 3).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Субстратная специфичность дегидрогеназ. На
Рис. 3. Спектрофотометрический анализ метаболического
ми была выявлена специфичность четырех гомо
пути, ассоциированного с D глукаратом. Исходная реак
логов EryDH (UniProt ID: Q1QSN8, Q1QSM2,
ционная смесь содержала 100 мМ Tris HCl буфер (pH 8,0),
1,0 мМ Mg2+, 0,2 мМ NADH, 1 мМ D глукарата. a - Для
B9J8U2, A9CHF5; идентичность аминокислот
определения ферментативной активности Q1LQ56 и
ной последовательности ~38-76%) в отношении
Q1LMW0 в реакционную смесь добавляли 2 единицы
D эритроновой кислоты, что согласуется с дан
LDH, 1 мкM дегидратазы (Q1LQ56) и 1 мкM альдолазы
ными предыдущей работы [10], в то время как го
(Q1LMW0); b - для определения редуктазной активности
Q1LMW1 в отношении 2 гидрокси 3 оксопантаноевой
мологи ThrDH были способны катализировать
кислоты в реакционную смесь добавляли 1 мкM дегидра
реакции с разнообразными субстратами (табл. 1).
тазы (Q1LQ56), 1 мкM альдолазы (Q1LMW0) и 0,05 мкM
Из представленной на рис. 1 SSN для гомо
ThrDH (Q1LMW1); с - для определения ферментативной
логов ThrDH (рис. 1) видно, что Q1QSN6 обла
активности Q1LMV9 в отношении пирувата и 2 гидрокси
дает специфической активностью в отношении
3 оксопантаноевой кислоты в реакционную смесь добав
ляли 1 мкM дегидратазы (Q1LQ56), 1 мкM альдолазы
L треоновой кислоты (расположена в верхнем
(Q1LMW0) и 5 мкM Q1LMV9.
левом синем круге). Однако B9JKN9 (~49% ная
С цветным вариантом рисунка можно ознакомиться в
идентичность аминокислотной последовательнос
ти с Q1QSN6) может окислять как L треоновую
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
542
ЧЖАН и др.
a
b
c
d
Рис. 4. Генные контексты для дегидрогеназы L идоновой кислоты (B9JKN9), редуктазы 2 гидрокси 3 оксопантановой
кислоты (Q1LMW1) (а) и их соответствующие катаболические пути (b-d). а - Генный контекст для B9JKN9 (arad_9439)
и Q1LMW1 (rmet_1632), выделено красным цветом. Субстрат Q1LMV9 (rmet_1634) неизвестен, однако эта дегидрогеназа
проявляет редуктазную активность в отношении фенилпировиноградной и α кетоглутаровой кислот; b, c - катаболичес
кие пути, ассоциированные с L треоновой и L идоновой кислотами у Agrobacterium radiobacter K84. Разные ферменты,
участвующие в этих путях, вызывают деградацию обеих альдоновых сахарных кислот с образованием соответствующих
фосфатов кетопроизводных сахаров; d - катаболический путь D глукарата у Ralstonia metallidurans CH34; гомологи ThrDH
выделены синим цветом.
journal/biokhsm/
кислоту, так и L идоновую кислоты (табл. 1 и 2).
нижнем синем круге). Кинетические величины
D7A6R3 и Q1LMW1 (63% ная идентичность
(kcat/KM) вышеперечисленных ферментов с
аминокислотной последовательности, распола
субстратами альдоновых сахарных кислот ко
гаются в верхнем правом синем круге) специфи
леблются в диапазоне от 103 до 105 с-1 M-1
чески окисляют D глицериновую кислоту с об
(табл. 2).
разованием 2 гидрокси 3 оксопантоевой кис
Определение катаболического пути. Геномные
лоты, в то время как для B9J8U1 и A9CHF6
контексты для B9JKN9 и Q1LMW1 показаны на
(67% ная идентичность аминокислотной после
рис. 4, a. Проведенные эксперименты in vitro
довательности) была показана активность в от
подтвердили, что L идоновая кислота может
ношении четырех субстратов (D глюконовая,
подвергаться деградации путем, сходным с изве
L идоновая, L треоновая и D ксилоновая кис
стным путем катаболизма L треоновой кислоты
лоты, табл. 1). Кроме того, выявлены новые
(рис. 4, b) [10]. В этом метаболическом пути L
ферменты: (R) пантоатдегидрогеназа (PanDH,
идоновая кислота окисляется с помощью
Q120Q9 и Q1QSM4, 61% ная идентичность ами
B9JKN9 с образованием 2 оксогексоновой кис
нокислотной последовательности) и дегидроге
лоты, которая затем изомеризуется и фосфори
наза L альтроновой кислоты (расположены в
лируется с участием изомеразы AP_endo
БИОХИМИЯ том 85 вып. 4 2020
ФУНКЦИИ ДЕГИДРОГЕНАЗ PF14833 И PF03446
543
(B9JKP0) и киназы DUF1537 (B9JKP1). На за
кислот (EryDH: PF01370; ThrDH: PF14833 и
ключительном этапе нестабильная 3 оксо гек
PF03446). Во первых, с использованием комби
соновая кислота 6P может распадаться с обра
нированного биоинформатического анализа
зованием L ксилулозо 5Р - самопроизвольно
(анализ гомологии с помощью SSN и анализ ин
либо под действием альдолазы (B9JKP2) [10, 12]
дивидуальных геномных контекстов) мы отоб
(рис. 2; рис. 4, с).
рали ферменты, которые могли бы обладать раз
У Ralstonia metallidurans CH34 Q1LMW1 при
личными функциями. Во вторых, основываясь
нимает участие в типичном пути катаболизма
на структуре субстратов ( COOH/ SO3H) ранее
D глукарата [13]. Сначала D глукарат дегидри
охарактеризованной ThrDH, отобранные нами
руется D глукаратдегидратазой (Q1LQ56) с об
гомологи ThrDH были подвергнуты скринингу
разованием 2 кето 3 дезокси D глукарата. Да
против библиотеки 34 сахарных кислот. Затем
лее этот промежуточный продукт может рас
гомологи ThrDH были протестированы индиви
щепляться альдолазой (Q1LMW0) с образовани
дуально с соответствующими субстратами на
ем пирувата и 2 гидрокси 3 оксопропановой
предмет детального сравнения кинетических
кислоты (полуальдегид тартроновой кислоты).
параметров. В завершение на основании выяв
В завершение Q1LMW1 превращает 2 гидрок
ленных активностей ThrDH по отношению к
си 3 оксопропановую кислоту в D глицерино
тестируемым субстратам были изучены ассоци
вую кислоту (рис. 3; рис. 4, d).
ированные с этими ферментами метаболичес
кие пути.
На основе полученных результатов можно
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
утверждать, что гомологи EryDH специфичны в
отношении D эритроновой кислоты, в то время
Альдоновые сахарные кислоты широко
как функции гомологов ThrDH довольно разно
распространены в окружающей среде и в биоло
образны. Некоторые гомологи ThrDH являются
гических жидкостях человека и выполняют
разнородными и проявляют высокую актив
множество важных физиологических функций
ность в отношении различных структурно сход
[14, 15]. Однако до настоящего времени прово
ных сахарных кислот. Например, субстраты
дились лишь единичные исследования метабо
фермента Q92TT0 (6 дезокси L талоновая кис
лизма альдоновых сахарных кислот [16, 17]. В
лота, L альтроновая кислота) имеют (2R) кон
данной работе нами была предпринята попытка
фигурацию, в то время как субстраты B9JKN9/
определить метаболические пути посредством
B9J8U1/A9CHF6 (L треоновая, L идоновая, D
тщательного анализа разнообразия субстратов
ксилоновая и D глюконовая кислоты) - кон
двух известных семейств дегидрогеназ сахарных
сервативную (2R,3S) конфигурацию (рис. 5).
(R) pantoate
Рис. 5. Структура субстратов и сравнение аминокислотных последовательностей гомологов ThrDH. Консервативные
структуры субстратов показаны синим цветом (левая панель), последовательности субстратсвязывающих мотивов выде
лены пунктирными рамками (правая панель). Для проведения выравнивания аминокислотных последовательностей бы
ли использованы структуры дегидрогеназы 3 гидроксиизомасляной кислоты (P9WNY5, PDB: 5Y8N) из Mycobacterium
tuberculosis и L сериндегидрогеназы (Q9I5I6, PDB: 3OBB) из Pseudomonas aeruginosa, идентичность их аминокислотных
последовательностей с анализируемыми в данной работе ThrDHs составляет 22,4-29,5%.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
544
ЧЖАН и др.
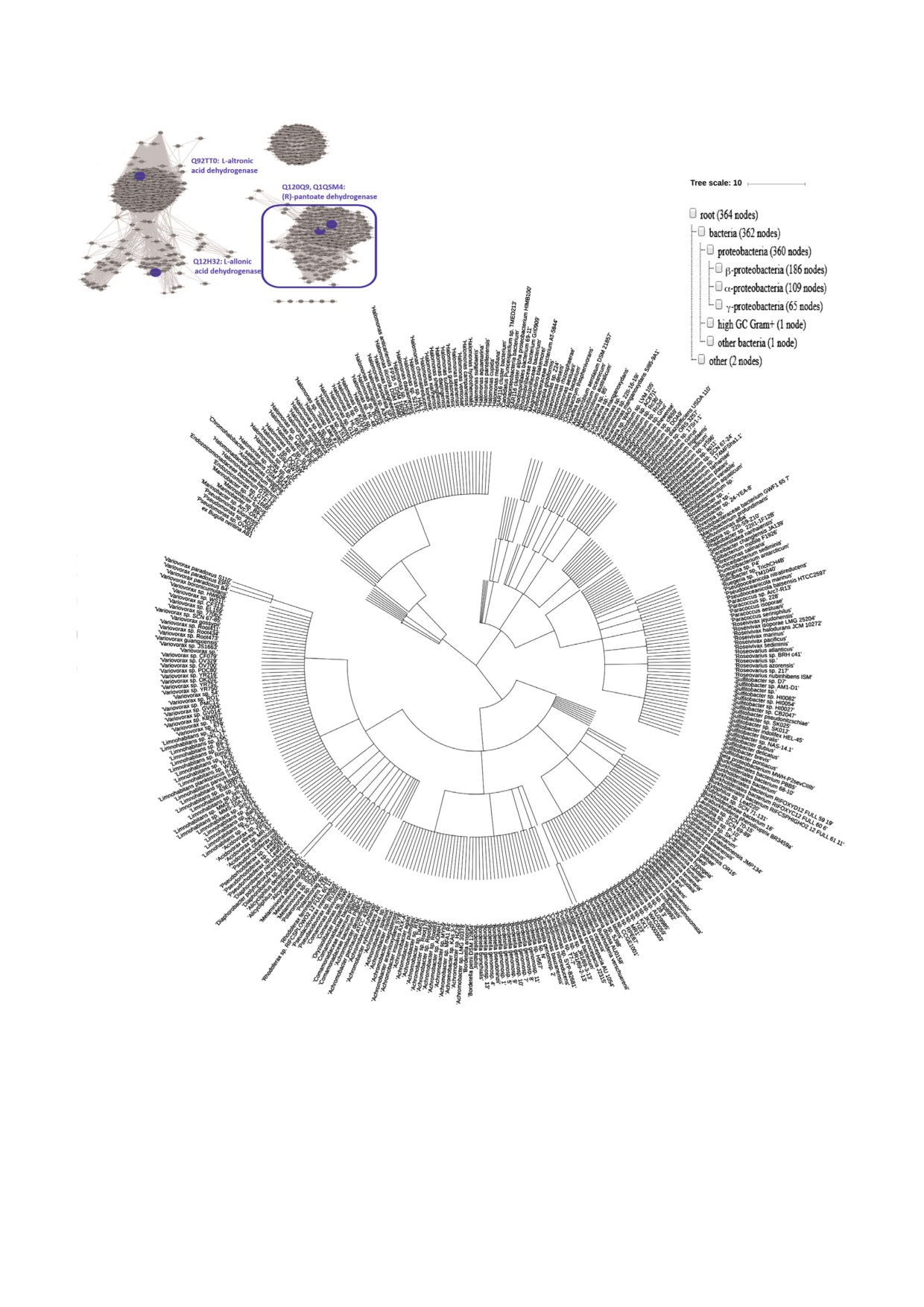
Рис. 6. Верхняя часть: SSN для 3000 гомологов Q1QSM4 (e-72, сходство 50%, 90% rep). Четыре охарактеризованных в нас
тоящей работе гомолога ThrDH выделены синим цветом. Для проведения филогенетического анализа был отобран клас
тер с (R) пантоатдегидрогеназой. Нижняя часть: присутствие (R) пантоатдегидрогеназы (выделена синей рамкой в верх
ней части рисунка) в различных организмах. Идентификационные номера из SSN были использованы для построения
CommonTree/wwwcmt.cgi. Затем скачанный файл с филогенетическим деревом открывали в программе iToL (https://
itol.embl.de/upload.cgi).
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
ФУНКЦИИ ДЕГИДРОГЕНАЗ PF14833 И PF03446
545
Некоторые гомологи ThrDH (Q1QSN6,
отношении L треоновой и L идоновой кислот,
Q1QSM4, Q120Q9, D7A6R3 и Q1LMW1) катали
имеют геномный контекст дегидратаз (треонин
зируют реакцию с субстратами, типичными для
дегидратаза, дегидратаза дигидроксикислот),
дегидрогеназы L треоновой кислоты, дегидро
что может указывать на их участие в различных
геназы D глицериновой кислоты и новой
метаболических путях. В отличие от PanDH, ко
(R) пантоатдегидрогеназы (PanDH). Выравни
торая кластеризуется с другими ферментами био
вание аминокислотных последовательностей
синтеза пантотената [21], охарактеризованная в
этих ThrDHs и дегидрогеназ β гидроксикислот
настоящей работе (R) пантоатдегидрогеназа
позволило выявить присутствие консерватив
(Q120Q9, Q1QSM4) имеет тенденцию образовы
ных последовательностей, необходимых для
вать пару с альдегиддегидрогеназой. Кроме то
связывания карбоксильных групп (мотив
го, две дегидрогеназы D глицериновой кислоты
DAPVSGG) и соседних атомов углерода (мотив
(Q1LMW1, D7A6R3) имеют разные геномные
FXXXXXXKDL) [18, 19]. Однако из за ограни
контексты. Так, Q1LMW1 кластеризуется с аль
ченности данных по структурам с близкой гомо
долазой (Q1LMW0) и катализирует следующую
логией трудно выявить корреляцию между
за этим ферментом стадию в катаболизме D
субстратной специфичностью и аминокислот
глукарата у Ralstonia metallidurans CH34 (рис. 4).
ной последовательностью фермента.
В то же время D7A6R3, возможно, вовлечена в
В отличие от широко распространенной
метаболизм гликолевой кислоты благодаря
PanDH (PF02558 PF08546), которая является
близко расположенной карболигазе глиоксило
важным ферментом биосинтеза кофермента A
вой кислоты [22]. Дегидрогеназа L альтроновой
[20], (R) пантоатдегидрогеназа (Q1QSM4,
кислоты (Q92TT0) и находящиеся поблизости
PF14833 PF03446) обнаружена исключительно
метилтрансфераза и гликозилат указывают на
в протеобактериях (рис. 6). Несмотря на то что
существование совершенно незнакомого пути,
Q12H32 (идентичность ее аминокислотной по
который необходимо будет определить.
следовательности с Q1QSM4 составляет 35,7%),
Проведенная в настоящей работе идентифи
Q92TT0 и Q1QSM4 демонстрируют различную
кация субстратов для гомологов ThrDH не толь
субстратную специфичность, они локализуются
ко проясняет метаболические пути этих соеди
в одном кластере в сети гомологов ThrDH
нений, но также способствует дальнейшему вы
(рис. 1). Увеличение строгости критериев оцен
явлению физиологических функций гомологов
ки выравнивания (e-72) позволило разделить эти
ThrDH.
ферменты на разные кластеры в соответствии с
их функциями (рис. 6).
Приведенные выше данные о субстратной
Финансирование. Работа выполнена при под
специфичности гомологов ThrDH согласуются с
держке National Natural Science Foundation,
данными о разнообразии их геномного контекс
China (grant No. 31970087) и South China Normal
та (рис. S1 Приложения). Аналогично дегидро
University (start up grant).
геназе L треоновой кислоты (Q1QSN6) и дегид
Конфликт интересов. Авторы заявляют об от
рогеназе L идоновой кислоты (B9JKN9) было
сутствии конфликта интересов.
доказано, что DUF1537 и соседняя альдолаза
Соблюдение этических норм. Настоящая
участвуют в деградации сахаров, представлен
статья не содержит описания каких либо иссле
ных на рис. 4 [10]. Однако B9J8U1 и A9CHF6,
дований с использованием людей и животных в
которые демонстрируют сходную активность в
качестве объектов изучения.
СПИСОК ЛИТЕРАТУРЫ
1.
Ramachandran, S., Fontanille, P., Pandey, A., and Larroche, C.
human metabolome, Nucleic Acids Res., 37, D603 D610,
(2006) Gluconic acid: properties, applications and microbial
doi: 10.1093/nar/gkn810.
production, Food Technol. Biotechnol., 44, 185 195.
5.
Holzer, H., and Holldorf, A. (1957) Isolation of D glycerate
2.
Smirnoff, N. (2000) Ascorbic acid: metabolism and func
dehydrogenase, some properties of the enzyme and its appli
tions of a multi facetted molecule, Curr. Opin. Plant Biol.,
cation to the enzymic optic determination of hydroxypyru
3, 229 235.
vate in presence of pyruvate, Biochem. Z., 329, 292 312.
3.
Vimr, E. R., Kalivoda, K. A., Deszo, E. L., and
6.
Dreyer, J. L. (1987) The role of iron in the activation of
Steenbergen, S. M. (2004) Diversity of microbial sialic acid
mannonic and altronic acid hydratases, two Fe requiring
metabolism, Microbiol. Mol. Biol. R,
68,
132153,
hydro lyases, Eur. J. Biochem., 166, 623 630, doi: 10.1111/
doi: 10.1128/mmbr.68.1.132 153.2004.
j.1432 1033.1987.tb13559.x.
4.
Wishart, D. S., Knox, C., Guo, A., Eisner, R., Young, N.,
7.
Dahms, A. S., and Donald, A. (1982) D xylo aldonate
Gautam, B., Hau, D. D., Psychogios, N., Dong, E.,
dehydratase, Methods Enzymol.,
90, E302 E305,
Bouatra, S. et al. (2009) HMDB: a knowledgebase for the
doi: 10.1016/s0076 6879(82)90145 8.
БИОХИМИЯ том 85 вып. 4 2020
546
ЧЖАН и др.
8.
Shimizu, T., Takaya, N., and Nakamura, A. (2012) An L
of
4 pentulosonate
(4 keto D pentonate) from D
glucose catabolic pathway in Paracoccus species 43P, J. Biol.
aldopentose and D pentonate by two different pathways
Chem., 287, 40448 40456, doi: 10.1074/jbc.M112.403055.
using membrane enzymes of acetic acid bacteria, Biosci.
9.
Wichelecki, D. J., Balthazor, B. M., Chau, A. C., Vetting, M. W.,
Biotechnol. Biochem., 75, 2418 2420, doi: 10.1271/bbb.
Fedorov, A. A., Fedorov, E. V., Luk, T., Patskovsky, T. Y.,
110575.
Stead, M. B., Hillerich, B. S., Seidel, R. D., Almo, S. C.,
16. Arrigoni, O., and De Tulio, M. C. (2002) Ascorbic acid:
and Gerlt, J. A. (2014) Discovery of function in the enolase
much more than just an antioxidant, Biochim. Biophys.
superfamily: D mannonate and D gluconate dehydratases
Acta, 1569, 1 9, doi: 10.1016/s0304 4165(01)00235 5.
in the D mannonate dehydratase subgroup, Biochemistry,
17. Yew, W. S., Fedorov, A. A., Fedorov, E. V., Rakus, J. F.,
53, 2722 2731, doi: 10.1021/bi500264p.
Pierce, R. W., Almo, S. C., and Gerlt, J. A. (2006)
10.
Zhang, X., Carter, M. S., Vetting, M. W., Francisco, B. S.,
Evolution of enzymatic activities in the enolase super
Zhao, S., Al Obaidi, N. F., Solbiatia, J. O., Thiavilled, J. J.,
family: L fuconate dehydratase from Xanthomonas
Crecy Lagard, V., Jacobson, M. P., Almo, S. C., and
campestris, Biochemistry, 45, 14582 14597, doi: 10.1021/
Gerlt, J. A. (2016) Assignment of function to a domain of
bi061687o.
unknown function: DUF1537 is a new kinase family in
18. Tchigvintsev, A., Singer, A., Brown, G., Flick, R.,
catabolic pathways for acid sugars, Proc. Natl. Acad. Sci.
Evdokimova, E., Tan, K., Gonzalez, C. F., Savchenko, A.,
USA, 113, E4161 E4169, doi: 10.1073/pnas.1605546113.
and Yakunin, A. F. (2012) Biochemical and structural stud
11.
Gerlt, J. A., Bouvier, J. T., Davidson, D. B., Imker, H. J.,
ies of uncharacterized protein PA0743 from Pseudomonas
Sadkhin, B., Slater, D. R., and Whalen, K. L. (2015)
aeruginosa revealed NAD dependent L serine dehydroge
Enzyme Function Initiative Enzyme Similarity Tool (EFI
nase, J. Biol. Chem., 287, 1874 1883, doi: 10.1074/jbc.
EST): a web tool for generating protein sequence similari
M111.294561.
ty networks, Biochim. Biophys. Acta, 1854, 1019 1037,
19. Srikalaivani, R., Singh, A., Vijayan, M., and Surolia, A.
doi: 10.1016/j.bbapap.2015.04.015.
(2018) Structure, interactions and action of Mycobacterium
12.
Luo, S., and Huang, H. (2018) Discovering a new catabol
tuberculosis
3 hydroxyisobutyric acid dehydrogenase,
ic pathway of D ribonate in Mycobacterium smegmatis,
Biochem. J., 475, 2457 2471, doi: 10.1042/BCJ20180271.
Biochem. Biophys. Res. Commun.,
505,
11071111,
20. Zheng, R., and Blanchard, J. S. (2000) Kinetic and mech
doi: 10.1016/j.bbrc.2018.10.033.
anistic analysis of the E. coli panE encoded ketopantoate
13.
Aghaie, A., Lechaplais, C., Sirven, P., Tricot, S., Besnard
reductase, Biochemistry, 39, 3708 3717, doi: 10.1021/
Gonnet, M., Muselet, D., Berardinis, V., Kreimeyer, A.,
bi992676g.
Gyapay, G., Salanoubat, M., and Perret, A. (2008) New
21. Webb, M. E., Smith, A. G., and Abell, C.
(2004)
insights into the alternative D glucarate degradation path
Biosynthesis of pantothenate, Nat. Prod. Rep., 21, 695
way, J. Biol. Chem., 283, 15638 15646, doi: 10.1074/jbc.
721, doi: 10.1039/b316419p.
M800487200.
22. Grostern, A., Sales, C.M., Zhuang, W.Q., Erbilgin, O.,
14.
Severi, E., Hood, D. W., and Thomas, G. H. (2007) Sialic
and Alvarez Cohen, L. (2012) Glyoxylate metabolism is a
acid utilization by bacterial pathogens, Microbiology, 153,
key feature of the metabolic degradation of 1,4 dioxane by
2817 2822, doi: 10.1099/mic.0.2007/009480 0.
Pseudonocardia dioxanivorans strain CB1190, Appl.
15.
Adachi, O., Hours, R. A., Shinagawa, E., Akakabe, Y.,
Environ. Microbiol., 78, 3298 3308, doi: 10.1128/AEM.
Ykushi, T., and Matsushita, K. (2011) Enzymatic synthesis
00067 12.
SUBSTRATE DIVERSITY OF L THREONIC ACID
DEHYDROGENASE HOMOLOGS*,**
C. F. Zhang1#, Y. P. Liu1#, X. X. Wu1, X. S. Zhang2***, and H. Huang1***
1 Guangdong Provincial Key Laboratory of Biotechnology for Plant Development, School of Life Sciences,
South China Normal University, Guangzhou, 510631 Guangdong, China; E mail: hhuang@m.scnu.edu.cn
2 Institute of Ecological Science, School of Life Sciences, South China Normal University,
Guangzhou, Guangdong, 510631 China; E mail: xszhang@scnu.edu.cn
Received November 26, 2019
Revised January 7, 2020
Accepted January 21, 2020
Despite physiological importance of aldonic sugar acids for living organisms, little is known about metabolic pathways
of these compounds. Here, we investigated the functional diversity of homologs of L threonic acid dehydrogenase
(ThrDH; UniProt ID: Q0KBC7), an enzyme composed of two NAD binding domains (PF14833 and PF03446). Ten
ThrDH homologs with different genomic context were studied; seven new enzymatic activities were identified, such
as (R) pantoate dehydrogenase, L altronic acid dehydrogenase, 6 deoxy L talonate dehydrogenase, L idonic acid
dehydrogenase, D xylonic acid dehydrogenase, D gluconic acid dehydrogenase, and 2 hydroxy 3 oxopantoate
reductase activities. Two associated metabolic pathways were identified: L idonic acid dehydrogenase was found to be
involved in the degradation of L idonic acid through oxidation/decarboxylation in Agrobacterium radiobacter K84,
while 2 hydroxy 3 oxopantoate reductase was found to participate in D glucarate catabolism through dehydra
tion/cleavage in Ralstonia metallidurans CH34.
Keywords: (R) pantoate dehydrogenase, L idonic acid catabolism, D glucarate catabolism, L altronic acid dehydro
genase, D xylonic acid dehydrogenase
БИОХИМИЯ том 85 вып. 4 2020