БИОХИМИЯ, 2020, том 85, вып. 4, с. 598 - 606
УДК 577.152.313
НЕОРГАНИЧЕСКИЕ ПОЛИФОСФАТЫ И ОСОБЕННОСТИ
ФИЗИОЛОГИИ ДРОЖЖЕЙ Saccharomyces cerevisiae
ПРИ СВЕРХЭКСПРЕССИИ ГЕНА PPN2
© 2020
Л.П. Рязанова1, Л.А. Ледова1, Н.А. Андреева1, А.Н. Звонарев1,
М.А. Эльдаров2, Т.В. Кулаковская1*
1 Пущинский научный центр биологических исследований,
Институт биохимии и физиологии микроорганизмов им. Г. К. Скрябина РАН,
142290 Пущино Московской обл., Россия; электронная почта: alla@ibpm.pushchino.ru
2 ФИЦ биотехнологии, Институт биоинженерии РАН, 117312 Москва, Россия
Поступила в редакцию 29.01.2020
После доработки 15.02.2020
Принята к публикации 17.02.2020
Исследовано влияние сверхрпродукции дрожжевой эндополифосфатазы Ppn2 на метаболизм неорганичес!
ких полифосфатов у Saccharomyces cerevisiae. Экспрессия гена PPN2 в дрожжах под контролем сильного
конститутивного промотора гена глицеральдегид!3!фосфатдегидрогеназы (PKG1) приводила к значитель!
ному повышению эндополифосфатазной активности, стимулируемой ионами кобальта/цинка. Эта актив!
ность была более выражена с длинноцепочечными полифосфатами, стимулировалась АDP и присутствова!
ла как в растворимой, так и грубой мембранной фракциях. Содержание короткоцепочечных полифосфатов
в клетках штамма!трансформанта увеличилось в ~ 2,5 раза по сравнению с родительским штаммом. Штамм
c сверхэкспрессией Ppn2 более устойчив к перекиси и щелочи. Обсуждается роль короткоцепочечных по!
лифосфатов в адаптации к этим неблагоприятным факторам.
КЛЮЧЕВЫЕ СЛОВА: полифосфат, полифосфатаза, ген PPN2, сверхэкспрессия, Saccharomyces cerevisiae.
DOI: 10.31857/S0320972520040120
Неорганические полифосфаты (полиР), ли!
ношением экзо! и эндополифосфатазной ак!
нейные полимеры ортофосфорной кислоты,
тивности [11], не имеют сходства по аминокис!
представляют собой регуляторные биополиме!
лотной последовательности и относятся к раз!
ры, которые присутствуют в клетках как прока!
ным семействам, cогласно базам данных
риот, так и эукариот [1-4]. Cистема деградации
полиР у дрожжей состоит из нескольких фер!
ментов, различающихся по своей локализации,
клетки двойного нокаут!мутанта по генам PPX1
физико!химическим свойствам и функциональ!
и PPN1 способны использовать свои полиР для
ному значению [5-10]. Эти ферменты различа!
роста при голодании по фосфату [12]. Следова!
ются по преобладанию экзополифосфатазной
тельно, Ddp1и Ppn2 способны компенсировать
или эндополифосфатазной активностей, благо!
отсутствие двух других полифосфатаз. В связи с
даря чему по!разному воздействуют на полиР.
такой мультикомпонентностью и возможной
Экзополифосфатаза (полифосфат фосфогидро!
взаимозаменяемостью в системе катаболизма
лаза, КФ 3.6.1.11) отщепляет P с конца поли!
полиР у дрожжей, использование нокаут!мутан!
мерной цепи, а эндополифосфатаза (полифос!
тов по каждому из генов, кодирующих полифос!
фат деполимераза, КФ 3.6.1.10.) расщепляет
фатазы, не достаточно для изучения функций
длинноцепочечные полиР на более короткоце!
этих ферментов. Еще одним подходом, позволя!
почечные, вплоть до триполифосфата. У дрож!
ющим судить о функциональном значении от!
жей Saccharomycer cerevisiae известны четыре
дельных полифосфатаз, является получение
белка, обладающих полифосфатазной актив!
штаммов, сверхэкспрессирующих эти фермен!
ностью: Ppx1 [5, 6], Ppn1 [7, 8], Ddp1 [9] и Ppn2
ты. Используя данный подход, мы показали, что
[10]. Эти белки характеризуются разным соот!
сверхэкспрессия Ppx1 не влияет на длину цепи и
количество полиР [13], сверхэкспрессия Ppn1
Принятые сокращения: полиР - неорганические
[14] и Ddp1 [15] приводит к изменениям в коли!
полифосфаты.
честве и длине цепи полиР, в сверхэкспрессия
* Адресат для корреспонденции.
Ppn1 влияет на стрессовые ответы [16]. Эндопо!
598
ДРОЖЖИ, ТРАНСФОРМИРОВАННЫЕ ГЕНОМ PPN2
599
лифосфатаза Ppn2 открыта относительно недав!
ванной синтетической минимальной среде YNB
но [10] и предполагается, что основная ее функ!
без урацила [14]. Cреда содержала на 1 л: 6,7 г
ция - это деполимеризация полиР в вакуолях,
бакто!дрожжевых азотистых оснований
где локализован этот фермент.
(«Difсo», США), 20 г глюкозы, по 20 мг L!трип!
Целью настоящей работы была оценка влия!
тофана, L!гистидина, L!метионина и аденина и
ния сверхэкспрессии гена PPN2 на метаболизм
60 мг L!лейцина. При выращивании штамма
полифосфатов и устойчивость к некоторым ви!
CRN дополнительно вносили урацил в конце!
дам стресса у S. cerevisiae.
нтрации 20 мг/л.
Для получения биомассы культуры выращи!
вали при 29 °С на качалке при 145 об/мин до
МАТЕРИАЛЫ И МЕТОДЫ
стационарной стадии роста в колбах с 200 мл
среды YNB с урацилом и без урацила для штам!
Штаммы дрожжей. Штамм CRN с инактиви!
мов CRN и CRN/PPN2 соответственно. Затем
рованным геном PPN1 (MATa ade2 his3 ura3
пересевали на такие же среды, для посева брали
ppn1Δ::CgTRP1) [7] использовали в качестве ро!
аликвоты культуры с одинаковой концентраци!
дительского штамма. Применение штамма, де!
ей клеток. Эти культуры использовали для по!
фектного по гену PPN1, cвязано с тем, что
лучения кривых роста, а клетки на стационар!
штамм дикого типа при попытках ввести в него
ной стадии роста - для определения чувстви!
векторы, содержащие гены полифосфатаз, имел
тельности к токсикантам и получения образцов
очень слабую жизнеспособность. Штамм
биомассы для анализа. Кривые роста строили
CRN/PPN2, сверхэкспрессирующий ген PPN2
по оптической плотности при 595 нм в кюветах
(MATa ade2 his3 ura3 ppn1Δ::CgTRP1 pMB1_PPN2
с толщиной оптического пути 0,3 см на спек!
Sc), получали согласно методу, подробно опи!
трофотометре
«Unico» (США). Концентра!
санному ранее [14]. Cоздание экспрессионного
цию клеток в стационарной стадии роста оце!
вектора рМВ1 с «кассетой экспрессии», состо!
нивали с помощью подсчета в камере Горяева, а
явшей из сильного конститутивного промотора
количество мертвых клеток - с помощью ок!
глицеральдегид!3!фосфатдегидрогеназы (PKG1)
раски пропидий йодидом и подсчета доли окра!
и терминатора фоcфосфоглицераткиназы (TDH)
шенных клеток при флуоресцентной микроско!
S. cerevisiae, описано в той же работе [14].
пии.
Конструирование вектора экспрессии гена
Биомассу собирали центрифугированием
PPN2. Кодирующую последовательность гена
при 4000 g, дважды промывали холодной дис!
PPN2 получали методом ПЦР на матрице ге!
тиллированной водой.
номной ДНК штамма CRN с помощью Phuzion
Получение сферопластов и препаратов, содер>
ДНК полимеразы
(«New England Biolabs»,
жащих Ppn2. Для получения сферопластов био!
США) и праймеров PPN2_F (5′!GGACAT!
массу промывали 0,8 М раствором маннита в
GTCTGAAGATAAGCGGAAAAGACGAG!3′) и
5%!ном цитратном буфере, рН 6,5, инкубирова!
PPN2_R
(5′!GGTCTCGAGTGTTTTAAGAG!
ли в этом же буфере с лиофилизированным же!
CATTGTACTTGAATTA!3′). Праймеры выбира!
лудочным соком виноградных улиток (150 мг на
ли с помощью сервиса PrimerBLAST (https://
1 г биомассы) и дитиотреитолом (10 мг на 1 г би!
омассы) в течение 2 ч при 30 °С. Cферопласты
новании референсной последовательности гена
промывали тем же буфером и разрушали при
YNL217W (Genbank ID NM_001183055.1). К
4 °С в стеклянном гомогенизаторе с тефлоно!
последовательностям добавляли 5′!фланкирую!
вым пестиком в 50 мМ Tris!HCl, рН 7,2, и
щие сайты PciI и XhoI. Полученный ПЦР фраг!
0,5 мМ фенилметилсульфонилфторид («Sigma»,
мент размером 1 т.п.н. после гидролиза PciI и
США). Затем центрифугировали при 5000 g в те!
XhoI встраивали в NcoI/XhoI вектор pMB1r.
чение 5 мин, к осадку снова добавляли этот же
После проверки секвенированием препараты
буфер и обрабатывали в гомогенизаторе. Затем
плазмидной ДНК с «корректными» вставками
центрифугировали при тех же условиях. Объ!
использовали для трансформации реципиент!
единенный супернатант центрифугировали при
ного штамма СRN методом электропорации.
13 000 g в течение 60 мин. Супернатант предс!
Отобранные на среде SD прототрофные по ура!
тавлял собой бесклеточный экстракт, а осадок -
цилу трансформанты проверяли дополнительно
грубую мембранную фракцию.
методом ПЦР на наличие вектора.
Для определения влияния двухвалентных
Условия культивирования. Штамм CRN под!
катионов, ADP и ATP, а также эндополифосфа!
держивали на агаризованной синтетической
тазной активности с полиР разной степени по!
минимальной среде YNB с добавлением ураци!
лимерности использовали препарат бесклеточ!
ла, а трансформант CRN/PPN2 - на агаризо!
ного экстракта после высаливания при 85%!ном
БИОХИМИЯ том 85 вып. 4 2020
600
РЯЗАНОВА и др.
1 мкмоль Р за 1 мин. Концентрацию белка опре!
деляли с использованием БСА в качестве стан!
дарта [17].
Эндополифосфатазную активность анализи!
ровали по уменьшению длины цепи полифос!
фатов (полиР188 и полиР15). Инкубационная сре!
да (0,5-1 мл) содержала 50 мМ Tris!HCl, pH 7,2,
200 мМ NH4Cl, 0,01-0,1 мМ ZnCl2, 2,5 мM,
9 мМ полиР188 либо 6,8 мМ полиР15. Время ин!
кубации составляло 30 мин. Реакцию останав!
ливали добавлением HClO4 до концентрации
0,5 М. Дальнейшую подготовку образцов и
электрофорез в 24%!ном ПААГ с 7 М мочеви!
ной проводили как описано ранее [8].
Определение содержания полифосфатов в
клетках. Для экстракции полиР применяли из!
вестный метод [18] c небольшими модификаци!
ями. Кислоторастворимую фракцию полиР по!
лучали двукратной обработкой биомассы 0,5 N
HClO4 при 0 °С в течение 15 мин при перемеши!
вании. После отделения супернатанта оставшу!
Рис. 1. а - Кривые роста штаммов СRN (1) и СRN/PPN2
(2) на среде YNB; б -микрофотографии (фазовый конт!
раст) клеток родительского штамма CRN и штамма!
СRN/PPN2, выращенных в течение 36 ч на среде YNB,
метка - 10 мкм. Представлены средние значения трех био!
логических повторностей.
насыщении сульфатом аммония. Сульфат ам!
мония добавляли к бесклеточному экстракту до
50%!ного насыщения, выдерживали в течение
1 ч, затем удаляли балластные белки центрифу!
гированием при 13 000 g 20 мин. К супернатанту
добавляли сульфат аммония до 85%!ного насы!
щения, выдерживали в течение 20 ч на холоду,
затем осаждали при 14 000 g 1 ч и перерастворя!
ли осадок в 25 мM Tris!HCl, pH 7,2, содержав!
шем 0,1%!ный Triton X!100.
Определение полифосфатазных активностей.
Экзополифосфатазную активность определяли
при 30 °С по скорости образования Р [5]. Инку!
бационная среда содержала 50 мМ Tris!HCl, рН
7,2, 2,5 мМ MgSO4 и 200 мМ NH4Cl. В качестве
субстратов использовали 2,5 мМ полиР со сред!
ней длиной цепи 188 фосфатных остатков (по!
лиР188) или 15 фосфатных остатков (полиР15)
(«Monsanto», США). Концентрация полиР ука!
Рис. 2. Эндополифосфатазная активность в грубой мемб!
зана в соответствии с количеством P, образую!
ранной фракции (1) и бесклеточном экстракте (2) штам!
щимся при гидролизе полимера в 1 М HCl при
мов CRN и СRN/PPN2. Активность определяли c исполь!
100° за 10 мин. ПолиР предварительно очищали
зованием полиР188 в качестве субстрата в присутствии
1 мM Zn2+. Содержание белка в образцах: 40 мкг (мембран!
от примесей пирофосфата и ортофосфата как
ная фракция CRN),
4 мкг (мембранная фракция,
описано ранее [5]. За единицу активности (Е) в
CRN/PPN2), 150 мкг (растворимая фракция, CRN), 13 мкг
случае экзополифосфатаной активности прини!
(растворимая фракция CRN/PPN2). Представлен резуль!
мали количество фермента, образующего
тат двух биологических повторностей
БИОХИМИЯ том 85 вып. 4 2020
ДРОЖЖИ, ТРАНСФОРМИРОВАННЫЕ ГЕНОМ PPN2
601
юся биомассу дважды обрабатывали насыщен!
крышкой, содержавшие среду YPD и аликвоты
ным раствором NaClO4 при 0 °С, супернатант
стерильного раствора Cd(CH3COO)2⋅2H2O, пе!
после центрифугирования представлял собой
рекиси или KOH. После 24 ч культивирования
солерастворимую фракцию полиР. Осадок обра!
оптическую плотность культур измеряли с по!
батывали дважды 0,05 М NaOH, супернатант
мощью планшетного фотометра «Эфос» (Рос!
представлял собой щелочерастворимую фрак!
сия) при длине волны 600 нм.
цию. В полученных фракциях содержание по!
Статистическая обработка. Все эксперимен!
лиР оценивали по лабильному фосфору. Коли!
ты повторяли трижды. На рисунках представле!
чество оставшихся в биомассе кислотонераство!
ны средние значения со стандартным отклоне!
римых полифосфатов оценивали по содержа!
нием, полученные с помощью программы Excel.
нию P после обработки биомассы 0,5 N HClO4
Электрофореграммы повторяли дважды, на ри!
при 100 °С в течение 20 мин. Количество P опре!
сунках представлены лучшие результаты.
деляли колориметрически [19].
Определение чувствительности штаммов к пе>
рекиси, щелочи, ионам кадмия. Чувствительность
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
к Cd2+, щелочи и перекиси определяли с по!
мощью культивирования в планшетах на среде
Наличие у штамма CRN/PPN2 экспрессион!
YPD, поскольку в среде YNB при добавлении
ного вектора, содержащего ген PPN2, приводи!
этих реагентов выпадал осадок. Образцы куль!
ло к изменению характера роста на минималь!
тур, стандартизованных по концентрации кле!
ной среде по сравнению с исходным штаммом
ток, добавляли в ячейки стерильного планшета с
(рис. 1, а), скорость роста в логарифмической
Рис. 3. Влияние двухвалентных катионов на эндополифосфатазную активность бесклеточного экстракта штамма
СRN/PPN2 (препарат, полученный с помощью высаливания сульфатом аммония) с полиР188 (9 мМ), в присутствии 200 мМ
NH4Cl, время инкубации 30 мин. К - контроль, без препарата белка, 0 - в отсутствии двухвалентных катионов, цифрами
указаны концентрации двухвалентных катионов в мМ. Представлен результат двух биологических повторностей
10 БИОХИМИЯ том 85 вып. 4 2020
602
РЯЗАНОВА и др.
Известно, что Ppn2 проявляет эндополи!
фосфатазную активность [6]. Проведено срав!
нение эндополифосфатазной активности беск!
леточного экстракта и грубой мембранной
фракции исходного штамма СRN, и штамма
CRN/PPN2 в присутствии 1 мМ Zn2+, оцени!
вая их по уменьшению длины цепи полиР188.
У исходного штамма СRN отсутствует эндопо!
лифосфатаза Ppn1 [7], но имеется фермент
Ddp1, проявляющий эндополифосфатазную
активность. Эндополифосфатазная активность
как в бесклеточном экстракте, так и в грубой
мембранной фракции сверхпродуцента Ppn2
ожидаемо увеличилась (рис. 2). Отметим, что в
норме фермент Ppn2 локализуется в вакуолях,
тогда как у сверхпродуцента Ppn2 наблюдается
появление его в растворимой форме. Подоб!
ный эффект наблюдали для штамма, сверхэкс!
прессирующего полифосфатазу Ppn1 под конт!
Рис. 4. Эндополифосфатазная активность бесклеточного
экстракта CRN/PPN2 (препарат, полученный с помощью
высаливания сульфатом аммония) c полиР различной сте!
пени полимерности, в инкубационной среде присутство!
вал 0,05 мМ Со2+ и 200 мМ NH4Cl. ПолиР188, полиР65, по!
лиР15 - полиР cо средней длиной цепи 188, 65 и 15 фосфат!
ных остатков инкубировали в отсутствии препарата Ppn2.
Представлен результат двух биологических повторностей
стадии была снижена (0,28 ч-1) по сравнению с
родительским штаммом CRN (0,376 ч-1). Одна!
ко на стационарной стадии роста количество
сырой биомассы, оптическая плотность культу!
ры (рис. 1, а) и концентрация клеток у обоих
штаммов становились близкими. В популяции
штамма CRN/PPN2 присутствовало много кле!
ток увеличенного размера и измененной формы
(рис. 1, б). По!видимому, увеличение размера
клеток объясняет изменение соотношения меж!
ду величинами сухой и сырой биомассы: 1 г су!
хой биомассы соответствовал 4,9 и 5,7 г сырой
биомассы для клеток штаммов CRN и
Рис. 5. Влияние ADP на эндополифосфатазную актив!
CRN/PPN2 соответственно. Оценку количества
ность бесклеточного экстракта CRN/PPN2 PPN2 (препа!
рат, полученный с помощью высаливания сульфатом ам!
мертвых клеток на стационарной стадии роста у
мония) с полиР188 в присутствии 200 мМ NH4Cl и 0,05 мМ
обоих штаммов проводили с помощью окраски
CoSO4, время инкубации 30 мин. К - контроль, препарат
пропидий йодидом, оно оказалось близким и не
Ppn2 не добавлен, Ppn2 - препарат добавлен. Представлен
превышало 5-7%.
результат двух биологических повторностей
БИОХИМИЯ том 85 вып. 4 2020
ДРОЖЖИ, ТРАНСФОРМИРОВАННЫЕ ГЕНОМ PPN2
603
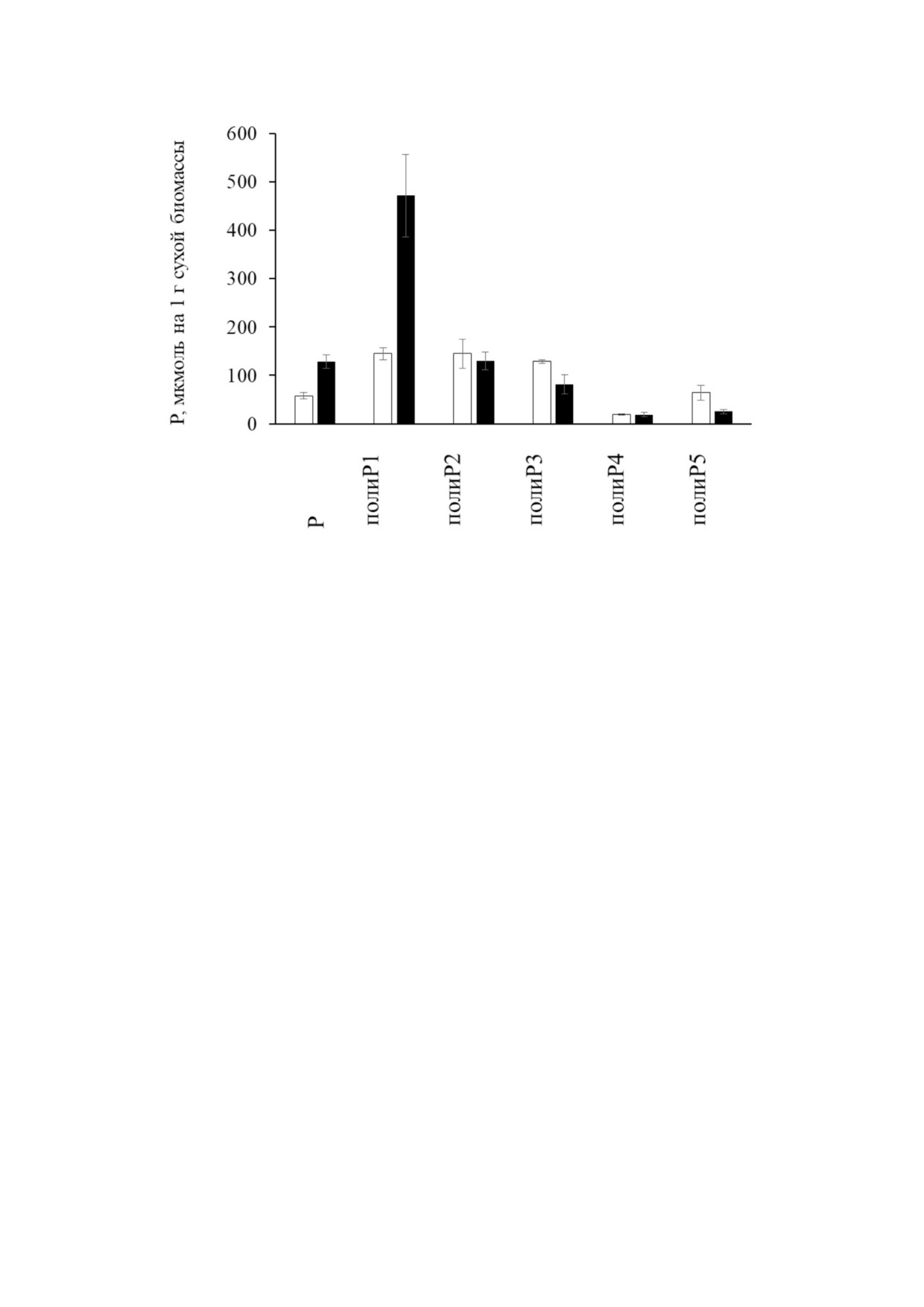
Рис. 6. Содержание ортофосфата (Р) и полиР различных фракций в клетках штаммов S. cerevisiae CRN (белые столбцы) и
CRN/PPN2 (черные столбцы) на стационарной стадии роста. Представлены средние значения трех биологических пов!
торностей
ролем того же вектора, содержащего ген PPN1
длина цепи полиР этих двух фракций у сверх!
[20].
продуцента уменьшена по сравнению с клетка!
Мы изучили некоторые свойства эндополи!
ми родительского штамма (рис. 7). В целом,
фосфатазной активности бесклеточного экс!
сверхэкспрессия эндополифосфатазы Ppn2 при!
тракта штамма CRN/PPN2, используя препарат,
вела к увеличению содержания короткоцепо!
полученный из растворимой фракции после
чечных полиР, что согласуется с субстратной
осаждения сульфатом аммония в условиях 85%
специфичностью этого фермента (см. рис. 4).
насыщения. Экзополифосфатазная активность
Рассмотрим, какие еще физиологические
препарата была низкой и не превышала 3 мЕ на
особенности проявляются при сверхэкспрессии
1 мг белка. На рис. 3 показано влияние двухва!
эндополифосфатазы Ppn2. Известно, что важ!
лентных катионов на эндополифосфатазную ак!
ную роль в устойчивости клеток дрожжей к Cd2+
тивность такого препарата. Ионы Co2+ и Zn2+
играют кислоторастворимые низкополимерные
cтимулировали активность уже при 0,005 мМ,
полиР [21]. Однако, несмотря на увеличение со!
тогда как ионы Mg2+ были слабыми стимулято!
держания этих полиР у штамма, сверхэкспрес!
рами. Co2+ оказался более эффективным стиму!
сирующего Ppn2, по чувствительности к кад!
лятором, чем Zn2+. Эта активность проявлялась
мию разницы между штаммами в диапазоне
как с длинноцепочечными полиР188, так и с ко!
концентраций 0,01-0,1 мМ не обнаружено.
роткоцепочечными полиР15, однако наиболее
Концентрация 0,05 мМ вызывала ~ 70% ингиби!
выраженной она была с полиР188 (рис. 4). АDP
рование роста у обоих штаммов. Штамм
оказывал стимулирующее воздействие (рис. 5), а
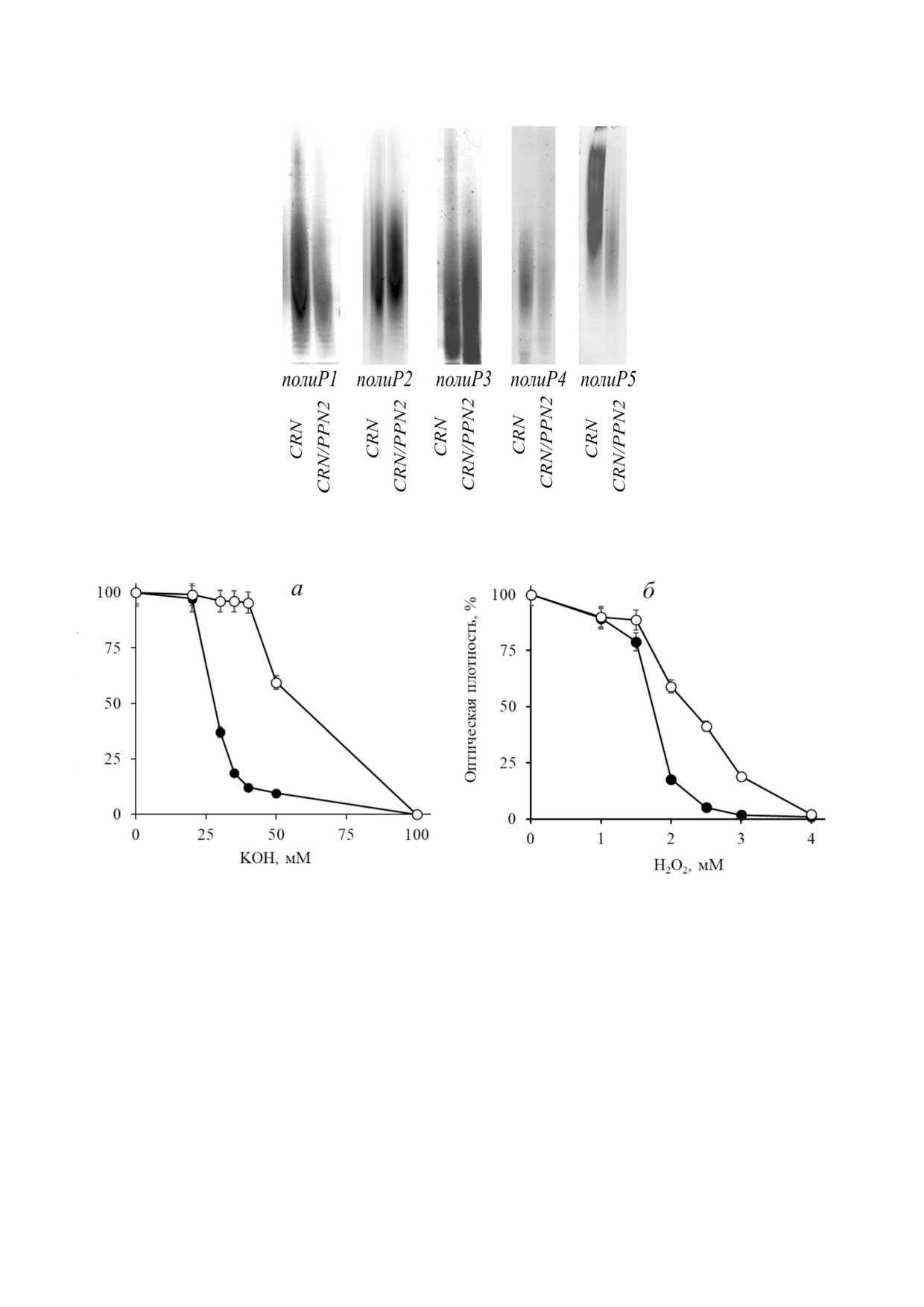
CRN/PPN2 оказался более устойчивым к воз!
ATP (2 мМ) не влиял на эту активность (не ил!
действию щелочи и перекиси (рис. 8).
люстрируется).
Итак, сверхэкспрессия полифосфатазы Ppn2
Проведено сравнение содержания фосфата и
в клетках S. cerevisiae привела к увеличению эн!
полиР различных фракций в клетках стационар!
дополифосфатазной активности, зависимой от
ной стадии роста (рис. 6). Видно, что у штам!
ионов цинка или кобальта, и наиболее активной
ма-трансформанта увеличилось содержание P и
в отношении длинноцепочечных полиР. Клетки
наиболее короткоцепочечных полиР1 и снизи!
штамма, сверхпродуцирующего Ppn2, cодержат
лось содержание наиболее длинноцепочечных
значительно больше фосфата и короткоцепочеч!
полиР3 и полиР5. Отметим также, что средняя
ных полиР1. Отметим, что штамм, сверхпроду!
БИОХИМИЯ том 85 вып. 4 2020
10*
604
РЯЗАНОВА и др.
Рис. 7. Электрофорез фракций полиР, экстрагированных из клеток штаммов CRN и CRN/PPN2 S. cerevisiae, выращенных
на среде YNB до стационарной стадии роста. Представлен результат двух биологических повторностей
Рис. 8. Подавление роста штаммов CRN (черные кружки) и CRN/PPN2 (белые кружки) при культивировании в присут!
ствии КОН и перекиси. Представлены средние значения трех биологических повторностей
цирующий полифосфатазу Ppn1, характеризует!
ральном фосфорном обмене. Возможно, что уве!
ся значительным снижением содержания как
личение содержания Р и низкополимерных по!
короткоцепочечных, так и длинноцепочечных
лиР приводит к увеличению внутриклеточного
полиР [14], а в клетках штаммов, сверхпродуци!
осмотического давления и изменению формы и
рующих полифосфатазы Ppx1 [13] и Ddp1 [15],
размера клеток у штамма CRN/PPN2 (рис. 1, б).
не было отмечено значительных изменений в со!
Подобный эффект у других штаммов, сверхпро!
держании полиР по сравнению с родительским
дуцирующих полифосфатазы, не наблюдали.
штаммом. Сравнение влияния сверхэкпрессии
Полученные данные позволяют уточнить
различных полифосфатаз на содержание полиР
роль Ppn2 в условиях щелочного и окислитель!
у S. cerevisiae свидетельствует в пользу представ!
ного стрессов. Предположено, что короткоце!
ления о разной роли этих ферментов в мине!
почечные полиР, которые образуются в увели!
БИОХИМИЯ том 85 вып. 4 2020
ДРОЖЖИ, ТРАНСФОРМИРОВАННЫЕ ГЕНОМ PPN2
605
ченном количестве у штамма, сверхпродуциру!
для дальнейшего исследования роли низкомо!
ющего эту полифосфатазу, повышают устойчи!
лекулярных полиР в адаптационных реакциях
вость к обоим воздействиям. Известно, что по!
клеток S. cerevisiae.
лиР могут выполнять роль «химических» шапе!
ронов, предохраняющих белки от воздействия
перекиси [22]. Низкополимерные полиР, обыч!
Конфликт интересов. Авторы заявляют об от!
но локализованные в цитоплазме [23], лучше
сутствии конфликта интересов.
гидролизуются полифосфатазой Ррх1 и благода!
Соблюдение этических норм. Настоящая
ря этому в клетке появляется больше P для нейт!
статья не содержит описания каких!либо иссле!
рализации ионов OH!. Полученный в данной
дований с использованием людей и животных
работе штамм CRN/PPN2 представляет интерес
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Rao, N. N., Gómez Garc a, M. R., and Kornberg, A.
Biochemistry (Moscow), 79, 1211!1215, doi: 10.1134/
(2009) Inorganic polyphosphate: essential for growth and
S000629791411008X.
survival, Ann. Rev. Biochem., 78, 605!647, doi: 10.1146/
14.
Eldarov, M. A., Baranov, M. V., Dumina, M. V., Shgun, A. A.,
annurev.biochem.77.083007.093039.
Andreeva, N. A., Trilisenko, L. V., Kulakovskaya, T. V.,
2.
Clotet, J. (2017) Polyphosphate: popping up from oblivion,
Ryasanova, L. P., and Kulaev, I. S. (2013) Polyphosphates
Curr. Genet., 63, 15!18, doi: 10.1007/s00294!016!0611!5.
and exopolyphosphatase activities in the yeast Saccharo>
3.
Baker, C. J., Smith, S. A., and Morrissey, J. H. (2018)
myces cerevisiae under overexpression of homologous and
Polyphosphate in thrombosis, hemostasis, and inflamma!
heterologous PPN1 genes, Biochemistry (Moscow), 78, 946!
tion, Res. Pract. Thromb. Haemost., 3, 18!25, doi: 10.1002/
953, doi: 10.1134/S0006297913080129.
rth2.12162.
15.
Trilisenko, L. V., Andreeva, N. A., Eldarov, M. A.,
4.
Xie, L., and Jakob, U. (2019) Inorganic polyphosphate, a
Dumina, M. V., and Kulakovskaya, T. V.
(2015)
multifunctional polyanionic protein scaffold, J. Biol.
Polyphosphates and polyphosphatase activity in the yeast
Chem.,
294,
2180!2190, doi:
10.1074/jbc.REV118.
Saccharomyces cerevisiae during overexpression of the
002808.
DDP1 gene, Biochemistry (Moscow), 80, 1312!1317,
5.
Andreeva, N. A., and Okorokov, L. A. (1993) Purification
doi: 10.1134/S0006297915100120.
and characterization of highly active and stable polyphos!
16.
Trilisenko, L., Zvonarev, A., Valiakhmetov, A., Penin, A. A.,
phatase from Saccharomyces cerevisiae cell envelope, Yeast,
Eliseeva, I. A., Ostroumov, V., Kulakovskiy, I. V., and
9, 127!139.
Kulakovskaya, T. (2019) The reduced level of inorganic
6.
Wurst, H., T. Shiba, T., and Kornberg, A. (1995) The gene
polyphosphate mobilizes antioxidant and manganese!
for a major exopolyphosphatase of Saccharomyces cerevisi>
resistance systems in Saccharomyces cerevisiae, Cells, 8,
ae, J. Bacteriol., 177, 898!906.
461, doi: 10.3390/cells8050461.
7.
Sethuraman, A., Rao, N. N., and Kornberg, A. (2001) The
17.
Bensadoun, A., and Weinstein, D. (1976) Assay of proteins
endopolyphosphatase gene: essential in Saccharomyces
in the presence of interfering materials, Anal. Biochem., 70,
cerevisiae, Proc. Natl. Acad. Sci. USA, 98, 8542!8547.
241!250.
8.
Andreeva, N., Trilisenko, L., Eldarov, M., and
18.
Vagabov, V. M., Trilisenko, L. V., and Kulaev I. S. (2000)
Kulakovskaya, T.
(2015) Polyphosphatase PPN1 of
Dependence of inorganic polyphosphate chain length on
Saccharomyces cerevisiae: switching of exopolyphosphatase
the orthophosphate content in the culture medium of the
and endopolyphosphatase activities, PLoS One,
10,
yeast Saccharomyces cerevisiae, Biochemistry (Moscow), 65,
e0119594, doi: 10.1371/journal.pone.0119594.
349!355.
9.
Lonetti, A., Szijgyarto, Z., Bosch, D., Loss, O., Azevedo, C.,
19.
Kulakovskaya, T. V., Andreeva, N. A., Karpov, A. V.,
and Saiardi, A. (2011) Identification of an evolutionarily
Sidorov, I. A., and Kulaev, I. S. (1999) Hydrolysis of
conserved family of inorganic polyphosphate
tripolyphosphate by purified exopolyphosphatase of
endopolyphosphatases, J. Biol. Chem., 286, 31966!31974,
Saccharomyces cerevisiae cytosol: kinetic model,
doi: 10.1074/jbc.M111.266320.
Biochemistry (Moscow), 64, 990!993.
10.
Gerasimait, R., and Mayer, A. (2017) Ppn2, a novel Zn2+!
20.
Andreeva, N., Trilisenko, L., Kulakovskaya, T., Dumina, M.,
dependent polyphosphatase in the acidocalcisome l i k e
and Eldarov, M. (2015) Purification and properties of
yeast vacuole, J. Cell. Sci., 130, 1625!1636, doi: 10.1242/
recombinant exopolyphosphatase PPN1 and effects of its
jcs.201061.
overexpression on polyphosphate in Saccharomyces cere!
11.
Andreeva, N., Ledova, L., Ryazanova, L., Tomashevsky, A.,
visiae, J. Biosci. Bioeng., 119, 52!56, doi: 10.1016/j.jbiosc.
Kulakovskaya, T., and Eldarov, M.
(2019) Ppn2
2014.06.006.
endopolyphosphatase overexpressed in Saccharomyces
21.
Trilisenko, L., Kulakovskaya, E., and Kulakovskaya, T.
cerevisiae: comparison with Ppn1, Ppx1, and Ddp1
(2017) The cadmium tolerance in Saccharomyces cerevisi!
polyphosphatases, Biochimie, 163, 101!107, doi: 10.1016/
ae depends on inorganic polyphosphate, J. Basic
j.biochi.2019.06.001.
Microbiol., 57, 982!986, doi: 10.1002/jobm.201700257.
12.
Lichko, L. P., Kulakovskaya, T. V., Kulakovskaya, E. V.,
22.
Gray, M. J., and Jakob, U. (2015) Oxidative stress pro!
and Kulaev, I. S. (2008) Inactivation of PPX1 and PPN1
tection by polyphosphate!new roles for an old player,
genes encoding exopolyphosphatases of Saccharomyces
Curr. Opin. Microbiol., 24, 1!6, doi: 10.1016/j.mib.2014.
cerevisiae does not prevent utilization of polyphosphates as
12.004.
phosphate reserve, Biochemistry (Moscow), 73, 985!989,
23.
Lichko, L., Kulakovskaya, T., Pestov, N., and Kulaev, I.
doi: 10.1134/s0006297908090046.
(2006) Inorganic polyphosphates and exopolyphosphatases
13.
Lichko, L. P., Eldarov, M. A., Dumina, M. V., and
in cell compartments of the yeast Saccharomyces cerevisi!
Kulakovskaya, T. V. (2014) PPX1 gene overexpression has
ae under inactivation of PPX1 and PPN1 genes, Biosci.
no influence on polyphosphates in Saccharomyces cerevisiae,
Rep., 26, 45!54, doi: 10.1007/s10540!006!9003!2.
БИОХИМИЯ том 85 вып. 4 2020
606
РЯЗАНОВА и др.
INORGANIC POLYPHOSPHATE AND THE PECULIARITIES
OF PHYSIOLOGY UNDER OVEREXPRESSION
OF PPN2 GENE IN Saccharomyces cerevisiae
L. P. Ryazanova1, L. A. Ledova1, N. A. Andreeva1,
A. N. Zvonarev1, M. A. Eldarov2, and T. V. Kulakovskaya1*
1 Pushchino Scientific Center for Biological Research of the Russian Academy of Sciences,
Skryabin Institute of Biochemistry and Physiology of Microorganisms, 142290 Pushchino,
Moscow Region, Russia; E>mail: alla@ibpm.pushchino.ru
2 Institute of Bioengineering, Research Center of Biotechnology of the Russian Academy of Sciences,
119071 Moscow, Russia
Received January 29, 2020
Revised February 15, 2020
Accepted February 17, 2020
The effect of the overproduction of yeast endopolyphosphatase Ppn2 on the metabolism of inorganic polyphosphates
in Saccharomyces cerevisiae was studied. The expression of the PPN2 gene in yeast under the control of the strong con!
stitutive promoter of glyceraldehyde!3!phosphate dehydrogenase (PKG1) led to a significant increase in
endopolyphosphatase activity, stimulated by cobalt/zinc ions. This activity was higher with long chain polyphos!
phates, it was stimulated by ADP, and was present in both soluble and membrane subcellular fractions. The content
of short!chained polyphosphates in the cells of overexpressing strain increased ~2.5 times as compared with the par!
ent strain. The strain with overexpression of Ppn2 was more resistant to peroxide and alkali. The role of short chained
polyphosphates in adaptation to these stress factors is discussed.
Keywords: inorganic polyphosphate, polyphosphatase, PPN2 gene, overexpression, Saccharomyces cerevisiae
БИОХИМИЯ том 85 вып. 4 2020