БИОХИМИЯ, 2020, том 85, вып. 7, с. 890 - 906
УДК 577.2
МАРКЕРЫ АКТИВАЦИИ МОЛЕКУЛЯРНЫХ ПУТЕЙ
СВЯЗАНЫ С ЭФФЕКТИВНОСТЬЮ ТЕРАПИИ ТРАСТУЗУМАБОМ
ПРИ HER2 ПОЗИТИВНОМ МЕТАСТАТИЧЕСКОМ РАКЕ МОЛОЧНОЙ
ЖЕЛЕЗЫ ЛУЧШЕ, ЧЕМ УРОВЕНЬ ЭКСПРЕССИИ ОТДЕЛЬНЫХ ГЕНОВ*
© 2020
М. Сорокин1,2,3, К. Игнатьев4, В. Барбара4, У. Владимирова1,3, А. Муравьева3,
М. Сунцова1, Н. Гайфуллин5, И. Воротников6, Д. Камашев1,3, А. Бондаренко7,
М. Баранова7,8, Е. Поддубская3,7, A. Буздин1,2,3,9**
1 ФГБУН «Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова» РАН,
117997 Москва, Россия; электронная почта: buzdin@oncobox.com
2 OmicsWay Corp., 91789 Walnut, CA, США
3 ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), 119991 Москва, Россия
4 ГБУЗ Республики Карелия «Республиканский онкологический диспансер», 185016 Петрозаводск, Россия
5 Московский государственный университет имени М.В. Ломоносова,
факультет фундаментальной медицины, 119991 Москва, Россия
6 ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина»
Министерства здравоохранения Российской Федерации, 115478 Москва, Россия
7 Многопрофильный медицинский центр «ВитаМед», 121309 Москва, Россия
8 ФГБНУ «Росийский Научный Центр Хирургии им. акад. Б.В. Петровского», 119991 Москва, Россия
9 ФГАОУ ВО «Московский физикоGтехнический институт (национальный исследовательский университет)»,
141701 Долгопрудный, Московская обл., Россия
Поступила в редакцию 31.03.2020
После доработки 29.05.2020
Принята к публикации 31.05.2020
Повышенная экспрессия или амплификация гена ERBB2, кодирующего тирозинкиназу HER2, - хорошо
известный и широко используемый прогностический биомаркер назначения таргетного противоопухолево"
го препарата трастузумаб и его аналогов при раке молочной железы (РМЖ). Поскольку часть опухолей с по"
вышенной экспрессией HER2 все же не отвечает на трастузумаб, мы провели клиническое исследование
NCT03521245 для выявления дополнительных экспрессионных биомаркеров трастузумаба при HER2"пози"
тивных РМЖ. С помощью РНК"секвенирования мы профилировали генную экспрессию для 23"х образцов
фиксированной в формалине парафинизированной ткани HER2"позитивного РМЖ, полученных от паци"
ентов с известным статусом ответа на трастузумаб. Для групп пациентов"ответчиков и неответчиков на ле"
чение мы обнаружили ряд дифференциально регулируемых генов и молекулярных путей. Мы сравнили эти
результаты с 42"мя профилями РНК"секвенирования пациентов"ответчиков и неответчиков на терапию
трастузумабом, ранее опубликованными по итогам клинических исследований NCT00513292 и
NCT00353483. Мы не нашли корреляции между статусом ответа и уровнем экспрессии самого гена ERBB2 в
HER2"положительных образцах РМЖ. Сравнение дифференциально регулируемых генов и молекулярных
путей в объединенном наборе данных выявило 15 активированных и 27 подавленных у ответчиков на трас"
тузумаб генов и 15/25 молекулярных путей соответственно. Тем не менее по сравнению с моделью случай"
ного распределения статистически значимым оказалось только пересечение молекулярных путей, активи"
рованных у ответчиков по сравнению с неответчиками. Классификатор, построенный нами на основе наи"
более сильно активированного дифференциального молекулярного пути «cAMP Pathway Protein Retention»,
показал наилучшую эффективность для прогнозирования ответа на трастузумаб HER2"положительного
РМЖ как для наших, так и для ранее опубликованных данных. Этот путь также статистически достоверно
(p = 0,041) предсказывал время до рецидивирования заболевания в комбинированном наборе данных.
КЛЮЧЕВЫЕ СЛОВА: рак молочной железы, HER2, ERBB2, транскриптомика, РНК"секвенирование,
трастузумаб, таргетная терапия, персонализированная медицина, NCT03521245.
DOI: 10.31857/S0320972520070040
Принятые сокращения: РМЖ - рак молочной железы, PR - прогестероновый рецептор, AUC - площадь под
ROC"кривой, УАП - уровень активации пути, ER - эстрогеновый рецептор.
biokhimiya, в рубрике «Papers in Press», BM20"089, 24.06.2020.
** Адресат для корреспонденции.
890
МАРКЕРЫ ЭФФЕКТИВНОСТИ ТРАСТУЗУМАБА ПРИ РМЖ
891
ВВЕДЕНИЕ
ментальным свойством объединения экспрес"
сии отдельных генов в результирующий показа"
На исследования и лечение рака молочной
тель, называемый уровнем активации пути
железы (РМЖ) сильно повлияло открытие та"
(УАП). Объединение генных продуктов по
ких мощных прогностических биомаркеров, как
функциональному признаку в молекулярные
сверхэкспрессия или амплификация тирозин"
пути позволяет использовать УАП вместо уров"
киназы HER2, экспрессия эстрогенового (ER) и
ней экспрессии отдельных генов [5, 18]. Для
прогестеронового (PR) рецепторов. Злокачест"
многих видов рака было показано, что исполь"
венные опухоли молочной железы, где отсут"
зование УАП вместо уровней отдельных генов
ствует значительная экспрессия ER и PR, с ба"
позволяет нивелировать артефакты измерения
зальным уровнем HER2 классифицируют как
генной экспрессии за счет уменьшения значи"
тройной отрицательный РМЖ. При РМЖ ам"
мости технических ошибок основных экспери"
плификация ERBB2 и повышенная экспрессия
ментальных платформ [19, 20]. Значения акти"
кодируемого им белка HER2 наблюдаются в
вации молекулярных путей могут быть преобра"
15-35% случаев [1-3]. Амплификация ERBB2 и
зованы в клинически действенную оценку ин"
избыточная экспрессия HER2, называемая
дивидуального ответа опухоли на таргетную те"
«HER2"положительным» фенотипом опухоли,
рапию, например моноклональными антитела"
хорошо коррелирует с ответом пациента на ле"
ми
[21] или ингибиторами тирозинкиназ
чение трастузумабом - HER2"специфичным
[22-24].
моноклональным антителом, применяемым для
Для поиска дополнительных биологических
таргетной терапии РМЖ и рака желудка [4]. Для
маркеров ответа на трастузумаб при HER2"по"
HER2"положительных онкологических заболе"
зитивном метастатическом РМЖ мы иницииро"
ваний таргетная терапия трастузумабом обычно
вали клиническое исследование NCT03521245,
рекомендуется независимо от статуса ER и PR,
нацеленное на измерение экспрессии генов и
что привело к значительному увеличению вы"
УАП в раковых тканях ответчиков и неответчи"
живаемости больных в последние годы. HER2"
ков на терапию. Для определения генной
таргетная терапия часто сочетается со стандарт"
экспрессии мы использовали метод РНК"секве"
ными режимами химиотерапии или с гормо"
нирования, считающийся в настоящее время зо"
нальной терапией. И наоборот, подавляющее
лотым стандартом транскриптомики [11].
большинство HER2"отрицательных опухолей
оказываются нечувствительны к HER2"таргет"
ным препаратам [5, 6].
МАТЕРИАЛЫ И МЕТОДЫ
Тем не менее клиническая практика показы"
вает, что только 25-80% женщин с HER2"поло"
Биологический материал исследования. Им"
жительным РМЖ (согласно иммуногистохими"
муногистохимическая диагностика образцов
ческим тестам и/или гибридизации in situ) отве"
РМЖ (HER2, PR, ER) была выполнена в ГБУЗ
чают на трастузумаб [7-9]. В целом, уровень от"
Республики Карелия «Республиканский онко"
вета оказывается выше, когда трастузумаб ис"
логический диспансер» (Петрозаводск, Россия)
пользуется в сочетании с химиотерапией или
с использованием наборов антител («Roche
другими таргетными препаратами, и ниже - в
Diagnostics», США). Для интерпретации статуса
случае метастатического рака [10].
HER2 была использована следующая шкала:
Следовательно, поиск дополнительных моле"
(i) базовое окрашивание (0), (ii) «+» (1), (iii) «++»
кулярных биомаркеров, связанных с ответом на
(2) и (iv) «+++» (3). Результаты «++» и «+++»
трастузумаб при HER2"положительном РМЖ,
были подтверждены с помощью набора «ISH
представляет большой фундаментальный и
DNA Probe Cocktail»
(«Roche Diagnostics»,
практический интерес. Молекулярные биомар"
США). При оценке рецепторного статуса стеро"
керы могут включать диагностически значимые
идных гормонов (PR и ER) была использована
мутации или уровни генной экспрессии на уров"
шкала от 0 до 8.
не мРНК или белка [11]. Кроме того, биомарке"
Биоматериал был получен от 23"х женщин с
рами нового поколения могут служить уровни
HER2"положительным РМЖ, средний возраст
активации молекулярных путей, рассчитанные
которых составил 53,3 г. (диапазон 33-77 лет).
на основе профилей генной экспрессии [5, 12,
Пациентки получали монотерапию трастузума"
13]. Они показывают большую диагностическую
бом или трастузумаб в сочетании с другими про"
значимость, чем уровни экспрессии единичных
тивоопухолевыми препаратами: доцетаксел, или
генов или наличие отдельных мутаций [14-17].
паклитаксел + карбоплатин, или паклитаксел,
Данное преимущество молекулярных путей
или доцетаксел + карбоплатин, или ингибитор
в качестве биомаркеров обусловлено их фунда"
ароматазы, или пертузумаб, или капецитабин,
БИОХИМИЯ том 85 вып. 7 2020
892
СОРОКИН и др.
или винорелбин, или гемцитабин; из них 19 па"
Подготовка библиотек и РНК секвенирова
циенток получали адъювантную терапию, 4 -
ние. РНК выделяли из срезов парафиновых бло"
неоадъювантную. Более подробные клиничес"
ков толщиной 10 мкм с использованием набора
кие характеристики представлены в табл. S1 в
RNeasy FFPE («Qiagen», Нидерланды) в соответ"
Приложении.
ствии с протоколом производителя. Для измере"
Все исследованные образцы представляли
ния концентрации РНК использовали наборы
собой фиксированные в формалине парафини"
RNA 6000 Nano Assay («Agilent Technologies»,
зированные ткани РМЖ, содержание опухоле"
Германия). Целостность РНК (RIN) оценивали
вых клеток в которых превышало 70%, из них 19
с использованием биоанализатора Agilent 2100
образцов были получены в ГБУЗ Республики
(«Agilent Technologies», Германия). Для удаления
Карелия «Республиканский онкологический
рибосомной РНК и конструирования библио"
диспансер» (Петрозаводск) и 4 образца - в
тек использовали набор KAPA RNA Hyper
Многопрофильном медицинском центре «Вита"
(«Roche Sequencing Solutions Inc», США) с деп"
Мед» (Москва). 21 образец РМЖ представлял
лецией рибосомальной РНК. Для увеличения
собой фрагменты первичных опухолей и 2 - ме"
количества анализируемых образцов за один
тастазы в лимфатических узлах.
цикл секвенирования использовали лигирова"
РНК"секвенирование было проведено для
ние адаптеров с баркодами. Концентрации и ка"
всех 23"х образцов РМЖ, однако только 9 из них
чество библиотеки измеряли с использованием
соответствовали критериям включения в следую"
набора Qubit dsDNA HS
(«Thermo Fisher
щий этап работ: адъювантная терапия, отрица"
Scientific», США) и Agilent Tapestation («Agilent
тельный ER/PR"статус, метастазирование. Так"
Technologies», Германия). Всего было получено
же из дальнейших анализов были исключены
не менее 30 млн одноконцевых прочтений на
образцы с люминальным подтипом B (HER2"
каждый исследованный образец. РНК"секвени"
положительные, ER/PR"положительные), пос"
рование было выполнено компанией «Омикс"
кольку для него характерен лучший прогноз,
Лаб», Россия и Кафедрой патологии и лабора"
чем для остальной части HER2"положительных
торной медицины Калифорнийского универси"
опухолей молочной железы [25, 26].
тета (Department of Pathology and Laboratory
В итоге 9 образцов, отобранных для дальней"
Medicine, University), США с использованием
шего анализа, были получены от женщин с
секвенатора Illumina HiSeq
3000
(«Illumina,
HER2"положительным ER/PR"отрицательным
Inc.», США). Проверку качества данных прово"
РМЖ, средний возраст которых составлял 55,2 г.
дили с помощью программного обеспечения
(диапазон 44-77 лет). Больные получали моно"
(ПО) Illumina SAV («Illumina, Inc.», США), а де"
терапию трастузумабом в адъювантном режиме
мультиплексирование - с помощью ПО Illumina
или трастузумаб в сочетании с другими терапев"
bcl2fastq2 v 2.17 («Illumina, Inc.», США). Данные
тическими средствами: доцетаксел или пакли"
секвенирования были депонированы в NCBI
таксел, + карбоплатин или паклитаксел или до"
Sequencing Read Archive (SRA) с кодами доступа
цетаксел, + карбоплатин или капецитабин или
PRJNA565016 и PRJNA578290.
винорелбин или гемцитабин (табл. 1). Восемь
Обработка данных РНК секвенирования. По"
отобранных образцов были получены в ГБУЗ
лученные в результате РНК"секвенирования
Республики Карелия «Республиканский онко"
FASTQ"файлы обрабатывались с помощью ПО
логический диспансер» (Петрозаводск), и один
STAR aligner [27] в режиме «GeneCounts» с анно"
образец - в Многопрофильном медицинском
тацией транскриптома человека Ensembl (версия
центре «ВитаМед» (Москва).
GRCh38.89). Генные идентификаторы Ensembl
Восемь образцов соответствовали первич"
были преобразованы в генные символы с ис"
ным опухолям и один - метастазированию в
пользованием набора данных HGNC (https://
лимфатический узел (BC"20). Данная проба бы"
ла включена в анализ, поскольку мы стремились
июля 2017 г.). Всего были определены уровни
определить надежные биомаркеры устойчивос"
экспрессии для 36 596 генов с уникальными
ти к трастузумабу, которые потенциально могли
идентификаторами HGNC. Минимальное число
бы быть применимы не только для биопсий, по"
уникально картированных прочтений составило
лученных из первичного очага, но и для мета"
1,40 млн со средним значением 7,35 млн. для 9
стазов. Пациентов считали ответчиками на те"
отобранных образцов (8,03 - для всех 23"х образ"
рапию, если ремиссия регистрировалась, по
цов). Дифференциальный анализ генной экс"
крайней мере, за период до 25"го месяца после
прессии был выполнен с использованием ПО
биопсии включительно. Пять пациентов были
DESeq2 [28]. Дифференциально экспрессиро"
классифицированы как ответчики и четыре -
ванные гены у ответчиков и неответчиков на те"
как неответчики на терапию.
рапию использовали для дальнейшего анализа.
БИОХИМИЯ том 85 вып. 7 2020
МАРКЕРЫ ЭФФЕКТИВНОСТИ ТРАСТУЗУМАБА ПРИ РМЖ
893
Таблица 1. Клинические данные 9 отобранных для эксперимента пациентов
Ответчик/
Продолжи"
Продолжи"
№
Возраст
Стадия
неответчик
тельность
тельность
Схема терапии
на терапию
безрецидивного
ремиссии
(О/НО)
периода (мес.)
(мес.)
BC"3
55
T2N1M0, IIIa
О
-
29
2 курса: доксорубицин + цикло"
фосфамид, затем 6 курсов: доце"
таксел + трастузумаб; монотера"
пия трастузумабом (каждые 3 не"
дели, 18 инъекций)
BC"4
58
T2N1M0, IIB
О
-
33
6 курсов: паклитаксел + доксору"
бицин; монотерапия трастузума"
бом (18 инъекций)
BC"7
53
T2N3M0, IIIC
НО
25
без
3 курса: адъювантная химиотера"
ремиссии
пия, лучевая терапия; монотера"
пия трастузумабом
BC"14
49
T2N2M0, IIIA
О
-
27
6 курсов: доксорубицин + цикло"
фосфамид; паклитаксел
(12 инъекций); монотерапия
трастузумабом каждые 21 день
BC"20
51
T2N0M0, II
О
-
28
6 курсов: доцетаксел + карбопла"
тин + трастузумаб; монотерапия
трастузумабом (каждые три неде"
ли в течение 12 мес.)
BC"21
49
T1N3M0, IIIC
НО
10
без
2 курса: паклитаксел + доксору"
ремиссии
бицин; 3 курса: паклитаксел; мо"
нотерапия трастузумабом (5 мес.)
BC"25
77
T1N1M0, IIA
НО
14
без
6 курсов: доксорубицин + цикло"
ремиссии
фосфамид; паклитаксел + кар"
боплатин + трастузумаб; моноте"
рапия трастузумабом
BC"27
44
T2N0M0, IIA
О
-
26
паклитаксел (12 инъекций) +
трастузумаб
BC"71
61
T2N0M0
НО
13
без
5 курсов АС (доксорубицин +
ремиссии
циклофосфамид); паклитаксел +
трастузумаб; монотерапия трас"
тузумабом
Литературные данные генной экспрессии.
2 группы. Первая получала фторурацил
Данные генной экспрессии пациентов с РМЖ
500 мг/м2, эпирубицин 75 мг/м2 и циклофосфа"
были получены из Базы данных генотипов и фе"
мид 500 мг/м2 (FEC"75) в 1"й день 21"дневного
нотипов (dbGAP), код доступа: phs001291.v1.p1
цикла для четырех циклов с последующим пак"
[4]. 31 случай РМЖ был изучен в исследовании
литакселом 80 мг/м2 и трастузумабом 2 мг/кг
Z1041 Американской коллегии хирургов"онко"
(после нагрузки 4 мг/кг) один раз в неделю в те"
логов (NCT00513292), где сравнивали частоту
чение 12 недель. Вторая группа получала пакли"
полного патологического ответа пациентов с
таксел и трастузумаб один раз в неделю в тече"
HER2"положительным РМЖ. В исследование
ние 12 недель, а затем - четыре цикла FEC"75
были включены небеременные женщины с ин"
(в 1"й день каждого 21"дневного цикла) и один
вазивным РМЖ со средним возрастом 50,14 г.
раз в неделю трастузумаб, в той же дозировке,
(диапазон 36-70 лет), которые получали нео"
что и для первой группы. Помимо пациентов из
адъювантную химиотерапию и трастузумаб. Па"
исследования Z1041, в phs001291.v1.p1 были
циенты были случайным образом разделены на
включены также профили для 11 HER2"поло"
БИОХИМИЯ том 85 вып. 7 2020
894
СОРОКИН и др.
жительных случаев РМЖ, участвующих в иссле"
Oncobox [29]. Для анализа были отобраны 1754
довании Медицинской школы Вашингтонского
пути, содержащие по крайней мере 10 генных
университета (NCT00353483), получавших нео"
продуктов, доступные в открытых базах данных
адъювантную терапию трастузумабом в сочета"
Reactome [30], NCI Pathway Interaction Database
нии с химиотерапией: трастузумаб + паклитак"
[31], Kyoto Encyclopedia of Genes and Genomes
сел + карбоплатин, или доксорубицин + кар"
[32], HumanCyc [33], Biocarta [34] и Qiagen
боплатин, затем трастузумаб + паклитаксел, или
Pathway Central, перечисленых в табл. S3 в При"
FEC"75, затем трастузумаб + паклитаксел [4].
ложении.
HER2"положительный статус для всех случа"
Для расчета УАП все экспериментальные
ев определялся иммуногистохимически и/или с
профили генной экспрессии для ответчиков бы"
помощью флуоресцентной гибридизации in situ
ли нормализованы на профили неответчиков.
(FISH). Образцы РНК выделяли из заморожен"
Таким же образом были нормализованы и лите"
ных биоптатов опухоли, полученных до лечения
ратурные профили генной экспрессии. Молеку"
пациентов, и секвенировали. Опубликованный
лярные пути были визуализированы с использо"
набор данных (табл. S2 в Приложении) содер"
ванием методов визуализации путей Oncobox
жал профили РНК"секвенирования для 42"х па"
[16, 29, 35-37].
циентов, из которых 17 соответствовали крите"
риям включения в исследование - двойной от"
рицательный ER и PR статус. Из них 12 пациен"
РЕЗУЛЬТАТЫ ИССЕЛЕДОВАНИЙ
тов продемонстрировали полный патологичес"
кий ответ (ППО) после лечения, а у 5 обнаружи"
В настоящем исследовании мы сравнили
ли остаточное заболевание. Клиническая анно"
экспериментальные и литературные данные по
тация исследованного набора образцов приве"
дифференциальной экспрессии генов и актива"
дена в табл. 2.
ции молекулярных путей при РМЖ в зависи"
Анализ молекулярных путей. Уровни актива"
мости от успешности лечения трастузумабом.
ции молекулярных путей были рассчитаны с ис"
Клинические данные. В ходе клинического
пользованием метода и аналитического ПО испытания NCT03521245 «Маркеры активации
Таблица 2. Клиническая аннотация 17"ти HER2+/ER-/PR- образцов РМЖ из литературного набора phs001291.v1.p1
Гистологи"
Полный
Время до
№
Источник
Возраст
T"стадия
N"стадия
ческая степень
патологи"
Иденти"
рецидива
злокачествен"
ческий ответ
фикатор
болезни
ности
(да/нет)
(дни)
BRC251
Z1041
52
T2
N1
3
да
SRR6447437
1679
BRC261
Z1041
61
T2
N1
2
да
SRR6498562
1665
BRC262
Z1041
45
T4
N1
3
да
SRR6447573
1674
BRC263
Z1041
49
T3
N0
3
да
SRR6447580
1582
BRC271
Z1041
70
T4
N2
3
да
SRR6447458
1285
BRC272
Z1041
47
T2
N0
3
нет
SRR6447472
112
BRC274
Z1041
52
T3
N0
3
нет
SRR6447567
1064
BRC276
Z1041
39
T2
N0
2
да
SRR6498531
NA
BRC277
Z1041
57
T2
N0
2
да
SRR6498535
936
BRC278
Z1041
53
T3
N1
3
да
SRR6498552
874
BRC279
Z1041
61
T1
N1
3
да
SRR6498528
352
BRC280
Z1041
48
T3
N1
3
нет
SRR6498538
216
BRC284
NCT00353483
50
T2
N2
3
нет
SRR6498557
NA
BRC286
NCT00353483
47
T3
N1
3
да
SRR6447563
NA
BRC288
NCT00353483
61
T2
N1
3
нет
SRR6447558
NA
BRC290
NCT00353483
50
T3
N0
2
да
SRR6447556
NA
BRC295
Z1041
54
T2
N2
3
да
SRR6447565
1674
БИОХИМИЯ том 85 вып. 7 2020
МАРКЕРЫ ЭФФЕКТИВНОСТИ ТРАСТУЗУМАБА ПРИ РМЖ
895
молекулярных путей, прогнозирующие эффек"
тивность терапии трастузумабом HER2"пози"
тивного рака молочной железы» мы получили
набор экспериментальных данных для настоя"
щего исследования. Пациенты были жителями
Северо"Западной и Центральной частей Рос"
сийской Федерации, которые проходили лече"
ние в ГБУЗ Республики Карелия «Республика"
нский онкологический диспансер» (Петроза"
водск) или Многопрофильном медицинском
центре «ВитаМед» (Москва). Использовали сле"
дующие критерии включения: взрослые женщи"
ны с гистологически подтвержденным HER2"
Рис. 1. Репрезентативная гистологическая микрофотогра"
положительным РМЖ и доступными образцами
фия исследуемой ткани РМЖ. Показан умеренно диффе"
опухоли молочной железы; пациенты, получав"
ренцированный инфильтрированный протоковый рак (об"
шие трастузумаб отдельно или в комбинации с
разец BC71; HER2+/ER-/PR-). Окрашивание гематокси"
другими схемами химиотерапии с известным
лином и эозином, масштабный отрезок приведен на ри"
сунке. (С цветными вариантами рис. 1-6 можно ознако"
ответом, согласно критериям RECIST 1.1; паци"
миться в электронной версии статьи на сайте: http://
енты с РМЖ II или более поздней стадии, кото"
sciencejournals.ru/journal/biokhsm/.)
рые подписали информированное доброволь"
ное согласие на участие в этом клиническом ис"
следовании. Критерием исключения являлось
наличие менее 70% опухолевых клеток в доступ"
кодом доступа phs001291.v1.p1 (табл. S2 в При"
ных образцах ткани РМЖ (рис. 1). На первом
ложении). Из них 31 случай был описан в иссле"
этапе в исследование было включено 23 пациен"
довании Американской коллегии хирургов
та, опухолевые образцы которых профилирова"
Z1041 (NCT00513292). В этом исследовании па"
ли с помощью РНК"секвенирования (табл. S1 в
циенты были случайным образом распределены
Приложении). Средний возраст в группе паци"
между двумя группами, где первая получала те"
ентов составил 53 года. В качестве критерия от"
рапию в режиме FEC"75 (фторурацил, эпируби"
вета опухоли на терапию использовали ремис"
цин, циклофосфамид), затем паклитаксел +
сию в течение не менее 25 мес. после биопсии. В
трастузумаб, а вторая - в режиме паклитаксел +
соответствии с этим пациенты были классифи"
трастузумаб, затем трастузумаб + FEC"75. Кро"
цированы как отвечающие или не отвечающие
ме того, набор phs001291.v1.p1 содержал 11 про"
(ответчики/неответчики) на лечение трастузу"
филей HER2"положительного РМЖ, включен"
мабом. Тем не менее мы не могли напрямую
ных в исследование Медицинского университе"
сравнивать статусы ответа на трастузумаб для
те штата Вашингтон (NCT00353483), участники
всех включенных пациентов, поскольку они
которого получали неоадъювантную терапию
принадлежали к разным подтипам HER2"поло"
трастузумабом в сочетании с химиотерапией в
жительного РМЖ: люминальный B или
режимах: трастузумаб + паклитаксел + карбо"
ER-/PR- фенотип. Эти два подтипа имеют су"
платин, или доксорубицин + карбоплатин, за"
щественно различающиеся прогнозы по ответу
тем трастузумаб + паклитаксел, или FEC, затем
на терапию и общую выживаемость [25, 26], что
трастузумаб + паклитаксел [4]. Пациентами бы"
препятствует их объединению в одну группу.
ли женщины с инвазивным РМЖ, средний воз"
Для дальнейшего анализа мы отобрали группу
раст группы составлял 50 лет. Для дальнейшего
из 9 пациентов, которые имели ER-/PR- фено"
исследования мы отобрали образцы с ER-/PR-
тип, получали адъювантную терапию и имели
статусом. Пациенты также были классифициро"
метастазы: пять ответчиков и четыре неответчи"
ваны как ответчики (патологический полный
ка. Все пациенты получали трастузумаб в раз"
ответ) и неответчики (остаточное заболевание).
личных схемах лечения. Наиболее распростра"
Всего для последующего анализа было отобрано
ненные комбинации с трастузумабом (табл. 1)
17 литературных профилей, соответствующих 12
включали таксаны (паклитаксел или доцетак"
ответчикам и пяти неответчикам на терапию
сел, n = 7) и доксорубицин (n = 6).
(табл. 2).
В качестве данных для сравнения мы ис"
Дифференциально регулируемые гены и моле
пользовали ранее опубликованную коллекцию
кулярные пути. На массивах экспериментальных
[4] из 42"х клинически аннотированных профи"
и литературных данных мы отобрали гены, диф"
лей РНК"секвенирования РМЖ, доступных в
ференциально экспрессируемые при РМЖ у от"
базе данных генотипов и фенотипов (dbGAP) с
ветчиков и неответчиков на терапию. Для экс"
БИОХИМИЯ том 85 вып. 7 2020
896
СОРОКИН и др.
,
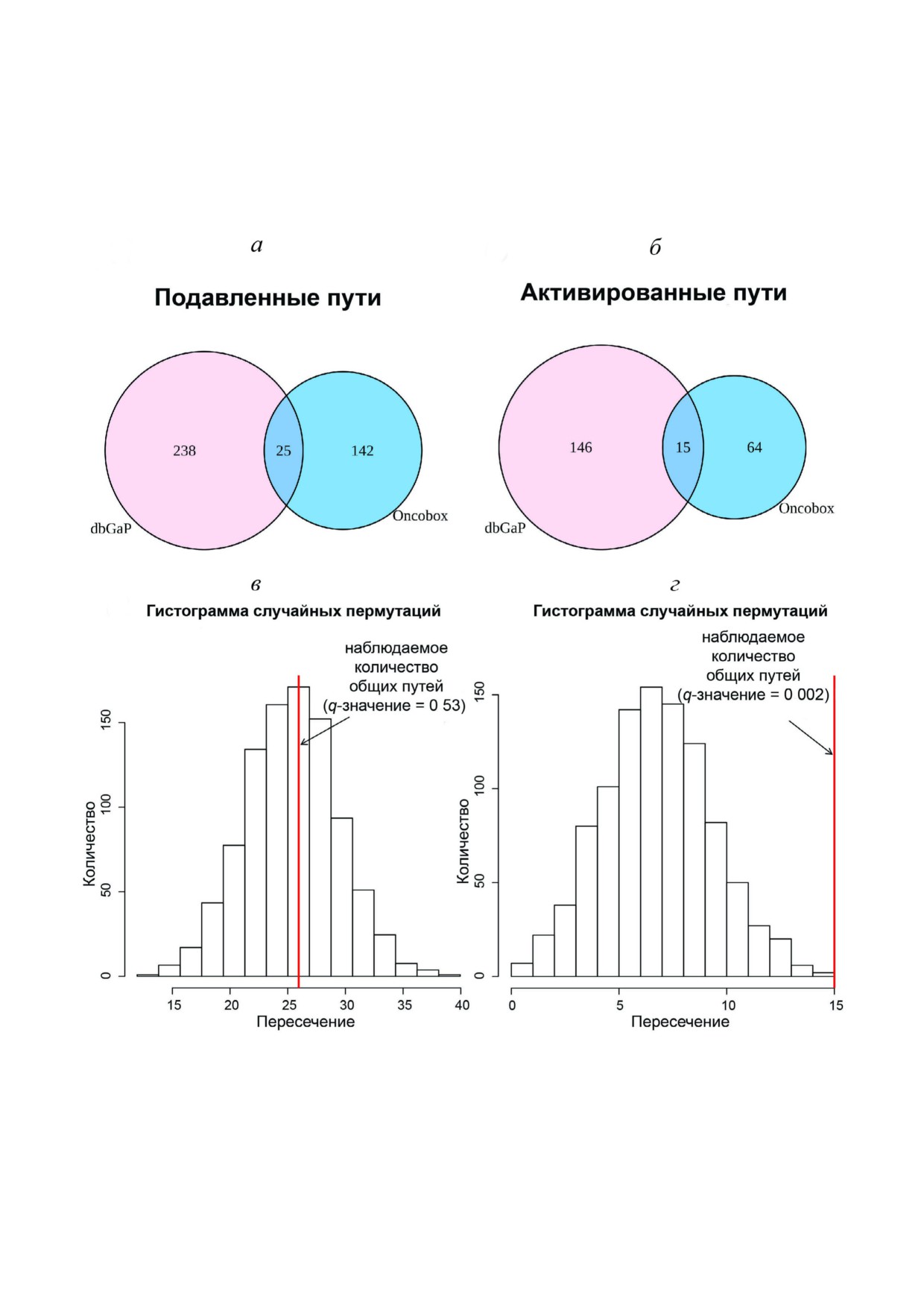
,
Рис. 2. Пересечение групп дифференциально экспрессируемых генов между экспериментальными и литературными на"
борами данных. Диаграммы Венна показывают количество дифференциально экспрессируемых подавленных (а) и акти"
вированных (б) генов между экспериментальным набором данных (NCT03521245) и литературным набором данных
(dbGAP: phs001291.v1.p1). Гистограммы (в и г) показывают фактически наблюдаемое, а также теоретически ожидаемое ко"
личество дифференциально регулируемых генов исходя из модели случайного распределения, число случайных переста"
новок 1000. в - Распределение пересечения подавленных генов, qGзначение для реально наблюдаемого пересечения сос"
тавляет 0,98. г - Распределение пересечения активированных генов, qGзначение для реально наблюдаемого пересечения
составляет 0,17
БИОХИМИЯ том 85 вып. 7 2020
МАРКЕРЫ ЭФФЕКТИВНОСТИ ТРАСТУЗУМАБА ПРИ РМЖ
897
периментальных данных статистический уро"
нако как было указано ранее, пересечение по"
вень значимости (р < 0,05) был пройден для 1600
давленных путей между экспериментальной и
генов, из которых 402 были активированы и
литературной выборками имеет признаки слу"
1198 подавлены в группе ответчиков на тера"
чайного совпадения (рис. 3, в).
пию. Для литературных данных было выявлено
Затем для каждого из 15 общих путей, акти"
2235 дифференциальных генов (p < 0,05), где
вированных у ответчиков, мы исследовали спо"
1049 были активированы и 1186 - подавлены у
собность дискриминировать ответчиков от не"
ответчиков (табл. S4 в Приложении). В свою
ответчиков на терапию трастузумабом. Для это"
очередь, пересечение экспериментальных и ли"
го вычисляли отношения рисков (от англ.
тературных данных дало 15 активированных и
Hazard Ratio) и p"значения теста Log"rank. Для
27 подавленных генов в группе ответчиков
этого анализа мы объединили пациентов из обе"
(рис. 2, а и б).
их выборок, для которых была доступна инфор"
Статистическая значимость этого пересече"
мация о времени до прогрессии заболевания.
ния была исследована путем пересечения слу"
Затем пациенты были разделены на две группы с
чайных групп генов того же размера со случай"
уровнями активации пути выше и ниже, чем ме"
ной перестановкой названий генов. Как для ак"
дианное значение. Мы обнаружили, что 12 ис"
тивированных, так и для подавленных генов мы
следованных дифференциально активирован"
обнаружили, что число пересекшихся генов со"
ных путей могут служить маркерами выживае"
ответствовало модели случайного распределе"
мости без прогрессирования заболевания. Для
ния и не показало статистически значимого
путей «PPAR», «noradrenaline and adrenaline
обогащения (рис. 2, в и г). Мы также сравнили
degradation» и «Drug metabolism cytochrome P450
экспрессию гена ERBB2, кодирующего молеку"
pathway» p"значение Log"rank теста превышало
лярную мишень трастузумаба, между ответчика"
0,05 (табл. 3). При этом путь «cAMP Protein
ми и неответчиками, но не обнаружили сущест"
Retention pathway» показал лучшую эффектив"
венных различий как для экспериментальных,
ность как для предсказания ответа на терапию,
так и для литературных данных (рис. S1 в При"
так и для прогнозирования времени до прогрес"
ложении).
сии (рис. 6). Дополнительно мы рассчитали
Для дифференциально регулируемых генов с
площадь под ROC"кривой (AUC), которая явля"
помощью ПО Oncobox [29] мы вычислили УАП
ется универсальной характеристикой качества
для 1754 внутриклеточных молекулярных путей,
биомаркеров, основанной на значениях
имеющих, по крайней мере, 10 генных продук"
чувствительности и специфичности [38]. Этот
тов в своем составе. Мы провели поиск статис"
статистический подход широко применим к
тически значимо дифференциально регулируе"
различным типам биомаркеров в онкологии [14,
мых путей (р < 0,05) и обнаружили 246 путей для
16, 17, 39-41]. AUC положительно коррелирует
экспериментальных данных (79 активирован"
с качеством биомаркера и изменяется в интер"
ных и 167 подавленных в группе ответчиков) и
вале 0,5-1. Стандартный порог дискриминации
424 - для литературных данных (161 активиро"
составляет 0,7, и биомаркеры с большим значе"
ванных и 263 подавленных в группе ответчи"
нием AUC считаются высококачественными, и
ков), (табл. S5 в Приложении). При пересече"
наоборот [42]. Путь «cAMP Pathway Protein
нии дифференциально регулируемых путей для
Retention» показал самое высокое значение
групп ответчиков и неответчиков мы получили
AUC и самое низкое наблюдаемое отношение
случайное значение для подавленных путей, но
рисков [AUC равно 1 для экспериментального и
неслучайное (qGзначение = 0,002) для 15 активи"
0,867 - для литературного набора данных; отно"
рованных путей (рис. 3).
шение рисков 0,34 (95% доверительный интер"
Среди этих
15 активированных путей
вал: 0,11-1, р"значение = 0,05)] (табл. 3).
(табл. 3) наиболее статистически значимыми по
критерию Уилкоксона-Манна-Уитни были
следующие два:
«PPAR Pathway» и
«cAMP
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Protein Retention Pathway». Профиль активации
пути для «cAMP Protein Retention Pathway», ко"
В этой статье мы получили экспрессионные
торый также был связан со временем до прог"
профили для 23 образцов фиксированной в
рессирования в последующем анализе, предс"
формалине парафинизированной ткани РМЖ,
тавлен для ответчиков и неответчиков на рис. 4.
полученных от HER2"положительных пациен"
Кроме того, среди пересечения молекуляр"
тов"ответчиков или неответчиков на лечение
ных путей, подавленных в группе ответчиков,
трастузумабом. Для групп, отвечающих и не от"
присутствовал путь
«ErbB Family Pathway»,
вечающих на лечение, мы определили диффе"
включающий продукт гена ERBB2 (рис. 5). Од"
ренциально регулируемые гены и молекулярные
4 БИОХИМИЯ том 85 вып. 7 2020
898
СОРОКИН и др.
пути. Затем мы сравнили полученные результа"
бом, которые ранее участвовали в клинических
ты с 42 опубликованными профилями РНК"
исследованиях NCT00513292 и NCT00353483
секвенирования тканей РМЖ пациентов с изве"
[4]. Интересно, что мы не обнаружили корреля"
стным статусов ответа на терапию трастузума"
ции между статусом ответа и уровнем экспрес"
,
,
Рис. 3. Пересечение дифференциально регулируемых молекулярных путей между экспериментальными и литературными
наборами данных. Диаграммы Венна показывают пересечение групп подавленных (а) и активированных (б) путей между
экспериментальным (NCT03521245) и литературным (dbGAP: phs001291.v1.p1) наборами данных. Гистограммы (в и г) по"
казывают фактически наблюдаемое, а также теоретически ожидаемое количество дифференциально регулируемых путей
исходя из модели случайного распределения, число случайных перестановок 1000. в - Распределение пересечения подав"
ленных путей, qGзначение для реально наблюдаемого пересечения составляет 0,53. г - Распределение пересечения акти"
вированных путей, qGзначение для реально наблюдаемого пересечения составляет 0,002
БИОХИМИЯ том 85 вып. 7 2020
МАРКЕРЫ ЭФФЕКТИВНОСТИ ТРАСТУЗУМАБА ПРИ РМЖ
899
а
б
Рис. 4. Профиль дифференциальной активации молекулярного пути «cAMP Protein Retention Pathway» у ответчиков на те"
рапию трастузумабом против неответчиков в экспериментальном (а) и литературном (б) наборах данных
сии гена ERBB2. При пересечении наборов вы"
Кроме того, в большинстве таких исследований
явленных дифференциально регулируемых ге"
для молекулярного профилирования использо"
нов и молекулярных путей в обеих выборках, мы
вали технологию микрочипирования [45-47]. В
обнаружили 15 активированных и 27 подавлен"
нашем исследовании для этого применяли
ных генов и 15/25 путей соответственно. Тем не
РНК"секвенирование, которое в настоящее вре"
менее статистически значимым по сравнению с
мя считается золотым стандартом профилиро"
моделью случайного распределения оказалось
вания генной экспрессии [48, 49]. Кроме того,
только пересечение молекулярных путей, акти"
мы использовали секвенирование тотальной
вированных у ответчиков по сравнению с неот"
РНК без поли(А) обогащения, и в будущих ис"
ветчиками. При использовании классификато"
следованиях наш набор данных может быть ис"
ра, построенного на основе наиболее активиро"
пользован также для изучения связи некодиру"
ванного молекулярного пути «cAMP Pathway
ющих РНК с устойчивостью к трастузумабу. На"
Protein Retention», мы получили AUC равное 1 и
конец, это единственный набор данных по об"
0,87 для прогнозирования ответа HER2"положи"
разцам РМЖ, связанным с ответом на трастузу"
тельного метастатического РМЖ на трастузумаб
маб, который полностью совместим с базой дан"
в экспериментальной и литературной выборках
ных здоровых нормальных тканей ANTE в силу
соответственно. При объединении выборок этот
использования того же экспериментального
путь также являлся прогностическим маркером
протокола [50].
времени до рецидивирования (p = 0,041).
Мы сравнили гены и пути, которые разделя"
Опубликовано множество исследований, где
ли ответчиков и неответчиков на терапию трас"
профилировали экспрессию генов для образцов
тузумабом, как по нашим экспериментальным,
пациентов с РМЖ, получавших трастузумаб [40,
так и по литературным данным [4]. Предыдущее
43, 44]. Но лишь малая их часть содержит статус
исследование было направлено на выявление
ответа на терапию, связанный с профилем
биомаркеров ответа на трастузумаб на геномном
экспрессии, а также данные о выживаемости
и транскриптомном уровне. Авторы не нашли
для зарегистрированных клинических случаев.
гены или их сигнатуры, связанные с ответом на
БИОХИМИЯ том 85 вып. 7 2020
4*
900
СОРОКИН и др.
Рис. 5. Профиль дифференциальной активации молекулярного пути «ErbB Family Pathway» у ответчиков на терапию трас"
тузумабом против неответчиков в экспериментальном (а) и литературном (б) наборах данных
БИОХИМИЯ том 85 вып. 7 2020
МАРКЕРЫ ЭФФЕКТИВНОСТИ ТРАСТУЗУМАБА ПРИ РМЖ
901
трастузумаб по данным секвенирования РНК
а
[4]. Вероятно, это связано с тем, что авторы не
стратифицировали пациентов по статусу рецеп"
торов гормонов ER и PR, как было сделано в
настоящем исследовании. Тогда как общие для
обеих групп данных дифференциальные гены с
высокой вероятностью представляют результат
случайного совпадения, фактическое число ак"
тивированных у ответчиков молекулярных пу"
тей оказалось существенно выше, чем можно
было бы ожидать исходя из модели случайного
пересечения. В частности, лучшая связь с
чувствительностью к трастузумабу наблюдалась
для одной из ветвей сигнального пути цАМФ
б
(табл. 3).
цAMФ является первым описанным вторич"
ным мессенджером, который играет фундамен"
тальную роль в клеточном ответе на самые раз"
ные внешние стимулы [51]. Одной из функций
молекулярного пути цАМФ является активация
рецептора KDEL (Lys"Asp"Glu"Leu), отвечаю"
щего за ретроградный транспорт белков из
комплекса Гольджи в эндоплазматический рети"
кулум, что необходимо для поддержания устой"
чивого гомеостаза клетки [52]. Ранее было пока"
зано, что изменения в этом комплексе процес"
сов могут приводить к метастазированию РМЖ
посредством измененной локализации рецепто"
в
ров [53]. Кроме того, внутренние дефекты меха"
низма эндоцитоза, ответственного за деграда"
цию HER2, коррелируют с невосприимчи"
востью к терапии трастузумабом [54]. Однако,
насколько нам известно, настоящее исследова"
ние впервые указывает на возможную связь
между ретроградным транспортом и устойчи"
востью к трастузумабу.
Предыдущие исследования показали не"
сколько других возможных механизмов устой"
чивости к трастузумабу при раке молочной же"
лезы [55]. Во"первых, с такой резистентностью
могут быть связаны другие рецепторы семейства
HER, например HER2"позитивные, но негатив"
ные по HER3 пациенты в основном выживают
без метастазирования [56]. Рецепторы семейств,
отличных от HER, такие как FGFR и IGF"1R,
Рис. 6. Прогностическая значимость УАП молекулярного
также могут играть важную роль в устойчивости
пути «cAMP Pathway Protein Retention» для ответа РМЖ на
к трастузумабу [57, 58]. Существует также воз"
терапию трастузумабом и предсказания времени до про"
можная роль андрогенного рецептора (AR), по"
грессии. Площадь под ROC"кривой (AUC) для разделения
скольку экспрессия AR отрицательно коррели"
ответчиков и неответчиков для экспериментальной (а) и
литературной (б) выборки пациентов. в - Прогностичес"
рует с инфильтрацией иммунными клетками,
кая значимость уровня активации пути «cAMP Pathway
что, в свою очередь, связано с устойчивостью к
Protein Retention» для предсказания времени до прогрес"
трастузумабу [59, 60].
сии пациентов с РМЖ для объединенной эксперименталь"
В нашем исследовании уровень активации
ной и литературной выборки. Отдельно показаны группы
пациентов с УАП ниже или выше медианы. Отношение
пути «cAMP Pathway Protein Retention» оказался
рисков (Hazard ratio) = 0,34 (95% доверительный интервал:
надежным биомаркером, разделяющим ответ"
0,11-1; р"значение = 0,05). Общее количество генов в пу"
чиков и неответчиков на терапию трастузума"
тях, а также количество дифференциальных генов в обоих
бом. Более того, активация этого пути оказалась
наборах приведены в табл. S6 в Приложении
БИОХИМИЯ том 85 вып. 7 2020
902
СОРОКИН и др.
Таблица 3. Характеристика качества биомаркеров для 15 пересекшихся молекулярных путей, дифференциально активи"
рованных в группе ответчиков на терапию трастузумабом
AUC,
AUC,
Соотношение
p"значение
p"значение
Название молекулярного пути
экспериментальная
литературная
рисков (95% CI)
соотношения
теста Log"
выборка
выборка
рисков
rank
cAMP Pathway Protein Retention
1
0,867
0,34 (0,11-1)
0,05
0,041
PPAR Pathway
1
0,867
0,46 (0,16-1,4)
0,16
0,155
cAMP Pathway Cell Proliferation
1
0,85
0,34 (0,11-1)
0,05
0,041
cAMP Pathway eNOS Signaling
1
0,85
0,34 (0,11-1)
0,05
0,041
Cardiovascular Homeostasis
cAMP Pathway Glycogen
1
0,85
0,17 (0,043-0,64)
0,0094
0,004
Synthesis
cAMP Pathway Lipolysis
1
0,85
0,34 (0,11-1)
0,05
0,041
cAMP Pathway Oncogenesis
1
0,85
0,34 (0,11-1)
0,05
0,041
Noradrenaline and adrenaline
0,95
0,9
0,59 (0,21-1,7)
0,32
0,316
degradation
Reactome PRC2 methylates his"
1
0,85
0,17 (0,045-0,66)
0,01
0,004
tones and DNA Main Pathway
cAMP Pathway Degradation
1
0,817
0,34 (0,11-1)
0,05
0,041
of Cell Cycle Regulators
Reactome Amyloids Main
0,95
0,85
0,17 (0,045-0,66)
0,01
0,004
Pathway
Reactome Condensation
0,95
0,85
0,17 (0,045-0,66)
0,01
0,004
of Prophase Chromosomes
Main Pathway
Reactome DNA Damage
0,95
0,85
0,17 (0,045-0,66)
0,01
0,004
Telomere Stress Induced
Senescence Main Pathway
Reactome Packaging of
0,95
0,85
0,17 (0,045-0,66)
0,01
0,004
Telomere Ends Main Pathway
KEGG Drug metabolism
0,95
0,817
0,47 (0,16-1,4)
0,17
0,158
cytochrome P450 Main Pathway
связана с благоприятным
прогнозом в плане
Финансирование.
Это
исследование было
предсказания времени до рецидива опухоли.
поддержано Российским научным фондом
Мы предполагаем, что уровень активации этого
(грант № 18"15"00061) (Антон Буздин, Дмитрий
пути может служить для дальнейшей разработки
Камашев, Ульяна Владимирова, Максим Соро"
молекулярно"диагностических инструментов
кин, Мария Сунцова) и исследовательской
для раннего выявления пациентов, не отвечаю"
программой OmicsWay в области онкологии.
щих на HER2"таргетную терапию. Этот путь со"
Конфликт интересов. Авторы М. Сорокин и
держит 14 генов; таким образом, такой диагнос"
А. Буздин работают в компании OmicsWay
тический инструмент может основываться на
Corp., США. Это исследование получило фи"
RT"PCR, таргетном РНК"секвенировании, под"
нансирование от компании Omicsway Corp.,
ходе NanoString или любой другой платформе
США. Компания принимала участие в анализе
для профилирования экспрессии генов. Тем не
данных, их интерпретации и написании текста.
менее для продвижения по этому пути потребу"
Компания не принимала участия в разработке
ется дальнейшая клиническая валидация этого
дизайна исследования, сборе данных и решении
подхода.
опубликовать данную статью. Остальные авто"
БИОХИМИЯ том 85 вып. 7 2020
МАРКЕРЫ ЭФФЕКТИВНОСТИ ТРАСТУЗУМАБА ПРИ РМЖ
903
ры заявляют, что исследование проводилось в
нии и публикацию его результатов в обезличен"
отсутствие каких"либо коммерческих или фи"
ной форме. Форма информированного согласия
нансовых отношений, которые могут быть ис"
и дизайн исследования были одобрены этичес"
толкованы как потенциальный конфликт инте"
кими комитетами ГБУЗ Республики Карелия
ресов.
«Республиканский онкологический диспансер»
Соблюдение этических норм. От всех пациен"
(г. Петрозаводск) и Многопрофильного медици"
тов, биоматериал которых был включен в кли"
нского центра «ВитаМед» (г. Москва).
ническое исследование NCT03521245, озаглав"
Дополнительные материалы. Приложение к
ленное «Маркеры активации молекулярных пу"
статье на английском языке опубликовано на
тей, прогнозирующие эффективность терапии
сайте журнала «Biochemistry» (Moscow) (http://
трастузумабом HER2"позитивного рака молоч"
protein.bio.msu.ru/biokhimiya/) и на сайте изда"
ной железы», было получено информированное
добровольное согласие на участие в исследова"
journal/10541), том 85, вып. 7, 2020.
СПИСОК ЛИТЕРАТУРЫ
1.
Press, M. F., Bernstein, L., Thomas, P. A., Meisner, L. F.,
(2017) Do all patients with advanced HER2 positive breast
Zhou, J. Y., Ma, Y., Hung, G., Robinson, R. A., Harris, C.,
cancer need upfront"chemo when receiving trastuzumab?
El"Naggar, A., Slamon, D. J., Phillips, R. N., Ross, J. S.,
Randomized phase III trial SAKK 22/99, Ann. Oncol., 28,
Wolman, S. R., and Flom, K. J. (1997) HER"2/neu gene
305"312, doi: 10.1093/annonc/mdw622.
amplification characterized by fluorescence in situ
8.
Schmid, S., Klingbiel, D., Aebi, S., Goldhirsch, A.,
hybridization: poor prognosis in node"negative breast car"
Mamot, C., Munzone, E., Nolè, F., Oehlschlegel, C.,
cinomas, J. Clin. Oncol., 15, 2894"2904, doi: 10.1200/JCO.
Pagani, O., Pestalozzi, B., Rochlitz, C., Thürlimann, B.,
1997.15.8.2894.
von Moos, R., Weder, P., Zaman, K., and Ruhstaller, T.
2.
Slamon, D. J., Clark, G. M., Wong, S. G., Levin, W. J.,
(2019) Long"term responders to trastuzumab monotherapy
Ullrich, A., and McGuire, W. L. (1987) Human breast
in first"line HER"2+ advanced breast cancer: characteris"
cancer: correlation of relapse and survival with amplifica"
tics and survival data, BMC Cancer, 19, 902, doi: 10.1186/
tion of the HER"2/neu oncogene, Science, 235, 177"182,
s12885"019"6105"3.
doi: 10.1126/science.3798106.
9.
Zhu, X., and Verma, S. (2015) Targeted therapy in her2"
3.
Hammond, M. E. H., Hayes, D. F., Dowsett, M.,
positive metastatic breast cancer: a review of the literature,
Allred, D. C., Hagerty, K. L., et al. (2010) American
Curr. Oncol., 22, S19"28, doi: 10.3747/co.22.2363.
Society of Clinical Oncology/College of American
10.
Slamon, D. J., Leyland"Jones, B., Shak, S., Fuchs, H.,
Pathologists guideline recommendations for immunohisto"
Paton, V., Bajamonde, A., Fleming, T., Eiermann, W.,
chemical testing of estrogen and progesterone receptors in
Wolter, J., Pegram, M., Baselga, J., and Norton, L. (2001)
breast cancer, Arch. Pathol. Lab. Med., 134, 907"922,
Use of chemotherapy plus a monoclonal antibody against
doi: 10.1043/1543"2165"134.6.907.
HER2 for metastatic breast cancer that overexpresses
4.
Lesurf, R., Griffith, O. L., Griffith, M., Hundal, J., Trani, L.,
HER2, N. Engl. J. Med., 344, 783"792, doi: 10.1056/
Watson, M. A., Aft, R., Ellis, M. J., Ota, D., Suman, V. J.,
NEJM200103153441101.
Meric"Bernstam, F., Leitch, A. M., Boughey, J. C.,
11.
Buzdin, A., Sorokin, M., Garazha, A., Glusker, A.,
Unzeitig, G., Buzdar, A. U., Hunt, K. K., and Mardis, E.
Aleshin, A., Poddubskaya, E., Sekacheva, M., Kim, E.,
R. (2017) Genomic characterization of HER2"positive
Gaifullin, N., Giese, A., Seryakov, A., Rumiantsev, P.,
breast cancer and response to neoadjuvant trastuzumab
Moshkovskii, S., and Moiseev, A. (2019) RNA sequencing
and chemotherapy"results from the ACOSOG Z1041
for research and diagnostics in clinical oncology, Semin.
(Alliance) trial, Ann. Oncol., 28, 1070"1077, doi: 10.1093/
Cancer Biol., doi: 10.1016/j.semcancer.2019.07.010.
annonc/mdx048.
12.
Artcibasova, A. V., Korzinkin, M. B., Sorokin, M. I.,
5.
Buzdin, A., Sorokin, M., Garazha, A., Sekacheva, M.,
Shegay, P. V., Zhavoronkov, A. A., Gaifullin, N.,
Kim, E., Zhukov, N., Wang, Y., Li, X., Kar, S., Hartmann, C.,
Alekseev, B. Y., Vorobyev, N. V., Kuzmin, D. V., Kaprin, А. D.,
Samii, A., Giese, A., and Borisov, N. (2018) Molecular
Borisov, N. M., and Buzdin, A. A. (2016) MiRImpact, a
pathway activation - New type of biomarkers for tumor
new bioinformatic method using complete microRNA
morphology and personalized selection of target drugs,
expression profiles to assess their overall influence on the
Semin. Cancer Biol.,
53,
110"124, doi:
10.1016/
activity of intracellular molecular pathways, Cell Cycle, 15,
j.semcancer.2018.06.003.
689"698, doi: 10.1080/15384101.2016.1147633.
6.
Artemov, A., Aliper, A., Korzinkin, M., Lezhnina, K.,
13.
Buzdin, A. A., Prassolov, V., Zhavoronkov, A. A., and
Jellen, L., Zhukov, N., Roumiantsev, S., Gaifullin, N.,
Borisov, N. M. (2017) Bioinformatics meets biomedicine:
Zhavoronkov, A., Borisov, N., and Buzdin, A. (2015) A
OncoFinder, a quantitative approach for interrogating
method for predicting target drug efficiency in cancer
molecular pathways using gene expression data, Methods
based on the analysis of signaling pathway activation,
Mol. Biol., 1613, 53"83, doi: 10.1007/978"1"4939"7027"
Oncotarget, 6, 29347"29356, doi: 10.18632/oncotarget.
8_4.
5119.
14.
Borisov, N. M., Terekhanova, N. V., Aliper, A. M.,
7.
Pagani, O., Klingbiel, D., Ruhstaller, T., Nolè, F.,
Venkova, L. S., Smirnov, P. Y., Roumiantsev, S.,
Eppenberger, S., Oehlschlegel, C., Bernhard, J., Brauchli, P.,
Korzinkin, M. B., Zhavoronkov, A. A., and Buzdin, A. A.
Hess, D., Mamot, C., Munzone, E., Pestalozzi, B.,
(2014) Signaling pathways activation profiles make better
Rabaglio, M., Aebi, S., Ribi, K., Rochlitz, C., Rothgiesser, K.,
markers of cancer than expression of individual genes,
Thürlimann, B., von Moos, R., Zaman, K., Goldhirsch, A.,
Oncotarget, 5, 10198"10205, doi: 10.18632/oncotarget.
and Swiss Group for Clinical Cancer Research (SAKK)
2548.
БИОХИМИЯ том 85 вып. 7 2020
904
СОРОКИН и др.
15.
Buzdin, A., Sorokin, M., Poddubskaya, E., and Borisov, N.
25.
Howlader, N., Cronin, K. A., Kurian, A. W., and
(2019) High"throughputm data now complement tran"
Andridge, R. (2018) Differences in breast cancer survival
scriptomic profiling: advances in molecular pathway acti"
by molecular subtypes in the United States, Cancer
vation analysis approach in cancer biology, Cancer Inform.,
Epidemiol. Biomarkers Prev., 27, 619"626, doi: 10.1158/
18, 1176935119838844, doi: 10.1177/1176935119838844.
1055"9965.EPI"17"0627.
16.
Zolotovskaia, M. A., Sorokin, M. I., Roumiantsev, S. A.,
26.
Prat, A., Carey, L. A., Adamo, B., Vidal, M., Tabernero, J.,
Borisov, N. M., and Buzdin, A. A. (2018) Pathway instabil"
Cortés, J., Parker, J. S., Perou, C. M., and Baselga, J.
ity is an effective new mutation"based type of cancer bio"
(2014) Molecular features and survival outcomes of the
markers, Front. Oncol., 8, 658, doi: 10.3389/fonc.2018.
intrinsic subtypes within HER2"positive breast cancer, J.
00658.
Natl. Cancer Inst., 106, doi: 10.1093/jnci/dju152.
17.
Lezhnina, K., Kovalchuk, O., Zhavoronkov, A. A.,
27.
Dobin, A., Davis, C. A., Schlesinger, F., Drenkow, J.,
Korzinkin, M. B., Zabolotneva, A. A., Shegay, P. V.,
Zaleski, C., Jha, S., Batut, P., Chaisson, M., and
Sokov, D. G., Gaifullin, N. M., Rusakov, I. G., Aliper, A. M.,
Gingeras, T. R. (2013) STAR: ultrafast universal RNA"seq
Roumiantsev, S. A., Alekseev, B. Y., Borisov, N. M., and
aligner, Bioinformatics,
29,
15"21, doi:
10.1093/
Buzdin, A. A. (2014) Novel robust biomarkers for human
bioinformatics/bts635.
bladder cancer based on activation of intracellular signaling
28.
Love, M. I., Huber, W., and Anders, S. (2014) Moderated
pathways, Oncotarget, 5, 9022"9032, doi: 10.18632/
estimation of fold change and dispersion for RNA"seq data
oncotarget.2493.
with DESeq2, Genome Biol., 15, 550, doi: 10.1186/s13059"
18.
Ozerov, I. V., Lezhnina, K. V., Izumchenko, E., Artemov, A. V.,
014"0550"8.
Medintsev, S., Vanhaelen, Q., Aliper, A., Vijg, J.,
29.
Sorokin, M., Kholodenko, R., Suntsova, M., Malakhova, G.,
Osipov, A. N., Labat, I., West, M. D., Buzdin, A.,
Garazha, A., Kholodenko, I., Poddubskaya, E., Lantsov, D.,
Cantor, C. R., Nikolsky, Y., Borisov, N., Irincheeva, I.,
Stilidi, I., Arhiri, P., Osipov, A., and Buzdin, A. (2018)
Khokhlovich, E., Sidransky, D., Camargo, M. L., and
Oncobox bioinformatical platform for selecting potentially
Zhavoronkov, A. (2016) In silico Pathway Activation
effective combinations of target cancer drugs using high"
Network Decomposition Analysis (iPANDA) as a method
throughput gene expression data, Cancers,
10,
for biomarker development, Nat. Commun., 7, 13427,
doi: 10.3390/ cancers10100365.
doi: 10.1038/ncomms13427.
30.
Croft, D., Mundo, A. F., Haw, R., Milacic, M., Weiser, J.,
19.
Buzdin, A. A., Zhavoronkov, A. A., Korzinkin, M. B.,
Wu, G., Caudy, M., Garapati, P., Gillespie, M.,
Roumiantsev, S. A., Aliper, A. M., Venkova, L. S.,
Kamdar, M. R., Jassal, B., Jupe, S., Matthews, L., May, B.,
Smirnov, P. Y., and Borisov, N. M. (2014) The OncoFinder
Palatnik, S., Rothfels, K., Shamovsky, V., Song, H.,
algorithm for minimizing the errors introduced by
Williams, M., Birney, E., Hermjakob, H., Stein, L., and
the high"throughput methods of transcriptome ana"
D’Eustachio, P.(2014) The Reactome pathway knowledge"
lysis, Front. Mol. Biosci., 1, 8, doi: 10.3389/fmolb.2014.
base, Nucleic Acids Res., 42, D472"477, doi: 10.1093/
00008.
nar/gkt1102.
20.
Borisov, N., Suntsova, M., Sorokin, M., Garazha, A.,
31.
Schaefer, C. F., Anthony, K., Krupa, S., Buchoff, J., Day, M.,
Kovalchuk, O., Aliper, A., Ilnitskaya, E., Lezhnina, K.,
Hannay, T., and Buetow, K. H. (2009) PID: the Pathway
Korzinkin, M., Tkachev, V., Saenko, V., Saenko, Y.,
Interaction Database, Nucleic Acids Res., 37, D674"D679,
Sokov, D. G., Gaifullin, N. M., Kashintsev, K.,
doi: 10.1093/nar/gkn653.
Shirokorad, V., Shabalina, I., Zhavoronkov, A., Mishra, B.,
32.
Kanehisa, M. (2000) KEGG: Kyoto Encyclopedia of
Cantor, C. R., and Buzdin, A. (2017) Data aggregation at
Genes and Genomes, Nucleic Acids Res., 28, 27"30,
the level of molecular pathways improves stability of exper"
doi: 10.1093/nar/28.1.27.
imental transcriptomic and proteomic data, Cell Cycle, 16,
33.
Romero, P., Wagg, J., Green, M. L., Kaiser, D.,
1810"1823, doi: 10.1080/15384101.2017.1361068.
Krummenacker, M., and Karp, P. D. (2005) Computational
21.
Zhu, Q., Izumchenko, E., Aliper, A. M., Makarev, E., Paz, K.,
prediction of human metabolic pathways from the com"
Buzdin, A. A., Zhavoronkov, A. A., and Sidransky, D.
plete human genome, Genome Biol., 6, R2, doi: 10.1186/
(2015) Pathway activation strength is a novel independent
gb"2004"6"1"r2.
prognostic biomarker for cetuximab sensitivity in colorec"
34.
Nishimura, D. (2001) BioCarta, Biotech Software and
tal cancer patients, Hum. Genome Var.,
2,
15009,
Internet
Report,
2,
117"120, doi:
10.1089/
doi: 10.1038/hgv.2015.9.
152791601750294344.
22.
Poddubskaya, E. V., Baranova, M. P., Allina, D. O.,
35.
Igolkina, A. A., Zinkevich, A., Karandasheva, K. O.,
Sekacheva, M. I., Makovskaia, L. A., Kamashev, D. E.,
Popov, A. A., Selifanova, M. V., Nikolaeva, D., Tkachev, V.,
Suntsova, M. V., Barbara, V. S., Kochergina"Nikitskaya, I. N.,
Penzar, D., Nikitin, D. M., and Buzdin, A.
(2019)
and Aleshin, A. A. (2019) Personalized prescription of ima"
H3K4me3, H3K9ac, H3K27ac, H3K27me3 and
tinib in recurrent granulosa cell tumor of the ovary: case
H3K9me3 histone tags suggest distinct regulatory evolu"
report, Cold Spring Harb. Mol. Case Stud., 5, doi: 10.1101/
tion of open and condensed chromatin landmarks, Cells, 8,
mcs.a003434.
doi: 10.3390/cells8091034.
23.
Poddubskaya, E. V., Baranova, M. P., Allina, D. O.,
36.
Marggraf, M. B., Panteleev, P. V., Emelianova, A. A.,
Smirnov, P. Y., Albert, E. A., Kirilchev, A. P., Aleshin, A. A.,
Sorokin, M. I., Bolosov, I. A., Buzdin, A. A., Kuzmin, D. V.,
Sekacheva, M. I., and Suntsova, M. V. (2018) Personalized
and Ovchinnikova, T. V. (2018) Cytotoxic potential of the
prescription of tyrosine kinase inhibitors in unresectable
novel horseshoe crab peptide polyphemusin III, Mar.
metastatic cholangiocarcinoma, Exp. Hematol. Oncol., 7,
Drugs, 16, doi: 10.3390/md16120466.
21, doi: 10.1186/s40164"018"0113"x.
37.
Buzdin, A., Garazha, A., Sorokin, M., Glusker, A.,
24.
Poddubskaya, E., Bondarenko, A., Boroda, A., Zotova, E.,
Aleshin, A., Allina, D., Suntsova, M., Tkachev, V., Borger, P.,
Glusker, A., Sletina, S., Makovskaia, L., Kopylov, P.,
Borisov, N., and Gaifullin, N. (2019) RNA sequencing
Sekacheva, M., Moisseev, A., and Baranova, M. (2019)
analysis for profiling activation of cancer"associated mole"
Transcriptomics"guided personalized prescription of tar"
cular pathways, J. Clin. Oncol., 37, e13032"e13032,
geted therapeutics for metastatic ALK"positive lung cancer
doi: 10.1200/jco.2019.37.15_suppl.e13032.
case following recurrence on ALK inhibitors, Front. Oncol.,
38.
Green, D. M., Swets, J. A. (1966) Signal Detection Theory
9, 1026, doi: 10.3389/fonc.2019.01026.
and Psychophysics, New York.
БИОХИМИЯ том 85 вып. 7 2020
МАРКЕРЫ ЭФФЕКТИВНОСТИ ТРАСТУЗУМАБА ПРИ РМЖ
905
39.
Chen, L., Zhou, Y., Tang, X., Yang, C., Tian, Y., Xie, R.,
49.
SEQC/MAQC"III Consortium (2014) A comprehensive
Chen, T., Yang, J., Jing, M., Chen, F., Wang, C., Sun, H.,
assessment of RNA"seq accuracy, reproducibility and
and Huang, Y. (2019) EGFR mutation decreases FDG
information content by the Sequencing Quality Control
uptake in non"small cell lung cancer via the NOX4/
Consortium, Nat. Biotechnol., 32, 903"914, doi: 10.1038/
ROS/GLUT1 axis, Int. J. Oncol.,
54,
370"380,
nbt.2957.
doi: 10.3892/ijo.2018.4626.
50.
Suntsova, M., Gaifullin, N., Allina, D., Reshetun, A., Li, X.,
40.
Tanioka, M., Fan, C., Parker, J. S., Hoadley, K. A., Hu, Z.,
Mendeleeva, L., Surin, V., Sergeeva, A., Spirin, P.,
Li, Y., Hyslop, T. M., Pitcher, B. N., Soloway, M. G.,
Prassolov, V., Morgan, A., Garazha, A., Sorokin, M., and
Spears, P. A., Henry, L. N., Tolaney, S., Dang, C. T.,
Buzdin, A. (2019) Atlas of RNA sequencing profiles for
Krop, I. E., Harris, L. N., Berry, D. A., Mardis, E. R.,
normal human tissues, Sci. Data, 6, 36, doi: 10.1038/
Winer, E. P., Hudis, C. A., Carey, L. A., and
s41597"019"0043"4.
Perou, M.(2018) Integrated analysis of RNA and DNA
51.
Kumar, N., Prasad, P., Jash, E., Saini, M., Husain, A.,
from the phase III trial CALGB 40601 identifies predictors
Goldman, A., and Sehrawat, S. (2018) Insights into
of response to trastuzumab"based neoadjuvant chemother"
exchange factor directly activated by cAMP (EPAC) as
apy in HER2"positive breast cancer, Clin. Cancer Res., 24,
potential target for cancer treatment, Mol. Cell. Biochem.,
5292"5304, doi: 10.1158/1078"0432.CCR"17"3431.
447, 77"92, doi: 10.1007/s11010"018"3294"z.
41.
Liu, T., Cheng, G., Kang, X., Xi, Y., Zhu, Y., Wang, K.,
52.
Capitani, M., and Sallese, M. (2009) The KDEL receptor:
Sun, C., Ye, J., Li, P., and Yin, H. (2018) Noninvasively
new functions for an old protein, FEBS Lett., 583, 3863"
evaluating the grading and IDH1 mutation status of diffuse
3871, doi: 10.1016/j.febslet.2009.10.053.
gliomas by three"dimensional pseudo"continuous arterial
53.
Maisel, S. A., and Schroeder, J. (2019) Wrong place at the
spin labeling and diffusion"weighted imaging,
wrong time: how retrograde trafficking drives cancer
Neuroradiology, 60, 693"702, doi: 10.1007/s00234"018"
metastasis through receptor mislocalization, J. Cancer
2021"5.
Metastasis Treat., 2019, doi: 10.20517/2394"4722.2018.82.
42.
Boyd, J. C. (1997) Mathematical tools for demonstrating
54.
Valabrega, G., Montemurro, F., Sarotto, I., Petrelli, A.,
the clinical usefulness of biochemical markers, Scand. J.
Rubini, P., Tacchetti, C., Aglietta, M., Comoglio, P. M.,
Clin. Lab. Invest. Suppl., 227, 46"63.
and Giordano, S. (2005) TGFα expression impairs
43.
Hendricks, W. P. D., Briones, N., Halperin, R. F., Facista, S.,
Trastuzumab"induced HER2 downregulation, Oncogene,
Heaton, P. R., Mahadevan, D., and Kim, S. (2019) PD"1"
24, 3002"3010, doi: 10.1038/sj.onc.1208478.
associated gene expression signature of neoadjuvant
55.
Ahmad, A. (2019) Current updates on trastuzumab resis"
trastuzumab"treated tumors correlates with patient survival
tance in HER2 overexpressing breast cancers, Adv. Exp.
in HER2"positive breast cancer, Cancers, 11, doi: 10.3390/
Med. Biol., 1152, 217"228, doi: 10.1007/978"3"030"20301"
cancers11101566.
6_10.
44.
Okuma, H. S., Koizumi, F., Hirakawa, A., Nakatochi, M.,
56.
Adamczyk, A., Kruczak, A., Harazin"Lechowska, A.,
Komori, O., Hashimoto, J., Kodaira, M., Yunokawa, M.,
Ambicka, A., Grela"Wojewoda, A., Domagala"Haduch,
Yamamoto, H., Yonemori, K., Shimizu, C., Fujiwara, Y.,
M., Janecka"Widla, A., Majchrzyk, K., Cichocka, A., Rys, J.,
and Tamura, K. (2016) Clinical and microarray analysis of
and Niemiec, J. (2018) Relationship between HER2 gene
breast cancers of all subtypes from two prospective preop"
status and selected potential biological features related to
erative chemotherapy studies, Br. J. Cancer, 115, 411"419,
trastuzumab resistance and its influence on survival of
doi: 10.1038/bjc.2016.184.
breast cancer patients undergoing trastuzumab adjuvant
45.
Popovici, V., Chen, W., Gallas, B. G., Hatzis, C., Shi, W.,
treatment, Onco Targets Ther.,
11,
4525"4535,
Samuelson, F. W., Nikolsky, Y., Tsyganova, M., Ishkin, A.,
doi: 10.2147/OTT.S166983.
Nikolskaya, T., Hess, K. R., Valero, V., Booser, D.,
57.
Hanker, A. B., Garrett, J. T., Estrada, M. V., Moore, P. D.,
Delorenzi, M., Hortobagyi, G. N., Shi, L., Symmans, W. F.,
Ericsson, P. G., et al. (2017) HER2"overexpressing breast
and Pusztai, L. (2010) Effect of training"sample size and
cancers amplify FGFR signaling upon acquisition of resis"
classification difficulty on the accuracy of genomic predic"
tance to dual therapeutic blockade of HER2, Clin. Cancer
tors, Breast Cancer Res., 12, R5, doi: 10.1186/bcr2468.
Res., 23, 4323"4334, doi: 10.1158/1078"0432.CCR"16"
46.
Shi, L., Campbell, G., Jones, W. D., Campagne, F., Wen, Z.,
2287.
et al. (2010) The MicroArray Quality Control (MAQC)"II
58.
Lenz, G., Hamilton, A., Geng, S., Hong, T., Kalkum, M.,
study of common practices for the development and vali"
Momand, J., Kane, S. E., and Huss, J. M. (2018) t"Darpp
dation of microarray"based predictive models, Nat.
activates IGF"1R signaling to regulate glucose metabolism
Biotechnol., 28, 827"838, doi: 10.1038/nbt.1665.
in trastuzumab"resistant breast cancer cells, Clin. Cancer
47.
Sonnenblick, A., Brohée, S., Fumagalli, D., Rothé, F.,
Res., 24, 1216"1226, doi: 10.1158/1078"0432.CCR"17"
Vincent, D., Ignatiadis, M., Desmedt, C., Salgado, R.,
0824.
Sirtaine, N., Loi, S., Neven, P., Loibl, S., Denkert, C.,
59.
Martinez, V. G., O’Neill, S., Salimu, J., Breslin, S.,
Joensuu, H., Piccart, M., and Sotiriou, C.
(2015)
Clayton, A., Crown, J., and O’Driscoll, L.
(2017)
Integrative proteomic and gene expression analysis identi"
Resistance to HER2"targeted anti"cancer drugs is associat"
fy potential biomarkers for adjuvant trastuzumab resis"
ed with immune evasion in cancer cells and their derived
tance: analysis from the Fin"her phase III randomized
extracellular vesicles, Oncoimmunology, 6, e1362530,
trial, Oncotarget,
6,
30306"30316, doi:
10.18632/
doi: 10.1080/2162402X.2017.1362530.
oncotarget.5080.
60.
Van Rooijen, J. M., Qiu, S. Q., Timmer"Bosscha, H., van der
48.
Nault, R., Fader, K. A., and Zacharewski, T. (2015) RNA"
Vegt, B., Boers, J. E., Schroder, C. P., and de Vries, E. G. E.
Seq versus oligonucleotide array assessment of dose"
(2018) Androgen receptor expression inversely correlates
dependent TCDD"elicited hepatic gene expression in
with immune cell infiltration in human epidermal growth
mice, BMC Genomics, 16, 373, doi: 10.1186/s12864"015"
factor receptor 2"positive breast cancer, Eur. J. Cancer,
1527"z.
103, 52"60, doi: 10.1016/j.ejca.2018.08.001.
БИОХИМИЯ том 85 вып. 7 2020
906
СОРОКИН и др.
MOLECULAR PATHWAY ACTIVATION MARKERS ARE LINKED
WITH EFFICACY OF TRASTUZUMAB THERAPY IN METASTATIC
HER2 POSITIVE BREAST CANCER BETTER THAN INDIVIDUAL
GENE EXPRESSION LEVELS*
M. Sorokin1,2,3, K. Ignatev4, V. Barbara4, U. Vladimirova1,3, A. Muraveva3, M. Suntsova1,
N. Gaifullin5, I. Vorotnikov6, D. Kamashev1,3, A. Bondarenko7, M. Baranova7,8,
E. Poddubskaya3,7, and A. Buzdin1,2,3,9**
1 Shemyakin and Ovchinnikov Institute of Bioorganic Chemistry, 117997 Moscow, Russia; EGmail: buzdin@oncobox.com
2 OmicsWay Corp., 91789 Walnut, CA, USA
3 Institute of Molecular Medicine of the Sechenov First Moscow State Medical University (Sechenov University),
119991 Moscow, Russia
4 Republican Oncological Dispensary of Karelia Republic, 185016 Petrozavodsk, Russia
5 Lomonosov Moscow State University, Faculty of Fundamental Medicine, 119991 Moscow, Russia
6 Blokhin National Medical Research Center of Oncology of the Ministry of Health of the Russian Federation,
115478 Moscow, Russia
7 VitaMed Medical Center, 121309 Moscow, Russia
8 Russian Scientific Center of Surgery named after B. V. Petrovsky, 119991 Moscow, Russia
9 Moscow Institute of Physics and Technology (National Research University),
141701 Dolgoprudny, Moscow Region, Russia
Received March 31, 2020
Received May 29, 2020
Accepted May 31, 2020
Increased expression or amplification of HER2 receptor tyrosine kinase gene ERBB2 is well"known and widely used
as a prognostic biomarker of breast cancer (BC) response to the targeted treatment with trastuzumab and its analogs.
Considering that part of the BC patients overexpressing HER2 does not respond to trastuzumab, clinical trial
NCT03521245 was initiated to identify additional gene expression and molecular pathway activation response bio"
markers to trastuzumab treatment in HER2"positive BC. Using RNA sequencing gene expression in 23 formalin"
fixed, paraffin embedded HER2 positive BC tissue blocks from patients who either responded or not responded to
trastuzumab treatment was profiled. Differentially regulated genes and molecular pathways were identified in the
groups of trastuzumab responders and non"responders. These results were next compared with the 42 previously pub"
lished BC trastuzumab responder and non"responder RNA sequencing profiles from the clinical trials NCT00513292
and NCT00353483. No correlation was observed between the response status and the expression levels of ERBB2 gene
in the HER2 positive BC samples. Analysis of the differentially expressed genes and molecular pathways in the com"
bined dataset revealed 15/27 commonly up/down regulated genes and 15/25 pathways, respectively. However, only the
intersection of molecular pathways upregulated in trastuzumab responders vs nonGresponders was statistically signifi"
cantly enriched compared to the random expectation model. A classifier built using the most significantly upregulat"
ed molecular pathway—cAMP Pathway Protein Retention—demonstrated the best performance for prediction of the
HER2 positive BC response to trastuzumab for both our experimental and previously reported data. This pathway also
predicted time to recurrence in the combined dataset with Log"rank p"value 0.041.
Keywords: breast cancer, HER2, ERBB2, transcriptomics, RNA sequencing, trastuzumab, targeted therapy, personal"
ized medicine, NCT03521245
БИОХИМИЯ том 85 вып. 7 2020