БИОХИМИЯ, 2021, том 86, вып. 1, с. 56 - 72
УДК 577.151.43
МЕХАНИЗМ ИНГИБИРОВАНИЯ ЦИТОХРОМ c ОКСИДАЗЫ
ТРИТОНОМ Х 100
© 2021
И.П. Олейников1,2, Н.В. Ацаркина2*, Т.В. Выгодина2,
А.А. Константинов2
1 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119992 Москва, Россия
2 НИИ физико(химической биологии им. А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119992 Москва, Россия; электронная почта: azarkina@yahoo.com
Поступила в редакцию 15.09.2020
После доработки 30.10.2020
Принята к публикации 30.10.2020
Известно, что тритон Х 100 (ТХ) обратимо ингибирует активность цитохром с(оксидазы (ЦО). В работе
проанализирован механизм ингибирования. Действие ТХ не направлено на реакцию ЦО с цитохромом с, не
вызывает переход фермента в «медленную» форму и не связано с мономеризацией препарата. ТХ полностью
подавляет кислород редуктазную реакцию, однако ингибирование предотвращается и частично обращает
ся додецилмальтозидом (ДМ) - детергентом, применяемым для поддержания ЦО в растворе. Показано, что
ДМ конкурирует с ТХ за связывание с ЦО в соотношении 1/1, Ki = 0,3 мМ, сродство ДМ к ферменту со
ставляет 1,2 мМ. В окисленном ферменте ТХ вызывает спектральный ответ с максимумом при 421 нм и
[TX]1/2 = 0,28 мМ, связанный, предположительно, с гемом а3. При взаимодействии ЦО с избытком Н2О2 ТХ
влияет на равновесие кислородных интермедиатов каталитического центра, ускоряя переход FI 607→FII 580,
ингибирует образование ферментом O•- и, в меньшей степени, подавляет каталазную парциальную актив
ность. Наблюдаемые эффекты могут объясняться ингибированием превращения в каталитическом цикле
интермедиата FII 580 в свободную окисленную форму. В работающем ферменте ТХ подавляет внутримоле
кулярный перенос электронов между гемами а и а3. В условиях эффективного ингибирования оксидазной
реакции пероксидазная парциальная активность ЦО достаточно устойчива к ТХ. Эти особенности указыва
ют на нарушение проводимости протонного канала К. Мы полагаем, что ТХ взаимодействует с ЦО в цент
ре связывания желчных кислот (ЦСЖК), расположенном на субъединице I в устье К канала и контактиру
ющем с амфипатическими регуляторами ЦО [Buhrow et al. (2013) Biochemistry, 52, 6995 7006]. По видимому,
ТХ является аналогом физиологического лиганда ЦСЖК, а молекула ДМ - аналогом эндогенного фосфо
липида, связывающегося на границе ЦСЖК и контролирующего эффективное сродство к лиганду.
КЛЮЧЕВЫЕ СЛОВА: цитохром с оксидаза, тритон Х 100, регуляция, К канал, амфипатические лиганды.
DOI: 10.31857/S032097252101005X
ВВЕДЕНИЕ
ления кислорода по цепочке редокс центров,
входящих в структуру фермента (схема 1).
Цитохром с оксидаза (ЦО) катализирует вос
становление кислорода до воды электронами,
цитохром с => CuA => гем a => гем a3/CuB => O2
приходящими по дыхательной цепи от субстра
тов цикла Кребса, открывая возможность ис
Схема 1. Последовательность переноса электронов по
цепочке редокс центров ЦО.
пользования энергии восстановления кислорода
для энергетических нужд клетки в процессе
окислительного фосфорилирования. В ходе ок
Кислород восстанавливается в биядерном
сидазной реакции электроны поступают на ЦО
центре, который образован высокоспиновым
от цитохрома с и переносятся к месту восстанов
гемом а3 и ионом меди CuВ. В реакции О2 → Н2О
участвуют 4 «субстратных» протона, поступаю
щих в биядерный центр из матрикса митохонд
Принятые сокращения: ДМ - додецилмальтозид;
ТМФД - N,N,N′,N′ тетраметил п(фенилендиамин; ТХ - рий (цитоплазмы бактерий). С восстановлением
тритон Х 100; ЦО - цитохром с(оксидаза; ЦСЖК - центр кислорода сопряжен также перенос четырех
связывания желчных кислот; Ki - константа ингибирова
«помповых» протонов через мембрану (в на
ния; Ki(app) - кажущаяся константа ингибирования; Ох -
свободная окисленная форма фермента; WST 1 - водорас
правлении изнутри наружу). Все протоны,
творимый тетразолий.
участвующие в каталитическом цикле ЦО, пере
* Адресат для корреспонденции.
носятся внутри белка по протонным каналам К
56
ИНГИБИРОВАНИЕ ЦИТОХРОМОКСИДАЗЫ ТРИТОНОМ Х 100
57
и D, названным по образующим их критичес
ческой регуляции фермента, позволяющей
ким аминокислотным остаткам. Более подроб
быстро и гибко подстраивать его активность под
но c механизмом работы ЦО можно ознако
текущие энергетические запросы клетки. Не
миться в недавно вышедших обзорах [1-4].
давно в трехмерной структуре ЦО была выявле
Как и другие мембранные белки, ЦО отлича
на особая гидрофобная площадка, названная
ется высокой гидрофобностью. Первой стадией
центром связывания желчных кислот (ЦСЖК)
в процедуре ее выделения является солюбилиза
[20]. Предполагается, что в ЦСЖК могут обра
ция: растворение окружающей мембраны при
тимо связываться амфипатические (содержа
помощи детергентов и встраивание белка в об
щие гидрофобные и гидрофильные участки) ли
разованные детергентом мицеллы. В солюбили
ганды
- регуляторы активности. В работе
зированной форме ЦО проходит дальнейшие
Antalik et al. [21] высказывается предположение,
стадии выделения и очистки, хранится и ис
что в этой же зоне связывается и ТХ.
пользуется в экспериментах.
В представленной работе мы исследовали
Уже при первых попытках выделения ЦО
взаимодействие ТХ с митохондриальной ЦО бо
было замечено, что от типа применяемого де
лее подробно, чем это делалось раньше. Нами
тергента зависит не только выход препарата, но
обнаружена конкуренция ТХ с «мягким» детер
и его свойства [5, 6]. Так, многие детергенты, на
гентом додецилмальтозидом (ДМ). Также мы ус
зываемые «жесткими» (тритон, SDS и в мень
тановили место действия ТХ в цепочке перено
шей степени холат и дезоксихолат) позволяют
са электронов по редокс центрам ЦО и вероят
экстрагировать ЦО из мембраны наиболее пол
ную мишень ингибирования в каталитическом
но и получать стабильный и гомогенный конеч
цикле оксидазной реакции. Полученные дан
ный продукт, но обладающий крайне низкой
ные указывают на то, что эффекты ТХ в отноше
ферментативной активностью. Более «мягкие»
нии ЦО имитируют действие природного регу
агенты (Tween, октилглюкозид, додецилмальто
лятора ее активности.
зид), напротив, при меньшем количественном
выходе позволяют получить активный препарат
[7, 8]. Важным обстоятельством оказался обра
МАТЕРИАЛЫ И МЕТОДЫ
тимый характер инактивации в первом случае:
препарат ЦО, выделенный с применением три
Реактивы. В работе использовали следующие
тона Х 100 (ТХ) или желчных кислот, частично
реактивы высокой степени чистоты: рН буферы
или полностью реактивируется при последую
(Tris и Hepes) и этилендиаминтетрауксусная
щей замене детергента на Tween, Emasol, или ал
кислота (ЭДТА) («Amresco», США); β D доде
килглюкозиды [7, 9]. В связи с этим «жесткие»
цилмальтозид квалификации
«Sol grade»
детергенты продолжают применять для солюби
(«Anatrace», США); о(дианизидин дихлорид
лизации мембран, но заменяют их на «мягкие»,
(«ICN Biomedicals Inc», США); L аскорбиновая
чтобы поддерживать в растворимой форме ко
кислота, цитохром с из сердца лошади (тип III),
нечный препарат.
дитионит натрия, цианид калия, феррицианид
Феномен ингибирования активности мито
калия, ферроцианид калия, тетраметил п фени
хондриальной ЦО тритоном Х 100 обсуждался в
лендиамин (ТМФД), каталаза (23000 ед/мг бел
литературе многократно [5, 7, 10-15]. В ранних
ка), супероксиддисмутаза, тритон Х 100, гекса
работах снижение оксидазной активности в
аммиакат рутения (RuAm) («Sigma Aldrich»,
присутствии ТХ обычно связывали с вытесне
США); водорастворимый тетразолий (water sol
нием детергентом молекул фосфолипидов,
uble tetrazolium, WST 1) («Dojindo Molecular
прочно ассоциированных с белком в нативных
Technologies», Япония).
условиях [16]. Отмечалось также, что обработка
Концентрированный раствор перекиси во
препарата ТХ ведет к мономеризации белковых
дорода (~30%) («Sigma Aldrich», США) хранили
комплексов [9, 17, 18], тогда как в составе мемб
при +4 °С, перед опытом проверяли концентра
раны (естественной или искусственной), а так
цию спектрофотометрически, используя
же в растворе «мягких» неионных детергентов
ε240 = 40 М-1⋅см-1 [22], и готовили разведения
ЦО из митохондрий быка находится в форме
нужной концентрации. Все растворы готовили
димеров [16, 19]. Позже были получены данные
на воде, очищенной с помощью системы MilliQ.
о том, что фермент, перешедший в неактивную
Препараты. Цитохром с оксидаза была выде
конформацию, в присутствии ТХ теряет способ
лена из митохондрий сердца быка. Говяжьи
ность к реактивации после прохождения ката
сердца получали на скотобойне ООО «Пушкин
литического цикла [14, 15].
ский мясной двор», Пушкино, Московская обл.,
В последние годы основное внимание иссле
и хранили во льду до начала процедуры выделе
дователей ЦО сосредоточилось на физиологи
ния. Выделение начинали через 2-3 ч после за
БИОХИМИЯ том 86 вып. 1 2021
58
ОЛЕЙНИКОВ и др.
боя и проводили по модифицированному мето
ЦО в присутствии милимолярных концентра
ду Fowler et al. [23], как описано ранее [24]. Вы
ций Н2О2. Восстановление водорастворимого
деленный препарат хранили расфасованным не
красителя WST 1 регистрировали по возраста
большими порциями при -70 °С. Концентра
нию экстинкции при 440 нм относительно вол
цию фермента определяли по разностному
ны сравнения 550 нм. Среда опыта: базовая сре
спектру оптического поглощения (образец, вос
да + 50 мМ KCl, рН 7,5, 1 мМ ДМ.
становленный дитионитом, минус окислен
Каталазную активность ЦО регистрировали
ный), используя Δε605630 = 27 мМ-1⋅см-1.
с помощью кислородного электрода, как описа
Спектрофотометрические измерения прово
но ранее [27]. Измерения проводили в 30 мМ ка
дили в стандартной кювете («Hellma», Герма
лий фосфатном буфере, рН 7,2, содержащем
ния) с затемненными боковыми гранями и дли
0,1 мМ ЭДТА и 1 мМ додецилмальтозид («ката
ной оптического пути
10
мм. Абсолютные
лазная среда»). В качестве субстрата использо
спектры поглощения записывали при ширине
вали 12 мМ Н2О2. Наблюдаемое выделение кис
оптической щели 2 нм и скорости записи 2 нм/с
лорода полностью подавлялось цианидом.
на двулучевом спектрофотометре Cary Bio 300
Перевод ЦО в форму FI 607 по Николсу. Аэ
(«Varian», США). Кинетику изменений оптичес
робный раствор фермента в течение 2 мин про
кого поглощения регистрировали на спектро
дували окисью углерода. Как впервые показано
фотометре SLM Aminco DW 2000
(«SLM
в работе Nicholls и Chanady [28], эта процедура
Instruments», США) в двуволновом режиме.
позволяет получить оксоферрильный комп
Измерения ферментативных активностей. Ок
лекс FI 607 с высоким выходом и практически
сидазная активность. Скорость потребления
без примеси FII 580. Процесс протекает непо
кислорода регистрировали амперометрически с
средственно в биядерном центре и состоит в его
помощью закрытого электрода Кларковского
двухэлектронном восстановлении молекула
типа на приборе Oxygraph («Наnsatech», Вели
ми СО с последующим двухэлектронным окис
кобритания) в термостатируемой ячейке объе
лением кислородом и образованием in situ сте
мом 1 мл при 25 °C и постоянном перемешива
хиометрического количества H2O2 и интермеди
нии. Измерения проводили в базовой среде, со
ата FI 607. Процедуру проводили в закрытой
держащей 50 мМ Tris/Hepes, 0,1 мM ЭДТА, при
кювете, в присутствии 0,1 мМ феррицианида
pH 7,5. Перед опытом в базовую среду добавля
(для предотвращения восстановления гема а) и
ли детергент (додецилмальтозид или тритон Х
каталазы, добавляемой в объеме 1 мкл до концен
100) в указанной концентрации. Концентрация
трации 690 ед/мл (для полного удаления воз
обоих детергентов приводится в тексте в мМ
можных следов экзогенной перекиси).
(0,05% додецилмальтозид ≈ 1,0 мM; 0,1% три
Обработку данных проводили при помощи
тон Х 100 ≈ 1,6 мМ). В качестве субстрата дыха
программы Origin
7
и
9
ния использовали 5 мМ аскорбат (как восстано
витель цитохрома с), 0,1 мМ ТМФД (как ре
Погрешность измерений. Эксперименты по
докс медиатор) и 10 мкМ цитохром с (как не
исследованию кинетики изменений концентра
посредственный донор). Концентрация ЦО в
ции кислорода и изменений оптического погло
пробе составляла 15-54 нМ. Cкорость дыхания
щения проводили в трех независимых повторах,
при расчетах корректировали, вычитая само
разброс данных не превышает 10%. В экспери
окисление аскорбата.
ментах по титрованию ферментативных актив
Пероксидазную активность ЦО измеряли,
ностей тритоном Х 100, реактивации ингибиро
как описано ранее [25]. Перекисное окисление
ванного фермента додецилмальтозидом, титро
0,2 мМ о(дианизидина в присутствии перекиси
ванию тритоном спектральных изменений и оп
водорода регистрировали спектрофотометри
ределению концентрационной зависимости
чески в двуволновом режиме по разности погло
константы скорости каждое измерение прово
щений при 432 нм относительно волны сравне
дили в 2-4 независимых повторах, на рисунках
ния
580
нм. В среду опыта (базовая сре
приводятся средние значения, оценка погреш
да + 50 мМ KCl, рН 7,5, детергенты в указанных
ности соответствует разбросу эксперименталь
концентрациях) вносили ЦО и о дианизидин.
ных точек относительно проведенных теорети
Окисления о(дианизидина не наблюдалось и ре
ческих кривых. В эксперименте по титрованию
акцию запускали добавлением H2O2.
оксидазной активности додецилмальтозидом
Образование супероксида ЦО в присутствии
каждое измерение проводили в 3-10 независи
избытка перекиси измеряли на спектрофото
мых повторах, на рисунке приводятся средние
метре, классическим методом [26] - по чувстви
значения и среднеквадратичные отклонения.
тельному к супероксиддисмутазе восстановле
В случае спектров поглощения погрешность оп
нию солей тетразолия, которое катализируется
ределяется отношением сигнала к шуму. В экс
БИОХИМИЯ том 86 вып. 1 2021
ИНГИБИРОВАНИЕ ЦИТОХРОМОКСИДАЗЫ ТРИТОНОМ Х 100
59
периментах по титрованию спектральных изме
где v - нормализованная скорость реакции (в
нений перекисью водорода погрешность соот
процентах), [I] - концентрация ТХ и Ki(app) - ка
ветствует размеру символов на рисунке.
жущееся значение константы ингибирования в
присутствии заданной концентрации ДМ. При
наибольших концентрациях ДМ (рис. 1, б, кри
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
вые 4 и 5) в области субмилимолярных концент
раций ингибитора можно заметить небольшую
ТХ ингибирует цитохромоксидазную актив
лаг фазу. Мы предполагаем, что она может быть
ность, конкурируя с ДМ за связывание с ЦО. Ин
вызвана включением части молекул ТХ в обра
гибирование активности в присутствии ТХ. На
зованные ДМ пустые мицеллы.
ши исследования показали, что тритон Х 100
На рисунке 1, в значения Ki(app), полученные
подавляет оксидазную активность ЦО в детерген
в результате аппроксимации эксперименталь
тном растворе, что соответствует литературным
ных данных уравнением (1), представлены как
данным [7, 11, 13, 21]. Ингибирование наблюда
функция от концентрации ДМ. При концентра
ется при использовании в качестве субстрата
циях ДМ ниже 20 мМ зависимость имеет линей
окисления как естественного (цитохром с, см.
ный характер, что указывает на конкуренцию в
ниже), так и искусственного (ТМФД, данные не
соотношении 1/1 между ТХ и ДМ за связывание
приведены) донора электронов. В обоих случаях
с ферментом. Тангенс угла наклона прямой к
ингибирование может достигать 100% и предо
оси Х равен отношению сродства к ЦО ингиби
твращается, а также обращается при повыше
тора (ТХ) и его конкурента (ДМ), которое со
нии в среде концентрации ДМ.
ставляет 1/4. Экстраполяция к нулевому значе
На рис. 1 показано ингибирующее действие
нию [ДМ] позволяет оценить истинную величи
ТХ на оксидазную реакцию, катализируемую
ну Ki = 0,3 мМ. Отрезок, отсекаемый на оси абс
солюбилизированной формой ЦО из сердца бы
цисс в области отрицательных значений, дает
ка. Ингибирование существенно ослабляется
оценку константы диссоциации комплекса ДМ
при повышении в среде концентрации ДМ.
с ферментом, Кс = 1,2 мМ.
Скорость убыли кислорода в аэробном раство
В рамках предположения о конкуренции
ре, содержащем фермент и дыхательный
между ДМ и ТХ за взаимодействие с ЦО можно
субстрат (цитохром с, аскорбат и ТМФД) на фо
выразить Ki(app) следующим образом:
не 1 мМ ДМ, уменьшается примерно на треть
после внесения 1 мМ ТХ (рис. 1, а, кривая 1). И
(2)
наоборот, добавление 1 мМ ДМ к ферменту, ра
ботающему с пониженной скоростью в присут
ствии 1 мМ ТХ, приводит к ускорению оксидаз
где Ki - истинная константа ингибирования,
ной реакции примерно в 2,5 раза (рис. 1, а, кри
[С] - концентрация ДМ и Кс - константа диссо
вая 2). Как видно из приведенных данных, ин
циации комплекса ЦО с ДМ. Подставив выра
гибирующий эффект ТХ развивается за время
жение (2) в уравнение (1), получаем теоретичес
смешивания, тогда как после добавления ДМ
кую зависимость, связывающую скорость рабо
скорость выходит на стационарный уровень в
ты ЦО с концентрациями ТХ и ДМ, а также с ве
течение 10-20 с.
личинами их сродства к ферменту:
Более детально влияние ДМ на ингибирую
щее действие ТХ показано на рис. 1, б, на кото
(3)
ром приведены зависимости активности ЦО от
концентрации ТХ в присутствии разных концен
траций ДМ. Во всех случаях экспериментальные
данные хорошо описываются гиперболической
Реактивация додецилмальтозидом ЦО, пред
функцией, стремящейся к нулю (ингибирова
варительно ингибированной ТХ. На рис. 2, а
ние 100%) при бесконечно большой концентра
представлены результаты титрования ДМ актив
ции ингибитора. При этом видно, что повыше
ности ЦО, предварительно сниженной добав
ние в среде [ДМ] приводит к сдвигу действую
ленным ТХ. Видно, что по мере возраста
щих концентраций ТХ в сторону больших вели
ния [ДМ] активность фермента восстанавлива
чин. Мы аппроксимировали полученные дан
ется до некоторого конечного уровня, который
ные уравнением:
тем выше, чем меньше в среде ТХ. В диапазоне
концентраций 0-7 мМ ДМ через эксперимен
тальные точки проведены теоретические кри
(1)
вые, соответствующие функции (3) (см. выше),
в которой значения [I] и [С] заданы условиями
БИОХИМИЯ том 86 вып. 1 2021
60
ОЛЕЙНИКОВ и др.
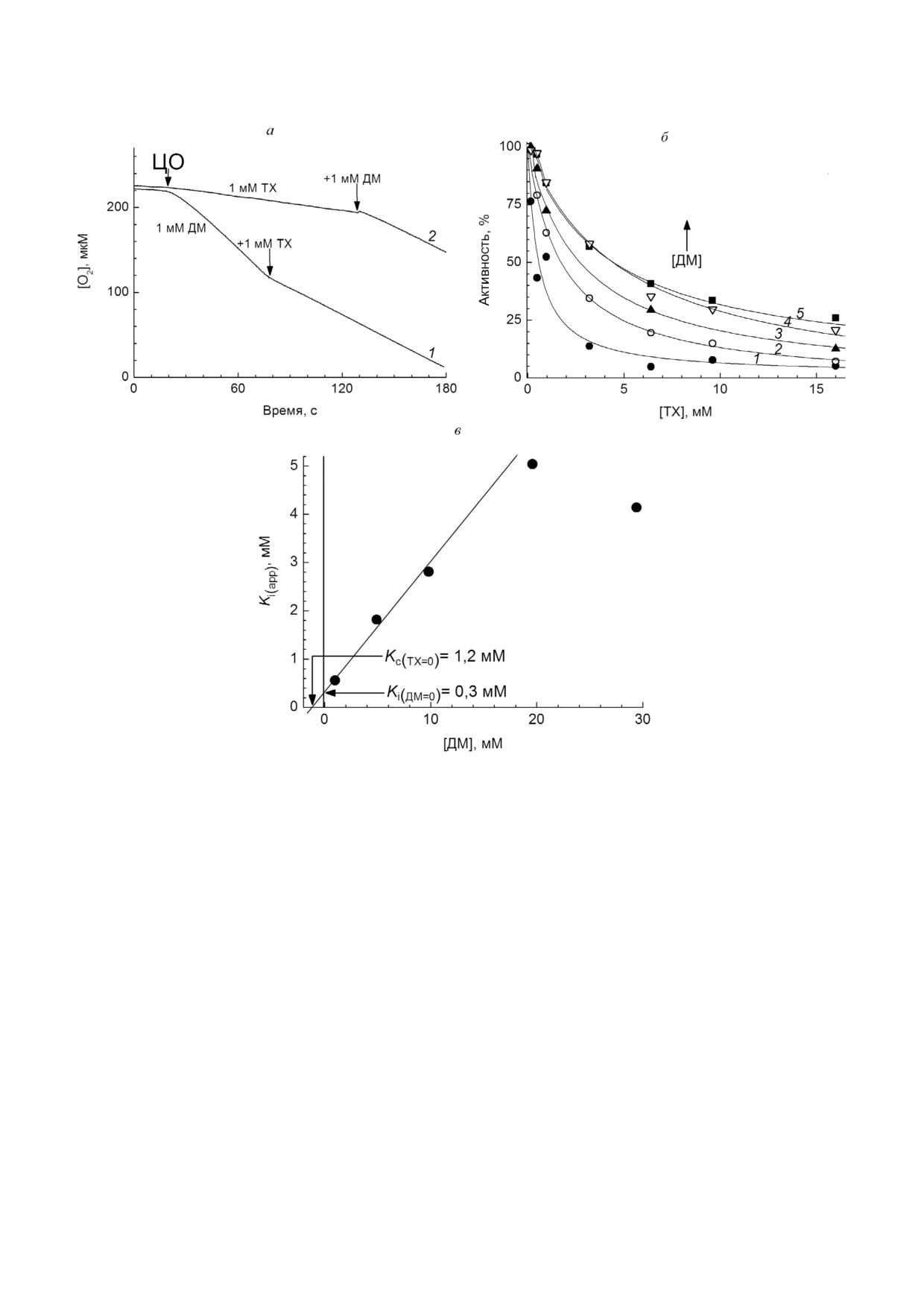
Рис. 1. ТХ ингибирует оксидазную активность ЦО. а - Потребление кислорода в ходе оксидазной реакции. Концентра
цию кислорода регистрировали электродом Кларка. В базовую среду добавляли дыхательный субстрат (аскор
бат + ТМФД + цитохром с) и через 1 мин запускали реакцию внесением ЦО (показано стрелкой). Исходно среда содер
жала 1 мМ ДМ (кривая 1) либо 1 мМ ТХ (кривая 2). Последующие добавления ТХ и ДМ обозначены стрелками. б - Кон
центрационная зависимость ингибирующего действия ТХ на фоне различных концентраций ДМ. Скорость цитохромок
сидазной реакции определяли по убыли кислорода. За 100% принята активность фермента в присутствии 1 мМ ДМ и
без ТХ. Среда опыта исходно содержала ДМ в следующих концентрациях: 1 - 1 мМ (черные кружки); 2 - 5 мМ (белые
кружки); 3 - 10 мМ (черные треугольники); 4 - 20 мМ (белые треугольники); 5 - 30 мМ (квадраты). Скорость работы фер
мента в присутствии ТХ определяли через 1 мин после добавления ингибитора. Остальные условия, как на панели а. Че
рез экспериментальные точки проведены теоретические кривые, соответствующие уравнению (1) (см. в тексте). Началь
ные участки кривых 4 и 5 аппроксимированы эмпирически подобранной функцией, описывающей наблюдаемую лаг фа
зу (см. в тексте). в - Зависимость полученных значений Ki(app) от концентрации ДМ. Стрелками показаны отрезки, отсе
каемые аппроксимирующей прямой на осях Y и Х, которые представляют, соответственно, значение истинной (в отсут
ствие ДМ) Ki для ТХ и сродство ДМ к ферменту, Кс
опыта, а значения констант Ki и Кс являются
должно достигать 100% (при бесконечной кон
подгоночными параметрами, изменяющимися в
центрации ДМ), тогда как в условиях экспери
пределах 0,08-0,23 мМ и 0,2-1,5 мМ соответ
мента активность выходит на конечный уро
ственно (см. подпись к рис. 2, а). Видно, что
вень, который всегда ниже, чем скорость работы
функция (3) хорошо описывает эксперимен
фермента без ТХ. Так, при минимальном добав
тальные данные, однако лишь при концентра
лении ТХ (0,96 мМ) ингибированной остает
циях ДМ ниже 10 мМ. Далее, согласно теорети
ся ~25% активности (рис. 2, а, кривая 1), при
ческим кривым, восстановление активности
максимальном (16 мМ) - ~90%.
БИОХИМИЯ том 86 вып. 1 2021
ИНГИБИРОВАНИЕ ЦИТОХРОМОКСИДАЗЫ ТРИТОНОМ Х 100
61
На рисунке 2, б показана зависимость актив
контролем, что объясняется замедлением рабо
ности ЦО от концентрации ДМ в среде опыта.
ты фермента. Оба эффекта выражены тем силь
Видно, что при 5 мМ ДМ скорость работы фер
нее, чем выше концентрация ТХ.
мента практически не отличается от контроль
На рис. 3, б представлены результаты анало
ных условий (1 мМ ДМ). При более высокой
гичного эксперимента, в котором регистрирова
концентрации детергента активность достовер
лась разность оптического поглощения при
но снижается: при 10 мМ ДМ - примерно
на 20%, а при 20 мМ ДМ и выше - на 30% от
контрольного уровня. Подавление активнос
ти ЦО высокими концентрациями ДМ могло бы
объяснить отклонение экспериментальных дан
ных в опыте по реактивации фермента от теоре
тической зависимости (3) (рис. 2, а), а также,
возможно, отклонение концентрационной за
висимости Ki(app) от линейной функции при
[ДМ] > 20 мМ (рис. 1, в).
Механизм ингибирующего действия ТХ на
ЦО. Для получения информации о механизме
взаимодействия ТХ с ферментом мы определи
ли место ингибирования в цепочке переноса
электронов, исследовали некоторые изменения,
вызываемые ТХ в биядерном центре и сравнили
влияние, оказываемое ТХ на катализируе
мые ЦО парциальные реакции.
ТХ ингибирует перенос электронов с гема а на
гем а3. Последовательность переноса электро
нов между редокс центрами ЦО показана на
схеме 1. Поскольку ингибирование ТХ обнару
живается при использовании в качестве донора
не только цитохрома с, но и ТМФД, оно, оче
видно, направлено не на взаимодействие ЦО с
внешним донором, а на одну из дальнейших,
внутримолекулярных стадий переноса электро
нов.
Для того, чтобы выяснить, влияет ли ТХ на
стационарное распределение электронов между
гемом а и биядерным центром в работающем
ферменте, ЦО инкубировали в аэробных усло
виях в присутствии восстановителя (аскор
бат + ТМФД), следя за изменениями уровня
восстановления гемов по мере протекания реак
Рис. 2. ДМ восстанавливает активность ЦО, ингибирован
ции. Результаты приведены на рис. 3.
ной ТХ. а - Реактивация ЦО, предварительно ингибиро
На рис. 3, а представлен опыт, в котором ре
ванной ТХ, после добавления ДМ. Условия эксперимента
гистрировали изменения поглощения в види
как на рис. 1, б, но среда опыта исходно содержала не ДМ,
а ТХ в следующих концентрациях: 1 - 0,96 мМ (черные
мой области (605-630 нм). Это позволяло сле
кружки); 2 - 3,2 мМ (белые кружки); 3 - 6,4 мМ (черные
дить за восстановлением гема а, вклад которого
треугольники);
4
- 11,2
мМ (белые треугольники);
в суммарное поглощение при данных длинах
5 - 16 мМ (квадраты). Скорость работы фермента опреде
волн составляет 80% [29]. Сравнивая контроль
ляли через 1 мин после добавления ДМ (2 мин после нача
ла дыхания). За 100% принята активность ЦО в сре
ную кривую 1 с кривыми 2-4, можно видеть, что
де без ТХ в присутствии 1 мМ ДМ. Данные, представлен
внесение в среду опыта ТХ приводит к увеличе
ные на кривых 1-5, аппроксимированы функцией (3) (см.
нию уровня восстановления гема а в стационар
в тексте), в которой параметры Ki и Kc равны, соответ
ных условиях оксидазной реации. При макси
ственно: 0,15 мМ и 0,2 мМ (кривая 1); 0,13 мМ и 0,32 мМ
мальной концентрации ТХ (16 мМ) уровень вос
(кривая 2); 0,08 мМ и 0,33 мМ (кривая 3); 0,12 мМ и 1,0 мМ
(кривая 4); 0,23 мМ и 1,5 мМ (кривая 5). б - Зависимость
становления повышается в 3 раза по сравнению
активности ЦО от концентрации ДМ. Скорость работы
с контролем. Кроме того, в присутствии ТХ вре
фермента определяли через 1 мин после начала дыхания в
мя протекания реакции до наступления анаэро
среде с различными концентрациями ДМ. За 100% приня
биоза также увеличивается по сравнению с
та активность ЦО в присутствии 1 мМ ДМ.
БИОХИМИЯ том 86 вып. 1 2021
62
ОЛЕЙНИКОВ и др.
444 нм против 500 нм (γ полосы восстановлен
ных гемов а и а3, имеющих в этой области при
близительно равную молярную экстинкцию
[29]). Целью данного опыта было исследование
кинетики восстановления гемов при наступле
нии анаэробиоза (стационарная фаза работы
фермента не приводится, для удобства сравне
ния кривые совмещены по вертикали). Как вид
но из рисунка, добавление ТХ существенно за
медляет вторую (медленную) фазу суммарного
восстановления, которая связана преимущест
венно с гемом а3 [21, 30].
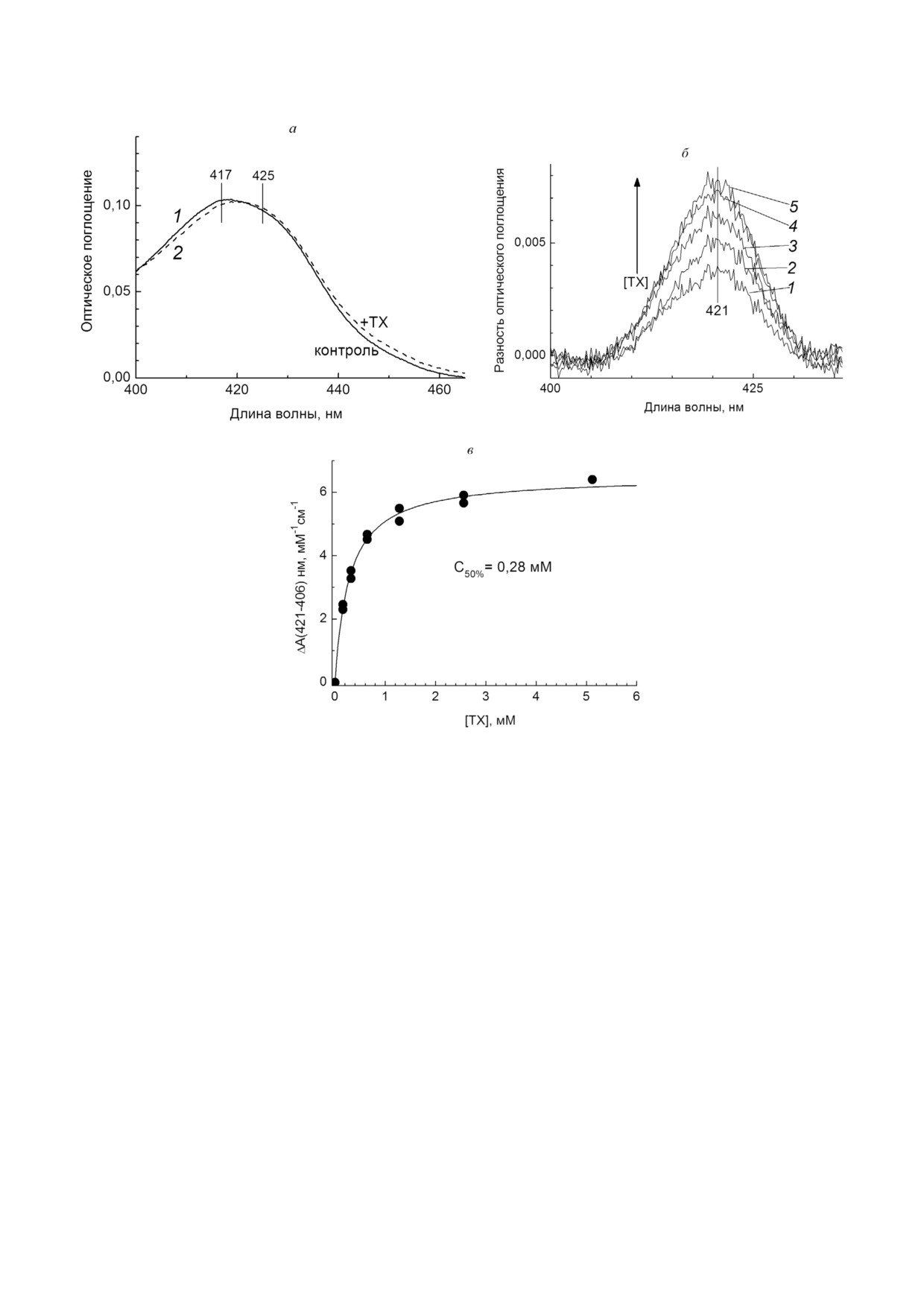
Влияние ТХ на биядерный центр окисленной
ЦО. Спектральный сдвиг. Обнаружилось, что ТХ
влияет не только на активность фермента, но и
на его спектр поглощения (рис. 4). При добавле
нии ТХ к окисленной форме ЦО возрастает по
глощение в районе 420-424 нм (рис. 4, а).
На разностном спектре относительно окислен
ного образца появляется максимум с центром
при 421 нм (рис. 4, б), что указывает на участие в
спектральных изменениях гема а3. Спектраль
ный ответ развивается быстро (за 3 мин после
добавления 0,16 мМ ТХ) и стабилен в течение
нескольких часов. Амплитуда ответа растет с
увеличением концентрации ТХ.
На рисунке 4, в показана зависимость амп
литуды ответа при 421 нм от концентрации ТХ.
Зависимость имеет вид кривой с насыщением
при [ТХ] ≈ 3 мМ, коэффициент экстинкции
достигает значения 6 мМ-1⋅см-1. Данные хоро
шо аппроксимируются гиперболической функ
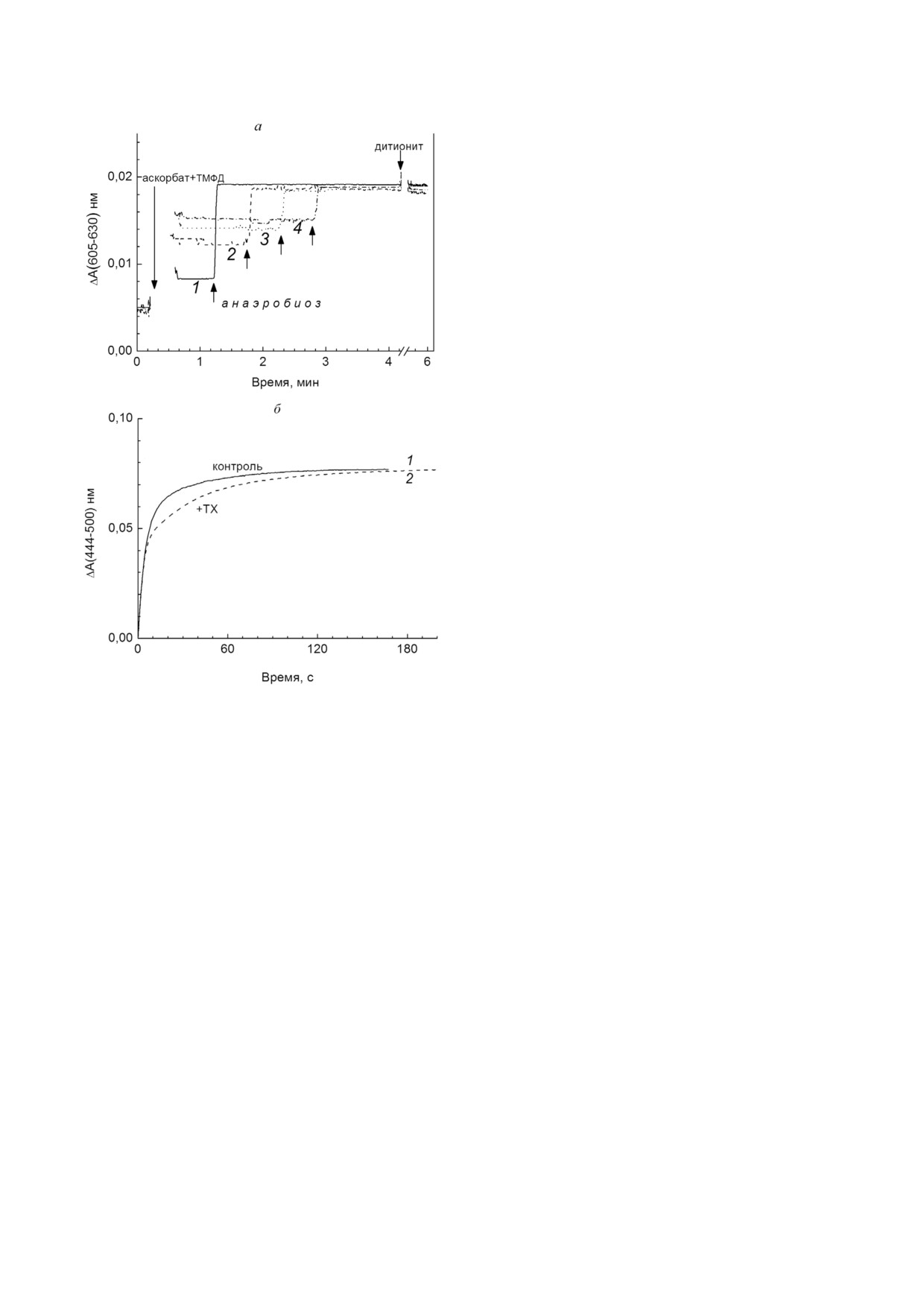
Рис. 3. ТХ замедляет перенос электрона на гем а3. а -
Влияние ТХ на стационарный уровень восстановления ге
цией. Величина С50% (концентрация ТХ, вызы
ма а в работающем ферменте. Уровень восстановления ре
вающая полумаксимальный ответ) = 0,28 мМ
гистрировали по разности оптического поглощения при
(сравн. с величиной Ki(app) = 0,56 мМ, получен
(605-630 нм). Опыт проводили в наполненной до верха
ной в сходных условиях, см. рис. 1, б и в).
закрытой кювете. Оксидазную реакцию запускали добавле
Связывание цианида. Известно, что препа
нием субстрата дыхания (5 мМ аскорбат + 0,1 мМ ТМФД,
показано стрелкой) после 30 с записи базовой линии в при
рат ЦО может находиться в «быстрой» и «мед
сутствии аэробной ЦО (0,5 мкМ) в среде опыта (базовая
ленной» формах [31], которые различаются ско
среда + 50 мМ KCl, рН 8,1, 1 мМ ДМ). При этом сигнал вы
ростью взаимодействия с лигандами. Соотноше
ходил на уровень, соответствующий восстановлению в ста
ние двух форм сильно варьирует в зависимости
ционарных условиях реакции. После исчерпания в среде
кислорода (показано стрелками) происходило полное вос
от методики выделения. Переход фермента в
становление ЦО, и сигнал резко возрастал. Отсутствие оп
«медленную» форму может провоцироваться
тических изменений после добавления дитионита (показа
многими факторами, в том числе - воздействи
но стрелкой) демонстрирует, что в анаэробиозе достигнуто
ем детергента. В некоторых работах [14, 15] вы
100% восстановление гема а. Кривая 1 (сплошная линия) -
сказывается предположение, что причиной ин
контроль, кривые 2-4 - среда опыта исходно содержа
ла 3,2 мМ (пунктирная линия), 6,4 мМ (линия обозначена
гибирования ЦО в присутствии ТХ может быть
точками) и 16 мМ (линия обозначена пунктиром с точка
переход фермента в неактивную форму. Спект
ми) ТХ соответственно. б - Регистрация суммарного уров
рально «быстрая» и «медленная» формы отлича
при наступлении анаэроби
ня восстановления гемов а и а3
ются друг от друга положением максимума в по
оза. Опыт ставили как на панели а, но регистрировали раз
лосе Соре окисленного фермента (424 нм vs
ность оптического поглощения в полосе Соре,
при 444-500 нм, что позволяло отслеживать уровень сум
417
нм соответственно) [31]. Как видно из
марного восстановления гемов а и а3. Представлена завер
рис. 4, а, в присутствии ТХ поглощение в облас
шающая часть кривых, соответствующая восстановлению
ти Соре немного сдвигается не в коротко , а в
фермента после наступления анаэробиоза. Концентра
длинноволновую сторону, однако суммарный
ция ЦО - 1,2 мкМ, остальные условия как на панели а.
Кривая 1 (сплошная линия) - контроль, кривая 2 (пунк
пик в обоих случаях гетерогенен, и количествен
тир) - среда опыта исходно содержала 6,4 мМ ТХ
но определить соотношение двух форм в образце
БИОХИМИЯ том 86 вып. 1 2021
ИНГИБИРОВАНИЕ ЦИТОХРОМОКСИДАЗЫ ТРИТОНОМ Х 100
63
Рис. 4. ТХ влияет на спектр поглощения гема а33+. а - Абсолютные спектры поглощения аэробно окисленной ЦО без доба
вок (1, сплошная линия) и в присутствии 16,8 мМ ТХ (2, пунктирная линия). Базовая среда, рН 7,5, 1мМ ДМ. Концентра
ция ЦО - 0,5 мкМ. Спектры записаны после 2 мин инкубации фермента в среде опыта. б - Разностные спектры поглоще
ния относительно аэробно окисленной ЦО (1,22 мкМ) зарегистрированы через 6 мин после добавления ТХ. Концентрация
ТХ: 1 - 0,16 мМ; 2 - 0,32 мМ; 3 - 0,64 мМ; 4 - 1,28 мМ; 5 - 2,56 мМ. Базовая среда, рН 7,0, 1 мМ ДМ. в - Представлена за
висимость амплитуд (421-406 нм) разностных спектров, показанных на панели б, от концентрации добавленного ТХ
не представляется возможным. Мы решили вы
скорости в контроле и в присутствии ТХ прак
яснить, не вызывает ли ТХ образование «мед
тически совпадают. Наблюдаемые величины хо
ленной» формы ЦО, изучив его влияние на реак
рошо согласуются с литературными данны
цию фермента с типичным лигандом окислен
ми [31] и указывают на преобладание в обоих
ного биядерного центра, цианидом. Замедление
случаях «быстрой» формы.
этой реакции считается классическим призна
Влияние ТХ на парциальные реакции ЦО. Пол
ком перехода фермента в «медленную форму».
ный каталитический цикл ЦО включает стадии,
На рисунке 5 представлены результаты опы
связанные с превращениями перекиси водоро
та, в котором спектрально (при длинах волн
да. Это соединение образуется в биядерном
434-412 нм) регистрировалась кинетика образо
центре в процессе восстановления ферментом
вания комплекса ЦО с цианидом. На рисунке
кислорода и представляет собой природный ли
приведена зависимость константы скорости об
ганд окисленного гема а3.
разования комплекса от концентрации цианида.
Влияние ТХ на стационарные концентрации
Зависимость имеет двухфазный характер и ли
оксоферрильных интермедиатов в псевдокаталаз(
нейна в обеих фазах. При этом в интервале кон
ном цикле. В отличие от реакции с цианидом,
центраций KCN 0,2-20 мМ значения констант
взаимодействие перекиси водорода с биядер
БИОХИМИЯ том 86 вып. 1 2021
64
ОЛЕЙНИКОВ и др.
новение формы FI 607 (рис. 6, б), которая пере
ходит в форму FII 580, как это следует из сохра
нения суммарного ответа в области Соре (па
нель а). Можно видеть, что ТХ не оказывает за
метного влияния на переход свободной формы
окисленной ЦО в смесь оксоферрильных со
Схема 2. Псевдокаталазный цикл ЦО. Показано состояние
стояний при добавлении низких микромоляр
биядерного центра: Ох - свободный окисленный (а3+/
ных концентраций перекиси (панель а), но
Cu2+/Tyr244), FI
607
- оксоферрильное состояние I
сильно ускоряет исчезновение формы FI 607 нм
580 - оксоферрильное состо
(а34+ = O2-/Cu2+/Tyr244•), FII
при дальнейшем увеличении концентрации
яние II (а34+ = O2-/Cu2+/Tyr244). См. текст.
H2O2 (панель б): так, при 20 мкМ H2O2 концент
рация FI 607 в опыте и контроле почти одина
ным центром ЦО не ограничивается присоеди
кова, а при 100 мкМ H2O2 она в 3 раза ниже в
нением к окисленному гему а3, и образующийся
присутствии ТХ, чем в контроле.
аддукт подвергается дальнейшим превращени
Такое уменьшение стационарной концент
ям [32, 33]. Эти превращения соответствуют
рации интермедиата FI 607 под действием ТХ в
частным стадиям каталитического цикла фер
псевдокаталазном цикле можно было бы объяс
мента в так называемой пероксидазной фазе ре
нить двояко. Во первых, ТХ мог бы воздейство
акции [34, 35]. Последовательность превраще
вать непосредственно на оксоферрильный
ний описывается схемой 2, которая получила
комплекс FI 607, дестабилизируя его. Во вто
название «псевдокаталазного цикла».
рых, к снижению стационарного уровня FI 607
Как можно видеть из схемы 2, в условиях
должно также приводить уменьшение скорости
большого избытка H2O2 над ферментом возни
его образования в цикле (реакция I на схеме 2)
кает многостадийная циклическая реакция, в
либо увеличение скорости его распада (реак
которой расходуется H2O2 и устанавливаются
ция II на схеме 2). Для проверки первой возмож
стационарные концентрации интермедиатов FI
ности мы исследовали влияние ТХ на стабиль
607 и FII 580. Аналогичные кислородные интер
ность формы FI 607, полученной не в результате
медиаты ЦО регистрируются в пероксидазной
фазе реакции восстановления кислорода мето
дами быстрой кинетики. Они представляют со
бой оксоферрильные формы, в которых атом
железа гема а3 находится в высшей степени
окисления (+4). В интермедиате FI 607 на близ
лежащем остатке Tyr244 имеется электронная
вакансия, которая заполняется при поступле
нии в биядерный центр 3 го электрона, что со
ответствует превращению FI 607→FII 580 [1, 3,
4, 35]. Феррильные формы фермента FI 607 и
FII 580 отличаются от свободной окисленной
формы ЦО спектрами поглощения, что позво
ляет следить за их образованием спектрофото
метрически. Друг от друга спектры FI 607 и FII
580 отличаются в видимой области (максимумы
поглощения, соответственно, при 607 и 580 нм
на разностном спектре относительно свободно
Рис. 5. ТХ не влияет на скорость образования цианидного
го окисленного фермента), а в области Соре
комплекса окисленной ЦО. Связывание цианида с фер
практически совпадают.
ментом регистрировали спектрофотометрически. Концен
На рис. 6 показана зависимость стационар
трация ЦО - 1 мкМ. Среда опыта (базовая среда, рН 8,1,
1 мМ ДМ) содержала 100 мкМ феррицианид калия для
ной концентрации оксоферрильных интерме
предотвращения восстановления ЦО в цианидном комп
диатов ЦО от количества добавленной переки
лексе. Реакцию запускали добавлением KCN, после чего ее
си водорода и влияние на эту зависимость ТХ.
скорость регистрировали по возрастанию оптического
Измерения в области Соре (рис. 6, а) свидетель
поглощения при 434-412 нм. Приведены рассчитанные
ствуют о том, что при концентрации H2O2
константы скорости образования комплекса псевдоперво
го порядка (k). Через экспериментальные точки, получен
20-100 мкM практически весь фермент перехо
ные в контрольных условиях (без ТХ, черные кружки) и в
дит в смесь оксоферрильных форм FI 607 и FII
присутствии 6,4 мМ ТХ (белые кружки), проведены ап
580. При дальнейшем увеличении концентра
проксимирующие прямые 1 (сплошная линия) и 2 (пунк
ции перекиси происходит постепенное исчез
тирная линия) соответственно
БИОХИМИЯ том 86 вып. 1 2021
ИНГИБИРОВАНИЕ ЦИТОХРОМОКСИДАЗЫ ТРИТОНОМ Х 100
65
Рис. 6. ТХ уменьшает стационарную концентрацию интермедиата FI 607 в псевдокаталазном цикле ЦО. а - Полоса Соре,
б - видимая область. Концентрационная зависимость амплитуды спектральных ответов, возникающих при титровании
ЦО (1,3 мкМ) возрастающими концентрациями H2O2. Среда опыта: базовая среда + 50 мМ KCl, рН 8,1, 1 мМ ДМ. Титро
вание проводили в среде без ТХ (контроль - кривая 1, белые кружки) либо в присутствии 6,4 мМ ТХ (кривая 2, черные
кружки). Изменение амплитуд возникающих разностных спектров относительно окисленной ЦО регистрировали по раз
ности поглощения при 435-412 нм, панель а, либо при 607-630 нм, панель б. Добавление Н2О2 производили с интерва
лом в 6 мин, спектры записывали через 3 мин после очередного добавления. в - ТХ не влияет на стабильность интерме
диата FI 607, полученного путем пропускания СО через аэробный раствор ЦО. Показан разностный спектр образца (от
носительно окисленной ЦО), возникающий после 2 мин обработки СО. Среда опыта: базовая среда + 50 мМ KCl, рН 8,1;
1 мМ ДМ; 0,1 мМ феррицианид; каталаза. Эксперимент проводили в закрытой кювете. Спектр 1 (пунктирная линия) -
контроль, спектры 2 (сплошная линия) и 3 (чередование пунктира с точками) - среда опыта содержала 16 мМ ТХ. Спект
ры 1 и 2 записаны через 5 мин, а спектр 3 - через 25 мин после обработки СО
взаимодействия ЦО с перекисью водорода, а
16 мМ ТХ стабильна, по крайней мере, 25 мин
альтернативным методом, по Николсу (см. «Ме
(сравн. спектры образца, записанные через 5 и
тоды исследования»). Форма ЦО, химически
через 25 мин после обработки СО, с контро
идентичная FI 607, образуется при аэробном
лем - соответственно, 2, 3 и 1). Это время соот
взаимодействии окисленного фермента с
ветствует стандартной продолжительности про
окисью углерода [28]. Как видно из приведен
ведения полных титрований ЦО перекисью во
ных на рис. 6, в разностных спектров (ЦО после
дорода, данные которых показаны на рис.
обработки СО против окисленного образца), в
6, а и б. Таким образом, более вероятно, что
этом случае ТХ практически не влияет ни на эф
действие ТХ на стационарную концентрацию
фективность образования формы FI 607, ни на
интермедиата FI 607 в ходе титрования ЦО пе
ее стабильность. Форма FI 607 в присутствии
рекисью водорода объясняется изменением
5 БИОХИМИЯ том 86 вып. 1 2021
66
ОЛЕЙНИКОВ и др.
что позволяет регистрировать пероксидазную
активность ЦО в аэробных условиях [34].
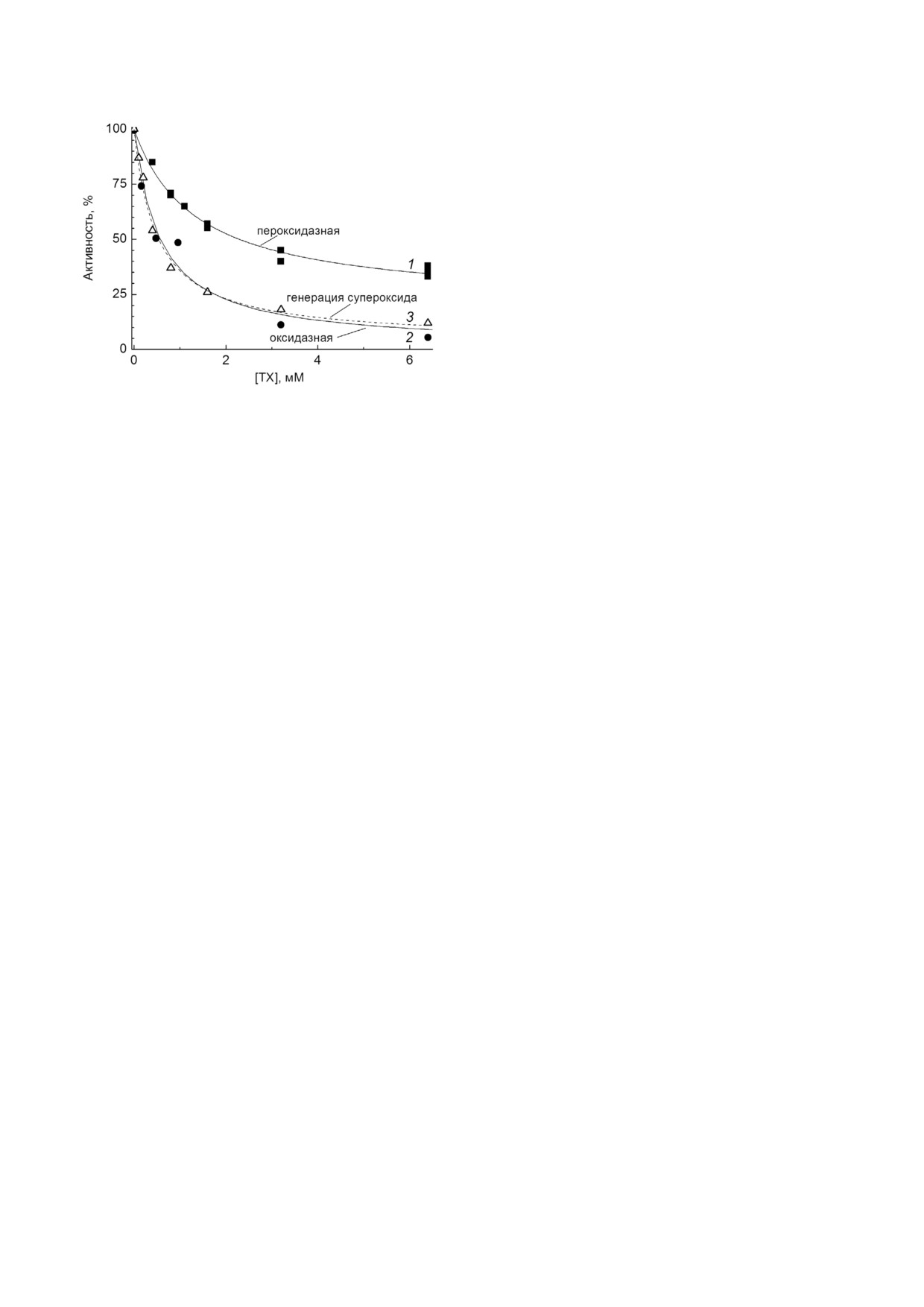
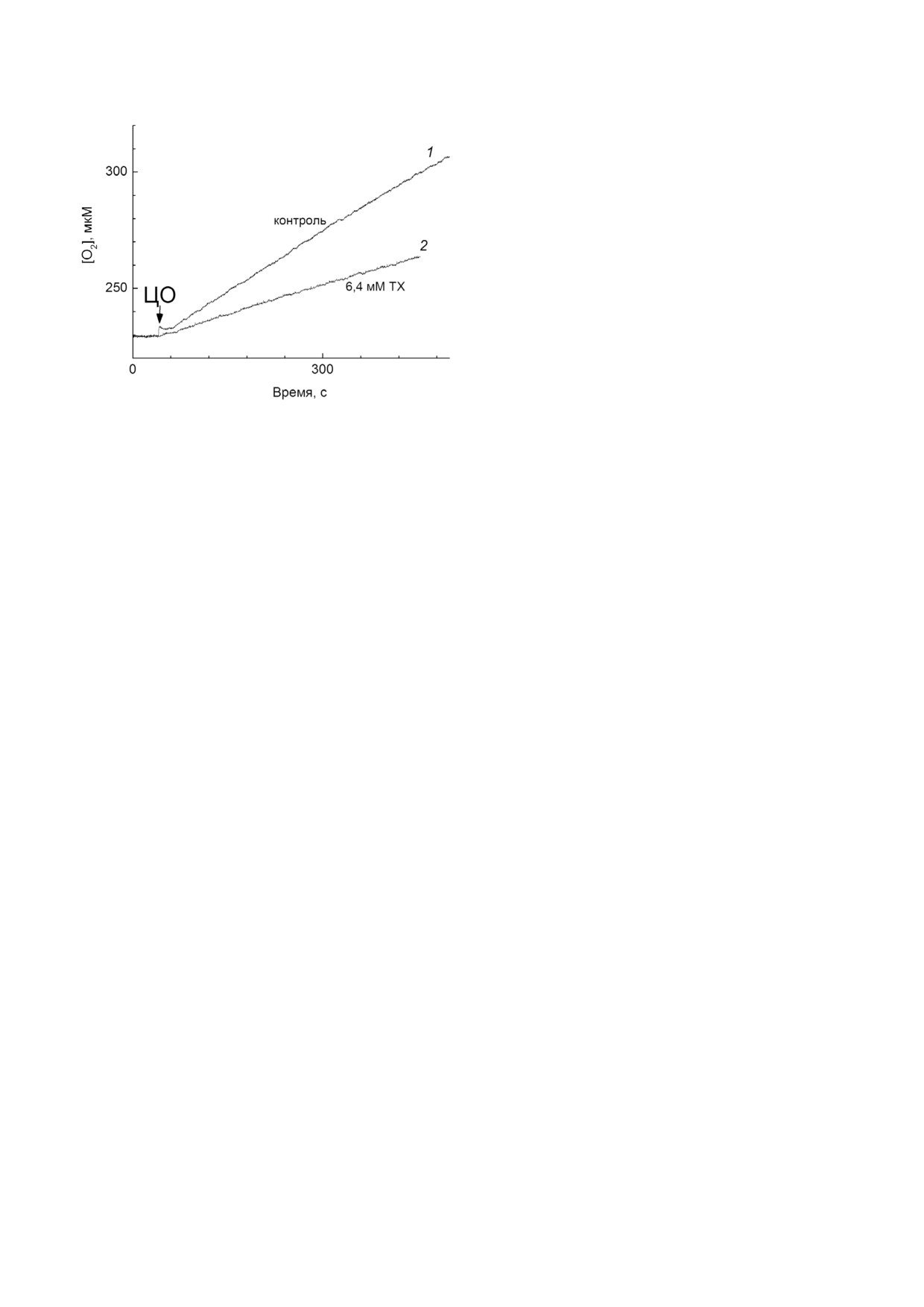
Влияние ТХ на пероксидазную активность
ЦО показано на рис. 7, кривая 1. Было обнару
жено, что в условиях двукратного ингибирова
ния оксидазной реакции ТХ почти не оказывает
действия на пероксидазную активность ЦО
(сравн. кривые 2 и 1 на рис. 7). В милимолярном
диапазоне концентраций ТХ пероксидазная ре
акция проявляет частичную чувствительность к
ингибированию: 80% активности титруется с
Ki(app) = 1,5 мМ, что втрое превышает значе
ние Ki(app) для оксидазной реакции в тех же усло
виях (1 мМ ДМ), а 20% активности остается ус
тойчиво к действию ингибитора.
Рис. 7. Сравнение действия ТХ на оксидазную и парциаль
Ингибирование образования O•-. Схема псев
ные активности ЦО. Все измерения проводили при рН 7,5
докаталазного цикла ЦО предсказывает образо
в присутствии 1 мМ ДМ. Ферментативные активности вы
вание супероксидных радикалов при взаимо
ражены в % от соответствующего контрольного значения,
полученного в отсутствие ТХ. Кривая 1: пероксидазную
действии ЦО с H2O2 на стадии одноэлектронно
активность (черные квадраты) определяли спектрофото
го восстановления FI 607, а также, возможно, и
метрически по перекисному окислению о(дианизидина.
при восстановлении интермедиата FII 580
Условия: ЦО - 0,5 мкМ, о(дианизидин - 0,2 мМ, H2O2 -
(см. схему 2, стадии II и III). Появление супер
4 мМ. Кривая 2: оксидазную активность (черные кружки)
измеряли, как на рис. 1, б. Кривая 3: генерацию суперокси
оксидных радикалов в ходе реакции окисленной
да (пунктирная линия, белые треугольники) измеряли
ЦО с избытком H2O2 было показано нами экс
спектрофотометрически, по восстановлению красителя
периментально [33, 36] и подтверждено недавно
WST 1. Условия: ЦО - 1 мкМ, WST 1 - 0,1 мМ, H2O2
- в работе Jancura et al. [37]. Эта реакция может
2 мМ
рассматриваться как еще одна парциальная
окислительно восстановительная активность
скорости реакции на некоторых стадиях псевдо
фермента.
каталазного цикла, представленного на схеме 2.
Данные по влиянию ТХ на образование су
Действие ТХ на пероксидазную активность.
пероксидных радикалов при взаимодействии
Для того, чтобы определить, какие из стадий,
ЦО с избытком H2O2 представлены на рис. 7,
входящих в полный каталитический цикл ЦО,
кривая 3. За образованием радикалов O•- следи
являются мишенью действия ТХ, мы протести
ли по восстановлению окрашенных солей тетра
ровали чувствительность к ингибированию пар
золия, которое полностью подавлялось супер
циальных активностей фермента.
оксиддисмутазой, цианидом, а также тепловой
ЦО катализирует двухэлектронное восста
инактивацией ЦО (данные не приведены). Было
новление до воды связанной с окисленным би
найдено, что образование радикалов O•- столь
ядерным центром молекулы перекиси, что
же чувствительно к ТХ, как и оксидазная реак
представляет собой «пероксидазную» часть пол
ция. Как показано на рис. 7, концентрационные
ного каталитического цикла фермента [34]. Од
зависимости двух активностей (кривые 3 и 2 со
нако регистрировать такую активность непрос
ответственно) практически совпадают и харак
то, поскольку в аэробных условиях перекись, как
теризуются значением Ki(app) ≈ 0,5 мМ.
конечный акцептор, проигрывает кислороду, и
Влияние ТХ на каталазную активность. Еще
пероксидазная реакция составляет лишь малую
одной частной реакцией ЦО является каталаз
долю общего числа оборотов фермента. Для из
ная активность: способность окисленного фер
мерения пероксидазной активности ЦО исполь
мента разлагать перекись водорода с выделени
зовались высокопотенциальные доноры: ре
ем кислорода [6, 38]. Несмотря на активное изу
докс буфер ферро/феррицианид (с редокс по
чение этого вопроса [27, 37, 39], механизм реак
тенциалом около +400 мВ) вместе с каталити
ции окончательно не установлен. Известно, од
ческим количеством цитохрома с, служащего не
нако, что процесс происходит при участии
посредственным донором электронов для ЦО,
окисленного биядерного центра. Как обсужда
либо классический субстрат пероксидаз - о диа
ется в работах Konstantinov et al. [33, 39], ката
низидин [25, 34]. При редокс потенциале буфера
лазная активность, как и генерация O•-, может
выше +400 мВ оксидазная активность ЦО прак
быть связана с функционированием фермента в
тически отсутствует, и реакция включается до
режиме псевдокаталазного цикла и осущест
бавлением в качестве конечного акцептора Н2О2,
вляться на стадиях II и III (схема 2).
БИОХИМИЯ том 86 вып. 1 2021
ИНГИБИРОВАНИЕ ЦИТОХРОМОКСИДАЗЫ ТРИТОНОМ Х 100
67
• Действие ТХ не связано с переходом ЦО в
«медленную» форму. Об этом свидетельствует
тот факт, что ТХ не влияет на скорость взаимо
действия окисленной ЦО с KCN в широком ди
апазоне концентраций лиганда (рис. 5). Замед
ление этой реакции является основным призна
ком перехода фермента в «медленную» форму.
Можно заключить, что ТХ не только не вызыва
ет подобный переход, но вообще не влияет на
соотношение двух форм в препарате.
• ТХ используется как агент, вызывающий
переход ЦО из димерной формы в мономерную,
и можно было бы думать, что наблюдаемые в на
шей работе эффекты имеют к этому отношение.
Однако методики, применяемые для мономери
зации, предполагают условия весьма далекие от
Рис. 8. Влияние ТХ на каталазную активность ЦО. Ката
использованных в нашей работе. В частности,
лазную активность ЦО регистрировали по выделению кис
концентрация ТХ составляет в них от 80 мМ [17]
лорода. Среда опыта
(«каталазная среда», рН
7,2, до
800
мМ [18]. Как отмечается в работах
1 мМ ДМ) содержала 12 мМ Н2О2. Реакцию запускали до
Robinson и Capaldi [16] и Sadoski et al. [40], при
бавлением 1 мкМ ЦО (показано стрелкой). Кривая 1 -
контроль, кривая
2
- среда опыта содержала так
концентрациях тритона в диапазоне 0,1-1% (со
же 6,4 мМ ТХ
ответствует 1,6-16 мМ) фермент полностью ос
тается в димерной форме. Это соответствует ус
ловиям всех наших экспериментов.
Каталазную активность окисленной ЦО оп
Мы предполагаем, что исследуемые нами
ределяли в присутствии Н2О2 по скорости повы
эффекты тритона на ЦО имеют прямое отноше
шения в среде концентрации О2 (рис. 8). В конт
ние к механизмам регуляции фермента. В серии
рольном опыте скорость реакции составля
работ лаборатории Ferguson Miller [20, 41-44] в
ет ~10 мкМ О2 за 1 мин (рис. 8, кривая 1), а в
трехмерной структуре ЦО из Rhodobacter
присутствии ТХ она уменьшается до 6 мкМ О2 за
sphaeroides описана гидрофобная площадка,
1 мин (рис. 8, кривая 2). Аналогичные результа
способная связывать относительно крупные ам
ты получены при добавлении ТХ по ходу реак
фипатические молекулы. Сравнительный ана
ции (данные не приведены). Таким образом,
лиз структуры ЦО из сердца быка обнаруживает
6,4 мМ ТХ ингибирует каталазную активность
аналогичный участок и у фермента из митохон
ЦО на 40%, т.е. примерно вдвое менее эффек
дрий [42, 45]. Сайт получил название центра
тивно, чем оксидазную (сравн. с ингибировани
связывания желчных кислот, поскольку на не
ем оксидазной активности в тех же условиях на
которых структурах в нем видна связанная мо
91% - см. рис. 1, б, кривая 1 и рис. 7, кривая 2).
лекула детергента, использовавшегося при
кристаллизации: дезоксихолат в ЦО из
R. sphaeroides и холат в ЦО из сердца быка. Со
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
гласно результатам компьютерного анализа
структуры, ЦСЖК обладает сродством к целому
Целью нашего исследования была попытка
ряду физиологически активных соединений ам
понять механизм действия тритона на актив
фипатической природы (производным желчных
ность солюбилизированной ЦО из митохонд
пигментов, ретиноевой кислоте, стероидам, ти
рий сердца быка. На основании полученных ре
реоидному гормону, нуклеотидам и др.) [43].
зультатов мы прежде всего смогли отвергнуть
Для некоторых из них было показано модулиру
несколько перечисленных ниже возможностей.
ющее (ингибирующее или активирующее) влия
• Ингибирование оксидазной активности
ние на активность ЦО. ЦСЖК находится на гра
ТХ не направлено на взаимодействие ЦО и ци
нице субъединиц I и II у внутренней стороны
тохрома с - это следует из того, что эффект наб
мембраны, вблизи входа в протонный канал К.
людается при использовании альтернативного
В непосредственной близости от него на струк
дыхательного субстрата, ТМФД (рис. 3). Отме
туре ЦО из R. sphaeroides просматривается свя
тим также, что, по данным работ Rosevear et al.
занная молекула децилмальтозида: ее алкиль
[9], Sinjorgo et al. [13] и Mahapatro и Robinson
ный «хвост» расположен в гидрофобной впади
[14], ТХ не изменяет скорости связывания ци
не на границе субъединиц I и II, а мальтозидная
тохрома с с солюбилизированным ферментом.
группа, как отмечают авторы, способна дости
БИОХИМИЯ том 86 вып. 1 2021
5*
68
ОЛЕЙНИКОВ и др.
гать места связывания типичных амфипатичес
ство ингибиторов - ТХ и эстрадиола. Несмотря
ких лигандов ЦСЖК, конкурируя с ними за взаи
на очевидную разницу в химическом строении
модействие с ферментом [20, 42]. На структуре
молекул, это сходство может проявляться при
фермента из митохондрий примерно в этом же
пространственном взаимодействии лиганда с
месте обнаружена молекула связанного фосфо
сайтом связывания. Гидрофобный фрагмент мо
липида [20].
лекулы тритона представляет собой группу 4
Нам удалось количественно охарактеризо
трет октилфенола - соединения, известного
вать влияние тритона и додецилмальтозида на
своей способностью связываться с рецепторами
активность солюбилизированной ЦО. Как вы
эстрогенов и имитировать их действие [47, 48].
яснилось (рис. 1, 2), додецилмальтозид предот
Можно предположить, что эта же часть молеку
вращает и обращает ингибирование фермента
лы ТХ взаимодействует с ЦСЖК, заменяя собой
тритоном, конкурируя с ним за место связыва
природный лиганд стероидной природы. Что
ния в соотношении 1/1. Неполное восстановле
касается додецилмальтозида, то он часто рас
ние активности в присутствии ДМ после обра
сматривается, как структурный аналог фосфо
ботки ЦО тритоном можно объяснить, по край
липида [49]. Таким образом, описанное нами в
ней мере, частично, ингибирующим действием
этой работе влияние додецилмальтозида на свя
самого ДМ, добавленного в высокой концент
зывание тритона с ЦО может имитировать естес
рации (рис. 2, б). Важно отметить, что мы на
твенную ситуацию, при которой эндогенный
блюдали модификацию эффекта тритона на ок
фосфолипид, связываясь вблизи сайта ЦСЖК,
сидазную активность в присутствии не только
контролирует величину сродства ЦСЖК к при
ДМ, но и ионного детергента холата (неопубли
родным амфипатическим лигандам (напри
кованные данные). В этом случае имело место
мер, стероидам).
не ослабление ингибирования, а лишь замедле
В цепочке переноса электронов между ко
ние его развития. Так, ингибирующий эффект
факторами ЦО (схема 1) тритон, судя по нашим
1 мМ ТХ на фоне 3,2 мМ холата развивается в
данным, ингибирует перенос электрона с гема а
течение 40-60 с (сравн. с рис. 1, а, кривая 1, где
на гем а3. Об этом свидетельствует повышение
ингибирующее действие 1 мМ ТХ на фоне
уровня восстановления гема а в ферменте, рабо
1 мМ ДМ развивается за время смешивания).
тающем в стационарных условиях (рис. 3, а), а
Конкурентные отношения между ТХ и ДМ, а
также уменьшение скорости восстановления ге
также между ТХ и холатом указывают на то, что
ма а3 при наступлении анаэробиоза (рис. 3, б). К
место связывания тритона совпадает или пере
такому же выводу пришли ранее Antalik et al.
крывается с ЦСЖК. Действительно, в этом слу
[21], изучая кинетику восстановления гема а3 в
чае мальтозидная группа ДМ препятствовала бы
присутствии тритона Х 100 методом быстрого
связыванию ТХ (см. выше), уменьшая его эф
смешивания. Замедление восстановления ге
фективное сродство к ферменту и величи
ма а3 в опытах с использованием быстрого сме
ну Ki(app). Сродство к ЦСЖК у тритона, по види
шивания мы наблюдали и в случае взаимодей
мому, существенно выше, чем у холата, посколь
ствия ЦО с эстрадиолом [46]. Примечательно,
ку в присутствии обоих лигандов ингибирующее
что именно данная стадия внутримолекулярно
действие ТХ развивается полностью, хотя и с за
го транспорта электрона блокируется в ЦО из
держкой.
R. sphaeroides мутациями по ключевым остаткам
В недавней работе Oleynikov et al. [46] мы
протонного К канала, в частности К362 и Е101
впервые продемонстрировали, что ингибитора
[50, 51]. На основании этого совпадения можно
ми ЦО из сердца быка могут быть стероидные
предположить, что действие тритона влияет на
гормоны. При этом, как и в случае с ТХ, додецил
функционирование К канала.
мальтозид ослаблял действие ингибитора, конку
Другая характерная особенность ингибиро
рируя с ним за связывание с ферментом в соотно
вания, вызываемого мутациями по остаткам К
шении 1/1. Сродство к ЦО самого додецилмаль
канала, состоит в том, что пероксидазная актив
тозида, полученное в настоящей работе (1,2 мМ,
ность ЦО, в отличие от оксидазной, остается не
рис. 1, в), весьма близко к оценкам, сделанным
затронутой [50, 51]. Это объясняется тем, что в
на основании исследования его конкуренции с
пероксидазной фазе каталитического цикла пе
эстрадиолом
(1,47
мМ) и с тестостеро
ренос протонов в биядерный центр осуществля
ном (1,3 мМ). Интересно отметить, что очень
ется не по К , а по D каналу [34, 50]. Как пока
близкими оказались также значения истинной
зано в нашей работе, пероксидазная активность
константы ингибирования, полученные для
окисленной ЦО проявляет значительную устой
ТХ (0,3 мМ, рис. 1, в) и для эстрадиола (0,37 мМ).
чивость к тритону в тех концентрациях, которые
Сходство параметров ингибирования может
вызывают практически полное ингибирование
указывать на определенное структурное сход
оксидазной реакции (рис. 7, кривые 1 и 2). Это
БИОХИМИЯ том 86 вып. 1 2021
ИНГИБИРОВАНИЕ ЦИТОХРОМОКСИДАЗЫ ТРИТОНОМ Х 100
69
наблюдение служит вторым серьезным аргумен
достаточной для мономеризации
(1%, т.е.
том в пользу того, что ингибирующее действие
16 мМ ТХ), эффект ускорения практически от
ТХ на оксидазную активность ЦО связано с на
сутствует, а под действием 0,1% (1,6 мМ) ТХ
рушением работы протонного К канала.
процесс, напротив, замедляется (см. Table 1 в ра
Косвенным свидетельством в пользу той же
боте Sadoski et al. [40]). В опытах по определе
гипотезы можно считать и индуцируемый ТХ
нию влияния ТХ на распределение стационар
спектральный сдвиг полосы поглощения ге
ных концентраций интермедиатов FI 607 и
ма а3. Канал К доставляет протоны непосред
FII 580 в процессе титрования окисленного фер
ственно в биядерный центр, и нарушение его
мента Н2О2 мы наблюдали ускорение исчезнове
проводимости под действием ТХ может повли
ния формы FI 607 (с переходом биядерного
ять на окружение высокоспинового гема, изме
центра в форму FII 580) в присутствии 6,4 мМ ТХ
нив распределение электронной плотности на
(рис. 6, а и б). Поскольку контрольный опыт по
лигандах и т.п.
казал, что ТХ не дестабилизирует интермедиат
Предположения о взаимодействии тритона с
FI 607 химически (рис. 6, в), то эффект, наблю
ЦСЖК и о его влиянии на К канал хорошо сог
даемый при титровании ЦО перекисью, можно
ласуются друг с другом. В работах лаборатории
объяснить лишь тем, что в условиях псевдоката
Ferguson Miller [42] отмечается близость ЦСЖК
лазного цикла (схема 2) тритон ускоряет реак
ко входу в К канал и высказывается гипотеза о
цию II (превращение FI 607→FII 580). С другой
том, что некоторые амфипатические лиганды
стороны, ингибирование тритоном образования
ЦСЖК могут нарушать перенос протонов в би
супероксида в условиях псевдокаталазного цик
ядерный центр. Авторы предполагают, что при
ла (рис. 7, кривая 3) указывает на замедление ре
чиной нарушения может быть как влияние на
акций II и/или III (схема 2). Наконец, каталаз
структуру водородных связей и ограничение
ная активность ЦО, предположительно в равной
подвижности молекул воды в канале, так и бло
степени сопряженная с реакциями II и III
кирование конформационных изменений в
[33, 39], оказалась в два раза более устойчивой к
районе трансмембранной спирали VIII, сопря
действию тритона, чем оксидазная (рис. 8).
женных с восстановлением фермента и необхо
Обобщая имеющиеся данные по влиянию
димых для быстрого проведения протонов к ге
тритона на взаимодействие ЦО с перекисью, мож
му а3. Мутация по остатку Glu101 во второй
но предположить, что наиболее вероятной ми
субъединице ЦО из R. sphaeroides (считающему
шенью действия ТХ является переход FII 580→Ох
ся входным пунктом для протонов, поступаю
(стадия III псевдокаталазного цикла), что согла
щих в канал К [51]) оказывает на эффекты, вы
суется с работой Sadoski et al. [40]. В наших экспе
зываемые лигандами ЦСЖК, серьезное модули
риментах торможением стадии III могло бы объ
рующее влияние [44]. Сходство действия трито
ясняться ингибирование тритоном генерации су
на с мутациями по остаткам К канала впервые
пероксида. Наблюдаемое в эксперименте подав
было отмечено в работе Antalik et al. [21], причем
ление каталазной активности на 40% также каче
там же высказано предположение о связывании
ственно согласуется с ингибированием стадии III
ТХ с ЦО в месте связывания холата. Любопыт
на 90% при сохранении или некотором увеличе
но, что авторы фактически приводят и данные
нии скорости реакции на стадии II. Ингибирова
об устойчивости к ингибированию тритоном пе
ние тритоном превращения FII 580→Ох проис
роксидазной активности ЦО, однако интерпре
ходит, очевидно, не только в псевдокаталазном,
тируют их как активацию перекисью оксидаз
но и в полном каталитическом цикле ЦО и мо
ной реакции с ферроцианидом в качестве доно
жет играть важную роль в механизме подавле
ра. Мы предполагаем, что в действительности
ния активности фермента.
речь идет здесь о восстановлении Н2О2 за счет
Таким образом, наши исследования взаимо
окисления ферментом высокопотенциального
действия тритона Х 100 с солюбилизированной
донора (ферроцианида в присутствии значи
митохондриальной ЦО
тельного количества феррицианида).
(1) обнаружили наличие конкуренции в со
Большой интерес представляет вопрос о
отношении 1/1 между тритоном Х 100 и доде
месте действия ТХ в каталитическом цикле фер
цилмальтозидом, которая, по видимому, ими
мента. В работе Sadoski et al. [40] утверждается,
тирует естественную ситуацию регуляции ак
что в присутствии тритона существенно ускоря
тивности фермента с участием лиганда ЦСЖК
ется переход FII 580→Ох, что на схеме 2 соответ
(например, стероидного гормона) и молекулы
ствует реакции III. Однако этот результат полу
эндогенного фосфолипида, контролирующей
чен при высокой (5%, т.е. 80 мМ) концентрации
эффективное сродство к лиганду;
ТХ, вызывающей переход фермента в мономер
(2) выявили у фермента, ингибированного
ную форму. При концентрации детергента, не
тритоном, характерные признаки нарушения
БИОХИМИЯ том 86 вып. 1 2021
70
ОЛЕЙНИКОВ и др.
работы протонного канала К (замедление реак
инструментом для изучения К канала митохон
ции переноса электрона с гема а на гем а3 и со
дриальной ЦО, отчасти заменяющим невозмож
хранение пероксидазной активности при пол
ный в данном случае мутагенез.
ном подавлении оксидазной);
(3) на основании данных о взаимодействии
фермента с Н2О2 позволили сделать предполо
Финансирование. Эта работа выполнена при
жение о месте действия тритона в каталитичес
финансовой поддержке Российского научного
ком цикле (ингибирование превращения интер
фонда (грант № 19 14 00063).
медиатов FII 580→Ох).
Конфликт интересов. Авторы заявляют об от
Полученные результаты представляются
сутствии конфликта интересов.
весьма существенными для понимания меха
Соблюдение этических норм. Настоящая
низма эндогенной регуляции активности ЦО.
статья не содержит описания выполненных ав
Работа имеет и практическую ценность, по
торами исследований с участием людей или ис
скольку тритон может оказаться удобным пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Wikström, M., and Sharma, V. (2018) Proton pumping by
nate oxidizing enzymes, Arch. Biochem. Bbiophys., 228,
cytochrome c oxidase - a 40 year anniversary, Biochim.
560 568, doi: 10.1016/0003 9861(84)90023 7.
Bbiophys. Acta (Bioenerg.), 1859, 692 698, doi: 10.1016/
13.
Sinjorgo, K. M., Durak, I., Dekker, H. L., Edel, C. M.,
j.bbabio.2018.03.009.
Bieleman, A. H., et al. (1987) The effect of detergents on
2.
Siletsky, S., and Konstantinov, A. A. (2012) Cytochrome c
bovine cytochrome c oxidase: a kinetic approach, Biochim.
oxidase: charge translocation coupled to single electron
Biophys. Acta,
893,
241250, doi:
10.1016/0005
partial steps of the catalytic cycle, Biochim. Biophys. Acta
2728(87)90045 4.
(Bioenerg.), 1817, 476 488, doi: 10.1016/j.bbabio.2011.
14.
Mahapatro, S. N., and Robinson, N. C. (1990) Effect of
08.003.
changing the detergent bound to bovine cytochrome c oxi
3.
Yoshikawa, S., and Shimada, A. (2015) Reaction mecha
dase upon its individual electron transfer steps,
nism of cytochrome c oxidase, Chem. Rev., 115, 1936
Biochemistry, 29, 764 770, doi: 10.1021/bi00455a025.
1989, doi: 10.1021/cr500266a.
15.
Tarasev, M., and Hill, B. C. (2002) Detergent modulation
4.
Rich, P. R. (2017) Mitochondrial cytochrome c oxidase:
of electron and proton transfer reactions in bovine
catalysis, coupling and controversies, Biochem. Soc. Trans.,
cytochrome c oxidase, Arch. Biochem. Bbiophys., 400, 162
45, 813 829, doi: 10.1042/BST20160139.
170, doi: 10.1016/S0003 9861(02)00011 5.
5.
Sun, F. F., Prezbindowski, K. G., Crane, F. L., and Jacobs,
16.
Robinson, N. C., and Capaldi, R. A. (1977) Interaction of
E. E. (1968) Physical state of cytochrome oxidase.
detergents with cytochrome c oxidase, Biochemistry, 16,
Relationship between membrane formation and ionic
375 381, doi: 10.1021/bi00622a006.
strength, Biochim. Biophys. Acta,
153,
804818,
17.
Georgevich, G., Darley Usmar, V. M., Malatesta, F., and
doi: 10.1016/0005 2728(68)90008 x.
Capaldi, R. A. (1983) Electron transfer in monomeric
6.
Lemberg, M. R. (1969) Cytochrome oxidase, Physiol. Rev.,
forms of beef and shark heart cytochrome c oxidase,
49, 48 121, doi: 10.1152/physrev.1969.49.1.48.
Biochemistry, 22, 1317 1322, doi: 10.1021/bi00275a001.
7.
Van Buuren, K. J., and Van Gelder, B. F. (1974) Biochem
18.
Robinson, N. C., and Talbert, L. (1986) Triton X 100 induced
ical and biophysical studies on cytochrome c oxidase. XIII.
dissociation of beef heart cytochrome c oxidase into mono
Effect of cholate on the enzymic activity, Biochim. Biophys.
mers, Biochemistry, 25, 2328 2335, doi: 10.1021/bi00357a005.
Acta, 333, 209 217, doi: 10.1016/0005 2728(74)90005 x.
19.
Henderson, R., Capaldi, R. A., and Leigh, J. S. (1977)
8.
Soulimane, T, and Buse, G. (1995) Integral cytochrome c
Arrangement of cytochrome oxidase molecules in two
oxidase. Preparation and progress towards a three dimen
dimensional vesicle crystals, J. Mol. Biol., 112, 631 648,
sional crystallization, Eur. J. Biochem., 227, 588 595,
doi: 10.1016/s0022 2836(77)80167 8.
doi: 10.1111/j.1432 1033.1995.tb20429.x.
20.
Qin, L., Mills, D. A., Buhrow, L., Hiser, C., and Ferguson
9.
Rosevear, P., Van Aken, T., Baxter, J., and Ferguson Miller,
Miller, S. A. (2008) Conserved steroid binding site in
S. (1980) Alkyl glycoside detergents: a simpler synthesis
cytochrome c oxidase, Biochemistry, 47, 99319933,
and their effects on kinetic and physical properties of
doi: 10.1021/bi8013483.
cytochrome c oxidase, Biochemistry, 19, 41084115,
21.
Antalik, M., Jancura, D., Palmer, G., and Fabian, M.
doi: 10.1021/bi00558a032.
(2005) A role for the protein in internal electron transfer to
10.
Soltysiak, D., and Kaniuga, Z. (1970) The effect of triton
the catalytic center of cytochrome c oxidase, Biochemistry,
X 100 on the respiratory chain enzymes of a heart muscle
44, 14881 14889, doi: 10.1021/bi050824z.
preparation, Eur. J. Biochem., 14, 70 74, doi: 10.1111/
22.
Bergmeyer, H. U., Gawehn, K., and Grassl, M. (1970) in
j.1432 1033.1970.tb00262.x.
Methoden der Enzymatischen Analyze (Bergmeyer, H. U.,
11.
Teller, J. K., Ziemnicki, K., and Obuchowicz, L. (1980)
ed.) Verlag Chemie, Weinheim, p. 440.
The effect of triton X 100 on cytochrome oxidase activity in
23.
Fowler, L. R., Richardson, S. H., and Hatefi, Y. (1962) A
carp, frog and rat liver mitochondria, Comp. Biochem.
rapid method for the preparation of highly purified
Physiol., 65B, 747 750, doi: 10.1016/0305 0491(80)90192 3.
cytochrome oxidase, Biochim. Biophys. Acta, 64, 170 173,
12.
Barbero, M. C., Valpuesta, J. M., Rial, E., Gurtubay, J. I.,
doi: 10.1016/0006 3002(62)90770 9.
Goñi, F. M., and Macarulla, J. M. (1984) Effect of the
24.
Vygodina, T. V., Kirichenko, A., and Konstantinov, A. A.
nonionic detergent Triton X 100 on mitochondrial succi
(2014) Cation binding site of cytochrome c oxidase:
БИОХИМИЯ том 86 вып. 1 2021
ИНГИБИРОВАНИЕ ЦИТОХРОМОКСИДАЗЫ ТРИТОНОМ Х 100
71
progress report, Biochim. Biophys. Acta, 1837, 1188 1195,
sitive electrode microsensor, Biochemistry (Moscow), 75,
doi: 10.1016/j.bbabio.2014.02.025.
1352 1360, doi: 10.1134/s0006297910110064.
25.
Vygodina, T. V., and Konstantinov, A. A. (2007) Peroxidase
40.
Sadoski, R. C., Zaslavsky, D., Gennis, R. B., Durham, B.,
activity of mitochondrial cytochrome c oxidase,
and Millett, F. (2001) Exposure of bovine cytochrome c
Biochemistry (Moscow), 72, 10561064, doi: 10.1134/
oxidase to high triton X 100 or to alkaline conditions caus
s0006297907100045.
es a dramatic change in the rate of reduction of compound
26.
Bielski, B. H., Shiue, G. G., and Bajuk, S.
(1980)
F, J. Biol. Chem., 276, 33616 33620, doi: 10.1074/jbc.
Reduction of nitro blue tetrazolium by CO2 and O2 radi
M103640200.
cals, J. Phys. Chem.,
84,
830833, doi:
10.1021/
41.
Ferguson Miller, S., Hiser, C., and Liu, J. (2012) Gating
j100445a006.
and regulation of the cytochrome c oxidase proton pump,
27.
Hilbers, F., von der Hocht, I., Ludwig, B., and Michel, H.
Biochim. Biophys. Acta (Bioenerg.),
1817,
489494,
(2013) True wild type and recombinant wild type
doi: 10.1016/j.bbabio.2011.11.018.
cytochrome c oxidase from Paracoccus denitrificans show a
42.
Hiser, C., Buhrow, L., Liu, J., Kuhn, L., and Ferguson
20 fold difference in their catalase activity, Biochim.
Miller, S. (2013) A conserved amphipathic ligand binding
Biophys. Acta, 1827, 319327, doi: 10.1016/j.bbabio.
region influences K path dependent activity of cytochrome c
2012.10.008.
oxidase, Biochemistry,
52,
1385 1396, doi:
10.1021/
28.
Nicholls, P., and Chanady, G. A. (1981) Interactions of
bi3014505.
cytochrome aa3 with oxygen and carbon monoxide. The
43.
Buhrow, L., Hiser, C., van Voorst, J. R., Ferguson Miller,
role of the 607 nm complex, Biochim. Biophys. Acta, 634,
S., and Kuhn, L. A. (2013) Computational prediction and
256 265, doi: 10.1016/0005 2728(81)90144 4.
in vitro analysis of potential physiological ligands of the bile
29.
Vanneste, W. H. (1966) The stoichiometry and absorption
acid binding site in cytochrome c oxidase, Biochemistry, 52,
spectra of components a and a(3 in cytochrome c oxidase,
6995 7006, doi: 10.1021/bi400674h.
Biochemistry, 5, 838 848, doi: 10.1021/bi00867a005.
44.
Hiser, C., Liu, J., and Ferguson Miller, S. (2018) The K
30.
Vygodina, T. V., Dyuba, A. V., and Konstantinov, A. A.
path entrance in cytochrome c oxidase is defined by muta
(2012) Effect of calcium ions on electron transfer between
tion of E101 and controlled by an adjacent ligand binding
hemes a and a3 in cytochrome c oxidase, Biochemistry
domain, Biochim. Biophys. Acta (Bioenerg.), 1859, 725
(Moscow), 77, 901 909, doi: 10.1134/S0006297912080111.
733, doi: 10.1016/j.bbabio.2018.03.017.
31.
Moody, A. J. (1996) “As prepared” forms of fully oxidised
45.
Yoshikawa, S., Muramoto, K., Shinzawa Itoh, K., and
haem/Cu terminal oxidases, Biochim. Biophys. Acta, 1276,
Mochizuki, M. (2012) Structural studies on bovine heart
6 20, doi: 10.1016/0005 2728(96)00035 7.
cytochrome c oxidase, Biochim. Biophys. Acta (Bioenerg.),
32.
Vygodina, T. V., and Konstantinov, A. A. (1988) H2O2
1817, 579 589, doi: 10.1016/j.bbabio.2011.12.012.
induced conversion of cytochrome c oxidase peroxy com
46.
Oleynikov, I. P., Azarkina, N. V., Vygodina, T. V., and
plex to oxoferryl state, Ann. NY Acad. Sci., 550, 124 138,
Konstantinov, A. A. (2020) Interaction of cytochrome c
doi: 10.1111/j.1749 6632.1988.tb35329.x.
oxidase with steroid hormones, Cells,
9,
2211,
33.
Konstantinov, A. A., Capitanio, N., Vygodina, T. V., and
doi: 10.3390/cells9102211.
Papa, S. (1992) pH changes associated with cytochrome c
47.
Madsen, L. L., Korsgaard, B., and Bjerregaard, P. (2003)
oxidase reaction with H2O2. Protonation state of the peroxy
Estrogenic effects in flounder Platichthys flesus orally
and oxoferryl intermediates, FEBS Lett., 312, 71 74,
exposed to 4 tert octylphenol, Aquatic Toxicol., 64, 393
doi: 10.1016/0014 5793(92)81412 f.
405, doi: 10.1016/s0166 445x(03)00106 1.
34.
Konstantinov, A. (1998) Cytochrome c oxidase as a proton
48.
Kennedy, R. H., Pelletier, J. H., Tupper, E. J., Hutchinson,
pumping peroxidase: reaction cycle and electrogenic
L. M., and Gosse, J. A. (2012) Estrogen mimetic 4 tert
mechanism, J. Bioenerg. Biomembr.,
30,
121130,
octylphenol enhances IgE mediated degranulation of
doi: 10.1023/a:1020571930850.
RBL 2H3 mast cells, J. Toxicol. Envir. Health., 75, 1451
35.
Konstantinov, A. A. (2012) Cytochrome c oxidase:
1455, doi: 10.1080/15287394.2012.722184.
Intermediates of the catalytic cycle and their energy cou
49.
Qin, L., Hiser, C., Mulichak, A., Garavito, R. M., and
pled interconversion, FEBS Lett.,
586,
630639,
Ferguson Miller, S. (2006) Identification of conserved
doi: 10.1016/j.febslet.2011.08.037.
lipid/detergent binding sites in a high resolution structure
36.
Ksenzenko, M. Yu., Vygodina, T. V., Berka, V., Ruuge,
of the membrane protein cytochrome c oxidase, Proc. Natl.
E. K., and Konstantinov, A. A. (1992) Cytochrome oxi
Acad. Sci. USA, 103, 16117 16122, doi: 10.1073/pnas.
dase catalyzed superoxide generation from hydrogen per
0606149103.
oxide, FEBS Lett., 297, 6366, doi: 10.1016/0014
50.
Vygodina, T. V., Pecoraro, C., Mitchell, D., Gennis, R.,
5793(92)80328 e.
and Konstantinov, A. A. (1998) Mechanism of inhibition of
37.
Jancura, D., Stanicova, J., Palmer, G., and Fabian, M.
electron transfer by amino acid replacement K362M in a
(2014) How hydrogen peroxide is metabolized by oxidized
proton channel of Rhodobacter sphaeroides cytochrome c
cytochrome c oxidase, Biochemistry, 53, 35643575,
oxidase, Biochemistry, 37, 30533061, doi: 10.1021/
doi: 10.1021/bi401078b.
bi971876u.
38.
Bickar, D., Bonaventura, J., and Bonaventura, C. (1982)
51.
Tomson, F. L., Morgan, J. E., Gu, G., Barquera, B.,
Cytochrome c oxidase binding of hydrogen peroxide,
Vygodina, T. V., and Gennis, R. B. (2003) Substitutions for
Biochemistry, 21, 2661 2666, doi: 10.1021/bi00540a013.
glutamate 101 in subunit II of cytochrome c oxidase from
39.
Bolshakov, I. A., Vygodina, T. V., Gennis, R., Karyakin,
Rhodobacter sphaeroides result in blocking the proton con
A. A., and Konstantinov, A. A. (2010) Catalase activity of
ducting K channel, Biochemistry,
42,
17111717,
cytochrome c oxidase assayed with hydrogen peroxide sen
doi: 10.1021/bi026750y.
БИОХИМИЯ том 86 вып. 1 2021
72
ОЛЕЙНИКОВ и др.
MECHANISM OF INHIBITION OF CYTOCHROME c OXIDASE
BY TRITON X 100
I. P. Oleynikov1,2, N. V. Azarkina2*, T. V. Vygodina2, and A. A. Konstantinov2
1 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University, 119992 Moscow, Russia
2 Belozersky Institute of Physico(Chemical Biology, Lomonosov Moscow State University,
119992 Moscow, Russia; E(mail: azarkina@yahoo.com
It is known that Triton X 100 (TX) reversibly inhibits activity of cytochrome c oxidase (CcO). The mechanism of inhi
bition is analyzed in this work. The action of TX is not directed to the reaction of CcO with cytochrome c, does not
cause transition of the enzyme to the “slow” form, and is not associated with monomerization of the enzyme com
plex. TX completely suppresses oxygen reduction by CcO, but inhibition is prevented and partially reversed by dode
cyl β-D maltoside (DDM), a detergent used to maintain CcO in solution. A 1/1 stoichiometry competition is shown
between DDM and TX for binding to CcO, with Ki = 0.3 mM and affinity of DDM for the enzyme of 1.2 mM. TX
interaction with the oxidized enzyme induces spectral response with maximum at 421 nm and [TX]1/2 = 0.28 mM,
presumably associated with heme a3. When CcO interacts with excess of H2O2 TX affects equilibrium of the oxygen
intermediates of the catalytic center accelerating the FI 607 → FII 580 transition, inhibits generation of O•- by the
enzyme, and, to a lesser extent, suppresses the catalase partial activity. The observed effects can be explained by inhi
bition of the conversion of the intermediate FII 580 to the free oxidized state during the catalytic cycle. TX suppress
es intraprotein electron transfer between hemes a and a3 during enzyme turnover. Partial peroxidase activity of CcO
remains relatively resistant to TX under conditions that block oxidase reaction effectively. These features indicate an
impairment of the K proton channel conductivity. We suggest that TX interacts with CcO at the Bile Acid Binding Site
(BABS) that is located on the subunit I at the K channel mouth and contacts with amphipathic regulators of CcO
[Buhrow et al. (2013) Biochemistry, 52, 6995 7006]. Apparently, TX mimics the physiological ligand of BABS, where
as the DDM molecule mimics an endogenous phospholipid bound at the edge of BABS that controls effective affin
ity for the ligand.
Keywords: cytochrome c oxidase, Triton X 100, regulation, K cnannel, amphipathic ligands
БИОХИМИЯ том 86 вып. 1 2021