БИОХИМИЯ, 2021, том 86, вып. 8, с. 1217 - 1230
УДК 577.113
АПТАМЕРНЫЕ РНК ДЛЯ ТЕРАНОСТИКИ
ГЛИОБЛАСТОМЫ МОЗГА ЧЕЛОВЕКА
© 2021
А.М. Копылов1*, Л.В. Фаб2, О. Антипова1, Е.А. Савченко3,
А.В. Ревищин2, В.В. Паршина2, С.В. Павлова2, И.И. Киреев1,
А.В. Головин1,4, Д.Ю. Усачев3, Г.В. Павлова2,3,4
1 Московский государственный университет имени М.В. Ломоносова, химический факультет,
119991 Москва, Россия; электронная почта: kopylov.alex@gmail.com
2 Институт высшей нервной деятельности и нейрофизиологии РАН, 117485 Москва, Россия
3 ФГАУ НМИЦ нейрохирургии им. ак. Н.Н. Бурденко Минздрава России, 125047 Москва, Россия
4 Первый МГМУ имени И.М. Сеченова Минздрава России, 119991 Москва, Россия
Поступила в редакцию 26.05.2021
После доработки 15.06.21
Принята к публикации 15.06.2021
Стандартные подходы к исследованию и молекулярному типированию опухолей включают ПЦР, блоттинг,
омиксы, иммуноцитохимию и иммуногистохимию; последние два метода самые востребованные, посколь
ку не только определяют наличие белка маркера, но и могут его локализовать в клетке. В работе продемон
стрированы возможности аптамерных РНК как альтернативы моноклональным антителам для аптацитохи
мии и аптагистохимии глиобластомы человека (ГБМ). В работе использовали 2′ F пиримидил РНК апта
мер МЕ07 длиной 48 нуклеотидов, специфичный к рецептору эпидермального фактора роста (РЭФР,
EGFR, ErbB1, Her1). Проточной цитометрией с флуоресцеиновым производным FАМ МЕ07 доказана спе
цифичность аптамера к рецептору EGFR на поверхности опухолевых клеток, полуколичественно определе
на кажущаяся константа диссоциации с рецептором на клетках, а также проведена оценка копийнос
ти EFGR на поверхности клетки. Использованы клеточные линии с разной степенью экспрессии EGFR:
A431 (106 копий на клетку), U87 (2 × 104 копий на клетку), MCF7 (103 копий на клетку), клетки перевивае
мой первичной клеточной культуры глиобластомы пациента ROZH (104 копий на клетку). Методом флуо
ресцентной микроскопии прямо показано взаимодействие FАМ МЕ07 с рецептором на клетках А431 с по
следующей интернализацией в цитоплазму и далее - в ядрышко, что открывает возможности использова
ния МЕ07 как эскорт аптамера для доставки терапевтических реагентов в клетки опухоли. FАМ МЕ07 эф
фективно окрашивает срезы клинических образцов ГБМ человека и чётко локализует EGFR положитель
ные клоны в гетерогенной опухоли, что позволяет перейти к опытам на моделях ГБМ у животных.
КЛЮЧЕВЫЕ СЛОВА: 2′ фтор пиримидил РНК аптамер, EGFR, глиобластома человека, клеточные куль
туры, опухолевая ткань, проточная цитометрия, флуоресцентная микроскопия.
DOI: 10.31857/S0320972521080121
ВВЕДЕНИЕ
данном случае - опухолевого маркера трансмем
бранного рецептора эпидермального фактора
Создание молекулярного узнающего эле
роста (EGFR) в глиобластоме. На втором этапе
мента (МУзЭля) для тераностики предполагает,
исследуется возможность таргетного блокирова
что на первом этапе исследуется возможность
ния рецептора с помощью МУзЭля либо рецеп
использования МУзЭля для детекции потенци
тор опосредованной таргетной доставки анти
альной терапевтической мишени в опухоли, в
пролиферативного агента с помощью МУзЭля.
При тераностике мультиформной глиобластомы
человека (ГБМ) для идентификации EGFR на
Принятые сокращения: EGFR - трансмембранный
рецептор эпидермального фактора роста; FАМ - 5(6) кар
поверхности клеток/опухоли и блокирования
боксифлуоресцеин; А431 - линия клеток эпидермоидной
пролиферации EGFR положительных клеток
карциномы человека; MCF7 - клеточная линия аденокар
используют моноклональные антитела и их про
циномы протоков молочной железы человека; U87 - кле
изводные [1]. В последнее время вместо антител
точная линия глиобластомы человека; ГБМ - глиобласто
начали использовать аптамеры.
ма мультиформная человека; кКд - кажущаяся константа
диссоциации; МУзЭл - молекулярный узнающий эле
В своей книге «Молекулярная биология. Ри
мент; 2′ F Py - 2′ фтор пиримидин.
босомы и биосинтез белка» А.С. Спирин ввёл
* Адресат для корреспонденции.
раздел «Эволюция древнего мира РНК путём
1217
1218
КОПЫЛОВ и др.
“систематического экспоненциального обога
является не одна молекула, а семейство молекул
щения”» [2]. Раздел начинается со следующего
со сходной аффинностью. Отсюда возникает це
абзаца: «В 1990 г. одновременно тремя группами
лый ряд теоретических вопросов. Во первых,
учёных в США (Тюрк и Голд; Эллингтон и Шос
молекулы финалисты (аптамеры) даже из одно
так; Робертсон и Джойс) была опубликована ме
го семейства имеют разные первичные и прост
тодология бесклеточной селекции, или бескле
ранственные структуры. Каким образом разные
точной эволюции, в пробирке молекул некоди
структуры обеспечивают специфичность взаи
рующих РНК, позволившая быстро получать в
модействия с одной мишенью? Во вторых, в
лаборатории нужные синтетические функцио
случае белка, аптамеры одного семейства с раз
нально активные РНК, специфически взаимо
личной структурой отбираются к одному или к
действующие с определёнными лигандами (ап
разным эпитопам белка; комплексы имеют
тамеры) или катализирующие определенные хи
сходные или различные структуры интерфаз? И,
мические реакции (искусственные рибозимы), а
наконец, каковы сравнительные свойства апта
также совершенствовать функции таких РНК…
меров, полученных из различных селекций?
Суть методологии “эволюции в пробирке” состо
Некоторые ответы можно найти при изуче
ит в многократном чередовании стадий селекции
нии аптамеров к белковой мишени, для которой
и амплификации РНК (“Systematic Evolution of
существует многообразие структур как для са
Ligands by EXponential enrichment”, SELEX)» [2].
мой мишени, так и для аптамеров к ней. Этим
По сути, независимо от того, на какую ми
условиям удовлетворяет рецептор эпидермаль
шень селектируются молекулы РНК (низкомо
ного фактора роста (РЭФР; epidermal growth fac
лекулярный органический краситель [3] или бе
tor receptor, EGFR; Her1, ErbB1), для которого
лок [4]) или на какую функцию (рибозим) се
известен достаточно большой набор аптамер
лектируются молекулы РНК [5]), задача состоит
ных РНК, ДНК и их модификаций. EGFR, как
в том, чтобы отобрать уникальные третичные
член семейства тирозинкиназных рецепторов
структуры РНК, которые обеспечивают аффин
ErbB, является достаточно распространённой
ность и специфичность аптамеров. И в этом
мишенью для многих типов рака; имеется боль
смысле РНК действительно обладает высоким
шой набор антител к EGFR, включая коммер
потенциалом для формирования сложных тре
чески доступные и терапевтические, для ряда
тичных структур. Большую роль при этом игра
антител проводятся клинические испытания, в
ет 2′ гидроксильная группа: её наличие в каж
том числе в случае глиобластом [1]. Получены
дом звене макромолекулы обеспечивает РНК
токсические конъюгаты терапевтических анти
многочисленными донорами и акцепторами во
тел, которые также проходят клинические ис
дородных связей, которые могут стимулировать
пытания. Таким образом, EGFR позволяет изу
и определять сворачивание, а также стабилизи
чать как теоретические, так и прикладные воп
ровать третичную структуру. Именно поэтому в
росы использования аптамеров.
первых работах по SELEX для селекции исполь
EGFR - наиболее часто сверхэкспрессируе
зовались в основном рандомизированные биб
мый онкоген рецепторной тирозинкиназы во
лиотеки РНК.
всех злокачественных новообразованиях чело
С другой стороны, наличие 2′ гидроксиль
века, который активируется при связывании
ной группы играет негативную роль, поскольку
различных факторов роста и, как следствие,
определяет гидролитическую нестабильность
инициирует каскад передачи сигнала, который
молекул РНК. Этот фактор является критичным
стимулирует клеточную миграцию, адгезию, ин
для продвижения аптамеров в прикладную об
вазию, пролиферацию, ангиогенез и анти апоп
ласть, например, в медицину - это трансляция в
тоз [8]; поэтому EGFR - это привлекательная
диагностику и терапию (тераностику, аптатера
мишень для терапии злокачественных опухолей.
ностику). В связи с этим аптамеры стали отби
Уровень экспрессии EGFR меняется от тысяч
рать из комбинаторных библиотек РНК, содер
молекул на клетку в норме вплоть до миллионов
жащих модифицированные остатки сахаров [6].
молекул на клетку - для некоторых опухолевых
В настоящее время наибольшую популярность
линий [9-11]. Наиболее часто встречаемый му
приобрели 2′ O метил , или 2′ фторпроизвод
тант EGFR - это EGFRvIII, который образуется
ные, либо так называемые мостиковые нуклеи
в результате делеции внеклеточной части рецеп
новые кислоты (locked nucleic acids, LNA;
тора от 6 до 273 аминокислоты (экзоны 2-7),
bridged nucleic acids, BNA) [7]. Ну и, конечно,
этот вариант экспрессируется в глиомах, немел
использование производных без 2′ гидрокси
коклеточных карциномах лёгкого и карциномах
ла - это комбинаторные библиотеки ДНК.
молочных желез. Количественный анализ кле
Необходимо отметить ещё одно обстоятель
ток, полученных биопсией глиомы человека, с
ство - естественно, что результатом селекции
помощью флуоресценции на клеточном сортере
БИОХИМИЯ том 86 вып. 8 2021
РНК АПТАМЕР ДЛЯ ТЕРАНОСТИКИ ГЛИОМЫ
1219
даёт цифру в несколько сотен тысяч копий
ров (Е01) синтезировали с рэндомизацией
EGFRvIII на клетку [12].
30% нуклеотидов, как описано ранее [18], для
Пионерские работы по получению аптамер
полученной библиотеки вновь проводили се
ных РНК к рецептору EGFR и изучению их
лекцию. В результате получена серия из семи
свойств были сделаны в лаборатории Э. Эллинг
2′ F Y РНК аптамеров Е01-Е07; для Е07 -
тона. При этом изучению собственно структуры
длиной 92 нт кКд = 2,4 нМ (против 36 нМ - для
аптамеров практически не уделялось внимания.
рецептора клеток мыши, mEGFR). Для введе
Классическим SELEX к внеклеточному домену
ния метки использовали якорный зонд, содер
рецептора для библиотеки РНК с очень боль
жащий биотин, флуорофор вводили с помощью
шой рандомизированной областью в 62 нт после
конъюгата стрептавидина с фикоэритрином.
12 раундов была получена аптамерная РНК J18
Аптамер Е07 взаимодействовал с клетка
длиной 104 нт. Аптамер J18 связывался с ми
ми А431, интернализация Е07 составляла 23%
шенью с кажущейся константой диссоциа
по сравнению с антителами С225 - 28% и фак
ции (кКд) ~7 нМ [13, 14]. Аптамер J18 не взаимо
тором роста EGF - 71%.
действовал ни с EGFR мыши, ни с hErbB2
Аптамер Е07 ингибировал активацию
(Her2/neu).
EGFR зависимого каскада фосфокиназ под
Аптамер был способен связываться с натив
действием 2 нМ EGF с IC50 = 300 нМ, а антите
ным рецептором, встроенным в мембрану кле
ла С225 - с ICmax = 100 нМ [17].
ток А431 эпидермоидной карциномы, которая
Аптамеры Е07 и их производные использо
содержит аномально высокое количество ре
вали для изучения пролиферации и миграции в
цептора на поверхности клеток - от 1 до
микроканалах [19], для электродетекции кле
3 млн [10]. Комплексы клеток с аптамерами, ме
точного EGFR в металлических нанощелях [20],
чеными фикоэритрином, анализировали про
а также для выделения EGFR позитивных кле
точной цитометрией. Связывание аптамера J18
ток [21, 22].
с клетками А431 ингибируется терапевтически
Текущие направления исследования аптаме
ми антителами к EGFR (Mab 225) [15, 16]. Флуо
ров к EGFR довольно разнообразны. Во пер
ресцентной микроскопией показано, что связы
вых, это минимизация аптамеров серии Е - по
вание аптамера J18 с клетками А431 блокирует
лучение МЕ07 длиной 48 нт [23]. Аффин
ся 10 кратным избытком фактора роста EGF че
ность ME07 к внеклеточному домену EGFR, из
ловека (но не мыши), а также антителами 225.
меренная интерферометрией биослоя, была вы
После инкубации 30 мин при 37 °С ~35% апта
сокая, кКд = 0,3 нМ, а к мутанту EGFRvIII - в
мера интернализовалось внутрь клеток; на холо
тысячу раз хуже, кКд = 0,3 мкМ [24, 25]. Во вто
ду аптамер рецепторный комплекс оставался на
рых, получение производных аптамеров для ви
поверхности клетки.
зуализации опухоли in vivo на моделях живот
Из за низкой гидролитической стабильности
ных. Например, для иммунодефицитных мы
РНК J18, следующая селекция РНК аптамеров к
шей с высоко туморогенной опухолью гор
EGFR была выполнена для 2′ F пиримидил
ла OSC 19 с помощью однофотонной эмисси
производных РНК (2′ F Y РНК) [13]. Селекцию
онной компьютерной томографии провели ви
проводили для рекомбинантного химерного бел
зуализацию конъюгатов полых золотых нано
ка - внеклеточного домена рецептора (L25-
частиц с аптамером Е07, меченых гамма эмит
S645) с Fc доменом IgG1 (P100-K330) через
тером111In; конъюгаты c аптамерами накапли
пептидный линкер IEGRMD. Получен высоко
ваются в опухоли в 2 раза лучше, чем конъюгаты
аффинный аптамер длиной 93 нт с кКд = 2,4 нМ.
с антителами [26]. При использовании 18F бен
Для введения метки в аптамер был использо
зоил МЕ07 показана возможность визуализа
ван следующий прием. 6 Карбоксифлуоресце
ции опухоли ксенографа А431 у мыши с по
ин (FАМ) меченый олигонуклеотидный зонд
мощью позитрон эмиссионной томогра
длиной 24 нт был комплементарен дополни
фии (ПЭТ), причём отношение опухоль/кровь
тельному участку аптамера на 3′ конце («якор
было 3,9, а опухоль/мышцы - 8,7 [24, 25].
ная» последовательность). После гибридизации
Интернализация рецептора в комплексе с Е07
10 мин при 70 °С с последующим отжигом гиб
открывает возможности его использования как
рид можно было использовать для флуоресцент
эскорт аптамера для доставки гемцитабина и его
ной детекции EGFR. Якорный олигонуклеотид
олигомерных производных [27]. Химерная РНК,
использовали для иммобилизации аптамера на
состоящая из аптамера и миРНК (Aptamer
поверхности стекла [13] или золота [14].
siRNA chimera, AsiC), используется для доставки
Для получения новых вариантов аптамеров
в клетки миРНК и нокдауна. Например, анти
использовали следующий приём [17]. После се
HOTAIR миРНК (HOX межгенная РНК) в виде
лекции 2′ F Y РНК один из аптамеров лиде
химеры с РНК аптамером Е07 эффективно ин
БИОХИМИЯ том 86 вып. 8 2021
1220
КОПЫЛОВ и др.
тернализуется в эндосомы в клетках тройного не
цепочечной ДНК матрицы, включающей нук
гативного рака молочной железы с последующим
леотидную последовательность аптамера, прай
нокдауном целевого гена [28]. В силу своих ма
мера и промотора РНК полимеразы T7. Прото
лых размеров аптамеры, в отличие от антител,
кол транскрипции включал обработку ДНКазой
оказались уникальным МУзЭлем, которые поз
и очистку переосаждением. Для введения флуо
волили развить технику детекции единичных мо
ресцентной метки 3′ конец РНК аптамера имел
лекул в живых клетках при супер разрешающей
дополнительную участок в 18 нт, который был
микроскопии [29-31].
комплементарен FАМ меченному 18 меру ДНК:
Помимо серии Е, к EGFR получен целый
FAM CATTTAGGACCAACACAA (таблица).
ряд аптамерных РНК [32, 33], ДНК [34, 35] и
Соли для буферов имели аналитическую чис
миксомеров [36], которые обладают различны
тоту («Biomedicals», Франция). Исходные раство
ми функциональными свойствами. Но, как и в
ры олигонуклеотидов с концентрацией 10 мкМ
случае с моноклональными антителами, при от
готовили в фосфатном буфере (PBS) («Thermo
сутствии данных об эпитопах/эпиаптах и пара
Fisher Scientific», США) c добавлением 5 мМ
топах/парааптах сравнительный анализ этих ап
MgCl2 («Sigma Aldrich», США). Структуру олиго
тамеров затруднён.
нуклеотидов в растворе преформировали: нагрев
Возможности направленной модификации
до 75 °C, затем медленное охлаждение до 25 °C.
аптамеров различными флуорофорами, равно
Клеточные линии. Клеточные линии эпите
как и развитие методов флуоресцентной детек
лиальной аденокарциномы A431, глиобласто
ции позволяют получать принципиально новую
мы U87, фибробластов dF и рака молочной же
информацию по механизму взаимодействия ап
лезы MCF7 были приобретены в Институте ци
тамеров с клетками и по поведению аптамеров
тологии РАН, Санкт Петербург, Россия. произ
внутри клетки. Все это создает фундамент для
водных без 2′ гидроксила (DMEM, «Gibco»,
развития аптатераностики, возможности кото
США) с добавлением 10% фетальной бычьей
рой могут оказаться выше, чем у иммунотера
сыворотки (FBS, «Thermo Fisher Scientific») в ат
ностики.
мосфере 5% CO2 при 37 °C. Клеточная культу
ра ROZH была получена в НМИЦ нейрохирур
гии им. академика Н.Н. Бурденко, Россия. Кле
МАТЕРИАЛЫ И МЕТОДЫ
точная культура из опухолевой ткани глиоблас
томы пациента была использована с согласия
Олигонуклеотиды. ДНК олигонуклеотиды
Этического Совета НМИЦ нейрохирургии
синтезированы и очищены методом ВЭЖХ в
им. академика Н.Н. Бурденко.
ООО «Евроген» (Россия). Флуоресцентно ме
Культивирование опухолевых клеточных куль8
ченный 2′ F РНК аптамер FАМ ME07 синте
тур и линий. Линии и первичные культуры кле
зирован и очищен методом ВЭЖХ в ООО «Син
ток, используемые в эксперименте, культивиро
тол» (Россия). Минимизированный вариант
вали в ростовой среде DMEM/F12 с пируватом
РНК аптамера MJ18 был синтезирован с по
натрия («Gibco») с добавлением 10% фетальной
мощью страндартного набора для транскрипции
бычьей сыворотки (FBS,
«Thermo Fisher
MegaScript («Thermo Fisher Scientific», США) с
Scientific»), 1% ного раствора HEPES для под
предварительно амплифицированной ПЦР дву
держания pH
(«Thermo Fisher Scientific»),
Первичные структуры олигонуклеотидов
Название
РНК/ДНК
Первичная структура
J18
РНК
GGCGCUCCGACCUUAGUCUCUGCAAGAUAAACCGUGCUAUUGACCACCCUCAACA
CACUUAUUUAAUGUAUUGAACGGACCUACGAACCGUGUAGCACAGCAGA
MJ18
РНК
GGUGCUAUUGACCACCCUCAACACACUUAUUUAAUGUAUUGAACGGACCUACGAAC
CGUGUAGCACC
MJ18h arm
РНК
GGUGCUAUUGACCACCCUCAACACACUUAUUUAAUGUAUUGAACGGACCUACGAAC
CGUGUAGCACCUUGUGUUGGUCCUAAAUG
FAM Harm
ДНК
FАМ CATTTAGGACCAACACAA
FAM ME07
2′ F пири
FАМ GGACGGAUUUAAUCGCCGUAGAAAAGCAUGUCAAAGCCGGAACCGUCC
мидил РНК
БИОХИМИЯ том 86 вып. 8 2021
РНК АПТАМЕР ДЛЯ ТЕРАНОСТИКИ ГЛИОМЫ
1221
1% GlutaMAX («Thermo Fisher Scientific») и 1%
тенсивность сигнала флуоресценции кана
антибиотика/антимикотика (раствор пеницил
ла FL1, 488 нм, регистрировали 10 000 событий.
лина/амфотерицина, «Cytiva», США). Флаконы
Флуоресценцию рассчитывали относительно
с клетками помещали в СО2 инкубатор
контрольной популяции клеток, которую инку
(«BINDER GmbH», Германия) при температуре
бировали без аптамера.
37 °C.
Флуоресцентная микроскопия. Скрининг
Проточная цитофлуориметрия РНК8аптаме8
флуоресцирующих клеток проводился на инвер
ра MJ18. Для введения флуоресцентной метки
тированной микроскопической платфор
1 мкМ раствор РНК олигонуклеотида MJ18 и
ме Eclipse Ti2 E («Nikon», Япония), оборудован
FАМ ДНК праймера в PBS с добавлением
ной моторизованным широкоформатным пред
5 мМ MgCl2 нагревали 3 мин до 75 °С и охлажда
метным столиком H139 («Prior Scientific», Вели
ли со скоростью 1 °С/мин до комнатной темпе
кобритания), системой автофокусировки на ос
ратуры.
нове инфракрасного лазера Perfect Focus
Для проточной цитофлуориметрии выращен
System («Nikon») и широкоформатной sCMOS
ные клетки переведены в суспензию, разделены
камеры Neo 5.5 («Andor Technologies», Ирлан
на порции по 500 000 клеток, промыты трижды
дия) под контролем программного обеспечения
буфером и ресуспендированы в 500 мкл PBS, со
NIS Elements ver.5.11 («Nikon») с модулем для
держащего 100 нМ дуплекса РНК олигонуклео
автоматизации скрининга JOBS. Флуоресцен
тида MJ18 с FAM Harm. Контрольные клетки
цию возбуждали при помощи 16 канального
инкубировали с FAM Harm. Положительный
блока LED pE 4000 («CoolLED», Великобрита
контроль: клетки инкубировали с раствором
ния). Сканирование культуральных планшетов
1 мкг/мл антител H11 против EGFR («Thermo
проводили с использованием объекти
Scientific») 1 ч при комнатной температуре в тем
ва PlanApo 10× (NA = 0,45), сканирование мно
ноте; далее 1 ч при 20 °C инкубировали с вторич
голуночных покровных стёкол 8 well μ Slide
ными антителами, мечеными Cy 2 (конъюгат
(«IBIDI», Германия) проводили с использовани
с Сy2 анти мышиные антитела AffiniPure,
ем объектива PlanApo 20× (NA = 0,75).
«Jackson ImmunoResearch», Великобритания),
Для флуоресцентной микроскопии исполь
разведение 1 : 200 в PBS. Клетки трижды промы
зовали аптамер FАМ ME07, λex = 490; λem = 513.
вали буфером и анализировали на проточном ци
Сканирование препаратов проводили в авто
тофлуориметре Attune NxT
(«Thermo Fisher
матическом режиме, для каждой лунки регист
Scientific»), измеряли интенсивность сигнала
рировали 8 полей зрения (для 96 луночных
флуоресценции канала BL1, 488 нм, регистрация
планшетов) и 36 полей зрения (для многолуноч
10 000 событий. Данные анализировали с по
ных стекол). Анализ результатов проводили при
мощью FACSDiva версии 5.02 Becton Dickinson.
помощи ImageJ. Для автоматизации анализа бы
Клеточный дебрис исключали на основании
ла создана серия скриптов, автоматически про
прямого и бокового рассеяния. Уровень флуо
водящих подсчёт клеток по флуоресцен
ресценции рассчитывали относительно конт
ции ДНК и измеряющих интегральную интен
рольной популяции клеток, которую инкубиро
сивность флуоресценции FАМ после вычитания
вали без добавления аптамеров.
фона. Результаты представлены в виде интег
Проточная цитофлуориметрия 2′8F8РНК8ап8
ральной интенсивности флуоресценции (в от
тамера FАМ8ME07. Клетки суспендировали,
носительных единицах), нормированной на ко
разделяли на порции по 500 000 клеток, трижды
личество клеток в поле зрения.
промывали фосфатным буфером и ресуспенди
Окраска фиксированных клеточных культур
ровали в 500 мкл PBS, содержащего необходи
аптамером FАМ8ME07. Культуру клеток
мую концентрацию FАМ МЕ07. Клетки инку
(10 000 клеток на лунку) высевали в 4 луночные
бировали 1 ч при комнатной температуре в тем
планшеты с вложенными покровными стёклами
ноте. Контрольные клетки, как в опыте с МJ18,
и инкубировали 2 дня при 37 °С. Фиксировали
окрашивали антителами H11 к EGFR («Thermo
4% ным параформальдегидом 20 мин при 4 °С.
Scientific») 1 ч при 4 °C, затем инкубировали с
Затем промывали 3 раза по 5 мин фосфатным
вторичными антителами, конъюгированными с
буфером. Клетки инкубировали с 100 нМ FАМ
флуоресцентным красителем Cy2 (конъюгат
ME07 в растворе PBS с 25 мм MgCl2, 60 мин при
с Сy2 анти мышиных антител AffiniPure,
комнатной температуре. Промывали 3 раза по
«Jackson ImmunoResearch»), разведение 1 : 200 в
5 мин в PBS. Для окраски ядер клеток использо
PBS, в течение 1 ч при 20 °C. После инкубации
вали раствор бисбензимида (Hoechst 33342,
клетки трижды промывали PBS. Анализ прово
«Sigma», разведение 1 : 500 в PBS). Перед анали
дили на проточном цитофлуориметре
зом клетки фиксировали в среде для заключе
AccuriC6 («BD Bioscience», США), измеряли ин
ния на основе поливинилового спирта
БИОХИМИЯ том 86 вып. 8 2021
1222
КОПЫЛОВ и др.
Mowiol («Sigma Aldrich», Германия) 8 ч при 4 °С,
шивали и инкубировали в растворе 100 нМ
а затем сутки - при комнатной температуре.
FАМ МЕ07 1 ч при комнатной температуре,
Полученные образцы исследовали на флуорес
промывали дважды по 5 мин в PBS. Ядра окра
центном инвертированном микроскопе Axiovert
шивали бисбензимидом (Hoechst
33342,
200M c цифровой камерой
(«Carl Zeiss
«Sigma», разведение 1 : 500 в PBS), инкубирова
MicroImaging GmbH», Германия).
ли 5 мин при комнатной температуре, промыва
Окраска нефиксированных клеточных культур
ли в PBS 5 мин. Срезы покрывали средой
одновременно антителами к EGFR и аптаме8
Mowiol («Sigma Aldrich») на основе поливини
ром FАМ8ME07. Клетки, культивируемые на
лового спирта, оставляли на 8 ч при 4 °С, затем
планшетах или на многолуночных стёк
на 24 ч - при комнатной температуре. Образцы
лах (10 000 клеток на лунку) инкубировали с
изучали на флуоресцентном инвертированном
500 нМ FАМ ME07 в растворе PBS с 25 мМ
микроскопе Axiovert 200M c цифровой камерой.
MgCl2 60 мин при комнатной температуре, затем
дважды отмывали от среды тремя объёмами
PBS (рН 7,2-7,4), после чего фиксировали до
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
бавлением 200 мкл 4% ного раствора парафор
мальдегида в PBS 30 мин при 4 °С. После фикса
Модели предполагаемых вторичных структур
ции клетки отмывали трижды тремя объёмами
аптамерных РНК к EGFR. Проведен анализ воз
PBS. Клетки инкубировали в растворе анти
можных вариантов вторичной структуры апта
тел H11к EGFR («Thermo Scientific», разбавле
мерных РНК к EGFR: РНК (J18 и MJ18) и 2′ F
ние 1 : 100) 1 ч; промывали PBS трижды по
модифицированных РНК (E07, ME07), рис. 1.
5 мин. Клетки инкубировали с вторичными ан
Такие достаточно короткие структуры РНК в
тителами, меченными Cy2 в разведении 1 : 100
50-70 нт доступны для экспериментального
(«Jackson ImmunoResearch») 60 мин при комнат
изучения.
ной температуре. Ядра клеток окрашивали рас
Проточная цитофлуорометрия аптамерных
твором бисбензимида (Hoechst 33342, («Sigma»),
РНК MJ18 и FАМ8МЕ07 с клетками, экспресси8
разведение 1 : 500 в PBS). Клетки фиксировали в
рующими EGFR на поверхности. В качестве
среде для заключения на основе поливинилово
стандарта для детекции EGFR на поверхности
го спирта Mowiol 4 88 («Sigma Aldrich») с анти
линейных клеток использовали коммерчески
оксидантом 1% ным DABCO («Sigma Aldrich»,
доступное моноклональное антитело Н11, ко
Германия) 8 ч при 4 °С, затем сутки - при ком
торое было мечено с помощью вторичных анти
натной температуре. Образцы исследовали на
тел с флуорофором Cy2. Для 2′ фтор пирими
флуоресцентном инвертированном микроскопе
дин МЕ07 (2′ F Py МЕ07) при синтезе на
Axiovert 200M c цифровой камерой.
5′ конец вводился флуоресцеиновый флуоро
Окраска клеточных культур аптамером FАМ8
фор 5(6) карбоксифлуоресцеин (FАМ).
ME07 без предварительной фиксации. Клетки,
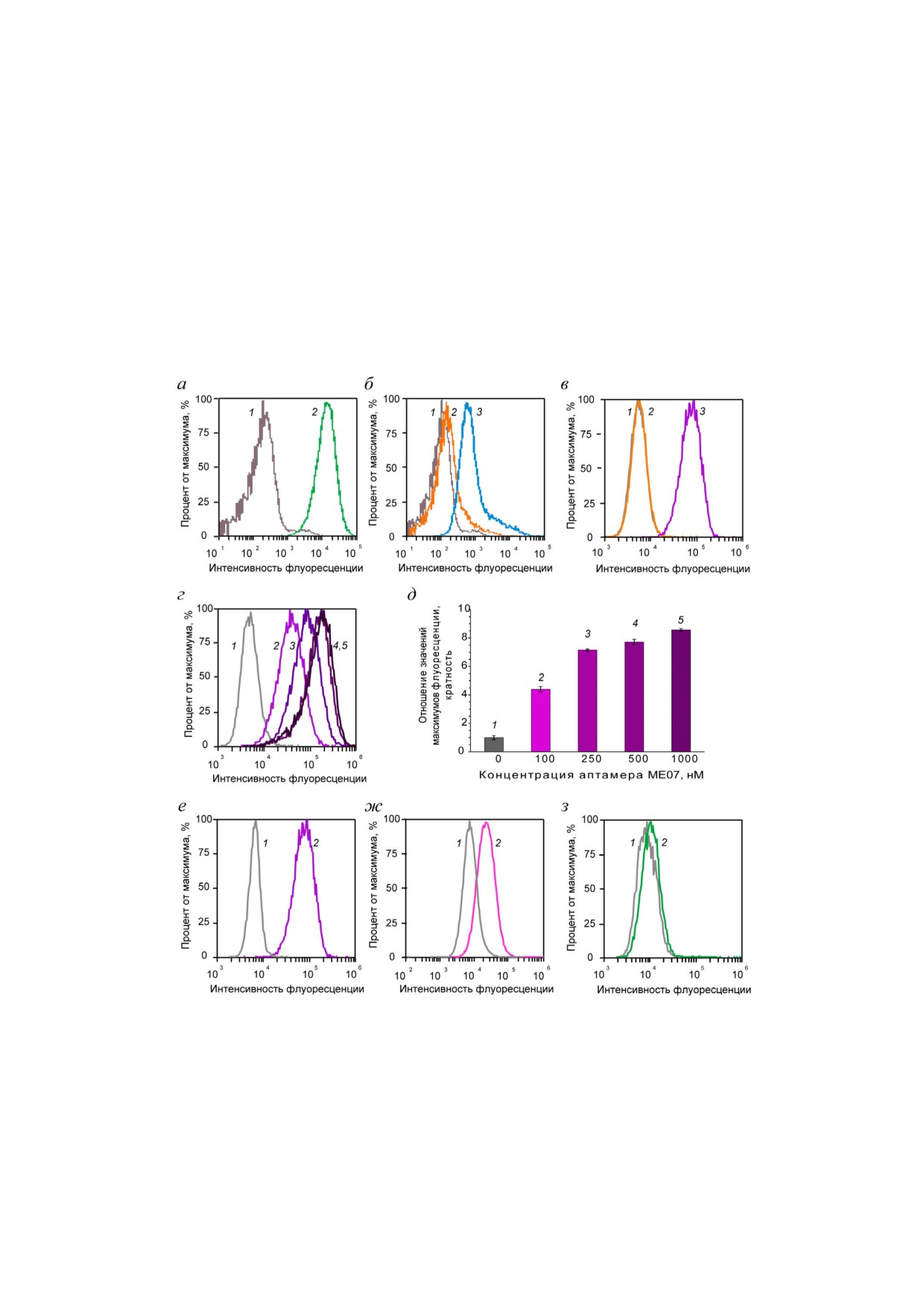
На рисунке 2, а видно, что клетки А431(ли
культивируемые на планшетах или на многолу
ния клеток эпидермоидной карциномы челове
ночных стёклах (10 000 клеток на лунку), инку
ка), которые суперэкспрессируют EGFR, дают
бировали с FАМ ME07 1 ч, дважды отмывали
хороший сигнал с флуоресцентными антитела
тремя объёмами PBS (рН 7,2-7,4) и фиксирова
ми Н11, сигнал характеризуется величиной
ли добавлением 200 мкл 4% ного раствора пара
сдвига правого пика (2) по абсциссе относитель
формальдегида в PBS, 30 мин при 4 °С. Клетки
но собственной флуоресценции клеток
(1).
отмывали трижды тремя объёмами PBS. Ядра
Причём величина сдвига пропорциональна ин
клеток окрашивали бисбензимидом (Hoechst
тенсивности флуоресценции, то есть пропорци
33342, («Sigma»), разведение 1 : 500 в PBS). Об
ональна количеству меченого лиганда на EGFR.
разцы покрывали средой на основе поливини
Несколько более слабый сигнал показывает
лового спирта Mowiol 4 88 с антиоксидантом
комплекс аптамерной РНК МJ18 с якор
1% ным DABCO.
ным FАМ ДНК комплементом (рис. 2, б). Сиг
Окраска срезов нефиксированной заморожен8
нал для отрицательного контроля с олигонуклео
ной опухолевой ткани глиобластомы человека ап8
тидом с неаптамерной первичной структурой
тамером FАМ8ME07. Опухолевую ткань глиоб
совпадает с сигналом от исходных клеток (ле
ластомы человека получали от пациентов в ре
вый пик (2) на рис. 2, в; правый пик (3) - сиг
зультате операционного вмешательства. Из за
нал от МЕ07).
мороженного в жидком азоте фрагмента опухо
Для верификации специфичности аптамера
ли нефиксированной глиобластомы человека с
к рецептору показательны результаты титрова
помощью криотома получали срезы толщи
ния EGFR на поверхности клеток А431 аптаме
ной 5 мкм. Срез промывали 5 мин в PBS, высу
ром FАМ МЕ07. С повышением концентрации
БИОХИМИЯ том 86 вып. 8 2021
РНК АПТАМЕР ДЛЯ ТЕРАНОСТИКИ ГЛИОМЫ
1223
Рис. 1. Предполагаемые вторичные структуры аптамерных РНК к EGFR, полученные моделированием для минимума
свободной энергии с помощью алгоритмов RNAStructure [37], визуализация результатов моделирования вторичных
структур с использованием сервиса RNApdbee [38]. РНК аптамер J18 был сокращён до 67 нуклеотидов - MJ18
аптамера увеличивается сдвиг по оси абс
Таким образом, метод проточной цитофлуо
цисс (рис. 2, г и д), что позволяет примерно оце
рометрии позволяет полуколичественно оценить
нить кажущуюся константу диссоциации апта
число молекул EFGR на поверхности клеток.
мера с рецептором в составе клетки - ~100 нМ.
Флуоресцентная микроскопия. Принципи
Ещё более показательны данные, получен
ально иную информацию о взаимодействии ан
ные для разных типов линейных клеток, кото
тител и аптамеров с рецептором EGFR на поверх
рые содержат разное количество рецептора на
ности клеток можно получить с помощью флуо
поверхности клеток в силу их физиологических
ресцентной микроскопии.
свойств. Использован следующий ряд стандарт
В качестве положительного контроля ис
ных линий клеток. Положительный контроль -
пользовали линию клеток А431 с суперэкспрес
линия клеток с суперэкспрессией рецепто
сией EGFR, которую обрабатывали одновре
ра EGFR; это эпидермоидная карцинома чело
менно аптамером FАМ МЕ07 и моноклональ
века, которая имеет до 3 × 106 молекул рецепто
ным антителом Н11; антитело Н11 метили с по
ра на поверхности одной клетки [39], значения
мощью вторичных антител, конъюгированных с
нормализованной экспрессии EGFR NX = 346
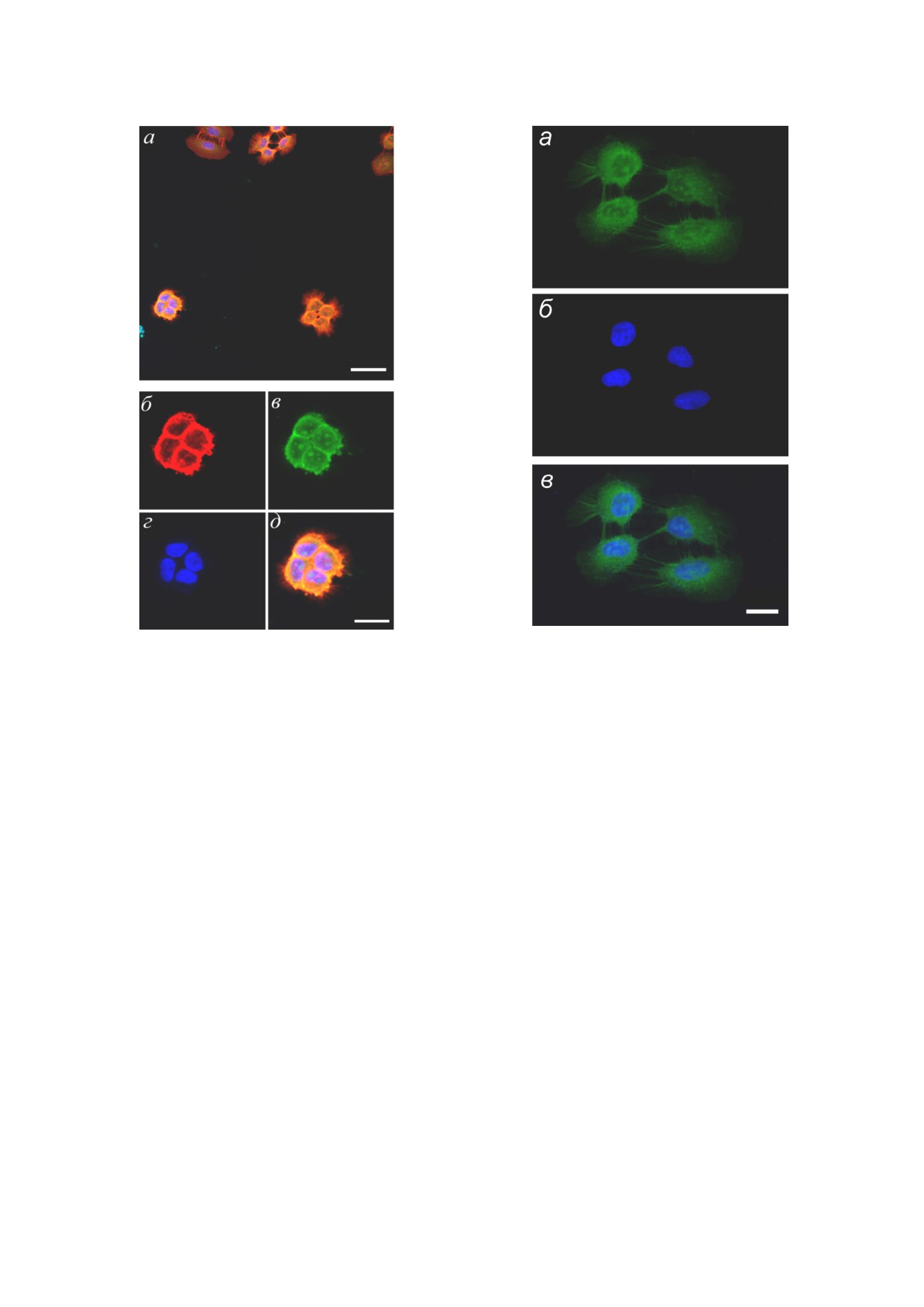
флуорофором Cy2. На рис. 3, а показано общее
поле для флуоресцентной микроскопии кле
шим числом рецепторов на одну клетку облада
ток А431 с окрашенными ядрами (синий цвет),
ет стандартная клеточная линия глиобластомы
антителом Н11 (красный цвет) и аптаме
человека U87, которая содержит 2 × 104 молекул
ром FАМ МЕ07 (зелёный цвет).
на одну клетку [40], значения нормализованной
Более детально группа из четырех клеток по
казана на других панелях рис. 3: в комплексе с
наконец, в качестве линии клеток с минималь
флуоресцентным антителом Н11 (б), в комплек
ным количеством рецептора была выбрана стан
се с флуоресцентным аптамером FАМ МЕ07
дартная линия клеток аденокарциномы прото
(в), с окрашенными ядрами (г). На рис. 3, д по
ков молочной железы человека (MCF7), кото
казан результат наложения изображений, при
рая содержит на порядок меньше молекул ре
совпадении локализации аптамеров и антител
цептора на клетку - до 2 × 103 [41], значения
получается оранжевый цвет.
нормализованной экспрессии NX = 0,2 (https://
Аптамер FАМ МЕ07, также как и антите
proteinatlas.org).
ло Н11, чётко локализуется на мембране кле
Из рис. 2 видно, что при уменьшении коли
ток А431. При этом не наблюдается заметной
чества молекул рецептора на клетку сигнал флуо
конкуренции антител Н11 и аптамеров FАМ
ресценции приближается к собственной флуо
МЕ07. В отличие от антитела Н11, аптамер
ресценции клеток, и для клеток MCF7 он прак
FАМ МЕ07 проникает в цитоплазму клеток и
тически совпадает с таковой.
далее попадает в ядрышки.
БИОХИМИЯ том 86 вып. 8 2021
1224
КОПЫЛОВ и др.
Для более точной локализации аптамера в
ра клеток мультиформной глиобластомы чело
клетках А431 был проведён опыт только с апта
века ROZH, полученная из хирургического об
мером FАМ МЕ07, без антител Н11. На рис. 4
разца опухоли пациента; культура клеток фиб
чётко видно свечение аптамера FАМ МЕ07 в
робластов человека.
цитоплазме клеток и в ядрышке.
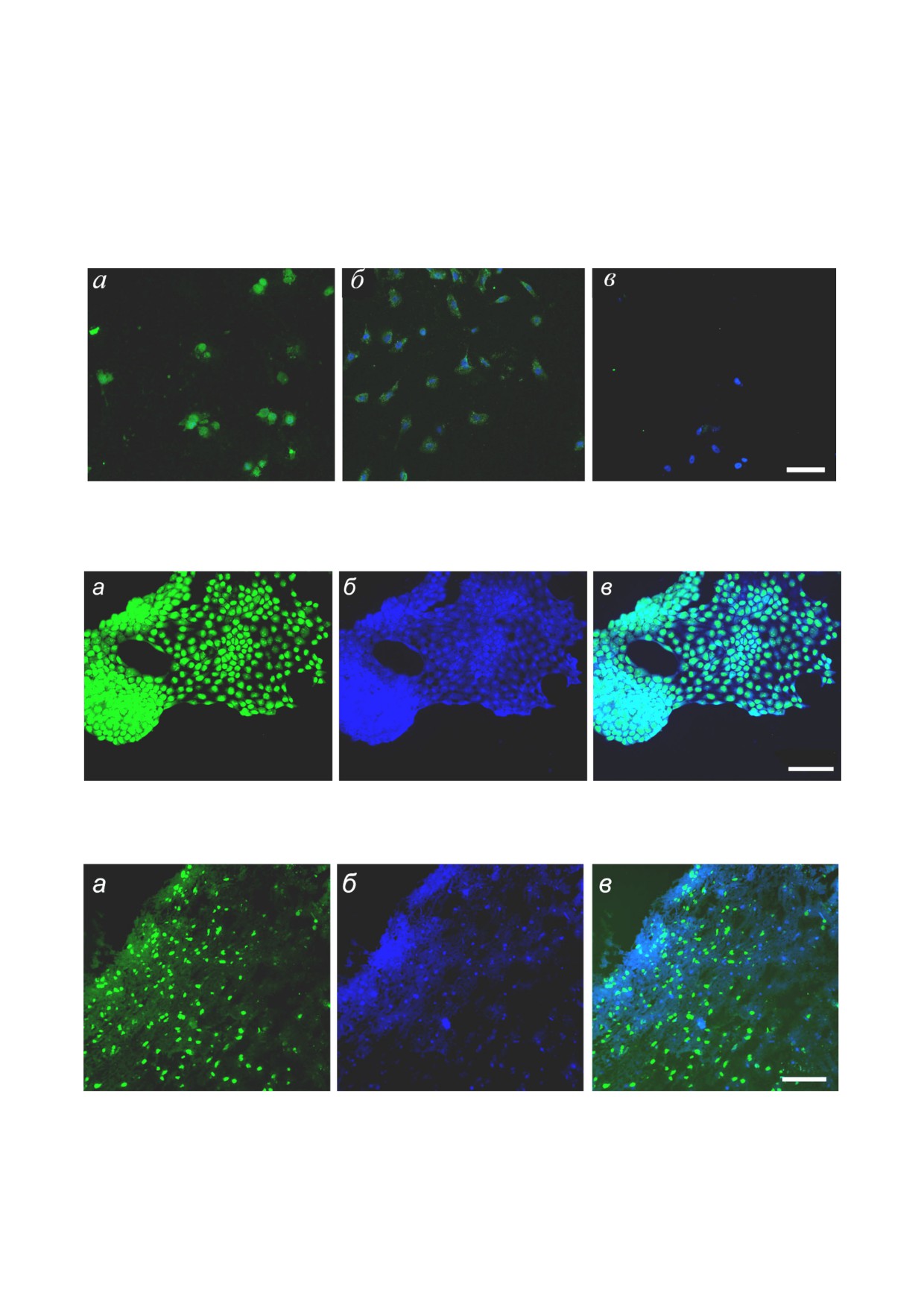
Для того, чтобы можно было выявить малое
Очень показательные данные получены при
количество рецептора на поверхности клеток,
сравнении взаимодействия FАМ МЕ07 с раз
концентрацию FАМ МЕ07 повысили на поря
ными типами линейных клеток, имеющих раз
док - до 1 мкМ. Неудивительно, что при такой
ное количество рецептора EGFR на поверхнос
высокой концентрации аптамера клетки А431
ти. На рис. 5 показана окраска аптамером АМ
окрашивались очень интенсивно. Клет
МЕ07 следующего набора клеток: положитель
ки ГБМ ROZH окрашивались в меньшей степе
ный контроль - клетки А431; первичная культу
ни, аптамер FАМ МЕ07 в основном локализо
Рис. 2. Проточная цитофлуориметрия. Собственная флуоресценция клеток (серый (1)). Первый ряд. Комплексы меченых
антител и аптамеров с линиями клеток. а - Клетки A431 с антителами Н11 (зеленый (2)); б - клетки A431 с якорным FАМ
ДНК комплементом (оранжевый (2)), клетки A431 с аптамером MJ18h и якорным FАМ ДНК олигонуклеотидом (голу
бой (3)); в - клетки A431 с якорным FАМ ДНК комплементом (оранжевый (2)), клетки A431 с аптамером FАМ ME07
(фиолетовый (3)). Второй ряд. Титрование клеток A431 аптамером FАМ ME07: г - клетки A431 с разными концентраци
ями FАМ ME07 (1 - 0 нм, 2 - 100 нм, 3 - 250 нм, 4 - 500 нм, 5 - 1000 нм), д - интенсивность флуоресценции клеток A431
для различных концентраций FАМ ME07 (1-5 повышение концентрации от 0 до 1000 нм). Третий ряд. Связывание апта
мера FАМ ME07 с различными типами клеток с разной представленностью EGFR (2): е - клетки A431, ж - клетки U87,
з - клетки MCF7
БИОХИМИЯ том 86 вып. 8 2021
РНК АПТАМЕР ДЛЯ ТЕРАНОСТИКИ ГЛИОМЫ
1225
Рис. 3. Флуоресцентная микроскопия клеток после окрас
Рис. 4. Окраска клеток линии эпидермоидной карцино
ки на EGFR. Клетки линии эпидермоидной карцино
мы А431 (замороженный образец) аптамером FАМ
мы А431, суперэкспрессирующие EGFR (замороженный
МЕ07
(а) (зелёный), окраска ядер бисбензимидом
образец). Общее поле для флуоресцентной микроскопии
Hoechst 33342 (б) (синий). в - Совмещение изображений а
клеток А431 (а). Масштаб - 100 мкм. Окраска б - антите
и б. Масштаб - 20 мкм
лом Н11 против EGFR (красный), вторичное антитело -
конъюгат с Cy2; в - аптамером FАМ МЕ07 (зелёный), г -
ядра окрашены бисбензимидом Hoechst 33342 (синий); д -
наложение изображений для антитела и аптамера (оранже
вый). Масштаб - 20 мкм
вался в цитоплазме. Несмотря на очень высо
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
кую концентрацию FАМ МЕ07, фибробласты
практически не окрашивались.
Пионерские работы по получению и изуче
Такие результаты характерны только для жи
нию свойств аптамерных РНК к рецептору
вых замороженных клеток. При фиксации кле
EGFR были сделаны в лаборатории Э. Эллинг
ток формальдегидом наблюдается нехарактерное
тона. К внеклеточному домену рецептора снача
окрашивание аптамером FАМ МЕ07 (рис. 6).
ла получили аптамерную РНК J18 длиной
Первые положительные полуколичествен
104 нт, кКд с EGFR составляла ~7 нМ [13, 14].
ные результаты аптацитохимии определили
Затем к химере внеклеточного домена рецепто
удачные попытки аптагистохимии для визуали
ра c константной частью иммуноглобулина се
зации EFGR позитивных клеток в тканях опу
лектированы РНК аптамеры с повышенной
холи ГБМ пациентов. На рис. 7 показана окрас
стабильностью к нуклеазам, которые содержали
ка крио среза ГБМ, полученного из хирургичес
2′ F пиримидины: Е07 длиной 92 нт и его мини
кого биоптата опухоли пациента, с помощью
мизированный вариант МЕ07 длиной
FАМ МЕ07. EFGR позитивные клетки состав
48 нт [17, 19-22, 26, 27]. При этом структура ап
ляют довольно значительную часть клеток гете
тамеров не изучалась.
рогенной опухоли и ярко окрашиваются апта
Нами были проанализированы возможные
мером FАМ МЕ07.
варианты вторичной структуры как исходных,
9 БИОХИМИЯ том 86 вып. 8 2021
1226
КОПЫЛОВ и др.
так и
2′ F модифицированных аптамерных
стэкинг взаимодействия. Несмотря на разницу
РНК, полученных Эллингтоном с коллегами.
в предполагаемых структурах, короткие вариан
Для аптамера МЕ07 предлагаемая нами вторич
ты аптамерных РНК (MJ18) и производных
ная структура (рис. 1) отличается от формально
2′ фтор пиримидинов РНК (МЕ07) одинаково
предложенной авторами, она допускает возмож
хорошо взаимодействуют с EGFR в составе кле
ность формирования единого коаксиального
ток (см. далее).
Рис. 5. Окраска клеточных культур с разной представленностью EGFR (замороженные образцы) с помощью аптамера
FАМ МЕ07 (зеленый); окраска ядер бисбензимидом Hoechst 33342 (синий). а - Клетки А431, б - первичная клеточная
культура глиобластомы человека ROZH. в - Фибробласты человека. Масштаб - 50 мкм
Рис. 6. Окраска фиксированных клеток линии эпидермоидной карциномы А431 с высокой экспрессией EGFR аптаме
ром FАМ ME07 (а), окраска ядер бисбензимидом Hoechst 33342 (б), совмещение каналов флуоресценции (в). Масш
таб - 100 мкм
Рис. 7. Окраска крио срезов нефиксированной опухолевой ткани глиобластомы человека (пациент 76, замороженный об
разец) аптамером FАМ ME07 (а) (зелёный); окраска ядер бисбензимидом Hoechst 33342 (б) (синий). в - Результат нало
жения изображений. Масштаб - 100 мкм
БИОХИМИЯ том 86 вып. 8 2021
РНК АПТАМЕР ДЛЯ ТЕРАНОСТИКИ ГЛИОМЫ
1227
Небольшие размеры и возможность сравне
меры не прошли дополнительные тесты на клет
ния аптамерных РНК позволяют искать «пара
ках - ситуация, типична и для моноклональных
апты». По аналогии с антителами, для которых
антител. Необходимо наличие как минимум
принято использовать термин «эпитоп» для ан
двух отрицательных контролей. Первый - ис
тигенной детерминанты на мишени и термин
пользование олигонуклеотида с неаптамерной
«паратоп» для узнаюшего элемента структуры
последовательностью оснований; второй - ис
антитела, для аптамеров можно использовать
пользование клеток с минимальной экспресси
термины «эпиапт» и «параапт» соответственно.
ей EFGR на поверхности.
Для применения аптамеров в тераностике
Проточная цитофлуорометрия. Оценка коли
прежде всего необходимо изучить возможность
чества EFGR на поверхности линейных опухо
их применения для детекции EGFR сначала на
левых клеток проводилась методом проточной
поверхности опухолевых клеток, а затем и на
цитофлуорометрии. В качестве стандарта для
тканях. Селекция аптамеров к EGFR проводи
детекции EGFR на поверхности линейных кле
лась для рекомбинантных белков вне клеток, в
ток использовали коммерчески доступное мо
составе клеток или ткани может измениться ста
ноклональное антитело Н11, которое имеет ли
тус EGFR (включая возможные изменения кон
нейный эпитоп во внеклеточном домене рецеп
формации и окружения), что может привести к
тора (в основном в домене 3, аминокисло
изменению аффинности и специфичности. Ис
ты 294-543) [46] и которое было мечено с по
кажать интерпретацию результатов могут и дру
мощью вторичных антител с флуорофором Cy2.
гие обстоятельства. Например, стандартный
В случае 2′ F Py РНК флуоресцентная метка
способ приготовления образца клеток из куль
вводилась на 5′ конец аптамера МЕ07 в процес
туры (или ткани) путём трипсинизации. И, на
се синтеза в виде флуоресцеинамидита (FАМ).
конец, степень клональной гетерогенности опу
На рис. 2, а хорошо видно, что клетки А431 с
холи также может повлиять на возможности де
суперэкспрессией EGFR дают хороший сигнал
текции EGFR позитивных клеток в ткани.
с антителами Н11, который проявляется в виде
В классическом варианте аптамеры селекти
сдвига по абсциссе (правый пик (2)) относи
ровали из библиотек РНК, поскольку считалось
тельно собственного свечения клеток (левый
(и небезосновательно), что РНК, в отличие
пик (1)). Хороший сигнал даёт флуоресцентный
от ДНК, обладает более развитой третичной
аптамер
5′ FАМ МЕ07 (рис.
2, в, правый
структурой благодаря наличию 2′ гидроксила.
пик (3)); при этом сигнал для отрицательного
И действительно, первый аптамер для
контроля с FАМ олигонуклеотидом с неапта
EGFR, J18, был РНК длиной 104 нт. Нами был
мерной первичной структурой совпадает с сиг
получен укороченный вариант аптамера J18,
налом от исходных клеток (рис. 2, в, левый
MJ18 длиной 67 нт, который сохранял его аф
пик (2)). Полученные результаты хорошо согла
финность для клеток (рис. 1 и 2).
суются с наблюдавшимися ранее [25].
Однако низкая стабильность к нуклеазам
Два других эксперимента, несмотря на их
заставила исследователей перейти к использо
очевидную необходимость, в данной работе вы
ванию 2′ фторпроизводных РНК. Для блокиро
полнены впервые.
вания нуклеазной активности панкреатического
Для верификации специфичности аптамера
типа используют 2′ фтор пиримидины (2′ F Py).
к рецептору в составе клеток очень показатель
Фторпроизводные РНК не только теряют до
ны результаты титрования EGFR на поверхнос
норно акцепторные свойства 2′ гидроксильной
ти клеток А431 аптамером FАМ МЕ07. С повы
группы, но и получают заместитель с сильными
шением концентрации аптамера увеличивается
гидрофобными свойствами, что не всегда учи
сдвиг по оси абсцисс (рис. 2, г и д). Такой сдвиг
тывается исследователями. Двутяжевая структу
оказался настолько характеристическим, что
ра такой РНК сохраняет А форму, но повыше
позволил примерно оценить кКд аптамера FАМ
ние гидрофобности сахарофосфатного остова
МЕ07 с рецептором EGFR в составе кле
приводит к мало предсказуемой термической
ток А431. Аффинность аптамера к рецептору в
стабильности и иногда - к повышенному срод
составе клетки хуже, по крайней мере в 100 раз,
ству с белками [42-44].
чем для свободного рецептора: ~100 нМ против
По этой же причине при использовании ап
1 нМ соответственно. Подобная закономерность
тамерных 2′ F Py РНК для детекции EGFR на
отмечалась ранее, например, аптамеры серии Е
поверхности клеток иногда наблюдается повы
ингибируют протеинкиназную активность ре
шенное неспецифическое связывание [45]; это
цептора EGFR при концентрациях ~300 нМ [17].
требует более тщательных доказательств специ
Из рис. 2 видно, что независимо от природы
фичности 2′ F Py РНК аптамеров для целей те
клеток при убывании количества молекул рецеп
раностики. Некоторые опубликованные апта
тора на клетку сигнал флуоресценции сдвигается
БИОХИМИЯ том 86 вып. 8 2021
9*
1228
КОПЫЛОВ и др.
к собственной флуоресценции клеток, и для кле
разца ГБМ пациента; культура клеток фибро
ток MCF7 он практически неотличим. Это ука
бластов человека. Для того, чтобы выявить ма
зывает на возможные значения нижнего порога
лое количество рецептора на поверхности кле
копийности при обнаружении рецептора, мече
ток концентрацию FАМ МЕ07 повышали в
ного флуоресцеином. Флуоресцеин - не самый
10 раз - до 1 мкМ. Неудивительно, что при та
яркий флуорофор, который можно использовать
кой концентрации аптамера клетки А431 окра
для конъюгации с олигонуклеотидами; напри
шивались настолько интенсивно, что маскиро
мер, фикоэритрин на порядок чувствитель
вали окраску ядер. Клетки ГБМ ROZH окраши
нее [17].
вались в меньшей степени; аптамер в основном
Таким образом, аптамерную РНК МЕ07, ме
локализовался в цитоплазме. Несмотря на очень
ченную FАМ, можно использовать для полуко
высокую концентрацию FАМ МЕ07, фибро
личественной оценки копийности рецептора на
бласты практически не окрашивались. Таким
поверхности клеток методом проточной цито
образом, как и для проточной цитометрии, оче
флуорометрии.
видно, что независимо от природы клеток при
Флуоресцентная микроскопия. Принципи
уменьшении количества молекул рецептора на
ально новую информацию о взаимодействии
клетку флуоресцентный сигнал убывает. Следо
аптамеров с рецептором EGFR на клетках мож
вательно, аптамер FАМ МЕ07 можно использо
но получить с помощью флуоресцентной мик
вать для аптацитохимии EGFR. Более того,
роскопии. На рис. 3 показано, что флуоресцент
FАМ МЕ07 можно будет использовать как эс
ный аптамер FАМ МЕ07 может служить хоро
корт аптамер для доставки реагентов в опухоле
шей заменой антителу против EGFR. Во пер
вые клетки ГБМ человека.
вых, очевидно, что аптамер FАМ МЕ07, также
Позитивные результаты аптацитохимии обус
как и антитело Н11, локализуется на мембране
ловили первые удачные попытки использования
клеток А431. Но, в отличие от комплекса с анти
аптагистохимии для визуализации EFGR пози
телами, комплекс аптамер рецептор способен
тивных клеток в тканях опухоли ГБМ пациен
проникать в клетку. Известная повышенная
тов. На рис. 7 показана окраска с помощью FАМ
склонность комплексов EGFR с лигандами к
МЕ07 крио среза ГБМ, полученного из хирурги
эндоцитозу позволяет предположить, что ин
ческого биоптата опухоли пациента НМИЦН им.
тернализация происходит по рецептор опосре
акад. Н.Н. Бурденко. Опухоль гетерогенна,
дованному механизму. Во вторых, отсутствие
EFGR позитивные клетки представляют доволь
заметной конкуренции антител Н11 и аптаме
но значительную часть клеток опухоли и ярко ок
ров FАМ МЕ07 позволяет предположить, что
рашиваются аптамером FАМ МЕ07.
эпитопы EGFR для антител не совпадают с эпи
Таким образом, начало первого диагности
аптами EGFR для аптамеров. И, наконец, за
ческого этапа в аптатераностике ГБМ человека с
30 мин инкубации при комнатной температуре
помощью аптамерной РНК FАМ МЕ07 - визуа
аптамер FАМ МЕ07 попадает не только в ци
лизации целевых EFGR позитивных клонов для
топлазму, но и обнаруживается в ядрышках.
гетерогенной опухоли, оказалось успешным.
Для уточнения такой необычной локализа
Для развития успеха необходимо повысить
ции аптамера FАМ МЕ07 в клетках А431 был
чувствительность детекции, например, с по
проведён опыт только с аптамером в отсутствие
мощью других флуорофоров; поискать более
антитела. На рис. 4 чётко видно свечение апта
эффективные аптамеры; разработать методы
мера FАМ МЕ07 в цитоплазме клеток и в яд
универсального введения метки в различные ап
рышке. Уникальные свойства аптамера FАМ
тамеры; разработать методы введения различ
МЕ07 позволяют надеяться, что его можно будет
ных агентов как для диагностики (напри
использовать в качестве эскорт аптамера для
мер, ПЭТ), так и целевой терапии для эрадика
специфической EGFR опосредованной достав
ции EGFR положительных клонов.
ки различных агентов в клетки.
Дальнейшее развитие аптатераностики для
Как и в случае проточной цитофлуоромет
EGFR положительных клеток опухоли позво
рии, очень показательные данные были получе
лит направлено удалять агрессивные клоны из
ны при сравнении разных типов опухолевых
гетерогенной ГБМ.
клеток и фибробластов, которые содержат раз
ное количество рецептора EGFR на поверхнос
ти благодаря их природе. На рис. 5 показана ок
Финансирование. Работа выполнена при фи
раска аптамером FАМ МЕ07 следующего набо
нансовой поддержке Минобрнауки России
ра клеток: положительный контроль - линей
(грант № 075 15 2020 809 (13.1902.21.0030)) и
ные клетки А431; первичная культура кле
Российского фонда фундаментальных исследо
ток ROZH, полученная из хирургического об
ваний (грант № 18 29 01047 мк).
БИОХИМИЯ том 86 вып. 8 2021
РНК АПТАМЕР ДЛЯ ТЕРАНОСТИКИ ГЛИОМЫ
1229
Благодарности. Авторы благодарят А.А. Би
дей, соответствуют этическим стандартам нацио
зяеву, С.Ф. Дрозда и М.В. Рыжову за постоян
нального комитета по исследовательской этике
ную помощь.
и Хельсинкской декларации 1964 года и её по
Конфликт интересов. Авторы заявляют об от
следующим изменениям или сопоставимым
сутствии конфликта интересов.
нормам этики. От каждого из включенных в ис
Соблюдение этических норм. Все процедуры,
следование участников было получено инфор
выполненные в исследованиях с участием лю мированное добровольное согласие.
СПИСОК ЛИТЕРАТУРЫ
1.
Копылов А. М., Завьялова Е. Г., Павлова Г. В. и Про
aptamer, PLoS One, 6, e20299, doi: 10.1371/journal.
нин И. Н. (2020) Перспективы тераностики глиоблас
pone.0020299.
томы с помощью моноклональных антител к рецепто
18.
Li, N., Wang, Y., Pothukuchy, A., Syrett, A., Husain, N.,
ру эпидермального фактора роста EGFR, Журнал
et al. (2008) Aptamers that recognize drug resistant HIV 1
«Вопросы нейрохирургии» имени Н.Н. Бурденко, 84, 113
reverse transcriptase, Nucleic Acids Res., 36, 6739 6751,
118, doi: 10.17116/neiro202084031113.
doi: 10.1093/nar/gkn775.
2.
Спирин, А. С. (2019) Молекулярная биология. Рибосомы
19.
Wan, Y., Tamuly, D., Allen, P. B., Kim, Y. T., Bachoo, R.,
и биосинтез белка, Лаборатория знаний, Москва.
et al. (2013) Proliferation and migration of tumor cells in
3.
Ellington, A. D., and Szostak, J. W. (1990) In vitro selec
tapered channels, Biomed. Microdevices, 15, 635 643,
tion of RNA molecules that bind specific ligands, Nature,
doi: 10.1007/s10544 012 9721 0.
346, 818 822, doi: 10.1038/346818a0.
20.
Ilyas, A., Asghar, W., Allen, P. B., Duhon, H., Ellington,
4.
Tuerk, C., and Gold, L. (1990) Systematic evolution of lig
A. D., and Iqbal, S. M. (2012) Electrical detection of can
ands by exponential enrichment: RNA ligands to bacterio
cer biomarker using aptamers with nanogap break junc
phage T4 DNA polymerase, Science, 249, 505510,
tions, Nanotechnology, 23, 275502, doi: 10.1088/0957
doi: 10.1126/science.2200121.
4484/23/27/275502.
5.
Robertson, D. L., and Joyce, G. F. (1990) Selection in vitro
21.
Wan, Y., Liu, Y., Allen, P. B., Asghar, W., Mahmood,
of an RNA enzyme that specifically cleaves single stranded
M. A., et al. (2012) Capture, isolation and release of can
DNA, Nature, 344, 467 468, doi: 10.1038/344467a0.
cer cells with aptamer functionalized glass bead array, Lab.
6.
Антипова О. М., Завьялова Е. Г., Головин А. В., Павло
Chip., 12, 4693 4701, doi: 10.1039/c2lc21251j.
ва Г. В., Копылов А. М., Решетников Р. В. (2018) Успе
22.
Wan, Y., Mahmood, M. A., Li, N., Allen, P. B., Kim, Y. T.,
хи применения модифицированных нуклеотидов в
et al. (2012) Nanotextured substrates with immobilized
технологии SELEX, Биохимия,
10,
11611172,
aptamers for cancer cell isolation and cytology, Cancer,
doi: 10.1134/S0320972518100020.
118, 1145 1154, doi: 10.1002/cncr.26349.
7.
Метелев В. Г., Орецкая Т. С. (2021) Модифицирован
23.
Avutu, V. (2010) Avidity Effects of MinE07, an AntiBEGFR
ные олигонуклеотиды: новые структуры, новые свой
Aptamer, on Binding to A431 Cells, Texas Scholar Works
ства, новые области применения, Биоорганическая хиB
University of Texas at Austin.
мия, 47, 179 183, doi: 10.31857/S0132342321020172.
24.
Kim, H. J., Park, J. Y., Lee, T. S., Song, I. H., Cho, Y. L.,
8.
Mendelsohn, J. (2004) EGF receptors as a target for can
et al. (2019) PET imaging of HER2 expression with an
cer therapy, Trans. Am. Clin. Climatol. Assoc., 115, 249 253.
18F fluoride labeled aptamer, PLoS One, 14, e0211047,
9.
Carpenter, G. (1983) The biochemistry and physiology of
doi: 10.1371/journal.pone.0211047.
the receptor kinase for epidermal growth factor, Mol. Cell.
25.
Cheng, S., Jacobson, O., Zhu, G., Chen, Z., Liang, S. H.,
Endocrinol., 31, 1 19, doi: 10.1016/0303 7207(83)90027 8.
et al. (2019) PET imaging of EGFR expression using an
10.
Carpenter, G. (1984) Properties of the receptor for epider
18F labeled RNA aptamer, Eur. J. Nucl. Med. Mol. Imaging,
mal growth factor, Cell, 37, 357 358, doi: 10.1016/0092
46, 948 956, doi: 10.1007/s00259 018 4105 1. Erratum in:
8674(84)90365 9.
Eur. J. Nucl. Med. Mol. Imaging, (2018) 45, 2245.
11.
Carpenter, G., and Cohen, S. (1979) Epidermal growth
26.
Melancon, M. P., Zhou, M., Zhang, R., Xiong, C.,
factor, Annu. Rev. Biochem., 48, 193 216, doi: 10.1146/
Allen, P., et al. (2014) Selective uptake and imaging of
annurev.bi.48.070179.001205.
aptamer and antibody conjugated hollow nanospheres
12.
Wikstrand, C. J., McLendon, R. E., Friedman, A. H., and
targeted to epidermal growth factor receptors overex
Bigner, D. D. (1997) Cell surface localization and density
pressed in head and neck cancer, ACS Nano, 8, 4530 4538,
of the tumor associated variant of the epidermal growth
doi: 10.1021/nn406632u.
factor receptor, EGFRvIII, Cancer Res., 57, 4130 4140.
27.
Ray, P., Cheek, M. A., Sharaf, M. L., Li, N., Ellington,
13.
Wan, Y., Kim, Y. T., Li, N., Cho, S. K., Bachoo, R., et al.
A. D., et al. (2012) Aptamer mediated delivery of
(2010) Surface immobilized aptamers for cancer cell isola
chemotherapy to pancreatic cancer cells, Nucleic Acid
tion and microscopic cytology, Cancer Res., 70, 9371 9380,
Ther., 22, 295 305, doi: 10.1089/nat.2012.0353.
doi: 10.1158/0008 5472.CAN 10 0568.
28.
Wang, Y. L., Chang, L. C., Chen, K. B., and Wang, S. C.
14.
Li, N., Larson, T., Nguyen, H. H., Sokolov, K. V., and
(2021) Aptamer guided targeting of the intracellular long
Ellington, A. D. (2010) Directed evolution of gold
noncoding RNA HOTAIR, Am. J. Cancer Res., 11, 945 954.
nanoparticle delivery to cells, Chem. Commun. (Camb)., 46,
29.
Opazo, F., Levy, M., Byrom, M., Schäfer, C., Geisler, C.,
392 394, doi: 10.1039/b920865h.
et al. (2012) Aptamers as potential tools for super resolu
15.
Goldstein, N. I., Prewett, M., Zuklys, K., Rockwell, P.,
tion microscopy, Nat. Methods, 9, 938
939, doi: 10.1038/
and Mendelsohn, J. (1995) Biological efficacy of a
nmeth.2179.
chimeric antibody to the epidermal growth factor receptor
30.
Strauss, S., Nickels, P. C., Strauss, M. T., Jimenez
in a human tumor xenograft model, Clin. Cancer Res., 1,
Sabinina, V., Ellenberg, J., et al. (2018) Modified aptamers
1311 1318.
enable quantitative sub 10 nm cellular DNA PAINT
16.
Groner, B., Hartmann, C., and Wels, W.
(2004)
imaging, Nat. Methods, 15,
685
688, doi: 10.1038/
Therapeutic antibodies, Curr. Mol. Med., 4, 539 547,
s41592 018 0105 0.
doi: 10.2174/1566524043360483.
31.
Delcanale, P., Porciani, D., Pujals, S., Jurkevich, A.,
17.
Li, N., Nguyen, H. H., Byrom, M., and Ellington, A. D.
Chetrusca, A., et al. (2020) Aptamers with tunable affi
(2011) Inhibition of cell proliferation by an anti EGFR
nity enable single molecule tracking and localization of
БИОХИМИЯ том 86 вып. 8 2021
1230
КОПЫЛОВ и др.
membrane receptors on living cancer cells, Angew. Chem.
ization of epidermal growth factor in human carcinoma
Int. Ed. Engl., 59, 1854618555, doi: 10.1002/anie.
cells A 431, Proc. Natl. Acad. Sci. USA, 75, 3317 3321,
202004764.
doi: 10.1073/pnas.75.7.3317.
32.
Esposito, C. L., Passaro, D., Longobardo, I.,
40. Obaid, G., Samkoe, K., Tichauer, K., Bano, S., Park, Y.,
Condorelli, G., Marotta, P., et al. (2011) A neutralizing
et al. (2021) Is tumor cell specificity distinct from tumor
RNA aptamer against EGFR causes selective apoptotic cell
selectivity in vivo? A quantitative NIR molecular imaging
death, PLoS One, 6, e24071, doi: 10.1371/journal.
analysis of nanoliposome targeting, Nano. Res., 14, 1344
pone.0024071.
1354, doi: 10.1007/s12274 020 3178 x.
33.
Passariello, M., Camorani, S., Vetrei, C., Ricci, S.,
41. Davidson, N. E., Gelmann, E. P., Lippman, M. E., and
Cerchia, L., and De Lorenzo, C. (2020) Ipilimumab and
Dickson, R. B. (1987) Epidermal growth factor receptor
its derived EGFR aptamer based conjugate induce effi
gene expression in estrogen receptor positive and negative
cient NK cell activation against cancer cells, Cancers
human breast cancer cell lines, Mol. Endocrinol., 1, 216
(Basel), 12, 331, doi: 10.3390/cancers12020331.
223, doi: 10.1210/mend 1 3 216.
34.
Peng, L., Liang, Y., Zhong, X., Liang, Z., Tian, Y., et al.
42. Pallan, P. S., Greene, E. M., Jicman, P. A., Pandey, R. K.,
(2020) Aptamer conjugated gold nanoparticles targeting
Manoharan, M., et al. (2011) Unexpected origins of the
epidermal growth factor receptor variant III for the
enhanced pairing affinity of 2′ fluoro modified RNA,
Treatment of glioblastoma, Int. J. Nanomedicine, 15, 1363
Nucleic Acids Res., 39, 3482 3495, doi: 10.1093/nar/
1372, doi: 10.2147/IJN.S238206.
gkq1270.
35.
Zavyalova, E., Turashev, A., Novoseltseva, A.,
43. Murray, J. B., Dunham, C. M., and Scott, W. G. (2002)
Legatova, V., Antipova, O., et al. (2020) Pyrene modified
A pH dependent conformational change, rather than the
DNA aptamers with high affinity to wild type EGFR and
chemical step, appears to be rate limiting in the hammer
EGFRvIII, Nucleic Acid Ther., 30, 175 187, doi: 10.1089/
head ribozyme cleavage reaction, J. Mol. Biol., 315, 121
nat.2019.0830.
130, doi: 10.1006/jmbi.2001.5145.
36.
Wang, T., Philippovich, S., Mao, J., and Veedu, R. N.
44. Piao, X., Wang, H., Binzel, D. W., and Guo, P. (2018)
(2019) Efficient epidermal growth factor receptor targeting
Assessment and comparison of thermal stability of phos
oligonucleotide as a potential molecule for targeted cancer
phorothioate DNA, DNA, RNA, 2′ F RNA, and LNA in
therapy, Int. J. Mol. Sci., 20, 4700, doi: 10.3390/
the context of Phi29 pRNA 3WJ, RNA, 24, 67 76,
ijms20194700.
doi: 10.1261/rna.063057.117.
37.
Reuter, J. S., and Mathews, D. H. (2010) RNA structure: soft
45. Li, N., Ebright, J. N., Stovall, G. M., Chen, X., Nguyen
ware for RNA secondary structure prediction and analysis,
H. H., et al. (2009) Technical and biological issues relevant
BMC Bioinformatics, 11, 129, doi: 10.1186/1471 2105 11 129.
to cell typing with aptamers, J. Proteome Res., 8, 2438
38.
Zok, T., Antczak, M., Zurkowski, M., Popenda, M.,
2448, doi: 10.1021/pr801048z.
Blazewicz, J., et al. (2018) RNApdbee 2.0: multifunction
46. Cochran, J. R., Kim, Y. S., Olsen, M. J., Bhandari, R., and
al tool for RNA structure annotation, Nucleic Acids Res.,
Wittrup, K. D. (2004) Domain level antibody epitope
46, W30 W35, doi: 10.1093/nar/gky314.
mapping through yeast surface display of epidermal growth
39.
Haigler, H., Ash, J. F., Singer, S. J., and Cohen, S. (1978)
factor receptor fragments, J. Immunol. Methods, 287, 147
Visualization by fluorescence of the binding and internal
158, doi: 10.1016/j.jim.2004.01.024.
RNA APTAMER FOR THERANOSTICS
OF HUMAN BRAIN GLIOBLASTOMA
А. М. Kopylov1*, L. V. Fab2, О. Antipova1, Е. А. Savchenko3, А. V. Revishchin2, V. V. Parshina2,
S. V. Pavlova2, I. I. Kireev1, А. V. Golovin1,4, D. Y. Usachev3, and G. V. Pavlova2,3,4
1 Faculty of Chemistry, Lomonosov Moscow State University, 119991 Moscow, Russia; EBmail: kopylov.alex@gmail.com
2 Institute of Higher Nervous Activity and Neurophysiology, Russian Academy of Sciences, 117485 Moscow, Russia
3 Institution “Burdenko National Medical Research Center of Neurosurgery”
of the Ministry of Health of the Russian Federation, 125047 Moscow, Russia
4 Sechenov First Moscow State Medical University, 11999 Moscow, Russia
Conventional approaches for studying and molecular typing of tumors include PCR, blotting, omics, immunocyto
chemistry and immunohistochemistry; the last two methods are the most common ones because they detect protein
marker and localize it within the cell. The study has demonstrated RNA aptamer abilities as alternatives to mono
clonal antibodies for aptacytochemistry and aptahistochemistry of human glioblastoma multiform (GBM). 2′ F
pyrimidyl RNA aptamer ME07, 48 nucleotides long, which is specific to epidermal growth factor receptor (EGFR,
ErbB1, Her1). Application of flow cytometry with fluorescein derivative FAM ME07 has proved aptamer specificity
to the receptor within the cells, it has estimated semi quantitatively apparent dissociation constant with the receptor
within the cells, as well as number of EGFR on the cell surface. The following cell lines have been used having dif
ferent EGFR copy number: A431 (106 receptor copies per cell), U87 (104 receptor copies per cell), MCF7 (103 recep
tor copies per cell), primary culture cells of glioblastoma of patient ROZH. With fluorescent microscopy it has been
shown directly interactions of FAM ME07 with the receptor within A431 cells with the following internalization into
the cytoplasm, and then into the nucleolus, which opens possibilities of application of ME07 as escort aptamer to
deliver of therapeutic reagents into the tumor cells. FAM ME07 efficiently stains sections of clinical specimens of
patient GBM, and it precisely indicates EGFR positive clones within heterogeneous tumor, which is a base to move
research to study animal models of GBM.
Keywords: 2′ fluoro pyrimidyl RNA aptamer, EGFR, human glioblastoma, cell cultures, flow cytometry, fluores
cence microscopy
БИОХИМИЯ том 86 вып. 8 2021