БИОХИМИЯ, 2023, том 88, вып. 10, с. 2002 - 2013
УДК 577.151.3
НОВАЯ ДВУХДОМЕННАЯ ЛАККАЗА СО СРЕДНИМ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМ ПОТЕНЦИАЛОМ:
ФИЗИКО-ХИМИЧЕСКИЕ И СТРУКТУРНЫЕ СВОЙСТВА
© 2023 Л.И. Трубицина1*, И.В. Трубицин1, А.В. Лисов1, А.Г. Габдулхаков2,
А.Г. Заварзина3, О.В. Белова1, А.П. Ларионова1, С.В. Тищенко2, А.А. Леонтьевский1
1 Федеральный исследовательский центр «Пущинский научный центр биологических исследований РАН»,
Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН,
142290 Пущино, Московская обл., Россия; электронная почта: lyubov_yurevich@mail.ru
2 Институт белка РАН, 142290 Пущино, Московская обл., Россия
3 Московский государственный университет имени М.В. Ломоносова, факультет почвоведения,
119234 Москва, Россия
Поступила в редакцию 15.05.2023
После доработки 04.09.2023
Принята к публикации 08.09.2023
Ген ранее неисследованной двухдоменной лакказы был идентифицирован в геноме актинобакте-
рии Streptomyces carpinensis ВКМ Ас-1300. Двухдоменная лакказа, названная ScaSL, была продуци-
рована в гетерологичной системе экспрессии (штамм Escherichia coli M15 [pREP4]). Фермент был
очищен до гомогенного состояния с использованием аффинной хроматографии. Лакказа ScaSL,
как и большинство двухдоменных лакказ, проявляла активность в форме гомотримера. Однако,
в отличие от большинства двухдоменных лакказ, она была активна и в мультимерных формах.
Фермент проявлял максимальную активность при 80 °C и был термостабилен. Время полуинакти-
вации ScaSL при 80 °C составило 40 мин. Лакказа окисляла нефенольное органическое соедине-
ние 2,2′-азинобис(3-этилбензотиазолин сульфонат) (АБТС) с максимальной скоростью при рН 4,7,
окисляла фенольное соединение 2,6-диметоксифенол с максимальной скоростью при pH 7,5.
Стабильность лакказы наблюдалась в диапазоне рН 9-11. При рН 7,5 лакказа слабо ингибирова-
лась азидом натрия, фторидом натрия и хлоридом натрия; при рН 4,5 лакказа полностью ингиби-
ровалась 100 мМ азидом натрия. Значения Km и kcat фермента для АБТС составили 0,1 мМ и 20 с-1,
а для 2,6-диметоксифенола - 0,84 мМ и 0,36 с-1 соответственно. ScaSL катализировала полимери-
зацию гуминовых кислот и лигнина. Окислительно-восстановительный потенциал лакказы соста-
вил 0,472 ± 0,007 В. Таким образом, лакказа ScaSL - первая охарактеризованная двухдоменная
лакказа со средним окислительно-восстановительным потенциалом. Кристаллическая структура
ScaSL была определена с разрешением 2,35 Å. Сравнительный анализ структур ScaSL и других
двухдоменных лакказ позволил предположить, что средний потенциал ScaSL может быть свя-
зан с конформационными различиями в положениях боковых групп аминокислот в позиции 230
(в нумерации ScaSL), относящихся ко второй координационной сфере атома меди Т1-центра.
КЛЮЧЕВЫЕ СЛОВА: двухдоменная лакказа, Streptomyces carpinensis, клонирование, кристаллизация,
термостабильность, окислительно-восстановительный потенциал.
DOI: 10.31857/S0320972523100184, EDN: OYBJZH
ВВЕДЕНИЕ
секомых [3], лишайников [4], водорослей [5].
В структурном отношении лакказы можно
Лакказы - медьсодержащие оксидазы, ко-
подразделить на двухдоменные (2д) и трёхдо-
торые катализируют восстановление кислорода
менные (3д) ферменты [6]. 2д-Лакказы обна-
до воды, при этом окисляют широкий спектр
ружены только у бактерий.
органических и неорганических соединений [1].
Лакказы выполняют различные функции у
Лакказы широко распространены у расте-
живых организмов: участвуют в синтезе вторич-
ний, грибов и бактерий [2], обнаружены у на- ных метаболитов, споруляции, патогенезе [7].
Принятые сокращения: 2д - двухдоменная(ые); 3д - трёхдоменная(ые); 2,6-ДМФ - 2,6-диметоксифенол; АБТС -
2,2′-азинобис(3-этилбензотиазолин сульфонат); ОВП -окислительно-восстановительный потенциал.
* Адресат для корреспонденции.
2002
СТРУКТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛАККАЗЫ ScaSL
2003
Бактерии используют лакказы для трансфор-
биотехнологический потенциал (они термо-
мации полимерных соединений, таких как лиг-
стабильны, окисляют фенольные соединения
нин или гуминовые вещества (органические
в нейтральной или щелочной среде, стабиль-
вещества, содержащиеся в почвенных и вод-
ны в широком диапазоне величин рН, устой-
ных экосистемах) [8, 9, 10]. Грибные 3д-лак-
чивы к действию классических ингибиторов
казы окисляют гуминовые вещества и лигнин,
лакказ), они активно не используются в про-
что приводит к их полимеризации или деполи-
мышленности из-за низкого ОВП. Исходя из
меризации [8, 11]. Бактериальные 2д-лакказы
этого, поиск новых 2д-лакказ со средним или
также способны трансформировать лигнин и
высоким ОВП является актуальной задачей.
гуминовые вещества, но эти субстраты толь-
ко полимеризуются под действием
2д-лак-
каз [12, 13]. Бактериальные 2д-лакказы - тер-
МАТЕРИАЛЫ И МЕТОДЫ
мостабильные ферменты, которые способны
выдерживать инкубирование при 70 °C, 80 °C
Клонирование гена
2д-лакказы. Штамм
и даже при 90 °C [14]. В отличие от 3д-лакказ
Streptomyces carpinensis ВКМ Ac-1300 (также
грибов, которые стабильны при кислых или
известный как =DSM 43835) был получен из
нейтральных значениях рН [15, 16], бактери-
Всероссийской коллекции микроорганизмов
альные 2д-лакказы стабильны при нейтраль-
ных или щелочных значениях рН
[17, 18].
при 29 °C (pH 7,2) в среде следующего состава
К тому же 2д-лакказы окисляют фенольные
(г/л): крахмал - 20,0; K2HPO4 - 0,5; KNO3 - 1;
соединения при нейтральных или щелочных
NaCl - 0,2; MgSO4 × 7 H2O - 0,3; CaCO3 - 0,5;
значениях pH [18, 19, 20], тогда как 3д-лакказы
FeSO4 × 7 H2O - 0,01; агар - 20. Полученную
окисляют фенольные соединения преимуще-
биомассу использовали для выделения геном-
ственно в кислой среде [21]. Ещё одно важное
ной ДНК. Выделение геномной ДНК прово-
различие между 2д- и 3д-лакказами - устой-
дили с использованием коммерческого набо-
чивость 2д-лакказ к действию классических
ра («diaGene», Россия) в соответствии с ин-
ингибиторов 3д-лакказ. При кислых значениях
струкцией производителя. Полноразмерную
рН азиды и фториды в низких концентрациях
последовательность гена идентифицировали
способны практически полностью ингиби-
и анализировали с помощью онлайн-серви-
ровать активность
3д-лакказ
[22, 23], тогда
как 2д-лакказы проявляют активность даже
Ген без последовательности сигнального пеп-
при 10 мМ концентрации данных ингибито-
тида амплифицировали с использованием
ров [19]. Более того, при щелочных значениях
геномной ДНК в качестве матрицы, пря-
рН эти ингибиторы не влияют на активность
мого и обратного праймеров
(1300F3nS
-
2д-лакказ или могут незначительно повышать
ACCTCGGACAAGCCCG, 1300R3/2 - TCACATG
активность ферментов [20, 24].
CCGGGCATG) и Taq-ДНК-полимеразы («Сиб-
Известно, что 3д-лакказы грибов исполь-
Энзим», Россия). Программа амплификации
зуются в биотехнологических процессах [25]:
была следующей: 1) начальная денатурация:
ферменты применяют для биоремедиации
95 °С, 5 мин; 2) 35 циклов: денатурация - 95 °С,
сточных вод текстильных заводов, для отбе-
30 с; отжиг - 50 °С, 30 с; элонгация - 72 °С,
ливания бумажной массы [7, 26], для хими-
1 мин; 3) финальная элонгация: 72 °С, 2 мин.
ческого синтеза [27], в пищевой промышлен-
Продукт ПЦР требуемой величины очищали
ности [28], для создания биосенсоров [29].
из реакционной смеси с использованием ком-
Такое широкое применение
3д-лакказ воз-
мерческого набора («diaGene») в соответствии
можно благодаря их низкой субстратной спе-
с инструкцией производителя. Последователь-
цифичности [30] и высокому окислительно-
ность гена подтверждали секвенированием.
восстановительному потенциалу (ОВП) [31].
Для клонирования гена в вектор pQE-30
Известно, что лакказа способна окислять со-
(«Qiagen», Германия) по сайтам эндонуклеаз
единения, ОВП которых равен или чуть выше
рестрикции SacI и HindIII использовали сле-
ОВП Т1-центра фермента. Исходя из этого,
дующие праймеры: 1300Fe3nS - AGTGAGCTC
более высокий ОВП позволяет применять фер-
ACCTCGGACAAGCCCG и 1300Re3 - TCA
мент в биотехнологических процессах. Уста-
AAGCTTTCACATGCCGGGCATG (сайты SacI
новлено, что все 2д-лакказы, описанные к
и HindIII выделены подчёркиванием). Усло-
настоящему времени - низкопотенциальные
вия амплификации были следующими: 95 °C,
ферменты [32]. Величина ОВП 2д-лакказ со-
5 мин; 35 циклов: 95 °C, 30 с, 50 °C, 30 с, 72 °C,
ставляет 0,33-0,45 В. Поэтому, несмотря на
1 мин; 72 °C, 2 мин. Ампликон обрабатывали
тот факт, что 2д-лакказы имеют определённый
эндонуклеазами рестрикции SacI и HindIII
БИОХИМИЯ том 88 вып. 10 2023
19*
2004
ТРУБИЦИНА и др.
(«Thermo Fisher Scientific», США) согласно
по скорости окисления 2,2′-азинобис(3-этил-
инструкции производителя. Затем ставили
бензотиазолин сульфоната) (АБТС) при 420 нм
реакцию лигирования вектора и ампликона
(ε420 = 36 000 M-1 × см-1) [34] и
2,6-диметок-
при +15 °C с использованием T4-ДНК-лигазы
сифенола
(2,6-ДМФ) при
469 нм (ɛ469 =
(«Thermo Fisher Scientific»). Лигазной смесью,
= 49 600 M-1 × см-1) [35] в 50 мМ буфере Britton-
содержащей конструкцию pQE::scasl, транс-
Robinson [36]. Спектр поглощения измеряли в
формировали компетентные клетки E. coli
диапазоне длин волн от 700 до 300 нм на спек-
M15 [pREP4] («QiaGen»). Плазмиды с геном-
трофотометре UV-1800 («Shimadzu», Япония).
вставкой получали из ночной культуры транс-
Оптимумы рН измеряли с АБТС и 2,6-ДМФ
формантов. Последовательность гена-вставки
в 50 мМ буфере Britton-Robinson (диапазон
проверяли на отсутствие мутаций секвениро-
величин рН: 3,0-5,5 для АБТС, 5,5-9,0 для
ванием.
2,6-ДМФ). Температурный оптимум измеряли
Экспрессия и очистка ScaSL. Для получе-
в температурном диапазоне 30-80 °C в 50 мМ
ния рекомбинантного белка ScaSL 1 мл «ноч-
буфере Britton-Robinson с 0,2 мМ АБТС при
ной культуры» трансформантов инокулирова-
рН 4,5. Стабильность фермента измеряли при
ли в 200 мл среды LB, содержащей ампициллин
рН 3, 5, 7, 9, 11 в аналогичных условиях в тече-
(100 мкг/мл) и канамицин (25 мкг/мл). Клет-
ние недели. Термостабильность ScaSL опре-
ки выращивали при 37 °C и 150 об./мин до
деляли, измеряя остаточную активность фер-
оптической плотности 1,0 при 600 нм, затем
мента после часа инкубирования при 70 °C,
вносили индуктор - 0,2 мМ ИПТГ, а также
80 °C и 90 °C в аналогичных условиях. Влия-
1 мМ CuSO4. После
15 ч роста температуру
ние азида натрия (NaN3), хлорида натрия
снижали до 20 °C и выращивали культуру без
(NaCl) и фторида натрия (NaF) в концентра-
перемешивания 24 ч. Клетки осаждали цен-
циях 1, 10 и 100 мМ на лакказную активность
трифугированием при комнатной температуре
определяли при рН 4,7 по скорости окисле-
(7000 об./мин, 30 мин). Осадок ресуспендиро-
ния 0,2 мМ АБТС, при рН 7,5 - по скорости
вали в буфере 1 (500 мМ NaCl, 20 мМ ими-
окисления 1 мМ 2,6-ДМФ. Кинетические кон-
дазол, 20 мМ Tris-HCl, pH 8,0) и разрушали
станты определяли для субстратов АБТС и 2,6-
ультразвуком. Клеточный экстракт, получен-
ДМФ при рН 4,7 и рН 7,5 соответственно, при
ный после центрифугирования (10 000 об./мин,
30 °C. Расчёт констант проводили в программе
40 мин), наносили на колонку HisTrapTMFF
Sigma Plot 11.0. ОВП лакказы ScaSL измеряли
(«GE Healthcare», США) с Ni-сефарозой. Колон-
методом редокс-титрования с использованием
ку уравновешивали с буфером 1, промыва-
редокс-пары K3[Fe(CN)6] / K4[Fe(CN)6] (E′° =
ли пятью объёмами буфера 2 (500 мМ NaCl,
= 0,433 В) в атмосфере азота [14, 37]. ОВП
50 мМ имидазол, 20 мМ Tris-HCl, pH 8,0) для
Т1-центра рассчитывали согласно уравнению
удаления белков, неспецифично связанных с
Нернста в программе Origin Pro 2015 («Origin-
носителем, и элюировали лакказу буфером 3
Lab Corporation», США). Средние значения и
(500 мМ NaCl, 300 мМ имидазол, 20 мМ Tris-
стандартные отклонения рассчитывали не ме-
HCl, pH 8,0). Фракции, содержащие синий
нее чем для трёх повторностей.
ферментный препарат, диализовали против
Реакция 2д-лакказы с полимерными субстра-
20 мМ Tris-HCl (pH 9,0). Фермент хранили
тами. Для эксперимента использовали гуми-
при +8 °C. Концентрацию белка определяли
новую кислоту из торфа («Merck», Германия),
с использованием коэффициента молярной
натриевую соль лигносульфокислоты («Sigma-
экстинкции, рассчитанного на основе после-
Aldrich», США). Гуминовую кислоту из дерно-
довательности белка в программе Vector NTI
во-подзолистой почвы (Stagnic Retisol, Loamic,
(«Life Technologies», США). Полученное
Humic, согласно мировой реферативной базе
значение коэффициента для ScaSL: ε280 =
почвенных ресурсов, WRB 2015) с зольностью
= 38 930 M-1 × см-1. Молекулярную массу мо-
3% получали в атмосфере N2, как описано ра-
номерной формы фермента определяли при
нее [38]. Реакцию 2д-лакказы с полимерными
помощи денатурирующего электрофореза в
веществами в щелочной среде и анализ про-
12%-ном ПААГ [33]. Молекулярную массу ак-
дуктов реакции методом гель-фильтрации на
тивной формы фермента определяли при по-
колонке с Sephadex G-75 проводили, как опи-
мощи нативного градиентного электрофореза,
сано ранее [13].
как описано ранее [14]. Визуализацию актив-
Кристаллизация. Кристаллизацию осущест-
ности фермента проводили согласно методике,
вляли при
24 °C с использованием метода
описанной ранее [14].
диффузии паров в модификации
«висящая
Характеристика ScaSL. Активность лак-
капля» на силиконизированных стёклах в
казы измеряли при комнатной температуре
планшетах Linbro
(«Molecular Dimensions»,
БИОХИМИЯ том 88 вып. 10 2023
СТРУКТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛАККАЗЫ ScaSL
2005
Великобритания). Кристаллизационные кап-
ли готовили путём смешивания 3 мкл белка
с концентрацией 14 мг/мл и 1 мкл раствора,
содержащего 20% (v/v) смеси ПЭГ (PEG Smear
Broad), 0,1 М цитрата натрия, рН 5,6, 0,15 М
ацетата магния (условие № 33 набора BCS-1,
«Molecular Dimensions»). Перед заморажива-
нием кристаллы вымачивали в криорастворе,
состоящем из 20% ПЭГ 4000, 20% глицерина,
0,1 М ацетата натрия, рН 4,6, 0,16 М сульфата
аммония (условия № 20 набора Crystal Screen
Cryo, «Hampton Research», США).
Сбор и обработка данных. Сбор дифрак-
ционных данных проводили посредством ла-
бораторного источника рентгеновского излу-
чения, состоящего из генератора с вращаю-
щимся анодом Proteum X8, оснащённого опти-
кой Montel 200 («Bruker», США) и детектором
PLATINUM 135 («Bruker»), в Институте бел-
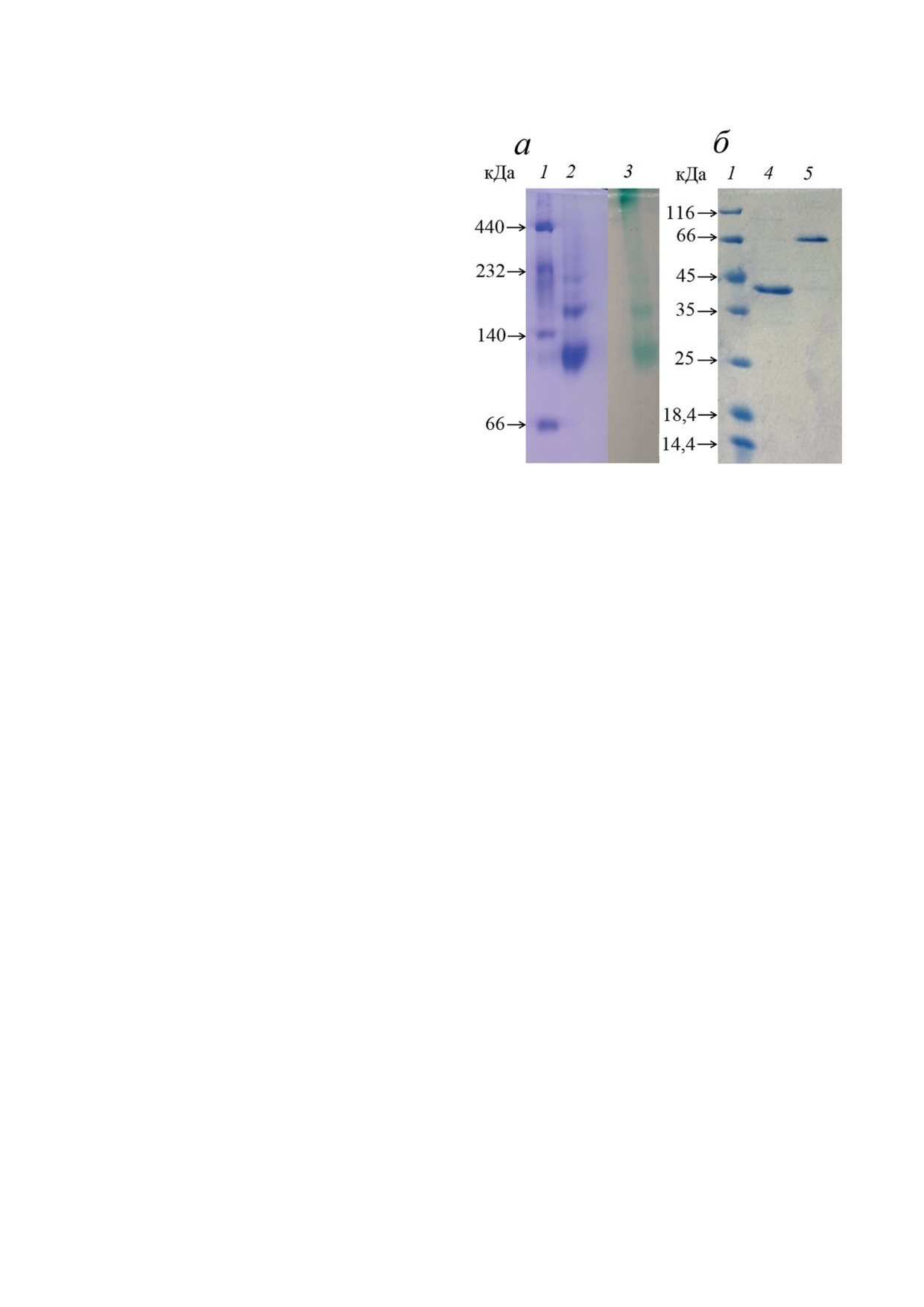
Рис. 1. Нативный градиентный (3-15%) электрофорез
ка РАН. Данные обрабатывали и усредняли
в ПААГ (a) и ДСН-ПААГ-электрофорез (б) лакказы
с помощью программы PROTEUM2 (http://
ScaSL из S. carpinensis ВКМ Ac-1300. 1 - Маркеры моле-
кулярной массы; 2 - окрашивание белка с Coomassie
Brilliant Blue R-250; 3 - зимограмма лакказной актив-
Решение и уточнение кристаллической струк-
ности с АБТС; 4 - фермент после очистки, кипячённый
туры. Пространственную структуру лакказы
с β-меркаптоэтанолом и ДСН; 5 - фермент после очист-
определили методом молекулярного замеще-
ки с β-меркаптоэтанолом и ДСН, без кипячения
ния с использованием программы Phaser [39].
В качестве стартовой модели использовали
структуру 2д-лакказы Streptomyces lividans, опре-
водили в одну стадию при помощи аффинной
делённую с разрешением 2,4 Å (PDB ID 4GYB).
хроматографии. Чистый белковый препарат
Структуру ScaSL уточняли с помощью програм-
имел тёмно-синий цвет. Нативный электро-
мы Phenix.refine [40]. Ручную правку струк-
форез в ПААГ показал, что белковая полоса
туры проводили в программе Coot [41]. Каче-
соответствовала молекулярной массе 100 кДа
ство уточнения оценивали с помощью сервера
(белок был активен в гомотримерной форме
MolProbity [42]. Атомные координаты модели
(рис. 1, а)).
и структурные факторы лакказы депонирова-
Однако на электрофорезе детектировались
ли в банке данных белков PDB, ID 8AIP. Рис. 5
другие полосы активного белка. Это свидетель-
и 6 подготовили с использованием программы
ствовало о том, что белок олигомеризовался с
PyMOL Molecular Graphics System v2.5 (https://
образованием активных комплексов. Рекомби-
pymol.org/2/) [43].
нантный ScaSL, кипячённый с β-меркаптоэта-
нолом, имел молекулярную массу 37 кДа, соглас-
но данным электрофореза в ПААГ с ДС-Na;
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
фермент с β-меркаптоэтанолом без кипячения
имел молекулярную массу 68 кДа (рис. 1, б).
Клонирование лакказного гена, его экс-
Это указывало на значительное количество во-
прессия и очистка ScaSL. Ген, кодирующий
дородных связей, участвующих во взаимодей-
2д-лакказу ScaSL, был клонирован из штамма
ствии отдельных субъединиц фермента.
S. carpinensis ВКМ Ас-1300 в плазмиду pQE-30.
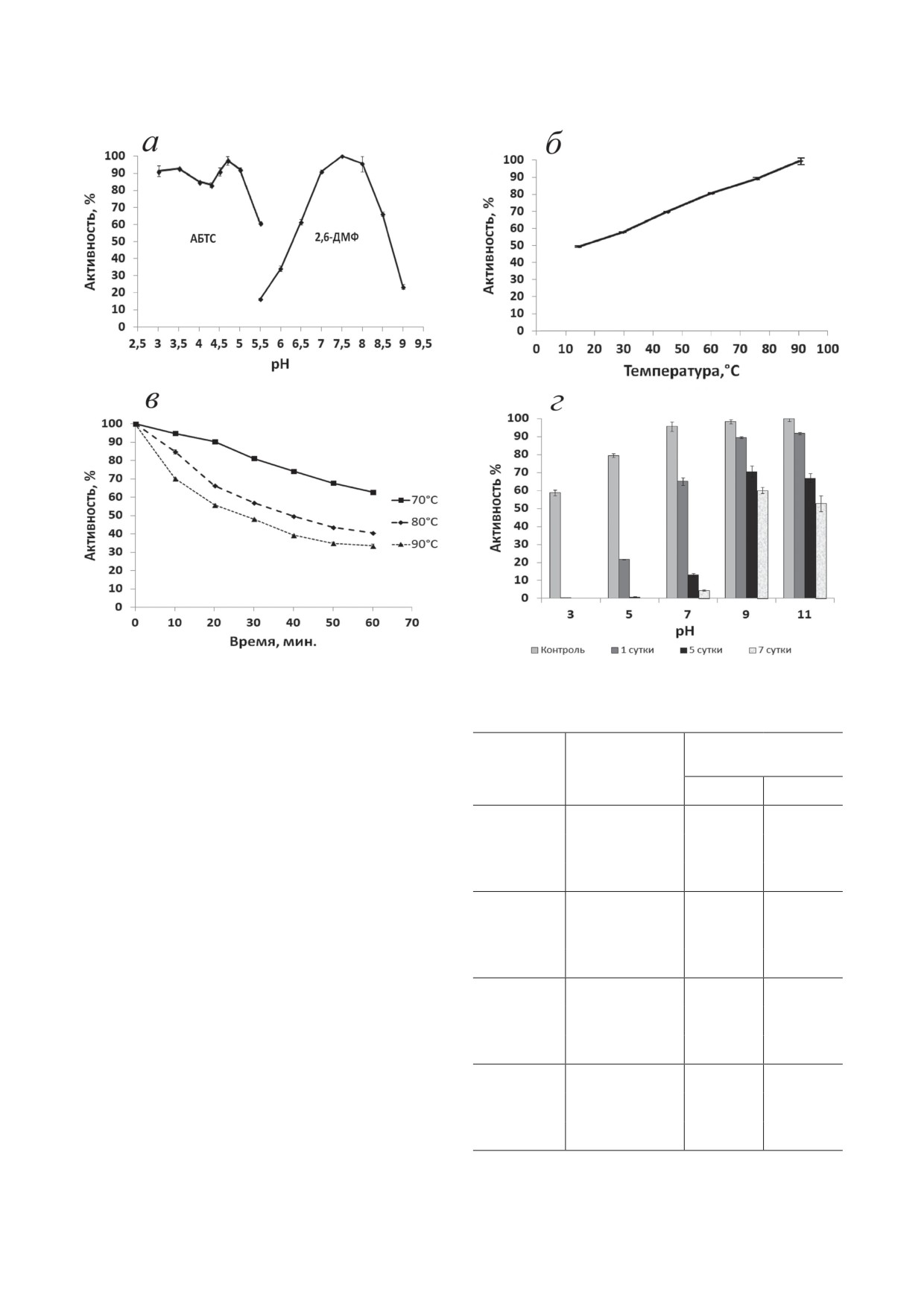
Характеристика лакказы ScaSL. Лакказа
Анализ аминокислотной последовательности
ScaSL окисляла типичные субстраты лакказ:
ScaSL показал наличие сигнального пептида
2,6-ДМФ и АБТС. Максимальная активность
для транслокации лакказы по ТАТ-секретор-
лакказы в отношении АБТС наблюдалась при
ному пути (1-37 а.о.). В последовательности
рН 4,7; в отношении 2,6-ДМФ - при рН 7,5
также присутствовали консервативные амино-
(рис. 2, а). Температурный оптимум фермента
кислоты: десять гистидинов и один цистеин,
составлял 80 °C (рис. 2, б). Остаточная актив-
координирующие четыре атома меди.
ность лакказы после часа инкубирования при
Клетки E. coli, несущие рекомбинантный
70 °С, 80 °C и 90 °С составляла 62%, 40% и 33%
вектор, продуцировали ScaSL с высоким выхо-
соответственно (рис. 2, в). Фермент сохранял
дом: около 100 мг с 1 л культуры. Очистку про-
60% и 52% своей исходной активности после
БИОХИМИЯ том 88 вып. 10 2023
2006
ТРУБИЦИНА и др.
Рис. 2. Биохимические свойства ScaSL. Оптимумы рН фермента по АБТС и 2,6-ДМФ (a); температурный оптимум
активности лакказы (б); термостабильность при 70, 80 и 90 °C (в); стабильность при различных рН (г)
Таблица 1. Влияние ингибиторов на активность лакказы
одной недели инкубации при значениях рН 9
и рН 11 соответственно (рис. 2, г). При инку-
Остаточная
Концентрация,
активность, %
бации лакказы при рН 3,0 фермент полностью
Ингибитор
мМ
инактивировался в течение 24 ч.
pH 4,7
pH 7,5
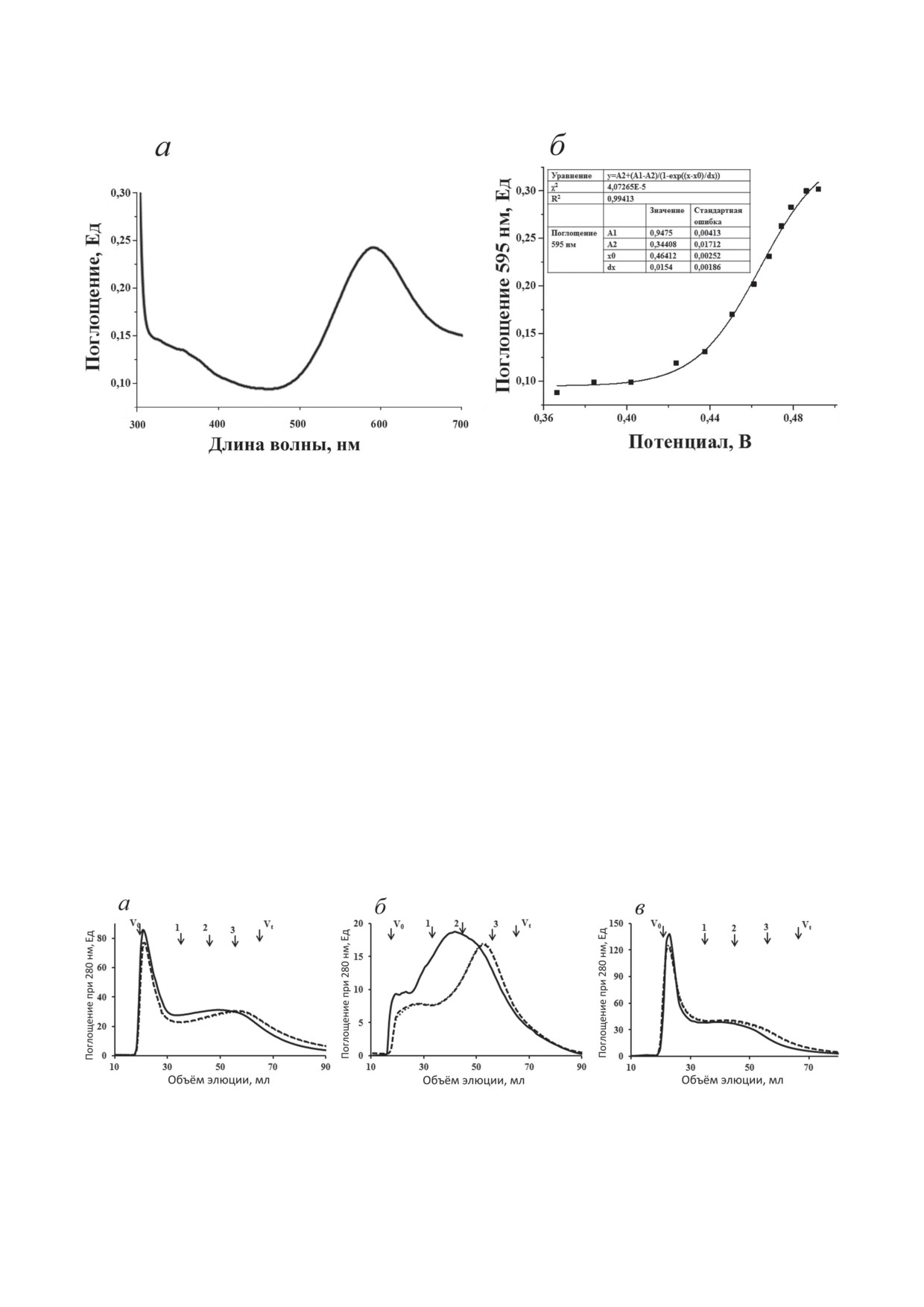
Спектр поглощения лакказы имел пик при
590 нм и плечо около 330-340 нм из-за присут-
1
50,2
102,3
ствия Т1-медного центра и Т3-медного центра
NaN3
10
10,3
110,2
соответственно (рис. 3, а). Окислительно-вос-
становительный потенциал Т1-центра ScaSL
100
0
78
составил 0,472 ± 0,007 В (рис. 3, б).
1
92,3
100
Кинетические константы ScaSL определя-
ли в отношении субстратов АБТС и 2,6-ДМФ.
NaF
10
58,3
100,8
Для АБТС Km составила 0,1 мМ, kcat составил
100
16,6
95,3
20 с-1. Для 2,6-ДМФ Km составила 0,84 мМ, kcat
составил 0,36 с-1. Исследовано влияние неко-
1
95,2
99,4
торых ингибиторов лакказы (NaN3, NaF, NaCl
NaCl
10
74,6
100
и ЭДТА) на активность фермента (табл. 1).
Влияние ингибиторов измеряли в кислых
100
36,5
95
(pH 4,7) и щелочных (pH 7,5) условиях. NaN3,
NaF и NaCl не оказывали сильного ингиби-
1
105,7
99,2
рующего эффекта на активность лакказы при
ЭДТА
10
92,7
63,8
рН 7,5: при 100 мМ NaN3, NaCl и NaF остаточ-
ная активность ScaSL составляла 78%, 95% и
100
78,1
8,7
95% соответственно. ЭДТА оказывала сильное
Примечание. Стандартные отклонения рассчитаны не ме-
ингибирующее действие на ScaSL: остаточная нее чем для трёх повторностей.
БИОХИМИЯ том 88 вып. 10 2023
СТРУКТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛАККАЗЫ ScaSL
2007
Рис. 3. Спектр поглощения ScaSL (a) и кривая редокс-титрования Т1-центра ScaSL (б)
активность фермента в присутствии 100 мМ
Снижение количества низкомолекулярной
ЭДТА составляла 8%. При рН 4,7 лакказа силь-
фракции, элюируемой в полный объём колон-
но ингибировалась 10 мМ NaN3, сохраняя при-
ки, уменьшалось для гуминовых кислот.
мерно 10% от начальной активности; однако
Кристаллическая структура ScaSL. Кри-
фермент сохранял 74% от начальной актив-
сталлическая структура ScaSL была определена
ности в присутствии 100 мМ NaCl и 58% от на-
с разрешением 2,35 Å. Кристаллы относились
чальной активности в присутствии 100 мМ NaF.
к пространственной группе P23 и содержали
ЭДТА при рН 7,5 не оказывала сильного инги-
одну молекулу мономера в асимметричной ча-
бирующего действия на активность лакказы.
сти элементарной ячейки. Статистика сбора и
Гуминовые кислоты. Фермент катализиро-
уточнения дифракционных данных представ-
вал окисление гуминовых кислот и лигносуль-
лена в табл. 2.
фокислоты. Гуминовые кислоты как из дерно-
Общая структура функционального триме-
во-подзолистой почвы, так и из торфа, а также
ра ScaSL напоминала структуры других 2д-лак-
лигносульфокислота полимеризовались под
каз (рис. 5), координация ионов меди также
действием лакказы, о чём свидетельствовало
была типична для 2д-лакказ. Ион меди T1-цен-
увеличение количества фракции, элюируемой
тра располагался вблизи поверхности лакказы,
в пустой объём колонки (рис. 4).
тринуклеарный центр находился на стыках мо-
Также наблюдалось увеличение количества
номеров. Ион меди Т2 отсутствовал, что доста-
фракции массой 30-70 кДа в случае гумино-
точно часто встречается в лакказах. В асимме-
вой кислоты из торфа и лигносульфокислоты.
тричной части ячейки находился один мономер.
Рис. 4. Реакция ScaSL с гуминовыми кислотами и лигносульфокислотой: данные гель-фильтрации. Гуминовая кислота
из торфа (а); натриевая соль лигносульфоновой кислоты (б); гуминовая кислота из дерново-подзолистой почвы (в).
Сплошная линия - образец после взаимодействия с ScaSL, штриховая линия - исходный образец, пунктирная ли-
ния - образец с инактивированной ScaSL. Стрелки указывают на свободный объём колонки (V0 > 80 кДа) и общий
объём колонки (Vt < 5 кДа); 1 - элюция БСА (66 кДа), 2 - элюция карбоангидразы (29 кДа), 3 - элюция цитохрома с
(12,4 кДа)
БИОХИМИЯ том 88 вып. 10 2023
2008
ТРУБИЦИНА и др.
Рис. 5. Структура мономера и функционального тримера ScaSL. а - Мономер ScaSL, первый домен показан сирене-
вым, второй домен серым цветом. Ионы меди показаны оранжевыми сферами. б - Функциональный тример, полу-
ченный с использованием оси третьего порядка
Таблица 2. Статистические характеристики дифракцион-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ного набора и кристаллографического уточнения
В геноме бактерии S. carpinensis ВКМ Ас-
Статистика набора
1300 был идентифицирован ген ранее неиз-
Пространственная группа
P23
ученной 2д-лакказы. Последовательность гена,
кодирующую каталитическую часть белка (без
a = b = c, (Å)
97,96
последовательности сигнального пептида),
α = β = γ, (°)
90,00
успешно клонировали в вектор pQE-30. Выбор
пал на этот вектор, так как ранее проводи-
Пределы разрешения, Å
32,65-2,3 (2,4-2,3)
лось успешное клонирование и экспрессия в
указанном векторе пяти других бактериаль-
Rsigma, %
11,1 (64,2)
ных
2д-лакказ. Известны случаи агрегации
Среднее I/σ (I)
6,54 (1,56)
2д-лакказ при гетерологичной продукции [44],
однако рекомбинантная лакказа ScaSL была
Полнота набора, %
97,0 (83,4)
идентифицирована во фракции супернатанта.
Избыточность
4,29 (2,13)
Эффект агрегации был минимальным при про-
дукции фермента при 37 °С и отсутствовал при
Число уникальных отражений
13 826 (1409)
продукции при 20 °С. Культивирование инду-
цированных клеток в микроаэробных условиях
Статистика уточнения
в присутствии ионов меди было необходимо
32,65-2,35
для получения фермента, максимально насы-
Разрешение, Å
(2,53-2,35)
щенного ионами меди [45].
Лакказа ScaSL, как и большинство 2д-лак-
Общее количество отражений
13 065 (2341)
каз, проявляла активность в форме гомотри-
Rwork/Rfree, %
23,1/28,1 (27,5/36,4)
мера, однако также она могла олигомеризо-
ваться с образованием мультимерных форм.
Усреднённый B-фактор, Å2
30,3
Эффект олигомеризации ранее наблюдался у
На карте Рамачандрана
2д-лакказы SaSL из Streptomyces anulatus [44] и у
2д-лакказы CjSL из Catenuloplanes japonicus [20].
Наиболее предпочтительные
95,6
Молекулярная масса мономерной формы ScaSL
районы, %
составила 37 кДа. Другие известные 2д-лакказы
Дополнительно разрешённые
в форме мономера имели схожие молекуляр-
4,4
районы, %
ные массы (33-39 кДа). Физико-химические
свойства полученной лакказы были типичны
Среднеквадратичное отклонение
для представителей этого семейства: лакказа
была термостабильна, окисляла нефенольное
Длины связей, Å
0,009
соединение АБТС в кислой среде (pH 4,7), а
Валентные углы, °
0,957
фенольное соединение 2,6-ДМФ - в нейтраль-
Примечание. Данные в скобках соответствуют интервалу
ной среде (pH 7,5). Как и большинство бакте-
наиболее высокого разрешения.
риальных 2д-лакказ, фермент ScaSL был более
БИОХИМИЯ том 88 вып. 10 2023
СТРУКТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛАККАЗЫ ScaSL
2009
Рис. 6. Структура лакказы ScaSL и SLAC из S. sviceus. а - Наложение структур ScaSL (серый) и SLAC S. sviceus (Ssl1)
(голубой). б - Увеличение областей вблизи T1-центра и оси третьего порядка тримера. Ион меди T1 показан оранже-
вой сферой, треугольником показана ось 3-го порядка. Остатки тирозина Tyr226 и Tyr227, принадлежащие трём раз-
ным мономерам, помечены соответствующим образом (например, Tyr227, Tyr227′ и Tyr227′′)
стабилен в щелочной среде [13, 17, 18, 44]. Ис-
Несмотря на то что аминокислотное окру-
следуемая лакказа характеризовалась самыми
жение активных центров 2д-лакказ в основ-
низкими значениями Km у 2д-лакказ для АБТС
ном практически идентично, некоторые раз-
и 2,6-ДМФ, они составляли 0,10 мМ и 0,84 мМ
личия всё же наблюдаются, в частности,
соответственно. Так, ранее наименьшая Km по
вблизи Т1-центра. В области Т1-центра про-
АБТС была обнаружена у 2д-лакказы SaSL из
исходит связывание и окисление субстрата;
S. anulatus и составила 0,17 мМ [44]; наимень-
в 2д-лакказах он расположен на стыке трёх
шая Km для субстрата 2,6-ДМФ была показана
мономеров (рис. 6).
для 2д-лакказы Ssl1 из Streptomyces sviceus и со-
При наложении участков вблизи Т1-цен-
ставила 0,89 мМ [17].
тра ScaSL и Ssl1 видны конформационные
Лакказы принято классифицировать по ве-
различия в расположении двух аминокислот-
личине ОВП на ферменты с низким (< 460 мВ),
ных остатков, принадлежащих второй коор-
средним
(> 460 мВ и
< 710 мВ) и высоким
динационной сфере иона меди Cu1 (рис. 6).
(> 710 мВ) потенциалом [31]. Известно, что 2д-
В ScaSL в положениях 229 и 230 находятся фе-
лакказы являются низкопотенциальными фер-
нилаланиновые остатки, тогда как в Ssl1 в со-
ментами. Так, значение ОВП Т1-центра лак-
ответствующих положениях находятся Tyr226
казы SLAC из Streptomyces coelicolor соста-
и Tyr227 (рис. 6). В результате таких замен
вило 0,43 В [46], лакказы SvSL из Streptomyces
может измениться не только геометрия суб-
viridochromogenes - 0,35 В [14], лакказы Ssl1 из
страт-связывающего кармана, но также гид-
S. sviceus - 0,37 В [32], лакказы SilA из Strep-
рофобность и заряд этого участка. Известно,
tomyces ipomoea - 0,33 В [47]. Величина ОВП
что замены аминокислотных остатков второй
определяет окислительную активность 2д-лак-
координационной сферы иона меди Cu1 могут
каз [48]. С учётом повышенной окислитель-
существенно влиять на изменение геометрии
ной активности лакказы был измерен ОВП
субстрат-связывающего кармана и, соответ-
фермента. Он составил 0,472 ± 0,008 В. Таким
ственно, на активность 2д-лакказ [24].
образом, полученная 2д-лакказа являлась пер-
вым изученным ферментом со средним ОВП.
Как и ранее описанные 2д-лакказы, ScaSL
ЗАКЛЮЧЕНИЕ
катализировала полимеризацию гуминовых кис-
лот [13]. Лигнин также мог полимеризоваться
Лакказа ScaSL из штамма S. carpinensis
под действием 2д-лакказ [12]. Грибная 3д-лак-
ВКМ Ac-1300 - новая исследованная двух-
каза способна как деполимеризовать лигнин
доменная лакказа. Фермент был продуциро-
и гуминовые кислоты, так и полимеризовать
ван в штамме E. coli и очищен до гомогенного
их
[11, 49, 50]. Возможно, полимеризующая
состояния. Проведено исследование физико-
способность ScaSL связана с её ОВП: хотя он
химических свойств фермента. Было установ-
выше, чем у других 2д-лакказ, но ниже, чем у
лено, что лакказа является первой изученной
3д-лакказ. Таким образом, ОВП белка ещё не-
двухдоменной лакказой со средним окисли-
достаточен для деполимеризации используе-
тельно-восстановительным потенциалом. SсaSL
мых веществ.
эффективно полимеризовала гуминовые кис-
БИОХИМИЯ том 88 вып. 10 2023
2010
ТРУБИЦИНА и др.
лоты и лигносульфокислоту. В дальнейшем
тирование текста; А.Г. Заварзина - проведе-
планируется изучить способность лакказы раз-
ние экспериментов; О.В. Белова - проведение
лагать красители различной природы, а так-
экспериментов; А.П. Ларионова - проведение
же выявить детерминанты, определяющие по-
экспериментов; С.В. Тищенко - проведение
вышенный окислительно-восстановительный
экспериментов и написание текста; А.А. Леон-
потенциал лакказы ScaSL.
тьевский - руководство работой.
Финансирование. Работа выполнена при
Вклад авторов. Л.И. Трубицина - планиро-
поддержке гранта Президента Российской
вание и проведение экспериментов, обсужде-
Федерации (проект № МК-5025.2021.1.4).
ние результатов, написание и редактирование
Конфликт интересов. Авторы заявляют об
текста; И.В. Трубицин - проведение экспе-
отсутствии конфликта интересов.
риментов и написание текста; А.В. Лисов -
Соблюдение этических норм. Настоящая
планирование экспериментов, обсуждение
статья не содержит описания каких-либо ис-
результатов и написание текста; А.Г. Габдул-
следований с участием людей или животных
хаков - проведение экспериментов и редак-
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Baldrian, P. (2006) Fungal laccases - occurrence
oxidation of lignin induces production of H2O2, ACS
and properties, FEMS Microbiol. Rev., 30, 215-242,
Sustainable Chem. Eng., 8, 831-841, doi: 10.1021/
doi: 10.1111/j.1574-4976.2005.00010.x.
acssuschemeng.9b04912.
2.
Janusz, G., Pawlik, A., Świderska-Burek, U.,
10.
Zahmatkesh, M., Spanjers, H., Toran, M. J.,
Polak, J., Sulej, J., et al., (2020) Laccase properties,
Blánquez, P., and van Lier, J. B. (2016) Bioremoval
physiological functions, and evolution, Int. J. Mol.
of humic acid from water by white rot fungi: exploring
Sci., 21, 996, doi: 10.3390/ijms21030966.
the removal mechanisms, AMB Express,
6,
118,
3.
Asada, N., Namba, M., Kodama, T., and Kyogoku, Y.
doi: 10.1186/s13568-016-0293-x.
(2004) Circular dichroism of prophenol oxidase
11.
Zavarzina, A. G., Leontievsky, A. A., Golovleva,
in relation to the structural stability in Drosophila
L. A., and Trofimov, S. Ya. (2004) Biotransformation
melanogaster, Arch. Insect. Biochem. Physiol., 56, 1-6,
of soil humic acids by blue laccase of Panus tigrinus
doi: 10.1002/arch.10137.
8/18: an in vitro study, Soil Biol. Biochem., 36,
4.
Lisov, A. V., Zavarzina, A. G., Zavarzin, A. A., and
359-369, doi: 10.1016/j.soilbio.2003.10.010.
Leontievsky, A. A. (2007) Laccases produced by
12.
Majumdar, S., Lukk, T., Solbiati, J. O., Bauer, S.,
lichens of the order Peltigerales, FEMS Microbiol. Lett.,
Nair, S. K., et al. (2014) Roles of small laccases from
275, 46-52, doi: 10.1111/j.1574-6968.2007.00858.x.
Streptomyces in lignin degradation, Biochemistry,
5.
Otto, B., Beuchel, C., Liers, C., Reisser, W.,
53, 4047-4058, doi: 10.1021/bi500285t.
Harms, H., and Schlosser, D. (2015) Laccase-like
13.
Trubitsina, L. I., Lisov, A. V., Belova, O. V., Trubitsin,
enzyme activities from chlorophycean green algae with
I. V., Demin, V. V., Konstantinov, A. I., Zavarzina,
potential for bioconversion of phenolic pollutants,
A. G., and Leontievsky, A. A. (2020) Transforma-
FEMS Microbiol. Lett., 362, fnv072, doi: 10.1093/
tion of low molecular compounds and soil humic
femsle/fnv072.
acid by two domain laccase of Streptomyces puni-
6.
Nakamura, K., and Go, N. (2005) Function and
ceus in the presence of ferulic and caffeic acids,
molecular evolution of multicopper blue proteins,
PLoS One, 15, e0239005, doi: 10.1371/journal.pone.
Cell. Mol. Life Sci., 62, 2050-2066, doi: 10.1007/
0239005.
s00018-004-5076-x.
14.
Trubitsina, L. I., Tishchenko, S. V., Gabdulkhakov,
7.
Arregui, L., Ayala, M., Gómez-Gil, X., Gutiérrez-
A. G., Lisov, A. V., Zakharova, M. V., and
Soto, G., Hernández-Luna, C. E., et al.
(2019)
Leontievsky, A. A. (2015) Structural and functional
Laccases: structure, function, and potential application
characterization of two-domain laccase from Strep-
in water bioremediation, Microb. Cell. Fact., 18, 200,
tomyces viridochromogenes, Biochimie, 112, 151-159,
doi: 10.1186/s12934-019-1248-0.
doi: 10.1016/j.biochi.2015.03.005.
8.
Munk, L., Sitarz, A. K., Kalyani, D. C., Mikkelsen,
15.
Góralczyk-Bińkowska, A., Jasińska, A., Długoński, A.,
J. D., and Meyer, A. S. (2015) Can laccases catalyze
Płociński, P., and Długoński, J. (2020) Laccase
bond cleavage in lignin? Biotechnol. Adv., 33, 13-24,
activity of the ascomycete fungus Nectriella pironii and
doi: 10.1016/j.biotechadv.2014.12.008.
innovative strategies for its production on leaf litter of
9.
Perna, V., Meyer, A. S., Holck, J., Eltis, L. D., Eijsink,
an urban park, PLoS One, 15, e0231453, doi: 10.1371/
V. G. H., and Agger, J. W. (2020) Laccase-catalyzed
journal.pone.0231453.
БИОХИМИЯ том 88 вып. 10 2023
СТРУКТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛАККАЗЫ ScaSL
2011
16.
Sun, Y., Liu, Z. L., Hu, B. Y., Chen, Q. J., Yang,
tions of fungal laccase, 3 Biotech, 6, 15, doi: 10.1007/
A. Z., et al. (2021) Purification and characteriza-
s13205-015-0316-3.
tion of a thermo- and pH-stable laccase from the
27.
Kunamneni, A., Camarero, S., García-Burgos, C.,
litter-decomposing fungus Gymnopus luxurians and
Plou, F. J., Ballesteros, A., et al. (2008) Engineering
laccase mediator systems for dye decolorization,
and applications of fungal laccases for organic
Front Microbiol.,
12,
672620, doi:
10.3389/fmicb.
synthesis, Microb. Cell Fact, 7, 32, doi: 10.1186/
2021.672620.
1475-2859-7-32.
17.
Gunne, M., and Urlacher, V. B. (2012) Character-
28.
Osma, J. F., Toca-Herrera, J. L., and Rodríguez-
ization of the alkaline laccase Ssl1 from Streptomyces
Couto, S. (2010) Uses of laccases in the food in-
sviceus with unusual properties discovered by genome
dustry, Enzyme Res.,
2010,
1-8, doi:
10.4061/
mining, PLoS One, 7, e52360, doi: 10.1371/journal.
2010/918761.
pone.0052360.
29.
Coelho, J. H., Eisele, A. P. P., Valezi, C. F.,
18.
Feng, H., Zhang, D., Sun, Y., Zhi, Y., Mao, L., et al.
Mattos, G. J., Schirmann, J. G., et al. (2019) Ex-
(2015) Expression and characterization of a recom-
ploring the exocellular fungal biopolymer botryos-
binant laccase with alkalistable and thermostable
phaeran for laccase-biosensor architecture and
properties from Streptomyces griseorubens JSD-1,
application to determine dopamine and spironolac-
Appl. Biochem. Biotechn., 176, 547-562, doi: 10.1007/
tone, Talanta, 204, 475-483, doi: 10.1016/j.talanta.
s12010-015-1594-2.
2019.06.033.
19.
Molina-Guijarro, J. M., Perez, J., Muñoz-Dorado, J.,
30.
Wang, F., Xu, L., Zhao, L., Ding, Z., Ma, H., et al.
Guillen, F., Moya, R., et al. (2009) Detoxification of
(2019) Fungal laccase production from lignocel-
azo dyes by a novel pH-versatile, salt-resistant laccase
lulosic agricultural wastes by solid-state fermenta-
from Streptomyces ipomoea, Int. Microbiol., 12, 13-21,
tion: a review, Microorganisms, 7, 665, doi: 10.3390/
doi: 10.2436/20.1501.01.77.
microorganisms7120665.
20.
Trubitsina, L. I., Abdullatypov, A. V., Larionova,
31.
Mot, A. C., and Silaghi-Dumitrescu, R.
(2012)
A. P., Trubitsin, I. V., Alferov, S. V., Ponamoreva,
Laccases: complex architectures for one electron
O. N., and Leontievsky, A. A. (2021) Expression
oxidations, Biochemistry (Moscow), 77, 1395-1407,
of thermophilic two-domain laccase from Catenu-
doi: 10.1134/S0006297912120085.
loplanes japonicus in Escherichia coli and its activity
32.
Gunne, M., Hoppner, A., Hagedoorn, P. L., and
against triarylmethane and azo dyes, PeerJ, 9, e11646,
Urlacher, V. B. (2014) Structural and redox properties
doi: 10.7717/peerj.11646.
of the small laccase Ssl1 from Streptomyces sviceus,
21.
Kaneko, S., Cheng, M., Murai, H., Takenaka, S.,
FEBS J., 281, 4307-4318, doi: 10.1111/febs.12755.
Murakami, S., et al.
(2009) Purification and
33.
Laemmli, U. K. (1970) Cleavage of structural proteins
characterization of an extracellular laccase from
during the assembly of the head of bacteriophage T4,
Phlebia radiata strain BP-11-2 that decolorizes fungal
Nature, 227, 680-685, doi: 10.1038/227680a0.
melanin, Biosci. Biotechnol. Biochem., 73, 939-942,
34.
Heinfling, A., Martinez, A. T., Martinez, M. J.,
doi: 10.1271/bbb.80740.
Bergbauer, M., and Szewzyc, U. (1998) Purification
22.
More, S. S., Renuka, P. S., Pruthvi, K., Swetha, M.,
and characterization of peroxidases from the dye-
Malini, S. S., et al. (2011) Isolation, purification,
decolorizing fungus Bjerkandera adusta, FEMS
and characterization of fungal laccase from Pleuro-
Microbiol. Lett., 165, 43-50, doi: 10.1111/j.1574-6968.
tus sp., Enzyme Res., 2011, 248735, doi: 10.4061/
1998.tb13125.x.
2011/248735.
35.
Wariishi, H., Valli, K., and Gold, M. H.
(1992)
23.
Patel, H., Gupte, S., Gahlout, M., and Gupte, A.
Manganese(II) oxidation by manganese peroxidase
(2014) Purification and characterization of an extra-
from the basidiomycete Phanerochaete chrysosporium.
cellular laccase from solid-state culture of Pleuro-
Kinetic mechanism and role of chelators, J. Biol.
tus ostreatus HP-1, 3 Biotech, 4, 77-84, doi: 10.1007/
Chem., 267, 23688-23695, doi: 10.1016/S0021-9258
s13205-013-0129-1.
(18)35893-9.
24.
Kolyadenko, I., Scherbakova, A., Kovalev, K.,
36.
Britton, H. T. K., and Robinson, R. A.
(1931)
Gabdulkhakov, A., and Tishchenko, S.
(2021)
Universal buffer solutions and the dissociation
Engineering the catalytic properties of two-domain
constant of veronal, J. Chem. Soc., 10, 1456-1462,
laccase from Streptomyces griseoflavus Ac-993, Int. J.
doi:10.1039/jr9310001456.
Mol. Sci., 23, 65, doi: 10.3390/ijms23010065.
37.
Olbrich, A. C., Schild, J. N., and Urlacher, V. B.
25.
Couto, S. R., and Herrera, J. L. T. (2006) Industrial
(2019) Correlation between the T1 copper reduction
and biotechnological applications of laccases: a
potential and catalytic activity of a small laccase,
review, Biotechn. Adv., 24, 500-513, doi: 10.1016/
J. Inorg. Biochem.,
201,
110843, doi:
10.1016/
j.biotechadv.2006.04.003.
j.jinorgbio.2019.110843.
26.
Upadhyay, P., Shrivastava, R., and Agrawal, P. K.
38.
Zavarzina, A. G., Kravchenko, E. G., Konstantinov,
(2016) Bioprospecting and biotechnological applica-
A. I., Perminova, I. V., Chukov, S. N., and Demin, V. V.
БИОХИМИЯ том 88 вып. 10 2023
2012
ТРУБИЦИНА и др.
(2019) Comparison of the properties of humic
characterization of fully copper loaded enzymes,
acids extracted from soils by alkali in the presence
J. Biol. Inorg. Chem., 13, 183-193, doi: 10.1007/
and absence of oxygen, Eur. Soil Sci., 52, 880-891,
s00775-007-0312-0.
doi: 10.1134/S1064229319080167.
46. Gallaway, J., Wheeldon, I., Rincon, R., Atanassov, P.,
39. McCoy, J., Grosse-Kunstleve, R. W., Adams, P. D.,
Banta, S., Calabrese, S., et al. (2008) Oxygen-re-
Winn, M. D., Storoni, L. C., et al. (2007) Phaser
ducing enzyme cathodes produced from SLAC,
crystallographic software Airlie, J. Appl. Crystallogr.,
a small laccase from Streptomyces coelicolor, Bios-
40, 658-674, doi: 10.1107/S0021889807021206.
ens. Bioelectron., 23, 1229-1235, doi: 10.1016/j.bios.
40. Afonine, P. V., Grosse-Kunstleve, R. W., Echols, N.,
2007.11.004.
Headd, J. J., Moriarty, N. W., et al. (2012) Towards
47. Blánquez, A., Rodríguez, J., Brissos, V., Mendes, S.,
automated crystallographic structure refinement with
Martins, L. O., et al. (2019) Decolorization and detox-
phenix.refine, Acta Crystallogr. D Biol. Crystallogr., 68,
ification of textile dyes using a versatile Streptomyces
352-367, doi: 10.1107/S0907444912001308.
laccase-natural mediator system, Saudi J. Biol. Sci.,
41. Emsley, P., Lohkamp, B., Scott, W. G., and Cowtan, K.
26, 913-920, doi: 10.1016/j.sjbs.2018.05.020.
(2010) Features and development of Coot, Acta
48. Xu, F. (1996) Oxidation of phenols, anilines, and
Crystallogr. D Biol. Crystallogr.,
66,
486-501,
benzenethiols by fungal laccases: correlation between
doi: 10.1107/S0907444910007493.
activity and redox potentials as well as halide
42. Chen, V. B., Wedell, J. R., Wenger, R. K., Ulrich,
inhibition, Biochemistry, 35, 7608-7614, doi: 10.1021/
E. L., Markley, J. L. (2015) MolProbity for the masses-
bi952971a.
of data, J Biomol. NMR, 63, 77-83, doi: 10.1007/
49. Kumar, V. P., Sridhar, M., and Rao, R. G. (2022)
s10858-015-9969-9.
Biological depolymerization of lignin using laccase
43. DeLano, W. L. (2002) The PyMOL Molecular Graph-
harvested from the autochthonous fungus Schizophyl-
ics System, Delano Scientific, San Carlos.
lum commune employing various production meth-
44. Lisov, A. V., Trubitsina, L. I., Lisova, Z. A., Trubitsin,
ods and its efficacy in augmenting in vitro digestibil-
I. V., Zavarzina, A. G., and Leontievsky, A. A. (2019)
ity in ruminants, Sci. Rep., 12, 11170, doi: 10.1038/
Transformation of humic acids by two-domain laccase
s41598-022-15211-9.
from Streptomyces anulatus, Process Biochemistry, 76,
50. Agustin, M. B., de Carvalho, D. M., Lahtinen,
128-135, doi: 10.1016/j.procbio.2018.11.001.
M. H., Hilden, K., Lundell, T., et al. (2021) Laccase
45. Durao, P., Chen, Z., Fernandes, A. T., Hildebrandt,
as a tool in building advanced lignin-based materials,
P., Murgida, D. H., et al. (2008) Copper incorporation
ChemSusChem,
14,
4615-4635, doi:
10.1002/cssc.
into recombinant CotA laccase from Bacillus subtilis:
202101169.
A NOVEL TWO-DOMAIN LACCASE
WITH A MIDDLE REDOX POTENTIAL:
PHYSICOCHEMICAL AND STRUCTURAL PROPERTIES
L. I. Trubitsina1*, I. V. Trubitsin1, A. V. Lisov1, A. G. Gabdulkhakov2, A. G. Zavarzina3,
O. V. Belova1, A. P. Larionova1, S. V. Tishchenko2, and A. A. Leontievsky1
1 Federal Research Center “Pushchino Scientific Center for Biological Research
of the Russian Academy of Sciences”, G. K. Skryabin Institute of Biochemistry and Physiology
of Microorganisms of the Russian Academy of Sciences,
142290 Pushchino, Moscow region, Russia; e-mail: lyubov_yurevich@mail.ru
2 Institute of Protein Research, Russian Academy of Sciences, 142290 Pushchino, Moscow region, Russia
3 Faculty of Soil Science, Lomonosov Moscow State University, 119991 Moscow, Russia
The gene for a previously unexplored two-domain laccase was identified in the genome of the actinobac-
terium Streptomyces carpinensis VKM Ac-1300. A two-domain laccase, named ScaSL, was produced in a
heterologous expression system (Escherichia coli strain M15 [pREP4]). The enzyme was purified to homo-
geneity using affinity chromatography. ScaSL laccase, like most two-domain laccases, exhibited activity in
the homotrimer form. However, unlike most two-domain laccases, it was also active in multimeric forms.
The enzyme exhibited maximum activity at 80°C and was thermally stable. The half-inactivation time of
ScaSL at 80°C was 40 min. Laccase oxidized the non-phenolic organic compound ABTS at a maximum rate
at pH 4.7; oxidized the phenolic compound 2,6-dimethoxyphenol at a maximum rate at pH 7.5. Laccase
stability was observed in the pH range 9-11. At pH 7.5, laccase was weakly inhibited by sodium azide, sodium
fluoride, and sodium chloride; at pH 4.5, laccase was completely inhibited by 100 mM sodium azide.
БИОХИМИЯ том 88 вып. 10 2023
СТРУКТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛАККАЗЫ ScaSL
2013
Km and kcat of the enzyme for ABTS are 0.1 mM and 20 s-1, respectively. Km and kcat for 2,6-dimethoxy-
phenol are 0.84 mM and 0.36 s-1, respectively. ScaSL catalyzed the polymerization of humic acids and
lignin. The redox potential of laccase was 0.472 ± 0.007 V. Thus, ScaSL laccase is the first characterized
two-domain laccase with a middle redox potential. The crystal structure of ScaSL was determined with
a resolution of 2.35 Å. A comparative analysis of the structures of ScaSL and other two-domain laccases
suggested that the middle potential of ScaSL may be associated with conformational differences in the
position of the side groups of amino acids at position 230 (in ScaSL numbering), which belong to the
second coordination sphere of the copper atom of the T1 center.
Keywords: two-domain laccase, Streptomyces carpinensis, gene cloning, crystal structure, thermal stability, redox
potential
БИОХИМИЯ том 88 вып. 10 2023