БИОХИМИЯ, 2023, том 88, вып. 3, с. 355 - 367
УДК 577.21;577.25
РОЛЬ ПОЛИМОРФИЗМА C1473G
В ГЕНЕ ТРИПТОФАНГИДРОКСИЛАЗЫ-2 В ЭФФЕКТАХ
ОСТРОГО ВВЕДЕНИЯ ЭТАНОЛА НА ЭКСПРЕССИЮ ГЕНА c-fos
И МЕТАБОЛИЗМ БИОГЕННЫХ АМИНОВ В МОЗГЕ МЫШЕЙ
© 2023 Д.В. Базовкина*, Д.В. Фурсенко, В.С. Науменко, А.В. Куликов
Институт цитологии и генетики СО РАН,
630090 Новосибирск, Россия; электронная почта: daryabazovkina@gmail.com
Поступила в редакцию 03.11.2022
После доработки 26.12.2022
Принята к публикации 29.12.2022
Триптофангидроксилаза-2 является ключевым ферментом синтеза нейромедиатора серотонина, иг-
рающего важную роль в механизмах регуляции широкого спектра физиологических функций и форм
поведения. В данной работе было изучено влияние острого введения этанола на экспрессию гена
раннего ответа c-fos и метаболизм серотонина и катехоламинов в структурах мозга мышей конген-
ных линий B6-1473C и B6-1473G, различающихся однонуклеотидной заменой C1473G в гене Tph2
и функциональной активностью фермента. Острая алкоголизация приводила к существенному
росту экспрессии гена c-fos во фронтальной коре и стриатуме мышей B6-1473G и гиппокампе мы-
шей B6-1473С. Введение этанола вызвало снижение индекса метаболизма серотонина в прилежащих
ядрах у мышей линии B6-1473С, а также в гиппокампе и стриатуме мышей линии B6-1473G. Также
этанол привел к снижению уровня норадреналина в гипоталамусе у мышей линии B6-1473C. Таким
образом, полиморфизм C1473G в гене Tph2 оказывает существенное влияние на вызванные ост-
рым введением этанола изменения паттерна экспрессии гена c-fos и метаболизма биогенных аминов
в мозге.
КЛЮЧЕВЫЕ СЛОВА: этанол, C1473G полиморфизм, триптофангидроксилаза-2, ген раннего ответа c-fos,
серотонин, дофамин, норадреналин, мышь.
DOI: 10.31857/S0320972523030016, EDN: QVYUTF
ВВЕДЕНИЕ
мозге, некоторые полиморфизмы в гене TPH2
человека ассоциированы с развитием нервно-
Многочисленными исследованиями пока-
психических заболеваний, включая депрессию
зано, что дисфункция серотониновой (5-НТ)
и биполярное аффективное расстройство [8, 9].
системы головного мозга вовлечена в патофи-
Однако участие этого фермента в патогенезе
зиологию широкого спектра нервно-психи-
расстройств, связанных с употреблением алко-
ческих заболеваний, в том числе алкогольных
голя, остается малоизученным. Было показа-
расстройств
[1-2]. Согласно литературным
но, что у страдающих алкоголизмом больных
данным, полиморфизмы в генах, кодирующих
повышены уровни мРНК TPH2 и количества
ключевые элементы серотониновой систе-
белка ТПГ2 в дорзальных и медиальных ядрах
мы мозга, такие как рецепторы 5-HT1B [3],
шва среднего мозга [10]. Однако ряд работ, на-
5-HT6 [4] и 5-HT2A [5], транспортер 5-HT [6],
правленных на выявление ассоциаций между
моноаминоксидаза А [7], могут обусловливать
различными полиморфизмами в гене TPH2
нарушения поведения, связанные с потребле-
и расстройствами поведения, связанными с
нием алкоголя.
алкоголизмом, не показали однозначных ре-
Триптофангидроксилаза-2 (TPH2) является
зультатов
[11-14]. Таким образом, создание
ключевым ферментом синтеза 5-НТ в головном полноценных животных моделей для изучения
Принятые сокращения: ТПГ2 - триптофангидроксилаза-2; DA - дофамин; DOPAC - 3,4-дигидроксифенилуксусная
кислота; 5-HIAA - 5-гидроксииндолуксусная кислота; 5-НТ - серотонин, HVA - гомованилиновая кислота, NA - нор-
адреналин; полиморфизм C1473G - замена цитозина на гуанин в положении 1473 гена Tph2.
* Адресат для корреспонденции.
355
356
БАЗОВКИНА и др.
роли гена TPH2 в регуляции эффектов алкоголя
относительная влажность 50-60%, с регули-
на поведение и нервную систему является акту-
руемым световым режимом (14 ч света и 10 ч
альной задачей.
темноты)) со свободным доступом к стан-
Полиморфизм C1473G (rs33849125) в
дартной пище и воде. Генотипы животных,
гене Tph2 мыши представляет собой функцио-
использованных в эксперименте, были допол-
нальную мутацию, результатом которой явля-
нительно подтверждены, согласно протоколу
ется замена аминокислот в белке TPH2 (Pro447
генотипирования, описанному ранее
[16].
на Arg447), что, в свою очередь, приводит к дву-
Исследование было выполнено на базе Центра
кратному снижению активности фермента
генетических ресурсов лабораторных живот-
и изменениям в поведении [15, 16]. В нашей
ных ФИЦ Институт цитологии и генетики
лаборатории были созданы конгенные линии
СО РАН (RFMEFI62119X0023).
мышей B6-1473C и B6-1473G, различающие-
Введение этанола и выведение животных
ся только этой однонуклеотидной заменой в
из эксперимента. За 2 дня до эксперимента
гене Tph2 [16]. Было показано, что полимор-
мышей рассаживали в индивидуальные клет-
физм C1473G в гене Tph2 вовлечен в эффекты
ки. Введение раствора этанола (1,6 г/кг; 20%)
неблагоприятных факторов среды (острый
осуществляли внутрибрюшинно [22], мыши
стресс, содержание при коротком фотоперио-
контрольных групп получали инъекцию физ-
де) на нервную систему [17-18]. Кроме этого,
раствора; через 40 мин после введения эта-
нами было обнаружено, что при остром введе-
нола животных декапитировали. Выбор дозы
нии этанол по-разному влияет на двигатель-
алкоголя и времени его действия проводили
ную активность и тревожное поведение мы-
по литературным данным, поскольку на гры-
шей линий B6-1473C и B6-1473G [19], однако,
зунах было показано, с одной стороны, увели-
как при этом такое введение алкоголя влияет
чение уровня мРНК гена c-fos в течение часа
на центральную нервную систему у животных
при введении этанола в дозах 0,25-4 г/кг [21,
этих линий, оставалось неизученным. Извест-
23]. С другой стороны, алкоголь может влиять
но, что однократная инъекция этанола может
на метаболизм биогенных аминов при таких
приводить к изменению метаболизма биоген-
параметрах введения [24].
ных моноаминов [20], а также к активации
На льду выделяли гипоталамус, фронталь-
экспрессии генов раннего ответа (например,
ную кору, область прилежащих ядер, гиппо-
гена c-fos) в мозге [21], при этом было показа-
камп, стриатум, черную субстанцию, область
но влияние генотипа на эти эффекты.
среднего мозга. Выбор структур был обуслов-
Целью работы было исследование эффек-
лен тем, что гипоталамус, фронтальная кора,
тов острого введения этанола на экспрессию
гиппокамп, стриатум являются чувствитель-
гена раннего ответа c-fos, а также содержа-
ными к нейротоксическому действию этанола
ния серотонина, норадреналина (NA), дофа-
на уровне экспрессии генов раннего реагиро-
мина (DA) и их метаболитов в структурах
вания [25-26]. Область ядер шва среднего моз-
мозга мышей конгенных линий B6-1473C и
га и черная субстанция являются основным
B6-1473G, различающихся однонуклеотидной
местом локализации тел серотониновых [8] и
заменой C1473G в гене триптофангидрокси-
дофаминовых нейронов [27] соответственно.
лазы-2.
Область прилежащих ядер и стриатум полу-
чают главным образом дофаминергические
проекции, а гипоталамус, фронтальная кора,
МАТЕРИАЛЫ И МЕТОДЫ
область прилежащих ядер, гиппокамп, стриа-
тум - серотонинергические проекции [8, 27].
Животные. Опыты проводили на взрос-
При выделении структур мозга ориентиро-
лых (10-12 недель) самцах мышей конген-
вались на данные атласа мозга мыши [28]. Для
ных линий B6-1473C (C/C) и B6-1473G (G/G),
лобной коры использовали следующие коорди-
полученных в результате 9 возвратных скре-
наты: передне-задняя (anterior-posterior, AP) -
щиваний самцов мышей F1[CC57BR(G/G)
от +1,6 до +2,8; латеральная (L) - от -2 до +2;
xC57BL/6(C/C)] с самками линии C57BL/6.
толщина среза была около 1,5 мм. Гипоталамус
Конгенные линии B6-1473C и B6-1473G,
рассекали по координатам АР - от +0,3 до -2,9;
полученные на основе линии C57BL/6, раз-
L - от -1 до +1; дорсо-вентрально (dorsal-
личались только однонуклеотидной заме-
ventral, DV) - от 3,2 до 5,8. Оба гиппокампа
ной C1473G в гене Tph2 [16]. Вес животных
были рассечены от АР -0,8 до АР -2,9. Коор-
составлял 25 ± 0,7 г, мышей содержали в плас-
динаты полосатого тела: АР - от +1,3 до -1,0;
тиковых клетках размером 40 × 30 × 15 см в
L - от -2,4 до -3,8 и от +2,4 до +3,8; DV -
стандартных условиях (температура 20-22 °С,
от 2,4 до 3,8. Координаты области, содержащей
БИОХИМИЯ том 88 вып. 3 2023
ПОЛИМОРФИЗМ C1473G В ГЕНЕ mTph2 В ЭФФЕКТАХ ВВЕДЕНИЯ ЭТАНОЛА
357
Таблица 1. Нуклеотидные последовательности праймеров
прилежащие ядра: AP - от +1,8 до +1,2; L -
и их характеристики
от -1,7 до -0,5 и от 0,5 до 1,7; DV - от 4,2
до 3,6. Для среднего мозга делали краниаль-
Длина
Нуклеотидная
Тотж.,
ный срез перед верхним бугорком (АР -3)
Ген
продукта
последовательность 5′→3′
°C
и каудальный срез перед ромбовидной ям-
ПЦР, п.н.
кой (АР -7,3), после чего бугорки удаляли.
F: tgtgacaactccatacaatgc
Черная субстанция рассекалась по координа-
rPol2
60
194
R: ctctcttagtgaatttgcgtact
там: AP - от -2,7 до -3,4; L - от -1,2 до -2,0 и
от +1,2 до +2,0; DV - от 3,6 до 4,4.
F: aaagagaaggaaaaactggag
c-fos
58
264
Проводили две серии введения этанола:
R: cggaaacaagaagtcatcaa
образцы тканей первой серии использовали
для выделения РНК (число животных в группе
составило 6-7 мышей), образцы второй се-
мых генов (табл. 1), разрабатывали на осно-
рии - для хроматографического анализа (чис-
ве последовательностей, опубликованных в
ло животных в группе составило 7-8 мышей).
базе данных EMBL Nucleotide database, при
Биоматериал замораживали в жидком азоте
помощи инструментов Oligoanalizer (https://
и хранили при -70 °C до процедур выделе-
eu.idtdna.com/calc/analyzer) и Ensemble (https://
ния РНК или ВЭЖХ.
Выделение общей РНК. Общая РНК была
в компании «Биосан». Для проведения ПЦР в
выделена с помощью TRIzol Reagent («Life
реальном времени 1 мкл кДНК смешивали c
technologies», США), затем обработана ДНКа-
универсальным набором реагентов для прове-
зой без РНКазной активности (RNase free
дения ПЦР-РВ в присутствии красителя SYBR
DNase («Promega», США), 1000 о.е./мл) в со-
Green I («Синтол», Россия) в соответствии с
ответствии с инструкциями производителей.
инструкцией производителя. ПЦР проводи-
Оптическая плотность РНК была измерена
ли на амплификаторе LightCycler 480 («Roche
на спектрофотометре
(«Nanodrop», США).
Applied Science», Швейцария) в соответствии
РНК была разведена водой до концентрации
со следующим протоколом: 95 °C - 3 мин;
0,125 мкг/мкл и хранилась при -70 °С. При-
затем 40 циклов: 95 °C - 10 с; при соответ-
сутствие примесей геномной ДНК в препара-
ствующей температуре отжига (табл. 1) - 30 с;
тах РНК определяли в соответствии с протоко-
72 °C - 30 с. Серию разведений геномной
лом, описанным ранее [29, 30].
ДНК с концентрацией 0,125; 0,25; 0,5; 1; 2; 4;
Реакцию обратной транскрипции прово-
8; 16; 32 и 64 нг/мкл амплифицировали одно-
дили по протоколу, описанному ранее [25].
временно в отдельных пробирках и использо-
Общую РНК (8 мкл или 1 мкг) смешивали
вали как внешний экзогенный стандарт для
со 180 нг статистического праймера длиной
построения калибровочной кривой. Калибро-
6 нуклеотидов (конечная концентрация прай-
вочная кривая в координатах Ct (значение по-
мера составила 5 мкМ) и 2,25 мкМ стериль-
рогового цикла) - lg P (десятичный логарифм
ного 1М KCl в объеме 16 мкл, денатурировали
количества стандарта ДНК) была построена
при 94 °C в течение 5 мин на амплификаторе
автоматически программным обеспечением
БИС М-120 («БИС-Н», Россия), затем добав-
«LightCycler 480». Для контроля специфич-
ляли 15 мкл смеси, содержащей 0,5 М Tris-HCl,
ности амплификации использовали анализ
pH 8,3 (0,63 мкл); смесь трифосфатов 4 мM
кривой плавления ПЦР-продукта для каждого
(3,63 мкл); 0,1 М дитиотреитол (2,25 мкл);
прогона каждой пары праймеров. Экспрес-
0,1 М MnCl2 (0,3 мкл); 2000 ед. обратной тран-
сия гена c-fos представлена как отношение
скриптазы MuMLV («Биосан», Россия) и 8 мкл
количества кДНК исследуемого гена к 100 ко-
воды, обработанной диэтилпирокарбонатом.
пиям гена ДНК-зависимой РНК-полимера-
Полученную смесь (конечным объемом 31 мкл)
зы 2 (rPol2), выполняющей функцию внутрен-
инкубировали при 41 °C в течение 60 мин.
него стандарта [17, 29, 30].
Синтезированную кДНК хранили при темпе-
Высокоэффективная жидкостная хромато-
ратуре -20 °C.
графия (ВЭЖХ). Содержание 5-HТ, его мета-
ОТ-ПЦР в реальном времени. Экспрес-
болита
5-HIAA
(5-гидроксииндолуксусная
сию генов определяли с помощью количе-
кислота), норадреналина, дофамина и его
ственного метода обратной транскрипции с
метаболитов DOPAC (3,4-дигидроксифенил-
последующей полимеразной цепной реак-
уксусная кислота) и HVA (гомованилиновая
цией (ОТ-ПЦР), разработанного в нашей
кислота) в мозге оценивали при ВЭЖХ по
лаборатории
[24,
25]. Праймеры, исполь-
протоколу, описанному ранее
[31]. Образ-
зуемые для амплификации кДНК исследуе-
цы мозга гомогенизировали в 150 мкл 0,6 М
БИОХИМИЯ том 88 вып. 3 2023
358
БАЗОВКИНА и др.
перхлората (HClO4), смесь центрифугировали
Статистика. Результаты представляли
15 мин при 4 оС и 14 000 об./мин для осаж-
как m ± SEM и сравнивали в программе
дения белка. Затем отбирался супернатант,
STATISTICA 8.0 с использованием двухфак-
который разбавляли бидистиллированной
торного дисперсионного анализа ANOVA
водой в 2 раза. Оставшийся осадок хранили
(факторы «генотип» и «этанол») с последую-
при -20 оС для последующего определения
щим межгрупповым сравнением методом LSD
белка по Брэдфорду [31]. Супернатант (20 мкл)
по Фишеру. Нормальность выборок определя-
вводили в петлю системы ВЭЖХ, которая со-
ли по критерию Колмогорова-Смирнова с по-
стояла из следующих компонентов: электро-
правкой Лиллиефорса и критерию Шапиро-
химический детектор (750 мВ, DECADE IITM)
Уилка. Достоверными считались различия
и проточный элемент из стеклоуглерода (ячей-
с p < 0,05.
ка VT-03, 3 мм GC sb) («Antec», Нидерланды),
системный контроллер CBM-20A, блок подачи
растворителя LC-20AD, автоматический про-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
боотборник SIL-20A и дегазатор DGU-20A5R
(«Shimadzu Corporation», США). Хроматогра-
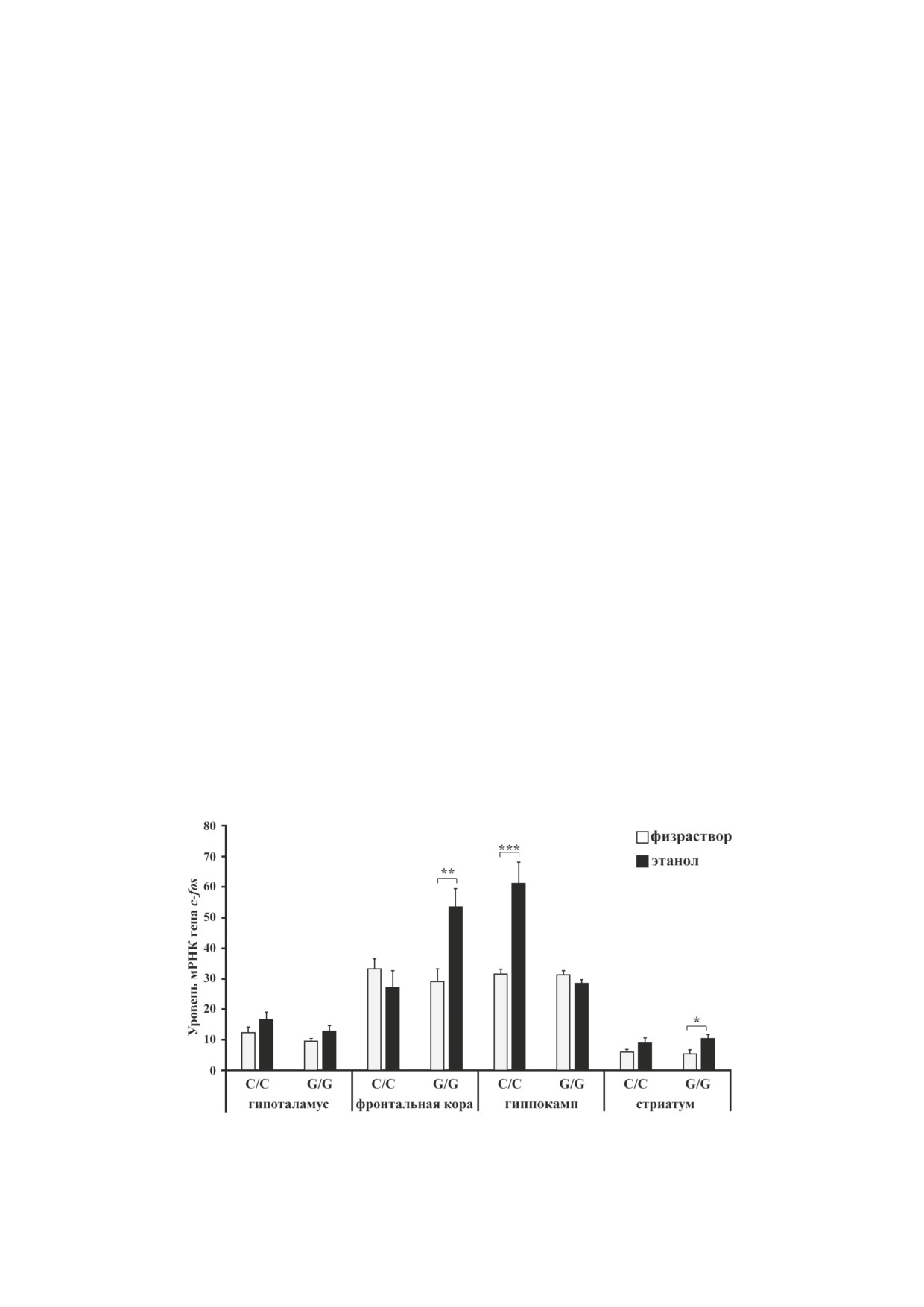
Экспрессия гена c-fos. Двухфакторный дис-
фическое разделение веществ осуществляли
персионный анализ выявил эффект этанола
в изократическом режиме элюирования при
(F1,22 = 5,23; p < 0,05) и взаимодействия фак-
скорости потока 0,6 мл/мин на колонке Luna
торов (F1,22 = 9,85; p < 0,01) для уровня мРНК
5 мкм C18, L × ID 75 × 4,6 мм, защищенной
гена c-fos во фронтальной коре, при этом
предколонкой C8 («Penomenex», США). По-
эффект генотипа был обнаружен на уровне
движная фаза состояла из 90%-ного буфера,
тенденции (F1,22 = 3,36, р = 0,08). Пост-хок-
содержащего 50 мМ дигидроортофосфата ка-
анализ показал достоверное увеличение экс-
лия («Sigma Aldrich», США), 1,4 мМ натриевой
прессии гена c-fos во фронтальной коре по-
соли октансульфоновой кислоты («Chimmed»,
сле введения этанола только у мышей линии
Россия) и 0,05 мМ этилендиаминтетрауксус-
B6-1473G (p < 0,01) (рис. 1). Были найдены
ной кислоты («Sigma Aldrich», США) рН 3,9 и
существенные эффекты генотипа (F1,22 = 24,15;
10% метанола («Chimmed»). Для построения
p < 0,001), этанола (F1,22 = 16,22; p < 0,001) и
калибровочной кривой внешних стандартов
взаимодействия этих факторов (F1,22 = 23,74;
использовали серию растворов, содержащих
p < 0,001) для уровня мРНК гена c-fos в гип-
0,5; 1 и 2 нг каждого исследуемого вещества
покампе. Анализ межгрупповых сравнений
(«Sigma Aldrich»). Высота пиков была оценена
показал, что рост уровня экспрессии этого
при помощи программы LabSolution LG/GC
гена, обусловленный введением этанола, на-
(«Shimadzu», США) и калибрована на соответ-
блюдался в гиппокампе только мышей линии
ствующий внешний стандарт. Концентрации
B6-1473С (p < 0,001) (рис. 1). В стриатуме
биогенных аминов выражали в нг/мг белка.
для уровня мРНК гена c-fos был обнаружен
Рис. 1. Влияние острого введения этанола на экспрессию гена c-fos в структурах мозга мышей линий B6-1473C (C/C)
и B6-1473G (G/G). Экспрессия генов представлена как отношение количества кДНК исследуемых генов к 100 копиям
кДНК rPol2; n = 6-7 животных в группе. * p < 0,05, ** p < 0,01, *** p < 0,001 по сравнению с мышами соответствующей
контрольной группы
БИОХИМИЯ том 88 вып. 3 2023
ПОЛИМОРФИЗМ C1473G В ГЕНЕ mTph2 В ЭФФЕКТАХ ВВЕДЕНИЯ ЭТАНОЛА
359
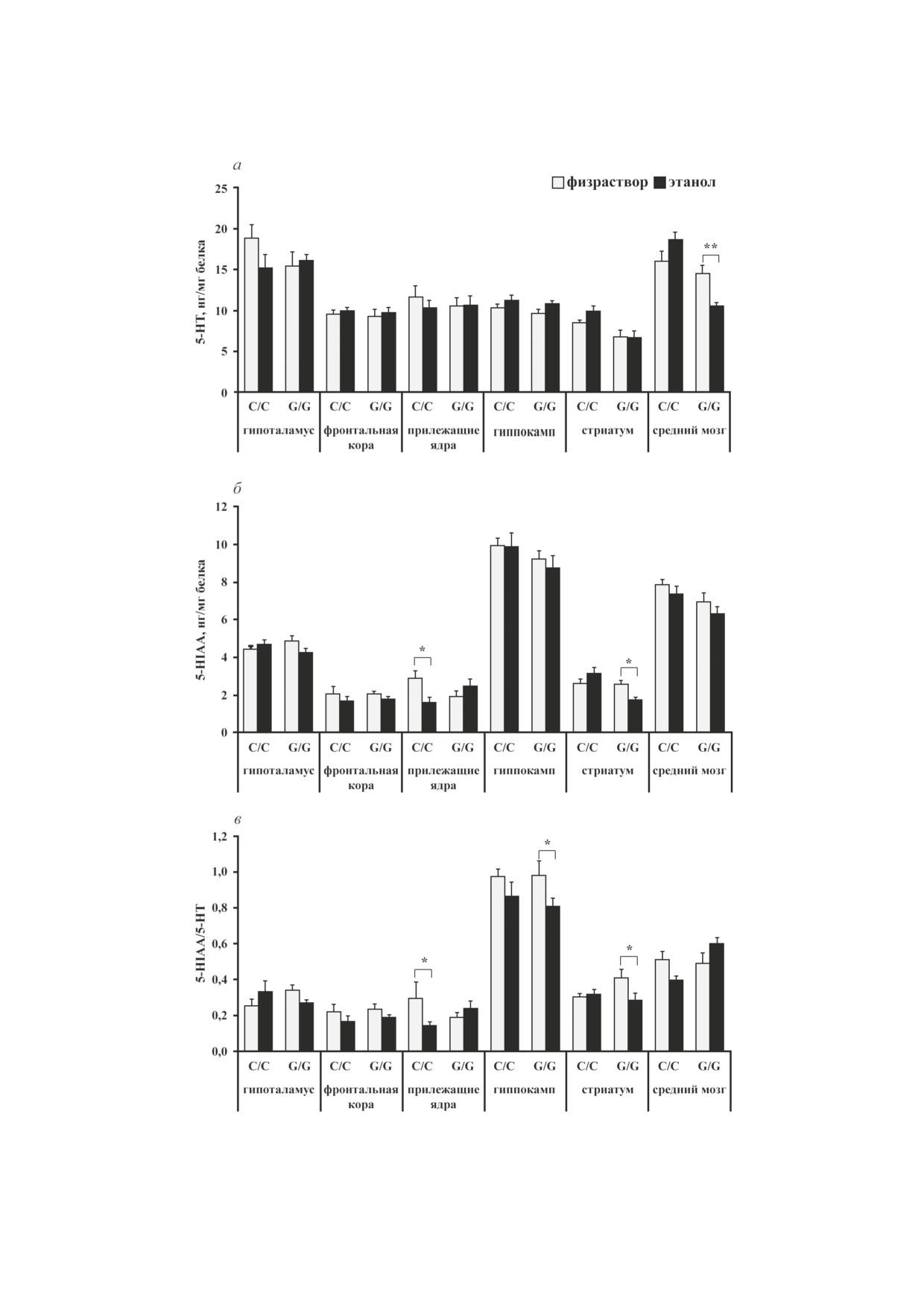
Рис. 2. Влияние острого введения этанола на содержание серотонина (а), его метаболита 5-HIAA (б) и индекс метабо-
лизма серотонина 5-HIAA/5-НТ (в) в структурах мозга мышей линий B6-1473C (C/C) и B6-1473G (G/G); n = 7-8 жи-
вотных в группе. * p < 0,05, ** p < 0,01 по сравнению с мышами соответствующей контрольной группы
БИОХИМИЯ том 88 вып. 3 2023
360
БАЗОВКИНА и др.
эффект этанола (F1,22 = 8,52; p < 0,01), но не
Содержание серотонина и его метаболита
генотипа (F1,22 < 1) и взаимодействия факторов
5-HIAA. Результаты дисперсионного анали-
(F1,22 < 1). Уровень мРНК гена c-fos был выше
за влияния факторов
«генотип»,
«этанол»
в стриатуме мышей B6-1473G, подвергавшихся
и их взаимодействия на уровень 5-HT, его
острой алкоголизации по сравнению с мыша-
метаболита
5-HIAA и индекс метаболизма
ми контрольной группы (p < 0,05). В гипотала-
серотонина 5-HIAA/5-HT в структурах мозга
мусе для уровня мРНК гена c-fos был найден
мышей линий В6-1473С и В6-1473G, подвер-
эффект этанола (F1,20 = 4,59; p < 0,05), эффект
гавшихся острому введению этанола, пред-
генотипа на уровне тенденции (F1,20 = 3,36;
ставлены в табл.
2. Анализ межгрупповых
p = 0,08) и не было обнаружено эффекта взаи-
сравнений показал, что после инъекции алко-
модействия факторов (F1,22 < 1). Анализ меж-
голя содержание 5-НТ в среднем мозге снизи-
групповых сравнений не показал никаких
лось у мышей B6-1473G (p < 0,01) и выросло
различий (рис. 1).
на уровне тенденции (р = 0,069) у животных
Таблица 2. Результаты дисперсионного анализа влияния факторов «генотип», «этанол» и их взаимодействия на уровень
5-HT, его метаболита 5-HIAA и индекс метаболизма серотонина 5-HIAA/5-HT в структурах мозга мышей линий
В6-1473С и В6-1473G, подвергавшихся острому введению этанола
Структура
Генотип
Этанол
Генотип × Этанол
5-HT
Гипоталамус
F1,25 < 1
F1,25 = 1,09; p > 0,05
F1,25 = 2,14; p > 0,05
Фронтальная кора
F1,25 < 1
F1,25 < 1
F1,25 < 1
Прилежащие ядра
F1,25 < 1
F1,25 < 1
F1,25 < 1
Гиппокамп
F1,26 = 1,08; p > 0,05
F1,26 = 3,71; p = 0,065
F1,26 < 1
Стриатум
F1,26 = 11,98; p < 0,01
F1,26 < 1
F1,26 = 1,98; p > 0,05
Средний мозг
F1,26 = 25,75; p < 0,001
F1,26 < 1
F1,26 = 12,37; p < 0,01
5-HIAA
Гипоталамус
F1,25 < 1
F1,25 < 1
F1,25 = 3,57, p = 0,07
Фронтальная кора
F1,25 < 1
F1,25 = 1,90, p > 0,05
F1,25 < 1
Прилежащие ядра
F1,25 < 1
F1,25 = 1,13; p > 0,05
F1,25 = 5,06; p < 0,05
Гиппокамп
F1,26 = 2,71; p > 0,05
F1,26 < 1
F1,26 < 1
Стриатум
F1,26 = 11,03; p < 0,01
F1,26 < 1
F1,26 = 12,19; p < 0,01
Средний мозг
F1,26 = 6,19; p < 0,05
F1,26 = 1,99; p > 0,05
F1,26 < 1
5-HIAA/5-HT
Гипоталамус
F1,25 < 1
F1,25 < 1
F1,25 = 4,62; p < 0,05
Фронтальная кора
F1,25 < 1
F1,25 = 2,69; p > 0,05
F1,25 < 1
Прилежащие ядра
F1,25 < 1
F1,25 = 1,04; p > 0,05
F1,25 = 4,66; p < 0,05
Гиппокамп
F1,26 < 1
F1,26 = 5,02; p < 0,05
F1,26 < 1
Стриатум
F1,26 = 1,07; p > 0,05
F1,26 = 2,04; p > 0,05
F1,26 = 4,11; p < 0,05
Средний мозг
F1,26 = 5,83; p < 0,05
F1,26 < 1
F1,26 = 8,08; p < 0,01
Примечание. Жирным шрифтом выделены статистически значимые результаты.
БИОХИМИЯ том 88 вып. 3 2023
ПОЛИМОРФИЗМ C1473G В ГЕНЕ mTph2 В ЭФФЕКТАХ ВВЕДЕНИЯ ЭТАНОЛА
361
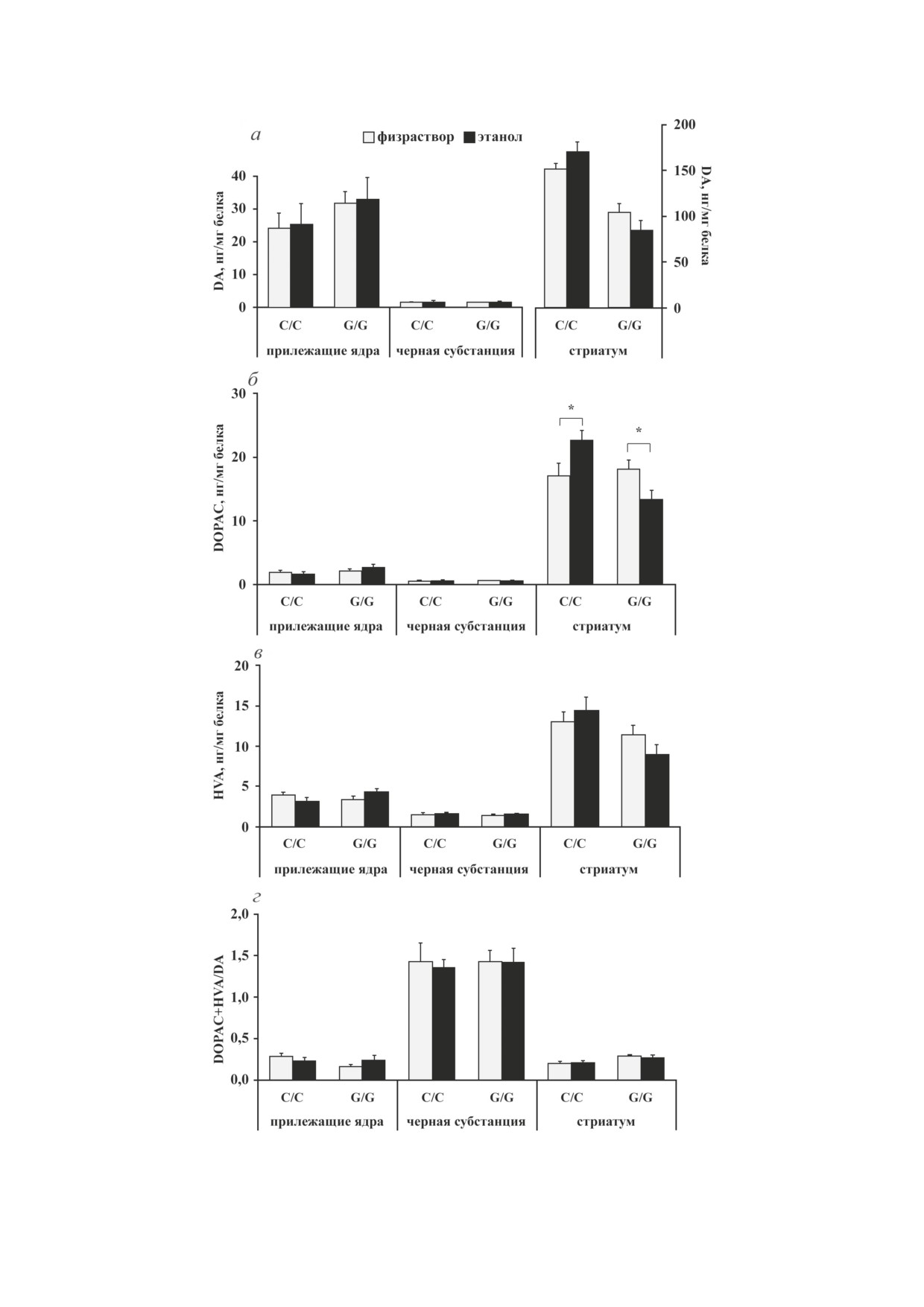
линии B6-1473С (рис. 2, а). Пост-хок-анали-
мышей линий В6-1473С и В6-1473G, подвергав-
зом было обнаружено падение уровня 5-HIAA
шихся острому введению этанола, представле-
в области прилежащих ядер мышей В6-1473С
ны в табл. 3. Анализ межгрупповых сравнений
(p < 0,05) и в стриатуме мышей B6-1473G
не выявил различий ни в одной из исследо-
(p < 0,05), получавших этанол, по сравнению
ванных структур по содержанию дофамина у
с контролем (рис. 2, б). Индекс метаболизма
животных обеих линий (p > 0,05) (рис. 3, а).
серотонина, определяемый как 5-HIAA/5-HT,
Однако в результате пост-хок-анализа было
снижался для области прилежащих ядер мы-
обнаружено, что уровень DOPAC в стриату-
шей В6-1473С (p < 0,05), а также гиппокам-
ме повысился у мышей В6-1473С (p < 0,05) и
па (p < 0,05) и стриатума мышей B6-1473G
упал - у животных B6-1473G (p < 0,05), полу-
(p < 0,05) после введения этанола (рис. 2, в).
чавших этанол (рис. 3, б). Кроме этого, анализ
Примечательно, что для среднего мозга этот
межгрупповых сравнений не выявил различий
показатель на уровне тенденции уменьшился у
ни в одной из исследованных структур по со-
животных линии В6-1473С (р = 0,054) и увели-
держанию HVA и индексу метаболизма дофа-
чился у мышей B6-1473G (р = 0,056) под дей-
мина DOPAC + HVA/DA у мышей обеих линий
ствием алкоголя (рис. 1, в).
(p > 0,05) (рис. 3, в и г).
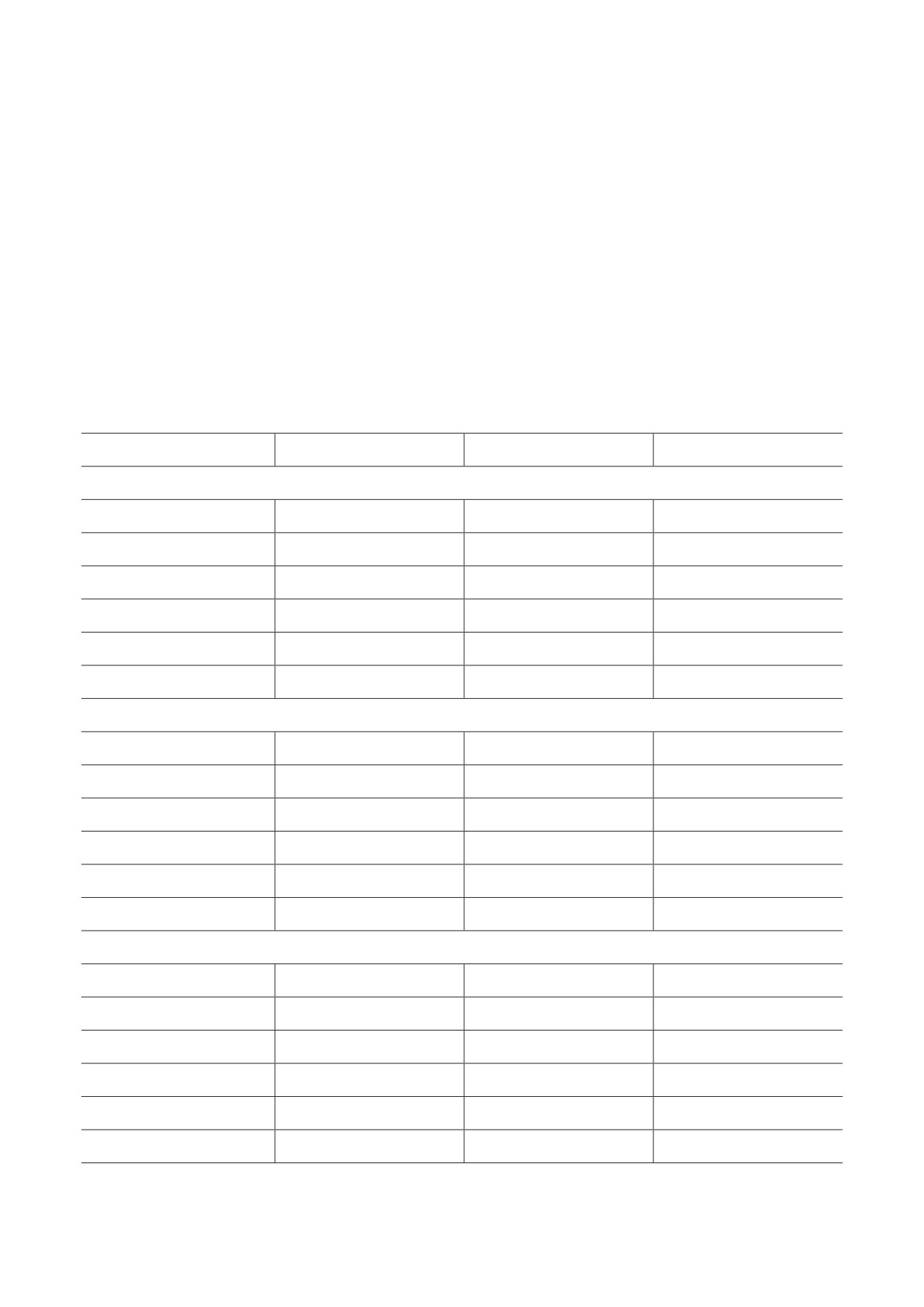
Содержание дофамина и его метаболитов
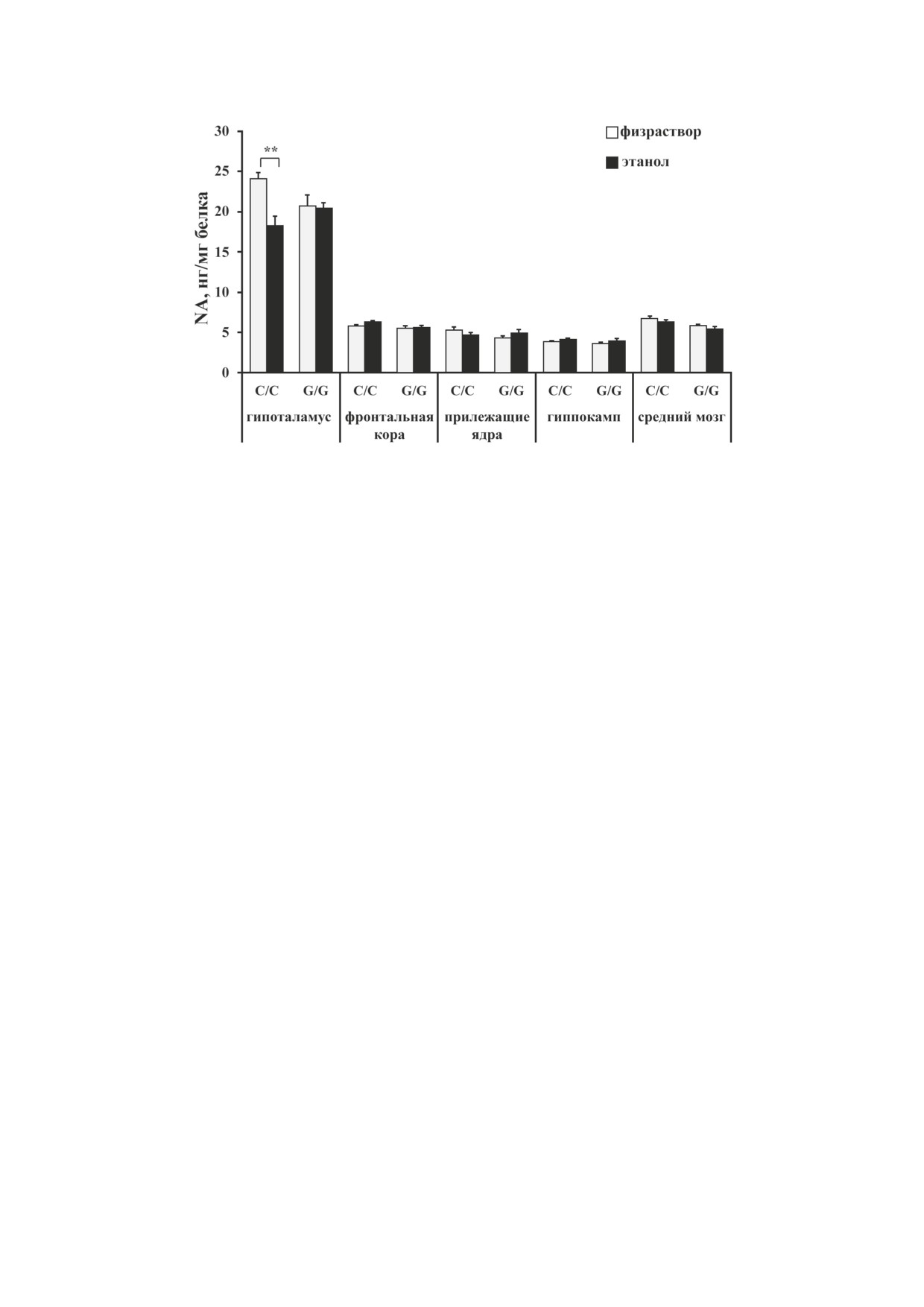
Содержание норадреналина. Двухфактор-
DOPAC и HVA. Результаты дисперсионного ана-
ный дисперсионный анализ выявил эффект
лиза влияния факторов «генотип», «этанол» и
этанола (F1,25 = 7,53; p < 0,05) и взаимодействия
их взаимодействия на уровень DA, его метабо-
факторов (F1,25 = 6,64; p < 0,05) для уровня
литов DOPAC, HVA и индекс метаболизма до-
норадреналина в гипоталамусе, при этом не
фамина DOPAC + HVA/DA в структурах мозга
было обнаружено эффекта генотипа (F1,25 < 1).
Таблица 3. Результаты дисперсионного анализа влияния факторов «генотип», «этанол» и их взаимодействия на
уровень DA, его метаболитов DOPAC, HVA и индекс метаболизма дофамина DOPAC + HVA/DA в структурах мозга
мышей линий В6-1473С и В6-1473G, подвергавшихся острому введению этанола
Структура
Генотип
Этанол
Генотип × Этанол
DA
Прилежащие ядра
F1,25 = 1,91; p > 0,05
F1,25 < 1
F1,25 < 1
Черная субстанция
F1,25 < 1
F1,25 < 1
F1,25 < 1
Стриатум
F1,26 = 47,95; p < 0,001
F1,26 < 1
F1,26 = 2,01; p = 0,055
DOPAC
Прилежащие ядра
F1,25 = 3,26; p = 0,08
F1,25 < 1
F1,25 = 1,08; p > 0,05
Черная субстанция
F1,25 < 1
F1,25 < 1
F1,25 < 1
Стриатум
F1,26 = 6,38; p < 0,05
F1,26 < 1
F1,26 = 10,05; p < 0,01
HVA
Прилежащие ядра
F1,25 < 1
F1,25 < 1
F1,25 = 4,05; p = 0,056
Черная субстанция
F1,25 < 1
F1,25 < 1
F1,25 < 1
Стриатум
F1,26 = 6,80; p < 0,001
F1,26 < 1
F1,26 = 1,99; p > 0,05
DOPAC + HVA/DA
Прилежащие ядра
F1,25 = 1,62; p > 0,05
F1,25 < 1
F1,25 = 2,14; p > 0,05
Черная субстанция
F1,25 < 1
F1,25 < 1
F1,25 < 1
Стриатум
F1,26 = 14,36; p < 0,001
F1,26 < 1
F1,26 < 1
Примечание. Жирным шрифтом выделены статистически значимые результаты.
БИОХИМИЯ том 88 вып. 3 2023
362
БАЗОВКИНА и др.
Рис. 3. Влияние острого введения этанола на содержание дофамина (а) и его метаболитов DOPAC (б), HVA (в) и индекс
метаболизма дофамина DOPAC + HVA/DA (г) в структурах мозга мышей линий B6-1473C (C/C) и B6-1473G (G/G);
n = 7-8 животных в группе. * p < 0,05 по сравнению с мышами соответствующей контрольной группы
БИОХИМИЯ том 88 вып. 3 2023
ПОЛИМОРФИЗМ C1473G В ГЕНЕ mTph2 В ЭФФЕКТАХ ВВЕДЕНИЯ ЭТАНОЛА
363
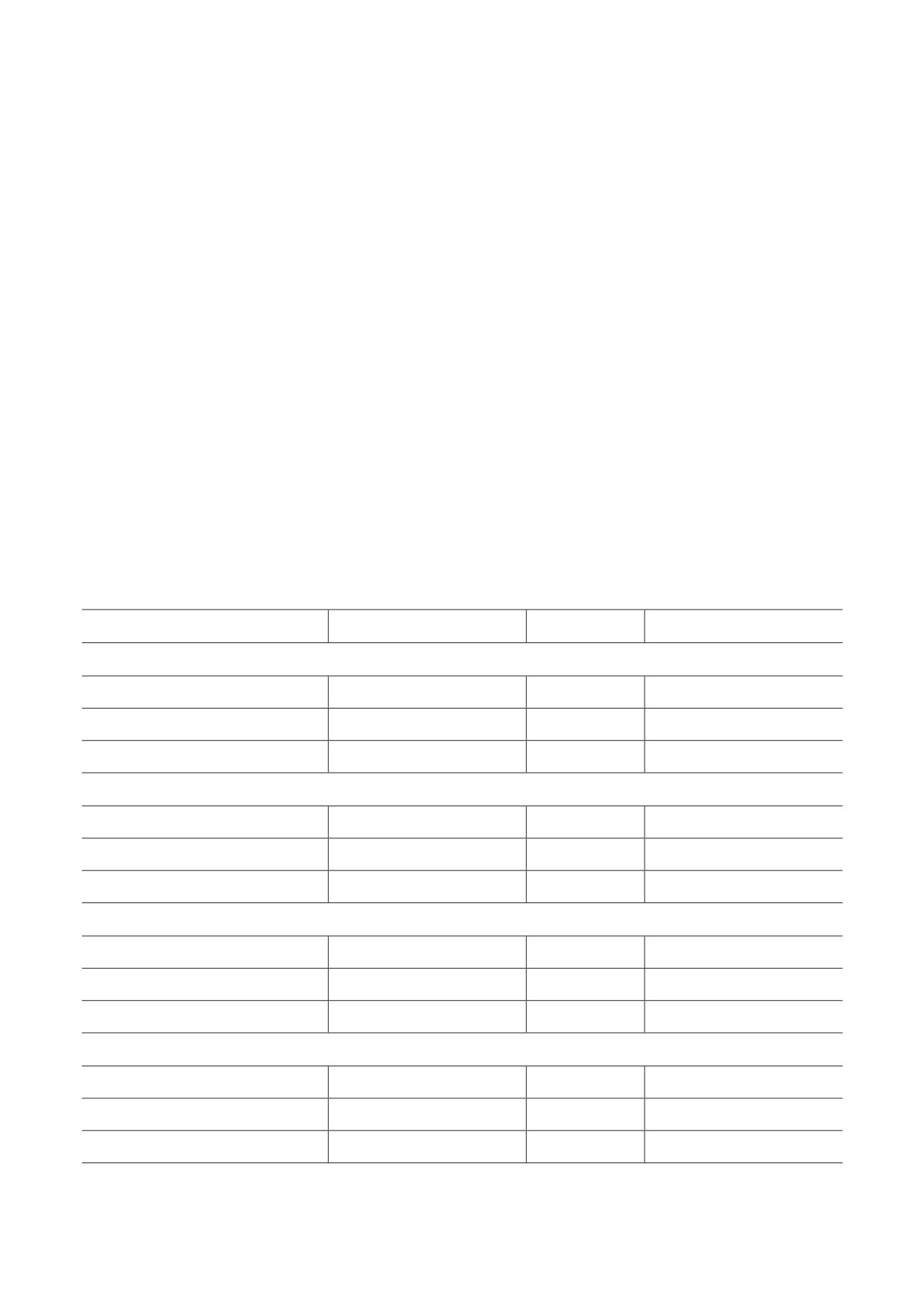
Рис. 4. Влияние острого введения этанола на содержание норадреналина в структурах мозга мышей линий B6-1473C
(C/C) и B6-1473G (G/G); n = 7-8 животных в группе. ** p < 0,01 по сравнению с мышами соответствующей
контрольной группы
Пост-хок-анализ показал достоверное сниже-
фектах острого действия этанола на нервную
ние уровня этого нейромедиатора в гипотала-
систему мышей. Для этого мы исследовали
мусе после введения этанола только у мышей
влияние острого введения этанола на экспрес-
линии B6-1473С (p < 0,01) (рис. 4). Не было
сию гена раннего ответа c-fos и метаболизм
обнаружено достоверного влияния ни генотипа
биогенных аминов в структурах мозга мышей
(F1,26 = 3,93; p = 0,058), ни этанола (F1,26 = 1,98;
конгенных линий B6-1473C и B6-1473G, раз-
p > 0,05), ни взаимодействия этих факторов
личающихся однонуклеотидной заменой
(F1,26 < 1) для фронтальной коры. Также дис-
C1473G в гене Tph2 и, как следствие, - функ-
персионный анализ не выявил эффектов гено-
циональной активностью фермента [16].
типа (F1,25 < 1), этанола (F1,25 < 1) и взаимодей-
По литературным данным, рост экспрессии
ствия этих факторов (F1,25 = 2,77; p > 0,05) для
гена с-fos является показателем нейрональной
содержания норадреналина в области при-
активности в мозге после воздействий, вклю-
лежащих ядер. Было найдено влияние эта-
чая острую алкогольную интоксикацию [25,
нола (F1,26 = 6,52; p < 0,05), но не генотипа
32-33]. Увеличение уровня мРНК гена c-fos
(F1,26 = 1,88; p > 0,05) и взаимодействия этих
в течение часа может наблюдаться при введе-
факторов (F1,26 < 1) для уровня норадреналина
нии этанола в дозах 0,25-4 г/кг [21, 23]. Однако
в гиппокампе. Анализ межгрупповых сравне-
некоторые исследователи отмечают, что, хотя
ний выявил лишь повышение на уровне тен-
рост экспрессии гена или белка c-Fos может
денции содержания этого нейромедиатора в
дать важную информацию об активированных
гиппокампе мышей В6-1473G (р = 0,66). Для
путях сигналинга, отрицательный результат не
среднего мозга дисперсионным анализом был
обязательно указывает на то, что активность
зафиксирован значительный эффект гено-
нейронов не повышалась в результате экспери-
типа (F1,25 = 15,61; p < 0,001), но не этанола
ментальных манипуляций [34]. В нашей работе
(F1,26 = 3,95; p = 0,058) и не взаимодействия
острое введение этанола по-разному изменило
этих факторов (F1,26 < 1). Анализ межгруппо-
паттерны экспрессии гена c-fos в структурах
вых сравнений не выявил различий между кон-
мозга: увеличение мРНК с-fos наблюдалось в
трольной и опытной группами мышей обеих
гиппокампе мышей линии B6-1473C (с нор-
линий по уровню норадреналина в среднем
мальной активностью ТПГ2) и во фронтальной
мозге (рис. 4).
коре и стриатуме мышей линии B6-1473G (со
сниженнной на 50% активностью ТПГ2). При-
мечательно, что в проведенном ранее экспери-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
менте по изучению эффекта острого (30 мин)
эмоционального стресса экспрессия гена с-fos
Целью данной работы было выяснение
значительно увеличивалась у мышей обеих ли-
роли полиморфизма C1473G в гене Tph2 в эф-
ний и в коре, и в гиппокампе [17].
БИОХИМИЯ том 88 вып. 3 2023
364
БАЗОВКИНА и др.
Различные исследования показали, что
Предположительно, острое введение этанола
острое введение этанола может приводить как
нарушает у мышей B6-1473G баланс компен-
к увеличению, так и к уменьшению уровня
саторных процессов в области среднего моз-
5-HT и его основного метаболита 5-HIAA во
га, и 5-НТ нейромедиаторная система мышей
всем мозге и/или различных областях мозга,
этой линии оказывается более чувствительной
или вообще не оказывать влияния на эти па-
к алкоголю. Это предположение согласуется
раметры [35, 36]. Эти противоречия, вероятно,
с данными литературы, демонстрирующими
можно объяснить тем, что в описанных рабо-
увеличение чувствительности ауторецепто-
тах используются различные виды и линии
ров 5-НТ1А вследствие действия этанола [40].
животных и дизайны экспериментов (дозы
Нужно отметить, что 30-минутный рестрик-
этанола, способ его введения, временные ин-
ционный стресс оказал большее влияние на
тервалы и т.д.). В нашем исследовании боль-
метаболизм 5-НТ-системы животных линии
ше изменений в метаболизме серотониновой
B6-1473С [17]. Данные этого эксперимента и
системы мозга после введения этанола демон-
результаты нашей работы свидетельствуют о
стрировали мыши линии B6-1473G, у которых
разных механизмах регуляции эффектов ост-
наблюдалось достоверное снижение содержа-
рого эмоционального стресса и острого вве-
ния 5-НТ в области ядер шва среднего мозга
дения этанола у мышей линий B6-1473G и
и метаболита - в стриатуме, а также уменьше-
B6-1473С на 5-НТ-систему мозга и экспрессию
ние индекса метаболизма 5-НТ в гиппокампе
гена раннего ответа с-fos.
и стриатуме. В то же время у мышей линии
Другими важными нейромедиаторами, уча-
B6-1473C наиболее чувствительной к острому
ствующими в контроле этанол-индуцирован-
действию этанола оказалась область прилежа-
ных эффектов на нервную систему, являются
щих ядер, где наблюдалось снижение 5-HIAA
дофамин и норадреналин [41-42]. В данной ра-
и индекса метаболизма нейромедиатора. Весь-
боте острое введение этанола оказало разнона-
ма примечательно, что изменения в показателе
правленный эффект на изменение содержания
5-HIAA/5-HT для области ядер шва среднего
метаболита дофамина DOPAC в стриатуме: об-
мозга носили разнонаправленный характер
наружено снижение у мышей B6-1473G, а также
(хотя и на уровне тенденции): уменьшение
повышение - у мышей B6-1473С. Последний
для мышей B6-1473C и увеличение для мышей
результат косвенно может свидетельствовать
B6-1473G. Поскольку область ядер шва сред-
об увеличении внеклеточного дофамина в об-
него мозга является основным местом локали-
ласти стриатума под действием этанола, что
зации тел серотониновых нейронов [8], можно
согласуется с данными литературы [43]. Ранее
предположить связь обнаруженного эффекта
было показано, что полиморфизм C1473G в
введения этанола с особенностями 5-НТ-си-
гене Tph2 влияет на метаболизм DA-системы
стемы мозга мышей B6-1473G. Важно отме-
мозга, приводя к снижению уровней DA и
тить - несмотря на то что замена цитозина на
DOPAC в среднем мозге и стриатуме [44], одна-
гуанин в положении 1473 гена Tph2 приводит
ко механизм этого влияния остается пока неяс-
к существенному снижению активности фер-
ным. Вероятно, измененная регуляция дофа-
мента ТПГ2, между контрольными группами
миновой нейромедиаторной системы у мышей
линий B6-1473G и B6-1473С не было найдено
линии B6-1473G обусловила различие в ответах
достоверных различий в уровне серотонина,
введения этанола на эту систему мозга у живот-
что согласуется с более ранними исследова-
ных обеих линий. Также в нашем исследова-
ниями [16, 37]. Этот факт может быть объ-
нии острая алкоголизация привела к падению
яснен развитием компенсаторных процессов
содержания норадреналина в гипоталамусе, но
в серотонинергической системе мозга у мы-
только у мышей линии B6-1473С, что согласу-
шей B6-1473G (вследствие снижения актив-
ется с данными о большей чувствительности к
ности ТПГ2), одним из которых является де-
острому стрессу животных этой линии [17].
сенситизация пресинаптических рецепторов
Таким образом, полиморфизм C1473G
5-НТ1А, локализованных в области ядер шва
в гене Tph2 участвует в регуляции эффектов
среднего мозга и осуществляющих регуля-
острого введения этанола на экспрессию гена
цию высвобождения серотонина по принципу
раннего ответа c-fos и метаболизм важней-
«обратной связи» [38]. Механизмы действия
ших нейромедиаторов, таких как серотонин и
острого введения этанола на высвобождение
катехоламины. Результаты настоящей работы
5-НТ до сих пор остаются не до конца ясны.
говорят о том, что линии мышей B6-1473G и
Считается, что в регуляции этих процессов
B6-1473С являются перспективными для из-
значительную роль играет активность пре-
учения роли ТПГ2 в регуляции эффектов ал-
синаптических
5-НТ1А-ауторецепторов
[39].
коголя на центральную нервную систему.
БИОХИМИЯ том 88 вып. 3 2023
ПОЛИМОРФИЗМ C1473G В ГЕНЕ mTph2 В ЭФФЕКТАХ ВВЕДЕНИЯ ЭТАНОЛА
365
Вклад авторов. Д.В. Базовкина, А.В. Ку-
Соблюдение этических норм. Все процеду-
ликов - концепция и руководство работой;
ры выполняли в соответствии с Международ-
Д.В. Базовкина, Д.В. Фурсенко, В.С. Наумен-
ными правилами обращения с животными
ко - проведение экспериментов; Д.В. Базовкина,
(National Institute of Health Guide for the Care
А.В. Куликов - обсуждение результатов исследо-
and Use of Laboratory Animals, NIH Publications
вания; Д.В. Базовкина - написание текста статьи.
No. 80023, 1996) и приказом Министерства
Финансирование. Работа выполнена при
здравоохранения РФ от 01.04.2016 № 119н «Об
поддержке Российского научного фонда (грант
утверждении правил надлежащей лаборатор-
№ 21-15-00051). Содержание животных осущес-
ной практики» (зарегистрирован
15.08.2016
твлялось за счет средств бюджетного проекта
№ 43232). Условия содержания животных и
FWNR-2022-0023.
проведенные экспериментальные процеду-
Конфликт интересов. Авторы заявляют об
ры были одобрены Комиссией по биоэтике
отсутствии конфликта интересов.
ИЦиГ СО РАН.
СПИСОК ЛИТЕРАТУРЫ
1.
Sari, Y., Johnson, V. R., and Weedman, J. M. (2011)
8.
Kulikova, E. A., and Kulikov, A. V. (2019) Trypto-
Role of the serotonergic system in alcohol dependence:
phan hydroxylase 2 as a therapeutic target for psychi-
from animal models to clinics, Prog. Mol. Biol.
atric disorders: focus on animal models, Expert. Opin.
Transl. Sci., 98, 401-443, doi: 10.1016/B978-0-12-
Ther. Targets, 23, 655-667, doi: 10.1080/14728222.
385506-0.00010-7.
2019.1634691.
2.
Marcinkiewcz, C. A. (2015) Serotonergic systems in
9.
Zhang, X., Gainetdinov, R. R., Beaulieu, J. M.,
the pathophysiology of ethanol dependence: relevance
Sotnikova, T. D., Burch, L. H., Williams, R. B.,
to clinical alcoholism, ACS Chem. Neurosci., 6, 1026-
Schwartz, D. A., Krishnan, K. R., and Caron, M. G.
1039, doi: 10.1021/cn5003573.
(2005) Loss-of-function mutation in tryptophan
3.
Lappalainen, J., Long, J. C., Eggert, M., Ozaki, N.,
hydroxylase-2 identified in unipolar major depression,
Robin, R. W., Brown, G. L., Naukkarinen, H.,
Neuron, 45, 11-16, doi: 10.1016/j.neuron.2004.12.014.
Virkkunen, M., Linnoila, M., and Goldman, D.
10.
Bach, H., Arango, V., Kassir, S. A., Tsaava, T.,
(1998) Linkage of antisocial alcoholism to the
Dwork, A. J., Mann, J. J., and Underwood, M. D.
serotonin 5-HT1B receptor gene in 2 populations,
(2014) Alcoholics have more tryptophan hydroxylase 2
Arch. Gen. Psychiatry, 55, 989-994, doi: 10.1001/
mRNA and protein in the dorsal and median raphe
archpsyc.55.11.989.
nuclei, Alcohol. Clin. Exp. Res.,
38,
1894-1901,
4.
Bonasera, S. J., Chu, H. M., Brennan, T. J.,
doi: 10.1111/acer.12414.
and Tecott, L. H. (2006) A null mutation of the
11.
Zupanc, T., Pregelj, P., Tomori, M., Komel, R.,
serotonin
6 receptor alters acute responses to
and Paska, A. V. (2011) TPH2 polymorphisms and
ethanol, Neuropsychopharmacology,
31,
1801-1813,
alcohol-related suicide, Neurosci. Lett., 490, 78-81,
doi: 10.1038/sj.npp.1301030.
doi: 10.1016/j.neulet.2010.12.030.
5.
Wrzosek, M., Jakubczyk, A., Wrzosek, M.,
12.
Bragatti, J. A., Bandeira, I. C., de Carvalho, A. M.,
Matsumoto, H., Łukaszkiewicz, J., Brower, K. J.,
Abujamra, A. L., Leistner-Segal, S., and Bian-
and Wojnar, M. (2012) Serotonin 2A receptor gene
chin, M. M. (2014) Tryptophan hydroxylase 2 (TPH2)
(HTR2A) polymorphism in alcohol-dependent
gene polymorphisms and psychiatric comorbidities
patients, Pharmacol. Rep., 64, 449-453, doi: 10.1016/
in temporal lobe epilepsy, Epilepsy Behav., 32, 59-63,
s1734-1140(12)70787-9.
doi: 10.1016/j.yebeh.2014.01.007.
6.
Boyce-Rustay, J. M., Wiedholz, L. M., Millstein,
13.
Zill, P., Preuss, U. W., Koller, G., Bondy, B., and
R. A., Carroll, J., Murphy, D. L., Daws, L. C.,
Soyka, M.
(2007) SNP- and haplotype analysis
and Holmes, A. (2006) Ethanol-related behaviors
of the tryptophan hydroxylase 2 gene in alcohol-
in serotonin transporter knockout mice, Alcohol.
dependent patients and alcohol-related suicide,
Clin. Exp. Res., 30, 1957-1965, doi: 10.1111/j.1530-
Neuropsychopharmacology, 32, 1687-1694, doi: 10.1038/
0277.2006.00241.x.
sj.npp.1301318.
7.
Popova, N. K., Vishnivetskaya, G. B., Ivanova, E. A.,
14.
Gacek, P., Conner, T. S., Tennen, H., Kranzler, H. R.,
Skrinskaya, J. A., and Seif, I. (2000) Altered behavior
and Covault, J. (2008) Tryptophan hydroxylase 2 gene
and alcohol tolerance in transgenic mice lacking
and alcohol use among college students, Addict. Biol.,
MAO A: a comparison with effects of MAO A inhibitor
13, 440-448, doi: 10.1111/j.1369-1600.2008.00118.x.
clorgyline, Pharmacol. Biochem. Behav., 67, 719-727,
15.
Zhang, X., Beaulieu, J. M., Sotnikova, T. D., Gainet-
doi: 10.1016/s0091-3057(00)00417-2.
dinov, R. R., and Caron, M. G. (2004) Tryptophan
БИОХИМИЯ том 88 вып. 3 2023
366
БАЗОВКИНА и др.
hydroxylase-2 controls brain serotonin synthesis,
targets, synapses, and circuits, Neuron, 96, 1223-1238,
Science, 305, 217, doi: 10.1126/science.1097540.
doi: 10.1016/j.neuron.2017.10.032.
16.
Osipova, D. V., Kulikov, A. V., and Popova, N. K.
27.
Ford, C. P. (2014) The role of D2-autoreceptors
(2009) C1473G polymorphism in mouse tph2 gene
in regulating dopamine neuron activity and
is linked to tryptophan hydroxylase-2 activity in
transmission, Neuroscience, 282, 13-22, doi: 10.1016/
the brain, intermale aggression, and depressive-like
j.neuroscience.2014.01.025.
behavior in the forced swim test, J. Neurosci. Res., 87,
28.
Slotnick, B. M., and Leonard, C. M. (1975) A Stereo-
1168-1174, doi: 10.1002/jnr.21928.
taxic Atlas of the Albino Mouse Forebrain, U. S. Dept. of
17.
Bazhenova, E. Y., Bazovkina, D. V., Kulikova, E. A.,
Health, Education and Welfare, Rockville, 174 p.
Fursenko, D. V., Khotskin, N. V., Lichman, D. V., and
29.
Naumenko, V. S., and Kulikov, A. V. (2006) Quanti-
Kulikov, A. V. (2017) C1473G polymorphism in mouse
tative assay of 5-HT(1A) serotonin receptor gene ex-
tryptophan hydroxylase-2 gene in the regulation of the
pression in the brain, Mol. Biol. (Mosk), 40, 37-44,
reaction to emotional stress, Neurosci. Lett., 640, 105-
doi: 10.1134/s0026893306010079.
110, doi: 10.1016/j.neulet.2017.01.010.
30.
Naumenko, V. S., Osipova, D. V., Kostina, E. V.,
18.
Bazhenova, E. Y., Fursenko, D. V., Kulikova, E. A.,
and Kulikov, A. V. (2008) Utilization of a two-
Khotskin, N. V., Sinyakova, N. A., and Kulikov, A. V.
standard system in real-time PCR for quantification
(2019) Effect of photoperiodic alterations on depres-
of gene expression in the brain, J. Neurosci.
sion-like behavior and the brain serotonin system in
Methods,
170,
197-203, doi:
10.1016/j.jneumeth.
mice genetically different in tryptophan hydroxylase
2008.01.008.
2 activity, Neurosci. Lett., 699, 91-96, doi: 10.1016/
31.
Bazovkina, D., Naumenko, V., Bazhenova, E., and
j.neulet.2019.01.041.
Kondaurova, E. (2021) Effect of central administration
19.
Bazovkina, D. V., Lichman, D. V., and Kulikov, A. V.
of brain-derived neurotrophic factor (BDNF) on
(2015) The C1473G polymorphism in the Tryptophan
behavior and brain monoamine metabolism in new
hydroxylase-2 gene: involvement in ethanol-related
recombinant mouse lines differing by 5-HT1A receptor
behavior in mice, Neurosci. Lett.,
589,
79-82,
functionality, Int. J. Mol. Sci., 22, 11987, doi: 10.3390/
doi: 10.1016/j.neulet.2015.01.043.
ijms222111987.
20.
Boone, E. M., Cook, M. N., Hou, X., and Jones, B. C.
32.
Robinson, S. L., Dornellas, A., Burnham, N. W.,
(1997) Sex and strain influence the effect of ethanol
Houck, C. A., Luhn, K. L., Bendrath, S. C., Com-
on central monoamines, J. Stud. Alcohol, 58, 590-599,
panion, M. A., Brewton, H. W., Thomas, R. D.,
doi: 10.15288/jsa.1997.58.590.
Navarro, M., and Thiele, T. E. (2020) Distinct and
21.
Hitzemann, B., and Hitzemann, R. (1997) Genetics
overlapping patterns of acute ethanol-induced c-Fos
ethanol and the Fos response: a comparison of the
activation in two inbred replicate lines of mice select-
C57BL/6J and DBA/2J inbred mouse strains, Alcohol.
ed for drinking to high blood ethanol concentrations,
Clin. Exp. Res., 21, 1497-1507.
Brain Sci., 10, 988, doi: 10.3390/brainsci10120988.
22.
Raymond, J. S., Wilson, B. B., Tan, O., Gururajan, A.,
33.
Smith, M. L., Li, J., Cote, D. M., and Ryabinin, A. E.
and Bowen, M. T. (2019) Acute alcohol exposure dose-
(2016) Effects of isoflurane and ethanol administration
dependently alleviates social avoidance in adolescent
on c-Fos immunoreactivity in mice, Neuroscience,
mice and inhibits social investigation in adult mice,
316, 337-343, doi: 10.1016/j.neuroscience.2015.12.047.
Psychopharmacology, 236, 3625-3639, doi: 10.1007/
34.
McBride, W. J. (2002) Central nucleus of the amygdala
s00213-019-05335-8.
and the effects of alcohol and alcohol-drinking
23.
Ogilvie, K. M., Lee, S., and Rivier, C. (1998) Di-
behavior in rodents, Pharmacol. Biochem. Behav., 71,
vergence in the expression of molecular markers of
509-515, doi: 10.1016/s0091-3057(01)00680-3.
neuronal activation in the parvocellular paraventric-
35.
LeMarquand, D., Pihl, R. O., and Benkelfat, C. (1994)
ular nucleus of the hypothalamus evoked by alcohol
Serotonin and alcohol intake, abuse, and dependence:
administration via different routes, J. Neurosci., 18,
findings of animal studies, Biol. Psychiatry, 36, 395-
4344-4352.
421, doi: 10.1016/0006-3223(94)91215-7.
24.
Nevo, I., and Hamon, M. (1995) Neurotransmitter
36.
Badawy, A. A. (2002) Tryptophan metabolism in
and neuromodulatory mechanisms involved in alcohol
alcoholism, Nutr. Res. Rev., 15, 123-152, doi: 10.1079/
abuse and alcoholism, Neurochem. Int., 26, 305-342,
NRR200133.
doi: 10.1016/0197-0186(94)00139-l.
37.
Siesser, W. B., Zhang, X., Jacobsen, J. P., Sotniko-
25.
Vilpoux, C., Warnault, V., Pierrefiche, O., Daoust, M.,
va, T. D., Gainetdinov, R. R., and Caron, M. G.
and Naassila, M. (2009) Ethanol-sensitive brain re-
(2010) Tryptophan hydroxylase 2 genotype determines
gions in rat and mouse: a cartographic review, using im-
brain serotonin synthesis but not tissue content in
mediate early gene expression, Alcohol. Clin. Exp. Res.,
C57Bl/6 and BALB/c congenic mice, Neurosci. Lett.,
33, 945-969, doi: 10.1111/j.1530-0277.2009.00916.x.
481, 6-11, doi: 10.1016/j.neulet.2010.06.035.
26.
Abrahao, K. P., Salinas, A. G., and Lovinger, D. M.
38.
Berger, S. M., Weber, T., Perreau-Lenz, S.,
(2017) Alcohol and the brain: neuronal molecular
Vogt, M. A., Gartside, S. E., Maser-Gluth, C., Lan-
БИОХИМИЯ том 88 вып. 3 2023
ПОЛИМОРФИЗМ C1473G В ГЕНЕ mTph2 В ЭФФЕКТАХ ВВЕДЕНИЯ ЭТАНОЛА
367
fumey, L., Gass, P., Spanagel, R., and Bartsch, D.
modulation, and relationship to stress, Alcohol, 43,
(2012) A functional Tph2 C1473G polymorphism
531-539, doi: 10.1016/j.alcohol.2009.05.004.
causes an anxiety phenotype via compensatory chang-
42. Weinshenker, D., and Schroeder, J. P. (2007) There
es in the serotonergic system, Neuropsychopharmacolo-
and back again: a tale of norepinephrine and drug
gy, 37, 1986-1998, doi: 10.1038/npp.2012.46.
addiction, Neuropsychopharmacology, 32, 1433-1451,
39. Kirby, L. G., Zeeb, F. D., and Winstanley, C. A. (2011)
doi: 10.1038/sj.npp.1301263.
Contributions of serotonin in addiction vulnerability,
43. Tang, A., George, M. A., Randall, J. A., and
Neuropharmacology,
61,
421-432, doi:
10.1016/
Gonzales, R. A. (2003) Ethanol increases extracellular
j.neuropharm.2011.03.022.
dopamine concentration in the ventral striatum in
40. Kelaï, S., Renoir, T., Chouchana, L., Saurini, F.,
C57BL/6 mice, Alcohol. Clin. Exp. Res., 27, 1083-
Hanoun, N., Hamon, M., and Lanfumey, L. (2008)
1089, doi: 10.1097/01.ALC.0000075825.14331.65.
Chronic voluntary ethanol intake hypersensitizes
44. Sinyakova, N. A., Bazhenova, E. Y., Kulikova, E. A.,
5-HT1A autoreceptors in C57BL/6J mice, J. Neuro-
Fursenko, D. V., and Kulikov, A. V. (2020) Effect of
chem., 107, 1660-1670, doi: 10.1111/j.1471-4159.2008.
the C1473G polymorphic variant of the tryptophan
05733.x.
hydroxylase 2 gene and photoperiod length on the
41. Melis, M., Diana, M., Enrico, P., Marinelli, M.,
dopamine system of the mouse brain [in Russian],
and Brodie, M. S. (2009) Ethanol and acetaldehyde
Mol. Biol. (Mosk),
54,
60-68, doi:
10.31857/
action on central dopamine systems: mechanisms,
S0026898420010140.
THE ROLE OF C1473G POLYMORPHISM
IN TRIPTOPHANHYDROXYLASE-2 GENE IN THE ACUTE ETHANOL
EFFECTS ON c-fos GENE EXPRESSION AND METABOLISM
OF BIOGENIC AMINES IN BRAIN OF MICE
D. V. Bazovkina*, D. V. Fursenko, V. S. Naumenko, and A. V. Kulikov
Institute of Cytology and Genetics, Siberian Branch of Russian Academy of Sciences,
630090 Novosibirsk, Russia; E-mail: daryabazovkina@gmail.com
Tryptophan hydroxylase-2 is a key enzyme in the synthesis of the neurotransmitter serotonin, which plays
an important role in the mechanisms of regulation of a wide range of physiological functions and behaviors.
In this work, we studied the effect of acute ethanol administration on the expression of the c-fos early response
gene and the metabolism of serotonin and catecholamines in the brain structures of B6-1473C and B6-1473G
congenic mice, which differ in the C1473G single-nucleotide substitution in the Tph2 gene and enzyme activity.
Acute alcoholization led to a significant increase in c-fos gene expression in the frontal cortex and striatum
of B6-1473G mice and the hippocampus of B6-1473C mice. The introduction of ethanol caused a decrease in
the index of serotonin metabolism in the nucleus accumbens in B6-1473C mice, as well as in the hippocampus
and striatum of B6-1473G mice. Also, ethanol led to a decrease in the level of norepinephrine in the hypo-
thalamus in B6-1473C mice. Thus, the C1473G polymorphism in the Tph2 gene has a significant effect on
changes in the c-fos gene expression pattern and metabolism of biogenic amines in the brain induced by acute
ethanol administration.
Keywords: ethanol, C1473G polymorphism, tryptophan hydroxylase-2, c-fos gene, serotonin, dopamine,
norepinephrine, mouse
БИОХИМИЯ том 88 вып. 3 2023