БИОХИМИЯ, 2023, том 88, вып. 5, с. 817 - 831
УДК 577.151
ГЛУТАРЕДОКСИН 1 ЭВОЛЮЦИОННО ДРЕВНЕЙ ГИДРЫ:
СВОЙСТВА ФЕРМЕНТА И ЕГО ВОЗМОЖНЫЕ
ВНУТРИКЛЕТОЧНЫЕ ФУНКЦИИ
© 2023 N. Perween1,2, K. Pekhale1, G. Haval1,3, G.S. Bose4,
S.P.K. Mittal4, S. Ghaskadbi5, S.S. Ghaskadbi1*
1 Savitribai Phule Pune University, Department of Zoology,
Pune 411007, India; e-mail: ssg@unipune.ac.in; sghaskadbi@gmail.com
2 M. C. E. Society’s Abeda Inamdar Senior College, Department of Zoology, Pune 411001, India
3 Abasaheb Garware College, Department of Zoology, Pune 411004, India
4 Savitribai Phule Pune University, Department of Biotechnology, Pune 411007, India
5 Agharkar Research Institute, Developmental Biology Group, Pune 411004, India
Поступила в редакцию 23.10.2022
После доработки 20.02.2023
Принята к публикации 20.02.2023
Глутаредоксин (Grx) является антиоксидантным редокс-белком, который использует глутатион в
качестве донора электронов. Grx играет важную роль в различных внутриклеточных процессах,
включая антиоксидантную защиту, клеточный редокс-статус, редокс-контроль процесса тран-
скрипции, обратимое S-глутатионилирование специфических белков, апоптоз, дифференцировка
клеток и др. В настоящем исследовании нами был выделен и охарактеризован дитиольный глута-
редоксин из Hydra vulgaris Ind-Pune (HvGrx1). Анализ аминокислотной последовательности пока-
зал, что HvGrx1 принадлежит к семейству Grx с классическим мотивом Grx (CPYC). Филогенети-
ческий анализ и моделирование гомологии свидетельствуют о близком родстве HvGrx1 с белком
Grx2 Danio rerio. Ген, кодирующий HvGrx1, был клонирован и экспрессирован в клетках Escherichia
coli; очищенный белок имел молекулярную массу 11,82 кДа. HvGrx1 эффективно восстанавливал
β-гидроксиэтилдисульфид (HED) с температурным оптимум 25 °C и рН-оптимум - 8,0. Экспрес-
сия HvGrx1 наблюдалась во всех частях тела Hydra. Экспрессия мРНК HvGrx1 и ферментативная
активность HvGrx1 значительно повышались после воздействия H2O2. При экспрессии в культуре
клеток человека HvGrx1 защищал клетки от окислительного стресса и усиливал пролиферацию
и миграцию клеток. Несмотря на то что Hydra является простым беспозвоночным, HvGrx1 эволю-
ционно ближе к своим гомологам из высших позвоночных (как и многие другие белки Hydra).
КЛЮЧЕВЫЕ СЛОВА: глутаредоксин, Hydra, гидра, редокс.
DOI: 10.31857/S0320972523050093, EDN: AYQWOQ
ВВЕДЕНИЕ
эктодермальным и эндодермальным эпители-
альным клеткам соответственно, и интерсти-
Hydra (Cnidaria) является эволюционно
циальные клетки, которые являются мультипо-
древним многоклеточным животным, которое
тентными клетками и дают начало нейронам,
предположительно эволюционировало пример-
нематоцитам, железистым клеткам и клеткам
но 60 млн лет назад [1]. Несмотря на простое
слизистой оболочки, а также сперматозоидам
диплобластическое строение тела, Hydra обла-
и яйцеклеткам [2]. Эктодермальные и эндодер-
дает сформировавшейся нервной системой и
мальные стволовые клетки самообновляются
тремя различными линиями стволовых клеток:
примерно через 3-4 дня, тогда как интерстици-
эктодермальные и эндодермальные эпители-
альные клетки - примерно через 1,5 дня. Ство-
альные стволовые клетки, которые дают начало ловые клетки Hydra непрерывно дифферен-
Принятые сокращения: DIG - дигоксигенин; GR - глутатионредуктаза; Grx - глутаредоксин; HvGrx1 - глутаредок-
син 1 из Hydra vulgaris; GSH - глутатион; HED - β-гидроксиэтилдисульфид; ISH - гибридизация in situ; Trx - тиоредок-
син; HvTrx1 - тиоредоксин из H. vulgaris.
* Адресат для корреспонденции.
817
9
818
PERWEEN и др.
цируются и замещают клетки организма. Для
N-концевой цистеин и одна молекула GSH для
Hydra характерны постоянно активные клеточ-
восстановления дисульфида, а образовавшийся
ные процессы, такие как деление, адгезия, ми-
глутатионилированный Grx регенерируется не-
грация, дифференцировка и апоптоз [3]. Кроме
посредственно GSH. Большинство монотиоль-
того, Hydra обладает впечатляющей регенера-
ных Grx лишены классической ферментативной
тивной способностью. Она не проявляет орга-
активности in vitro [18]. Монотиольные Grx мо-
низменного старения, и поэтому считается по-
гут быть однодоменными белками или состоять
тенциально бессмертным животным [4, 5]. Эти
из нескольких доменов с N-концевым Trx-по-
замечательные способности Hydra обеспечива-
добным доменом. Дитиольные Grx принимают
ются непрерывным самообновлением и диффе-
участие в различных внутриклеточных процес-
ренцировкой трех линий стволовых клеток [6].
сах, таких как синтез дезоксирибонуклеотидов,
Белком, ответственным за поддержание ство-
антиоксидантная защита, клеточный редокс-
ловых клеток и отсутствие старения у Hydra, яв-
статус, редокс-контроль процесса транскрип-
ляется фактор транскрипции FOXO1 (forkhead
ции, внутриклеточная передача сигнала, поли-
box protein O1) [7]. Он участвует в регуляции
меризация актина, обратимое S-глутатионили-
антиоксидантных генов и, таким образом, спо-
рование специфических белков, апоптоз и
собствует поддержанию окислительно-восста-
дифференцировка клеток [18-23]. Показано,
новительного (редокс) гомеостаза и восстанов-
что монотиольные Grx участвуют в регуляции
лению биомолекул, поврежденных активными
сборки железосерных кластеров, биосинтезе
формами кислорода (АФК) [8]. Экспрессия и
гема, эмбриональном развитии, иммунном
посттранскрипционная регуляция FOXO1 кон-
ответе и физиологии сердца. Моно- и дитиоль-
тролируется редокс-статусом клетки [8]. Поэто-
ные Grx разных видов различаются по своим
му для поддержания линий стволовых клеток у
структурным, каталитическим и функциональ-
Hydra были выработаны сложные и точно регу-
ным свойствам [18]. Были охарактеризованы
лируемые антиоксидантные системы. К настоя-
Grx различных организмов, таких как бактерии,
щему времени у Hydra охарактеризованы гены
дрожжи, млекопитающие и растения. В настоя-
некоторых антиоксидантных ферментов, напри-
щей работе сообщается о молекулярном клони-
мер фосфолипидгидропероксидглутатионпер-
ровании, экспрессии, анализе и характеристике
оксидазы, супероксиддисмутазы, каталазы и тио-
дитиольной изоформы Grx1 из Hydra (HvGrx1).
редоксина (Trx) [9-12].
Глутаредоксины (Grx) - повсеместно рас-
пространенные антиоксидантные белки, со-
МАТЕРИАЛЫ И МЕТОДЫ
держащие в активном центре мотив CXXC/S и
участвующие в окислительно-восстановитель-
Культура Hydra. В экспериментах использо-
ном гомеостазе клетки [13]. Они входят в состав
вали Hydra vulgaris Ind-Pune [24]. Hydra обыч-
антиоксидантной системы глутатиона (GSH) и
но содержали в среде для гидры (1 мМ CaCl2;
катализируют восстановление дисульфидов с
0,1 мМ KCl; 1 мМ NaCl; 0,1 мМ MgSO4 и
использованием GSH в качестве косубстра-
1 мМ Tris-НCl) при 12-часовом цикле свет/тем-
та [14]. Grx можно разделить на два класса на
нота при температуре 18 °C, кормили 3-4 раза
основе их структуры, мотива активного центра
в неделю только что вылупившимися рачками
и консервативных доменов [15]. Дитиольные
Artemia nauplii и оставляли голодать на 48 ч пе-
Grx, образующие класс I, содержат два остатка
ред проведением эксперимента.
цистеина в консенсусной последовательности
Выделение РНК и синтез кДНК. От 40 до 50
CXXC, расположенной в активном центре фер-
не отпочковавшихся особей гидры гомогени-
мента, в то время как ферменты, входящие в
зировали в 50 мкл реагента TRIzol® («TaKaRa»,
класс II, представляют собой монотиольные
Япония) и экстрагировали общую РНК в со-
Grx с единственным остатком цистеина в кон-
ответствии с протоколом производителя. Ко-
сенсусной последовательности CXXS активно-
личество РНК определяли на спектрометре
го центра [16, 17]. Дитиольным Grx необходи-
Biospectrometer («Eppendorf», Германия), а це-
мы два остатка цистеина для восстановления
лостность РНК подтверждали с помощью элек-
глутатионилированных белков с образованием
трофореза в 1,5%-ном агарозном геле. Син-
глутатионилированных Grx, которые регене-
тез кДНК проводили с помощью набора Verso
рируются за счет рециркуляции цистеинов
cDNA synthesis kit («Thermo Scientific», США) в
в активном центре. Восстановление образовав-
соответствии с протоколом производителя.
шейся дисульфидной связи происходит с уча-
Идентификация последовательности гена,
стием двух молекул GSH или Trx-редуктазы.
кодирующего белок HvGrx1, и её клонирование.
Напротив, монотиольным Grx требуется только
Предсказанная последовательность гена HvGrx1
БИОХИМИЯ том 88 вып. 5 2023
СВОЙСТВА HvGrx1 И ЕГО ФУНКЦИИ В КЛЕТКЕ
819
была извлечена из базы данных GenBank с
nlm.nih.gov/Structure/cdd/wrpsb.cgi). Молекуляр-
помощью программы tBLASTn [25] с исполь-
ную массу белка HvGrx1 и теоретическое
зованием последовательности Grx1 Homo sapi-
значение pI рассчитывали с помощью ин-
ens (UniProtKB, id: P35754) как запроса к
базе данных Hydra EST. Полученный EST
protparam). Последовательность HvGrx1 была
(GenBank: CV182757.1) был использован для
проанализирована на присутствие сигналь-
конструирования праймеров (прямой: 5′-TGTA
ного пептида и митохондриальной таргетной
ATAATAAAAAATGGGA-3′; обратный: 5′-AGAT
последовательности с использованием ин-
AAAGTATTTGTTCTCAT-3′), чтобы амплифи-
струментов SignalP 3.0 [27] и TargetP-2.0 [28]
цировать ген HvGrx1 из кДНК гидры. Полную
соответственно.
последовательность, кодирующую ген HvGrx1,
Анализ in silico последовательности HvGrx1.
с 5′ и 3′ UTRs (untranslated regions) амплифици-
Для поиска последовательностей гомологич-
ровали с использованием ДНК-полимеразы вы-
ных белков в базе данных UniProtKB/Swiss-
сокой точности Phusion® («New England Bio-
Prot использовали программу BLASTP с по-
labs», США) в следующих условиях: исходная
следовательностью белка HvGrx1 в качестве
денатурация при 95 °C -5 мин; денатурация при
последовательности запроса. Множественные
95 °C - 30 с, отжиг при 43,2 °C - 30 с, элонга-
выравнивания были созданы с помощью
ция при 72 °C -30 с, 35 циклов; достройка цепи
MEGA-X с использованием последовательно-
при 72 °C - 5 мин. Для визуализации продукт
стей гомологичных белков из репрезентатив-
ПЦР наносили на 1%-ный агарозный гель.
ных типов, и было создано филогенетическое
Искомый фрагмент элюировали из геля, очи-
древо с использованием метода минимальной
щали с помощью набора QIAquick PCR & Gel
эволюции (ME) [29]. Для проверки относи-
Cleanup Kit («QIAGEN», США), прикрепляли
тельной поддержки ветвей, полученных с по-
A-хвост с помощью ДНК-полимеразы Taq («New
мощью ME-анализа, использовался метод бут-
England Biolabs») и лигировали в вектор pGEM-T
стрэп-анализа. Вторичная структура HvGrx1
(«Promega», США). Полученную плазмиду ис-
была предсказана с помощью сервера SOPMA.
пользовали для трансформации клеток DH5α
Трехмерная структура белка была предска-
Escherichia coli. Трансформанты отбирали сине-
зана с помощью программы SWISSMODEL
белым скринингом. Плазмиды экстрагирова-
ли из трансформированных клеток и подвер-
кристаллической структуре белка Grx2 H. sapi-
гали перевариванию с помощью NotI для под-
ens (PDB: 2ht9). Качество сгенерированной
тверждения получения положительных клонов.
модели проверяли с помощью программы
Кроме того, нуклеотидные последовательности
вставок в этих плазмидах были подтверждены
3D-Структуры гомологичных Grx были
секвенированием по Сэнгеру. Нуклеотидная
получены с помощью расширенного инстру-
последовательность гена, кодирующего HvGrx1,
мента поиска последовательностей PDB, и
была получена с помощью программы Chro-
модель HvGrx1 была наложена на структуры
masPro («Technelysium Pty Ltd», Австралия).
белков Grx2 (3UIW) Danio rerio, Grx2 (2HT9)
Анализ последовательности. Открытую рам-
и Grx1 (4RQR) H. sapiens, Grx2 (3CTF) и Grx1
ку считывания (ORF) гена HvGrx1 идентифи-
(3C1R) Saccharomyces cerevisiae, Grx1 (4MZB)
цировали с помощью программы поиска ORF
Plasmodium falciparum, Grx (1GRX) E. coli и
Grx1 (2MXN) Trypanosoma brucei. Предсказа-
и транслировали в соответствующую амино-
ние связывания лигандов осуществлялось с
кислотную последовательность. Идентичность
использованием программы I-TASSER (https://
последовательности HvGrx1 определяли с по-
zhanggroup.org/I-TASSER).
мощью программы BLAST, а консервативные
Субклонирование гена HvGrx1 в экспресси-
аминокислотные остатки определяли с помо-
рующий вектор pET-28b. Кодирующий участок
щью программы MEGA-X [26]. Функционально
кДНК HvGrx1 амплифицировали из вектора
важные участки и консервативные аминокис-
pGEM-T с использованием высокоточной ДНК-
лотные остатки в белке HvGrx1 были предска-
полимеразы Phusion® и специфических прай-
заны с помощью компьютерных подходов с ис-
меров (прямой: 5′-CATGCCATGGGACGAGC
TGAAGCTGAA-3′ и обратный: 5′-CCGCTCG
tau.ac.il). Семейство белков идентифицировали
AGAGATTTCACAAGTTCTTTCAATTCC-3′),
с помощью программы InterProScan (https://
которые были созданы для включения сайтов
распознавания ферментами рестрикции NcoI
сервативные домены идентифицировали с
и XhoI. Реакцию ПЦР проводили в следующем
режиме: исходная денатурация при 98 °C - 30 с;
БИОХИМИЯ том 88 вып. 5 2023
9*
820
PERWEEN и др.
денатурация при 98 °C - 10 с, отжиг при
гель-фильтрации на колонке Superdex 75 FPLC
55,6 °C - 30 с, элонгация при 72 °C - 30 с,
(«GE Healthcare», Великобритания), предвари-
35 циклов; достройка цепи при 72 °C - 5 мин.
тельно уравновешенной 20 мМ Tris-HCl (pH 8,0)
Продукт ПЦР и вектор pET-28b («Novagen»,
с добавлением 50 мМ NaCl. Чистоту препарата
США) расщепляли эндонуклеазами рестрик-
белка HvGrx1 оценивали с помощью электро-
ции NcoI и XhoI, очищали с помощью набора
фореза в 10%-ном Tris-Tricine SDS-PAGE c по-
QIAquick PCR & Gel Cleanup Kit и лигиро-
следующим окрашиванием белковых полос кра-
вали при 4 °C в течение 18 ч с использовани-
сителем Кумасси бриллиантовый голубой R250.
ем ДНК-лигазы T4 («New England Biolabs»).
Концентрацию белка в образцах определяли
Смесью лигирования трансформировали ком-
с использованием стандартного метода Бред-
петентные клетки E. coli BL21 C43 (DE3), ко-
форда [30].
торые были нанесены на агар, содержащий
Анализ ферментативной активности HvGrx1.
50 мкг/мл канамицина. Для подтверждения вста-
Активность HvGrx1 определяли при помощи
вок в рамку плазмидную ДНК из трансформи-
HED (β-гидроксиэтилдисульфид) [31]. Спе-
рованных клеток подвергали секвенированию
цифичность действия HvGrx1 была подтвер-
по обеим цепям ДНК с использованием мето-
ждена с помощью специфического ингибито-
да Сэнгера.
ра 2-AAPA (R,R′-2-acetylamino-3-[4-(2-acetyl-
Экспрессия и очистка белка HvGrx1. Ноч-
amino-2-carboxyethylsulfanylthiocarbonylamino)
ную культуру клеток E. coli BL21 C43 (DE3) с
phenylthiocarbamoylsulfanyl] propionic acid hy-
рекомбинантной плазмидой, содержащей по-
drate) [32]. HvGrx1 (10 мкМ) инкубировали с
следовательность, кодирующую белок HvGrx1,
10, 25, 50, 100 или 200 мкМ 2-AAPA при 25 °C в
вводили (в соотношении 1 : 100) в 200 мл сре-
течение 15 мин и измеряли остаточную актив-
ды LB, дополненной 50 мкг/мл канамицина,
ность с использованием HED-анализа.
и инкубировали при 37 °C на шейкере при
Сообщается, что некоторые Grx снижают
200 об./мин до достижения оптической плот-
уровень инсулина, подобно Trx [33]. В реакци-
ности при 600 нм (ОП600), равной 0,4-0,5.
онную смесь, содержащую 20 мкМ инсулина
Для индукции экспрессии белка добавляли
в 63 мМ натрий-фосфатном буфере (pH 7,0),
0,25 мМ IPTG (изопропил-β-D-1-тиогалакто-
5 мМ Tris-HCl (pH 7,5) и 2 мМ EDTA (pH 8,0),
пиранозид) с последующей инкубацией клеток
добавляли 50 мкМ очищенного белка. Конеч-
при 4 °С при 200 об./мин в течение 18 ч. Далее
ное значение рН реакционной смеси было
клетки собирали путем центрифугирования
равным 7,0. Реакцию запускали добавлени-
при 6000 об./мин в течение 10 мин, ресуспен-
ем 1 мМ GSH и инкубировали при 25 °C в те-
дировали в буфере для лизиса (50 мМ Tris-Cl
чение 20 мин. Увеличение поглощения при
(pH
8,0);
100 мМ NaCl;
0,1 мМ ЭДТА;
650 нм (A650) контролировали каждую минуту
0,02% азид натрия; 0,05% (v/v) Triton X-100;
в течение 10 мин. Очищенный тиоредоксин
0,1 мМ PMSF;0,1 мМ DTT; 0,02 мг/мл лизо-
из H. vulgaris (HvTrx1) использовали в каче-
цим) и лизировали ультразвуком, используя
стве положительного контроля, а 1 мМ DTT
Sonics vibra cell VCX130 («Sonics & Materials,
использовали в качестве восстанавливающего
Inc.», США) при амплитуде 35% в течение
агента. Отрицательный контроль не содержал
10 мин при 15-секундном импульсе включения/
белка и учитывал прямое снижение уровня
15-секундного выключения. Лизат центрифу-
инсулина с помощью DTT.
гировали при 10 000 об./мин в течение 10 мин
Сообщалось, что Grx проявляет актив-
при 4 °C, и супернатант наносили на колонку
ность глутатионредуктазы (GR), т.е. восста-
Ni-NTA Superflow, предварительно уравнове-
навливает GSSG до GSH [34]; поэтому мы
шенную буфером, содержащим 0,01 M Tris-HCl
проанализировали HvGrx1 на активность GR.
(pH 8,0) с добавлением 0,2 M NaH2PO4. Несвя-
Реакционная смесь содержала 100 мМ фосфата
завшиеся белки удаляли промывочным буфе-
калия (pH 8,0); 0,2 мМ NADPH и 5 мМ GSSG
ром (0,01 M Tris-HCl (pH 8,0); 0,2 M NaH2PO4;
в общем объеме реакционной смеси, рав-
50 мМ имидазол). Связанные His6-мечен-
ном 100 мкл. Реакцию запускали добавлением
ные белки элюировали буфером для элюции
10 мкМ HvGrx1; и в течение 10 мин регистри-
(0,01 M Tris-HCl (pH 8,0); 0,2 M NaH2PO4;
ровали уменьшение поглощения при 340 нм
250 мМ имидазол). Элюированные белки под-
(A340) вследствие окисления NADPH. В каче-
вергали диализу против фосфатно-солевого бу-
стве положительного контроля использовали
фера (PBS (pH 7,4): 137 мМ NaCl; 2,7 мМ KCl;
очищенную GR S. cerevisiae («Sigma-Aldrich»,
8 мМ Na2HPO4; 2 мМ KH2PO4) в течение 24 ч
США); в качестве отрицательного контроля
при 4 °C с 3-кратной сменой буфера. Даль-
использовали отсутствие фермента в реакци-
нейшую очистку белка проводили с помощью
онной смеси.
БИОХИМИЯ том 88 вып. 5 2023
СВОЙСТВА HvGrx1 И ЕГО ФУНКЦИИ В КЛЕТКЕ
821
Определения оптимума pH и температуры.
Через 0, 0,5, 2, 4, 8 или 24 ч каждый раз отби-
Для определения pH-оптимума HvGrx1 опреде-
рали по 40 особей. Гидры, не подвергавшиеся
ляли активность очищенного фермента (10 мкМ)
воздействию H2O2, были использованы в ка-
с использованием HED в буферных растворах
честве контроля. Экстракцию РНК из под-
с различными значениями pH: Glycine-HCl
вергавшихся и не подвергавшиеся воздей-
(pH 4,0 и 5,0), KH2PO4/NaOH (pH 6,0 и 7,0),
ствию H2O2 (контрольных) гидр проводили с
Tris-НCl (pH 8,0) и Glycine-NaOH (pH 9,0
использованием реагента TRIzol®, и синтез
и 10,0). Для определения температурного оп-
кДНК осуществляли с помощью набора Verso
тимума активности HvGrx1 очищенный фер-
cDNA synthesis kit. Количественную ПЦР в
мент (10 мкМ) анализировали при различных
реальном времени (RT-qPCR) проводили на
значениях температуры (18, 25, 37, 45 и 55 °C)
приборе StepOnePlus real-time PCR system
при рН 8,0.
(«Applied Biosystems», США) с использова-
Для определения рН-стабильности HvGrx1
нием сконструированных праймеров (прямой:
очищенный фермент (10 мкМ) предваритель-
5′-GCTACTTACACTGTTTTGGAG-3′; обрат-
но инкубировали в течение 30 мин при раз-
ный: 5′-AGTACGAGCACCAGTCATAT-3′) при
ных значениях рН (4-10), а затем определяли
следующих условиях: исходная денатурация
остаточную активность фермента с помощью
при 95 °C - 10 мин; денатурации при 95 °C -
HED-анализа. Термостабильность фермента
30 с, отжиг при 56,7 °C - 15 с, элонгация
исследовали путем инкубации 10 мкМ HvGrx1
при 60 °C - 15 с, 40 циклов. В качестве внут-
при различных значениях температуры (25, 45
реннего контроля был использован ген β-акти-
или 55 °C) в течение 40 мин. Каждые 10 мин
на из H. vulgaris (прямой праймер: 5′-CAA
отбирали аликвоту и анализировали при опти-
TTGAACACGGAATTGTA-3′; обратный прай-
мальных условиях, как описано выше. Наи-
мер:
5′-AGTAAGAAGGACAGGGTGTTC-3′),
высшее значение активности было принято
чтобы нормировать уровень экспрессии мРНК
за 100% остаточной активности.
HvGrx1. Эксперименты проводили в трех не-
Оценка кинетических параметров HvGrx1.
зависимых повторах. Для оценки количества
Очищенный HvGrx1 (10 мкМ) инкубировали с
транскриптов использовали метод 2-ΔΔCt.
различными концентрациям HED (1-16 мкМ)
Ферментативная активность HvGrx1 после
или GSH (0,2-1,2 мМ), и активность фермента
воздействия H2O2 на клетки. Суммарно 240 осо-
определяли при рH 8,0 и температуре 25 °C с ис-
бей Hydra после 48-часового голодания подвер-
пользованием HED-анализа. Для определения
гали воздействию 1 мМ H2O2, добавленной в
констант GSH мы использовали 0,7 мМ HED и
среду для гидр на 30 мин, после чего животных
варьировали концентрацию GSH. Для опреде-
тщательно промывали и переносили в свежую
ления констант HED использовали 1 мМ GSH
среду для гидры. Через 0, 0,5, 2, 4, 8 или 24 ч
и варьировали концентрацию HED. Кинетиче-
каждый раз отбирали по 40 особей и разрушали
ские параметры Km, kкат и kкат/Km рассчитывали
их тела импульсным ультразвуком в буфере для
с помощью уравнения Михаэлиса-Ментен на
лизиса (20 мМ Tris-HCl (pH 8,0); 1 мМ ЭДТА;
графике Лайнуивера-Берка. Общую каталити-
0,7% (v/v) Triton X-100; 0,1 мМ PMSF и кок-
ческую скорость HvGrx1 (kкат) определяли с по-
тейль ингибиторов 1X Protease). Лизат клеток
мощью уравнения kкат = Vмакс [E]t, где [E]t - кон-
центрифугировали при 10 000 об./мин в тече-
центрация фермента, используемого в реакции.
ние 30 мин при 4 °C. Концентрацию белка в
Локализация транскриптов гена HvGrx1 в
супернатанте оценивали с помощью метода
теле Hydra, определенная методом гибридиза-
Бредфорда, а активность белка HvGrx1 опре-
ции in situ. Транскрипты гена HvGrx1 локали-
деляли при помощи HED-анализа. Экспери-
зовали с помощью гибридизации in situ (ISH),
менты проводили в трех независимых повтора-
проводимой по стандартным протоколам [35]
ми. В качестве контроля использовали Hydra,
с использованием меченных дигоксигени-
не подвергавшиеся воздействию H2O2.
ном (DIG) смысловых и антисмысловых рибо-
Влияние 2-AAPA, ингибитора Grx1, на ре-
зондов, приготовленных с помощью набора
генерацию Hydra. Гидры, которые голодали в
DIG RNA labelling kit («Roche», Германия).
течение 48 ч, были разделены на три части, и
Экспрессия мРНК HvGrx1 после воздей-
образцы, содержащие 12-13 средних частей,
ствия на клетки H2O2. Суммарно 240 особей
инкубировали в среде гидры, содержащей
Hydra после 48-часового голодания подвер-
0, 100, 200 или 1000 мкМ 2-AAPA (ингиби-
гали воздействию 1 мМ H2O2, добавленной в
тор Grx1). Оценивали степень регенерации и
среду для гидр на 30 мин, после чего живот-
записывали живые изображения через 24, 48
ных тщательно промывали и переносили в све-
и 72 ч под стереомикроскопом Zeiss Stemi 302
жую среду для гидры (не содержащую H2O2).
(«Zeiss», Германия). В качестве контроля ис-
БИОХИМИЯ том 88 вып. 5 2023
822
PERWEEN и др.
пользовали средние части Hydra, не подвер-
роскопа со встроенной камерой DP70 CCD
гавшиеся воздействию H2O2.Эксперимент вы-
(«Zeiss»). Количественную оценку флуорес-
полняли в трех независимых повторах.
ценции проводили с помощью программного
Культура клеток и плазмидная трансфек-
обеспечения ZEN 2.3 и Image J.
ция. Клетки HCT116 (линия опухолевых кле-
Определение способности клеток к мигра-
ток рака толстой кишки) были получены из
ции. Трансфицированные клетки HCT116 куль-
Национального центра клеточных исследова-
тивировали в среде, содержащей сыворотку.
ний, Пуна, Индия. Клетки культивировали в
После достижения конфлуентности создавали
среде DMEM, дополненной 10%-ной феталь-
в монослое клеток «рану» с помощью наконеч-
ной бычьей сывороткой (FBS) и раствором,
ника для микропипеток на 10 мкл. Наблюдали
содержащим антибиотики и противогриб-
за миграцией клеток с помощью инвертиро-
ковые средства (1×) при 37 °C в атмосфере
ванного микроскопа со встроенной камерой
5% CO2. Для проведения трансфицирования
DP70 CCD. Расстояние, пройденное клетками
2 × 105 клеток рассевали на 30-мм чашки с
к ране, определяли через 24 ч.
полной средой DMEM. Кодирующую последо-
Статистическая обработка данных. Каждый
вательность гена HvGrx1 амплифицировали из
эксперимент проводили как минимум в трех
вектора pGEM-T с использованием ДНК-по-
независимых повторах; данные представлены
лимеразы высокой точности Phusion® и спе-
как среднее ± SE. Для проведения сравнения
цифических праймеров (прямой: 5′-CGCGGA
между группами использовали t-критерий
TCCCACCATGGGACGAGCTGAAGCTGA-3′,
Стьюдента. Различия считались статистически
обратный: 5′-TGCTCTAGATTAGATTTCACAA
достоверными при значении p < 0,05.
GTTCTTTCAATTCCC-3′), которые включали
сайты ферментов рестрикции BamHI и XbaI,
и затем клонировали в вектор экспрессии
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
pCS + GFP, содержащий на C-конце метку -
белок GFP (зеленый флуоресцирующий бе-
Клонирование и анализ последовательности
лок). Клетки были трансфицированы плазми-
гена, кодирующего HvGrx1. Продукт ПЦР раз-
дами pCS + GFP или pCS + GFP + HvGrx1
мером 379 п.н. был получен в результате ам-
с использованием полиэтиленимина (PEI)
плификации гена HvGrx1 (рис. S1 в Приложе-
в среде DMEM. После инкубации в течение
нии). Нуклеотидная последовательность гена
ночи производили замену неполной культу-
HvGrx1 (рис. S2 в Приложении) была размеще-
ральной среды на полную среду. Через 48 ч
на в базе данных NCBI GenBank (код доступа
клетки оценивали на жизнеспособность, при-
KX760114). Секвенирование клонированного
годность к образованию колоний и миграции.
в плазмиде pGEM-T гена (pGEM-T + HvGrx1)
Анализ жизнеспособности клеток. Чтобы вы-
выявило открытую рамку считывания для
явить роль HvGrx1 в процессе восстановления
105 а.о. С помощью программы BLAST была
клеток после воздействия H2O, трансфициро-
выявлена гомология аминокислотной после-
ванные клетки HCT116 рассевали в 96-луноч-
довательности HvGrx1 с последовательностями
ные планшеты (10 000 клеток/лунка). После
других белков Grx, размещенных в базе данных
инкубации в течение ночи клетки подвергали
NCBI. С помощью базы данных InterProScan
воздействию 0,8 мМ H2O2 в течение 24 ч, по-
было обнаружено, что HvGrx1 принадлежит к
сле чего в каждую лунку добавляли реагент
группе дитиольных белков Grx, которые про-
MTT (5 мг/мл). После 4 ч инкубации в каждую
являют активность глутатионоксидоредуктазы и
лунку добавляли по 100 мкл солюбилизирующе-
глутатиондисульфидредуктазы (NADPH) и име-
го раствора, и инкубировали клетки в течение
ют один домен Grx (рис. S3, A в Приложении).
ночи. Поглощение регистрировали при 570 нм с
Поиск консервативных доменов показал,
помощью планшетного ридера ELISA («Hidex»,
что HvGrx1 имеет домен Grx и принадлежит
Финляндия), и рассчитывали процент жизне-
к Trx-подобному суперсемейству (рис. S3, B
способных клеток, принимая за 100% жизне-
в Приложении). В результате проведения мно-
способность контрольных клеток, не подвер-
жественного выравнивания последователь-
гавшихся трансфекции.
ностей с помощью программы Clustal omega,
Определение колониеобразующей способно-
в последовательности HvGrx1, а именно в его
сти клеток. Трансфицированные клетки HCT116
активном центре, был выявлен мотив CPYC.
рассевали в колбы T-25 со средой, содержащей
С помощью программы ScanProsite было пред-
сыворотку. Образование колоний в колбах на-
сказано, что Grx-домен содержит два остатка
блюдали в течение 4 дней; изображения были
цистеина, которые могут образовывать ди-
получены с помощью инвертированного мик-
сульфидные связи. С использованием сервера
БИОХИМИЯ том 88 вып. 5 2023
СВОЙСТВА HvGrx1 И ЕГО ФУНКЦИИ В КЛЕТКЕ
823
Consurf были выявлены экспонированные на
SOPMA-анализ HvGrx1 показал, что белок со-
поверхности белка высококонсервативные и
стоит из 47,62% α-спиралей, 30,48% приходится
функционально важные остатки лизина (L24
на структуры типа случайный клубок, 15,24%
и L34), глутаминовой кислоты (E48 и E50),
составляют удлиненные цепи и 6,67% - β-пово-
глутамина (Q59), треонина (T66 и T70), про-
роты (рис. S6, A в Приложении).
лина (P72), аргинина (R73), изолейцина (I81)
3D-Модель структуры HvGrx1 с типичным
и глицина (G94). Кроме того, были выявлены
для Grx способом сворачивания белка была
структурно значимые высококонсервативные
создана с использованием SWISS-MODEL
остатки фенилаланина (F22), серина (S23),
(рис. S6, B в Приложении). Согласно серверу
цистеина (C27), валина (V71), глицина (G83)
SAVES v6.0, предсказанная модель HvGrx1 имеет
и лейцина (L96), которые были скрыты внутри
общий коэффициент качества, равный 97,87, и
молекулы белка (рис. S3, C в Приложение).
для 99,02% аминокислотных остатков средняя
Физико-химические свойства HvGrx1 рас-
оценка 3D-1D >= 0.2.3D. Структура HvGrx1
считывали с помощью программы Protparam
включает ядро, состоящее из четырех β-листов,
(инструмент ExPasy). Предсказанная молеку-
окруженных пятью α-спиралями (рис. S6, B
лярная масса HvGrx1 составила 11,87 кДа, а
в Приложении) с мотивом активного центра
предсказанное значение pI - 4,94. Анализ по-
CXXC, расположенным в петле, соединяющей
следовательности белка с помощью программ
β-лист 1 и α-спираль 1. Предсказанная струк-
SignalP и TargetP 2.0 позволил предположить,
тура белка HvGrx1 была наложена на доступ-
что HvGrx1 является внутриклеточным бел-
ные структуры белков Grx1 или Grx2 (рис. S6, C
ком, расположенным в цитоплазме.
в Приложении) с рассчитанными значениями
Анализ in silico HvGrx1 и других Grx. Мно-
RMSD, равными
жественное выравнивание аминокислотной
0,073 (Grx2 D. rerio; 3UIW),
последовательности подтвердило наличие Grx-
0,677 (Grx2 H. sapiens; 2HT9),
домена, а также локализацию консервативных
0,759 (Grx2 S. cerevisiae; 3CTF),
остатков цистеина (C27 и C30), необходимых
0,773 (Grx1 H. sapiens; 4RQR),
для каталитической активности, в активном
0,927 (Grx1 S. cerevisiae; 3C1R),
центре HvGrx1. Было показано, что Grx-домен
0,988 (Grx1 P. falciparum; 4MZB),
и остатки цистеина из активного центра фер-
1,578 (Grx E. coli; 1GRX),
мента консервативны во всех белках Grx1 и
2,074 (Grx1 T. brucei; 2MXN).
Grx2, за исключением Arthropoda, у которых
Было определено наибольшее структур-
второй остаток цистеина заменен на остаток
ное сходство HvGrx1 с Grx2 D. rerio. Про-
аланина (рис. S4 в Приложении). Кроме ката-
гнозирование сайтов связывания лиганда с
литически важных остатков, в большинстве
помощью сервера I-TASSER выявило сайты
типов также присутствуют другие консерватив-
связывания для трех субстратов: GSH, циспла-
ные аминокислотные остатки, такие как G67,
тина и β-меркаптоэтанола (рис. S6, D в При-
G82, G83, T70, V71 и P72.
ложении).
Чтобы определить эволюционное положе-
Экспрессия и очистка белков. Экспрессиро-
ние белка HvGrx1, мы провели филогенетиче-
ванный в клетках E. coli и очищенный белок да-
ский анализ с использованием метода ME на
вал единственную полосу с молекулярной мас-
основе выведенной аминокислотной последо-
сой 12 кДа в 10%-ном Tris-Tricine SDS-PAGE
вательности и последовательностей дитиоль-
(рис. 1, a). Наблюдаемая молекулярная масса
ных Grx некоторых репрезентативных орга-
HvGrx1 соответствовала расчетной.
низмов, полученных из базы данных SwissProt/
Биохимические анализы. Как показано
UniProt-KB database (рис. S5 в Приложении).
на рис. 1, b, HvGrx1 проявляет активность Grx
Полученное филогенетическое древо дало пред-
(восстановление дисульфидной связи в HED)
ставление о разнообразии белков Grx и эволю-
в зависимости от концентрации. Специфич-
ционных отношениях между разными видами.
ность реакции подтверждали с помощью
Дитиольные белки Grx в основном группиро-
2-AAPA, специфического ингибитора Grx1.
вались в две ветви (Grx1 и Grx2). Интересно,
Чтобы определить концентрацию 2-AAPA, кото-
что HvGrx1 группировался с ферментами выс-
рая полностью ингибирует активность HvGrx1,
ших позвоночных и был наиболее близок к
мы обрабатывали одни и те же количества
белку Grx2 D. rerio. Взаимосвязи, показанные
HvGrx1 разными концентрациями ингибито-
на филогенетическом древе, хорошо согласо-
ра. По мере увеличения концентрации 2-ААРА
вывались с традиционной таксономией, так как
активность HvGrx1 снижалась, а при кон-
вирусы, бактерии, дрожжи, беспозвоночные и
центрации 200 мкМ 2-ААРА полностью ин-
позвоночные образовывали отдельные клады.
гибировал восстановление HED (рис. 1, c).
БИОХИМИЯ том 88 вып. 5 2023
824
PERWEEN и др.
Рис. 1. a - Очищенный рекомбинатный белок HvGrx1, проанализированный с помощью 10%-ного Tris-Tricine
SDS-PAGE: дорожка 1 - маркеры молекулярной массы; дорожка 2 - очищенный белок. b - Ферментативная актив-
ность очищенного HvGrx1, проанализированная при использовании HED в качестве субстрата. c - Влияние ингиби-
тора (2-AAPA) на ферментативную активность HvGrx1. d - Снижение уровня инсулина с помощью HvGrx1 (в качестве
положительного контроля был взят тиоредоксин из H. vulgaris (HvTrx1)). e - Глутатионредуктазная (GR-активность)
HvGrx1 (в качестве положительного контроля была взята GR из S. cerevisiae). f - График Лайнуивера-Берка катали-
тической активности HvGrx1. Все определения проводились как минимум в трех независимых повторах. Результаты
представлены в виде среднего значения ± SD
Сообщалось, что Grx восстанавливает два
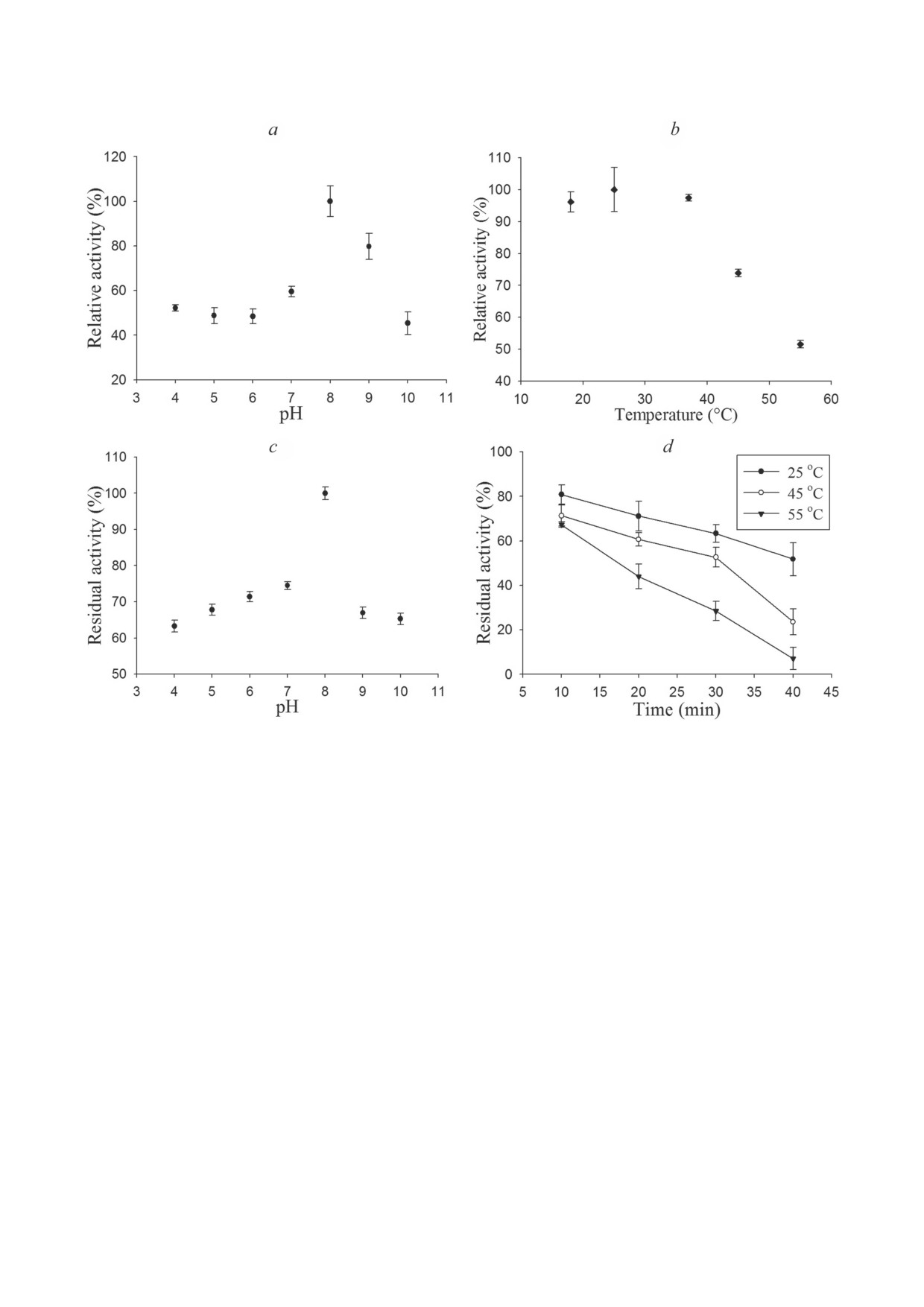
В то же время инкубация белка при 45 и 55 °C
межцепочечных дисульфидных мостика в мо-
приводила к падению активности HvGrx1 на 30
лекуле инсулина, подобно Trx [33, 36]. Одна-
и 50% соответственно. Температурный опти-
ко даже при концентрации, равной 50 мкМ,
мум HvGrx1 оказался равным 25 °C. Фермент
HvGrx1 не смог катализировать восстановле-
сохранял более 60% активности после инку-
ние инсулина по сравнению с 10 мкМ HvTrx1,
бации при различных значениях рН (4-10),
который восстанавливал инсулин, что указы-
и максимальная стабильность фермента на-
вает на отсутствие активности Trx у HvGrx1
блюдалась при рН 8,0 (рис. 2, c). Анализ тер-
(рис. 1, d). HvGrx1 также не смог восстановить
мостабильности HvGrx1 также показал, что
GSSG до GSH, что указывает на отсутствие
HvGrx1 сохранял
64,0% своей активности
активности GR (рис. 1, e).
после инкубации в течение 40 мин при 25 °C,
Кинетические параметры. Кинетические
но инактивировался на 50% после инкубации
параметры HvGrx1 при использовании HED
при 45 или 55 °C (рис. 2, d).
в качестве субстрата определяли по графику
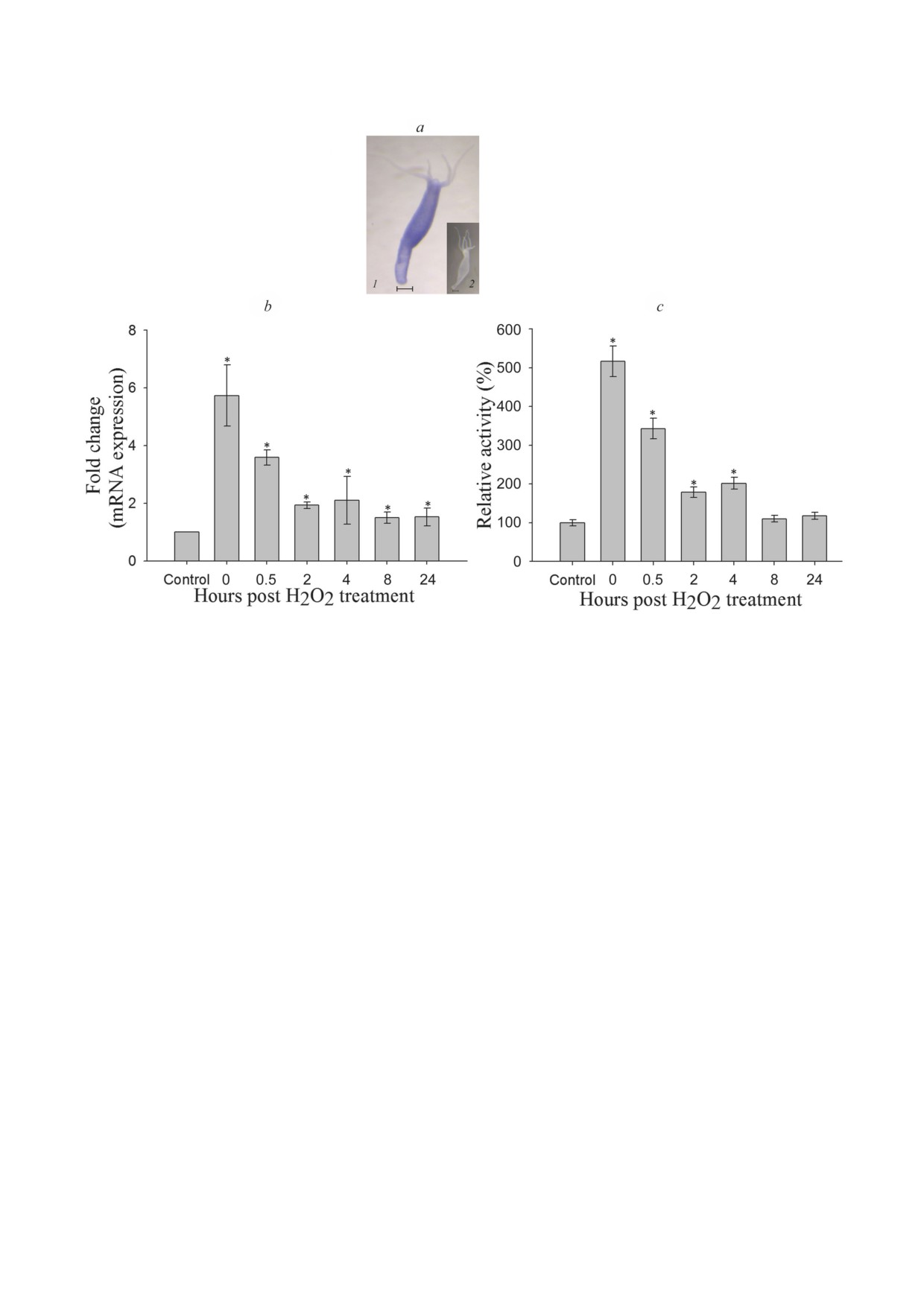
Локализация транскриптов гена Grx1 в теле
Лайнуивера-Берка: Km = 0,57 ± 0,05 мМ; Vмакс =
Hydra. Расположение транскриптов мРНК
= 3,63 ± 0,15 мкМ NADPH/мин; kкат = 21,80 ±
HvGrx1 в теле гидры изучали с помощью мето-
± 0,24 с-1 и kкат/Km = 38,24 ± 1,1. Значения, по-
да ISH с использованием меченных DIG рибо-
лученные при использовании GSH в качестве
зондов. Выявлено, что мРНК HvGrx1 экспрес-
субстрата, были равны: Km = 0,003 мМ; Vмакс =
сировалась как в эктодерме, так и эндодерме,
= 4,12 ± 0,1 мкМ NADPH/мин; kкат = 24,71 ±
что указывает на то, что мРНК HvGrx1 экс-
± 0,4 с-1 и kкат/Km = 8236,66 ± 11,3 (рис. 1, f).
прессируется в Hydra повсеместно (рис. 3, a).
Влияние pH и температуры на активность
Влияние H2O2 на уровень экспрессии HvGrx1
HvGrx1. Как показано на рис. 2, a, HvGrx1
и его ферментативную активность. Максималь-
проявляет активность в широком диапазоне
ная экспрессия транскриптов гена HvGrx1 на-
pH (4,0-10,0), и максимальная активность на-
блюдалась сразу после воздействия H2O2, а за-
блюдается при рН 8,0.
тем снижалась в течение 0,5 ч после переноса
Активность HvGrx1 измеряли в диапазоне
животных в свежую среду. Активность HvGrx1
температур 18-55 °C. Как показано на рис. 2, b,
в лизате клеток была аналогичной, при этом
инкубация белка при
18,
25 или
37 °C не
наибольшая активность наблюдалась сразу
влияла на его ферментативную активность.
после воздействия H2O2 (рис. 3, b и c).
БИОХИМИЯ том 88 вып. 5 2023
СВОЙСТВА HvGrx1 И ЕГО ФУНКЦИИ В КЛЕТКЕ
825
Рис. 2. a - pH-Оптимум каталитической активности HvGrx1, определенный в ходе проведения реакции при различных
значениях pH (4,0-10,0) при 25 °C. b - Температурный оптимум ферментативной активности HvGrx1, определенный
по параметрам реакции восстановления HED при различных температурах (18, 25, 37, 45 и 55 °C). c - рН-Стабиль-
ность HvGrx1 при различных значениях рН, определяемая в ходе инкубации белка в буферах с различными значе-
ниями pH (pH 4, 5, 6, 7, 8, 9, и 10) в течение 30 мин с последующей оценкой остаточной активности в отношении HED.
d - Устойчивость HvGrx1 к температурам. Белок инкубировали при 25, 45 или 55 °C в течение 10, 20, 30 или 40 мин,
а затем измеряли его остаточную активность
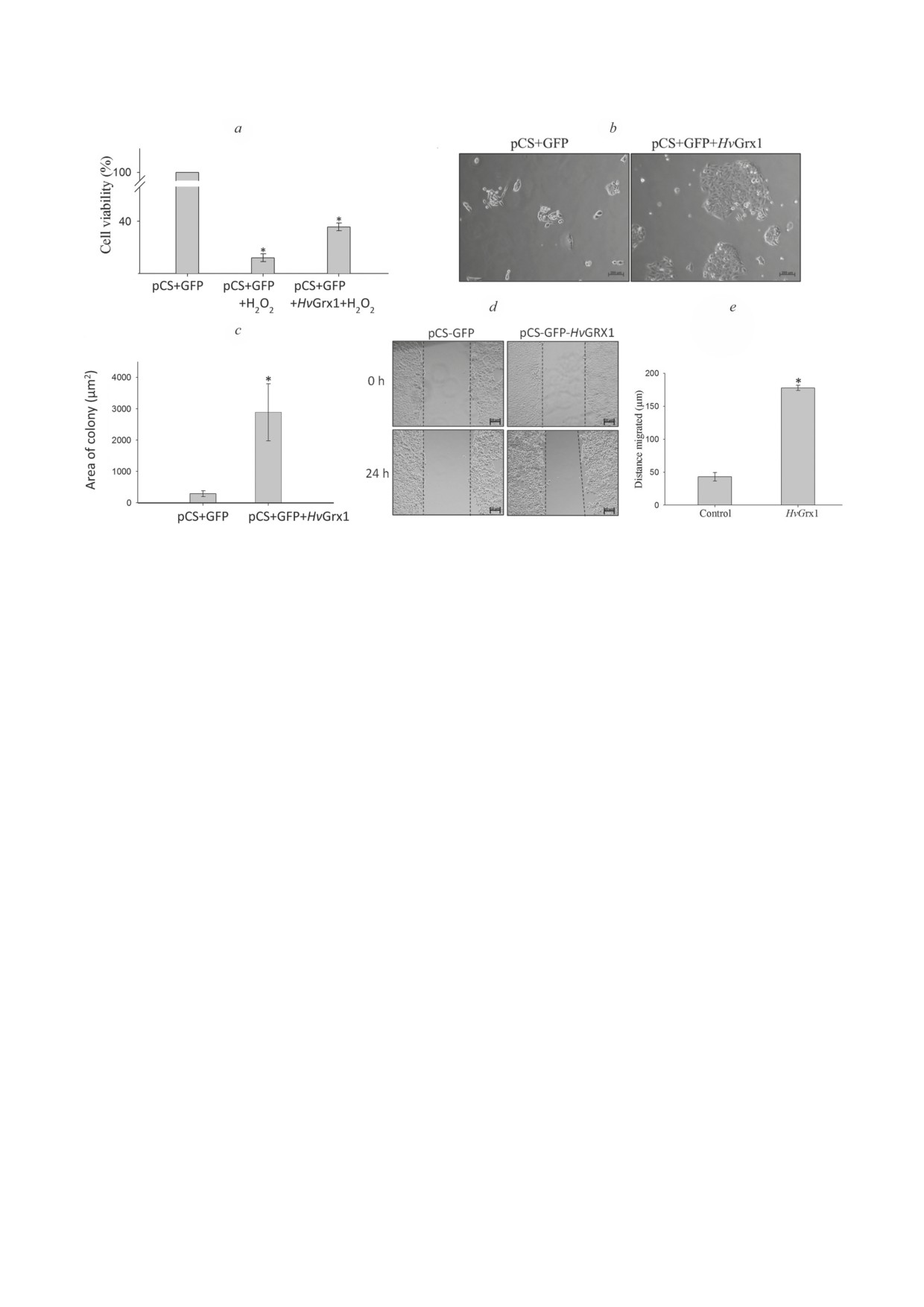
Влияние ингибирования активности Grx1
экспрессию HvGrx1 в клетках HCT116 и ис-
на процесс регенерации Hydra. 2-AAPA даже в
следовали жизнеспособность клеток после
максимальной концентрации, равной 1 мМ,
обработки H2O2 с помощью MTT-анализа,
не ингибировал регенерацию средних участ-
а пролиферацию клеток - с помощью ана-
ков разделенного на три части тела гидры. Все
лиза образования колоний. HvGrx1 защищал
обработанные H2O2 и необработанные сред-
клетки от окислительного стресса, вызванно-
ние части тела гидры в течение 3 дней успеш-
го H2O2. Клетки со сверхэкспрессией HvGrx1
но регенерировали как голову, так и подошву
были на 25% более жизнеспособными по срав-
(рис. S7 в Приложении).
нению с контрольными клетками после обра-
HvGrx1 защищал клетки человека от окис-
ботки H2O2 (рис. 4, a).
лительного стресса и способствовал пролифе-
HvGrx1 способствовал пролиферации кле-
рации и миграции клеток. Поскольку HvGrx1
ток, о чем свидетельствовал больший размер
демонстрирует высокое сходство с Grx позво-
колоний, формируемых клетками, трансфици-
ночных, было изучено влияние HvGrx1 на
рованными геном HvGrx1 (рис. 4, b и c). HvGrx1
пролиферацию клеток, их способность к об-
также усиливал миграцию клеток HCT116. Как
разованию колоний и к миграции в клетках
показано на рис. 4, d, площадь заживления в
HCT116 человека. Мы индуцировали сверх-
монослое клеток была значительно уменьшена в
БИОХИМИЯ том 88 вып. 5 2023
826
PERWEEN и др.
Рис. 3. a - Локализация транскриптов гена HvGrx1 в гидре методом ISH с использованием меченных DIG рибозондов:
смысловой зонд (1) и антисмысловой зонд (2). Изображения были получены на стереомикроскопе Zeiss; масштабная
линейка - 200 мкМ. Экспрессия HvGrx1 (b) и его активность (c) в целой гидре после воздействия H2O2. Каждый экспе-
римент был проведен как минимум в трех независимых повторах. Полученные данные представлены в виде среднего
значения ± SE (* p < 0,05 в сравнении с контролем)
клетках, повышенно экспрессирующих HvGrx1,
становительного гомеостаза, Grx контролируют
и эти клетки мигрировали в 4 раза быстрее по
многие физиологические процессы, такие как
сравнению с контрольными клетками (рис. 4, e).
иммунный ответ, процесс формирования ней-
ронов, развитие сердца, апоптоз и т.д. [20, 38].
Мы впервые идентифицировали, клониро-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
вали и охарактеризовали дитиольный Grx1 из
H. vulgaris Ind-Pune. Клонированная последо-
Во всех организмах окислительно-восста-
вательность содержала ORF размером 379 п.н.,
новительный (редокс) гомеостаз поддержива-
что соответствует 105 а.о. (предсказанная моле-
ется ферментативными и неферментативными
кулярная масса HvGrx1 составляет 11,87 кДа).
системами антиоксидантной защиты, которые
Множественное выравнивание последователь-
противодействуют возникновению избыточ-
ности HvGrx1 и дитиольных Grx других видов,
ных количеств АФК [15]. В число этих защит-
а также анализ вторичной структуры, выпол-
ных систем входят глутаредоксины (Grx) - не-
ненный на сервере Consurf, выявили наличие
большие, содержащие дисульфидные связи,
характерного для белков Grx консервативного
редокс-белки, участвующие в многочисленных
каталитического мотива CXXC с двумя остат-
жизненно важных процессах, происходящих
ками цистеина, ответственными за редокс-
в клетках. Были идентифицированы две изо-
активность фермента. С помощью инструмен-
формы Grx, дитиольная и монотиольная, ко-
тов SignalP и TargetP-2.0 было предположено,
торые содержат каталитический мотив CXXC
что HvGrx1 является цитоплазматическим бел-
или CXXS соответственно в высококонсерва-
ком, у которого отсутствует ассоциированная
тивном участке [37]. Grx используют GSH в
с митохондриями сигнальная последователь-
качестве восстанавливающего агента и играют
ность. Grx2 D. rerio, имеющий наибольшее
важную роль в защите клеток от окислитель-
структурное сходство с HvGrx1, также является
ных повреждений. Помимо окислительно-вос-
цитоплазматическим белком [39].
БИОХИМИЯ том 88 вып. 5 2023
СВОЙСТВА HvGrx1 И ЕГО ФУНКЦИИ В КЛЕТКЕ
827
Рис. 4. a - Жизнеспособность контрольных клеток и клеток со сверхэкспрессией HvGrx1 после обработки H2O2.
b - Определение способности к формированию колоний. c - Площадь, занятая GFP-положительными колониями.
d - Репрезентативные изображения клеток HCT116, трансфицированных геном HvGrx1, полученные при изучении
миграции клеток. e - Расстояние, пройденное контрольными клетками и клетками со сверхэкспрессией HvGrx1 через
12 ч. Каждый эксперимент был выполнен в трех независимых повторах. Результаты представлены в виде среднего зна-
чения ± SE (* p < 0,05 в сравнении с контролем)
Выравнивание последовательностей пока-
в мотиве TVF и остатком тирозина (Y29) ак-
зало, что HvGrx1 является дитиольным Grx с
тивного центра фермента, мотив G-G образует
мотивом CPYC, расположенным в активном
на поверхности белка бороздку для связывания
центре фермента. Аминокислотные остатки,
GSH [42]. Анализ результатов множественного
расположенные между остатками цистеина
выравнивания аминокислотных последователь-
дитиольного мотива (C27PYC30), высококон-
ностей показал, что консервативный остаток
сервативны как у прокариот, так и у эукариот.
валина (V19) в HvGrx1 заменен на остаток изо-
Остатки цистеина Grx2 человека (C68 и C153)
лейцина. Однако это не влияет на структуру
и Grx2 D. rerio (C64 и C149) участвуют через
белка из-за схожего строения и наличия гидро-
железосерный (2Fe-2S) кластер в образовании
фобных боковых цепей у обеих аминокислот.
ферментативно неактивного димера Grx2 [40].
Анализ филогенетического древа и моделиро-
Отсутствие этих дополнительных остатков
вание гомологии показали, что HvGrx1 имеет
цистеина в HvGrx1 позволяет предположить,
наибольшую идентичность с Grx2 D. rerio, ука-
что этот фермент не образует димеров. HvGrx1
зывая на то, что HvGrx1 эволюционно ближе
также содержит консервативную C-конце-
к Grx высших позвоночных, а не к ферментам
вую последовательность, участвующую в свя-
беспозвоночных или прокариот.
зывании GSH, которая проявляет наиболь-
Очищенный HvGrx1 имел кажущуюся мо-
шую гомологию с другими Grx. С помощью
лекулярную массу 12 кДа при электрофорезе в
программы I-TASSER были предсказаны три
10%-ном Tris-Tricine SDS-PAGE (как и предпо-
GSH-связывающих сайта, которые содержат
лагалось). Подобно Grxs, он эффективно вос-
консервативные аминокислотные остатки F18,
станавливал HED. Было показано, что HvGrx1
V20, K24, C27, Y29, Q59, T70, V71, P72, F75,
обладает высокой стабильностью в широком
I76, N77, R78, G83, G84, T85 и D86, предпо-
диапазоне рН и сохраняет 50% активности
ложительно участвующие во взаимодействии
при
55 °C. Анализ кинетических парамет-
c GSH [41]. Мотив G-G, который был опре-
ров HvGrx1 выявил высокое сродство этого
делен как характерный для Grx мотив [42],
белка к HED с Km = 0,57 мМ и kкат = 21,80 с-1.
также был обнаружен в HvGrx1 (G83-G84).
Значение Km для HvGrx1 оказалось ниже,
Взаимодействуя с остатком треонина (T70)
чем у Grx из Chlorella virus (1,4-2,1 мМ) [43],
БИОХИМИЯ том 88 вып. 5 2023
828
PERWEEN и др.
Grx2 из H. sapiens (1,68 мМ) [44] и Grx из
ЗАКЛЮЧЕНИЕ
Cryptococcus neoformans (1,03 мМ) [45]. Это ука-
зывает на то, что HvGrx1 имеет более высокое
В настоящей работе мы клонировали,
сродство к HED. Некоторые Grx также могут
экспрессировали и охарактеризовали Grx1
снижать уровень инсулина и GSSG; однако
Hydra (Cnidaria). Было показано, что HvGrx1
нам не удалось обнаружить такую активность
представляет собой однодоменный дитиоль-
у HvGrx1.
ный Grx. Анализ белка in silico показал, что
Было обнаружено, что HvGrx1 из Hydra
он эволюционно близок к глутаредоксинам
экспрессируется по всему телу, подобно Grx2
высших позвоночных. HvGrx1 проявлял мак-
человека [44], Grx2 из Hippocampus abdom-
симальную ферментативную активность при
inalis [33] и Grx1 из Sebastes schlegelii [22]. Из-
рН 8,0 и 25 °C и обладал очень высоким срод-
вестно, что многие гены антиоксидантов, в
ством к HED как к субстрату. Мы показали,
том числе ген, кодирующий Grx1, активиру-
что HvGrx1 повсеместно присутствует в теле
ются транскрипционным фактором OxyR в от-
Hydra; как его транскрипция, так и трансля-
вет на действие H2O2 [46]. Действительно, мы
ция усиливались в ответ на обработку H2O2.
обнаружили, что у Hydra сразу после воздей-
Интересно, что HvGrx1 оказался функцио-
ствия H2O2 повышались экспрессия и актив-
нален в клетках человека, и он поддерживал
ность HvGrx1. Мы также проверили влияние
пролиферацию клеток и их миграцию, а также
ингибирования активности Grx1 специфи-
защищал клетки от окислительных поврежде-
ческим ингибитором, 2-AAPA, на процессы
ний. Полученные результаты показывают, что
регенерации Hydra. Однако даже при самых
хотя Hydra является эволюционно древним
высоких используемых концентрациях инги-
простым беспозвоночным, HvGrx1 является
битор не блокировал регенерацию. Возможно,
высококонсервативным белком и близок к
Hydra содержит изоформы Grx, компенсирую-
своим гомологам из высших позвоночных.
щие ингибирование активности Grx1.
Поскольку HvGrx1 показал структурное
Вклад авторов. NP, SG и SSG являются
сходство с ферментами высших позвоноч-
авторами идеи исследования; NP, KP, GH,
ных, нам было любопытно выяснить, может
GB и SPM выполнили эксперименты и про-
ли HvGrx1 функционировать в клетках чело-
анализировали результаты; NP и SSG написа-
века. Известно, что Grx усиливают пролифе-
ли манускрипт; NP, KP, GH, SPM, SG и SSG
рацию клеток [47, 48]. Мы обнаружили, что
рассмотрели окончательный вариант статьи;
гиперэкспрессия HvGrx1 действительно спо-
SSG руководил исследованием.
собствовала росту клеток HCT116, о чем сви-
Финансирование. SSG выражает искрен-
детельствуют более крупные колонии клеток.
нюю признательность Департаменту науки
Это указывает на то, что HvGrx1 поддерживал
и технологий по содействию университет-
пролиферацию клеток человека. Grx также за-
ским исследованиям и научному совершенству
щищают клетки от окислительных поврежде-
(DST-PURSE), правительству Индии [F-5-2/
ний [49, 50]. HvGrx1 защищал клетки HCT116
2005(SAP-II)], Комиссии по университетским
от действия перекисью водорода, обеспечивая
грантам и Центру перспективных исследований
лучшее, по сравнению с контрольными клет-
(UGC-CAS) (грант № GOI-A-670 предоставлен
ками, выживание после воздействия H2O2.
Департаменту зоологии), Университету Сави-
Кроме того, известно, что Grx участвуют в
трибай Фуле Пуна (SPPU) за финансовую под-
миграции клеток. Так, нокдаун гена, кодирую-
держку. NP и SPM выражают признательность
щего Grx3 в клетках OSCC человека, приводил
Программе наставничества по инновационным
к ингибированию миграции и инвазии кле-
исследованиям (ASPIRE) SPPU.
ток in vitro, тогда как сверхэкспрессия Grx2c
Благодарности. Авторы благодарят д-ра
в клетках HeLa значительно индуцировала
Шекхара Манде (Национальный центр клеточ-
клеточную подвижность и позволяла клет-
ных наук, Пуна) и г-жу Сапну Суганди за их
кам внедряться в модельный матрикс [51, 52].
помощь и советы по очистке белков. NP, KP
В нашем исследовании HvGrx1 способствовал
и GB признают финансовую поддержку в виде
миграции клеток, что оценивалось в тесте на
стипендий от Совета по научным и промыш-
заживление ран. Все вышеприведенные дан-
ленным исследованиям (CSIR), Нью-Дели.
ные ясно указывают на то, что HvGrx1 сохра-
SG является почетным ученым Совета по науч-
няет свои функции в клетках человека, и это
ным и промышленным исследованиям (CSIR),
говорит о высокой эволюционной консерва-
Нью-Дели.
тивности данного белка и на функциональ-
Конфликт интересов. Авторы заявляют об
ном уровне.
отсутствии конфликта интересов.
БИОХИМИЯ том 88 вып. 5 2023
СВОЙСТВА HvGrx1 И ЕГО ФУНКЦИИ В КЛЕТКЕ
829
Соблюдение этических норм. Эта статья не
Дополнительные материалы. Приложение к
содержит каких-либо исследований с участием
статье на английском языке опубликовано на
людей или животных, выполненных кем-либо
из авторов.
journal/10541), том 88, вып. 5, 2023.
СПИСОК ЛИТЕРАТУРЫ
1.
Martínez, D. E., Iñiguez, A. R., Percell, K. M.,
zation of two superoxide dismutases from Hydra
Willner, J. B., Signorovitch, J., and Campbell,
vulgaris, Gene,
387,
93-108, doi:
10.1016/j.gene.
R. D. (2010) Phylogeny and biogeography of Hydra
2006.08.020.
(Cnidaria: Hydridae) using mitochondrial and nuclear
11.
Dash, B., and Phillips, T. D. (2012) Molecular charac-
DNA sequences, Mol. Phylogenet. Evol., 57, 403-410,
terization of a catalase from Hydra vulgaris, Gene, 501,
doi: 10.1016/j.ympev.2010.06.016.
144-152, doi: 10.1016/j.gene.2012.04.015.
2.
Bosch, T. C., Anton-Erxleben, F., Hemmrich, G., and
12.
Perween, N., Pekhale, K., Haval, G., Mittal, S.,
Khalturin, K. (2010) The Hydra polyp: nothing but an
Ghaskadbi, S., and Ghaskadbi, S. S. (2022) Cloning
active stem cell community, Dev. Growth Differ., 52,
and characterization of Thioredoxin 1 from the Cni-
15-25, doi: 10.1111/j.1440-169X.2009.01143.x.
darian Hydra, J. Biochem., 171, 41-51, doi: 10.1093/jb/
3.
Schaible, R., Sussman, M., and Kramer, B. H. (2014)
mvab092.
Aging and potential for self-renewal: hydra living in
13.
Holmgren, A., Johansson, C., Berndt, C., Lönn,
the age of aging - a mini-review, Gerontology, 60,
M. E., Hudemann, C., and Lillig, C. H. (2005) Thi-
w548-556, doi: 10.1159/000360397.
ol redox control via thioredoxin and glutaredox-
4.
Martínez, D. E. (1998) Mortality patterns suggest lack
in systems, Biochem. Soc. Trans.,
33,
1375-1377,
of senescence in hydra, Exp. Gerontol., 33, 217-225,
doi: 10.1042/bst20051375.
doi: 10.1016/s0531-5565(97)00113-7.
14.
Wells, W. W., Xu, D. P., Yang, Y. F., and Rocque, P. A.
5.
Martínez, D. E., and Bridge, D. (2012) Hydra, the
(1990) Mammalian thioltransferase (glutaredoxin)
everlasting embryo, confronts aging, Int. J. Dev. Biol.,
and protein disulfide isomerase have dehydroascorbate
56, 479-487, doi: 10.1387/ijdb.113461dm.
reductase activity, J. Biol. Chem., 265, 15361-15364,
6.
Hemmrich, G., Khalturin, K., Boehm, A.-M.,
doi: 10.1016/S0021-9258(18)55401-6.
Puchert, M., Anton-Erxleben, F., Wittlieb, J.,
15.
Lillig, C. H., Berndt, C., and Holmgren, A. (2008)
Klostermeier, U. C., Rosenstiel, P., Oberg, H.-H.,
Glutaredoxin systems, Biochim. Biophys. Acta, 1780,
Domazet-Lošo, T., Sugimoto, T., Niwa, H., and
1304-1317, doi: 10.1016/j.bbagen.2008.06.003.
Bosch, T. C. G. (2012) Molecular signatures of the
16.
Couturier, J., Jacquot, J. P., and Rouhier, N. (2013)
three stem cell lineages in hydra and the emergence
Toward a refined classification of class I dithiol
of stem cell function at the base of multicellularity,
glutaredoxins from poplar: biochemical basis for the
Mol. Biol. Evol., 29, 3267-3280, doi: 10.1093/molbev/
definition of two subclasses, Front. Plant Sci., 4, 518,
mss134.
doi: 10.3389/fpls.2013.00518.
7.
Boehm, A. M., Khalturin, K., Anton-Erxleben, F.,
17.
Keselman, A., Pulak, R. N., Moyal, K., and
Hemmrich, G., Klostermeier, U. C., Lopez-Quintero,
Isakov, N. (2011) PICOT: A multidomain protein with
J. A., Oberg, H. H., Puchert, M., Rosenstiel, P.,
multiple functions, ISRN Immunol., 2011, 426095,
Wittlieb, J., and Bosch, T. C. (2012) FoxO is a critical
doi: 10.5402/2011/426095.
regulator of stem cell maintenance in immortal
18.
Herrero, E., and de la Torre-Ruiz, M. A.
(2007)
Hydra, Proc. Natl. Acad. Sci. USA, 109, 19697-19702,
Monothiol glutaredoxins: a common domain for
doi: 10.1073/pnas.1209714109.
multiple functions, Cell. Mol. Life Sci., 64, 1518-1530,
8.
Klotz, L. O., Sánchez-Ramos, C., Prieto-Arroyo, I.,
doi: 10.1007/s00018-007-6554-8.
Urbánek, P., Steinbrenner, H., and Monsalve, M.
19.
Bräutigam, L., Jensen, L. D., Poschmann, G.,
(2015) Redox regulation of FoxO transcription fac-
Nyström, S., Bannenberg, S., Dreij, K., Lepka, K.,
tors, Redox Biol.,
6,
51-72, doi:
10.1016/j.redox.
Prozorovski, T., Montano, S. J., Aktas, O., Uhlén, P.,
2015.06.019.
Stühler, K., Cao, Y., Holmgren, A., and Berndt, C.
9.
Dash, B., Metz, R., Huebner, H. J., Porter, W., and
(2013) Glutaredoxin regulates vascular development
Phillips, T. D. (2006) Molecular characterization of
by reversible glutathionylation of sirtuin 1, Proc. Natl.
phospholipid hydroperoxide glutathione peroxidases
Acad. Sci. USA, 110, 20057-20062, doi: 10.1073/
from Hydra vulgaris, Gene, 381, 1-12, doi: 10.1016/
pnas.1313753110.
j.gene.2006.04.026.
20.
Fernandes, A. P., and Holmgren, A. (2004) Glutar-
10.
Dash, B., Metz, R., Huebner, H. J., Porter, W.,
edoxins: glutathione-dependent redox enzymes with
and Phillips, T. D. (2007) Molecular characteri-
functions far beyond a simple thioredoxin backup sys-
БИОХИМИЯ том 88 вып. 5 2023
830
PERWEEN и др.
tem, Antioxid. Redox Signal., 6, 63-74, doi: 10.1089/
involvement in cellular redox homeostasis and host
152308604771978354.
immune responses, Fish Shellfish Immunol., 95, 411-
21.
Jeong, D., Kim, J. M., Cha, H., Oh, J. G., Park, J.,
421, doi: 10.1016/j.fsi.2019.09.071.
Yun, S. H., Ju, E. S., Jeon, E. S., Hajjar, R. J., and Park,
34.
Ken, C. F., Chen, I. J., Lin, C. T., Liu, S. M., Wen, L.,
W. J. (2008) PICOT attenuates cardiac hypertrophy
and Lin, C. T. (2011) Monothiol glutaredoxin cDNA from
by disrupting calcineurin-NFAT signaling, Circ. Res.,
Taiwanofungus camphorata: a novel CGFS-type glutare-
102, 711-719, doi: 10.1161/circresaha.107.165985.
doxin possessing glutathione reductase activity, J. Agric.
22.
Madusanka, R. K., Tharuka, M. D. N., Liyanage,
Food Chem., 59, 3828-3835, doi: 10.1021/jf1048113.
D. S., Sirisena, D., and Lee, J. (2020) Role of rock-
35.
Martinez, D. E., Dirksen, M. L., Bode, P. M.,
fish (Sebastes schlegelii) glutaredoxin 1 in innate im-
Jamrich, M., Steele, R. E., and Bode, H. R. (1997)
munity, and alleviation of cellular oxidative stress:
Budhead, a fork head/HNF-3 homologue, is expressed
Insights into localization, molecular characteristics,
during axis formation and head specification in hydra,
transcription, and function, Comp. Biochem. Physiol.
Dev. Biol., 192, 523-536, doi: 10.1006/dbio.1997.8715.
B Biochem. Mol. Biol., 243-244, 110432, doi: 10.1016/
36.
Gupta, A., Sripa, B., and Tripathi, T. (2017) Purifica-
j.cbpb.2020.110432.
tion and characterization of two-domain glutaredoxin
23.
Wang, J., Boja, E. S., Tan, W., Tekle, E., Fales,
in the parasitic helminth Fasciola gigantica, Parasitol.
H. M., English, S., Mieyal, J. J., and Chock, P. B.
Int., 66, 432-435, doi: 10.1016/j.parint.2016.05.005.
(2001) Reversible glutathionylation regulates actin
37.
Ströher, E., and Millar, A. H. (2012) The biological
polymerization in A431 cells, J. Biol. Chem., 276,
roles of glutaredoxins, Biochem. J., 446, 333-348,
47763-47766, doi: 10.1074/jbc.C100415200.
doi: 10.1042/bj20112131.
24.
Reddy, P. C., Barve, A., and Ghaskadbi, S. (2011)
38.
Arnér, E. S., and Holmgren, A. (2000) Physiological
Description and phylogenetic characterization of
functions of thioredoxin and thioredoxin reductase,
common hydra from India, Curr. Sci., 101, 736-738.
Eur. J. Biochem.,
267,
6102-6109, doi:
10.1046/
25.
Johnson, M., Zaretskaya, I., Raytselis, Y., Mere-
j.1432-1327.2000.01701.x.
zhuk, Y., McGinnis, S., and Madden, T. L. (2008)
39.
Berndt, C., Poschmann, G., Stühler, K., Holmgren, A.,
NCBI BLAST: a better web interface, Nucleic Acids
and Bräutigam, L. (2014) Zebrafish heart development
Res., 36, W5-W9, doi: 10.1093/nar/gkn201.
is regulated via glutaredoxin 2 dependent migration
26.
Kumar, S., Stecher, G., Li, M., Knyaz, C., and
and survival of neural crest cells, Redox Biol., 2, 673-
Tamura, K. (2018) MEGA X: molecular evolutionary
678, doi: 10.1016/j.redox.2014.04.012.
genetics analysis across computing platforms, Mol. Biol.
40.
Hashemy, S. I., Johansson, C., Berndt, C., Lillig,
Evol., 35, 1547-1549, doi: 10.1093/molbev/msy096.
C. H., and Holmgren, A. (2007) Oxidation and S-nitro-
27.
Bendtsen, J. D., Nielsen, H., von Heijne, G., and
sylation of cysteines in human cytosolic and mito-
Brunak, S. (2004) Improved prediction of signal
chondrial glutaredoxins: effects on structure and ac-
peptides: SignalP 3.0, J. Mol. Biol., 340, 783-795,
tivity, J. Biol. Chem., 282, 14428-14436, doi: 10.1074/
doi: 10.1016/j.jmb.2004.05.028.
jbc.M700927200.
28.
Almagro Armenteros, J. J., Salvatore, M., Emanuels-
41.
Lundberg, M., Johansson, C., Chandra, J., Enoks-
son, O., Winther, O., von Heijne, G., Elofsson, A.,
son, M., Jacobsson, G., Ljung, J., Johansson, M., and
and Nielsen, H. (2019) Detecting sequence signals
Holmgren, A. (2001) Cloning and expression of a nov-
in targeting peptides using deep learning, Life Sci.
el human glutaredoxin (Grx2) with mitochondrial and
Alliance, 2, e201900429, doi: 10.26508/lsa.201900429.
nuclear isoforms, J. Biol. Chem., 276, 26269-26275,
29.
Rzhetsky, A., and Nei, M. (1993) Theoretical foun-
doi: 10.1074/jbc.M011605200.
dation of the minimum-evolution method of phy-
42.
Ceylan, S., Seidel, V., Ziebart, N., Berndt, C.,
logenetic inference, Mol. Biol. Evol., 10, 1073-1095,
Dirdjaja, N., and Krauth-Siegel, R. L. (2010) The
doi: 10.1093/oxfordjournals.molbev.a040056.
dithiol glutaredoxins of african trypanosomes have
30.
Kruger, N. J. (2009) The Bradford method for pro-
distinct roles and are closely linked to the unique
tein quantitation, in The Protein Protocols Handbook,
trypanothione metabolism, J. Biol. Chem.,
285,
pp. 17-24.
35224-35237, doi: 10.1074/jbc.M110.165860.
31.
Holmgren, A., and Aslund, F. (1995) Glutaredoxin, in
43.
Fitzgerald, L. A., Zhang, Y., Lewis, G., and Van
Methods in Enzymology, Academic Press, pp. 283-292.
Etten, J. L. (2009) Characterization of a monothiol
32.
Sadhu, S. S., Callegari, E., Zhao, Y., Guan, X., and
glutaredoxin encoded by Chlorella virus PBCV-1, Virus
Seefeldt, T. (2013) Evaluation of a dithiocarbamate
Genes, 39, 418-426, doi: 10.1007/s11262-009-0392-8.
derivative as an inhibitor of human glutaredoxin-1,
44.
Gallogly, M. M., Starke, D. W., Leonberg, A. K.,
J. Enzyme Inhib. Med. Chem.,
28,
456-462,
Ospina, S. M., and Mieyal, J. J. (2008) Kinetic and
doi: 10.3109/14756366.2011.649267.
mechanistic characterization and versatile catalytic
33.
Omeka, W. K. M., Liyanage, D. S., Yang, H.,
properties of mammalian glutaredoxin 2: implications
and Lee, J. (2019) Glutaredoxin 2 from big belly
for intracellular roles, Biochemistry, 47, 11144-11157,
seahorse (Hippocampus abdominalis) and its potential
doi: 10.1021/bi800966v.
БИОХИМИЯ том 88 вып. 5 2023
СВОЙСТВА HvGrx1 И ЕГО ФУНКЦИИ В КЛЕТКЕ
831
45. Sa, J. H., Kim, K., and Lim, C. J. (1997) Purification
49. Liu, X., Jann, J., Xavier, C., and Wu, H.
(2015)
and characterization of glutaredoxin from Cryptococcus
Glutaredoxin 1 (Grx1) protects human retinal pigment
neoformans, Mol. Cells, 7, 655-660.
epithelial cells from oxidative damage by preventing
46. Aslund, F., Zheng, M., Beckwith, J., and Storz, G.
AKT glutathionylation, Invest. Ophthalmol. Vis. Sci.,
(1999) Regulation of the OxyR transcription factor
56, 2821-2832, doi: 10.1167/iovs.14-15876.
by hydrogen peroxide and the cellular thiol-disulfide
50. Luikenhuis, S., Perrone, G., Dawes, I. W., and Grant,
status, Proc. Natl. Acad. Sci. USA, 96, 6161-6165,
C. M. (1998) The yeast Saccharomyces cerevisiae con-
doi: 10.1073/pnas.96.11.6161.
tains two glutaredoxin genes that are required for pro-
47. Löfgren, S., Fernando, M. R., Xing, K. Y., Wang, Y.,
tection against reactive oxygen species, Mol. Biol. Cell,
Kuszynski, C. A., Ho, Y. S., and Lou, M. F. (2008)
9, 1081-1091, doi: 10.1091/mbc.9.5.1081.
Effect of thioltransferase (glutaredoxin) deletion
51. Gellert, M., Richter, E., Mostertz, J., Kantz, L.,
on cellular sensitivity to oxidative stress and cell
Masur, K., Hanschmann, E. M., Ribback, S.,
proliferation in lens epithelial cells of thioltransferase
Kroeger, N., Schaeffeler, E., Winter, S., Hochgräfe, F.,
knockout mouse, Invest. Ophthalmol. Vis. Sci., 49,
Schwab, M., and Lillig, C. H. (2020) The cytosolic
4497-4505, doi: 10.1167/iovs.07-1404.
isoform of glutaredoxin 2 promotes cell migration and
48. Mollbrink, A., Jawad, R., Vlamis-Gardikas, A.,
invasion, Biochim. Biophys. Acta Gen. Subj., 1864,
Edenvik, P., Isaksson, B., Danielsson, O., Stål, P., and
129599, doi: 10.1016/j.bbagen.2020.129599.
Fernandes, A. P. (2014) Expression of thioredoxins
52. Li, B., Chen, M., Lu, M., Xin-Xiang, J., Meng-
and glutaredoxins in human hepatocellular carcinoma:
Xiong, P., and Jun-Wu, M. (2018) Glutaredoxin 3 pro-
correlation to cell proliferation, tumor size and meta-
motes migration and invasion via the Notch signalling
bolic syndrome, Int. J. Immunopathol. Pharmacol., 27,
pathway in oral squamous cell carcinoma, Free Radic.
169-183, doi: 10.1177/039463201402700204.
Res., 52, 390-401, doi: 10.1080/10715762.2018.1435871.
GLUTAREDOXIN 1 FROM EVOLUTIONARY ANCIENT Hydra:
CHARACTERISTICS OF THE ENZYME
AND ITS POSSIBLE FUNCTIONS IN CELL
N. Perween1,2, K. Pekhale1, G. Haval1,3, G. S. Bose4,
S. P. K. Mittal4, S. Ghaskadbi5, and S. S. Ghaskadbi1*
1 Department of Zoology, Savitribai Phule Pune University,
Pune 411007, India; e-mail: ssg@unipune.ac.in; sghaskadbi@gmail.com
2 Department of Zoology, M. C. E. Society’s Abeda Inamdar Senior College, Pune 411001, India
3 Department of Zoology, Abasaheb Garware College, Pune 411004, India
4 Department of Biotechnology, Savitribai Phule Pune University, Pune 411007, India
5 Developmental Biology Group, Agharkar Research Institute, Pune 411004, India
Glutaredoxin (Grx) is an antioxidant redox protein that uses glutathione (GSH) as an electron donor. Grx
plays a crucial role in various cellular processes, such as antioxidant defense, control of cellular redox state,
redox control of transcription, reversible S-glutathionylation of specific proteins, apoptosis, cell differenti-
ation, etc. In the current study, we have isolated and characterized dithiol glutaredoxin from Hydra vulgaris
Ind-Pune (HvGrx1). Sequence analysis showed that HvGrx1 belongs to the Grx family with the classical
Grx motif (CPYC). Phylogenetic analysis and homology modeling revealed that HvGrx1 is closely related
to Grx2 from zebrafish. HvGrx1 gene was cloned and expressed in Escherichia coli cells; the purified protein
had a molecular weight of 11.82 kDa. HvGrx1 efficiently reduced β-hydroxyethyl disulfide (HED) with the
temperature optimum of 25°C and pH optimum 8.0. HvGrx1 was ubiquitously expressed in all body parts
of Hydra. Expression of HvGrx1 mRNA and enzymatic activity of HvGrx1 were significantly upregulated
post H2O2 treatment. When expressed in human cells, HvGrx1 protected the cells from oxidative stress and
enhanced cell proliferation and migration. Although Hydra is a simple invertebrate, HvGrx1 is evolutionary
closer to its homologs from higher vertebrates (similar to many other Hydra proteins).
Keywords: glutaredoxin, Hydra, redox
БИОХИМИЯ том 88 вып. 5 2023